干细胞向成骨细胞诱导分化染色及鉴别方法
人皮下脂肪干细胞的成骨、成脂分化诱导及鉴定

中国组织工程研究 第19卷 第32期 2015–08–06出版Chinese Journal of Tissue Engineering Research August 6, 2015 Vol.19, No.32ISSN 2095-4344 CN 21-1581/R CODEN: ZLKHAH 5155www.CRTER .org肖建红,女,1980年生,四川省绵阳市人,羌族,2012年中山大学毕业,博士,主治医师,主要从事造血干细胞抑制、干细胞与组织工程,以及免疫性血小板减少性紫癜的临床研究和基础研究。
通讯作者:张阳春,硕士,主治医师,中山大学附属第一医院东院下肢骨科,广东省广州市 510700中图分类号:R394.2 文献标识码:A 文章编号:2095-4344 (2015)32-05155-07 稿件接受:2015-07-01 Xiao Jian-hong, M.D., Attending physician, Department of Internal Medicine, Eastern Branch of the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 51000, Guangdong Province, ChinaCorresponding author: Zhang Yang-chun, Master, Attending physician, Department of Lower limbs Orthopedics, Eastern Branch of the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 51000, Guangdong Province, ChinaAccepted: 2015-07-01人皮下脂肪干细胞的成骨、成脂分化诱导及鉴定肖建红1,张阳春2,张常然1,杨 兴2(中山大学附属第一医院东院,1普通内科,2下肢骨科,广东省广州市 510700)文章亮点:1 实验通过密度梯度离心和贴壁筛选法相结合,对人脂肪干细胞进行分离、体外培养及扩增。
成人骨髓间充质干细胞向成骨细胞定向诱导分化的实验研究

的理 想 种 子 细 胞 。
关 键 词 间质 干 细胞
骨髓细胞
成骨细胞
分化
组 织 工程
Sl yo iee t t no d l h ma sn h ma tm e stw r sebat nv r Z i S N Jn td f f rni i f ut u nmee c y l e cl a dot l s/ io HU We l d ao a s l o s s t , U u . i , E i — n , HU L— a G in r g C N J nl g Z i i , U La . n a o xn
c n i i g d x me h s n ,b t— o i m lc r p o p a e a d a c r i c d e l lr mo p oo i s w r b e v d u d r o t nn e a tao e a e s du gy e o h s h t n s o b c a i .C l a r h lg e e e o s r e n e a u
p aec nr tmirso ea dtego t u ew sda n a c rigy T ec l g n tp a doto acnwa ee td h s—o t coc p n h rw hc r a rw c odn l. h ol e y eI n se c li sd tce s a v a
s e el o o e t s e e g n e n .M e h d h C r x rc e r m h o e mar w n u t r d i e d c l f rb n i u n i e r g s s i tos MS swe e e ta t d f o t e b n ro a d c l e mme it l u d aey i MEM d u c n an n 0 / ea o i e s r m. h Cswe e a ay e y t e f w c t mer o d t c t e nD me im o t ii g 1 0 mL L f tlb vn eu MS r n lz d b h l yo t t e e t h o y s r c a t e s u a e ni n . f g T e u c h rd c l s n u e o df r n it it se b a t t a se id c ie h s b u u e el wa i d c d t i e e t e n o o to lss wi s a h n o t on u t me i m v du
骨髓间质干细胞成软骨诱导分化实验原理

骨髓间质干细胞成软骨诱导分化实验原理
软骨的破坏、缺失是包括骨关节炎(osteoarthritis,OA)在内的多种骨科疾病的重要病理改变。
由于软骨特殊的解剖及组织特性,如缺乏血管和淋巴管的分布,使得其自我修复能力异常不足,因此通过人工方法修复软骨破坏具有重要临床意义。
近年来,随着间充质干细胞的发现和研究深入,其来源广泛、良好的增殖能力、多分化潜能、与各种3D支架材料具有良好的生物相容性等特性,使得其在软骨修复应用中具有令人期待的潜力。
MSC成软骨分化的过程:MSC首先收回其突起,聚集成团,这个团中间的细胞经分裂分化转变成一种大而圆的细胞,即成软骨细胞;成软骨细胞产生基质和纤维(主要为II型胶原蛋白),当基质的量增加到一定程度时,成软骨细胞被分隔在陷窝内,分化为成熟的软骨细胞。
体外诱导成软骨分化的鉴定主要围绕成软骨的标志物——II型胶原蛋白来进行,包括通过免疫组化、Westernblot检测II型胶原蛋白的表达和RT-PCR检测II型胶原蛋白的mRNA的表达,不同的角度进行鉴定;而甲苯胺蓝则主要检测成软骨细胞内酸性粘多糖。
下图是骨髓间充质干细胞的成软骨分化诱导图,可以看到软骨细胞埋藏在软骨间质内,它所存在的部位为一小腔,称为软骨陷窝(cartilage lacuna)。
人牙髓干细胞体外成骨向分化的实验研究

人牙髓干细胞体外成骨向分化的实验研究毛丽霞;刘加强;赵晶蕾;王洁;夏韫晖;王博;袁玲君;房兵【摘要】目的:探讨人牙髓干细胞在体外成骨向分化潜能。
方法:用免疫磁珠法分选人牙髓干细胞并检测其干细胞表面标志物Stro-1、 CD29、 CD34、 CD44、CD45、 CD90、 CD105的表达。
体外诱导人牙髓干细胞向成骨细胞分化,通过碱性磷酸酶染色和茜素红染色观察成骨诱导后细胞的成骨活性和矿化结节形成情况,通过real-time PCR分析成骨相关基因ALP、col I、RunX2、OC的表达,未成骨诱导细胞作为对照。
结果:人牙髓干细胞阳性表达间充质干细胞表面标志物Stro-1、 CD29、 CD44、 CD90、 CD105,阴性表达造血干细胞表面标志物CD34、CD45。
成骨诱导5d、7d、14d ALP染色阳性,21d茜素红染色仅诱导组可见明显钙结节形成,对照组为阴性。
成骨相关基因ALP、RunX2和Col I mRNA在成骨诱导早期高表达,OC mRNA在成骨诱导14d表达开始逐渐升高。
结论:经磁珠分选纯化的人牙髓干细胞在成骨诱导条件下可向成骨细胞分化,形成钙盐沉积和矿化结节, ALP、col I、RunX2、OC参与了成骨向分化的过程。
%Objective:To investigate the capability of human dental pulp stem cells (hDPSCs) on osteogenic differentia-tion in vitro.Methods:hDPSCs were purified by magnetic-activated cell sorting with Stro-1 and the phenotypes were ana-lyzed with stem cell surface markers CD29, CD44, CD90, CD105, Stro-1,CD34, CD45. hDPSCs were treated continuous-ly with osteogenic inductive medium for 21. Alkaline phosphatase(ALP) staining, the expression levelsof ALP, osteocalcin (OC), Collengen I(ColI), RunX2 genes and alizarin red staining for mineralization at different time points were analyzed. The non-induced cells were used as control.Results:Phenotype analysis indicatedthat hDPSCs were positive for mes-enchyme stem cell markers CD29, CD44, CD90, CD105, Stro-1, and negative for hematopoietic stem cell markers CD34, CD45. Compared with the control group, the ALP staining of the cells in induced group were significantly higher at day 5, 7, 14 and only the induced cells could form mineralized nodes as shown by alizarin red staining on Day 21. The expression of the ALP, ColI, RunX2, OC genes were positive in induced group.Conclusion:Human DPSCs selected by Stro-1 have the potential of differentiation into osteoblasts under osteogenic culture and forming mineralized nodes. Osteoblast markers (ALP, OC, ColI, RunX2 etc) participated in the osteogenic differentiation of hDPSCs.【期刊名称】《口腔颌面修复学杂志》【年(卷),期】2014(000)004【总页数】6页(P193-198)【关键词】人牙髓;干细胞;成骨诱导;细胞分化【作者】毛丽霞;刘加强;赵晶蕾;王洁;夏韫晖;王博;袁玲君;房兵【作者单位】上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011;上海交通大学医学院附属第九人民医院口腔颅颌面科上海 200011【正文语种】中文【中图分类】R782.4人牙髓干细胞(human dental pu lp stem cell,hDPSCs)具有自我更新和多向分化潜能[1,2],可向多种细胞分化,其中包括成骨样细胞[3-5],这种特性使人牙髓干细胞替代骨髓基质干细胞修复骨组织缺损成为可能。
茜素红染色预实验

茜素红染色成骨分化是干细胞的一个重要特性。
在特定的诱导培养基作用一段时间后,干细胞可分化为成骨细胞,在细胞表面沉积钙盐,形成钙结节。
应用茜素红的复合物,可用于鉴定干细胞是否已成功向成骨细胞转化一.实验目的:通过茜素红染色检测细胞成骨分化二.实验原理:1.成骨诱导的过程是使钙离子能够以钙盐的方式沉淀下来,即“钙结节”,鉴定钙结节的染色方法常用茜素红染色法。
2.茜素红:茜素磺酸钠,茜素S,茜素红S,茜素胭脂红,1,2-二羟基蒽醌-3-磺酸钠,1,2-二羟基蒽醌-3-磺酸钠盐。
橙黄色或黄棕色粉末。
易溶于水,微溶于乙醇,不溶于苯和氯仿。
1%水溶液pH为2.15,其水溶液呈前黄褐色,加盐酸后变为黄色,加氢氧化钠后则变成蓝紫色。
有刺激性。
能与许多金属离子生成有色化合物,能与锆、钍、铝、钛及钙发生显色反应。
3.染色原理:茜素红与钙发生显色反应,产生一种深红色的带色化合物,这样成骨诱导的细胞外面沉积的钙结节也就被染成了深红色。
三.实验试剂及仪器1.试剂:PBS 10%甲醛缓冲液0.1%茜素红-Tris-HCL染液蒸馏水2.仪器:倒置显微镜四.实验步骤1.弃培养液,PBS冲洗2次2.10%甲醛缓冲液固定10min3.蒸馏水冲洗3次4.加入0.1%茜素红-Tris-HCL染液(pH8.3),37℃下染色30min5.蒸馏水冲洗6.在倒置显微镜下观察有无茜素红染色阳性细胞五.实验结果及讨论RT-PCR检测PPARγmRNA表达水平实验目的:定量检测干细胞中PPARγmRNA的表达水平实验原理:1.由一条RNA单链转录为互补DNA(cDNA)称作“逆转录”,由依赖RNA的DNA聚合酶(逆转录酶)来完成。
随后,DNA的另一条链通过脱氧核苷酸引物和依赖DNA的DNA聚合酶完成,随每个循环倍增,即通常的PCR。
原先的RNA模板被RNA酶H降解,留下互补DNA。
2.RT-PCR的指数扩增是一种很灵敏的技术,可以检测很低拷贝数的RNA。
间充质干细胞成脂成骨分化实验方法学开发思路和流程

间充质干细胞成脂成骨分化实验方法学开发思路和流程干细胞是一种具有自我更新能力和多潜能分化的细胞,可以分化成为各种类型的细胞,包括脂肪细胞和骨细胞。
间充质干细胞(MSCs)是一种重要的干细胞类型,它们存在于各种组织中,如骨髓、脂肪组织和胎盘组织等。
间充质干细胞成脂成骨分化的实验方法学开发,是生物医学研究中一个重要的课题。
本文将从方法学开发的思路和流程入手,对间充质干细胞成脂成骨分化实验方法学进行探讨。
一、研究背景间充质干细胞成脂成骨分化是指间充质干细胞在一定的诱导条件下分化为脂肪细胞或骨细胞的过程,这一过程在细胞生物学和再生医学领域具有重要意义。
成脂成骨分化的研究有助于深入了解骨质疏松症、骨折愈合和脂肪代谢等疾病的发病机制,同时也为干细胞治疗提供了理论基础。
因此,开发一套可靠的实验方法学对于间充质干细胞成脂成骨分化研究至关重要。
1.确定分化诱导条件间充质干细胞在体外培养时,可通过添加不同的生长因子、细胞因子或药物来诱导其分化为脂肪细胞或骨细胞。
因此,确定最佳的分化诱导条件是方法学开发的第一步。
此过程需要考虑到诱导因子的种类、浓度、培养时间等因素,以及不同来源的间充质干细胞在分化过程中的差异性。
2.确定评价指标分化过程中,需要通过一系列的生物化学和分子生物学方法来评价间充质干细胞的脂肪细胞或骨细胞特征。
这些评价指标包括脂肪细胞的油红O染色、脂肪球形成实验,以及骨细胞的矿化实验、ALP染色等。
确定合适的评价指标对于评估分化效果至关重要。
3.确定实验方案在确定了分化诱导条件和评价指标后,需要制定详细的实验方案。
包括细胞的处理方法、诱导条件的优化、实验的时间节点等,以便后续实验的顺利进行。
1.间充质干细胞的提取和培养首先需要从适当的组织中分离和提取间充质干细胞,并进行细胞培养。
这一步需要注意细胞的纯度和活性,以保证后续实验的准确性。
2.分化诱导实验将培养好的间充质干细胞分别进行脂肪和骨分化诱导实验,根据预先确定的诱导条件进行处理。
脂肪干细胞定向诱导分化为成骨细胞及其鉴定

第 29 卷 第 12 期 2011 年12 月
中华中医药学刊
CHINESE ARCHIVES OF TRADITIONAL CHINESE MEDICINE
Vol. 29 No. 12 Dec. 2 0 1 1
脂肪干细胞定向诱导分化为成骨细胞及其鉴定
收稿日期:2011 - 07 - 30 基金项目:浙江省自然科学基金资助项目( Y2080180) 作者简介:刘波( 1978 - ) ,男,山东诸城人,主治医师,硕士,研究方
向: 脂肪移植治疗的基础与临床研究。
整形外科门诊行脂肪抽吸术的患者; DMEM 低糖培养基、胎 牛血清、胰蛋白酶均为 Gibco 公司产品; β - 甘油磷酸钠、地 塞米松、抗坏血酸及 1,25 - ( OH) 2 VitD3 均为 Sigma 公司产 品; OPN、OCN、I 型胶原一抗为 CHEMICON 公司产品,二抗 为 Santa Cruz 公司产品。 1. 2 脂肪干细胞培养与传代 无菌条件下将脂肪抽吸物 用 PBS 反复冲洗,尔后移入离心管,加入等体积的 0. 075% 的 I 型胶原酶消化,37℃ 、1h,加带血清培养液终止消化,离 心 1380r / min,10min,弃去上清,用 100 目细胞滤器过滤,再 离心 1380r / min,5min,弃 去 上 清,加 入 含 10% 胎 牛 血 清 DMEM 低糖培养液混匀细胞,以 2 × 104 / cm2 接种于 100mm 培养皿中培养。24h 后,可见梭型细胞贴壁,每 3 天更换培 养液一次,待细胞融合至 80% ~ 90% 时进行传代,传代密 度为 1 × 104 / cm2 。扩增到第 2 代后,换成骨诱导液。 1. 3 AKP 定量检测 将底物 40mg( 1 粒) 溶解于 10mL 去 离子水中备用; 取 5 支 15mL 离心管分别标记空白等,各放 入 0. 5mL 缓冲液和 0. 5mL 底物水溶液,37℃ 水浴 10min; 每 盘细胞 PBS 冲洗后,加入 3mL Tris ( ph7. 4) ,将细胞刮下,
干细胞成骨、成脂、成软骨诱导分化及检测
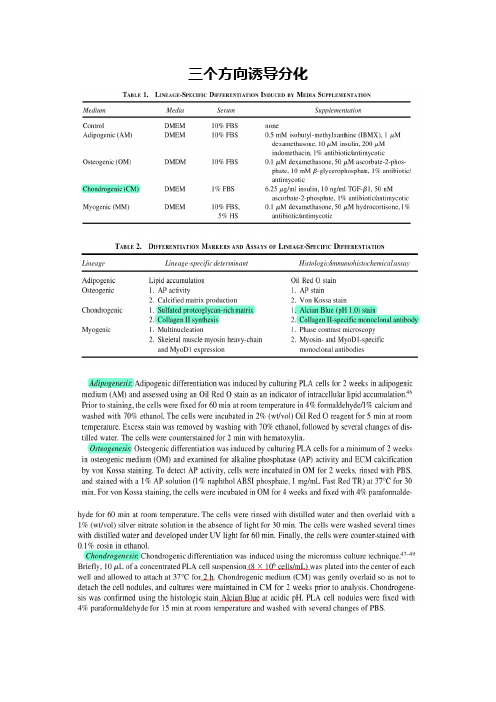
三个方向诱导分化诱导骨髓间充质干细胞成软骨分化一、诱导方法将细胞悬液置于50 mL聚苯乙烯培养瓶(Nunclon)中培养。
完全培养基中加入能诱导MSCs 向软骨细胞转化的诱导因子: (一致统一的诱导物质)转化生长因子β1 10ng/ml,(左旋)维生素C 50 mg/L(也有0.1mmol/L)地塞米松0.1nmol/L (也有10 nmol/L)ITS 50mg/ml丙酮酸钠1mmol/L亚油酸5.35ug/mg牛血清白蛋白1.25ng/ml。
倒置显微镜逐日(1-3 weeks)观察细胞生长情况。
细胞长成单层后进行传代。
细胞培养3周。
去除培养液,晾干,①细胞用通用Ⅱ型胶原检测试剂盒(晶美生物工程有限公司) 免疫组化,按试剂盒说明书操作;②用alcian blue 孵育5 min, 流水冲洗2 min ,麦氏苏木素复染5 min ,流水冲洗2 min ,晾干,显微镜下观察细胞的蛋白聚糖沉积。
或者用甲苯胺蓝染色,具体我也没做过,查到一篇文章中是这么说的:MSC成软骨诱导后的甲苯胺蓝染色检测:培养不同时间的MSC培养皿倒掉诱导培养液,10%甲醛固定lh,自来水冲洗15min,双蒸水冲洗1次,滴加1%甲苯胺蓝染液于培养皿内,染色3h,加人95%乙醇,洗去多余的染液,烘干,中性树胶封片。
诱导骨髓间充质干细胞成骨方向分化成骨诱导培养: 取第3代细胞, 接种入含体积分数为0.1 的新生牛血清、0.1 μmol/L 地塞米松、50 μmol/L 抗坏血酸、10 mmol/L β- 甘油磷酸钠的高糖DMEM培养基进行成骨诱导培养, 进行形态观察、功能检测。
间充质干细胞成骨特性检测:①碱性磷酸酶组织化学染色:取成骨诱导14 d 的细胞, 40 g/L 中性甲醛固定15 min, Gomori改良钙钴法染色。
取5 块玻片, 每片随机取2个视野, 采用网格计数法, 计算碱性磷酸酶染色阳性细胞的百分比。
:取第3 代细胞, 以1×105/ 孔的密度接种于6 孔板中, 分别成骨诱导3, 5, 7, 10, 12,14 d,按碱性磷酸酶活性检测试剂盒要求进行检测。
牙周膜干细胞向成骨细胞方向分化实验

中华老年口腔医学杂志 2 01 1 年 5 月 第 9 卷第 3期
� 论著 �
牙周膜干细胞向成骨细胞方向分化实验 *
贺慧霞 刘洪臣 郭 宏 杨 洋 刘一涵牙周 膜干细胞( Peri odon a ll i g a m en s em c el l , P D L SC s)向成骨细 胞定向分 化潜能,从 细胞�分 子和基因水 平分析矿 化诱导过程 中细胞形态 �功能变化 �方法:将 免疫磁珠 分离的 人 P D L SC s 矿化诱 导 ,通 过倒 置显 微 镜观 察诱 导 细胞 形 态变 化, EL ISA 法 检 测诱 导细 胞 碱性 磷 酸酶 活 性( A L Pa se)�R T - P C R � W es ern b l o 及免疫化学染色分析其成骨相关基因 �蛋白表达变化,茜素 红染色法检测其矿化 结节形成情况来诱 导细胞做对照 �结果:矿化诱导 1 4 d,细胞形态呈 成骨样短 突起�多角 形改变,诱导 7 d�1 4d A LP a se 活性显著 增 强 �21 d, 诱 导 细 胞 高丰 度 表 达骨 桥 素 ( OPN ) �骨钙素( O C N )� 牙 骨 质附 着 蛋 白 ( C A P )及 I 型 胶 原 ( C O L Ⅰ) � � m R N A ,而对照组只有 C O L Ⅰm R N A 弱表达�同时,W es er nb l o 及免疫化学 染色均显示 诱导细胞 分泌骨涎蛋 白( B SP)�21 d,仅诱导组形成大量矿化结节�结论:人 PD L SC s 在矿化液诱导下可向成骨细胞分化,具有成骨细 胞的形态�表型和功能特点,有望成为牙周及种植体周围骨缺损修复再生的理想的种子细胞 �
关键词:牙周膜干细胞;成骨;矿化液;诱导 [ 中国图书分类号] R7 81 [ 文献标识码] A [ 文章编号] 16 7 2-2973 ( 201 1 )0 3 -01 29- 05
人体脂肪干细胞培养及成骨诱导分化

人体脂肪干细胞培养及成骨诱导分化人体脂肪干细胞培养及成骨诱导分化引言干细胞是一类具有自我更新和多能性的细胞,可以不断分化生成各种不同类型的细胞。
人体脂肪组织中存在一种特殊类型的干细胞,即人体脂肪干细胞(human adipose-derived stem cells,hADSCs)。
与其他干细胞相比,hADSCs具有较高的抽取和培养效率,而且可以从自身脂肪组织中获得,不需要侵入性手术。
因此,hADSCs成为研究人体再生医学和组织工程领域的热门课题之一。
本文将介绍人体脂肪干细胞的培养方法以及成骨诱导分化的研究进展。
人体脂肪干细胞培养1. 来源和提取人体脂肪组织富含脂肪干细胞,因此从脂肪组织中提取hADSCs是最常用的方式之一。
提取过程通常通过脂肪抽吸或手术操作完成。
在脂肪抽吸中,通过低压吸引脂肪组织,并用特殊工具将其收集。
手术操作则需要进行小切口,直接收集脂肪组织。
提取得到的脂肪组织需要经过一系列处理,如洗涤、消化、离心等,以获得单个细胞悬浮液。
2. 培养条件提取得到的hADSCs需要在适宜的培养条件下进行扩增。
通常,使用营养丰富的培养基,如DMEM/F12,加入适量的胎牛血清和抗生素,以提供必需的生长因子和营养物质。
细胞培养的环境需要保持在37℃,5% CO2的恒温恒湿条件下。
培养过程中,需要定期更换培养基以保持细胞的生长和代谢活性。
3. 鉴定和鉴定为了确认提取得到的细胞为hADSCs,需要进行鉴定和鉴定。
常用的方法包括油红O染色、免疫细胞化学染色和流式细胞术分析。
油红O染色可用于检测细胞中脂滴的积累情况,免疫细胞化学染色可检测特定表面标记物的表达水平,流式细胞术则可对细胞表型进行全面的分析。
人体脂肪干细胞成骨诱导分化人体脂肪干细胞具有向多个细胞系分化的潜力,其中包括成骨细胞。
为了将hADSCs诱导分化为成骨细胞,需要在体外提供特定的诱导因子。
1. 前处理在进行成骨诱导前,需要对hADSCs进行适当的前处理。
干细胞成骨分化和成脂分化后的表征方法及原理

干细胞成骨分化和成脂分化后的表征方法及原理YAO Xiang由于易分离获得、免疫原性低且具有多向诱导分化潜能,骨髓基质干细胞(Bone marrow stroma stem cells,MSCs)成为了组织工程与再生医学中理想的种子细胞。
正是由于上述原因,骨髓基质干细胞成为了很多研究者关注并使用的模型细胞。
在我的另一篇百度文献《干细胞诱导分化的方法及各类诱导试剂的配置》中已经详细介绍了骨髓基质干细胞的成骨诱导分化、成软骨诱导分化和成脂诱导分化的参考“诱导方案”及相应诱导试剂的配置和诱导试剂的详细原材料信息。
本文将侧重于介绍骨髓基质干细胞成骨和成脂诱导分化后的表征方法(包括染色表征及利用RT-PCR对相应特征性基于的表达进行表征)及相关原理,这些内容将解答我们怎样快速而有效地表征各个实验组别中成骨和成脂分化的相对强弱。
相关参考内容能够让初步涉入该领域的科研工作者极大地缩短前期探索实验和文献搜索整合所耗费的时间。
本文主要涵盖内容如下:1.成骨分化后的表征方法及原理—染色表征2.成骨分化后的表征方法及原理—RT-PCR表征特征基因的表达3.成脂分化后的表征方法及原理—染色表征4.成脂分化后的表征方法及原理—RT-PCR表征特征基因的表达5.成骨成脂共诱导的表征方法及原理—染色表征6.成骨成脂共诱导的表征方法及原理—RT-PCR表征特征基因的表达注:下述各类方案经多次实验验证是行之有效的,笔者依据类似方案发表的部分参考文献如下:1. Yao X, Peng R, Ding JD*. Cell-material interactions revealed via material techniques of surface patterning. Advanced Materials, 2013;25:5257-86. (材料领域TOP期刊)2. Yao X, Hu YW, Cao B, Peng R, Ding JD*. Effects of surface molecular chirality on adhesion and differentiation of stem cells. Biomaterials, 2013;34:9001-9. (生物材料领域TOP期刊)3. Yao X, Peng R, Ding JD*. Effects of aspect ratios of stem cells on lineage commitments with and without induction media. Biomaterials, 2013;34:930-9.一、成骨分化后的表征方法及原理—染色表征干细胞成骨分化后会有明显的碱性磷酸酶(alkaline phosphatase,一般也简写为ALP)生成,经固蓝染色后在显微镜下呈现蓝色,未分化细胞则无明显颜色(如后面的图1或图2所示)。
骨髓间充质干细胞向成骨细胞诱导分化的实验研究(论文)

骨髓间充质干细胞向成骨细胞诱导分化的实验研究作者:吕玉明, 程立明, 裴国献, 蔡哲, 舒峻, 张可华, 郭丽丽, 俞庆声, LV Yu-ming, CHENG Li-ming, PEI Guo-xian, CAI Zhe, SHU Jun, ZHANG Ke-hua, GUO Li-li, YU Qing-sheng作者单位:吕玉明,LV Yu-ming(510150,广州医学院第三附属医院骨科), 程立明,CHENG Li-ming(中日友好医院关节外科, 北京市,100029), 裴国献,PEI Guo-xian(第四军医大学西京医院骨科, 西安市,710032), 蔡哲,舒峻,张可华,郭丽丽,俞庆声,CAI Zhe,SHU Jun,ZHANG Ke-hua,GUO Li-li,YU Qing-sheng(中日友好医院临床医学研究所免疫室, 北京市,100029)刊名:实用医学杂志英文刊名:The Journal of Practical Medicine年,卷(期):2012,28(9)被引用次数:8次1.Goodwin H S;Bicknese A R;Chien S N Multilineage differentiation activity by cells isolated from umbilical cord blood:expression of bone,fat,and neural markers 2001(11)2.Kanczler JM;Ginty PJ;White The effect of the delivery of vascular endothelial growth factor and bone morphogenic protein-2 to osteoprogenitor cell populations on bone formation.[外文期刊] 2010(6)3.吕玉明,程立明,裴国献,王玉,崔福斋纳米晶重组类人胶原基/聚乳酸复合支架材料的表征及细胞相容性研究[期刊论文]-中国临床解剖学杂志 2011(5)4.Barou O;Mekraldi S;Vico L;Boivin G;Alexandre C;Lafage Proust MH Relationships between trabecular bone remodeling and bone vascularization: a quantitative study.[外文期刊] 2002(4)5.Stains J P;Civitelli R Cell-cell interactions in regulating osteogenesis and osteoblast function 2005(01)6.Qu D;Li J;Li Y Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bone tissue engineering in reconstruction of calvarial defects 2011(01)7.Kann S;Chiu R;Ma T OP-1 (BMP-7) stimulates osteoprogenitor cell differentiation in the presence of polymethylmethacrylate particles 2010(02)8.Aubin JE Osteoprogenitor cell frequency in rat bone marrow stromal populations: role for heterotypic cell-cell interactions in osteoblast differentiation.[外文期刊] 1999(3)9.Kamalia N;McCulloch C A;Tenebaum H C Dexamethasone recruitment of self-renewing osteoprogenitor cells in chick bone marrow stromal cell cultures 1992(02)1.张雯,陈香宇,何巧玉,王闪,李春燕,段芳龄,黄华经不同方式移植骨髓间充质干细胞治疗肝纤维化的疗效[期刊论文]-实用医学杂志 2013(06)2.陈瑾,兰泽栋,陈良娇,童晓洁地塞米松对成牙骨质细胞增殖和矿化功能的调节作用[期刊论文]-中国美容医学 2014(13)3.黄懿文,杨锐,陈思,孙嘉,陈容平,黄震PPARγ通路对模拟微重力条件下大鼠骨髓间充质干细胞向成骨细胞分化的影响[期刊论文]-南方医科大学学报 2013(04)4.李振想,官立萍,姬明丽,李韶山人脐带间充质干细胞体外诱导分化为甲状腺细胞的初步探讨[期刊论文]-实用医学杂志2013(12)5.曾晶晶,周诺,黄旋平,廖凤春,陈亚莉犬骨髓间质干细胞体外培养和鉴定[期刊论文]-实用医学杂志 2013(16)6.谷子芽,翟强,吕秋峰,彭灿星,刘芳菲,史月华牙周膜细胞与壳聚糖温敏水凝胶生物相容性评价[期刊论文]-实用医学杂志2013(22)7.杨渊,李小峰,罗道明,温超海柚皮甙诱导兔骨髓间充质干细胞的成骨特征**[期刊论文]-中国组织工程研究 2013(14)8.师彬,杨武斌,王平骨髓间充质干细胞诱导分化成骨细胞的研究现状[期刊论文]-中国实验方剂学杂志 2014(19)。
成骨诱导分化茜素红染色方法和原理、步骤

成骨诱导分化茜素红染色方法和原理、步骤
茜素红染色方法和原理:茜素红又名茜素磺酸钠,茜素S,茜素红S,茜素胭脂红,1,2-二羟基蒽醌-3-磺酸钠,1,2-二羟基蒽醌-3-磺酸钠盐。
橙黄色或黄棕色粉末。
易溶于水,微溶于乙醇,不溶于苯和氯仿。
1%水溶液pH 为2.15,其水溶液呈浅黄褐色,加盐酸后变成黄色,加氢氧化钠后则变成蓝紫色。
有刺激性。
能与许多金属离子生成带色化合物,能与锆、钍、铝、钛及铍和钙的显色反应。
染色的原理就是茜素红和钙发生显色反应,产生一种深红色的带色化合物,这样成骨诱导的细胞外面沉积的钙结节也就被染成了深红色。
成骨诱导的过程是使钙离子能够以钙盐的方式沉淀下来,这就是我们常说的“钙结节”。
鉴定钙结节的染色方法常用“茜素红”。
步骤:
(1)吸去诱导液,再PBS 洗一到两次;
(2)加入10%中性甲醛,固定30min-60min;
(3)吸去固定液,加入0.1%的茜素红染色液,染色6-10min;
(4)用PBS 洗两次,去处残留的染色液;
(5)加入PBS,完成染色。
骨髓间充质干细胞向成骨细胞诱导分化的实验研究

骨髓间充质干细胞向成骨细胞诱导分化的实验研究摘要】目的:研究体外培养的骨髓间充质干细胞(MSCs)在特定的条件下诱导分化为成骨细胞。
方法:从骨髓血中提取MSCs,在含10%胎牛血清,地塞米松、β-甘油磷酸钠和维生素C的条件培养基培养的DMEM培养基中培养,放免法检测骨钙蛋白。
比色法检测碱性磷酸酶、von Kossa法钙结节染色。
结果: MSCs诱导培养后碱性磷酸酶、钙结节、骨钙蛋白表达明显增强。
结论:MSCs在一定条件下能诱导分化为成骨细胞,能作为骨组织工程的种子细胞应用于临床治疗。
【关键词】间质干细胞;成骨细胞;分化【中图分类号】R285.5【文献标识码】B【文章编号】1008-6455(2010)10-0196-01成骨细胞的增殖是骨折愈合重要因素,也是造成骨不愈合,延迟愈合的主要原因[1]。
现在很多医院对一些病人经皮自体骨髓移植治疗骨不连,并取得较好的临床治疗效果,但对其具体作用机制还不清楚,本论文主要通过体外实验研究骨髓移植治疗骨不连可能的作用机制。
1材料和方法1.1主要试剂与仪器: DMEM培养基 (GIBCO,USA)(每L含10%小牛血清、L-谷氨酰胺0.33mg,青霉素100U、链霉素100U、pH7.4);胰蛋白酶(MERCK,USA);二甲基亚砜 (DMSO)(Merck,Germany);6孔细胞培养板(Costar, Denmark);细胞培养箱 (NAPCO,USA);倒置相差显微镜 (OLYMPUS,JAPAN);流式细胞仪(BD,USA),激光共聚焦显微镜(Leica,TCS-SP5)。
1.2实验方法1.2.1骨髓基质干细胞(bone marrow stem cell, BMSCs)BMSCs的体外培养:自愿捐助骨髓患者局部麻醉后,18号骨穿针于髂结节处穿刺,抽取骨髓 5ml,置于肝素化的注射器中。
在无菌条件下分离,按Haynesworth方法,加入含有地塞米松(10-8mol/LSigma)、β-磷酸甘油钠(10mmol/L,Sigma)和抗坏血酸(50μmol/L,Sigma)的DMEM成骨条件培养液,制成细胞悬液。
干细胞成骨和成脂诱导方法

干细胞成骨和成脂诱导方法一、成骨诱导体系:1. 试剂成骨诱导液:DMEM+10%FBS,双抗,谷氨酰胺,诱导因子:地塞米松:通过促进Cbfal mRNA和Osterix mRNA的表达而促进骨髓基质细胞向成骨细胞分化。
β-甘油磷酸钠:可促进地塞米松对MSC的的诱导分化。
Vc:一种重要的营养素和氧化还原剂,在骨盐代谢及骨形成中具有重要作用。
在体外,它能增加钙盐的沉积,促进矿化结节的形成,并通过间充质细胞间接调节破骨细胞的分化。
维生素C能直接抑制核因子κB受体活化子配体(RANKL)诱导的破骨细胞形成。
2. 诱导步骤(1)待干细胞达到80~90%融合时,消化。
(2)将干细胞接种于六孔板中,每孔约3x103个细胞,加入2ml / 孔干细胞完全培养液。
放入37°C,5% CO2孵箱中培养。
(3)24h后,移去旧的培养液,加入2ml孔成骨诱导液。
(4)每三天换液,诱导2-3周。
(5)2-3周后,钙结节形成,进行茜素红染色。
二、成脂诱导体系:1. 试剂成脂诱导液A:DMEM+10%FBS,双抗,谷氨酰胺,诱导因子:胰岛素,I BMX,地塞米松,吲哚美锌。
成脂诱导液B:DMEM+10%FBS,双抗,谷氨酰胺,诱导因子:胰岛素。
2. 诱导步骤:(1)待干细胞达到80~90%融合时,消化。
(2)将干细胞接种于六孔板中,每孔约2x104个细胞,加入2ml / 孔干细胞完全培养液。
放入37°C,5% CO2孵箱中培养。
(3)每三天进行换液(干细胞完全培养液),直至细胞达到100%融合。
(4)待细胞达到100%融合时,移去旧的培养液,加入2ml / 孔成脂诱导液A开始诱导。
(5)三天后更换成成脂诱导液B进行维持,24h后再更换成成脂诱导液A诱导,如此进行3个循环。
(6)当脂滴出现较多,但比较小时,可以用成脂诱导液B进行维持3-5天,脂滴增大。
(7)油红O染色。
人皮下脂肪干细胞的成骨、成脂分化诱导及鉴定

人皮下脂肪干细胞的成骨、成脂分化诱导及鉴定肖建红;张阳春;张常然;杨兴【摘要】背景:脂肪干细胞是从脂肪组织中分离得到的一种具有多向分化潜能的间充质干细胞,在组织工程中比骨髓间充质干细胞具有更多优势,是当今的研究热点之一。
<br> 目的:在体外建立一种分离纯化人皮下脂肪来源脂肪干细胞的方法,进行体外培养扩增及诱导其向成骨、成脂细胞分化。
<br> 方法:通过密度梯度离心和贴壁筛选法相结合,对人脂肪干细胞进行分离、体外培养及扩增。
倒置显微镜下观察人脂肪干细胞的细胞形态和生长特性。
选取第2代及第5代细胞,用CCK-8法检测细胞活性,绘制细胞生长曲线,用流式细胞仪检测细胞表面抗原标记。
选取第5代细胞,分别进行成脂及成骨诱导分化,以确定其多向分化潜能。
<br> 结果与结论:①采用密度梯度离心和贴壁培养相结合方法,可成功从人脂肪组织中获得纯度较高的人脂肪干细胞。
②人脂肪干细胞经历了生长滞缓期、对数增殖期和生长平台期,符合正常细胞的生长规律,且其生长具有对数生长期,其倍增时间较短。
③人脂肪干细胞表达干细胞表面抗原标记,具有低免疫原性,且具有成脂成骨多向分化潜能。
④DAPI是一种简单、有效的标记人脂肪干细胞的方法,DAPI不损伤细胞活性,对细胞标记率高。
%BACKGROUND:Adipose-derived stem cels are a kind of mesenchyam stem cels with multipotent differentiation capacity, which have more advantages than bone marrow mesenchymal stem cels in tissue engineering research. OBJECTIVE: To establish a method to isolate and purify adipose-derived stem cels from human subcutaneous adipose tissues folowed byin vitro amplification and osteoblastic/adipogenic differentiation. <br> METHODS: Adipose-derived stem cels were isolated from human subcutaneous adipose tissue andcultured by density gradient centrifugation and adherent culture. Cel morphology and growth features were observed under inverted microscope. Adipose-derived stem cels at passages 2 and 5 were selected for viability measurement using cel counting kit-8 method, and then cel growth curves were drawn. The immunophenotype identification was analyzed by flow cytometry. Passage 5 cels underwentosteoblastic/adipogenic induction to confirm the multi-differentiation potential. <br> RESULTS AND CONCLUSION: (1) Using density gradient centrifugation and adherent culture method, high-purity human adipose-derived stem cels can be successfuly isolated from human adipose tissues.(2) The growth process of human adipose-derived stem cels includes stagnant phase, logarithmic phase and plateau phase, which meets the growth rhythm of normal cels. Moreover, the population doubling time is shorter. (3). Human adipose-derived stem cels are positive for stem cel-related antigens, with low immunogenicity and the multi-differentiation potential. (4) Labeling human adipose-derived stem cels with DAPI is a simple efficient labeled method, and the labeling rate is high but the cytotoxicity is low【期刊名称】《中国组织工程研究》【年(卷),期】2015(000)032【总页数】7页(P5155-5161)【关键词】干细胞;脂肪干细胞;人来源的脂肪干细胞;细胞分化;脂肪组织;细胞培养;细胞鉴定;国家自然科学基金【作者】肖建红;张阳春;张常然;杨兴【作者单位】中山大学附属第一医院东院普通内科,广东省广州市 510700;中山大学附属第一医院东院下肢骨科,广东省广州市 510700;中山大学附属第一医院东院普通内科,广东省广州市 510700;中山大学附属第一医院东院下肢骨科,广东省广州市 510700【正文语种】中文【中图分类】R394.2文章亮点:1 实验通过密度梯度离心和贴壁筛选法相结合,对人脂肪干细胞进行分离、体外培养及扩增。
骨髓间充质干细胞成软骨诱导分化(平面诱导)

骨髓间充质干细胞成软骨诱导分化(平面诱导)
1. 细胞分化诱导
将对数生长期的细胞消化下来计数,成软骨诱导分化培养基诱导液重悬细胞,离心后调整细胞密度密度1.0~2.0x 10e7cells/mL。
吸取20 μl细胞悬液(约2.0~4.0x 10e5个细胞)悬滴至24孔板中央。
置于37°C, 5% CO2培养环境下培养2~3 h使细胞贴壁。
2~3 h后补充1 mL成软骨诱导分化培养基诱导液正常培养。
每隔2~3天换液一次。
按照以上换液频率诱导21~28天,并注意观察细胞形态变化。
2. 染色鉴定
2.1 细胞固定
吸去培养基使用适量1xPBS清洗一次,弃去.后取适量4%中性甲醛溶液覆盖培养器皿底面,室温固定30~60min后,弃去固定液再使用1xPBS清洗两次。
2.2 阿利辛蓝染色
向清洗干净的诱导孔内加入适量染色液,避光静置染色30min。
吸去阿利辛蓝染色液,用1xPBS清洗两次,并加入适量1xPBS避免细胞干燥。
2.3 诱导评估
显微镜下观察成软骨染色效果,并进行图像采集和诱导评估。
诱导成功时,软骨组织中的内酸性粘多糖可被阿利辛蓝染成蓝绿色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
干细胞向成骨细胞诱导分化染色及鉴别方法
碱性磷酸酶(ALP)是成熟成骨细胞的标志性酶之一。
1 Gomori钙钴法
【染色原理】ALP在pH值9.4的环境下,以镁离子作为激活剂,能够把β-甘油磷酸钠水解出磷酸,磷酸与高浓度的钙盐结合形成无色的磷酸钙,再与硝酸钴作用形成磷酸钴,经硫化胺处理形成黑色的硫化钴沉淀在酶活性处。
【孵育液配制】3%β-甘油磷酸钠5ml
2%巴比妥钠5ml
蒸馏水10ml
2% CaCl2 10ml
2% MgSO4 1ml
【步骤】
(1)将无菌的玻片放入培养皿中,传代时加入适量的细胞悬液,作细胞爬片,呆细胞长满玻片后取出。
(2)PBS冲洗后用冷丙醇固定10min,蒸馏水冲洗数次。
(3)入孵育液中,37℃孵育4-6h。
自来水冲洗数次。
(4)2%硝酸钴中浸3-5min,蒸馏水洗数次。
(5)1%的硫化铵中2min,自来水冲洗,自然干燥,封固。
【结果】胞质中阳性反应呈现灰黑色颗粒或块状沉淀。
2 偶氮偶联法:
【孵育液配制】萘酚AS-BI磷酸盐20mg
DMSO 0.5ml
0.2mol/L巴比妥醋酸缓冲液(PH 9.2)50ml
六偶氮副品红0.5ml
1mol/L NaOH调PH 9-10,混合后过滤使用。
(六偶氮副品红:副品红400mg,浓盐酸2ml,双蒸水8ml混合过滤;临用前与等体积4%亚硝酸钠混合)【步骤】
(1)细胞爬片成功后,PBS冲洗后,置入4℃10%甲醛固定10min。
(2)蒸馏水冲洗。
(3)将过滤孵液直接滴加于玻片上,室温下作用45min。
(4)流水冲洗,晾干。
(5)甘油明胶封固。
【结果】成骨细胞胞质中可见红色ALP阳性颗粒。
3 碱性磷酸酶染色试剂盒法:
【作用原理】细胞内碱性磷酸酶在Ph9.4-9.6条件下水解磷酸萘酚AS-MX产生萘酚,后者被重氮盐捕获,生成不溶性有色沉淀。
【作用液配制】取2号储备液10ml,加3号液200ul,再加4号粉剂10mg,振摇速溶,立即过滤到细胞爬片上。
【步骤】
(1)细胞爬片滴加数滴1号液,室温固定一分钟(不可以延长),流水漂洗2分,晾干。
(2)滴加作用液数滴,置湿盒内于37℃孵育2小时,流水冲洗2分钟。
(3)滴加5号液数滴,复染5分钟,流水冲洗2分钟,晾干。
【结果】阳性结果是胞浆内出现蓝色沉淀。
1 茜素红法
【步骤】
(1)培养皿用PBS冲洗2次,95%乙醇固定10min,双蒸水冲洗3次。
(2)0.1%茜素红-Tris-Hcl(PH 8.3)37℃,30min。
(3)蒸馏水冲洗,干燥,封片。
【结果】染料品种的不同,矿化结节呈现不同的红色。
2 von Kossa法
【步骤】
(1)培养皿用PBS冲洗2次,4%多聚甲醛固定5分钟,双蒸水冲洗3次。
(2)培养皿中加入5%硝酸银溶液1ml,将培养板开盖在紫外灯下照射1小时。
(3)倒出残留的硝酸银溶液,蒸馏水冲洗3遍。
(4)培养皿中加入5%硫代硫酸钠溶液1ml,中和残留的硝酸银溶液,吸出残液。
(5)室温下晾干,封固。
