ChIP样本交联步骤
chip-seq过程

chip-seq过程Chip-seq(染色质免疫沉淀测序)是一种常用的基因组学技术,它可以用来研究蛋白质与DNA之间的相互作用。
本文将详细介绍chip-seq的过程及其应用。
一、引言Chip-seq是一种结合了染色质免疫沉淀(ChIP)和高通量测序(sequencing)的技术,用于研究特定蛋白质与DNA之间的相互作用。
通过该技术,我们可以确定蛋白质与DNA的结合位点,并进一步了解这些结合位点在基因调控中的作用。
二、实验步骤1. 交联:首先,将细胞或组织交联,使DNA与蛋白质相互交联形成复合物。
这一步骤可以使用甲醛等交联剂进行。
2. 染色质免疫沉淀:将交联后的细胞或组织进行裂解,使DNA与蛋白质分离。
然后,使用特异性抗体与目标蛋白质结合,形成抗原抗体复合物。
接着,使用磁珠或琼脂糖柱等材料,将抗原抗体复合物与其他非特异性结合的蛋白质和DNA分离。
3. 反交联:将抗原抗体复合物中的DNA与蛋白质进行反交联,使其分离。
这一步骤可以通过高温或酶切等方法进行。
4. DNA纯化:将反交联后的DNA进行纯化,去除杂质。
可以使用酚/氯仿等方法进行DNA的提取和纯化。
5. DNA测序:将纯化后的DNA进行高通量测序。
通过测序,可以得到大量的DNA片段序列。
6. 数据分析:对测序得到的数据进行分析,包括数据过滤、比对和富集分析等。
通过对数据的分析,可以确定蛋白质与DNA的结合位点,并推测这些结合位点在基因调控中的功能。
三、应用1. 确定转录因子结合位点:转录因子是调控基因表达的关键蛋白质,chip-seq可以用来确定转录因子与DNA的结合位点。
通过分析转录因子的结合位点,我们可以了解基因调控网络的组成和功能。
2. 研究组蛋白修饰:组蛋白修饰是一种重要的基因调控机制,chip-seq可以用来研究组蛋白修饰与DNA的相互作用。
通过分析组蛋白修饰的分布情况,我们可以了解基因的激活或抑制状态。
3. 鉴定染色体可及性:染色体的可及性是指染色体上的DNA片段是否容易被蛋白质结合。
免疫共沉淀实验流程--chip

染色体免疫共沉淀(Chip)实验报告步骤一:样品准备试剂和仪器:Biopulverizer(biospec)37% formaldehyde甘氨酸(Glycine)PBSprotease inhibitors步骤二:细胞交联1. 向客户提供的细胞沉淀中加入1ml 细胞培养基,混匀细胞后转移到15ml离心管中。
2. 向15ml离心管中加入270ul 37%甲醛溶液,使得甲醛的终浓度为1%,室温温育10min。
3. 向反应体系中各加入505ul 2.5M甘氨酸到终浓度为125mM,室温温育5min以终止交联反应。
4. 135x g,4°C离心10min,去上清,并用冰冷的10ml 1XPBS迅速漂洗两次。
5. 吸净PBS后,加入1ml PBS+protease inhibitors混合液,并转移到1.5ml离心管中。
800Xg,4°C离心5min,小心去掉上清。
步骤三:细胞裂解试剂:裂解缓冲液1: 50mM Hepes-KOH pH7.5; NaCl 140mM; EDTA 1mM; glycerol 10%;NP-40 0.5%;Tritonx -100 0.25%。
裂解缓冲液2: 10mM Tris-HCl pH8.0; NaCl 100mM; EDTA 1mM pH8.0; Na-Deoxycholate 0.1% Protease inhibitors。
步骤:1. 加入蛋白酶抑制剂(终浓度为1x) 到所有的裂解缓冲液中。
2. 用1ml的裂解缓冲液1重悬上述处理的样品,4°C旋转混合10min后,800g,4°C离心5min,弃上清。
3. 用300ul 裂解缓冲液2重悬样品,冰上放置30min。
步骤四:超声破碎DNA仪器:Bioruptor(Diagenode)步骤:(1)、将超声仪器Bioruptor 调到中档“Mid”(M)。
(2)、在超声池中注入一定量的冰水。
ChIP实验流程整理

1、ChIP实验用的苗是正常光照条件下生长的四周大的苗子,取1.5克嫩苗组织,放入50ml 1%甲醛溶液中,抽真空交联。
2、用2.5ml 2M甘氨酸溶液停止交联反应。
3、水洗苗子数次,然后将苗用吸水纸吸干,液氮碾磨,然后用25ml提取缓冲液1重悬。
extraction buffer I0.4 M sucrose,10 mM Tris-HCl, pH 8,10 mM MgCl2,5mM b-mercaptoethanol,0.1mM phenylmethylsulfonyl fluoride [PMSF],1* protease inhibitor; Roche),4、用神奇滤器或者是金属筛过滤,然后4000rpm, 4℃离心20分钟5、用1ml提取缓冲液2,重悬沉淀物,14,000 rpm ,4℃离心10分钟。
extraction buffer II0.25 M sucrose,10 mM Tris-HCl, pH 8,10mMMgCl2,1%Triton X-100,5mM b-mercaptoethanol,0.1mM PMSF,1*protease inhibitor)6、用300ul提取缓冲液3,重悬沉淀物,14,000 rpm ,4℃离心60分钟。
extraction bufferIII1.7Msucrose,10mMTris-HCl, pH8,0.15%Triton X-100,2mMMgCl2,5mMb-mercaptoethanol,0.1mM PMSF,1*protease inhibitor)7、粗核提取物用200ul裂解缓冲液重悬,在冰浴上孵育10分钟,以充分裂解细胞。
8、超声处理,以剪切基因组DNA,使DNA大部分断裂成200-1000bp大小,如果能把大部分控制在400-800bp则更佳。
超声过程中请一定注意要保持样品处于冰浴中,并且处于较低温度。
超声剪切的效果在后续去交联后可以用常规的DNA琼脂糖凝胶电泳检测。
染色体免疫共沉淀(chip)步骤

染色体免疫共沉淀(chip)步骤
染色体免疫共沉淀(ChIP)是一种常用的实验技术,用于研究染色体上特定蛋白质与DNA的相互作用。
以下是染色体免疫共沉淀的基本步骤:
1. 交联:将细胞或组织与形成蛋白质-DNA复合物的交联剂(如甲醛)处理,使蛋白质与DNA之间形成致密的交联。
这一步骤有助于保持蛋白质与DNA的相互作用并固定其在细胞或组织中的位置。
2. 细胞破碎和核裂解:将交联后的细胞或组织进行破碎和核裂解,以释放细胞内的染色质。
这可以通过机械方法(如超声波处理)或化学方法(如利用细胞裂解缓冲液和蛋白酶进行破碎)完成。
3. 免疫共沉淀:在破碎的细胞或组织提取物中,加入特异性抗体,该抗体可以与目标蛋白质结合。
免疫抗体与目标蛋白质形成免疫复合物,并与形成蛋白质-DNA复合物的目标区结合。
4. 洗涤:通过一系列洗涤步骤,去除非特异性和非特定结合的蛋白质和核酸,以减少背景信号的干扰。
5. 解交联:通过加热或酶处理等方法,解除细胞或组织中的蛋白质-DNA交联,并将DNA释放出来。
6. DNA提取:通过加入DNA提取缓冲液和有机溶剂,从溶液中沉淀出DNA,并用适当的方法进行纯化和浓缩。
7. 分析:对提取的DNA进行进一步的分析,可使用PCR、测序等技术,以检测免疫共沉淀的蛋白质与目标DNA的相互作用。
这些步骤旨在允许研究人员从细胞或组织中获得特定蛋白质与DNA的结合信息,并进一步了解基因调控、表观遗传学等相关的生物学过程。
实际操作时,具体的步骤和条件可能会因实验目的和样本类型而有所不同。
因此,在进行染色体免疫共沉淀实验时,建议参考相关文献和实验室经验,以确保实验的准确性和
可重复性。
chip操作步骤

磁珠吸附法chip操作步骤及试剂配方1、每盘细胞(8ml培液),加入11×Fixation solution 800ul使得甲醛的终浓度为1%,fixation solution为现配,室温摇床10min。
(甲醛能有效的使蛋白质-蛋白质,蛋白质-DNA,蛋白质-RNA交联,形成生物复合体,防止细胞内组分的重新分布。
甲醛的交联反应是完全可逆的,便于在后续步骤中对DNA和蛋白质进行分析; 交联时间如果过长,细胞染色质难以用超声波破碎,影响ChIP结果,而且实验材料也容易在离心过程中丢失。
交联时间如果过短,则交联不完全,产生假阴性。
甲醛的交联反应可被加入的甘氨酸终止。
)2、终止交联:加1M甘氨酸1.26ml,使其终浓度为0.125。
室温摇床5min。
3、用冰冷的PBS 冲洗两次后,加适量pbs+pmsf,用细胞刷刮下细胞,4℃ 1000RPM离心5min。
4、倒去上清,加入1ml Scell Lysis Buffer,冰上放置10min,匀浆器匀浆后转入2ml Ep管中,4℃ 5000RPM离心5min.5、弃上清,300ul nuclei Lysis buffer,吹散沉淀。
6、socinate破碎:1min on off 30 10次左右,4℃ 13000RPM离心20min,琼脂糖胶电泳,亮带集中在1000bp左右的方可。
(以便暴露目标蛋白,利于抗体识别。
)7、分别收集20ul样品做input -20℃保存。
(Input是断裂后的基因组DNA,需要与沉淀后的样品DNA一起经过逆转交联,DNA纯化,以及最后的PCR或其他方法检测。
Input对照不仅可以验证染色质断裂的效果,还可以根据Input中的靶序列的含量以及染色质沉淀中的靶序列的含量,按照取样比例换算出ChIP的效率,所以Input对照是ChIP实验必不可少的步骤。
)8、用 Chip Diluiton Buffer 稀释样品10倍9、准备beads,用Pre-Blocking buffer for dynabeads 洗beads3次.(Protein A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合),最好实验前一天准备beads。
组织染色质免疫沉淀技术(chip)-步骤

Chip步骤组织裂解:1.新鲜组织。
切成1-3 mm3小块。
2.转移组织到50ML试管里。
加入10 ml of 1X PBS.3.加甲醛至终浓度为1%。
室温下转动15—20mins。
(10ul)4.加2.5 M Glycine至终浓度为0.125 M(终止交联)。
4°C下转动10mins。
(0.5ml)5.100 g, 4°C 离心样本5mins。
6.弃上清,取沉淀。
用45 ml 冰冻1X PBS和25 ml 冰冻1X PBS各洗一次。
离心弃上清。
7.再加入2 ml 冰冻1X PBS。
匀浆机裂解组织。
1000 rpm,4°C ,离心5 min。
弃上清。
8.细胞裂解液重悬细胞。
加入蛋白酶抑制剂PMSF (10 ul per ml), aprotinin (1 ul per ml) andleupeptin (1 ul per ml).冰上孵育10-15mins9.5,000 rpm ,4°C离心5分钟。
取沉淀10.细胞核裂解液重悬细胞加入(8)中的蛋白酶抑制剂。
冰上孵育10-20mins。
11.接下来就进去超声过程了。
(接下来第一天的5)第一天1.细胞中加入1%的甲醛,8ml的培养液加入216 ul的甲醛,37度十分钟。
2.配制含有蛋白酶抑制剂的PBS 20 ml和含有蛋白酶抑制剂的SDS溶液1ml3.将细胞拿出来,迅速的移除含甲醛的培养基,加入含蛋白酶抑制剂的PBS洗两遍。
胰酶消化20秒,加入含蛋白酶抑制剂的PBS 1ml。
用细胞刮刀把细胞刮下,收集到1.5ml的离心管里面。
4.4度2000rpm离心10min,弃上清液,加入200ul含蛋白酶抑制剂的SDS溶液。
吹打重悬细胞,冰上孵育10分钟。
5.超声切割DNA,总切割时间4min30sec,超声10sec,间隙10sec。
6.4度13000rpm离心10min,转移上清液到一个新的2ml的离心管,弃沉淀。
ChIP原理及实验方法

ChIP原理及实验方法ChIP(Chromatin Immunoprecipitation)是一种用于研究蛋白质与DNA相互作用的实验方法。
该方法主要用于探究转录因子与染色质的相互作用、蛋白质修饰与基因表达调控之间的关系等。
下面将详细介绍ChIP的原理和实验步骤。
ChIP的原理:ChIP的基本原理是通过特异性抗体结合到目标蛋白质上,然后通过交联、裂解、免疫沉淀和DNA提取等步骤分离出与目标蛋白质结合的DNA片段。
通过对这些DNA片段的分析,可以了解目标蛋白质在染色质上的分布情况,从而揭示蛋白质与DNA相互作用的生物学功能。
ChIP的实验步骤:1.交联:将细胞或组织与甲醛交联,使蛋白质与DNA形成稳定的结合。
2.裂解:将交联的样品进行裂解,使细胞核和染色质释放出来。
3.免疫沉淀:将特异性抗体加入裂解的样品中,使其与目标蛋白质结合。
通过免疫沉淀,可以分离出与抗体结合的蛋白质-DNA复合物。
4.洗涤:通过洗涤去除非特异性结合的蛋白质和DNA。
5.解交联:通过高温或酶解去除交联,使DNA恢复原始状态。
6.DNA提取:将解交联后的样品进行DNA提取,获取与目标蛋白质结合的DNA片段。
7.PCR扩增:使用特异性引物对提取的DNA片段进行PCR扩增,以检测目标DNA片段的存在与否。
8.数据分析:通过测定PCR产物的数量,可以推断目标蛋白质在染色质上的结合情况。
ChIP的注意事项:1.选择合适的抗体:要确保选择的抗体具有高特异性和敏感性,以避免误差和背景信号。
2.优化实验条件:包括交联时间、裂解方法、洗涤条件等,以获得清晰的信号和较低的背景噪音。
3.正负对照组:需要设置正负对照组,以验证实验结果的可靠性。
4.数据分析:可以使用定量PCR、测序等方法对ChIP的结果进行定量和定性分析。
总结:ChIP是一种用于研究蛋白质与DNA相互作用的重要实验方法。
通过ChIP,可以了解转录因子在染色质上的定位、蛋白质修饰与基因表达调控之间的关系等。
CHIP实验操作过程

CHIP实验操作过程(一)、细胞的甲醛交联与超声破碎。
1、取出1平皿细胞(10cm平皿),在9ml培养基中加入243ul 37%甲醛,使得甲醛的终浓度为1%。
2、37摄氏度孵育10min。
(此时准备1*PBS,加入蛋白酶抑制剂混合物5ul/ml)。
3、终止交联:加10*甘氨酸900ul,混匀后,在室温下放置5min即可,置冰上。
4、吸尽培养基,用冰冷的PBS清洗细胞2次。
5、加入含有蛋白酶抑制剂的PBS 2ml,细胞刮刀收集细胞于15ml离心管中。
预冷后4度,700g,5min收集细胞。
(此时准备SDS Lysis buffer,加入蛋白酶抑制剂混合物5ul/ml)。
6、倒去上清。
按照细胞量,加入SDS Lysis Buffer。
使得细胞终浓度为每200ul含2×106个细胞。
这样每100ul溶液含1×106个细胞。
再加入蛋白酶抑制剂复合物。
假设MCF7长满板为5×106个细胞。
本次细胞长得约为80%。
即为4×106个细胞。
因此每管加入400ul SDS Lysis Buffer,将2管混在一起,共800ul。
7、超声破碎:VCX750,25%功率,4.5S冲击,9S间隙(共18S*3+9S)。
共14次。
(破碎前可取10ul样品,用于琼脂糖电泳,冻存)(二)、除杂及抗体孵育。
8、超声破碎结束后,15.000g 4度离心10min,去除不溶物质。
留取300ul做实验,其余保存于-80度,最多可以保存2个月。
(可取10ul样品,用于琼脂糖电泳,冻存)300ul中,100ul加抗体(anti-STAT1)做为实验组;100ul加anti-RNA Polymerase II做为阳性对照组;100ul加Normal rabbit IgG作为阴性对照。
9、15ml离心管,300ul的超声破碎产物中,加入2.7ml ChIP Dilution Buffer和13.5ul的Protease Inhibitor Cocktail II,再加入180ul Protein G Agarose,4度颠转混匀1h。
ChIP实验步骤

第一天:(一)、细胞的甲醛交联与超声破碎。
1、取出1平皿细胞(10cm平皿),加入243 ul 37%甲醛,使得甲醛的终浓度为1%(培养基共有9ml)。
2、37摄氏度孵育10min。
3、终止交联:加甘氨酸至终浓度为0.125M。
450 ul 2.5M甘氨酸于平皿中。
混匀后,在室温下放置5min即可。
4、吸尽培养基,用冰冷的PBS清洗细胞2次。
5、细胞刮刀收集细胞于15ml离心管中(PBS依次为5ml,3ml和3ml)。
预冷后2000rpm 5min收集细胞。
6、倒去上清。
按照细胞量,加入SDS Lysis Buffer。
使得细胞终浓度为每200 ul含2×106个细胞。
这样每100ul溶液含1×106个细胞。
再加入蛋白酶抑制剂复合物。
假设MCF7长满板为5×106个细胞。
本次细胞长得约为80%。
即为4×106个细胞。
因此每管加入400ul SDS Lysis Buffer。
将2管混在一起,共8 00ul。
7、超声破碎:VCX750,25%功率,4.5S冲击,9S间隙。
共14次(二)、除杂及抗体哺育。
8、超声破碎结束后,10,000g 4oC离心10min。
去除不溶物质。
留取300ul做实验,其余保存于-80oC。
300ul中,100ul加抗体做为实验组;100ul不加抗体做为对照组;100ul加入4 ul5MNaCl(NaCl终浓度为0.2M),65oC处理3h解交联,跑电泳,检测超声破碎的效果。
9、在100ul的超声破碎产物中,加入900ulChIPDilutionBuffer和20ul的50×P IC。
再各加入60ulProteinAAgarose/SalmonSpermDNA。
4oC颠转混匀1h。
10、1h后,在4摄氏度静置10min沉淀,700rpm离心1min。
11、取上清。
各留取20ul做为input。
一管中加入1ul抗体,另一管中则不加抗体。
ChIP基本流程图

ChIP基本流程图ChIP(染色质免疫沉淀)是一种用于研究蛋白质与染色质相互作用的实验技术。
下面是ChIP的基本流程图,以便更好地了解该技术的原理和步骤。
1.交联:首先,将细胞或组织交联。
这一步骤的目的是固定蛋白质-DNA复合物,以便后续的实验处理。
交联通常通过添加交联剂(如甲醛)来完成。
2.细胞裂解:将交联的细胞或组织裂解,以释放细胞核。
这可以通过机械破碎、化学裂解或超声波处理来完成。
裂解的目的是将染色质解离为小片段,以便后续的免疫沉淀步骤。
3.DNA切割:使用特定的限制酶或酶切剂切割DNA。
这一步骤的目的是产生适当大小的DNA片段,以便后续的免疫沉淀和测序分析。
4.免疫沉淀:将特定抗体与要研究的蛋白质结合。
这些抗体通常是针对特定蛋白质的单克隆或多克隆抗体。
将抗体与它们所结合的蛋白质-DNA复合物一起孵育,以形成抗原-抗体复合物。
5.洗涤:使用缓冲液洗涤掉非特异性的蛋白质-DNA复合物,以去除非特异性结合的物质。
这一步骤的目的是减少背景噪音,提高实验的特异性。
6.反交联:通过加热或酶切等方法去除交联剂,以使蛋白质-DNA复合物解离。
这将使DNA片段从蛋白质中释放出来,以便后续的纯化和分析。
7.DNA纯化:纯化被免疫沉淀的DNA片段,以去除杂质。
这可以通过酚/氯仿提取、柱层析或磁珠纯化等方法完成。
8.DNA分析:对纯化的DNA片段进行进一步的分析。
这可以包括PCR扩增、测序、芯片分析或基因组定位等技术。
这些分析将帮助确定与特定蛋白质结合的DNA区域,并揭示蛋白质与基因调控之间的关系。
ChIP作为一种重要的基因组学技术,广泛应用于研究基因调控、表观遗传学和疾病发生机制等方面。
通过了解ChIP的基本流程,我们可以更好地理解该技术的原理和操作步骤,从而更好地利用它来解答科学问题。
染色质免疫共沉淀技术原理

染色质免疫共沉淀技术原理一、前言染色质免疫共沉淀技术(ChIP)是生物学研究中常用的一种方法,它通过利用抗体特异性识别染色质上的特定蛋白质,进而从复杂的细胞核提取物中富集这些蛋白质,并对其进行鉴定和分析。
本文将详细介绍染色质免疫共沉淀技术的原理。
二、实验步骤1. 交联首先,需要对活细胞进行交联处理,以稳定染色质和蛋白质之间的相互作用。
常用的交联剂有甲醛和二氧化硅等。
2. 染色质片段化接下来,需要将交联后的细胞进行裂解,并将DNA片段化。
这可以通过超声波或者限制性内切酶等方法实现。
3. 免疫共沉淀然后,在裂解液中加入与目标蛋白特异性结合的抗体,并进行免疫共沉淀。
在共沉淀过程中,目标蛋白和与其结合的DNA片段会被富集到抗体上。
4. 分离DNA片段接下来,需要将DNA片段从抗体上分离出来。
这可以通过加入盐或者进行热处理等方法实现。
5. 鉴定和分析最后,对富集的DNA片段进行鉴定和分析。
这可以通过PCR扩增、测序或者芯片技术等方法实现,以确定目标蛋白在染色质中的作用位置和作用方式。
三、原理解析1. 抗体选择ChIP技术的核心是抗体的选择。
抗体需要特异性识别目标蛋白,并保持其活性。
通常情况下,使用多个不同来源的抗体可以提高富集效率和准确性。
2. 交联原理交联是通过甲醛或二氧化硅等化学物质与细胞核内的DNA、蛋白质发生共价结合而实现的。
交联后的染色质会更加稳定,避免了在裂解过程中DNA和蛋白质之间失去相互作用。
3. 片段化原理染色质片段化是为了将长链DNA切成适当大小的小片段,以便于后续步骤中与抗体结合并富集目标蛋白。
超声波法利用高频声波震荡使DNA分子破碎,而限制性内切酶法则利用特定的酶切割位点切割DNA分子。
4. 免疫共沉淀原理免疫共沉淀是利用抗体与目标蛋白之间的特异性结合,将目标蛋白及其相关DNA片段从裂解液中富集到抗体上。
这一步骤需要注意选择合适的抗体和免疫共沉淀条件,以提高富集效率和准确性。
5. DNA片段分离原理将DNA片段从抗体上分离出来是为了进一步进行后续鉴定和分析。
CHIP技术操作步骤

CHIP技术操作步骤1.将细胞接种到2个10 cm玻璃平皿内,加入10 mL 培养液进行培养;2.当细胞密度长至70-80%时,进行甲醛交联(首次进行交联时,消化细胞进行计数,使每个平皿内细胞数长至1x107个/板);3.吸弃培养液,PBS洗涤细胞2次,最后一次PBS不要吸走,预留10 mLPBS液于平皿内;4.每个平皿内加入270 µL 37%甲醛,至终浓度为1%,37℃交联染色质10 min;5.倒掉上清,冰浴PBS洗板2次(PBS内含有PMSF 1mmoL/L,aprotinin1µg/mL);6.加入5 mLPBS,刮下细胞,收集到15 mL离心管中进行离心,2000 rpm/3min,弃上清;7.加入含有蛋白酶抑制剂(PMSF,aprotinin)的SDS lysis buffer 900 µL,将细胞吹打均匀,分成3管;8.将细胞悬液置于冰上,进行超声;(Out put:5W;间隙10s,工作15s),将细胞内基因组打碎至500-1000 bp的小片段;9.取出80 µL超声产物作为In put组冻存于-70℃;10.加入9倍体积IP dilution buffer摇匀,加入100 µL protein A agarose/salmonsperm DNA混合液,同时加入蛋白酶抑制剂,4℃,3h;11.2000 rpm/3min,收集上清,加入抗体(稀释度一般为1:1000),4℃,过夜;12.再加入80 µL protein A agarose/salmon sperm DNA混合液,4℃,3 h;13.2000 rpm/5min,弃上清,收集protein A agarose/antibody/DNA复合物;14.分别用以下buffer各1 mL,依次洗涤;●TSI液1 mL洗一次;●TSII液1 mL洗一次;●Buffer III 1 mL洗一次;●TE液1 mL洗2次;每次3000 rpm/3min离心,收集沉淀;15.加入Extraction buffer 250 µL洗涤2次,平板摇床摇15 min,收集约500 µL洗脱液;16.取出In put管,以及15步骤所得洗脱液,每管加入20 µL NaCl 5 M/L,65℃,4-6 h反应去交联;17.加入10 µL 0.5 M/L EDTA,20 µL 1M/L Tris-HCl,2 µL 10 mg/mL,蛋白酶K,45℃反应1-2 h;18.酚-氯仿法提纯DNA;●加入450 µL饱和酚,5000 rpm/10min,取上清,重复一次;●取上清转移至新离心管中,加入450 µL(氯仿:异戊醇=24:1),重复一次;●取上清转移至新离心管中,加入1/10体积3 M/L乙酸钠pH=5.2,2.5倍体积无水乙醇,轻柔混匀,悬液静置于-20℃3个小时,离心10000rpm/15min;●70%乙醇洗涤1-2次,倒掉上清,空气中静置20min或者真空干燥5min;●每管加入30 µLRF water,-20℃保存;19.每次取1-2 µL模板,PCR反应,1.5%EB胶检测。
CHIP流程中文版

按照Nature Protocol 2008整理1.取材:根尖0.5cm约4g(~80皿双排种)/2 g花/ 4g叶子2.交联:加入37ml 交联缓冲液(GB buffer),其中含1ml 37%甲醛,370ul 100mM PMSF,这两个现用现加。
取根尖的话先把剪下的根泡在含PMSF的GB buffer中,取材完毕再加入甲醛和PMSF。
真空抽气10min,抽气力度慢慢调大,前5min不时停下晃匀,以免材料贴壁3.停止交联:加入2.5ml 2M甘氨酸,真空抽气5min4.提核:用蒸馏水清洗材料,然后用滤纸把水吸干。
研磨材料,加入25ml预冷的提核缓冲液(nuclei isolation buffer),其中PMSF和cocktail现用现加。
用滤膜过滤研磨得到的液体,单层过滤2次滤出液4℃11000g离心20min5.核裂解:弃上清,向沉淀加入1ml 预冷的核裂解液(nuclei lysis buffer加入PMSF和cocktail),重悬,将重悬液转入新的1.5ml EP管中。
因为异丙醇可以消气泡,所以PMSF 可以最后再加以消除重悬时吹吸引起的气泡6.超声破碎:将EP管放在EP管架上并泡在冰水混合物中,超声条件:200W 15S 5次。
中间间隔60-80s。
4℃13800g离心10min。
上清可冻于-80℃,也可继续下面流程。
--------------------------------------------------------------------------------------------------------------- 7.超声检测:取5ul超声后的液体到新EP管中,加入100ul核裂解液。
加入4ul 5M NaCl,65℃放置至少4hr;加入2ul 10mg/ml RNase,37℃放置0.5hr加入2ul 0.5M EDTA,4ul 1M Tris-HCl(pH6.5)和1ul 20mg/ml Proteinase K,45℃放置1.5hr加入113ul酚/氯仿,混匀,室温13800g离心15min。
染色体免疫沉淀 ChiP

ChIP实验流程如下图所示,具体操作步骤包括:
第一步、细胞的甲醛固定
交联所用的甲醛终浓度约为1%,而交联时间需要预实验来确定。
交联时间如果过长,细胞染色质难以用超声波破碎,影响ChIP结果,而且实验材料也容易在离心过程中丢失。
交联时间如果过短,则交联不完全,产生假阴性。
甲醛的交联反应可被加入的甘氨酸终止。
通常的交联条件为室温10 min。
第二步、超声波断裂染色质
甲醛交联后的染色质对限制酶和DNase I高度抵抗,因此通常使用超声使得染色质断裂。
超声波是使用机械力断裂染色质,容易引起升温或产生泡沫,这都会引起蛋白质变性,进而影响ChIP的效率。
所以在超声波断裂染色质时,要在冰上进行,且要设计时断时续的超声程序,保证低温。
总超声时间也不要太长,以免蛋白降解。
打断后的染色质片段的长度主要集中在200-1000bp左右(可以用琼脂糖凝胶电泳来鉴定)。
第三步、用特异性抗体与目的蛋白结合,免疫沉淀蛋白和DNA复合物。
抗体的量要进行优化,防止非特异的结合。
用Protein-A/G Sepharose回收免疫沉淀复合体。
经过洗涤除去非特异结合的染色质。
第四步、65℃解交联蛋白质和DNA复合物,消化蛋白质,纯化富集的DNA。
在免疫沉淀复合体中加人不含DNase的RNase和蛋白酶K,65℃保温6h以上,使交联逆转。
交联逆转后用QIAquick DNA cleanup system纯化回收DNA。
纯化的DNA极少,可用NanoDrop® ND-1000仪定量。
CHIP实验流程图

CHIP实验流程图1.实验准备1.1准备实验所需的器材和试剂:包括CHIP试剂盒、离心管、PCR管、电泳仪等。
1.2清洗实验器材:使用去离子水和酒精对实验器材进行清洗和消毒。
1.3准备实验样本:从细胞培养物或组织中提取DNA,并进行纯化和浓缩。
1.4质检实验样本:使用比色法或紫外分光光度计检测DNA的质量和浓度。
1.5设计实验方案:根据实验目的和样本特点,设计合适的实验方案。
2.交叉连接试验2.1设计引物:根据需要扩增的目标序列,设计合适的引物。
2.2 制备PCR反应体系:将引物、模板DNA、Taq酶和其他试剂按照一定比例加入PCR管中。
2.3进行PCR扩增反应:使用PCR仪对PCR反应体系进行温度循环扩增。
2.4检测PCR产物:将PCR产物进行电泳分析,观察扩增结果。
2.5确认PCR产物:使用测序技术对PCR产物进行测序,确认扩增结果。
3.CHIP实验3.1 交叉连接反应:将DNA样本与蛋白质进行交叉连接反应,形成DNA-protein结合物。
3.2 细胞裂解:使用细胞裂解缓冲液将细胞裂解,释放DNA-protein结合物。
3.3 DNA纯化:使用离心管将DNA-protein结合物离心,将上清液中的DNA进行纯化。
3.4DNA修饰:将纯化后的DNA进行修饰,如去磷酸化或甲基化等。
3.5 免疫沉淀:使用特异性抗体对DNA-protein结合物进行免疫沉淀。
3.6洗涤和离心:对免疫沉淀产物进行洗涤和离心,去除非特异性结合物。
3.7 DNA解交联:对免疫沉淀产物进行加热处理,解除DNA-protein结合。
3.8DNA纯化:使用离心管将解交联产物离心,将上清液中的DNA进行纯化。
3.9 DNA测序:对纯化后的DNA进行测序,获取DNA-protein结合物的序列信息。
4.结果分析4.1数据处理:将测序数据进行质量控制和去除低质量序列。
4.2 数据比对:将测序数据与参考基因组进行比对,找到DNA-protein结合位点。
ChIP_原理及实验方法

ChIP_原理及实验方法ChIP(Chromatin Immunoprecipitation)是一种常用的分子生物学实验技术,用于研究蛋白质与染色质之间的相互作用。
它可以帮助我们了解基因的表达调控机制,以及特定蛋白质在染色质上的分布情况。
本文将详细介绍ChIP的原理及实验方法。
一、原理ChIP实验的基本原理是通过交联染色质上的蛋白质与DNA分子,然后用特异性抗体将蛋白质-DNA复合物沉淀下来,最后通过PCR或测序等方法检测目标DNA序列的富集情况。
ChIP实验的步骤包括:交联、裂解、免疫沉淀、洗涤和DNA分离等。
具体步骤如下:1.交联:将细胞或组织进行交联,使得染色质上的蛋白质与DNA形成稳定的交联复合物。
常用的交联剂包括甲醛和二甲亚砜。
交联后,用甲醛或二甲亚砜进行破交联,使得蛋白质与DNA分离。
2.裂解:将细胞或组织裂解,释放出染色质,并将染色质切割成适当的片段。
常用的裂解方法包括机械裂解、酶裂解和超声波裂解等。
3.免疫沉淀:将特异性抗体与染色质中的目标蛋白质结合,形成蛋白质-DNA复合物。
免疫沉淀的条件需要优化,包括抗体浓度、缓冲液成分和温度等。
4.洗涤:将免疫沉淀得到的蛋白质-DNA复合物进行洗涤,去除非特异性结合的蛋白质和杂质。
5.DNA分离:将洗涤后的蛋白质-DNA复合物进行解交联,并纯化出目标DNA序列。
常用的方法包括蛋白酶K处理、蛋白质酶解和PCR等。
二、实验方法ChIP实验的方法流程如下:1.细胞或组织处理:根据研究目的,选择合适的细胞系或组织样本,并进行相应的处理。
例如,可以添加药物、诱导表达或处理刺激等。
2.交联:将细胞或组织用1%甲醛溶液交联15-30分钟,停止交联反应,然后加入0.125M甘氨酸进行孵育10分钟。
3.裂解:将细胞或组织裂解,释放出染色质。
可使用适当的细胞裂解缓冲液,如SDS缓冲液、NP-40缓冲液或胶体缓冲液。
4. 切割染色质:使用限制性内切酶或超声波等方法将染色质切割成适当的片段。
ChIP Protocol(用于细胞)

ChIP实验步骤总结1.细胞交联将细胞从孵箱取出,置于常温。
加入甲醛溶液(SIGMA),至终浓度为1%。
(以10cm皿为例,内含10ml培养液时,加入280ul甲醛溶液)。
轻轻混匀,RT,静置10min。
2.终止交联加入2.5M甘氨酸(SIGMA),至其终浓度为0.125M(以10cm皿为例,内含10ml培养液时,加入550ul 2.5M甘氨酸)。
轻轻混匀,RT,静置5min。
3.洗涤吸去培养基,用PBS清洗三次。
每次加入5ml PBS,轻摇混匀,吸去液体。
4.细胞收集加入PBS,将细胞收集到15ml离心管内。
水平转子离心,RT,2000rpm,8min,弃去上清。
于液氮中速冻后放于-80℃冻存,或进行下步实验。
5.细胞膜的破碎⑴加入1ml ChIP Hypotonic buffer ,20ul Protease InhibitorCocktail,10ul 100mM PMSF,将细胞转移到1.5ml EP管中,4℃,旋转10-15min.⑵用杜恩斯组织匀浆器匀浆,选用紧锤(即Pestle B),匀浆20-30次至推拉无阻力。
⑶离心。
4℃,3000rpm,5min,弃去上清。
6.细胞核的破碎加入300ul Nuclear Lysis Buffer,6ul Protease Inhibitor Cocktail,3ul 100mM PMSF,将沉淀吹散后,4℃旋转15-30min.7.超声加入1.2ml ChIP Dilution Buffer , 24ul Protease Inhibitor Cocktail,12ul100mM PMSF,混匀后分成三份(每份约500ul)到1.5mlEP管中。
Diagenode* Bioruptor™ 300 细胞超声破碎仪(以293T细胞为例)设置程序:1 CYCLE=15’ON 20’OFF TOTAL 32 CYCLE 8.离心,4℃,13000rpm,20min。
组织染色质免疫沉淀技术chip步骤

Chip环节组织裂解:1.新鲜组织。
切成1-3 mm3小块。
2.转移组织到50ML试管里。
加入10 ml of 1X PBS.3.加甲醛至终浓度为1%。
室温下转动15—20mins。
(10ul)4.加2.5 M Glycine至终浓度为0.125 M(终止交联)。
4°C下转动10mins。
(0.5ml)5.100 g, 4°C 离心样本5mins。
6.弃上清,取沉淀。
用45 ml 冰冻1X PBS和25 ml 冰冻1X PBS各洗一次。
离心弃上清。
7.再加入2 ml 冰冻1X PBS。
匀浆机裂解组织。
1000 rpm,4°C ,离心5 min。
弃上清。
8.细胞裂解液重悬细胞。
加入蛋白酶克制剂PMSF (10 ul per ml), aprotinin (1 ul per ml) andleupeptin (1 ul per ml).冰上孵育10-15mins9.5,000 rpm ,4°C离心5分钟。
取沉淀10.细胞核裂解液重悬细胞加入(8)中旳蛋白酶克制剂。
冰上孵育10-20mins。
11.接下来就进去超声过程了。
(接下来第一天旳5)第一天1.细胞中加入1%旳甲醛,8ml旳培养液加入216 ul旳甲醛,37度十分钟。
2.配制具有蛋白酶克制剂旳PBS 20 ml和具有蛋白酶克制剂旳SDS溶液1ml3.将细胞拿出来,迅速旳移除含甲醛旳培养基,加入含蛋白酶克制剂旳PBS洗两遍。
胰酶消化20秒,加入含蛋白酶克制剂旳PBS 1ml。
用细胞刮刀把细胞刮下,搜集到1.5ml旳离心管里面。
4.4度rpm离心10min,弃上清液,加入200ul含蛋白酶克制剂旳SDS溶液。
吹打重悬细胞,冰上孵育10分钟。
5.超声切割DNA,总切割时间4min30sec,超声10sec,间隙10sec。
6.4度13000rpm离心10min,转移上清液到一种新旳2ml旳离心管,弃沉淀。
7.稀释超声后旳上清液到10X旳CHIP稀释液,200ul旳上清液加入1.8ml旳CHIP稀释液,到达最终体积2ml。
CHIP实验流程图
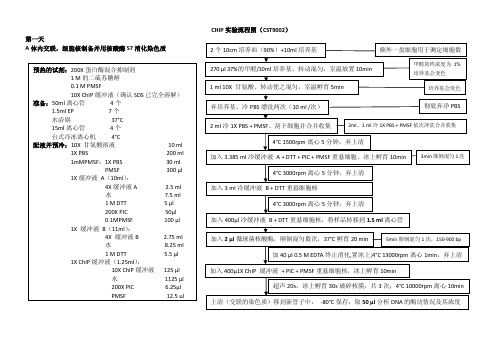
CHIP实验流程图(CST9002)第一天A体内交联,细胞核制备并用核酸酶S7消化染色质B.分析染色质的浓度和酶切情况(推荐步骤)C. 染色质免疫沉淀第二天D.漂洗免疫沉淀的染色质:ArrayE. 将染色质从抗体/蛋白G微球上洗脱并解交联F.用离心柱纯化DNA。
G. 实时定量PCR方法:建议:实验中使用带滤芯的枪头以尽可能减少污染的可能性。
试剂盒中所包含的对照引物特异性识别人或小鼠的RPL30基因,既可以用于常规PCR也可以用于实时定量PCR。
如果用户做的ChIP样品来源于其它他物种,建议客户设计合适的特异对照引物并优化PCR反应条件。
建议使用热启动Taq聚合酶以减少产生非特异PCR产物的风险。
PCR引物的选择很关键。
引物应尽可能按照下列标准来设计:引物长度: 24个核苷酸最佳Tm值:60°C最佳GC含量: 50%扩增片段长度:150-200 bp(用于常规PCR)80-160 bp (用于实时定量PCR)实时定量PCR方法:1.选与所用定量PCR仪配套的PCR管或板,做好标记。
注意加入阳性对照组蛋白H3样品组,阴性对照正常兔IgG样品组,以及监控DNA污染的不加DNA模板的空白组对照。
另外在加入反应体系前,将2%样品输入对照做一系列稀释(不稀释,1:5,1:25,1:125),据此可以产生标准曲线并测算PCR扩增效率。
2.在每个反应管或孔(板上)中加入2 μl相应DNA模板。
3.按下面配比配置PCR反应液总管,记住计算时多算两份以补偿分管时的体积损失。
配好后,向每个PCR管中加入18 μl反应液混合物。
试剂每个PCR反应(20 μl)所需体积无核酸酶的水 6 μl5 μM RPL30 引物 2 μlSYBR-Green反应体系10 μl4.按下面程序执行PCR:a.预变性95°C 3 分钟b.变性95°C 10 秒c.退火及延伸:60°C 30 秒d.重复第2及第3步,共40个循环5.用定量PCR仪自带的程序分析定量结果。
