Thermo Scientific蛋白酶抑制剂
蛋白酶抑制剂

不良反应
Joan Stephenson博士在美国医学会《医学新闻及观点》杂志上发表文章称,美国、加拿大及澳大利亚的研 究者发现,一些接受抗HⅣ治疗的患者在服用蛋白酶抑制剂后出现了脂肪的异常分布。
研究者发现,在服用3个月或以上蛋白酶抑制剂后,一部分患者在体重不变的情况下,出现了脂肪组织的异常 沉积,其表现为“水牛背”(即颈底部的脂肪组织)、壶状腹或“满月脸”。而另外一些患者在服用蛋白酶抑制 剂后却出现了四肢或脸部的脂肪消耗。上述症状在柯兴综合征患者中十分常见。该综合征是由于血清皮质酮异常 升高引起的,但在这些患者中没有发现血清皮质酮升高的证据。引起脂肪异常沉积的蛋白酶抑制剂至少有4种: indinavir、nelfinavir、ritonavir和saquinavir。美国国家健康署(NIH)的研究人员通过对10位出现腹围 增大的患者进行CT扫描发现,在服用indinavir后,脂肪并不是沉积于皮肤下,而是沉积在腹部脏器周围。蛋白 酶抑制剂究竟是如何引起上述症状的原因尚不清楚。一些研究显示蛋白酶抑制剂可能会影响代谢功能,引起甘油 三脂及血糖的升高、胰岛素抵抗以及糖尿病,但在这些出现脂肪沉积的患者并没有发现这些异常。同样,脂肪沉 积在换药后是否是可逆的也尚不清楚。
PRRSV强弱毒感染PAM和Marc-145细胞入胞途径差异的研究

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:猪繁殖与呼吸综合征(PRRS )是由猪繁殖与呼吸综合征病毒(PRRSV )引起的猪场最重要传染病之一,给全世界养猪业造成了持续的经济损害。
减毒活疫苗免疫接种作为防控PRRS 的有效手段在全世界范围内得到广泛应用。
减毒活疫苗毒株是在猴源细胞系上连续传代获得的,导致其与亲本毒株在生物学特性上存在巨大差异,同时本实验室前期结果也提示HP-PRRSV 野毒株和疫苗毒株在入胞途径上可能存在差异。
Na +/H +交换的依赖是巨胞饮的标志性特征,阿米洛利(EIPA )是Na +/H +交换的特异性抑制剂,细胞骨架重排在病毒的入胞过程中发挥重要作用,细胞松弛素D (Cyt D )是肌动蛋白聚合的特异性抑制剂。
分别利用EIPA 和Cyt D 预处理PAM 和Marc-145细胞后接毒,对比强弱毒在两种细胞内病毒拷贝数、蛋白表达水平及子代病毒的释放上与空白对照组的差异。
结果表明,PRRSV 强弱毒均不利用巨胞饮途径感染Marc-145或者PAM 细胞,但强弱毒在感染不同细胞时对肌动蛋白的依赖性存在明显的区别。
本研究结果初步揭示了PRRSV 野毒株和疫苗毒株入胞过程的差异,为进一步揭示PRRSV 疫苗毒株致弱机制提供了前期基础。
关键词:猪繁殖与呼吸综合征病毒;入胞途径;巨胞饮;肌动蛋白中图分类号:S858.28 文献标志码:A 文章编号:1674-6422(2023)04-0018-08Analysis of the Differences of the Entry Pathway of PAM and Marc-145 Infectedwith Highly Pathogenic and Attenuated PRRSVsZHU Haojie 1, GAO Fei 1, XU Jingjing 1, LIU Yuting 1, TONG Guangzhi 1, JIANG Yifeng 1, LI Guoxin 1,2(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for the Prevention andControl of Important Animal Infectious Disease and Zoonoses, Yangzhou 225009, China)收稿日期:2021-01-02基金项目:国家生猪现代产业技术体系(CARS-35);国家自然科学基金(31670158)作者简介:朱豪杰,男,硕士研究生,预防兽医学专业通信作者:李国新,E-mail:*****************.cn;姜一峰,E-mail:********************.cnPRRSV 强弱毒感染P AM 和Marc-145细胞入胞途径差异的研究朱豪杰1,高 飞1,徐晶晶1,刘宇婷1,童光志1,姜一峰1,李国新1,2(1.中国农业科学院上海兽医研究所,上海200241;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009)2023,31(4):18-25Abstract: Porcine reproductive and respiratory syndrome (PRRS), which caused by Porcine reproductive and respiratory syndrome virus (PRRSV) is considered as the most important infectious disease to the pig industry. Immunization is considered as an effective way to control PRRS all over the world. Live attenuated vaccine which obtained by continuous generation on Marc-145 cells was considered as the most effective vaccine, the generation on allogenic cell line resulting huge biological difference compaired with their parents strains including growth characteristic. Our previous results also showed that PRRSV fi eld strain and vaccine strain might have differences in the pathway of entry the cell. Na +/H + exchange is the key characteristic of macropinocytosis, Amiloride (EIPA) is the specific inhibitors of Na +/H +exchange, Cytochalasin D (Cyt D) was widely used to inhibited actin polymerzation. The PAM and Marc-145 cells were pretreated· 19 ·朱豪杰等:PRRSV 强弱毒感染PAM 和Marc-145细胞入胞途径差异的研究第31卷第4期猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS),俗称蓝耳病,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)引起的一种急性且高度传染的病毒性疾病。
受体相互作用蛋白激酶1(RIPK1)调控人结肠癌HT-29细胞程序性坏死的分子机制

受体相互作用蛋白激酶1(RIPK1)调控人结肠癌HT-29细胞程序性坏死的分子机制王海玉;张波【摘要】目的研究受体相互作用蛋白激酶1 (receptor interacting protein kinase 1,RIPK1)在人结肠HT-29细胞程序性坏死过程中的作用,并探讨E3泛素连接酶三重结构域包含蛋白16 (tripartite domain containingprotein 16,Trim16)对其作用的潜在调控机制.方法用肿瘤坏死因子α(tumor necrosis factor α,TNFα)建立HT-29细胞的程序性坏死模型,采用Annexin V-FITC/PI双染色法检测其对凋亡、坏死细胞数目的影响.分别用Western blot和qRT-PCR检测RIPK1在细胞程序性坏死中的表达.构建稳定表达Flag标记的RIPK1的HT-29细胞株,采用Flag 标记的pulldown试验结合质谱检测发现与RIPK1有相互作用的新蛋白.应用Ni-NTA pulldown试验检测筛选出的E3泛素连接酶对RIPK1泛素化的调控.结果TNFα能够成功诱导HT-29细胞程序性坏死.HT-29细胞在TNFα和半胱天蛋白酶抑制剂z-VAD处理后,表现出RIPK1、RIPK3、混合系列蛋白激酶样结构域(mixed lineage kinase domain-like protein,MLKL)表达水平显著增加,并伴随着炎性因子白介素1α(IL1α)和白介素6(IL6)水平明显升高.Flag标记的pulldown试验结合质谱检测发现一个与RIPK1有相互作用的E3泛素连接酶Trim16,体外实验表明Trim16可以增强RIPK1的泛素化程度,其可能调节RIPK1在程序性坏死过程中的作用.结论 RIPK1在TNFα和z-VAD诱导人结肠癌HT-29细胞的程序性坏死过程中起重要作用,E3泛素连接酶Trim16对此过程可能有重要调控作用.【期刊名称】《复旦学报(医学版)》【年(卷),期】2014(041)006【总页数】8页(P720-726,741)【关键词】受体相互作用蛋白激酶1 (RIPK1);人结肠癌细胞;程序性坏死;E3泛素连接酶;三重结构域包含蛋白16 (Trim16)【作者】王海玉;张波【作者单位】复旦大学附属中山医院普外科上海200032;复旦大学附属中山医院普外科上海200032【正文语种】中文【中图分类】R735.2programmed necrosis;E3 ubiquitin ligase;tripartite domain containing protein 16(Trim16)结肠癌在全球女性和男性恶性肿瘤发病率中分别居第2位和第3位[1],进展期的结肠癌患者辅助治疗后中位生存期仅为20个月左右[2]。
说明书-Thermo Scientific Pierce 免疫共沉淀(Co-IP)试剂盒

说明书Pierce®免疫共沉淀(Co-IP)试剂盒26149 2181.6货号描述26149 Pierce免疫共沉淀(Co-IP)试剂盒,包含足够进行50次免疫沉淀反应的试剂(每次使用25 μL树脂固相化抗体)试剂盒组分:加强型AminoLink®偶联树脂,2 mL固相树脂以50%的浆液形式提供(例如,100 μL 50%的浆液含有50 μL固相树脂)20×交联缓冲液,25 mL,使用时稀释至:0.01M Na3PO4,0.15M NaCl;pH 7.2氰基硼氢化钠溶液(5 M),0.5 mL淬灭缓冲液,50 mL ,1M Tris-HCl洗涤缓冲液,60 mL,1M NaClIP裂解/洗涤缓冲液,2 × 50mL,0.025M Tris,0.15M NaCl,0.001M EDTA,1% NP-40,5%甘油;pH 7.4改良型杜氏PBS (20×),25mL,使用时稀释至:0.008M Na3PO4、0.002M K3PO4、0.14M NaCl、0.01M KCl;pH 7100×条件缓冲液,5 mL,中性pH缓冲液洗脱缓冲液,50 mL,pH 2.8,含有伯胺非还原型泳道标记上样缓冲液,(5×),5 mL,0.3M Tris•HCl,5% SDS,50%甘油,泳道标记示踪染料;pH 6.8Pierce离心柱-带螺帽,100个柱子,包含相应配件微量离心收集管,2 mL,100个微量离心样品管,1.5 mL,50个Pierce对照用琼脂糖树脂(4%琼脂糖珠交联),2 mL固相树脂以50%的浆液形式提供(例如,100 μL 50%的浆液含有50 μL固相树脂)储存:收到试剂盒后将其储存于4°C。
将DSS于4°C干燥保存。
常温运输。
产品简介Thermo Scientific Pierce免疫共沉淀(Co-IP)试剂盒通过将纯化的抗体直接固定在琼脂糖基质上,从细胞裂解液或其它复杂混合物中分离天然蛋白复合体。
蛋白酶抑制剂Cocktail使用说明书奥默生物
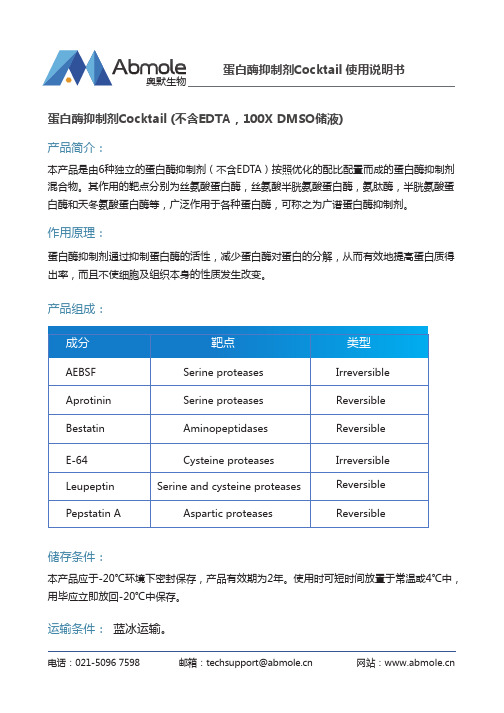
奥默生物电话:021-5096 7598 邮箱:techsupport@ 网站:产品简介:本产品是由6种独立的蛋白酶抑制剂(不含EDTA)按照优化的配比配置而成的蛋白酶抑制剂混合物。
其作用的靶点分别为丝氨酸蛋白酶,丝氨酸半胱氨酸蛋白酶,氨肽酶,半胱氨酸蛋白酶和天冬氨酸蛋白酶等,广泛作用于各种蛋白酶,可称之为广谱蛋白酶抑制剂。
本产品应于-20℃环境下密封保存,产品有效期为2年。
使用时可短时间放置于常温或4℃中,用毕应立即放回-20℃中保存。
储存条件:蛋白酶抑制剂Cocktail (不含EDTA,100X DMSO储液)蛋白酶抑制剂Cocktail 使用说明书蛋白酶抑制剂通过抑制蛋白酶的活性,减少蛋白酶对蛋白的分解,从而有效地提高蛋白质得出率,而且不使细胞及组织本身的性质发生改变。
作用原理:产品组成:成分MTT法CCK法 AEBSFAprotininBestatinE-64LeupeptinPepstatin A Cysteine proteases Serine proteases Aminopeptidases Serine proteases Serine and cysteine proteases Aspartic proteases Irreversible Reversible Reversible ReversibleReversible Irreversible 靶点靶点类型运输条件: 蓝冰运输。
奥默生物使用说明:1. 本产品适用于哺乳动物细胞及组织的蛋白质提取及纯化,蛋白免疫印迹(WesternBlot),免疫共沉淀(Co-IP),免疫荧光(IF),免疫组织化学(IHC),激酶测定(kinaseassay)和抗体,酶诊断试剂盒(Dignose Kit)等。
2. 实验时,按照1:100的容积比,将Cocktail预先加入在已准备好的实验体系中,轻轻混合均匀。
注意事项:1. 本产品不含EDTA,为100×DMSO储存液形式。
蛋白酶及其抑制剂

蛋白酶及其抑制剂
一、蛋白酶-抑制剂对照表
二、蛋白酶抑制剂混合物选择表
三、抑制剂-蛋白酶对照表
想要寻找适合您的蛋白酶抑制剂?请参看以下蛋白酶-抑制剂对照表!
为了您实验方便,我们向您提供以下蛋白酶抑制剂和蛋白酶抑制剂混合物表一、蛋白酶抑制剂混合物
表二、蛋白酶抑制剂(按蛋白酶抑制剂名称英文字母排序):
欢迎您下载我们的文档,后面内容直接删除就行
资料可以编辑修改使用
资料可以编辑修改使用
致力于合同简历、论文写作、PPT设计、计划书、策划案、学习课件、
各类模板等方方面面,
打造全网一站式需求
主要经营:网络软件设计、图文设计制作、发布广告等,公司秉着以优质的服务对待每一位客户,做到让客户满意!
感谢您下载我们文档。
细胞核质蛋白分离

介绍核蛋白抽提试剂可以从哺乳动物培养的细胞或组织中逐步分离和制备细胞质和细胞核提取物。
不变性的活性蛋白在不到两小时内纯化。
在细胞颗粒中加入前两种试剂会导致细胞膜破裂和细胞质内容的释放。
用离心法从细胞质提取液中提取完整细胞核后,用第三试剂从细胞核中提取蛋白质。
用这种产品提取的核和细胞质组分提取物一般污染率不到10%,这对于大多数涉及核提取物的实验来说是足够的纯度核抽提物比起全细胞裂解物通常更适合于进行基因调控研究。
全细胞裂解液中的细胞成分对核蛋白的相互作用和稳定性有不利影响,核蛋白更集中于核提取物,而非全细胞裂解物。
核提取物/试剂与多种下游应用兼容(包括Western blotting,BCA蛋白定量分析(产品编号23225),凝胶移位(产品编号20148),报告基因和酶活性的测定)重要产品信息●此试剂盒适用于新鲜(未冷冻)的细胞或组织样品。
使用蛋白酶抑制剂维持提取物的完整性和功能。
使用前,将蛋白酶抑制剂加入CRE I和NER浓缩物中以减少试剂稀释(浓缩蛋白酶抑制剂eg.100x)。
不需要添加蛋白酶抑制剂到CER II。
●如果在随后应用中需要大量的核提取物或出现问题,透析前用核提取物清除多余的盐。
试剂盒中的洗涤剂是不可透析的,但它主要是在细胞质中。
使用Thermo Scientific™Slide-A-Lyzer™小型透析装置进行透析。
另外,无回收蛋白或条块分割的不利影响下,NER 用于提取液的体积可以减小2倍可以得到更集中的核提取物。
●在4°C条件下执行所有离心步骤,保持细胞样本和提取物在冰上。
额外所需材料●蛋白酶抑制剂●磷酸盐缓冲盐水(PBS)细胞培养制备●贴壁细胞,用胰蛋白酶-EDTA消化,然后在500g离心5分钟。
对于悬浮细胞,通过离心在500G 5分钟收获。
●用PBS重悬细胞颗粒冲洗细胞●1-10×106细胞转移至1.5ml离心管,并在500G 离心2-3分钟●使用吸管小心地去除和丢弃上清液,使细胞颗粒尽可能干燥。
常用蛋白酶抑制剂和磷酸酶抑制剂的贮存与工作液浓度

常用蛋白酶抑制剂和磷酸酶抑制剂的贮存与工作液浓度在与蛋白相关的检测中,首先最关键的一步便是蛋白质的提取。
蛋白质的提取过程中,我们要经常加和蛋白酶抑制剂以防止蛋白质的降解。
另外在磷酸化蛋白的研究过程中,磷酸酶抑制剂也是必不可少的,本文总结了常用的蛋白酶抑制剂PMSF,Leupeptin 亮肽素,Aprotinin抑肽酶,Pepstatin胃蛋白酶抑制剂,EDTA-Na2等以及磷酸酶抑制剂NaF氟化钠,Na3VO4 原矾酸钠,BETA-glycerophosphate 甘油磷酸钠,Na2P2O4 焦磷酸钠等。
对这些蛋白酶抑制剂的溶解配制,贮存液与工作液浓度,保存都做了详细的说明。
蛋白酶抑制剂PMSF:特性:丝氨酸蛋白酶抑制剂,如胰凝乳蛋白酶,胰蛋白酶和凝血酶,也抑制半胱氨酸蛋白酶如木瓜蛋白酶(可逆的地面处理)。
溶解性:溶于异丙醇,乙醇,甲醇和丙二醇果>10mg/ml。
在水溶液中不稳定。
在100%异丙醇,+25℃时稳定至少9个月分子量:174.2使用:贮存浓度:200mM,工作浓度:1mMLeupeptin 亮肽素特性:抑制丝氨酸和半胱氨酸蛋白酶如胰蛋白酶,木瓜蛋白酶,纤溶酶,和组织蛋白酶B 溶解性:高度溶于水(1mg/ml)。
4℃一周稳定,分成小份冷冻在-20℃至少6个月分子量:C20H38N6O4 x 1/2 H2SO4:475.6C20H38N6O4 x 1/2 H2SO4 x H2O:493.6使用:贮存浓度:1mg/ml,工作浓度0.5 ug/ml (1mM)Aprotinin抑肽酶特性:丝氨酸蛋白酶抑制剂,抑制纤维蛋白溶酶,激肽释放酶,胰蛋白酶,糜蛋白酶的高活性。
不抑制凝血酶或因子X。
溶解性:易溶于水(10mg/ml)或缓冲液(例如,tris,0.1M,pH8.0)。
pH约7-8的溶液在4℃可保存1周,分装保存在-20℃可至少保存6个月。
避免反复冻融, pH>12.8的碱性环境可使其灭活。
二肽激肽酶4抑制剂对帕金森病模型细胞形态和增殖的干预作用及其机制

二肽激肽酶4抑制剂对帕金森病模型细胞形态和增殖的干预作用及其机制伊木然江·苏布哈提1,艾尼瓦尔·吾买尔1,木塔力甫·艾买提21 新疆医科大学药学院药理学教研室,乌鲁木齐830017;2 新疆医科大学中心实验室摘要:目的 基于体外实验及网络药理学,初步探讨二肽激肽酶4(DPP -4)抑制剂对鱼藤酮(ROT )诱导神经细胞帕金森病(PD )的干预作用及其相关机制。
方法 神经细胞株PC -12分为对照组、模型组、模型+西格列汀组、模型+利格列汀组、模型+维格列汀组,除对照组外各组均使用ROT 建立PD 体外模型,模型+西格列汀组、模型+利格列汀组、模型+维格列汀组在使用ROT 建模的同时在培养基中分别加入DPP -4抑制剂西格列汀、利格列汀、维格列汀。
倒置显微镜观察各组细胞形态学变化,CCK -8法观察各组细胞增殖能力。
从Swiss Target Prediction 、SEA 等数据库分别获取DPP -4抑制剂西格列汀、利格列汀、维格列汀、沙格列汀及阿格列汀的药物靶点,通过DisGeNet 、OMIM 及GeneCards 等数据库获取PD 相关的疾病靶点,利用韦恩图将药物与疾病靶点取交集得到DPP -4抑制剂作用于PD 的相关靶点。
通过String 数据库构建蛋白—蛋白相互作用(PPI )网络,选取基因满足度(Degree )值>平均值的基因作为DPP -4抑制剂对PD 产生作用的关键靶点,将DPP -4抑制剂作用于PD 的关键靶点基因输入到DAVID 数据库进行GO 基因功能和KEGG 作用通路分析。
将DPP -4抑制剂治疗PD 的关键靶点以及KEGG 信号通路导入到Cytoscape 3.7.2软件构建药物—疾病—靶点—通路网络,筛选与PD 相关信号通路关系最为密切的靶点作为DPP -4抑制剂治疗PD 的核心靶点,采用CB -Dock 2对接平台进行核心靶点的分子对接验证。
常用蛋白酶抑制剂

添加蛋白酶抑制剂是大多数细胞裂解和蛋白质提取的必要步骤。
蛋白质提取过程中,内源性蛋白酶会降解蛋白质,导致蛋白质产量的降低。
在裂解试剂中加入蛋白酶抑制剂,可防止提取蛋白的降解,确保在细胞裂解后获得蛋白质的产量。
蛋白酶抑制剂是生物或化学化合物,其作用是可逆或不可逆地结合蛋白酶。
大多数已知的蛋白酶属于四个进化上不同的酶家族之一,基于功能基团参与肽键的裂解。
一般情况下,蛋白提取过程中总是需要使用蛋白酶抑制剂。
大多数情况下,需使用几种不同抑制剂化合物的混合物(也称Cocktail,鸡尾酒),以确保蛋白质提取物在分析之前不会降解。
常见蛋白酶抑制剂
常见蛋白酶抑制剂活性组分
不可
常用蛋白酶抑制剂混合物组成
*EDTA影响蛋白活性时,需实验是否需要添加EDTA。
常见蛋白酶抑制剂

当前位置:生物帮 > 实验技巧 > 生物化学技术 > 正文蛋白酶及蛋白酶抑制剂大全日期:2012-06-13 来源:互联网标签:相关专题:解析蛋白酶活性测定聚焦蛋白酶研究新进展摘要: 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。
在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。
以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度恩必美生物新一轮2-5折生物试剂大促销!Ibidi细胞灌流培养系统-模拟血管血液流动状态下的细胞培养系统广州赛诚生物基因表达调控专题蛋白酶抑制剂破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。
在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。
以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度。
由于蛋白酶抑制剂在液体中的溶解度极低,尤其应注意在缓冲液中加人蛋白酶抑制剂时应充分混匀以减少蛋白酶抑制剂的沉淀。
在宝灵曼公司的目录上可查到更完整的蛋白酶和蛋白酶抑制剂表。
常用抑制剂PMSF1)抑制丝氨酸蛋白酶(如胰凝乳蛋白酶,胰蛋白酶,凝血酶)和巯基蛋白酶(如木瓜蛋白酶);2)10mg/ml溶于异丙醇中;3)在室温下可保存一年;4)工作浓度:17~174ug/ml(0.1~1.0mmol/L);5)在水液体溶液中不稳定,必须在每一分离和纯化步骤中加入新鲜的PMSF。
EDTA1)抑制金属蛋白水解酶;2)0.5mol/L水溶液,pH8~9;3)溶液在4℃稳定六个月以上;4)工作浓度:0.5~1.5mmol/L. (0.2~0.5mg/ml);5)加入NaOH调节溶液的pH值,否则EDTA不溶解。
胃蛋白酶抑制剂(pepst anti n)l)抑制酸性蛋白酶如胃蛋白酶,血管紧张肽原酶,组织蛋白酶D和凝乳酶;2)1mg/ml溶于甲醇中;3}储存液在4℃一周内稳定,-20℃稳定6个月;4)1作浓度:0.7ug/ml(1umol/L)5)在水中不溶解。
蛋白酶抑制剂分类和应用

蛋白酶抑制剂分类和应用在分离蛋白时,组织或细胞裂解液中充满了来自溶酶体的酶,而且原先无活性的蛋白酶原被充分激火,开始消化其周围的蛋白质. 为幸免此因素,蛋白酶抑制剂必需被加入在缓冲液内以阻止蛋白酶对细胞组织的消化作用. 来自哺乳类动物,植物, 霉菌或细菌的组织,蛋白酶成份是不同的, 并依照机体状态的进展也能够发生转变. 哺乳类动物组织分离时比细菌或其它组织分离时更需要应用蛋白酶抑制剂使组织细胞受到完全的爱惜.因此,在各类蛋白分离时,在各类蛋白电泳时蛋白酶抑制剂的适被选用就成了很重要的因素。
蛋白酶功能 :涉及到许多细胞内和细胞外的进程:o食物蛋白在消化道的消化o激活无活性酶原和多肽激素/神经转移介质的释放o调剂血凝物质和纤维素o内源性和外源性蛋白的细胞内消化o跨膜的蛋白转移o微生物对生物体解决,通过释放蛋白酶的致使毒性增加蛋白酶分类 :依照催化中心结构的不同蛋白酶可分为4类 :1. 丝氨酸蛋白酶在其活性中心含有丝氨酸和组氨酸,如: 糜蛋白酶, 弹性蛋白酶,血纤维蛋白溶酶,凝血酶,枯草杆菌蛋白酶,胰酶Chymotrypsin, Elastase, Plasmin, Subtilisin, Thrombin, Trypsin2. 半胱氨酸蛋白酶(别名 :硫醇或SH 蛋白酶)在其催化中心含有半胱氨酸,如 : Calpain, 组织蛋白酶 B,C 和L,和木瓜蛋白酶3 天(门)冬氨酸蛋白酶(羧基蛋白酶)在其活化中心含有天(门)冬氨酸,如 : 组织蛋白酶D, 木瓜蛋白酶, 肾素4. 金属蛋白酶含有金属离子,即 : 锌2+在其催化中心,如氨基肽酶,羧基蛋白酶A 和 B,嗜热菌蛋白酶机体避免蛋白酶破坏作用几种可能性 :•酶在特殊囊性小泡的分派 (溶酶体,包涵体)•内源性蛋白酶抑制剂(如 : Aprotinin,抗凝血酶,抗胰酶)SERVA 6种蛋白酶抑制剂鸡尾酒的作用:➢SERVA提供6种不同的蛋白酶抑制剂鸡尾酒,用于分离纯化各类组织的蛋白,多肽的最正确选择➢蛋白酶抑制剂混合物G含有5种水溶性的抑制剂用于抗丝氨酸- , 半胱氨酸- 和金属蛋白酶作用,而且是经常使用选择的鸡尾酒,应当幸免同时利用有机体溶剂➢蛋白酶抑制剂混合物H P含有4种水溶性抑制剂用于抗丝氨酸- , 半胱氨酸蛋白酶作用,而且有效地用于分离和提取重组蛋白,幸免金属螯合物。
阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究

阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究邹瑞;彭正松【摘要】利用阳离子脂质体作为载体,用其搭载鱼精蛋白与STAT3 siRNA复合物,通过一系列实验证实该复合体系可显著抑制STAT3基因在黑色素瘤细胞B16中的表达,促进肿瘤细胞的凋亡.首先对载体材料进行了一系列表征测定,检测了不同复合比例下载体和siRNA复合物的粒径和电位.利用载体和siRNA的复合物对B16细胞进行转染并测定转染效率,随后对复合材料的毒性进行了检测.此外还进行了细胞凋亡、平板克隆、荧光定量PCR以及Western Blot等一系列实验来进一步确定载体复合物的有效性.实验结果表明,阳离子脂质体搭载复合了鱼精蛋白的STAT3siRNA表现出了良好的靶向治疗性及优秀的递送效率,且复合体系稳定性良好,毒性低.【期刊名称】《西昌学院学报(自然科学版)》【年(卷),期】2019(033)001【总页数】6页(P28-33)【关键词】阳离子脂质体;鱼精蛋白;siRNA;STAT3【作者】邹瑞;彭正松【作者单位】西华师范大学生命科学学院,四川南充 637009;西华师范大学生命科学学院,四川南充 637009;西昌学院农业科学学院,四川西昌 615000【正文语种】中文【中图分类】R739.51998年,华盛顿卡耐基研究院的Fire A 等首次在秀丽隐杆线虫(C.elegans)发现了一个双链RNA能够沉默蠕形秀丽隐杆线虫基因表达,并证明上述现象属于转录后水平的基因沉默[1],这一现象正式被称为 RNA 干扰(RNAi)。
从 1999年人们发现RNAi 现象[2]的存在到 2001年,RNAi 技术正式应用于哺乳动物细胞基因功能的研究中[3],短短几年内,RNAi技术得到了飞速发展。
毫无疑问,若RNAi技术能有效应用于临床,这将是基因治疗领域的一大突破。
RNAi 能够抵抗转基因或外源性病毒的侵犯。
在体外设计与靶基因mRNA 同源互补的双链RNA后,将这段双链RNA 导入目的细胞,其能够通过同源互补,从而靶向性地降解该mRNA,达到靶基因沉默的效果。
exosomes外泌体实验方案

外泌体分离提纯草案By 朱旭峰一、以超高速离心的方法来分离外泌体(细胞上清)1.1细胞培养液(CM)是来自无菌的80%-90%的培植细胞,并用浓度比1:1.000的蛋白酶抑制剂混合。
(sigma)1.2快速地将CM用0.22μm 的过滤筛(Millipore)过滤,来分离完整地细胞和残渣。
超速离心于120,000_g (Sorvall WXULTRA SERIES, rotorA-641) 4 ℃.2 小时1.3用1mL 冷的PBS 重悬和清洗小囊泡,再次超速离心120,000_g(Sorvall WXULTRA SERIES, rotor A-641) 4 ℃.2 小时1.4再用100μL 冷的PBS 重悬后转移到低粘附的管中1.5快速地使用或置于-80℃中待用为检测外泌体的蛋白浓度,取2μL的样品置于卡上,用Direct Detect™(Millipore)2材料a)细胞培养液b)蛋白酶抑制(Sigma)c)过滤筛(Millipore)d)冷的PBSe)低粘附的管f)Direct Detect™(Millipore)二、以超高速离心的方法来分离外泌体(人血浆)1.1在提取外泌体之前应该向血浆里添加1;500浓度比的蛋白酶抑制剂(Sigma)1.2将上清液移至一个新的管中离心200*g 20分钟4℃1.3小心地再将上清液移至新的管中离心10000*g 30分钟于4℃来去除较大的囊泡、1.4此阶段的样品可以1.5将样品用0.22μm的注射器滤筛(Millipore)过滤并且离心110000g(Sorvall WX ULTRA SERIES, rotor F65L) 2小时4℃1.6用冷的PBS重悬后再次超速离心(110,000g, 1 h, 4 ℃).,1.7将外泌体小心干燥并且用冷的PBS重悬1.8外泌体应该立即使用或-80摄氏度冷藏2.材料a)蛋白酶抑制(Sigma)b)过滤筛(Millipore)c)冷的PBSd)低粘附的管e)Direct Detect™(Millipore)三、ExoQuick TM化学沉淀法1.1ExoQuick TM的使用要按照厂家提供的说明书来实行1.2该试剂盒可以简单地提取CM,人血浆,和血清里的外泌体,只需用倒相管按照所指示的量来加入ExoQuick TM试剂盒里的溶液1.3溶液孵化过夜,在4℃温和的摇晃1.4在流式细胞仪缓冲液中洗涤1.5试剂盒里的带荧光的免疫磁珠已经被绑定,用流式细胞仪鉴定即可(BD Biosciences)配合使用CellQuest的软件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
100mg
1515
78432
抑肽酶(Aprotinin)
25mg
1678
78433
抑氨肽酶(Bestatin)N-[(2S,3R)-3-氨基-2-羟基-4-苯基丁酰]-L-亮氨酸
(N-[(2S,3R)-3-amino-2-hydroxy-4-phenylbutyryl]-L-leucine)
可逆
1mg/ml(水)
胃酶抑素A(PepstatinA)
685.9
天冬氨酸蛋白酶
可逆
1mg/ml(甲醇)
PMSF (苯甲磺酰基氟化物)
174.2
丝氨酸蛋白酶
可逆
18mg/ml(甲醇)
订购消息:
单独包装的蛋白酶抑制剂
产品
货号
产品描述
包装
价格¥
78431
AEBSF [4-(2-氨乙基)氟化苯磺酰•HCl]
10mg
2801
78435
亮抑蛋白酶肽(Leupeptin)
[(乙酰基-亮氨酰-亮氨酰-argininal) •半硫酸盐]
50mg
4317
78436
胃酶抑素A(PepstatinA)
25mg
2118
36978
PMSF (氟化苯基甲磺酰氟)
5mg
911
焦磷酸钠(Sodium
Pyrophosphate)
221.9
丝氨酸/苏氨酸磷酸酶
不可逆
65mg/ml(水)
E-64
357.4
半胱氨酸蛋白酶
不可逆
20mg/ml(1:1乙醇/水)
EDTA
372.24
金属蛋白酶
(螯合二价阳离子)
可逆
10克/100ml(水)
亮抑蛋白酶肽(Leupeptin)
475.6
丝氨酸和半胱氨酸蛋白酶
Thermo Scientific蛋白酶抑制剂
抑制剂
分子量
目标酶家族
•HCl
239.5
丝氨酸蛋白酶
不可逆
200mg/ml(水)
抑肽酶(Aprotinin)
6511.5
丝氨酸蛋白酶
可逆
10mg/ml(水)
抑氨肽酶(Bestatin)
308.38
氨基肽酶
可逆
5mg/ml(甲醇)
10mg
2118
78434
E-64,[N-反式-环氧琥珀酰-L-亮氨酸-4-胍基丁酰胺]也称其为N-[N-(L-3-反式-碳环氧乙烷-2-羰基)]-L-亮氨酰胍丁胺
([N-trans-epoxysuccinyl-L-leucine-4-guanidinobutylamide] ;N-[N-(L-3-trans-carboxirane-2-carbonyl)]-L-leucylagmatine)
