Experiment8间接计数法
间接计数法-涂碟法、倒碟法、浊度法
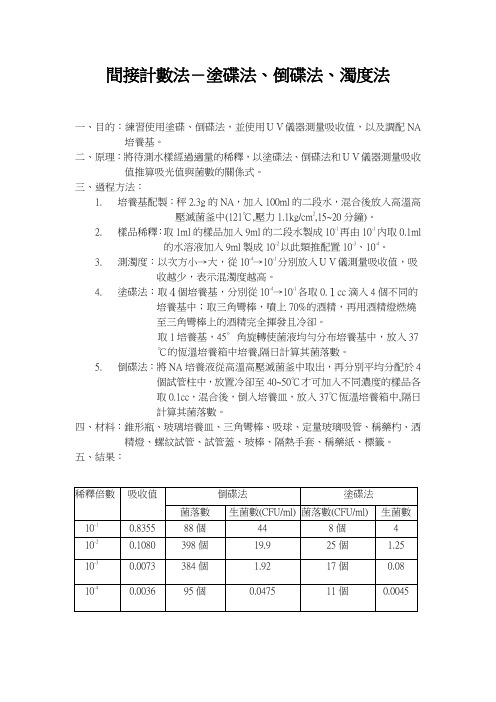
間接計數法-塗碟法、倒碟法、濁度法一、目的:練習使用塗碟、倒碟法,並使用UV儀器測量吸收值,以及調配NA培養基。
二、原理:將待測水樣經過適量的稀釋,以塗碟法、倒碟法和UV儀器測量吸收值推算吸光值與菌數的關係式。
三、過程方法:1.培養基配製:秤2.3g的NA,加入100ml的二段水,混合後放入高溫高壓滅菌釜中(121℃,壓力1.1kg/cm2,15~20分鐘)。
2.樣品稀釋:取1ml的樣品加入9ml的二段水製成10-1再由10-1內取0.1ml的水溶液加入9ml製成10-2以此類推配置10-3、10-4。
3.測濁度:以次方小→大,從10-4→10-1分別放入UV儀測量吸收值,吸收越少,表示混濁度越高。
4.塗碟法:取4個培養基,分別從10-4→10-1各取0.1cc滴入4個不同的培養基中;取三角彎棒,噴上70%的酒精,再用酒精燈燃燒至三角彎棒上的酒精完全揮發且冷卻。
取1培養基,45∘角旋轉使菌液均勻分布培養基中,放入37℃的恆溫培養箱中培養,隔日計算其菌落數。
5.倒碟法:將NA培養液從高溫高壓滅菌釜中取出,再分別平均分配於4個試管柱中,放置冷卻至40~50℃才可加入不同濃度的樣品各取0.1cc,混合後,倒入培養皿,放入37℃恆溫培養箱中,隔日計算其菌落數。
四、材料:錐形瓶、玻璃培養皿、三角彎棒、吸球、定量玻璃吸管、稱藥杓、酒精燈、螺紋試管、試管蓋、玻棒、隔熱手套、稱藥紙、標籤。
五、結果:倒碟法塗碟法1.說明10ml之菌液如何配置成10-2倍與10-3倍之稀釋菌液?Ans:先加入90ml的二段水製成10-1;取1ml的10-1加入10-2的瓶中,加9ml二段水製成10-2;取1ml的10-2加入10-2的瓶中,加9ml二段水製成10-3。
2.實驗所得之總生菌數是否能真正代表樣品中的微生物數量?為什麼?Ans:不行;限於物理、化學因素,無法滿足所有細菌的營養需求,且肉眼無法判斷是否有重疊的菌落,所以測出的菌落比實際的還低。
《临床检验基础》课程中细胞计数的常用方法

《临床检验基础》课程中细胞计数的常用方法细胞计数是临床检验中常用的一种方法,用于测量体液或组织中的细胞数量。
细胞计数的结果可以反映出疾病的程度和进展情况,对于疾病的诊断和治疗具有重要的参考价值。
本文将介绍细胞计数的常用方法。
一、直接计数法直接计数法是最常用的一种细胞计数方法。
其原理是将待测液体或组织样本通过显微镜观察,手工计数细胞数量。
该方法操作简单、准确性高,但由于需要手工计数,所以工作量大,速度慢,不适用于大批量样本的计数。
二、电子计数法电子计数法是一种自动化的细胞计数方法,通过电子计数器对待测样本进行计数。
该方法具有快速、高效、准确的优点,适用于大批量样本的计数。
但是,该方法需要设备的支持,成本较高,同时对于不同类型的细胞计数,需要进行不同的设备调整,操作难度较大。
三、显微镜计数法显微镜计数法是一种通过显微镜观察待测样本进行计数的方法。
该方法适用于细胞数量较少的样本,可以进行手工计数或电子计数。
该方法操作简单,准确性较高,但需要使用显微镜进行观察,对于不同类型的细胞计数,需要进行不同的显微镜调整,操作难度较大。
四、流式细胞术流式细胞术是一种通过细胞表面标记物的特异性识别和分离,实现对细胞种类和数量的分析的方法。
该方法具有高准确性、高速度、高通量的优点,适用于大批量样本的计数和分析。
但是,该方法需要设备的支持,成本较高,同时对于不同类型的细胞计数,需要进行不同的设备调整,操作难度较大。
综上所述,细胞计数是临床检验中常用的一种方法,其常用的方法包括直接计数法、电子计数法、显微镜计数法和流式细胞术。
不同的方法适用于不同的样本类型和计数需求,临床医生需要根据实际情况选择合适的方法进行细胞计数,以提高诊断和治疗的准确性和效率。
常见微生物计数法汇总!(一)

常见微生物计数法汇总!(一)引言概述:微生物计数是一种常见的实验方法,用于定量估计和检测环境中的微生物数量。
常见微生物计数法有许多种,本文将汇总介绍其中的几种常用计数方法。
一、直接计数法1. 显微镜计数法:使用显微镜观察培养皿中的微生物数量,通过数在视野中出现的微生物来估算总数。
2. 填充网格计数法:使用遗传学细胞计数板或计数室将细胞封装在微小方格中进行计数。
3. 浓度计算法:通过对微生物液体培养物的稀释以及菌落形成数量进行计算,从而估算原始液体中微生物的数量。
4. 流式细胞仪计数法:利用流式细胞仪对细胞进行连续识别和计数,快速且准确。
二、间接计数法1. pH法:通过确定微生物在特定pH值下的生长情况来计算微生物的数量。
2. 活菌数测定法:使用平板法、涂布法和滤膜法等方法,根据菌落形成数量来计算微生物的数量。
3. 光密度测定法:利用光密度计测量微生物培养物中细胞浓度对光的吸光度,从而计算微生物的数量。
4. ATP测定法:通过测量微生物中的ATP含量来估算微生物数量。
5. 核酸测定法:通过分子生物学技术,测定微生物DNA或RNA的含量,计算微生物数量。
三、表面计数法1. 培养基涂布法:将待测样品均匀涂布在培养基表面,按规格标准进行观察和计数。
2. 表面化学计数法:通过使用表面活性剂或化学溶液对微生物进行杀灭,并利用计数技术计算杀灭的微生物数量。
3. 扫描电子显微镜计数法:利用扫描电子显微镜观察样品表面的微生物数量,并进行计数。
4. 膜过滤计数法:将待测液体通过微孔膜过滤,然后在培养基上进行培养和计数。
四、生物传感器计数法1. pH微电极法:利用微电极检测微生物生长过程中产生的H+离子浓度变化。
2. 导电性测定法:利用微生物生理代谢活性所产生的电导率变化进行计数。
3. 生物发光法:利用荧光素酶或细菌荧光素所产生的可见光等特性进行计数。
五、图像处理计数法1. 数字图像处理法:利用图像处理软件进行图像分析,自动或半自动计数微生物数量。
微生物计数原理

微生物计数原理一、引言微生物计数是微生物学研究中的基础工作之一,它可以用于评估微生物的数量和生长状况。
微生物计数原理是指基于一定的方法和技术,通过对微生物样本的处理和观察,确定其中微生物数量的过程。
本文将介绍几种常用的微生物计数原理及其应用。
二、直接计数法直接计数法是最常见的微生物计数原理之一,它通过直接观察和计数微生物的个体来确定其数量。
常用的直接计数方法有显微镜计数法和电子计数法。
1. 显微镜计数法显微镜计数法是一种传统的微生物计数方法,它通过显微镜放大被计数微生物的图像,再用目镜进行计数。
该方法适用于大型微生物,如细菌和酵母菌等。
在显微镜下,通过顶点计数法或方格计数法,将显微镜视野中的微生物个数进行计数,并根据显微镜视野的大小和计数范围来计算总体数量。
2. 电子计数法电子计数法是一种利用电子显微镜进行微生物计数的方法。
它通过将微生物样品制备成薄片,然后在电子显微镜下观察和计数微生物的个体。
电子计数法具有高分辨率和高准确性的特点,适用于微小微生物的计数,如病毒和细菌孢子等。
三、间接计数法间接计数法是一种无需直接观察和计数微生物个体,而是通过测量微生物活性或生物产物来确定微生物数量的方法。
常用的间接计数方法有培养计数法和生物化学计数法。
1. 培养计数法培养计数法是一种通过培养微生物并计数生长的菌落数量来确定微生物数量的方法。
该方法需要将微生物样品接种到含有适宜营养物质的培养基上,经过一定的时间后,观察和计数培养基上形成的菌落数量。
根据菌落的形态和特征,可以初步确定微生物的种类,并通过计算菌落的数量来推断微生物的数量。
2. 生物化学计数法生物化学计数法是一种利用微生物在生长过程中产生的生物化学物质来确定微生物数量的方法。
常用的生物化学计数方法有ATP计数法和蛋白质计数法。
在这些方法中,通过测量微生物产生的ATP或蛋白质的浓度来推断微生物的数量。
四、流式细胞术流式细胞术是一种高通量的微生物计数方法,它通过将微生物样品悬浮液通过流式细胞仪,以高速流动的方式逐个计数微生物个体。
实验八大要数

实验八大要数
第一要素试验名称﹕
实验要取个能清楚表达实验内容的名称是重要的﹐有利于试验报表的分类存盘和调阅。
第二要素试验目的﹕
实验有针对性﹐在做实验之前﹐首先要明确实验目的。
利于采取正确的实验方法﹐做到有的放矢。
第三要素试验样本﹕
选取正确的试验样本是做好实验的前提﹐在实验前要确认样本的正确性和适用性。
第四要素试验注意事项﹕
明确实验所要注意的事项﹐排除一些偶然性﹑意外因素对实验的影响﹐保证实验的顺利进行及实验结论的正确性。
第五要素试验方法﹕
实验方法即如何进行实验﹐实验方法是整个实验过程中最为重要的一个环节﹐是根据实验所要达到的目的而选择的﹐试验方法选取的合理性直接影响到试验结果是否达到预期目的及要求。
第六要素实验数据处理﹕
一定量的样本测出的数是很多的﹐单从这些数据上看显得杂乱﹑无头绪﹐只有对数进行适当的处理﹐才能使数清晰﹑直观﹐使人一目了然﹐同时也有利于试验分析﹐抓住主要因素﹐排除次要因素。
第七要素试验结论﹕
结论是本次试验最终结果﹐它是在以上各要素正确的基础上﹐根据试验及其数据处理的结果与标准要求进行比较﹐看是否符合要求。
第八要素试验样本处理方式﹕
样本处理是试验最后一步﹐处理的好坏对后续的正确性与生产顺利性都有重要影响。
名称间接计数法进行总菌数测定平板计数法

實驗名稱:間接計數法進行總菌數測定(平板計數法)一原理:間接計數法式將待測樣品(飲用水、廢污水、食品、乳類、空氣)等予以培養計數,常用方法為平板計數法(plate count method),其原理是講一定體積的待測水樣經過適量的稀釋,以塗碟法或倒碟法,於平板計數培養基(plate count agar )或 (tryptone glucoseextract agar),培養24小時,在稀釋倍數已知的情況下,計算培養基上的菌落數目,便可知水中存活細菌總數。
二設備:1.電子天秤 3. 高溫高壓滅菌釜2.水浴鍋 4. 培養箱三器材:1.秤藥紙 5.培養皿 9.酒精燈2.秤藥勺 6.試管 10.吸球3.錐形瓶 7. 試管架4.接踵環 8.定量玻璃吸管四實驗步驟:(1)塗碟法(spread plate technique):1.吸取酵母菌液1mL,置於9mL之無菌水中,充份混合後即成為10-1倍之稀釋菌液,並依前步驟製作10-2倍和10-3倍等連續稀釋菌液。
2.利用以滅菌之玻璃定量吸管過火後由五種不同稀釋系列各去0.1mL~0.2mL菌液,分別滴於五個含有NA培養皿中心處。
3.將三腳彎棒置於95%酒精中從酒精中取出過火使酒精燃盡,並等待其冷卻。
4.取滅菌完之三角棒塗抹滴入之菌液,旋轉培養皿使菌液均勻分布再放入培養箱。
(2)倒碟法(pour plate):1.吸取酵母菌液1mL,置於9mL之無菌水中,充份混合後即成為10-1倍之稀釋菌液,並依前步驟製作10-2倍和10-3倍等連續稀釋菌液。
2.製作NA培養基,製作完成後拿出泡在水浴鍋中李保持45~50度。
3.吸取25mL之NA培養基,放入試管中,滴入菌液混合倒入培養皿中。
4. 取滅菌完之三角棒塗抹滴入之菌液,旋轉培養皿使菌液均勻分布,完成滴取菌液之試驗再放至培養箱。
五實驗結果及數據:吸光值:倒碟法:塗碟法:六問題:1.說明10mL之菌液如何配置成10-2倍與10-3倍之稀釋菌液?先各取1mL得原液與9mL的蒸餾水後,並加以混合成為10-1,在稀釋成10-1的菌液1mL和9mL的蒸餾水混合成為10-2,重複幾次後,再取10-2菌液加入稀釋後就會得到10-3的結果。
《临床检验基础》课程中细胞计数的常用方法

《临床检验基础》课程中细胞计数的常用方
法
1.细胞计数的概念
细胞计数是临床检验中常用的一种分析手段,它可以用来分析血液、尿液、脑脊液、骨髓等样本中细胞的数量和比例,从而帮助临床医生诊断疾病并进行治疗。
细胞计数的方法有很多种,其中包括直接计数法、间接计数法、电子计数法等。
2.直接计数法
直接计数法通常使用显微镜手工计数,适用于细胞数量较少的样本。
该方法的原理是将样本经特殊处理后,在计数板上对细胞进行手工计数。
这种方法简单易行,但是需要特别注意计数板的选择和计数误差的控制。
3.间接计数法
间接计数法是通过细胞的特异性反应(如增殖、膜通透率、荧光反应等)来分析细胞数量、比例和状态的方法。
该方法适用于细胞数量较多的样本,并且计数结果更加精确、可靠。
4.电子计数法
电子计数法是一种比较先进的细胞计数方法,它利用流式细胞仪进行细胞计数。
该方法主要依赖于细胞的荧光标记和生物学特性,通
过分析细胞的大小、形状、密度、荧光等特征,从而快速、精确地计数细胞。
5.细胞计数的意义和应用
细胞计数的意义在于帮助医生判断疾病的严重性、预测病情发展趋势以及确定治疗方案等。
例如,白细胞计数可以快速检测身体的免疫状态,红细胞计数可以反映肝脏和肾脏的功能,血小板计数可以判断出凝血系统的健康状况。
这些数据可以为医生制定诊断和治疗方案提供重要的参考。
总之,细胞计数是一种非常重要和必要的临床检验方法,可以为医生提供确定疾病预后、制定治疗方案以及进行随访管理等方面提供科学依据。
不同的细胞计数方法各有优缺点,需要根据具体的检测要求和技术条件来选择最合适的细胞计数方法。
血液学一般检验第二节

高色素性(hyperchromic):红细胞染色深、中央浅区消失。 见于巨幼红细胞性贫血、球形红细胞增多症。 嗜多色性(多染色性polychromatic):红细胞呈淡灰色或紫灰色。 见于增生性贫血,巨幼红细胞性贫血。
嗜碱性点彩:
卡波环
有核红细胞
染色质小体:
4.结构的异常
4.结构的异常
三. 试剂
赫姆氏(Hayem)红细胞稀释液
氯化钠:调节渗透压
硫酸钠:提高比密,防止红细胞粘连。
氯化高汞:防腐剂
( RBC )
手工显微镜法红细胞计数
四. 方法
1.小试管加RBC稀释液1.99ml。
2.采血,取血10ul。
3.擦去管外的血,轻吹入试管底部, 再漱洗吸管2~3次,立即混匀。
4.混匀后充入计数室,静置3~5 min, 高倍镜下计数。
形态异常
红细胞缗钱状形成(rouleaux formation):涂片中红细胞呈串状叠连似缗钱状。 常见于:多发性骨髓瘤、原发性巨球蛋白血症等。
3.染色反应的异常
低色素性(hypochromic):红细胞染色过浅,中央苍白区扩大,提示血红蛋白含量明显减少。最常见于缺铁性贫血、珠蛋白生成障碍性贫血、铁粒幼细胞性贫血,也可见于某些血红蛋白病。
2 形态异常
口形细胞(stomatocyte) ;红细胞中央淡染区呈扁平裂缝状,宛如微张口的嘴形或鱼口状。 靶形细胞(target cell ) :细胞中央淡染区扩大,中心部位又有部分色素存留而深染,状似射击之靶标。见于珠蛋白生成障碍性贫血、异常血红蛋白病等。
2 形态异常
镰形细胞(sickle cell) :形如镰刀状,见于镰形细胞性贫血。 泪滴形细胞(dacrycyte,teardrop cell ) :细胞呈泪滴状或手镜状。见于骨髓纤维化,珠蛋白生成障碍性贫血,溶血性贫血。
间接记数法的名词解释

间接记数法的名词解释在数学中,间接记数法是一种数数的方式,也称为跳步计数法。
与直接记数法不同,直接记数法是将物品一一列举并进行数数,而间接记数法则是通过跳过一定数量的物品,通过间接的方式进行数字的推断和计算。
间接记数法在实际生活中应用广泛,尤其在大量物品或无法直接数数的情况下特别有用。
1. 历史起源间接记数法的使用可以追溯到古代文明。
在古埃及,人们发现古墓中的壁画上描述了通过跳过一定数量的符号或图案来计数牛羊的方式。
这种跳步计数法的使用为后来的数学家提供了灵感,进一步发展了间接记数法的理论基础。
2. 应用领域间接记数法被广泛应用于各行各业。
在商业领域,对大型仓库中的库存进行计数,往往采用间接记数法。
假设有一仓库里堆放了成百上千的箱子,每个箱子里又装满了商品,如果一一进行直接计数将会非常耗时耗力。
而通过跳过一定数量的箱子,每隔一定数量进行点算,可以相对快速地估算出仓库中商品的大致数量。
同样,在科学研究领域,当研究对象很小或者无法直接观测时,也可以运用间接记数法。
在昆虫学中,研究人员无法直接数清一个昆虫群体的数量,但可以通过在一定区域内随机采样并数清特定范围内的昆虫数量,然后根据该范围内昆虫的平均密度进行推算,从而得出整个群体的数量。
3. 计算方法间接记数法的计算方法主要基于间隔数和倍数。
在使用间接记数法时,需要确定一个基准点,通常是一个已知数量的物品,并将其作为起点。
然后,通过选择一个间隔数,如跳过2个或跳过5个物品,并在基准点之后开始计算。
通过在每个间隔数的物品上增加特定倍数,如加1、2、3或其他数值,逐步推断出未被计数的物品的数量。
例如,假设在一排箱子中,我们使用间隔数为3,起点箱子中有2个苹果。
通过在第一个箱子上加1个苹果,第二个箱子上加2个苹果,第三个箱子上加3个苹果,然后再根据间隔数和倍数推算其他未被计数的箱子上的苹果数量。
这种方法既避免了逐一数数,又能够通过间接计数得出较为准确的总数。
indirect counting method

indirect counting method
(原创实用版)
目录
1.间接计数法的定义
2.间接计数法的应用领域
3.间接计数法的优点和缺点
4.间接计数法的实际应用案例
正文
一、间接计数法的定义
间接计数法,又称为估算法,是一种统计数据收集的方法。
它是通过对样本进行调查、抽查或估算,从而推断出总体数据的一种方法。
这种方法的特点是不直接对总体数据进行统计,而是通过一系列的计算和推算来得出结果。
二、间接计数法的应用领域
间接计数法被广泛应用于各种领域,如市场调查、人口统计、经济预测等。
例如,在市场调查中,通过对一部分样本的调查,可以推断出整个市场的需求情况;在人口统计中,通过对一部分人口的抽样调查,可以推断出整个人口的基本情况。
三、间接计数法的优点和缺点
间接计数法的优点在于,它可以通过对一部分样本的调查,来推断出整个总体的情况,节省了大量的人力、物力和时间。
同时,由于它是通过科学的计算和推算得出的结果,因此其结果具有一定的准确性。
然而,间接计数法也存在一些缺点。
首先,由于它是通过抽样调查得出的结果,因此其结果可能存在一定的误差。
其次,间接计数法的结果受到样本的选择和调查方法的影响,如果样本选择不当或调查方法不合理,
那么得出的结果可能与实际情况相差甚远。
四、间接计数法的实际应用案例
以我国进行的人口普查为例,由于我国的人口众多,如果对人口进行全面统计,将需要大量的人力和物力,而且效果可能并不理想。
因此,我国采用的是间接计数法,通过对一部分人口进行抽样调查,来推断出整个人口的情况。
高中生物计数的知识点总结

高中生物计数的知识点总结1. 生物计数的方法生物计数有多种方法,包括直接计数、间接计数和抽样调查。
直接计数是指直接数出生物体的数量,比如在实验室中用显微镜数细胞数量。
这种方法适用于样本数量较小的情况。
间接计数是指通过测量生物体的某种指标来推断其数量,比如通过测量植被的覆盖度来估算种群密度。
这种方法适用于样本数量较大的情况。
抽样调查是指通过随机采样的方式来估算总体数量,比如在生态学调查中使用网格抽样法。
这种方法适用于大面积的生态系统调查。
2. 生物计数的应用生物计数在生态学、进化论和环境保护中都有重要应用。
在生态学中,我们可以通过生物计数来了解不同物种的数量分布和种群密度,从而研究它们在生态系统中的相互关系。
在进化论中,我们可以通过生物计数来了解不同物种的数量变化和分布范围,从而研究它们的进化历程和适应环境的能力。
在环境保护中,我们可以通过生物计数来监测濒危物种的数量变化和生物多样性的丰富程度,从而制定相应的保护措施。
3. 生物计数的局限性尽管生物计数是一种重要的方法,但它也有一定的局限性。
首先,生物计数可能受到环境因素的影响,比如气候变化和人类活动。
这些因素可能导致生物体的数量变化,从而影响我们的计数结果。
其次,生物计数可能受到观测方法的限制,比如在野外调查中可能存在样本不均匀的问题,从而导致我们的估算结果不准确。
最后,生物计数可能受到生物体自身特性的影响,比如某些物种可能比较难以观测或容易被忽略,从而导致我们的计数结果有偏差。
综上所述,生物计数是一种重要的方法,它可以帮助我们了解生物体的数量分布、种群密度以及生态系统的生物多样性。
但是,在进行生物计数时,我们需要考虑到一定的局限性,从而保证我们的计数结果准确可靠。
高二生物个体数学知识点

高二生物个体数学知识点1. 个体数量的测定方法生物学研究中,我们常常需要确定某个区域或群体中的个体数量。
为了做到准确和可重复性,科学家们发展出了多种个体数量测定的方法。
其中常见的方法包括:1.1. 直接计数法:一些较小且易观察的个体,如细菌、线虫等,可以通过直接观察和计数来确定个体数量。
这种方法简单直接,但通常只适用于个体数量较少的情况。
1.2. 样方法:将研究区域划分为多个等大的小区域,随机选择若干个小区域进行个体数量的测定,然后计算平均值。
这种方法适用于个体较多的情况,可以较好地反映整个区域的个体数量。
1.3. 标记-重捕法:适用于个体活动范围较大的情况。
首先在个体身上打上独特的标记,然后将其释放回原始环境。
隔一段时间后,再次捕获个体并记录标记情况,根据标记的比例来估计整个个体群体的数量。
2. 个体数量与种群密度个体数量是衡量一个生物群体的重要指标,而种群密度则是指单位面积或单位体积中的个体数量。
科学家们通过研究个体数量与种群密度之间的关系,可以更好地理解生物群体的生态特征和动态变化。
2.1. 稀疏种群:个体数量相对较少,种群密度较低的群体称为稀疏种群。
这种种群往往具有较大的活动范围和个体间的距离,相互之间的竞争较小。
2.2. 密集种群:个体数量相对较多,种群密度较高的群体称为密集种群。
这种种群中个体之间的竞争较为激烈,资源利用更为紧张。
3. 种群增长模式种群数量的增长模式是生物学中的一个重要研究方向。
通过研究个体数量随时间的变化规律,科学家们可以揭示种群的增长特点和影响因素。
3.1. J型增长模式:J型增长曲线呈指数增长,即种群数量随时间的推移呈现出迅速增长的趋势。
这种增长模式常见于种群资源充足、环境条件良好的情况。
3.2. S型增长模式:S型增长曲线呈对数增长,即种群数量随时间的推移逐渐趋于稳定。
这种增长模式常见于种群数量接近环境承载力、资源有限的情况。
4. 种群的数量调控为了维持一个相对稳定的种群数量,自然界中存在着多种数量调控机制。
物理实验八步法数据处理具体内容

物理实验八步法数据处理具体内容在实验过程中,通常要得出一些实验数据,要确定各物理量之间的关系,就要对实验中得出的数据进行处理,从而得出物理规律、数据处理的方法有多种,一般情况下,可有以下一些处理数据的方法、1、平均值法取算术平均值是为减小偶然误差而常用的一种数据处理方法。
通常在同样的测量条件下,对于某一物理量进行多次测量的结果不会完全一样,用多次测量的算术平均值作为测量结果,实验误差最小。
2、公式法根据测定的两组或多组数据代入公式求解的方法。
公式法的应用要领是充分利用数据取平均值或利用差值较大的两组数据。
3、列表法实验中将数据列成表格,可以简明地显示出有关物理量之间的关系,便于检查测量结果和运算是否合理。
有助于发现和分析问题,列表法还常是图象法的基础。
列表时应注意表格要直观地反映有关物理量之间的关系,便于分析:表格要清楚地反映测量的次数,测得的物理量的名称及单位:表中所列数据要准确地反映测量值的有效数字4、图解法根据实验数据通过列表、描图、求斜率和坐标轴上的截距,表示所求未知量。
选取适当的自变量,通过作图可以找到或反映物理量之间的变化关系,并找出其中的规律,确定对应量的函数关系。
作图法是最常用的实验数据处理方法之一。
5、根据测量的要求选定坐标轴,一般以横轴为自变量,纵轴为因变量。
坐标轴要标明所代表的物理量的名称及单位。
6、坐标轴标度的选择应合适,使测量数据能在坐标轴上得到准确的反映。
为避免图纸上出现大片空白,坐标原点可以是零,也可以不是零。
坐标轴的分度的估读数,应与测量值的估读数(即有效数字的末位)相对应。
7、确立数学模型,对于只研究两个变量相互关系的实验,其数学模型可借助于图解法来确定,首先根据实验数据在直角坐标系中作出相应图线,看其图线是否是直线、反比关系曲线、幂函数曲线、指数曲线等,确定出以上几种情况的数学模型分别为:y=a+bx,y=a+b/x,y=ax",y=aebx。
8、改为直线方程,为方便地求出曲线关系方程的未定系数,在精度要求不太高的情况下,在确定的数学模型的基础上,变换成为直线方程,并根据实验数据在坐标系中作出对应的直线图形。
计数法

每一个大方格边长为1mm, 每一个大方格边长为1mm,则每一大方格的 1mm 面积为1mm 盖上盖玻片后, 面积为1mm2,盖上盖玻片后,载玻片与盖玻片 之间的高度为0.1mm, 之间的高度为0.1mm,所以计数室的容积为 0.1mm 0.1mm3。 在计数时,通常数五个中方格的总菌数, 在计数时,通常数五个中方格的总菌数, 然后求得每个中方格的平均值,再乘上16或25, 然后求得每个中方格的平均值,再乘上16或25, 16 就得出一个大方格中的总菌数, 就得出一个大方格中的总菌数,然后再换算成 1ml菌液中的总菌数。 1ml菌液中的总菌数。 菌液中的总菌数
实验材料
菌种:酿酒酵母、 菌种:酿酒酵母、紫球藻 仪器或其他用具:血球计数板、显微镜、 仪器或其他用具:血球计数板、显微镜、盖 玻片、 玻片、毛细滴管
方法与步骤
1.菌悬液制备 1.菌悬液制备 2.镜检计数室 2.镜检计数室 3.加样品 3.加样品 取酵母菌液,摇匀。 取酵母菌液,摇匀。用滴管由盖玻片边 缘滴一小滴, 缘滴一小滴,让菌液沿缝隙靠毛细渗透作用 自动进入计数室,计数室内不得有气泡。 自动进入计数室,计数室内不得有气泡。
(5)同一个样品,要计数两个计数室,得出 同一个样品,要计数两个计数室, 平均数来进行计算。 平均数来进行计算。 清洗时,切勿用硬物洗刷, (6)清洗时,切勿用硬物洗刷,洗完后要自 行晾干或吹风机吹干。 行晾干或吹风机吹干。
显微镜直接计数法
目的要求 基本原理 实验材料 方法与步骤 注意事项
目的要求
了解血球计数板的构造 明确显微直接计数法的原理 掌握显微直接计数的方法
基本原理
测定微生物细胞数量的常用方法 间接计数法——稀释平板计数法 (1)间接计数法 稀释平板计数法 其原理:根据微生物在固体培养基上所形成的 其原理: 一个菌落是由一个单细胞繁殖而成的现象进行的, 一个菌落是由一个单细胞繁殖而成的现象进行的, 也就是说一个菌落即代表一个单细胞。 也就是说一个菌落即代表一个单细胞。 计数时,先将待测样品作一系列稀释, 计数时,先将待测样品作一系列稀释,再取一 定量的稀释菌液接种到培养皿中, 定量的稀释菌液接种到培养皿中,使其均匀分布于 平皿中的培养基内,经培养后, 平皿中的培养基内,经培养后,由单个细胞生长繁 殖形成菌落,统计菌落数目, 殖形成菌落,统计菌落数目,即可换算出样品中的 含菌数。 含菌数。
生物学科的直接计数法和间接计数法

⽣物学科的直接计数法和间接计数法显微镜直接计数法和稀释平板计数法是测定微⽣物数量的常⽤⽅法。
直接计数法中常⽤的是显微镜直接计数法,这种⽅法是先将待测样品制成悬液,然后取⼀定量的悬液放在显微镜下进⾏计数(图1- 3-1)。
根据在显微镜下观察到的微⽣物数⽬来计算出单位体积内的微⽣物总数。
直接计数法所需设备简单,可迅速得到结果,⽽且在计数的同时能观察到所研究微⽣物的形态特征,其缺点是难以计数微⼩的细菌。
这种⽅法⼀般适⽤于纯培养悬浮液中各种单细胞菌体的计数。
间接计数法最常⽤的是稀释平板计数法,它是根据微⽣物的培养特征⽽设计的计数⽅法。
这种⽅法在样品中含菌数较少的情形下,也可以完成计数。
应⽤稀释平板计数法计数时,需要将待测样品配制成均匀的系列稀释液,尽量使样品中的微⽣物细胞分散开。
再取⼀定稀释度、⼀定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内;或是将⼀定量的稀释液,与溶化后冷却⾄ 45左右的琼脂培养基混合,倾⼊⽆菌培养⽫中,摇匀、静置待凝。
经过培养后,就由单个微⽣物⽣长繁殖形成菌落,这样的⼀个菌落就代表着⼀个微⽣物个体。
统计培养基中出现的菌落数,即可推算出检测样品中的活菌数。
FOR EXAMPLE:] ⼟壤中好⽓性细菌的计数⼟壤中⽣活的微⽣物种类和数量是极其丰富的,这些数量众多的微⽣物对提⾼⼟壤肥⼒有重要作⽤。
因此,测定⼟壤中的含菌量可以作为判定⼟壤肥⼒的⼀个重要指标。
材料器具⼟壤样品;⽜⾁膏蛋⽩胨琼脂培养基(附录⼆)、⽆菌⽔;培养⽫、移液管、天平、锥形瓶、试管、酒精灯、恒温培养箱、摇床等。
活动程序 1.制备⼟壤稀释液取⼟壤表层5~10 cm 处的⼟样。
准确称取1 g ⼟样,放⼊盛有 99 mL ⽆菌⽔的锥形瓶(250 mL,放有⼩玻璃珠)中,⽤⼿或摇床振荡 20 min,即制成102 倍的稀释液。
⽤1 mL⽆菌移液管,吸取10 2倍稀释液0.5 mL,移⼊装有4.5 mL ⽆菌⽔的试管中,配制成103 倍稀释液。
实验八微生物数量的测定――――显微镜直接计数法

实验八微生物数量的测定――――显微镜直接计数法一目的要求了解血球计数板的结构,学习并掌握血球计数板计数微生物数量的技术,包括样品的点样、菌数计数的方法与计算;二实验原理镜检计数法适用于各种含单细胞菌体的纯培养悬浮液,如有杂菌或杂质常不易分辨。
菌体较大的酵母菌或霉菌泡子可采用血球计数板;一般细菌则采用彼得罗夫·霍泽(Petroff Hausser)细菌计数板。
两种计数板的原理和部件相同,只是细菌计数板较薄,可以使用油镜观察。
而血球计数板较厚,不能使用油镜,故细菌不易看清。
血球计数板是一块特制的厚载玻片,载玻片上有4条槽而构成3个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各有一个方格网(图Ⅳ-2)。
每个方格网共分9大格,其中间的一大格(又称为计数室)常被用作微生物的计数。
计数室的刻度有两种:一种是大方格分为16个中方格,而每个中方格又分成25个小方格;另一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格。
但是不管计数室是哪一种构造,它们都有一个共同特点,即每个大方格都由400个小方格组成(图5)。
每个大方格边长为1mm,则每一大方格的面积为1mm2,每个小方格的面积为1/400mm2,盖上盖玻片后,盖玻片与计数室底部之间的高度为0.1mm,所以每个计数室(大方格)的体积为0.1mm3,每个小方格的体积为l/4000mm3。
使用血球计数板直接计数时,先要测定每个小方格(或中方格)中微生物的数量,再换算成每毫升菌液(或每克样品)中微生物细胞的数量。
图Ⅳ-2 血球计数板的构造a.平面图(中间平台分为两半,各刻有一个方格网)b.侧面图(中间平台与盖玻片之间有高度为0.1毫米的间隙)图Ⅳ-3 血球计数板计数网的分区和分格三实验材料1、菌种:酿酒酵母;2、血球计数板,显微镜,盖玻片,无菌毛细滴管;3、菌种:大肠杆菌菌悬液。
4、1ml无菌吸管,无菌平皿,无菌水,试管,恒温培养箱牛肉膏蛋白胨培养基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Experiment8間接計數法
實驗目的:
以塗抹或倒碟法置於培養基內培養24小時,再觀察紀錄菌落的生長數目,來計算原水樣中細菌總數。
實驗原理:
將一定的體積的待測水漾經過適量的稀釋,以塗抹或倒碟(注入培養)於平板計數培養基培養24小時,由於一個微生物細胞可以長成一個菌落,在稀釋倍數已知的情況下,計算培養基上生成的菌落數目,便可以知道水樣中存活細菌的總數。
操作步驟:
1取配好的酵母菌0.5g+培養液50ml(溫度不可過高),取1ml進行實驗。
2將10被稀釋好的菌液,進行吸光值檢測。
3倒碟法
(A)取3.5克的NB培養基與100ml去離子水混合配置成培養基,放入高溫高壓滅菌府進行滅菌,待冷卻培養基(非凝固)進行倒碟。
(B)倒碟時,由稀釋菌液取0.1ml,充分混合後,倒入空的培養皿等待凝固,放置。
於37O C培養箱培養,隔天觀察並且記錄。
4塗碟法
(1)將菌液先進行稀釋(連續10被稀釋成10-110-210-310-410-5)取0.1ml~0.2ml,滴入已準備好的培養皿正中央位置。
(2)三角彎棒浸於酒精溶液中在取出,以燃燒法將酒精燃盡後,溫度降低才可進進行塗碟(達滅菌又不殺死酵母菌的效果)。
(3)塗碟時,用三角彎棒將菌液均勻塗抹於培養基上。
(4)放於37度c培養箱培養,隔日觀察及計算菌數一般以30-300個菌為主。
器材
1.錐形瓶
2.奇異筆
3.三角彎棒
4.吸球
5.定量玻璃管
6.稱藥勺
7.酒精燈
8.玻棒
9.隔熱手套 10.秤藥紙 11.燒杯 12.試管架
2-2儀器
1.電子天平
2.高溫高壓滅菌釜
3.微風恆溫培養箱
4.分光光度計
實驗結果:
10-1 10-2 10-3 菌落約600(個)菌落約400(個)菌落約311(個)
10-4
菌落約250(個)
10-1 10-2 10-3 菌落約500(個)菌落約420(個)菌落約294(個)
實驗討論:
由於10倍稀釋,可以得知吸光值越高,菌數越多,培養出的菌落數也相對越多,倒碟法和塗碟法中,10-1與10-2吸光值相差很大,可想而知粗略大概的數值可能比實際的更多,在倒碟法與塗碟法中我們發現,倒碟法的菌落數比較龐大,可能是人為誤差也可能因為倒碟法可以使菌落均勻落在培養基上,塗碟法取0.1ml可能因為不均勻導致菌數數量減少或增多,照片顯示我們倒碟的培養基有氣泡存在,是因為我們疏忽培養基凝固的溫度,導致倒碟時不容易倒出,容易造成實驗的誤差。
問題與討論:
1.說明10 ml之菌液如何配置成10^-2倍與10^-3倍之稀釋菌液?
取1 ml的酵母菌加入 9 ml的二段水製成10-1稀釋菌液,再從10-1取1 ml的菌液 + 9 ml的二段水製成10-2稀釋菌液,最後從10-2取1 ml 的菌液 + 9 ml的二段水就製成10-3稀釋菌液。
2.實驗所得之總生菌數是否真正代表樣品中的微生物數量?為什麼?
否,因為可能在稀釋過程中不會成正比造成實驗結果會有誤差,人為的實驗操作也可能使菌不會完全成長,只能計算出菌液裡大概的菌,肉眼無法正確計算出菌數。
若菌落數約在30~300之間,則推算回去就可得知樣品總數量。
3.為什麼進行平板計數法時,我們以0.2 ml菌液進行塗抹,而不直接採1 ml 進行試驗?
吸取太多菌液會造成培養基長出太多菌落,會使得我們觀察時難以觀察,無法計算菌數,也可能因為菌液態多,進入培養箱倒放時可能因漏出使儀器或其他組別實驗有所汙染,故我們適量菌液塗抹是最理想狀態。
4..平板計數法進行計數時,其計數原則為何?
答:菌落數要在30~300之間
心得:
4980N006 楊儀佳
做實驗不外乎就是體驗其中,然後發現其中的奧妙,當發現問題,心想那a阿ㄋㄟ,這時就該檢討犯下的錯誤導致實驗上誤差,正所謂差之毫釐,失之千里,一開始就要養成良好的習慣,把實驗誤差降到最低,把自己觀察力提升到最高。
980N034 蕭于琳
這次的實驗做的比往常的實驗久了一點,大不份的時間還是樣再等待...在等待,但其中也發生了不少趣事,例如:我們大家在分培養液時,大家都忘了他很快就會凝固了,突然間...多虧學長想到,哈哈,一聲令下大家急忙的分配每個培養液,雖然底部有少許結凍了,但也多虧學長才安全得救,隔天看到我們這次的實驗結果真是嚇了一跳,因為菌數真是史上無敵的多,這也是大家這次努力下得到的結果,完美囉
4970N076 楊舜斌
這次實驗步驟其實跟前面差不多,可是這次的結果似乎有感受到其他的汙染,每個的菌落數都多的很誇張,這次可能要多討論其中的錯誤。
4980N092 黃硯翎
這次的實驗因為高溫高壓完又加入菌液,放的太冷加上動作太慢,在試管時就有點凝固了,差點就倒不出來,所以這次的實驗應該是沒成功。
下次如果還有做到要高溫高壓的實驗一定要更小心。
4980N006 楊儀佳100%
980N034 蕭于琳100%
4970N076 楊舜斌100%
4980N092 黃硯翎100%。
