化工原理第六章第二节讲稿
合集下载
化工原理第六章蒸馏

恒摩尔气流 恒摩尔液流
注意:V不一定等于V′,L不一定等于L′
溶液中两组分的摩尔汽化热相等,即rA rB; 因汽液两相温度不同而传递的热量可忽略; 假定 精馏塔保温良好,其热量损失可以忽略。
三、进料热状态参数q
1.进料热状况的定性分析:
A — — 过冷液体;
B — — 饱和液体;
加料板及其以下 ——提馏段
加料板以上 ——精馏段
间歇精馏:
——只有精馏段, 没有提馏段
第三节 双组分连续精馏的计算与分析
设计型计算: 操作型计算:
一、全塔物料衡算
F、D、W — kmol( A B) h
xF、xD、xW — kmolA kmol( A B) 总物料:F D W
Ln1 温度 易挥发汽化多
Vn yn
气相
液相
yn yn1 xn xn1
Ln1 x n1
Ln xn
n-1 n n+1
塔顶:纯A 塔釜:纯B
Vn1 y n 1
yn+1 tn+1 tn tn-1 xn
G O P
yn
t/℃
xn-1
0
x或y
1.0
加料位置 ——与原料液组成和温度相近的板上进料
240 101.33
pA
pB
0
,kPa ,kPa
101.33 116.9 135.5 155.7 179.2 204.2 40.0 46.0 54.0 63.3 74.3 86.0
0
温度℃
80.1
85
90
95
100
105
110.6 240
pA
0
,kPa
《化工原理教学资料》第六章蒸馏(郭锴)

m 顶 釜
式中: α 顶: 塔顶的相对挥发度 α 釜: 塔釜的相对挥发度
4.α 的物理意义 气相中两组分组成之比是液相中两组分组成之 比的倍数;
α 标志着分离的难易程度;
若α>1,则 y>x ,可用蒸馏方法分离,且α愈大,
平衡线愈远离对角线,物系愈易分离;
α =1, 无法用普通蒸馏方法分离。
6.3 简单蒸馏和平衡蒸馏
一 、 简单蒸馏 1. 装置 2. 特点: • 间歇非定态 • 一次进料
• xD, xW不是一对平衡 组成
• 适合于大的组分 • 对A部分提出, 粗分
二. 平衡蒸馏(又叫闪蒸) 1. 流程 2. 特点: •一次进料,粗分 •xD, xW是一对平 衡组成 F xF
D xD
1、收率低;
2、设备重复量大,设备投资大; 3、能耗大,过程有相变。 问题:工业上如何实现?
2. 有回流的多次部分汽化和多次部分冷凝
6.4.2 连续精馏装置流程
进料板:原料液进入的 那层塔板
精馏段:进料板以上的 塔段 提馏段:进料板以下 (包括进料板) 的塔段
6.4.3 塔板的作用
特点:
•塔板提供了汽液 分离的场所; •每一块塔板是一 个混合分离器; •足够多的板数可 使各组分较完全分 离。
A pA xA 一般物系: B pB xB
yA xA 理想气体: yB xB
对于二元物系:yB=1-yA xB=1-xA 则
y 1 y x 1 x
即
x y ——相平衡方程 1 ( 1) x
理想溶液:
p p
o A o xW
6.4 精馏原理
6.4.1 多次部分汽化、部分冷凝
化工原理(第二版)第六章-

管道阻力引起的温度差损失 ,其值一般取为1℃。
第三节 多效蒸发
一、多效蒸发的操作原理
由蒸发器的热量恒算可知,在单效蒸发器中每蒸发1㎏的水需要 消耗1㎏多的生蒸汽。在大规模的工业生产中,水分蒸发量很大,需 要消耗大量的生蒸汽。如果能将二次蒸汽用作另一蒸发器的加热蒸汽, 则可减少生蒸汽消耗量。由于二次蒸汽的压力和温度低于生蒸汽的压 力和温度,因此,二次蒸汽作为加热蒸汽的条件是:该蒸发器的操作 压力和溶液沸点应低于前一蒸发器。采用抽真空的方法可以很方便地 降低蒸发器的操作压力和溶液的沸点。每一个蒸发器称为一效,这样, 在第一效蒸发器中通入生蒸汽,产生的二次蒸汽引入第二效蒸发器, 第 二效的二次蒸汽再引入第三效蒸发器,以此类推,末效蒸发器的二 次 蒸汽通入冷凝器冷凝,冷凝器后接真空装置对系统抽真空。于是, 从第 一效到最末效,蒸发器的操作压力和溶液的沸点依次降低,因此 可以 引入前效的二次蒸汽作为后效的加热介质,即后效的加热室成为 前效 二次蒸汽的冷凝器,仅第一效需要消耗生蒸汽,这就是多效蒸发
降。
3
真空蒸发系统要求有造成减压的装置,使系统的
投资费和操作费提高。
第二节 单效蒸发
F,w0,t0,h0
D, T, H
W, T’, H’
蒸发室
加 热 室
(F-W),w1, t1, h1
D, T, hw
图6-2 单效蒸发示意图
第二节 单效蒸发
二、单效蒸发的计算
单效蒸发计算的主要内容有:水分蒸发量;加热蒸气 消耗量;蒸发器的传热面积。 计算的依据是:物料衡算、热量衡算和传热速率方程。
(6-2)
第二节 单效蒸发
式中
Q——蒸发器的热负荷或传热量,kJ/h ; D——加热蒸气消耗量,kg/h; Cp0——原料液比热容,kJ/(㎏·℃); t0——原料液的温度,℃;
第三节 多效蒸发
一、多效蒸发的操作原理
由蒸发器的热量恒算可知,在单效蒸发器中每蒸发1㎏的水需要 消耗1㎏多的生蒸汽。在大规模的工业生产中,水分蒸发量很大,需 要消耗大量的生蒸汽。如果能将二次蒸汽用作另一蒸发器的加热蒸汽, 则可减少生蒸汽消耗量。由于二次蒸汽的压力和温度低于生蒸汽的压 力和温度,因此,二次蒸汽作为加热蒸汽的条件是:该蒸发器的操作 压力和溶液沸点应低于前一蒸发器。采用抽真空的方法可以很方便地 降低蒸发器的操作压力和溶液的沸点。每一个蒸发器称为一效,这样, 在第一效蒸发器中通入生蒸汽,产生的二次蒸汽引入第二效蒸发器, 第 二效的二次蒸汽再引入第三效蒸发器,以此类推,末效蒸发器的二 次 蒸汽通入冷凝器冷凝,冷凝器后接真空装置对系统抽真空。于是, 从第 一效到最末效,蒸发器的操作压力和溶液的沸点依次降低,因此 可以 引入前效的二次蒸汽作为后效的加热介质,即后效的加热室成为 前效 二次蒸汽的冷凝器,仅第一效需要消耗生蒸汽,这就是多效蒸发
降。
3
真空蒸发系统要求有造成减压的装置,使系统的
投资费和操作费提高。
第二节 单效蒸发
F,w0,t0,h0
D, T, H
W, T’, H’
蒸发室
加 热 室
(F-W),w1, t1, h1
D, T, hw
图6-2 单效蒸发示意图
第二节 单效蒸发
二、单效蒸发的计算
单效蒸发计算的主要内容有:水分蒸发量;加热蒸气 消耗量;蒸发器的传热面积。 计算的依据是:物料衡算、热量衡算和传热速率方程。
(6-2)
第二节 单效蒸发
式中
Q——蒸发器的热负荷或传热量,kJ/h ; D——加热蒸气消耗量,kg/h; Cp0——原料液比热容,kJ/(㎏·℃); t0——原料液的温度,℃;
化工原理 第六章 蒸发

件
返回
前页
后页
主题
西
安 1、溶液沸点升高――杜林规则
交 大
’:与溶液的种类、浓度、蒸汽压
化
力有关
工 (1)手册上可以查到常压下的溶液沸点
原 (2)杜林规则:(压强影响)
理
电 子 课
tA tw
t
0 A
tw0
K
件
返回
前页
后页
主题
西
安 两种不同压力下溶液的沸点差与另 交 一种标准液体在相应压力下的沸点差的 大 比值为常数。
西
安
交
大 化
化工原理 第六章 蒸发
工
原
理
电
子
课
件
返回
前页
后页
主题
西
第一节 概 述
安
交 一、蒸发的概念:
大 化 工
挥发性溶剂,不挥发溶质――加热、沸腾 -→ 溶剂部分汽化;溶液浓缩
原
热量供给→汽化→热量衡算 传热
理特
速率
电 子
点 蒸汽移出→浓缩→物料衡算
方程
课
沸腾现象 溶液→沸点升高
件
返回
前页
后页
任务:(1)计算水分蒸发量(二次蒸汽量)
W kg/h
子
(2) 加热蒸汽消耗量D kg/h
课
(3)蒸发器传热面积S
件
返回
前页
后页
主题
西
安
交
一、单效蒸发器的计算
大
化
物料衡算
工
热量衡算
原
理
传热速率方程
电
沸点升高关系式
子
课
件
化工原理讲稿8(第六章)(天大版).

九、塔高与塔径的计算 (一)塔板效率
指反映实际塔板的气液两相传质的完善程度; 表示方法有总板效率、单板效率等; 1.总板效率(又称全塔效率)ET 指达到指定分离效果所需理论板层数与实际塔板 层数的比值;
ET
NT Np
100%
理论板数 实际板数
Np
NT ET
NT:不包括塔釜再沸器,再沸器相当一块理论板;
问: (1)此时产品组成将有何变化? (2)若维持xD不变,可采用哪些 措施,并比较这些方法的优缺点?
十二、特殊精馏 1.恒沸精馏
原理:在混合液中加入第三组分(称为挟带剂) 形成新的最低恒沸物;
2.萃取精馏 原理:向混合液中加入溶剂(又称萃取剂),萃取剂
不与原料液中任何组分形成恒沸物;
P73页 习题15、16;
xF 对xD, xW 的影响
b. 加料板位置上移
结论:xD , xW
加料板位置对xD, xW 的影响
c. R 结论:xD , xW
R 对xD, xW 的影响
d. q , R 不变, D不变, V’ 结论:xD , xW
q 对xD, xW 的影响
十一、 精馏装置的热量恒算
xn1 xn xn1 f '( yn )
xn1 xn
xn1 f '( xn1 )
习题16
1.y1 xD
F L'
2.
D
V
'
L
'
x1
V
'
yW
WxW
3.yW
1
xW ( 1)xW
指反映实际塔板的气液两相传质的完善程度; 表示方法有总板效率、单板效率等; 1.总板效率(又称全塔效率)ET 指达到指定分离效果所需理论板层数与实际塔板 层数的比值;
ET
NT Np
100%
理论板数 实际板数
Np
NT ET
NT:不包括塔釜再沸器,再沸器相当一块理论板;
问: (1)此时产品组成将有何变化? (2)若维持xD不变,可采用哪些 措施,并比较这些方法的优缺点?
十二、特殊精馏 1.恒沸精馏
原理:在混合液中加入第三组分(称为挟带剂) 形成新的最低恒沸物;
2.萃取精馏 原理:向混合液中加入溶剂(又称萃取剂),萃取剂
不与原料液中任何组分形成恒沸物;
P73页 习题15、16;
xF 对xD, xW 的影响
b. 加料板位置上移
结论:xD , xW
加料板位置对xD, xW 的影响
c. R 结论:xD , xW
R 对xD, xW 的影响
d. q , R 不变, D不变, V’ 结论:xD , xW
q 对xD, xW 的影响
十一、 精馏装置的热量恒算
xn1 xn xn1 f '( yn )
xn1 xn
xn1 f '( xn1 )
习题16
1.y1 xD
F L'
2.
D
V
'
L
'
x1
V
'
yW
WxW
3.yW
1
xW ( 1)xW
化工原理-6章蒸馏

1 yA 1 xA
y x 1 ( 1)x
——相平衡方程
当 α为已知时,可用相对挥发度表示了气液相平衡关系。
当 1 当 1
y=x, 即相平衡时气相的组成与液相的组成相同, 不能用蒸馏方法分离。
则y>x,α愈大,y比x大的愈多,组分A和B愈易分离。
三、双组分理想溶液的气液平衡相图
双组分理想溶液的汽液平衡关系用相图表示比较直观、 清晰,而且影响蒸馏的因素可在相图上直接反映出来。蒸馏 中常用的相图为恒压下的温度-组成( t-x-y )图和气相-液 相组成( x-y )图。
当生产任务要求将一定数量和组成的原料分离成指定组成 的产品时,精馏塔计算的内容有:出液和塔釜残液的流量、塔 板数、进料口位置、塔高、塔径等。
6.4.1 全塔物料衡算
1.全塔物料衡算
单位时间为基准
总物料衡算: qn,F=qn,D+qn,W 易挥发组分物料衡算:
qn,FxF=qn,DxD+qn,WxW qn,F、qn,D、qn,W——流量,kmol/h
二、蒸馏的分类
1、按蒸馏方法:简单蒸馏、平衡蒸馏(闪蒸)、精馏、特殊精馏。 2、按操作压力:常压;减压;加压。 3、按原料液组分数:双组分蒸馏和多组分蒸馏 4、按操作方式:间歇蒸馏和连续蒸馏。
三、蒸馏操作的特点
优点:* 适用面广,液体混合物和气体混合物均可 * 操作流程较简单,无需其他外加介质
缺点:* 能耗大
一、利用饱和蒸气压计算气液平衡关系
法国物理学家拉乌尔在1887年研究含有非挥发性溶质的 稀溶液的行为时发现的,可表述为:“在某一温度下,稀溶 液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数”。
PA PA0 xA ——拉乌尔定律
pA0——纯组分A在溶液温度下的饱和蒸气压,Pa; xA——溶液中组分A的摩尔分数;
y x 1 ( 1)x
——相平衡方程
当 α为已知时,可用相对挥发度表示了气液相平衡关系。
当 1 当 1
y=x, 即相平衡时气相的组成与液相的组成相同, 不能用蒸馏方法分离。
则y>x,α愈大,y比x大的愈多,组分A和B愈易分离。
三、双组分理想溶液的气液平衡相图
双组分理想溶液的汽液平衡关系用相图表示比较直观、 清晰,而且影响蒸馏的因素可在相图上直接反映出来。蒸馏 中常用的相图为恒压下的温度-组成( t-x-y )图和气相-液 相组成( x-y )图。
当生产任务要求将一定数量和组成的原料分离成指定组成 的产品时,精馏塔计算的内容有:出液和塔釜残液的流量、塔 板数、进料口位置、塔高、塔径等。
6.4.1 全塔物料衡算
1.全塔物料衡算
单位时间为基准
总物料衡算: qn,F=qn,D+qn,W 易挥发组分物料衡算:
qn,FxF=qn,DxD+qn,WxW qn,F、qn,D、qn,W——流量,kmol/h
二、蒸馏的分类
1、按蒸馏方法:简单蒸馏、平衡蒸馏(闪蒸)、精馏、特殊精馏。 2、按操作压力:常压;减压;加压。 3、按原料液组分数:双组分蒸馏和多组分蒸馏 4、按操作方式:间歇蒸馏和连续蒸馏。
三、蒸馏操作的特点
优点:* 适用面广,液体混合物和气体混合物均可 * 操作流程较简单,无需其他外加介质
缺点:* 能耗大
一、利用饱和蒸气压计算气液平衡关系
法国物理学家拉乌尔在1887年研究含有非挥发性溶质的 稀溶液的行为时发现的,可表述为:“在某一温度下,稀溶 液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数”。
PA PA0 xA ——拉乌尔定律
pA0——纯组分A在溶液温度下的饱和蒸气压,Pa; xA——溶液中组分A的摩尔分数;
化工原理 第六章 吸收
由 y * mx得,
Y* mX 1 Y * 1 X
*
mX Y 1 (1 m)X
当溶液浓度很低时,X≈0, 分母约等于1. 上式简化为:
Y mX
*
亨利定律的几种表达形式也可改写为
P * x , c HP E y Y * ℃ 下 , 测 得 氨 在 水 中 的 平 衡 数 据 为 : 0.5gNH3/100gH2O浓度为的稀氨水上方的平衡分压为400Pa, 在该浓度范围下相平衡关系可用亨利定律表示,试求亨利系
——逆流吸收塔操作线方程
在m—n截面与塔顶截面之间作组分A的衡算
VY LX 2 VY2 LX
L L Y X (Y2 X 2 ) V V
——逆流吸收塔操作线方程
表明 : 塔内任一截面的气相浓度Y与液相浓度X之间成直线 关系,直线的斜率为L/V。
吸收操作线总是位于平衡线的上方,
s
EM s
1000 7.32 104 kmol / m3 Pa 7.59 10 4 18
E 7.59 10 4 m 3 0.749 P 101.33 10
三、用气液平衡关系分析吸收过程
1、判断过程的方向
例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为 :
L L Y1 X 1 Y2 X 2 V V
吸收率 A 混合气中溶质A 被吸收的百分率
Y2 Y1 (1 A )
2、吸收塔的操作线方程式与操作线
在 m—n截面与塔底截面之间作组分A的衡算
VY LX1 VY1 LX
L L Y X (Y1 X 1 ) V V
操作线位于平衡线下方,则应进行脱吸过程。
并流吸收塔的操作线:
化工原理讲稿8(第六章)(天大版)

对 全 回 流 操 作 : y n +1 = x n、 y n = x n −1 y n − y n +1 x n −1 − x n E mV = y * − y = f ( x ) − x n n +1 n n 则: x n −1 − x n E = x n −1 − x n = x n −1 − x n = mL x n −1 − x n * x n −1 − f '( y n ) x n −1 − f '( x n −1 )
习题16 习题
1. y1 = xD F = L ' ⇒ L ' x1 = V ' yW + WxW 2. D = V ' α xW 3. yW = 1 + (α − 1) xW 4.EmV y1 − yW = y1 * − yW
设: F = 1kmol / h Dx D x F − xW x D 0.2 − xW 0.28 η D = 0.8 = = = ⇒ xW = 0.0857 Fx F x D − xW x F 0.28 − xW 0.2 D = 0.57 kmol / h、 W = 0.43kmol / h F = L ' F W ⇒ L ' x1 = V ' y W + Wx W ⇒ y W = x1 − xW D D D = V ' 1 0.43 ⇒ 0.206 = x1 − × 0.094 ⇒ x1 = 0.158 0.57 0.57 y1 = x D = 0.28 y1 − y W α xW 2.5 × 0.094 = = 0.206 由于: E mV = 其中: yW = y1 * − y W 1 + (α − 1) xW 1 + 1.5 × 0.094 α x1 2.5 × 0.158 = = 0.319 y1 * = 1 + (α − 1) x1 1 + 1.5 × 0.158 0.28 − 0.206 E mV = = 0655 0.319 − 0.206
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016/1/24
2.1.2、亨利定律
1、亨利定律
p Ex
*
E——亨利常数,单位与压强单位一致 。
*1 E值取决于物系的特性及温度;温度T上升,E值增大E值越 大的气体越难溶,即E=f(t. p). t↑E↑溶解度↓难溶.
*2总压不太高,稀溶液时E可视为常数
2016用溶质A的摩尔浓度和气相分压表示的亨利定律
实际组成y和x,在x-y坐标
图中确定状态点,若点在 平衡曲线上方,则发生吸 收过程;若点在平衡曲线 下方,则发生解吸过程。
2016/1/24
2、计算过程的推动力
当气液相的组成均用摩尔分数表示时,吸收的推动力可 表示为:
y y *:以气相组成差表示的吸收推动力;
x * x:以液相组成差表示的吸收推动力。
H
s
EM s
1000 4 3 7 . 32 10 kmol / m Pa 4 7.59 10 18
E 7.59 10 4 m 3 0.749 P 101.33 10
2016/1/24
2.1.3.吸收剂的选择
1.溶解度 2.选择性 对溶质组分有较大的溶解度 对溶质组分有良好的选择性, 即对其它组分基本不吸收或吸收甚微, 3.挥发性 应不易挥发 4.粘性 粘度要低 5.其它 无毒、无腐蚀性、不易燃烧、不发泡、 价廉易得,并具有化学稳定性等要求。
2016/1/24
1000kg/m3)
解:
* p 由亨利定律表达式知:E x
0.5 / 17 x 0.00527 0.5 / 17 100 / 18
2016/1/24
∴亨利系数为 E
p 400 7.59 10 4 Pa x 0.00527 400 p * * 0.00395 又 y mx,而 y 5 P 1.01 10
∴氨从气相转入液相,发生吸收过程。
若含氨0.02摩尔分数的混合气和 x=0.05的氨水接触,则
x * y / 0.94 0.02 / 0.94 0.021
2016/1/24
x 0.05 x* 0.021
气液相接触时,氨由液相转入气相,发生解吸过程。 此外,用气液相平衡曲线图也可判断两相接触时的传质方向 具体方法: 已知相互接触的气液相的
c p H
*
H——溶解度系数 ,单位:kmol/m3· Pa或kmol/m3· atm。
H是温度的函数,H值随温度升高而减小。
易溶气体H值大,难溶气体H值小。即t↓H↑易溶 ,浓度为 C总kmol / m ,则 设溶液的密度为 kg / m 3
3
H与E的关系
C总
M
M M A x A M S xS
*
P * x , c HP E y Y * * x , X m m
*
2016/1/24
例:在常压及20℃下,测得氨在水中的平衡数据为: 0.5gNH3/100gH2O浓度为的稀氨水上方的平衡分压为400Pa, 在该浓度范围下相平衡关系可用亨利定律表示,试求亨利系
数 E,溶解度系数 H,及相平衡常数 m。(氨水密度可取为
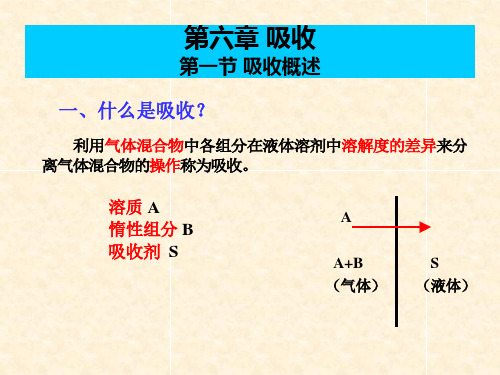
A A+B (气体)
2016/1/24
S (液体)
2.1.4、用气液平衡关系分析吸 收过程
1、判断过程的方向
例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为 :
y* 0.94 x ,若含氨0.094摩尔分数的混合气和组成 x A 0.05
的氨水接触,确定过程的方向。 解: 用相平衡关系确定与实际气相组成 y 0.094 成平衡的液相组成
3、确定过程的极限
所谓过程的极限是指两相充分接触后,各相组成变化的 最大可能性。
2016/1/24
增加塔高 组成为y1的混合气 塔底 x1增加 减少吸收剂用量
极限
组成为: x1 max
x1*
y1 m
塔顶y2降低 极限
组成为y1的混合气
增加塔高 增加吸收剂用量
*
组成为:y
2 min
y2 mx2
m与E的关系: 由分压定律知 : p P y
p y* P
由亨利定律: p * E x
E y x P
即:
2016/1/24
E m P
3)用摩尔比Y和X分别表示气液两相组成的亨利定律
a) 摩尔比定义:
液相中溶质的摩尔数 x X 液相中溶剂的摩尔数 1 x
第2章 吸收
2.1.1、气体的溶解度
2.1.2、亨利定律
2.1.3 吸收剂的选择
气液相平衡
2.1.4、用气液平衡关系分析 吸收过程
2016/1/24
2.1.1、气体的溶解度
1、气体在液体中溶解度的概念
气体在液相中的溶解度 : 气体在液体中的饱和浓度 C
表明一定条件下吸收过程可能达到的极限程度。
* A
2016/1/24
对于稀溶液, M
M S , S
H
C总 E
s
MsE
*
2) 气液相中溶质的摩尔分数表示的亨利定律
y mx
m——相平衡常数 ,是温度和压强的函数。m=f(t. p). 温度升高、总压下降则m值变大, m值越大,表明气体的溶解度越小。即t↑P↓m↑,难溶
2016/1/24
2、溶解度曲线
对于单组分物理吸收,由相律知
f c 2 3 2 2 3
2016/1/24
2016/1/24
2016/1/24
2016/1/24
•吸收剂、温度T、P 一定时,不同物质的溶解度不同。
•温度、溶液的浓度一定时,溶液上方分压越大的物质越难溶。
•对于同一种气体,分压一定时,温度T越高,溶解度越小。 •对于同一种气体,温度T一定时,分压P越大,溶解度越大。 •加压和降温对吸收操作有利。
∴相平衡常数 m 0.00395 0.75 0.00527
c p H
*
0.5 / 17 3 c 0 . 293 kmol / m 0.5 100 1000
2016/1/24
∴溶解度系数为:
0.293 H 7.33 10 4 kmol / m3 Pa 400
或由各系数间的关系求出其它系数
气相中溶质的摩尔数 y Y 气相中惰性组分的摩尔数 1 y
X Y x ,y 1 X 1 Y
由 y * mx得,
2016/1/24
Y* mx * 1 x 1 Y
mx Y 1 (1 m) x
*
当溶液浓度很低时,X≈0, 上式简化为:
Y mX
亨利定律的几种表达形式也可改写为
x y / 0.94 0.1
*
2016/1/24
将其与实际组成比较 : x 0.05 x* 0.1 ∴气液相接触时,氨将从气相转入液相,发生吸收过程。 或者利用相平衡关系确定与实际液相组成成平衡的气相组成
y * 0.94 x 0.94 0.05 0.047
将其与实际组成比较:y 0.094 y * 0.047
