工程热力学与传热学第三章作业参考答案.ppt
工程热力学第三章答案

能量守恒定律,表述为系统能量的变化等于传入和传出系统的热 量与外界对系统所做的功的和。
热力学第二定律
熵增加原理,表述为封闭系统的熵永不减少,总是向着熵增加的 方向发展。
热力过程和热力循环的分类
热力过程
在热力学中,将系统从某一初始状态出发,经过某一过程到达另一终态的过程称为热力过程。根据过程中是否发 生相变,可以将热力过程分为等温过程、等压过程、绝热过程和多变过程等。
热力循环
将热能转换为机械能的循环过程,通常由若干个热力过程组成。常见的热力循环有朗肯循环、布雷顿循环和斯特 林循环等。
02
热力学第一定律的应用
等温过程、绝热过程和多方过程的能量转换关系
80%
等温过程
等温过程中,系统与外界交换的 热量全部用于改变系统的内能, 没有其他形式的能量转换。
100%
绝热过程
工程热力学第三章答案
目
CONTENCT
录
• 热力学基本概念 • 热力学第一定律的应用 • 热力学第二定律的应用 • 热力学第三定律的应用 • 热力学在工程实践中的应用案例
01
热力学基本概念
温度、压力、体积和熵的定义
01
02
03
04
温度
压力
体积
熵
表示物体热度的物理量,是物 体分子热运动的宏观表现。常 用的温度单位有摄氏度(℃)、 华氏度(℉)和开尔文(K)。
05
热力学在工程实践中的应用案例
汽车发动机的热力循环分析
总结词
汽车发动机的热力循环分析是热力学在 工程实践中的重要应用,通过对发动机 工作过程中的热量流动和能量转换进行 分析,优化发动机性能和提高燃油效率 。
VS
传热学第三章答案(精品资料).doc

【最新整理,下载后即可编辑】第三章思考题1. 试说明集中参数法的物理概念及数学处理的特点答:当内外热阻之比趋于零时,影响换热的主要环节是在边界上的换热能力。
而内部由于热阻很小而温度趋于均匀,以至于不需要关心温度在空间的分布,温度只是时间的函数,数学描述上由偏微分方程转化为常微分方程、大大降低了求解难度。
2. 在用热电偶测定气流的非稳态温度场时,怎么才能改善热电偶的温度响应特性?答:要改善热电偶的温度响应特性,即最大限度降低热电偶的时间常数hA cvc ρτ=,形状上要降低体面比,要选择热容小的材料,要强化热电偶表面的对流换热。
3. 试说明”无限大平板”物理概念,并举出一二个可以按无限大平板处理的非稳态导热问题答;所谓“无限大”平板,是指其长宽尺度远大于其厚度,从边缘交换的热量可以忽略不计,当平板两侧换热均匀时,热量只垂直于板面方向流动。
如薄板两侧均匀加热或冷却、炉墙或冷库的保温层导热等情况可以按无限大平板处理。
4.什么叫非稳态导热的正规状态或充分发展阶段?这一阶段在物理过程及数学处理上都有些什么特点?答:非稳态导热过程进行到一定程度,初始温度分布的影响就会消失,虽然各点温度仍随时间变化,但过余温度的比值已与时间无关,只是几何位置(δ/x)和边界条件(Bi数)的函数,亦即无量纲温度分布不变,这一阶段称为正规状况阶段或充分发展阶段。
这一阶段的数学处理十分便利,温度分布计算只需取无穷级数的首项进行计算。
5.有人认为,当非稳态导热过程经历时间很长时,采用图3-7记算所得的结果是错误的.理由是:这个图表明,物体中各点的过余温度的比值与几何位置及Bi有关,而与时间无关.但当时间趋于无限大时,物体中各点的温度应趋近流体温度,所以两者是有矛盾的。
你是否同意这种看法,说明你的理由。
答:我不同意这种看法,因为随着时间的推移,虽然物体中各点过余温度的比值不变但各点温度的绝对值在无限接近。
这与物体中各点温度趋近流体温度的事实并不矛盾。
工程热力学和传热学课后题答案ppt课件

途径的S;
答案“错。两者的S是相等的。理由同(2)。
(4)工质经不可逆循环,S 0;
答案“错。S=0,理由同(2)。
(5)工质经不可逆循环,由于答案:“错。应该是理由同(2)。
(6)可逆绝热过程为定熵过程,定熵过程就是可逆绝热过程;
答案:前一句话对,后一句话错。
(7)自然界的过程都朝着熵增大的方向进行,因此熵减少的过程不可能实现;
其中: S 工质 = 0
S H=
S H +
S H =
( Q 1 TH
Q 1 ), 高温热源放热,故 T H
SH 0
S
=
L
(Q2 TL
), 低温热源吸热,故
SL 0
(1 ) S iso
( 1200 600
400 ) ( 800 ) 0 . 167 0 , 可行,且为不可逆循环
545.62min 9.09hour
287(17 273)
.
• 3、有质量2kg,初态为p1=0.13 MPa, t1=27°C的氮气在定压下加热到t2=127°C, 求热力学能、焓和熵的变化量(按定比热容计算)。
解:N2是双原子气体M,=28
教材P57,双原子气体 cM,P 29.3kJ/(kmol k)
H cM,pT 2=29.3(127- 27)2 209.3kJ
28
28
U cM,vT 2=(cM,p RM )T 2=(29.3-8.314)(127- 27)2 149.9kJ
28
28
28
S
2
cp
ln
T2 T1
2 cM,p 28
ln T2 T1
2 29.3 ln 127 273 0.602kJ/ K 28 27 273
工程热力学与传热学3)热力学第一定律

工质的总储存能E(简称总能)= 内部储存能+外部储存能=热力学能+宏观运动 动能+位能
E =U+Ek+Ep
内部储存能 外部储存能
(3.1)
• •
dE=dU+dEk+dEp ΔE=ΔU+ΔEk+ΔEp
(3.2) (3.3)
E =U+Ek+Ep
Ek=(mcf2)/2 Ep=mgz (3.4)
1 2 E U mcf mgz 2
例题3.2附图
(1)首先计算状态1及2的参数:
p1=p0+F1/A=771×133.32+195×9.81/0.01=2.941×105 (Pa) V1=h×A=0.1×0.01=10-3 (m2) p2=p0+F2/A=771×133.32+95×9.81/0.01=1.960×105 (Pa)
3.3.2 功量
功源的不同形式
电功 磁功 机械拉伸功 弹性变形功 表面张力功 膨胀功 轴功
(1)膨胀功(容积功) 与系统的界面移动有关 • 定义:热力系统在压力差作用下因工质容 积发生变化而传递的机械功。
• 热量转换为功量→工质容积发生膨胀→产 生膨胀功 • 闭口系统膨胀功:通过热力系统边界传递 开口系统膨胀功:通过其他形式传递
• 热力学第一定律解析式:热力学第一定律 应用于闭口系统而得的能量方程式,是最 基本的能量方程式 • Q = ∆U + W
一部分用于增加 工质的热力学能 储存于工质内部
一部分以作功的方 式传递至环境
• 热力学第一定律解析式的微分形式: • • • δQ=dU+δW (3.10) • 对于1kg工质: q=Δu+w δq=du+δw (3.11) (3.12)
工程热力学思考题答案,第三章

工程热力学思考题答案,第三章TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-第三章理想气体的性质1.怎样正确看待“理想气体”这个概念在进行实际计算是如何决定是否可采用理想气体的一些公式答:理想气体:分子为不占体积的弹性质点,除碰撞外分子间无作用力。
理想气体是实际气体在低压高温时的抽象,是一种实际并不存在的假想气体。
判断所使用气体是否为理想气体(1)依据气体所处的状态(如:气体的密度是否足够小)估计作为理想气体处理时可能引起的误差;(2)应考虑计算所要求的精度。
若为理想气体则可使用理想气体的公式。
2.气体的摩尔体积是否因气体的种类而异是否因所处状态不同而异任何气体在任意状态下摩尔体积是否都是 0.022414m 3 /mol答:气体的摩尔体积在同温同压下的情况下不会因气体的种类而异;但因所处状态不同而变化。
只有在标准状态下摩尔体积为 0.022414m 3 /mol 3.摩尔气体常数 R 值是否随气体的种类不同或状态不同而异?答:摩尔气体常数不因气体的种类及状态的不同而变化。
4.如果某种工质的状态方程式为pv =R g T,那么这种工质的比热容、热力学能、焓都仅仅是温度的函数吗?答:一种气体满足理想气体状态方程则为理想气体,那么其比热容、热力学能、焓都仅仅是温度的函数。
5.对于一种确定的理想气体,()p v C C -是否等于定值?p v C C 是否为定值?在不同温度下()p v C C -、pv C C 是否总是同一定值?答:对于确定的理想气体在同一温度下()p v C C -为定值,pv C C 为定值。
在不同温度下()p v C C -为定值,pv C C 不是定值。
6.麦耶公式p v g C C R -=是否适用于理想气体混合物是否适用于实际气体答:迈耶公式的推导用到理想气体方程,因此适用于理想气体混合物不适合实际气体。
7.气体有两个独立的参数,u(或 h)可以表示为 p 和 v 的函数,即(,)u u f p v =。
工程热力学和传热学课后答案(前五章)

第一篇工程热力学第一章基本概念一.基本概念系统:状态参数:热力学平衡态:温度:热平衡定律:温标:准平衡过程:可逆过程:循环:可逆循环:不可逆循环:二、习题1.有人说,不可逆过程是无法恢复到起始状态的过程,这种说法对吗?错2.牛顿温标,用符号°N表示其温度单位,并规定水的冰点和沸点分别为100°N和200°N,且线性分布。
(1)试求牛顿温标与国际单位制中的热力学绝对温标(开尔文温标)的换算关系式;(2)绝对零度为牛顿温标上的多少度?3.某远洋货轮的真空造水设备的真空度为0.0917MPa,而当地大气压力为0.1013MPa,当航行至另一海域,其真空度变化为0.0874MPa,而当地大气压力变化为0.097MPa。
试问该真空造水设备的绝对压力有无变化?4.如图1-1所示,一刚性绝热容器内盛有水,电流通过容器底部的电阻丝加热水。
试述按下列三种方式取系统时,系统与外界交换的能量形式是什么。
(1)取水为系统;(2)取电阻丝、容器和水为系统;(3)取虚线内空间为系统。
(1)不考虑水的蒸发,闭口系统。
(2)绝热系统。
注:不是封闭系统,有电荷的交换(3)绝热系统。
图1-15.判断下列过程中那些是不可逆的,并扼要说明不可逆原因。
(1)在大气压力为0.1013MPa时,将两块0℃的冰互相缓慢摩擦,使之化为0℃的水。
耗散效应(2)在大气压力为0.1013MPa时,用(0+dt)℃的热源(dt→0)给0℃的冰加热使之变为0℃的水。
可逆(3)一定质量的空气在不导热的气缸中被活塞缓慢地压缩(不计摩擦)。
可逆(4)100℃的水和15℃的水混合。
有限温差热传递6.如图1-2所示的一圆筒容器,表A的读数为360kPa;表B的读数为170kPa,表示室I压力高于室II的压力。
大气压力为760mmHg。
试求:(1) 真空室以及I 室和II 室的绝对压力; (2) 表C 的读数;(3) 圆筒顶面所受的作用力。
工程热力学和传热学课后题答案

第2章课后题答案解析
简答题
简述热力学第一定律的实质和应用。
计算题
计算一定质量的水在常压下从100°C冷却 到0°C所需吸收的热量。
答案
热力学第一定律的实质是能量守恒定律在 封闭系统中的表现。应用包括计算系统内 能的变化、热量和功的相互转换等。
答案
$Q = mC(T_2 - T_1) = 1000gtimes 4.18J/(gcdot {^circ}C)times (0^circ C 100^circ C) = -418000J$
工程热力学和传热学课后题答 案
目
CONTENCT
录
• 热力学基本概念 • 气体性质和热力学关系 • 热力学应用 • 传热学基础 • 传热学应用 • 习题答案解析
01
热力学基本概念
热力学第一定律
总结词
能量守恒定律
详细描述
热力学第一定律是能量守恒定律在热力学中的表述,它指出系统能量的增加等于进入系统的能量减去离开系统的 能量。在封闭系统中,能量的总量保持不变。
热力学第二定律
总结词:熵增原理
详细描述:熵增原理指出,在一个孤 立系统中,自发反应总是向着熵增加 的方向进行,而不是减少。这意味着 孤立系统中的反应总是向着更加无序、 混乱的方向进行。
热力过程
总结词:等温过程 总结词:绝热过程 总结词:等压过程
详细描述:等温过程是指系统温度保持不变的过程。在 等温过程中,系统吸收或释放的热量全部用于改变系统 的状态,而不会引起系统温度的变化。
热力过程分析
总结词
热力过程分析是研究系统在热力学过程 中的能量转换和传递的过程,包括等温 过程、绝热过程、多变过程等。
VS
详细描述
等温过程是指在过程中温度保持恒定的过 程,如等温膨胀或等温压缩。绝热过程是 指在过程中系统与外界没有热量交换的过 程,如火箭推进或制冷机工作。多变过程 是指实际气体在非等温、非等压过程中的 变化过程,通常用多变指数来表示压力随 温度的变化关系。
工程热力学和传热学课后答案(前五章)

页眉内容
对于可逆过程,都正确。
3.某封闭系统经历了一不可逆过程,系统向外界放热为10kJ,同时外界对系统作功为20kJ。
1)按热力学第一定律计算系统热力学能的变化量;
2)按热力学第二定律判断系统熵的变化(为正、为负、可正可负亦可为零)。
4.判断是非(对画,错画×)
1)在任何情况下,对工质加热,其熵必增加。()
2.下列说法是否正确,为什么?
1)熵增大的过程为不可逆过程;
只适用于孤立系统
2)工质经不可逆循环,S0;
S =0
3)可逆绝热过程为定熵过程,定熵过程就是可逆绝热过程;
定熵过程就是工质状态沿可逆绝热线变化的过程
4)加热过程,熵一定增大;放热过程,熵一定减小。
根据ds≥△q/T,前半句绝对正确,后半句未必,比如摩擦导致工质温度升高的放热过程。
w123>w143
14
谁大谁小?又如2和3在同一条等温线上呢?
所以
P
v
图4-2
2
2->3为绝热膨胀过程,内能下降。所以
u2>u3。
4.讨论1<n<k的多变膨胀过程中绝气热体线温度的变化以及气体与外界热传递的方向,并用热力学第一
(3)绝热系统。
图
1-1
5.判断下列过程中那些是不可逆的,并扼要说明不可逆原因。
(1)在大气压力为0.1013MPa时,将两块0℃的冰互相缓慢摩擦,使之化为0℃的水。
耗散效应
(2)在大气压力为0.1013MPa时,用(0+dt)℃的热源(dt→0)给0℃的冰加热使之变为0℃的水。
可逆
(3)一定质量的空气在不导热的气缸中被活塞缓慢地压缩(不计摩擦)。
800kJ。从状态2到状态3是一个定压的压缩过程,压力为p=400kPa,气体向外散热450kJ。并且已
工程热力学和传热学课后参考答案(前五章)

第一篇工程热力学第一章基本概念一.基本概念系统:状态参数:热力学平衡态:温度:热平衡定律:温标:准平衡过程:可逆过程:循环:可逆循环:不可逆循环:二、习题1错2(开尔3,而当地大气压力变化?4器底部界交换(13)取虚线内空间为系统。
(1)不考虑水的蒸发,闭口系统。
(2)绝热系统。
注:不是封闭系统,有电荷的交换(3)绝热系统。
图1-15.判断下列过程中那些是不可逆的,并扼要说明不可逆原因。
(1)在大气压力为0.1013MPa时,将两块0℃的冰互相缓慢摩擦,使之化为0℃的水。
耗散效应(2)在大气压力为0.1013MPa时,用(0+dt)℃的热源(dt→0)给0℃的冰加热使之变为0℃的水。
可逆(3可逆(4)100℃的水和6室I压力760mmHg。
图1-2一.基本概念功:热量:体积功:节流:二.习题1.膨胀功、流动功、轴功和技术功四者之间有何联系与区别?2.下面所写的热力学第一定律表达是否正确?若不正确,请更正。
3.一活塞、气缸组成的密闭空间,内充50g气体,用叶轮搅拌器搅动气体。
活塞、气缸、搅拌器均用完全绝热的材料制成。
搅拌期间,活塞可移动以保持压力不变,但绝对严密不漏气。
已测得搅拌前气体处于状态1,搅拌停止后处于状态2,如下表所示。
活塞与气缸壁间有一些摩擦4.1kg,对(1(3)压缩5到状态2,气体吸热500kJ,p=400kPa,2-3过程中气体体积-450= U3-U2+400(V3-V2)V3-V2=6.现有两股温度不同的空气,稳定地流过如图2-1所示的设备进行绝热混合,以形成第三股所需温度的空气流。
各股空气的已知参数如图中所示。
设空气可按理想气体计,其焓仅是温度的函数,按{h}kJ/kg =1.004{T}K 计算,理想气体的状态方程为pv=RT,R=287J/(kg·K)。
若进出口截面处的动、位能变化可忽略,试求出口截面的空气温度和流速。
m3=m1+m2h3=h1+h2图2-17.某气体从初态p 1=0.1MPa ,V 1=0.3m 3可逆压缩到终态p 2=0.4MPa ,设压缩过程中p=aV -2,式中a 为常数。
工程热力学与传热学 第3章 习题PPT

工程热力学
第三章 理想气体的性质和热力过程 习 题
习题 课
理想气体状态方程的应用
1. 启动柴油机用的空气瓶 体积 启动柴油机用的空气瓶, 体积V=0.3m3, 装有p 的压缩空气。 装有 1=8MPa,Tl=303K 的压缩空气。 , 启动后, 瓶中空气压力降低为p 启动后 瓶中空气压力降低为 2=4.6MPa, 这时T 这时 2=303K。 。 求用去空气的量 (mol) 及相当的质量 (kg)。 。
习题 课
理想气体的热力过程
8. 在一具有可移动活塞的封闭气缸中 储有温度 在一具有可移动活塞的封闭气缸中, t1=45℃, 表压力为pgl=10KPa 的氧气 的氧气0.3m3。 ℃ 表压力为 在定压下对氧气加热, 加热量为40kJ;再经过 在定压下对氧气加热 加热量为 ; 多变过程膨胀到初温45℃ 压力为18KPa。 多变过程膨胀到初温 ℃, 压力为 。 设环境大气压力为0.1MPa, 氧气比热容为定值。 氧气比热容为定值。 设环境大气压力为 及所作的功; 求:(1)两过程的焓变量及所作的功; )两过程的焓 (2)多变膨胀过程中气体与外界交换的热量。 )多变膨胀过程中气体与外界交换的热量。
习题 课
理想气体的热力过程
6. 空气以 m=0.012kg/s的流量流过散热良好的 空气以q 的流量流过散热良好的 压缩机,入口参数P 压缩机,入口参数 1=0.102MPa,T1=305K, , , 可逆压缩到出口压力P 可逆压缩到出口压力 2=0.51MPa,然后进入 , 储气罐。 1kg空气的焓变量 和熵变量∆s, 空气的焓变量∆h和熵变量 储气罐。求1kg空气的焓变量∆h和熵变量∆s, 以及压缩机消耗的功率P和每小时的散热量 和每小时的散热量q 以及压缩机消耗的功率 和每小时的散热量 Q。 (1)设空气按定温压缩; )设空气按定温压缩; (2)设空气按可逆绝热压缩; )设空气按可逆绝热压缩; (3)设空气按n=1.28的多变过程压缩。 )设空气按 的多变过程压缩。 的多变过程压缩 比热容取定值。 比热容取定值。
工程热力学第三章课后答案

第三章 气体和蒸气的性质3−1 已知氮气的摩尔质量328.110 kg/mol M −=×,求: (1)2N 的气体常数g R ;(2)标准状态下2N 的比体积v 0和密度ρ0; (3)标准状态31m 2N 的质量m 0;(4)0.1MPa p =、500C t =D 时2N 的比体积v 和密度ρ; (5)上述状态下的摩尔体积m V 。
解:(1)通用气体常数8.3145J/(mol K)R =⋅,查附表23N 28.0110kg/mol M −=×。
22g,N 3N8.3145J/(mol K)0.297kJ/(kg K)28.0110kg/molR R M −⋅===⋅×(2)1mol 氮气标准状态时体积为22233m,N N N 22.410m /mol V M v −==×,故标准状态下2233m,N 3N 322.410m /mol 0.8m /kg28.0110kg/molV v M −−×===×223N 3N111.25kg/m 0.8m /kgv ρ===(3)标准状态下31m 气体的质量即为密度ρ,即0 1.25kg m =。
(4)由理想气体状态方程式g pv R T=g 36297J/(kg K)(500273)K2.296m /kg0.110Pa R T v p ⋅×+===×33110.4356kg/m 2.296m /kgv ρ===(5)2223333m,N N N 28.0110kg/mol 2.296m /kg 64.2910m /mol V M v −−==××=×3-2 压力表测得储气罐中丙烷38C H 的压力为4.4MPa ,丙烷的温度为120℃,问这时比体积多大?若要储气罐存1 000kg 这种状态的丙烷,问储气罐的体积需多大?解:由附表查得383C H 44.0910kg/mol M −=×3838g,C H 3C H8.3145J/(mol K)189J/(kg K)44.0910kg/molR R M −⋅===⋅×由理想气体状态方程式g pv R T=g 36189J/(kg K)(120273)K0.01688m /kg4.410PaR T v p⋅×+===×331000kg 0.01688m /kg 16.88m V mv ==×=或由理想气体状态方程g pV mR T=g 361000kg 189J/(kg K)(120273)K16.88m 4.410PamR T V p×⋅×+===×3−3 供热系统矩形风管的边长为100mm ×175mm ,40℃、102kPa 的空气在管内流动,其体积流量是0.018 5m 3/s ,求空气流速和质量流量。
工程热力学第三章答案

1、已知某气体的分子量为29,求:(1)气体常数;(2)标准状态 下的比体积及千摩尔容积;(3)在P = 0.1MPa,20℃时的比体积及 千摩尔容积。
解: (1)气体常数 R
R Rm 8.314 0.287 kJ/(kgK) M 29
(2)标准状态下的比体积及千摩尔容积 因为气体处于标准状态,所以 p = 101.325kPa,T = 273K,又因为 p RT
506.2 0.444 p 120 (1.004 ln 0.287 ln ) 673 p 506.2 0.556 p 150 ((1.004 ln 0.287 ln ) 373 p 64.9 kJ/(kg h)
8、一绝热刚性容器被隔板分成A、B两部分。A中有压力为0.3MPa、温度为200℃的氮 气,容 积为0.6m3;B中有压力为1MPa、温度为20℃的氧气,容积为1.3m3.现抽去隔板, 两种气体均匀混合。若比热容视为定值,求:(1)混合气体的温度;(2)混合气体的压 力;(3)混合过程各气体的熵变和总熵变。
3、某储罐容器为3m3,内有空气,压力指示为0.3MPa,温度计读数为15℃,现由压缩机每
分钟从压力为0.1MPa,温度为12℃的大气中吸入0.2m3的空气,经压缩后送入储罐,问经多长 时间可使储罐内气体压力升高到1MPa、温度升到50℃?
解:由题意知:
因为:
pV NRmT N
pV RmT
RT 0.287 273 0.773 m3 /kg p 101.325
3 V mv 29 0.773 22.4 m /kmol 千摩尔容积:
1、已知某气体的分子量为29,求:(1)气体常数;(2)标准状态 下的比体积及千摩尔容积;(3)在P = 0.1MPa,20℃时的比体积及 千摩尔容积。
工程热力学与传热学(中文) 第3章 理想气体的性质与热力过程

对定容过程: 对定容过程:
du + pdv ∂u cV = ( )V = ( )V = ( )V dT dT ∂T
说明
δq
cv意义: 意义: 在体积不变时,比热力学能对温度的偏导数, 在体积不变时,比热力学能对温度的偏导数, 其数值等于在体积不变时, 其数值等于在体积不变时,物质温度变化1K 时比热力学能的变化量。 时比热力学能的变化量。
分析:同温度下,任意气体的 分析:同温度下,任意气体的cp > cv ?
气体定容加热时,不对外膨胀作功, 气体定容加热时,不对外膨胀作功,所加入的热量全 部用于增加气体本身的热力学能,使温度升高。 部用于增加气体本身的热力学能,使温度升高。而定压过 程中,所加入的热量,一部分用于气体温度升高, 程中,所加入的热量,一部分用于气体温度升高,另一部 分要克服外力对外膨胀作功,因此, 分要克服外力对外膨胀作功,因此,相同质量的气体在定 压过程中温度升高1K要比定容过程中需要更多的热量 要比定容过程中需要更多的热量。 压过程中温度升高 要比定容过程中需要更多的热量。
t1
cdt
3-2-3 利用理想气体的比热容计算热量
对理想气体: 对理想气体: u = f (T ), h = f (T ), cV = f (T ), c p = f (T ) 1. 真实比热容(The real specific heat capacity) ) 当温度变化趋于零的极限时的比热容。 当温度变化趋于零的极限时的比热容。 它表示某瞬间温度的比热容。 它表示某瞬间温度的比热容。
C,c,Cm,CV之间的关系: , , 之间的关系:
CV =
Cm 22 .4
kJ /( m 3 ⋅ K )
C = mc = nC m = V0CV
工程热力学与传热学第三章作业参考答案
“山水之乐”的具体化。3.第三段同样是写“乐”,但却是写的游人之乐,作者是如何写游人之乐的?明确:“滁人游”,前呼后应,扶老携幼,自由自在,热闹非凡;“太守宴”,溪深鱼肥,泉香酒洌,美味佳肴,应有尽有;“众宾欢”,投壶下棋,觥筹交错,说说笑笑,无拘无束。如此勾画了游人之乐。4.作者为什么要在第三段写游人之乐?明确:写滁人之游,
贯穿全篇,却有两个句子别出深意,不单单是在写乐,而是另有所指,表达出另外一种情绪,请你找出这两个句子,说说这种情绪是什么。明确:醉翁之意不在酒,在乎山水之间也。醉能同其乐,醒能述以文者,太守也。这种情绪是作者遭贬谪后的抑郁,作者并未在文中袒露胸怀,只含蓄地说:“醉能同其乐,醒能述以文者,太守也。”此句与醉翁亭的名称、“醉翁之
p50习题习题3214476p50习题习题33lnlnp50习题习题351331可逆绝热过程2自由膨胀lnln576kjkmcmr理想气体定值比热及比热比单原子双原子多原子摩尔定容比热ckjkmolk摩尔定压比热ckjkmolk比热比k16714129当计算精度要求不高或气体处于较低温度范围常采用定值比热忽略比热与温度的关系
Ws U mu mcv T1 T2 1746.3kJ
S 0
(2)自由膨胀
Ws 0 Q 0, U 0 T2 T1 340K
S
mcv
ln T2 T1
mR ln
v2 v1
5.76kJ/K
当计算精度要求不高,或气体处于较低温度 范围,常采用定值比热,忽略比热与温度的关系。 不同气体在标准状态下均为22.4m3,不同气体只 要其原子数相同则其摩尔定值比热相等。
江西)人,因吉州原属庐陵郡,因此他又以“庐陵欧阳修”自居。谥号文忠,世称欧阳文忠公。北宋政治家、文学家、史学家,与韩愈、柳宗元、王安石、苏洵、苏轼、苏辙、曾巩合称“唐宋八大家”。后人又将其与韩愈、柳宗元和苏轼合称“千古文章四大家”。
工程热力学和传热学课后参考答案(前五章)

第一篇工程热力学第一章基本概念一.基本概念系统:状态参数:热力学平衡态:温度:热平衡定律:温标:准平衡过程:可逆过程:循环:可逆循环:不可逆循环:二、习题1.有人说,不可逆过程是无法恢复到起始状态的过程,这种说法对吗?错2.牛顿温标,用符号°N表示其温度单位,并规定水的冰点和沸点分别为100°N和200°N,且线性分布。
(1)试求牛顿温标与国际单位制中的热力学绝对温标(开尔文温标)的换算关系式;(2)绝对零度为牛顿温标上的多少度3.某远洋货轮的真空造水设备的真空度为0.0917MPa,而当地大气压力为0.1013MPa,当航行至另一海域,其真空度变化为0.0874MPa,而当地大气压力变化为0.097MPa。
试问该真空造水设备的绝对压力有无变化4.如图1-1所示,一刚性绝热容器内盛有水,电流通过容器底部的电阻丝加热水。
试述按下列三种方式取系统时,系统与外界交换的能量形式是什么。
(1)取水为系统;(2)取电阻丝、容器和水为系统;(3)取虚线内空间为系统。
(1)不考虑水的蒸发,闭口系统。
(2)绝热系统。
注:不是封闭系统,有电荷的交换(3)绝热系统。
图1-15.判断下列过程中那些是不可逆的,并扼要说明不可逆原因。
(1)在大气压力为0.1013MPa时,将两块0℃的冰互相缓慢摩擦,使之化为0℃的水。
耗散效应(2)在大气压力为0.1013MPa时,用(0+dt)℃的热源(dt→0)给0℃的冰加热使之变为0℃的水。
可逆(3)一定质量的空气在不导热的气缸中被活塞缓慢地压缩(不计摩擦)。
可逆(4)100℃的水和15℃的水混合。
有限温差热传递6.如图1-2所示的一圆筒容器,表A的读数为360kPa;表B的读数为170kPa,表示室I压力高于室II的压力。
大气压力为760mmHg。
试求:(1)真空室以及I室和II室的绝对压力;(2)表C的读数;(3)圆筒顶面所受的作用力。
图1-2第二章热力学第一定律一.基本概念功:热量:体积功:节流:二.习题1.膨胀功、流动功、轴功和技术功四者之间有何联系与区别?2.下面所写的热力学第一定律表达是否正确?若不正确,请更正。
工程热力学和传热学课后答案解析(前五章)

第一篇工程热力学第一章基本概念一.基本概念系统:状态参数:热力学平衡态:温度:热平衡定律:温标:准平衡过程:可逆过程:循环:可逆循环:不可逆循环:二、习题1.有人说,不可逆过程是无法恢复到起始状态的过程,这种说法对吗?错2.牛顿温标,用符号°N表示其温度单位,并规定水的冰点和沸点分别为100°N和200°N,且线性分布。
(1)试求牛顿温标与国际单位制中的热力学绝对温标(开尔文温标)的换算关系式;(2)绝对零度为牛顿温标上的多少度?3.某远洋货轮的真空造水设备的真空度为0.0917MPa,而当地大气压力为0.1013MPa,当航行至另一海域,其真空度变化为0.0874MPa,而当地大气压力变化为0.097MPa。
试问该真空造水设备的绝对压力有无变化?4.如图1-1所示,一刚性绝热容器内盛有水,电流通过容器底部的电阻丝加热水。
试述按下列三种方式取系统时,系统与外界交换的能量形式是什么。
(1)取水为系统;(2)取电阻丝、容器和水为系统;(3)取虚线内空间为系统。
(1)不考虑水的蒸发,闭口系统。
(2)绝热系统。
注:不是封闭系统,有电荷的交换(3)绝热系统。
图1-15.判断下列过程中那些是不可逆的,并扼要说明不可逆原因。
(1)在大气压力为0.1013MPa时,将两块0℃的冰互相缓慢摩擦,使之化为0℃的水。
耗散效应(2)在大气压力为0.1013MPa时,用(0+dt)℃的热源(dt→0)给0℃的冰加热使之变为0℃的水。
可逆(3)一定质量的空气在不导热的气缸中被活塞缓慢地压缩(不计摩擦)。
可逆(4)100℃的水和15℃的水混合。
有限温差热传递6.如图1-2所示的一圆筒容器,表A的读数为360kPa;表B的读数为170kPa,表示室I压力高于室II的压力。
大气压力为760mmHg。
试求:(1)真空室以及I室和II室的绝对压力;(2)表C的读数;(3) 圆筒顶面所受的作用力。
图1-2第二章 热力学第一定律一.基本概念功: 热量: 体积功: 节流:二.习题1.膨胀功、流动功、轴功和技术功四者之间有何联系与区别? 2.下面所写的热力学第一定律表达是否正确?若不正确,请更正。
工程热力学与传热学 第三章
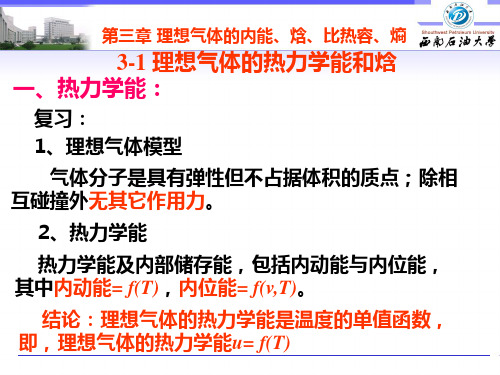
3-1 理想气体的热力学能和焓 一、热力学能:
复习: 1、理想气体模型
气体分子是具有弹性但不占据体积的质点;除相 互碰撞外无其它作用力。
2、热力学能
热力学能及内部储存能,包括内动能与内位能, 其中内动能= f(T),内位能= f(v,T)。
结论:理想气体的热力学能是温度的单值函数, 即,理想气体的热力学能u= f(T)
qVLeabharlann u TVdT 即:
cV
qV dT
u T
V
升高1K内能 的增加量。
第三章 理想气体的内能、焓、比热容、熵
(2)定压比热容
对于实际气体的可逆过程(reversible process )
q dh vdp
热力学能 h 是状态参数,h h(T , p)
dh
h T
p
dT
h p
T
t
6c4页p,m表0称 3-1为及工65质页在表03-~2t中温查度取范。围注内意的:平单均位比为热摄容氏,℃可。在
第三章 理想气体的内能、焓、比热容、熵
3-3 理想气体的熵
由熵的定义式: ds qre
T
在可逆过程中(准静过程):
q du pdv 热一律解析式之一
q dh vdp 热一律解析式之二
代入熵的定义式中:
ds
du pdv T
cv0dT T
RgTdv vT
cv0
dp
对定压过程,dp 0 ,由上两式可得
物理意义: p 时1kg工质
qp
h T
p
dT
即:
cp
qp dT
h T
p
升高1K焓的 增加量。
清华大学热工基础课件工程热力学加传热学(4)第三章

物质的多少还以物质的量(摩尔数)来衡量。 物质的量:n ,单位: mol(摩尔)。 摩尔质量: M ,1 mol物质的质量,kg/mol。
4
物质的量与摩尔质量的关系: n m M
摩尔质量与气体的相对分子量之间的关系:
1 kmol物质的质量数值与气体的相对分子质 量的数值相同。
MO2 = 32.0010-3 kg/mol MN2 = 28.0210-3 kg/mol
19
2) 理想气体的熵
根据熵的定义式及热力学第一定律表达式,
可得
ds q du pdv du p dv
Τ
T
TT
ds q dh vdp dh v dp
T
T
TT
对于理想气体,
du cV dT , dh cpdT , pv RgT
代入上面两式,可得
20
ds
cV
dT T
Rg
dv v
ds
cp
dT T
Rg
dp p
比热容为定值时 ,分别将上两式积分,可得
代入
s
cV ln
T2 T1
Rg ln
v2 v1
s
c
p
ln
T2 T1
Rgln
p2 p1
pv RgT和迈耶公式cp cV=Rg ,得 21
结论:
s
cV ln
p2 p1
cpln
v2 v1
(1)理想气体比熵的变化完全取决于初态和终 态,与过程所经历的路径无关。这就是说,理 想气体的比熵是一个状态参数。
M空气 = 28.96 10-3 kg/mol
5
摩尔体积 Vm :1 mol物质的体积, m3/mol。
工程热力学与传热学第三章

理想气体的内能、焓、熵的一般计算式
根据比热容的定义并引用热力学第一定律解析式, 可得
q du pdv u cv dT v dT v T v q dh vdp h cp dT p dT p T v
所以 du c dT v
(3 9)
式(3-9)是计算理想气体内能的一般关系式。
理想气体的内能、焓、熵的一般计算式
同理,因为h=u+pv,理想气体状况方程pv=Rt, 于是又可得出一重要推论:“理想气体的焓也是温度的 单值函数,即h=f(t)”,那么,
dh h cp T p dT
应用比热容计算热量的方法
1. 平均比热容:设 1kg 气体,温度由 t1 升高到 t2 所需 的热量为q,则
c
t2 m t1
q t2 t1
t2 t1
[kJ / (kg ℃)]
——由t1到t2的平均质量比热容。
(3- 2)
cm 式中:
应用比热容计算热量的方法
2.真实比热容:设1kg气体,温度由t升高到t+Δt时所 需的热量为Δq,当Δt→0时,则
g
(2)用平均比热容(直线式)计算。 查表3-2,空气的定压容积比热容为
cpm ' 1.2866 0.0001201t kJ / ( Nm3 ℃)
所以
c pm ' 1.2866 0.0001201(200 20) 1.313kJ / ( Nm3 ℃)
又因为 故
Q V c pm '
终容积为初容积的3倍。设氮气具有理想气体性质,
试求: (1)气体的终温度。 (2)气体的终压力。 (3)气体因状态变化而引起的熵的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
t,=476℃
第三章
P50
作业参考答案
习题
习题3-3
s c p ln
T2 p R ln 2 T1 p1
V2 0.022m 3
T2 468.3K
s 0.217kJ / (kg K)
第三章
P50
作业参考答案
习题
习题3-5 (1)可逆绝热过程
k cp cv 1.33
高温热源熵变 低温热源熵变
工质熵变
S1
Q1 3.3(1 )Q1 3.33kJ/K T2 T2
S0 0 S S1 S2 S0 0
孤立系的总熵变
t=260.96℃
第四章
习题4-3 定容过程 P66
作业参考答案
习题
p1 p2 2.52 p1 , T2 1008 K T1 T2 T2
cv 5 4.157 0.717kJ/(kg K) 28.97
Q1 mcv (T2 T1 ) 435.9kJ
定温压缩过程
Q2 m RT 1 ln
理想气体定值比热及比热比
单原子 摩尔定容比热Cv kJ/(kmol﹒K) 摩尔定压比热Cp kJ/(kmol﹒K) 比热比k
3 Rm 2
双原子 多原子
5 Rm 2 7 Rm 2
5
Rm 2
7
Rm 2
9
Rm 2
1.67
1.4
1.29
第三章
P50 习题3-6
n
作业参考答案
习题
ln( p1 / p2 ) ln 8 0.904 ln(v2 / v1 ) ln10
第三章
P50 习题3-2
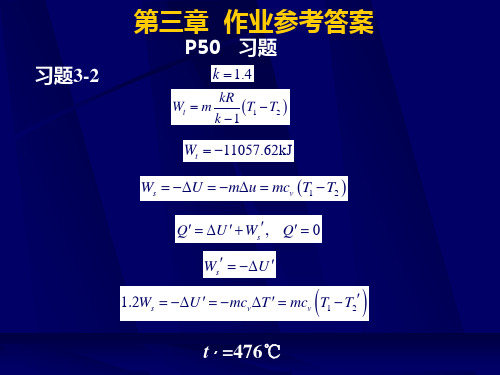
Wt m
作业参考答案
习题
kR T1 T2 k 1
k 1.4
Wt 11057.62kJ
Ws U mu mcv T1 T2
Q U Ws , Q 0 Ws U
1.2Ws U mcv T mcv T1 T2
5 4.157 cv 0.718kJ/(kg K) 28.97
nk 1 nk Qn mc n (T2 T1 ) mc v (T2 T1 ) mc v T1 n 1 4 n 1
T1 45.2K
U mcv (T2 T1 ) 8.16kJ
W Qn U 33.71kJ
T2 270.48K
Ws U mu mcv T1 T2 1746.3kJ
S 0
(2)自由膨胀
Ws 0 Q 0, U 0
S mcv ln
T2 T1 340K
T2 v mR ln 2 5.76kJ/K T1 v1
当计算精度要求不高,或气体处于较低温度 范围,常采用定值比热,忽略比热与温度的关系。 不同气体在标准状态下均为22.4m3,不同气体只 要其原子数相同则其摩尔定值比热相等。
高温热源熵变 低温热源熵变
工质熵变
S1
Q1 3.33kJ/K T1
S 2
Q2 (1 )Q1 3.33kJ/K T2 T2
S0 0 S S1 S2 S0 0
孤立系的总熵变
第四章
习题4-4 ( 2) P66
作业参考答案
习题
T2 W t Q1 kJ 1 T Q1 4135 1
Wt nW 30.47kJ
第四章
P66
作业参考答案
习题
习题4-2 (1)输出相同的功
T WA AQA 1 A2 QA TA1 TB 2 WB BQB 1 QA WA TB1
(2)热效率相等
t=360℃
TA2 TB 2 A 1 B 1 TA1 TB1
V1 264.4kJ V2
Q1 Q2 39.3% Q1
W Q1 Q2 171.5kJ
t 1
T1 60.3% T2
第四章
习题4-4 ( 1) P66
作业参考答案
习题
T2 W t Q1 1 T Q1 4000kJ 1
