已分装药品稳定性分析
药物制剂的稳定性与质量评价

药物制剂的稳定性与质量评价随着科技的不断进步,药物制剂在医疗领域的应用日益广泛。
药物制剂的稳定性和质量评价对于保证药物的疗效和安全性至关重要。
本文将对药物制剂的稳定性与质量评价进行论述,以期提高人们对于药物制剂的认识和理解。
一、稳定性的定义与重要性稳定性是指在一定条件下,药物制剂的物理、化学性质保持不变的程度。
药物制剂的稳定性直接关系到药物的疗效和安全性,对于药物的贮藏、运输和使用至关重要。
二、稳定性测试的方法为了评估药物制剂的稳定性,常用的测试方法包括物理性质测试、化学性质测试和生物性质测试。
其中,物理性质测试可以通过观察外观、测量体积、pH值等指标来判断药物制剂的稳定性;化学性质测试通过分析药物制剂中的化学成分、检测是否有杂质等方法来评价其稳定性;生物性质测试则是通过实验动物或体外试验来评估药物制剂的稳定性。
三、质量评价的指标药物制剂的质量评价可以从配方设计、制备工艺、包装材料等多个方面进行考虑。
常用的质量评价指标包括纯度、均匀性、溶解度、酸碱度、含量测定等。
四、稳定性与质量评价的关系稳定性测试是质量评价的重要组成部分,通过稳定性测试可以评估药物制剂在储存和使用过程中是否会发生质量变化。
药物制剂的稳定性与质量评价密切相关,只有稳定性良好的药物制剂才能达到预期的疗效并确保患者的安全。
五、稳定性提高的方法为了提高药物制剂的稳定性,可以采取一系列措施,包括合理设计产品配方、选择适当的药物载体、优化制备工艺、采用合适的包装材料等。
此外,药物制剂的贮藏条件、运输方式和使用方法也会对其稳定性产生影响,需要合理控制。
六、稳定性与药物研发的挑战药物研发是一个复杂而艰巨的任务,稳定性问题往往是制约药物研发和上市的重要因素之一。
药物研发过程中需要充分考虑稳定性问题,从早期的药物筛选到后期的制剂开发,都需要进行充分的稳定性测试和质量评价工作。
通过本文的论述,我们可以了解到药物制剂的稳定性与质量评价在现代医药领域中的重要性和影响。
药品稳定性及其影响因素分析

定性 的多种外 在因素 , 包 括药 品包装 、 温度 、 湿度、 空气 、 光、 时间等 , 以保 障临床用 药的安全有 效 。 关键 词 : 药 品; 稳定性 ; 原 因; 后果 ; 影响 因素
0 引言
等 诸 多 物理 特 性 保 持 不变 的 能力 ; 药 品的 化 学稳 定
性 是 指 药物 的 每 一 个 活 性 成 分 均 能 保 持 其 完 整 性
3 . 2 温 度 对 药 品 稳 定 性 的 影 响
温 度对 药 品质 量 影 响很 大 , 过 冷 或 过 热 都 能促
( 2 ) 产生有毒物质 , 使 药 品产 生 毒 性 或 毒 性 增 使 药 品变 质 失 效 , 尤其 是 生 物 制 品 、 脏 器制 剂 、 抗 生
1 药 品 稳 定 性
对 应 药 品 的物 理 稳 定性 、 化 学 稳 定性 、 生物 稳 定 性 , 药 品在 有 效 期 内可 能 会 产 生物 理 不 稳 定性 、 化 学 不
生物 不稳 定 性 。 其中, 物 理不 稳 定性 主要 是 药 物 及其 制 剂 都 有 其本 身 的质 量 标 准 , 各 国均 稳 定 性 、 有 相 应 的药 事 法 规 和药 品标 准 。一种 药 品或 制 剂 ,
产 生 水解 、 氧 化、 光 化 分解 、 聚 合等 化 学 反 应 , 药 品 的稳 定 性 是指 在 规 定 条 件 下 的整 个 有 效 影 响 ,
由于 药物 期 内, 药物 保 持 其 物理 、 化学、 生 物 学 和微 生物 学 性 使 药 品性 质 发生 变 化 而 不 能使 用 。此外 , 药物 与 敷 料 、 容器、 溶剂 、 催化剂 、 共 存 质 的 能力 , 主 要 包 括物 理 稳 定 性 、 化学稳定性、 生 物 与药 物 之 间 ,
药物制剂的稳定性评价与控制

药物制剂的稳定性评价与控制一、引言药物制剂的稳定性评价与控制是药学领域中至关重要的一项工作。
药物制剂的稳定性影响着药物的质量与安全性,直接关系到患者的用药效果和药物的疗效。
因此,对药物制剂的稳定性进行准确评价与控制具有重要意义。
二、药物制剂的稳定性评价方法1. 理化稳定性评价理化稳定性评价是对药物制剂进行物理性及化学性评价的方法。
物理性评价主要包括颗粒度分析、粘度测定等指标,用于评价制剂的物态性质。
化学性评价则是通过分析药物在特定条件下的化学反应情况,如水解、氧化等,评价药物的稳定性。
2. 生物学稳定性评价生物学稳定性评价主要是以药物在生物体内的代谢和消除动力学为依据,通过体内外试验评价药物在体内的稳定性。
这项评价方法能更准确地模拟药物在人体内的情况,评估药物在体内的代谢和降解情况,并为制剂的优化提供依据。
3. 微生物安定性评价微生物安定性评价是评价抗菌性、抗真菌性等药物制剂的稳定性方法。
通过在具备合适温度条件下暴露药物制剂于一定的微生物菌落中,观察药物对真菌、细菌的抑菌效果,评价抗菌制剂的稳定性。
三、药物制剂稳定性的控制方法1. 选择合适的药物配方药物配方的选择是制剂稳定性控制的首要环节。
合理的药物配方可以降低药物与其他成分间可能的相互作用,减少药物的降解和变质的可能性。
2. 控制生产工艺条件生产工艺条件是影响药物制剂稳定性的重要因素之一。
控制生产工艺中的温度、湿度、氧气接触等因素,可有效地保证药物制剂的质量稳定。
3. 适当的包装与储存条件适当的包装与储存条件对于维持药物制剂的稳定性至关重要。
选择合适的包装材料和储存温度,降低药物与外界环境的接触,减少药物分解和降解的可能性。
4. 进行稳定性研究与监测常规的稳定性研究与监测可以及时了解药物制剂的稳定性情况,并采取相应的调整措施。
包括对药物制剂进行加速稳定性研究、中间检测、长期贮存试验等,以确保制剂在使用期限内的稳定性。
四、稳定性评价与控制的意义1. 确保药物的质量与疗效稳定性评价与控制能够确保药物制剂在放置、运输和使用过程中不发生质量变化,保证药物的有效成分及其疗效的稳定性,从而保证病患获得有效治疗。
临床实验用药品稳定性检验

临床实验用药品稳定性检验药品的稳定性检验是临床实验中非常重要的一步。
在临床试验中,药品的稳定性直接关系到试验结果的准确性和可靠性。
因此,合理有效的药品稳定性检验方案对于临床试验的成功进行至关重要。
本文将介绍临床实验用药品稳定性检验的相关内容。
一、药品的稳定性定义药品的稳定性指的是药品在一定条件下保持其药理活性、药效和质量的能力。
在临床实验中,药品的稳定性要求较高,因为药品的不稳定性可能导致药物的成分发生变化,进而影响药效的准确评价。
因此,药品的稳定性检验对于临床试验的科学性和可靠性具有重要意义。
二、药品稳定性检验的方法1. 物化性稳定性测试:物化性稳定性测试主要通过测定药品的溶解度、颜色、气味、PH值、溶解速度以及晶体形态等指标来评价药品的物化性稳定性。
2. 化学稳定性测试:化学稳定性测试主要通过测定药品的含量、杂质、分解产物、光敏性等指标来评价药品的化学稳定性。
3. 生物学稳定性测试:生物学稳定性测试主要通过测定药品在体外和体内的药效、毒性、代谢动力学等指标来评价药品的生物学稳定性。
三、药品稳定性检验的条件1. 温度条件:不同的药品对温度有不同的敏感性,因此,在进行稳定性检验时,应根据药品的特性选择合适的温度条件。
2. 光照条件:光照对某些药品的稳定性有较大影响,因此,在进行稳定性检验时,应根据药品的特性选择合适的光照条件。
3. 湿度条件:湿度对某些药品的稳定性也有影响,因此,在进行稳定性检验时,应根据药品的特性选择合适的湿度条件。
四、药品稳定性检验结果的评价与分析1. 药品的含量变化:通过测定药品的含量变化,可以评价药品的稳定性。
2. 药品的物理变化:药品溶解度、颜色、气味等的变化也是评价药品稳定性的重要指标。
3. 药物分解产物和杂质的检测:通过对药品中分解产物和杂质的测定,可以评价药品的稳定性。
五、药品稳定性检验的意义药品的稳定性检验对于临床实验具有重要的意义。
首先,药品的稳定性检验可以评价药品是否适用于临床实验;其次,药品的稳定性检验可以保证临床试验结果的准确性和可靠性;最后,药品的稳定性检验可以为药品的生产和贮存提供参考。
药物溶解度和稳定性检测的试验原理及注意事项

药物稳定性研究的实验原理和注意事项药品的稳定性是指其保持理化性质和生物学特性不变的能力。
若药品的稳定性差,发生降解而引起质量变化,则不仅可能使药效降低,而且生成的杂质还有可能有明显的毒副作用,影响药品使用的安全性与有效性。
稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期,保证用药安全。
一、稳定性试验基本要求要求1: 影响因素试验用1批供试品进行(原料药或制剂)。
加速试验与长期试验要求用3批供试品进行。
要求2: 原料药供试品应是达到一定规模生产的产品。
供试品量相当于制剂稳定性试验所要求的批量;原料药合成工艺路线、方法、步骤应与大生产一致。
要求3: 药物制剂供试品应是放大试验的产品,其处方和工艺与大生产一致。
药物制剂,如片剂或胶囊剂,每批放大试验的规模,至少应为10000片或粒。
大体积包装的制剂,如静脉注射液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据具体情况另定。
要求4: 供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质童标准一致。
要求5: 加速试验与长期试验所用供试品的包装应与上市产品一致。
原料药所用包装应采用模拟小桶,但所用材料与封装条件应与大桶一致。
实验室规模的产品仅可用作辅助性稳定性预试验。
要求6: 研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性结果的可靠性。
在稳定性试验中,应重视有关物质,特别是降解产物的检查和鉴定。
要求7: 由于放大试验比规模生产的数量要小,故药品注册申请人应在获得批准后,从放大试验转人规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速与长期稳定性试验。
二、原料药物与药物制剂的稳定性试验1、原料药物(1)影响因素试验影响因素试验是将药品置于比加速试验更为剧烈的条件下进行的稳定性考察。
药品稳定性报告

药品稳定性报告1. 简介稳定性是药品质量控制的重要指标之一,它指的是药品在规定的条件下,其物理、化学和微生物特性在一段时间内保持不变的能力。
药品在不同条件下的稳定性研究对于确定药品的质量、有效期和储存条件至关重要。
本报告旨在通过稳定性研究结果,对药品的特性进行评估和监控。
2. 研究目的本次稳定性研究的目的是评估药品在不同储存条件下的物理、化学和微生物特性的变化情况,为确定药品的有效期和储存条件提供科学依据。
研究将对药品的外观、溶解度、pH值、含量、纯度和微生物污染进行分析,并进行稳定性研究结果的统计分析和总结。
3. 研究方法3.1 样品选取从批号为XXX的药品中,随机选取10瓶作为实验样品。
3.2 储存条件将选取的样品按照以下储存条件进行稳定性研究:•温度:25℃和40℃•湿度:相对湿度为60%和75%3.3 变量测定选择如下变量对样品进行测定:•外观:记录样品在不同储存条件下的颜色、形状和透明度。
•溶解度:测定样品在相同温度下的溶解度。
•pH值:测定样品在相同温度下的pH值。
•含量:使用适当的方法测定药物的含量。
•纯度:检测样品的纯度是否发生变化。
•微生物污染:进行微生物检测,检测样品是否受到细菌、酵母菌和霉菌的污染。
3.4 实验设计将样品随机分为不同组,每个组在不同的储存条件下进行储存。
每天测量样品的外观、溶解度和pH值,在不同时间点进行含量和纯度的分析。
每周进行一次微生物污染测试。
4. 结果与分析4.1 外观经过稳定性研究后,药品在不同储存条件下的外观变化可以总结如下:•温度为25℃下,药品的颜色在储存30天后变浅,形状和透明度无明显变化。
•温度为40℃下,药品的颜色在储存15天后变浅,形状和透明度有轻微变化。
•湿度为60%下,药品的颜色、形状和透明度无明显变化。
•湿度为75%下,药品的颜色、形状和透明度无明显变化。
4.2 溶解度与pH值经过稳定性研究后,药品在不同储存条件下的溶解度和pH值变化如下:•温度为25℃下,药品的溶解度和pH值在储存30天后无明显变化。
药物分析中的药物稳定性研究

药物分析中的药物稳定性研究药物稳定性是药物研发和质量控制过程中关键的一个方面。
药物的稳定性研究旨在评估药物在不同条件下的物理、化学和生物学变化情况,以确定药物的有效期和储存条件。
本文将从实验方法、稳定性评估和应用角度对药物稳定性研究进行探讨。
一、实验方法药物稳定性研究通常通过实验室条件下的加速测试来进行,以模拟药物在自然环境下的变化过程。
常见的实验方法有热力学方法、湿热法、光照法、氧化还原法等。
其中,热力学方法常用于评估药物在不同温度下的稳定性变化;湿热法则模拟了药物在高温高湿条件下的降解情况;光照法则研究药物在光照条件下的降解反应;氧化还原法适用于评估药物在体内代谢过程中的稳定性。
二、稳定性评估稳定性评估是药物稳定性研究的核心内容。
主要包括药物降解动力学、降解产物分析和氧化还原反应等方面。
药物降解动力学研究通过测定药物在不同时间点的含量变化,计算药物的降解速率常数,以评估药物的稳定性。
降解产物分析是通过质谱、红外光谱等分析手段,检测和鉴定药物在降解过程中产生的新化合物,从而评估药物降解的机理。
氧化还原反应则用于研究药物在体内代谢过程中的稳定性,通过测定药物在代谢酶作用下的氧化还原反应速率,来推断药物在体内的稳定性。
三、应用稳定性研究在药物研发和质控方面具有重要的应用价值。
首先,药物稳定性评估可为药物研发提供重要的参考依据。
通过对药物在不同条件下的稳定性变化进行研究,可以确定药物的最佳存储条件和有效期,从而保证药物的质量和疗效。
其次,稳定性研究可为药物质控提供科学依据。
通过定期对药物进行稳定性监测,可以及时发现药物的降解反应和变质现象,避免药物失效和毒副作用产生,保障患者的用药安全。
总结药物稳定性研究是药物分析中的重要方面,对药物的开发和质量控制起到至关重要的作用。
通过实验方法的选择与应用,可以评估药物在不同条件下的物理、化学和生物学变化情况。
稳定性评估将药物的降解动力学、降解产物分析和氧化还原反应等方面纳入考虑,从而获取药物的稳定性信息。
药物稳定性的评估与保护

药物稳定性的评估与保护药物稳定性是指药物在储存、制剂过程以及临床应用中,其物理、化学性质保持稳定的能力。
药物稳定性的评估与保护对于保障药物的疗效和安全性至关重要。
本文将探讨药物稳定性的评估方法、常见的稳定性问题以及药物稳定性的保护措施。
一、药物稳定性的评估方法1. 加速试验法加速试验法是评估药物稳定性的常用方法之一。
通过在加速条件下模拟药物的储存和使用环境,如高温、湿度等,观察药物的物化性质的变化情况,以推测其在实际储存和使用中的稳定性。
2. 稳定性研究法稳定性研究法是对药物的稳定性进行长期观察和研究,以了解其在不同条件下的变化规律。
通过在一定时间范围内对药物进行采样和分析,探索药物分子结构的变化,以及其中可能引起药物降解的因素。
二、常见的药物稳定性问题1. 光敏性部分药物对光线敏感,容易发生光降解。
这种降解可能导致药物活性的降低,甚至出现有害物质的产生。
因此,在储存和使用过程中,需要避免药物受到阳光直射,可以采用遮光瓶或者其他光隔离措施。
2. 温度药物的稳定性可能受到温度的影响。
过高的温度可能导致药物的降解,而过低的温度可能引起结晶或其它物理变化,进而影响药物溶解性和稳定性。
因此,储存药物时需注意控制温度,避免药物受热或过度冷藏。
3. 湿度湿度对一些药物的稳定性有一定影响。
过高的湿度可能导致药物吸湿变质,甚至引起微生物污染。
而过低的湿度则可能导致药物的干燥和结晶。
因此,在储存环境中,要注意避免过高或过低的湿度。
三、药物稳定性的保护措施1. 适当的储存条件根据药物的特性,选择适当的储存条件是保护药物稳定性的重要一环。
通常来说,药物应储存在干燥、避光、通风良好的环境中。
此外,还需注意药物的储存温度,尽量避免受到过高或过低的温度影响。
2. 良好的制剂工艺在药物的制剂过程中,制造商需要控制好各个步骤的条件和质量,以确保药物在制剂过程中不受到物理或化学变化的影响。
要注意使用合适的容器和包装材料,以防止药物受到光线、湿度或其他外界环境的影响。
药物分析中的药物稳定性评估方法

药物分析中的药物稳定性评估方法药物稳定性评估方法是药物分析中的关键步骤之一。
药物稳定性评估的目的是通过分析药物在不同条件下的变化,确定其质量稳定性,以保证药物在储存和使用过程中的安全性和有效性。
本文将介绍几种常用的药物稳定性评估方法。
一、热分析法热分析法是常用的药物稳定性评估方法之一。
它通过对药物在高温条件下的变化进行观察和分析,得出药物在高温下的分解情况和稳定性。
常用的热分析方法包括热重分析(TG)和差热分析(DSC)等。
热重分析是一种通过测量样品在升温过程中质量的变化来判断样品热稳定性的方法。
通过热重仪可以得到样品在不同温度下的热分解曲线,从而评估药物在高温下的分解情况。
差热分析是一种通过测量样品与参比物之间的温度差和吸热/放热的情况来评估药物热稳定性的方法。
差热分析曲线可以提供药物在升温过程中的热稳定性信息,包括熔点、热容等参数。
二、湿度分析法湿度是药物分析中常见的影响药物稳定性的因素之一。
湿度分析法通过控制不同湿度条件下药物样品的水分含量,观察药物在不同湿度条件下的稳定性变化。
常用的湿度分析方法包括恒湿箱法和水分测定法等。
恒湿箱法是一种通过将药物样品置于不同湿度的环境中,观察药物在不同湿度下的质量变化情况来评估药物湿度稳定性的方法。
通过测量样品质量的变化,可以得出药物在不同湿度条件下的失重率,从而评估药物的湿度稳定性。
水分测定法是一种通过测量药物样品中的水分含量来评估药物湿度稳定性的方法。
常用的水分测定方法包括卡尔费休法和干燥法等。
通过测量样品中水分的含量,可以得到药物的水分含量和相对湿度之间的关系,从而评估药物的湿度稳定性。
三、光分析法光分析法是一种通过对药物在光照条件下的变化进行观察和分析,评估药物光稳定性的方法。
光稳定性是指药物在光照条件下的分解和色谱性质的变化。
常用的光分析方法包括紫外光谱法和荧光光谱法等。
紫外光谱法通过测量药物在紫外光区域(200-400nm)的吸光度变化,判断药物在光照条件下的稳定性。
药物制剂中的稳定性研究与评价

药物制剂中的稳定性研究与评价稳定性是指药物制剂在规定的储存条件下,其质量特征保持在可接受范围内的能力。
药物稳定性的研究与评价是制药过程中极为重要的环节,它直接关系到药物的质量、疗效和安全性。
本文将探讨药物制剂中的稳定性研究与评价的方法和重要性。
一、稳定性研究方法1. 加速稳定性研究法加速稳定性研究法通过模拟不同环境条件下的药物分解反应,加快反应速率,从而缩短研究周期。
常见的加速稳定性研究方法包括高温储存法、湿热储存法和光照照射法等。
2.实时稳定性研究法实时稳定性研究法是将药物制剂在规定储存条件下长期保存,定期取样检测,观察药物在不同时间点的质量特征变化情况。
该方法能够准确模拟实际储存条件下药物的稳定性。
3.部分因素影响法部分因素影响法是通过研究制剂中某个因素的变化对稳定性的影响,如温度、湿度、光照、氧气浓度等,从而得出关于该因素对药物稳定性的贡献程度的结论。
二、稳定性研究评价指标1.物化指标物化指标主要包括溶解度、颜色、凝胶状态、PH值等。
这些指标能够直观反映药物在储存条件下的物理性质的变化情况。
2.化学指标化学指标是评价药物制剂稳定性的重要依据,主要包括药物分解产物的含量、剂型中其他成分的变化等。
常用的化学指标有高效液相色谱法、紫外分光光度法等。
3.微生物指标微生物指标是针对生物制剂而言的,主要评价药物制剂中微生物的变化情况。
常用的微生物指标有菌落总数、霉菌菌落总数等。
三、稳定性研究与评价的重要性1.保证药物质量稳定性研究与评价能够判断药物制剂在储存条件下的质量变化情况,确保药物在有效期内质量稳定。
2.揭示物质分解规律通过稳定性研究与评价,可以了解药物分解的速率和路径,确定合适的储存条件,延长药物的有效期限。
3.指导药物生产工艺稳定性研究与评价能够为药物生产工艺提供科学依据,指导制剂工艺的改进和调整,提高产品质量稳定性。
4.制定药物储存条件稳定性研究和评价还可为药物的储存条件的确定提供依据,并规范药物经销环节中的运输和储存,保证药品的质量和安全性。
药物的稳定性的方法

药物的稳定性的方法
药物的稳定性通常可以通过以下几种方法来评估和检测:
1. 热稳定性测试:将药物样品暴露在高温环境下,以模拟储存和运输中可能遇到的条件,并监测其物化性质和活性是否发生变化。
2. 光稳定性测试:将药物样品暴露在不同光照条件下,以模拟储存和使用中可能遇到的条件,检测其对光的敏感性和耐受性。
3. 湿度稳定性测试:将药物样品暴露在高湿度的环境下,以模拟储存和使用中可能遇到的条件,检测其是否受潮或发生分解。
4. pH稳定性测试:将药物样品在不同pH值的缓冲液中处理,以模拟消化系统中可能遇到的条件,检测其在不同酸碱环境中的稳定性。
5. 离子强度稳定性测试:将药物样品在不同离子强度的溶液中处理,以模拟储存和使用中可能遇到的条件,检测其在不同离子强度下的稳定性。
6. 加速稳定性测试:将药物样品暴露在高温高湿度的环境下,或进行冻融循环,加速评估其稳定性。
这些方法可以帮助药物研究人员评估药物的稳定性和改进药物的质量控制。
药物制剂中的药物稳定性研究与控制

药物制剂中的药物稳定性研究与控制随着科技的进步和医学的发展,药物制剂在医疗领域的应用越来越广泛。
然而,在药物制剂中,药物的稳定性是一个关键的问题。
本文将就药物制剂中的药物稳定性进行研究和探讨,并提出相应的控制措施。
一、药物稳定性的概念和重要性药物稳定性是指药物在一定条件下,在所要求的有效期内,保持规定质量和活性的能力。
药物的稳定性直接影响其疗效和安全性,因此成为药物制剂研制过程中必须要重视的因素。
二、影响药物稳定性的因素1.光照:光照是药物制剂中常见的影响因素之一。
光可以引起药物分子的电子迁移和氧化反应,导致药物降解。
2.温度:温度是影响药物稳定性的重要因素。
温度过高会使药物分子的振动增强,分子间的相互作用力减弱,从而导致药物分子的结构破坏和降解,影响药物的活性。
3.湿度:湿度对药物的稳定性也有一定的影响。
过高的湿度会导致药物分子的水解,从而引起药物的降解和失效。
4.酸碱性:药物的酸碱性也会影响其稳定性。
在酸性条件下,某些药物容易发生酸解或酸催化反应,导致药物的降解。
5.氧气:氧气是引发药物氧化反应的重要因素。
药物在氧气存在下容易发生氧化反应,导致药物的降解和失效。
三、药物稳定性的研究方法为了探索和评价药物的稳定性,科学家们开发了多种研究方法。
其中包括以下几种常见的方法:1.热分析法:热分析法主要包括热重分析(TGA)和差示扫描量热法(DSC)。
通过测定药物在不同温度下的热稳定性,可以评估药物的热稳定性。
2.光谱分析法:光谱分析法主要包括紫外-可见光谱(UV-Vis)和红外光谱(IR)等。
通过测定药物在光照条件下的光谱变化,可以评估药物的光稳定性。
3.湿度测定法:湿度测定法主要是通过测定药物在不同湿度条件下的含水量来评估药物的湿稳定性。
4.氧气吸收法:氧气吸收法主要是通过测定药物在氧气存在条件下的氧气吸收量,来评估药物的氧稳定性。
四、药物稳定性的控制措施为了保证药物制剂的质量和活性,制药工程师们采取了一系列控制措施。
药物制剂的稳定性研究与改进

药物制剂的稳定性研究与改进药物制剂的稳定性是制药工艺中非常重要的一个环节,它直接关系到药物的质量和疗效。
本文将就药物制剂的稳定性进行研究,并提出改进的方法和措施,以期提升药物制剂的稳定性,确保药物的安全性和疗效。
一、药物制剂的稳定性现状分析药物制剂的稳定性研究前需要对其现状进行深入分析。
稳定性研究的主要内容包括药物的物理、化学稳定性以及微生物污染等方面。
通过对已有数据和案例的总结和分析,掌握药物制剂在不同储存条件下的变化规律和影响因素,为后续的研究和改进提供依据。
二、药物制剂稳定性研究方法要深入研究药物制剂的稳定性,需要选取合适的研究方法。
常用的研究方法包括HPLC、GC、IR、UV、NMR等,这些方法可以用于药物制剂样品的质量分析和组成分析,从而得出药物制剂的稳定性情况。
同时,也可以借助各类仪器设备进行储存条件模拟实验,模拟不同温度、湿度、光照等条件下药物制剂的变化规律。
三、药物制剂稳定性改进方法与措施基于药物制剂稳定性研究的结果,我们可以针对不同药物制剂的特点提出相应的改进方法和措施。
1. 优化配方:针对药物制剂中存在的低稳定性成分,可以尝试调整药物的配方,增加辅料或添加剂的含量,以提高整个药物制剂的稳定性。
2. 改进工艺:制药工艺是影响药物制剂稳定性的重要因素之一。
通过对传统工艺的改进和创新,选择更合适的工艺参数和操作步骤,可以有效提升药物制剂的稳定性。
3. 储存条件优化:正确选择药物制剂的储存条件也是确保其稳定性的重要环节。
要选择适当的温度、湿度、光照等因素进行控制,避免药物制剂受到不利环境的影响。
4. 包装改进:药物制剂的包装材料也是影响稳定性的一个方面。
选择合适的包装材料,确保其对药物制剂的保护性能,避免药物受到外界环境的污染和侵害。
5. 检测手段更新:随着科学技术的不断进步,新的药物分析方法和检测手段也不断涌现。
及时掌握这些新技术,使用更精准、敏感的方法进行药物制剂稳定性的分析和评估。
药物分析中的色谱技术测定药物稳定性

药物分析中的色谱技术测定药物稳定性在药物研发过程中,药物的稳定性是一个十分重要的指标。
药物在储存和使用过程中的稳定性直接关系到其疗效和安全性。
为了准确评估和监测药物的稳定性,色谱技术被广泛应用于药物分析中。
本文将介绍色谱技术在药物分析中测定药物稳定性方面的应用和意义。
一、药物分析中的色谱技术简介色谱技术是一种将混合物中的各个组分分离并测定其含量的方法。
其原理是基于组分在固定或液动相中的分配系数和分配行为不同而实现分离。
常见的色谱技术包括气相色谱(GC)、液相色谱(HPLC)等。
这些技术具有高效、灵敏、精确和可靠的特点,被广泛应用于药物分析领域。
二、色谱技术在药物稳定性研究中的应用药物的稳定性研究是药物研发过程中必不可少的一环,其目的是评估药物在不同条件下的稳定性和寿命。
而色谱技术作为一种精密的分析方法,可以用于测定药物在不同环境因素下的分解、降解和生成产物数量的变化,从而评估药物的稳定性。
1. GC技术在药物分析中的应用气相色谱技术(GC)是一种基于气体载流相的分析方法,特点是分离效果好、峰形尖、灵敏度高。
在药物分析中,GC常用于测定药物中的杂质物质、挥发性成分、酸碱度以及药物的纯度等。
通过GC技术,可以准确分离和定量分析药物中的各个组分,从而评估药物的稳定性。
2. HPLC技术在药物分析中的应用液相色谱技术(HPLC)是一种基于液相载流相的分析方法,特点是分离效果好、分离速度快、灵敏度高。
在药物分析中,HPLC广泛用于药物中主要成分和杂质污染物的分离和定量分析。
通过HPLC技术,可以精确测定药物中的各个成分的含量和相关参数,帮助评估药物的稳定性。
三、药物稳定性测定的方法与参数在药物稳定性测定中,常用的方法是通过某种条件(如温度、湿度等)对药物进行加速实验,然后使用色谱技术分析样品中各个组分的变化,从而确定药物的稳定性。
常用的测量参数包括:1. 相对保留时间(RRT)相对保留时间是指药物和内标、杂质之间在色谱柱中的相对位置关系。
已分装药品稳定性分析

已分装药品稳定性分析作者:赵红梅来源:《科学与财富》2017年第20期(哈药集团生物工程有限公司)摘要:目的:探究同一药品分装后不同时期下药品成分状态是否稳定,以此对推动药品存放管理方式改进与完善,保证药品质量合格,避免用药安全问题发生。
方法:选择药房中最常见药品维生素B1以及乙酰氨基酚片作为实验对象,依据操作标准对药品进行样品分装,根据《中国药典》中药品含量测量方式对不同时期下药品成分含量进行检测。
结果:维生素B1在拆分一个月左右开始失效,乙酰氨基酚片在测试时间内并无明显变化,具体测试结果要通过进一步实验进行分析。
结论:与维生素B1相同的见光易分解、易受潮氧化类药品有效期通常较短,而乙酰氨基酚这类药性稳定的药品保质期相对较长,因此已分装药品根据药品特性不同其有效期限也不同,需要分装人员全面掌握药品特性,科学合理地选择药品存放环境,保证药品稳定性与质量,促进用药安全性提升。
关键词:已分装药品;稳定性;实验测定已分装药品是药房根据医嘱对患者所需药品剂量进行重新分装,以符合患者用药需求的一种措施,一般会将药品原有包装拆开,把药品经过剂量调整后放入合适大小的药袋中。
对药品进行拆分主要为了达到以下几个目的:(1)减少药品浪费。
患者可以根据病情需要购买适量药品,与病情进展相配合,有效降低药品资源浪费;(2)防止患者用药剂量不清,出现过量服用或服用剂量不足等问题,导致药效降低,产生用药安全问题;(3)降低用药支出,有利于经济效益提升,减缓财政压力。
但药品的分装同样存在问题,当进行分装后,其药品所处环境与保存条件与原有包装不同,若保存不当会使药性发生改变,产生安全隐患。
通常药品会因环境潮湿出现受潮,而受其他因素影响还会使药品性状产生变化,降低药效甚至出现变质问题,误服用变质药品不仅无法缓解病症,还会对人体造成极大伤害,因此有必要对已分装药品不同时期药性进行测量,以明确有效日期,并为存放条件的改进提供依据,保证药品质量稳定。
药品稳定性考察怎么总结分析

药品稳定性考察,怎么总结分析?对于药品生产企业中非研发人员来说,我们应当如何认识、理解药品稳定性问题?面对我们日常管理中的几件事,我们应当如何做呢?做到什么程度呢?今天,就以上几个问题,谈谈我个人的理解与看法,希望能抛砖引玉。
一、药品商业批生产阶段,稳定性分析的目的和工作内容是什么?对于非研发人员的我们来说,在我们手中生产的,和我们面对的是商业批药品,它们的有效期已经有了,是不能随意改变的,如要改变,则需要上报药监局批准才可以的。
(比如,4、5年前,我们的头孢拉定颗粒,原有效期是3年,但发现,含量在2年多时,就低于下限90%了,所以,经报备后缩短为现在的2年。
)1、商业批生产阶段,我们做稳定性分析的目的是什么?1.1、对已有的有效期,是否适合,进行校验,以规避风险;如上面的“头孢拉定颗粒”例子。
1.2、对稳定性很好的药品,可考虑延长其有效期,以提高企业经济效益和质量声誉;1.3、在缺少研发阶段稳定性数据和资料的情况下,建立每个药品的基础“稳定性”图谱;1.4、为商业批生产过程中,变更原辅料品种或增加供应商,提供可比较标准和数据,以便备案;1.5、为商业批生产过程中,出现中等及以上级偏差时,评估其对偏差批质量的影响程度,是否可以放行;1.6、为商业批生产管理中,研究分析产品批次之间,是否稳定,是否有显著性差异,是对首次工艺验证,再验证,以及持续性工艺验证,对产品是否稳定,是否受控,的延续和深入;更是终极证明的方法;注:2010版GMP第231条持续稳定性考察的目的是在有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。
2、商业批生产阶段,我们做稳定性分析的工作内容有哪些?2.1、根据GMP要求,每年每个品种,至少留一批,做持续性稳定性考察;2.2、考察方案(GMP害人的地方,一提的方案,马上让人产生“八股”的情绪,其实,也就是干这个活必须要考虑的几个方面问题,考虑不到,就可能得不到科学合理的结果,当然这个结果或许是预期的,或许是不想要的,处理起来很麻烦的)至少要涵盖8方面内容:1、每种规格、每个生产批量药品的考察批次数;2、相关的物理、化学、微生物和生物学检验方法,可考虑采用稳定性考察专属的检验方法;3、检验方法依据;4、合格标准;5、容器密封系统的描述;6、试验间隔时间(测试时间点);7、贮存条件(应当采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的长期稳定性试验标准条件);(比如我们现在碰到的“阴凉”贮存产品的长期稳定性试验目前是放在阴凉留样室内,而不是药典要求的标准条件问题。
药品配置后的稳定性
药品配置后的稳定性注射用药品在使用过程中,往往需要加在一定的输液中,经再配置,然后给病人使用。
配置后药品稳定性问题可归结为以下三个方面(一)化学作用包括药品与输液之间、药品与药品之间的作用。
这种作用更受到外界因素(温度、光、金属离子等)的影响,受它们的催化,加速反应的进行,最终影响药品的稳定性。
(二)物理作用例如TPN中离子对乳剂稳定性的影响,阳离子中和乳滴的表面电荷,破坏水化膜,从而引起分层,聚合,絮凝,甚至破乳。
(三)微生物的污染影响配置后药品稳定性的因素(一)温度对于多数反应,温度每升高10℃,反应速度增加2-4倍。
(二)酸碱度如青霉素钠,在中性溶液中较为稳定,酸性或碱性加强均可加速分解。
美洛西林钠与酸性药物(pH4.5以下)配伍产生沉淀,与碱性药物(pH8.0以上)配伍降低效价。
红霉素在酸性溶液中也更易降低效价。
(三)浓度如氨苄青霉素浓度愈高,稳定性愈差。
(四)光线光和热一样,能提供产生化学反应所必需的活化能。
药品的光分解通常是吸收了阳光中的紫光和/或紫外线引起。
药品对光是否敏感取决于药物的结构,如肾上腺素、多巴胺(含酚羟基),维生素E(含不饱和双键),喹诺酮(含卤素)都较敏感。
(五)金属离子如Vit C的氧化,在铜离子存在下,反应更为迅速。
(六)其他例如紫三醇注射液与PVC容器的作用。
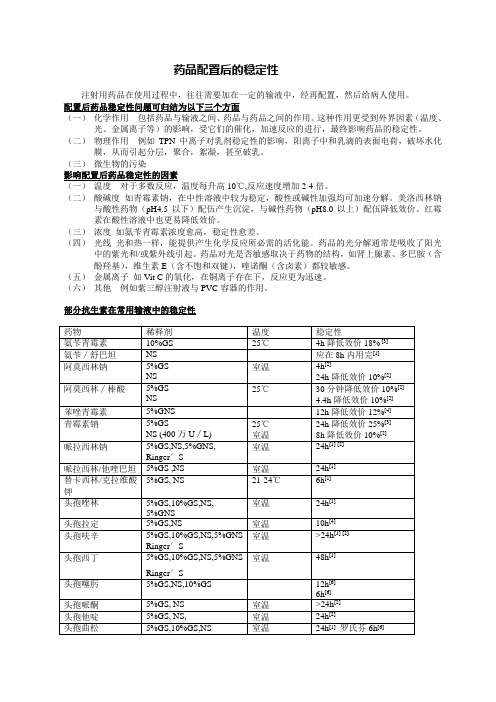
部分抗生素在常用输液中的稳定性部分药物的溶媒选择奥沙利铂- ---------------GS奈达铂---- ---------------NS (pH5以下不稳定)精氨酸--------------------5%GS易善复--------------------GS思美泰--------------------复方NaCL(C a2+)×世奥-----------------------复方NaCL(C a2+)×头孢拉定(Co32-)-----复方NaCL×阿莫西林/棒酸------- NS部分药物的浓度或容量要求VP16 ≤0.125g/500mlCTX NS20—30ml庆大qd>300ml丁卡 100-200ml妥布、依替米星 100ml泰能100ml阿昔洛韦>100ml万古霉素≥100ml氢可 20ml(0.1)/500ml阿米福汀 50ml参考文献[1] 药品注射剂使用指南[2] 注射药物相容性手册[3] Handbook on Injectable Drugs[4]《药物临床信息参考》美康B[5] 黑龙江护理杂志2000,6(5):9[6] 药品说明书[7] 医药导报2004,23(1):55[8] 中国药事2003,17(10):636。
药物稳定性试验统计分析方法

药物稳定性试验统计分析方法在确定有效期的统计分析过程中,一般选择可以定量的指标进行处理,通常根据药物含量变化计算,按照长期试验测定数值,以标示量%对时间进行直线回归,获得回归方程,求出各时间点标示量的计算值(y'),然后计算标示量(y')95%单侧可信限的置信区间为y'±z ,其中:2202)()(1X Xi X X N S t z N -∑-+⋅⋅=- (12-21)式中,t N -2—概率0.05,自由度N-2的t 单侧分布值(见表12-4),N 为数组;X 0—给定自变量;X —自变量X 的平均值;2-=N QS (12-22) 式中,xy yy bL L Q -=;L yy —y 的离差平方和,N y y L yy /)(22∑-∑=;L xy —xy 的离差乘积之和N y x xy L xy /))((∑∑-∑=;b —直线斜率。
将有关点连接可得出分布于回归线两侧的曲线。
取质量标准中规定的含量低限(根据各品种实际规定限度确定)与置信区间下界线相交点对应的时间,即为药物的有效期。
根据情况也可拟合为二次或三次方程或对数函数方程。
此种方式确定的药物有效期,在药物标签及说明书中均指明什么温度下保存,不得使用“室温”之类的名词。
例:某药物在温度25±2℃,相对温度60±10%的条件下进行长期实验,得各时间的标示量如表12-4。
表12-4 供试品各时间的标示量时间/月 0 3 6 9 12 18 标示量/%99.397.697.398.496.094.0以时间为自变量(x ),标示量%(y )为因变量进行回归,得回归方程 y= 99.18-0.26x ,r=0.8970,查T 单侧分布表,当自由度为4,P=0.05得 t N -2=2.1329279.04444.32==-=N Q S 210)(2=-∑X X i当X 0=0时,(即0月)2202)()(1X X X X N S t z i N -∑-+⋅⋅=- = 2.132×0.9297×210)80(612-+= 1.356按回归方程计算0月时的y'值得99.18%,则y'值置信区间y'±z ,即:99.18 + 1.356=100.54 99.18-1.356=97.82其他各时间(3、6、9、12、18月)的y'及置信区间按同法计算,结果见表12-5。
生物药物稳定性分析

生物药物稳定性分析生物药物稳定性分析旨在确定生物药物在特定的储存条件和时间下,其化学、物理、微生物学和生物学性质的变化程度。
研究生物药物的稳定性对于评估可能导致药品聚集和降解的因素的敏感性至关重要。
这些因素会影响药物的生物活性、产品的安全性以及质量。
环境因素(例如温度、氧气暴露或 pH 值变化)、表面吸附以及与赋形剂的相互作用都会影响药品稳定性,而生物药物稳定性变化会改变蛋白质折叠和蛋白质三维结构,从而影响药物功效。
通过精确评估药物在各种环境因素下的稳定性,有助于预测和控制可能的变化,从而为药物的开发、生产、储存和临床应用提供关键支持。
此外,稳定性分析也是药品注册和上市的重要环节,对推动生物药物产业的持续健康发展具有深远意义。
百泰派克生物科技(BTP)通过CNAS/ISO9001双重质量体系认证,建立七大检测平台,开发并验证了生物药物稳定性分析方法,为您提供各种类型的生物药物稳定性分析,包括蛋白质、单克隆抗体、疫苗、聚乙二醇化蛋白质、寡核苷酸、糖蛋白和生物仿制药等,我们通过理化性质、结构、聚集、生物活性、视觉外观、杂质等方面评估药物加速稳定性、短期和长期稳定性。
欢迎免费咨询,了解更多详情!关于样品。
样本类型。
药物液体制剂。
API溶液。
细胞培养液。
血浆或血清。
血液组织。
样本数量。
1-10ml。
1-10ml。
1-10ml。
1-10ml。
1-100ml。
中/英文项目报告。
在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1.实验步骤(中英文)。
2.相关的质谱参数(中英文)。
3.生物药物稳定性分析详细信息。
4.质谱图片。
5.原始数据。
生物药物稳定性分析一站式服务。
您只需下单-寄送样品。
百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
已分装药品稳定性分析王 静(成都市第七人民医院,四川成都621000) [摘要] 目的:通过对选定药品分装后不同时期的含量测定分析,对医院协定处方分装药品的管理、存放、使用提出合理的建议,保证医院用药的安全。
方法:将选定药品在规定环境下分装留样,依据《中国药典》2005版第二部对已选定药品按规定时间进度进行含量测定。
结果:维生素B1片等见光易分解药品及部分易氧化,潮解的药品有效期在一个月左右;对乙酰氨基酚片等性质较稳定的药品有效期需通过更多测试获得。
结论:不同性质的药品分装后有效期不一样,应按药品性质选择合适的药品包装材料及存放环境,并在分装药品的外包装上注明药品使用的各项必要信息,特别是使用的有效期。
[关键词] 拆零药品;含量测定;有效 [中图分类号]R 954 [文献标识码]A [文章编号]1003-403X (2008)03-0212-02 A nalyzing the Stability of Sub 2Packa ge Dr ugs/Wang Jing ∥Th e No 7Peop le ’s Ho spital o f Ch engdu ,Ch engdu 621000,Chi 2na 1 Abstract Objective :T o obtain reas onable sugges ti on of drug management ,s torag e ,and use by determin ing the content of selectedsub 2package dru g in di fferen t period ,,which is helpful to ensure the s afety of drugs 1Methods :T he sub 2samples of selected drugs were treated under the given conditions ,then their content w ere determined in the required time based on part II of the “Chines e Pharma 2copoeia ”2005v ersion 1Results :The lim itation period of drugs which are easy t o decomposition under light ,such as v itam in B1tablets ,and other drugs eas y to ox idation is ab out one m on th 1The limitation period of stable drugs as Paracetam ol tab lets need m ore test to be ob 2tained 1Conclusio n :T he limitation period o f sub 2packag ing dru gs is qu ite d ifferen t accordin g to their nature 1So the suitable drug packag 2ing materials and s torage env ironment sh ould be ch osen according t o their nature 1And the necessary in formation ,especially lim itation peri 2od need t o be marked on th e packag e 1 K ey w or ds D isman tle Drugs ;C ontent Determination;Lim itation Period 1 拆零药品是指医院药房药师与临床医师为了满足不同患者疾病的需求,根据共同协商制定的处方用量进行调配时,将药品原包装拆除后重新装于口服药袋或外用药袋中,交给患者使用的药品。
使用拆零药品有以下好处:①方便患者根据病情需要和药品使用特点予以购买,节省药物资源。
②有利于特殊人群,如老年人和儿童用药[2]。
③从社会医疗体系来看,拆零药品的应用减少了药品总支出,效益明显[3]。
但是药品经过拆零后销售,在贮存、保管方面都有别于原包装,一般易出现以下质量问题:①药品外观性状的改变;②药品水分超标,尤其是易潮解的药品;③药品药物含量降低,甚至变质[1]。
上述情况均会导致药品有效期或保质期发生改变,药效降低或失效,甚至可能导致毒性增加,副作用增大[4]。
因此,对拆零药品进行有效期的考察是保证药品质量和用药安全的重要环节。
1 材料与方法1 试验药品与仪器 在进行试验药品选择前,首先对各拆零药品稳定性进行文献调研,从药品的稳定性出发,结合医院实际条件,选择维生素B1片、对乙酰氨基酚片进行含量测定。
因为:①维生素类药品稳定性较差,多数见光易分解、易氧化、易潮解。
对其含量进行测定,有利于获得多数稳定性较差药品的拆零后有效期的范围。
②对乙酰氨基酚片性质稳定,多数情况下含量均不易产生变化,进行含量测定后,可用于推测化学稳定性高的药品拆零后的保存期限。
11111 试药:维生素B1片(20070408,20070606,天津金世制药有限公司);对乙酰氨基酚片(071006,迪奥集团成都药业股份有限公司);稀盐酸(20070101,20071004,湖南尔康制药有限公司);氢氧化钠片状(20071216,天津市科密欧化学试剂有限公司)。
11112 仪器:电子天平(梅特勒托利多A L104,梅特勒-托利多仪器(上海)有限公司);紫外分光光度计(T U1810PC ,北京普析通用仪器有限责任公司);电热恒温鼓风干燥箱(DHG 29070型,上海精宏实验设备有限公司)。
1 方法··第27卷第3期Vol 127NO 13四川省卫生管理干部学院学报JOURN AL OF SICH UAN C ONTIN UING EDUC ATION C OLLEGE OF MS2008年9月S ept 120081112212 取试验药品分别于拆分后0、7、14、28、56、84天进行含量测定。
11211 维生素B1片:取本品20片,研细,精密称取适量(相当于维生素B 125m g),置100ml 量瓶中,加盐酸溶液(9→1000)70ml ,振摇15分钟使维生素B 1溶解,加盐酸溶液(9→1000)稀释至刻度,摇匀,用干燥滤纸滤过,精密量取续滤液5m l ,置另一100ml 量瓶中,再加盐酸溶液(9→1000)稀释至刻度,摇匀,照分光光度法(《中国药典》2005年版附录ⅣA ),在246nm 的波长处测定吸收度,按C 12H 17C l N 4OS ·HC l 的吸收系数(E 1%1cm )为421计算。
标示量应在90%~110%范围之内,且RS D 小于1%,则样品含量测定符合要求。
C x =A xE 1%1cm ·L 标示量%=A ×D ×�W E1%1cm×100×W ×标示量×100%11212 对乙酰氨基酚片:取本品10片,研细,精密称取适量(相当于对乙酰氨基酚40mg ),置250ml 量瓶中,加014%氢氧化钠溶液50ml 与水50ml ,振摇15分钟,加水至刻度,摇匀,滤过,精密量取续滤液5ml ,置100m l 量瓶中,再加014%氢氧化钠溶液10ml ,加水至刻度,摇匀,照分光光度法(《中国药典》2005年版附录ⅣA ),在257nm 的波长处测定吸收度,按C 8H 9N OS 2的吸收系数(E 1%1cm )为715计算。
标示量应在90%~110%范围之内,且RSD 小于1%,则样品含量测定符合要求。
2 结果 将维生素B1片、对乙酰氨基酚片的拆零药品,从拆零之日起,按表1中的时间间隔进行含量测定。
发现拆零药品中,维生素B1片在实验第28天的测定中,平均标示量和含量达到标准的临界值,在第56天的测定时,不符合标准或出现异常变化,推测这两个品种在当前包装形式和储存条件下使用期在一个月左右。
对乙酰氨基酚片在目前的实验过程中,含量变化不明显,且均在合格范围内,其分装后的存放期有待后续实验确定。
见表1。
表1 拆零药品平均标示量测定(%)药品名称批号拆分时间(d )714285684维生素B 1200706069518295113921839017696115961112007040896105941619413901689612694182对乙酰氨基酚07100610112998194991519817298179981673 讨论311 由对乙酰氨基酚的耐用性试验可以看出,随放置时间的延长,对乙酰氨基酚吸光度增加,而从长期性试验看,对乙酰氨基酚的吸光度随时间延长呈递减状态,这一现象的出现可能由于对乙酰氨基酚在短时间内产生的代谢产物在相近波长处有吸收,但经过一定时间后,这种吸收减弱甚至消失,对于长期稳定性实验影响不大。
312 维生素B1片在存放28天后,含量已经接近于临界有效期,但是在之后的测定中,出现含量的异常升高,经加速实验后,含量并没有进一步上升,反有再次下降趋势,该现象有待于进一步实验进行解释。
313 由于实验所用药品均是由医院药库直接提供,所以因为药库购药的程序和进度,部分实验药品批号不全或者存放用量不够。
对实验的准确度产生影响。
314 对于有效期较短的药品,在制定留样观察的时间段时,间隔时间过长,对于标示量的变化趋势掌握不明确,影响了结果的准确性。
[参考文献][1] 邢小升.中心供药室拆零药品的保管[J ].安徽医药,2002;6(3):66.[2] 郑高峰,熊 华,张玉红.医院门诊药房药品拆零配方的利弊及对策[J ].药事组织,2007;16(8):47.[3] 蒋 渝,王晓华.医院协定处方与合理用药[J ].四川医学,2003;24(1):92.[4] 李 旭.药品拆零销售待改进[N].医药经济报,2007207218(A02).[5] 中国药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2005.(2008-09-11收稿)·3·27卷3期王 静:已分装药品稳定性分析200812。
