钒电池中高浓度VOSO4水溶液黏度预测
温度和浓度对钒电池电解液性能影响研究进展

2 . N AR I G r o u pC o r p o r a t i o n( s t a t eG r i dE l e c t r i cP o we r R e s e a r c hI n s t i t u t e ) , Na n j i n gJ i a n g s u2 1 1 0 0 0 , C h i n a ;
摘要 : 全钒 液流电池作为智能 电网建设 中的重要支撑环节 。 广泛应用 于电网发电、 输 电、 变电 、 配电、 用 电各个环节 。 电解 液作为
全钒液流 电池的活性 物质 。 决定 了全钒液流 电池 的储 存能量。 电解液作为全钒 液流 电池 的重 要组成部分 , 其性能直接 影响全钒 液流 电池的效率 。 从提 高全钒 液流电池电解液性能的角度 出发 。 针对影晌 电解液性 能的温度和浓度两个重要因素 , 介绍 了其影
响 电解 液性 能 的 原 理 , 总 结 了 国 内外 近 年来 的 相 关 研 究 。
关键词 : 温度 ; 浓度; 电解液 ; 性能 中图分 类号 : T M 9 1 2 文献标识码 : A 文章编号 : 1 0 0 2 — 0 8 7 X( 2 0 1 7 ) 0 2 — 0 3 2 8 — 0 3
v a n a d i u m f l o w b a k e r i e s . i t s p e f r or ma n c e d i r e c t l y a f e c t e d t h e e fi c i e n c y o f v a n a d i u m f l o w b a t t e r i e s . To pr o c e e d f r O m t h e t wo i mp o r t a n t f a c t o r s o f i mp r o v i n g t h e pe f r o r ma n c e o f e l e c t r o l y t e , t e mp e r a t u r e a n d t h e c o n c e n t r a t i o n o f e l e c t r o l y t e we r e
用从石煤中提取的V_2O_5制备钒电池用VOSO_4的研究

( 1) V 2 O 5 —— H 2SO 4 ——草酸、 酒石酸及蔗糖、 肼、 甲酸及乙酸法 ;
其中方法 ( 1) 的还原剂全为有机物 , 还原能力较弱, 反应 速度慢 , 并有 CO 2 产生 , 试剂用 量较大 , 成本 高 , 且还原剂过量时不宜排出。 方法( 2) , H 2 S 还原性 好 , 反应速 度较快。但该气体 在水中溶解度小 ( ≤ 0. 1M ) , 毒性大, 使用时不宜控制。方法 ( 3) 引进了 Fe 离子杂质 , 对 V OSO 4 作电池不利。 所以我们在研 究中选用了方法( 4) 。 该法还原能力强 , 反应速度快,
V 2O 5 + H 2 SO 4 → 过滤
加热、 活化
高温度可使 V 2O 5 活化时的 H 2 SO 4 用量明显降低。
冷却、 稀释
加还原剂
钒还原 →
常压, ~100 ℃
脱水、 干燥
产品
图 1 改进后 V OSO 4 制备实验工艺流程 3. 2 实验原料与设备 3. 2. 1 原料 ( 1) V 2O 5 ( 冶金级 ) : V 2O 5 含量大于 98% , 黄色 固体粉末 ; ( 2) H 2 SO 4 : 分析纯, 浓度 98% ; ( 3) H 2SO 3: 分析 纯, SO 2 含量 ( 以重 量计 ) 不少 于 6% 。 3. 2. 2 设备: ( 1) 791 型磁力加热搅拌器 ( 2) 可控温电炉 ( 3) DT — 100 光电天平 ( 4) 水浴锅 ( 5) 电热恒温真空干燥箱 ( 6) 2XZ- 1 型旋片式真空泵
7〕 化的有效途径。根据 B. A . 等人 〔 的研究结 À ¹ ½ À ³ 果 , 该溶解反应的反应式为 : V 2 O 5 + 4H 2SO 4 + H 2O V 2 O 5· 4SO 3 ·5H 2 O ………… ( 1) 〔 6〕 + 2
全钒氧化还原液流电池文献综述 (1)

全钒氧化还原液流电池通过阅读了一些关于全钒氧化还原液流电池的文献,我们实验小组对其做了一个总结。
我们从六个方面介绍:一、全钒氧化还原液流电池的简述;二、电解液的制备方法;三、电解液的优化;四、全钒氧化还原液流电池氧化还原动力学;五、钒电池充电过程中的副反应;六、实验方法简介。
一、全钒氧化还原液流电池的简述1.1 组成及概述钒电池是单金属系统的氧化还原液流电池,它主要由电极、液流电解质、电池隔膜、储液槽、反应电堆等组成。
不同价态的钒离子溶液分别作为正负极活性物质,通过外接泵把溶液从储液槽压入电池堆体内完成电化学反应之后,溶液又回到储液槽液态的活性物质不断循环流动。
选择合适的电极材料,可以提高钒氧化还原的电化学活性,最终实现钒电池能量效率的提高,钒电池电极材料有碳素类的如石墨、碳布、碳毡等,也有金属类的如 Pb 、Ti 等,还有导电聚合物或者聚合物混合物复合电极,有时,还要对电极的表面进行处理,以提高其性能。
适用于钒电池的隔膜必须是亲水性的,允许 H+自由通过,但是又要求必须能抑制正负极电解液中不同价态的钒离子的相互混合,避免了电池内部短路。
抑制了电池的自放电,从而延长了电池的寿命,这就要求选用具有良好导电性和选择性的离子交换膜。
一般选用交换 H+的阳离子交换膜,也有用 Nafion 膜的,但价格较贵。
钒电池采用钒的不同价态离子溶液作为电解液其中混合有硫酸作为支持电解质,钒电池的正极物质为V5+溶液,负极物质为V4+溶液,钒电池的溶液既是电极活性物质又是电解液,要求要能够长期稳定,存在并且要有好的化学活性,同时希望能尽量提高溶液的浓度以增加单位体积的储能能力。
1.2优点1) 电池的额定功率和额定能量是独立的,功率大小取决于电池堆,能量大小取决于电解液的体积和浓度,在使用中可以通过调节电解液的量来随意调节电池的容量;2) 在钒电池充放电期间电池内部只发生液相反应,不像普通电池那样有复杂的可引起电池电流中断或短路的固相反应,因此使用起来安全,性能可靠;3) 电池的保存期无限,储存寿命长,因为钒电池的电解液是循环使用的,不存在变质问题,只是长期使用后,电池隔膜电阻有所增加;4) 钒电池可实现真正意义上的深放电,钒电池的电化学反应是液相反应,可100%充放循环而不会影响电池性能;5) 钒电池电化学反应迅速,可快速充电及大电流密度放电;6) 钒电池具有类似于燃料电池的结构特点,它的反应电堆与储存电解液的槽体是相独立的,可通过更换电解液来实现能量的瞬间补充。
分光光度法测定全钒液流电池钒电解液中磷含量的不确定度评定

2017年01月分光光度法测定全钒液流电池钒电解液中磷含量的不确定度评定刘月菊张鹏姜雪莲(大连博融新材料有限公司,辽宁大连116450)摘要:本文叙述了铋磷钼蓝分光光度法测定全钒液流电池钒电解液中磷含量测定的不确定度评定方法。
通过对溶液配制过程和仪器测定过程的各种不确定度影响因素的评估,建立了全钒液流电池钒电解液中磷含量测定的不确定度评定数学模型,从而为测定的准确性提供了理论基础。
关键词:不确定度;分光光度法;全钒液流电池,钒电解液;磷全钒液流电池(Vanadium Redox Battery,缩写为VRB)[1],是一种液态氧化还原电池,也是一种新型清洁能源存储装置[2]。
与其他类型电池相比,具有功率大、寿命长、可靠性高、操作和维修费用少等明显的技术优势[3],因此在储能行业具备无可估量的发展潜力,甚至有可能将改变未来的能源格局。
而钒电解液组成成份含量的高低、杂质的含量,以及添加剂的用量会严重影响电池中膜及电极的寿命。
因此其成分检测方法,备受重视。
全钒液流电池电解液是硫酸、硫酸钒(V2(SO4)3)和硫酸氧钒(VOSO4)的混合溶液,在其中添加磷酸可以提高电池电解液的性能。
因此准确测定钒电解液中的磷含量,对全钒液流电池的性能提高和商业推广十分重要。
使用铋磷钼蓝分光光度法测定电解液中的磷含量,快速、准确、高效的满足了电解液大规模生产的要求。
而测量不确定度是与测量结果相关联的参数,它表征了可以合理的赋予被测对象的数值的分散程度。
由于其具有广泛的应用性与实用性,因此对测量不确定度的评定非常重要。
本文主要针对铋磷钼蓝分光光度法测定钒电解液中磷含量的测量结果不确定度进行了分析和评估。
1实验部分1.1原理在硝酸介质中,磷酸中的磷与铋及钼酸铵生成络合物,以抗坏血酸还原成磷钼蓝,于分光光度计700nm处,测量其吸光度。
测量方法依据标准:GB/T24583.5-2009。
1.2主要仪器设备T6紫外-可见分光光度计和30mm比色皿;2mL移液管;50mL、500mL、1000mL容量瓶。
专项训练 与金属钒有关的化工流程题

专项训练与金属钒有关的化工流程题1.钒是一种重要的金属材料,其用途之一是制备催化剂,如接触法生产硫酸中使用的催化剂(主要成分V2O5、V2O4)。
利用废催化剂回收制备V2O5的工艺流程如下:已知:20 ℃时,NH4VO3的K sp=1.68×10-2回答下列问题:(1)步骤①为提高浸取效率采取方法有________(任写两条)。
(2)步骤②中反应的氧化剂是______________________。
(3)步骤③中Cl被还原为Cl-,该反应的离子方程式为_________________。
(4)步骤④中,离子交换效率与pH的关系如图,为提高交换效率应控制的pH范围是_____________________________________________________________。
(5)步骤⑤所发生反应的离子方程式为 _____________________________。
若母液中N的浓度为1.0 mol·L-1,则c(V)=____________________。
(6)全钒电池是以溶解在一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为电极反应的活性物质。
一种全钒电池原理如图,放电时H+从右向左移动。
写出充电时阳极的电极反应式 _____________________________________,当转移0.1 mol电子时,转移H+的物质的量为____mol。
【解析】(1)提高浸取的速率可以提高浸取的效率,因此,可采用增大接触面积(粉碎废催化剂)、升高浸取温度或搅拌等手段;(2)步骤②中的反应方程式为2V2O5+2Na2SO44NaVO3+2SO2↑+O2↑,根据化合价变化判断只有S:+6→+4,化合价降低,发生了还原反应,O:-2→0化合价升高,发生了氧化反应,所以氧化剂为Na2SO4;(3)分析参与氧化还原反应的离子,根据电子转移守恒配平,考虑反应条件为碱性环境,反应前加OH-,反应后生成水。
钒离子浓度对钒电池容量利用率的影响

ISSN 1008-9446CN13-1265/TE 承德石油高等专科学校学报Journal of Chengde Petroleum College 第16卷第5期,2014年10月Vol.16,No.5,Oct.2014钒离子浓度对钒电池容量利用率的影响王海江1,扈显琦1,2,刘宗煜1(1.承德万利通实业集团有限公司,河北承德067002;2.承德石油高等专科学校化学工程系,河北承德067000)摘要:全钒液流电池(VFB )是一种新型电化学蓄电储能装置。
该电池容量取决于钒电解液的量和钒离子浓度。
电解液浓度的高低对电池的能量密度和容量的利用率有一定影响,而且在实际操作过程中,不同浓度的电解液在多次充放电循环过程中容量的衰减程度有所不同。
关键词:全钒液流电池;钒离子浓度;电池效率;容量衰减中图分类号:TM911文献标识码:A 文章编号:1008-9446(2014)05-0019-03Influence of Vanadium Ion Concentration on VanadiumBattery Capacity UtilizationWANG Hai-jiang 1,HU Xian-qi 1,2,LIU Zong-yu 1(1.Chengde WanLiTong Industrial Group Co.,Ltd ,Chengde 067000,Hebei ,China ;2.Department of Chemical Engineering ,Chengde Petroleum College ,Chengde 067000,Hebei ,China )Abstract :Vanadium Redox Fow Battery (VFB )is a new type of electrochemical battery energy stor-age device.The battery capacity depends on the quantity of electrolyte and vanadium ion concentra-tion.Electrolyte concentration has a certain influence on the energy density and the battery capacityutilization.In practical operation process ,the degree of capacity fade is different in the various con-centration electrolyte as the battery charge and discharge repeatedly.Key words :vanadium redox flow battery ;concentration of vanadium ions ;battery efficiency ;capac-ity fade基金项目:国家高技术研究发展计划(863计划)项目(全钒液流电池产业化关键技术与工艺研究):2012AA051203收稿日期:2014-05-08作者简介:王海江(1983-),男,内蒙古包头人,承德万利通实业集团有限公司助理工程师,主要从事储能电池研究。
全钒离子液流电池的应用研究

收稿日期:1999 12 22作者简介:崔艳华(1972 ),女,四川省人,助理研究员,硕士。
Biography:CUI Yan hua(1972 ),female,engineer,master.全钒离子液流电池的应用研究崔艳华, 孟凡明(中国工程物理研究院电子工程研究所,四川成都610003)摘要:采用循环伏安法研究了全钒离子液流电池正极溶液的浓度及添加剂对正极反应的影响。
研究了两种离子交换膜对钒电池性能的影响。
结果表明:高浓度的钒离子溶液,其循环伏安表现不理想,而添加剂过氧化氢对还原过程有利。
隔膜研究显示:阳离子交换膜Selemion CM V 有利于提高充放电电流和充电效率,但是机械强度较差,不利于长期使用。
关键词:全钒离子液流电池;循环伏安;添加剂;离子交换膜中图分类号:T M 911 文献标识码:A 文章编号:1002 087X(2000)06 0356 03Research on the vanadiu m ion redox flow batteryCU I Yan hua, M ENG Fan ming(Institute of Ele c tronic Engine er ing o f China Acade my of Engineering Physics,Che ng du Sic h uan 610003,China)Abstract:The effect of concentration and additive of vanadium ion redox flow battery on positive reaction w as investig ated by the means of cycle voltammetry.The results show that the high concentration of catholyte is unfa vorable but the additive H 2O 2is advantageous for reduction.The study on ion m embrane show s that:using the cation membrane Selemion CMV increase the charging efficiency of battery,but it is too breakable to last a long period of time.Key words:vanadium ion redox flow battery;cyclic voltammetry;additive;ion membrane全钒离子液流电池(以下简称钒电池)是一种新型的化学电源,它采用不同价态的钒离子溶液分别作为正负极活性物质,通过外接泵,把溶液从储液槽压入电池堆体内,完成电化学反应。
钒离子浓度对钒电池容量利用率的影响

A b s t r a c t : V a n a d i u m R e d o x F o w B a t t e r y( V F B )i s a n e w t y p e o f e l e c t r o c h e m i c a l b a t t e r y e n e r g y s t o r —
u t i l i z a t i o n. I n p r a c t i c a l o p e r a t i o n p r o c e s s,t h e d e g r e e o f c a pa c i t y f a d e i s d i f f e r e n t i n t he v a r i o us c o n—
( 1 . C h e n g d e Wa n L i T o n g I n d u s t r i a l G r o u p C o . ,L t d , C h e n g d e 0 6 7 0 0 0, He b e i ,C h i n a ;
2. De p a r t me n t o f C h e mi c a l E n g i n e e r i n g,C h e n g d e P e t r o l e u m Co l l e g e ,C h e n g d e 0 6 7 0 0 0,He b e i ,C h i n a )
i t v f a d e
全钒 液 流储 能系 统应用 了钒 元 素 在 不 同 电位 下 具 备 不 同价 态 的 特性 , 实 现 了 电能 的储 存 与 释放 , 1 9 8 5年 由澳 大利 亚新 南威 尔 士大 学 的 Ma r r i a K a c o s 首 次提 出 。V F B主要分 为 电堆及 电解 液两 个 相对
全钒液流电池提高电解液浓度的研究与应用现状

摘要全钒液流电池电解液为单一钒元素各价态离子的电解质溶液,避免了不同元素离子通过膜渗透产生的交叉污染,电池循环次数高,使用寿命长。
全钒液流电池非常适合电站削峰填谷、新能源发电储能和偏远地区供电等。
但受钒离子溶解度的限制,全钒液流电池电解液浓度相对较低,导致电池能量密度较低、电解液储罐体积大,钒电池更适用于静态储能系统,而较难应用于电动汽车、电子产品等领域,而电解液成本高也限制了其大规模商业化应用。
本工作基于各价态钒离子在不同酸度和温度条件下在传统H2SO4溶液中的溶解性能,总结了通过引入添加剂、改变支撑电解质和构建混合相电解液以提高钒电解液浓度和稳定性的方法及研究现状,介绍了不同种类添加剂在高温下稳定V(V)的作用机理,不同酸作为支撑电解质对V的溶解性及电解液电化学性能的影响,以及混合相电解液对于稳定电解液的内在机制。
重点分析了最近研究报道的新型高浓度钒电解液,展望了大幅提高钒电解液浓度的可行性及研发方向。
综合分析表明,改变传统H2SO4支撑电解质,如HCl/H2SO4等体系的开发,是大幅提高钒电解液浓度、增大电池能量密度比较有前景的研发方向。
关键词全钒液流电池;钒电解液;高浓度;稳定性;储能1988年澳大利亚新南威尔士大学(UNSW) 研究组注册了全钒氧化还原液流电池(VRFB)专利,标志着全钒液流电池的成功开发。
电池电解液中正、负极电解质由单一钒元素不同价态离子的溶液组成,正极电对为VO2+/VO2+,负极电对为V3+/V2+,避免了不同元素离子通过膜渗透产生的交叉污染。
因此,理论上钒电解液可通过电荷调整进行无限次循环使用。
VRFB循环次数比其他液流电池具有明显优势,得到了一定程度的商业化应用,主要用于电网削峰填谷、新能源电站储能、偏远地区应急供电等。
然而,受不同价态钒离子溶解度和五价钒离子高温下易水解的限制,钒电解液浓度普遍较低,导致VRFB能量密度较低。
目前商业运行钒电解液多为溶解1.5~1.8 mol/L钒的H2SO4(3~5 mol/L)溶液,能量密度一般为25 Wh/L,而Zn的混合液流电池均达到70 Wh/L。
全钒液流电池用电堆技术条件

全钒液流电池用电堆技术条件
全钒液流电池是一种新型的可再生能源储存技术,其电堆技术条件包括:
1. 电解质:全钒液流电池采用的是钒离子的溶液作为电解质,通常是采用硫酸钒(VOSO4) 溶液。
电解质的浓度和纯度对电池性能有影响,需要控制在适当的范围内。
2. 电极材料:全钒液流电池的正负极材料都是钒基材料,通常是采用氧化钒(V2O5)作为正极材料,还原后的钒(V)作为负极材料。
电极材料的制备工艺和纯度都需要严格控制,以保证电池的性能和循环寿命。
3. 温度控制:全钒液流电池的工作温度通常在20-50摄氏度之间,需要对电池进行温度控制,以保持较好的电池性能和循环寿命。
4. 流动控制:全钒液流电池是通过将正负极材料的溶液分别注入两个独立的电解槽中,并通过电池堆中的电解膜进行离子交换实现电荷传输。
因此,需要控制两个电解槽中溶液的流速和压力,以保证电荷传输的效率和稳定性。
5. 循环寿命:全钒液流电池的循环寿命与电极材料的稳定性、电解质的纯度、温度等因素有关。
需要通过优化电极材料的制备工艺、电解质的选取和控制,以及电池的运行参数调节等手段,延长电池的循环寿命。
以上是全钒液流电池电堆技术条件的一般要求,具体的
技术条件还需要根据实际应用需求和电池设计进行调整和优化。
比色法测钒电解液中全钒含量的不确定度评估报告

比色法测钒电解液中全钒含量的不确定度评估报告采用比色法测量硫酸、盐酸混合体系的钒电解液中全钒含量。
即在酸性条件下,将样品中可能含有的三价钒用双氧水氧化成四价钒,再用抗坏血酸将样品中可能含有的五价钒还原成四价钒,在760nm处,用1cm比色皿比色。
分别对其进行A类不确定度、B类不确定度评估,最后拟合成扩展不确定度。
标签:钒电解液;不确定度;全钒;比色法近年来,随着测量不确定度理论的发展,测量不确定度的应用越来越广泛和深入,尤其是ISO/IEC17025等体系标准和检测方法标准对测量不确定度的评估有相当具体的要求,使得测量不确定度评估成为检测工作中一项必要和重要的工作。
全钒液流电池(VanadiumRedoxBattery,缩写为VRB)主要依托一种以钒(即钒储能介质也称钒电解液)为活性物质呈循环液流态的氧化还原电池技术,具有容量大、转换迅速、无污染、操作成本低、安全性高、使用寿命长、不受地理位置限制等特点。
钒储能介质做为全钒液流电池储能系统中重要的一部分,其浓度和容量直接影响电池的储能容量。
因此,有必要对检测结果进行不确定度评估。
同时,不确定度评定结果的大小也是衡量一个实验室水平的重要指标。
本文按照JJF1059.1对不确定度进行评价,也称GUM法。
1实验部分1.1标准曲线1.1.1准确称取偏钒酸铵基准试剂0g、0.06g、0.12g、0.1800g、0.24g、0.30g、0.36g、0.42g(精确至0.0001g)于烧杯中,加水溶解(全溶即可),加入10mL 浓盐酸,冷却至室温,加入10mL抗坏血酸(40g/L),定容至100mL容量瓶中,放置5min,采用1cm比色皿在760nm处比色,以未加基准试剂的溶液为参比液。
1.1.2以偏钒酸铵基准试剂换算成V2O5的含量(单位为g)为纵坐标,并以吸光度为横坐标,绘制标准曲线,以此给出吸光度和V2O5含量之间互算的计算公式。
1.1.3样品检测准确移取5.00mL钒储能介质于锥形烧杯中,依次加入30mL浓盐酸,3mL 双氧水,放置1min,在电热板上煮沸,取下冷却后加入30mL抗坏血酸(40g/L),定容至500mL容量瓶中,放置5min。
钒电池负极电解液V2(SO4)3溶解性规律

钒电池负极电解液V2(SO4)3溶解性规律赵建新;武增华;席靖宇;邱新平【摘要】对钒电池负极电解液中活性物质V(Ⅲ)在不同硫酸浓度、不同温度条件下的溶解性规律进行了深入研究,同时对V(Ⅲ)-H2SO4体系电化学性能进行了初步探讨.结果表明:V(Ⅲ)的溶解是一个放热过程,在15~40℃范围内,V(Ⅲ)的溶解度随着温度升高而逐渐降低;并且溶液中V(Ⅲ)会以V-O-V形式形成二聚体,在低硫酸浓度下,V(Ⅲ)可以高浓度长时间稳定存在,随硫酸浓度的增大,V(Ⅲ)溶解度逐渐降低,其中30℃、1 mol/L H2SO4条件下V(Ⅲ)浓度可高达2.730 mol/L;进一步通过电化学测试,发现V(Ⅲ)-H2SO4体系是不可逆体系,H2SO4浓度的增大有益于提高V(Ⅲ)/V(Ⅱ)氧化还原反应的可逆性.%The solubility of Ⅴ(Ⅲ) species in negative electrolyte of all vanadium redox flow battery (VRB) was studied and the solubility parameters of Ⅴ(Ⅲ) species at va rious concentrations of H2SO4 and different temperatures were preliminarily obtained. The results showed that dissolution of Ⅴ(Ⅲ) was an exothermic process. The solubility of Ⅴ(Ⅲ) decreased with temperature (15-40℃). Also, the presence of Ⅴ(Ⅲ) in the solution was a V-O-V dimmer. The solubility of Ⅴ(Ⅲ) decreased with the increasing of H2SO4 and low concentration of H2SO4 would keep high concentration of Ⅴ(Ⅲ) stable for a long time. Especially, concentration of Ⅴ(Ⅲ) could reach 2.730 mol/L with 1 mol/L H2SO4 at 30 ℃ . Electrochemical properties was further investigated by experiment, the results revealed that Ⅴ(Ⅲ)-H2SO4 solution was an irreversible system for Ⅴ(Ⅲ)/Ⅴ(Ⅱ) redox reaction. Increasing of concentration of H2SO4 had great benefit to improve the revers ibility of Ⅴ(Ⅲ)/Ⅴ(Ⅱ) redox reaction.【期刊名称】《无机材料学报》【年(卷),期】2012(027)005【总页数】6页(P469-474)【关键词】钒电池;负极电解液;溶解性【作者】赵建新;武增华;席靖宇;邱新平【作者单位】清华大学深圳研究生院绿色化学电源实验室,深圳518055;清华大学化学系,北京100084;清华大学深圳研究生院绿色化学电源实验室,深圳518055;清华大学深圳研究生院绿色化学电源实验室,深圳518055;清华大学深圳研究生院绿色化学电源实验室,深圳518055;清华大学化学系,北京100084【正文语种】中文【中图分类】O645全钒氧化还原液流电池(All Vanadium Redox Flow Battery, 由Skyllas-Kazacos 等[1-3]于1985 年提出, 简称 VRB或者钒电池)具有循环寿命长、容易规模化、快速响应、选址自由等优点, 可以广泛用于太阳能和风能发电的储能设备、大型应急电源系统、电站储能和电力系统的削峰填谷等方面[4-7]. 电解液是钒电池的关键材料之一, 它不仅是离子导体,而且是能量储存的载体. 电解液浓度高低对钒电池能量密度有重要影响, 对钒电池电解液的溶解性与稳定性的研究将有助于推动钒电池的实用化进程.Skyllas-Kazacos等[8-9]的研究表明, 高浓度的钒正极电解液在高温下会有部分结晶析出. Rahman等[10-11]的研究得到了10~50℃ 范围内 V(IV)在 0~9 mol/LH2SO4溶液中的溶解数据, 以及高浓度V(V)的存在条件. 文越华等[12]对钒电池正极电解液配比进行了优化, 得到了最佳配比浓度, 即 V(IV)浓度1.5~2.0 mol/L,H2SO4浓度3 mol/L. 这些研究都给钒电池的实用化进展提供了很大的指导意义,但是其中对负极电解液 V(III)的研究[13]却鲜有涉及. 我们的前期实验表明 V(III)在较高硫酸浓度条件下容易析出沉淀, 这可能导致电池负极出现堵塞情况, 严重危害钒电池的安全运行. 文献[1,10]报道了V(III)在低温下比较不稳定, 容易形成沉淀,但并没有文献对V(III)的溶解性规律作具体的数据说明.本工作通过调节钒电池负极电解液中H2SO4浓度, 考察了15~40℃ 温度范围内负极电解液中V(III)的溶解性情况, 并对负极电解液作了循环伏安分析.1 实验部分1.1 试剂与仪器VOSO4·xH2O(分析纯 ); H2SO4(分析纯 ); K2Cr2O7(分析纯); H3PO4(分析纯). PHS-3C型精密酸度计; AEU-210电子分析天平; ICS-1500DIONEX离子色谱仪; S-4100紫外/可见分光光度计; PARSTAT 2273电化学工作站.1.2 钒离子浓度以及硫酸根浓度的测定方法V(III)浓度的测定[14-15]: 室温10 mol/L磷酸中,用重铬酸钾标准溶液电位滴定至V(III)→V(IV)突跃电位, 约600~800 mV (vs SCE), 根据滴定终点时消耗的滴定剂体积, 可计算出溶液中V(III)的浓度. 通过离子色谱仪测得溶液中总SO42−含量.1.3 负极电解液的配制以VOSO4·xH2O (其中x值通过电位滴定法测得为4)与H2SO4为原料, 配制高浓度(约为3 mol/L)的VOSO4溶液, 使用电解还原法[8]将V(IV)在电解槽的负极中控制电解还原为 V(III)溶液. 此溶液组分为2.950 mol/L V(III), 1 mol/L H2SO4. 以此溶液为母液分为五份, 调节溶液H2SO4浓度分别为1、2、3、4、5 mol/L, V(III)浓度均为2.9 mol/L, 所有样品均用25 mL的玻璃样品管分装, 氮气除氧后密闭保存, 分别在 15、30、40℃下搁置, 温度波动为±1℃.1.4 负极电解液的物化性能测试每隔一定时间观察 V(III)溶液的稳定性, 用0.45 μm的微滤膜过滤样品取得溶液, 测定溶液中V(III)浓度及总浓度. 搁置100 d后, 测定1 mL电解液的质量, 得到其密度; 在(30±1)℃恒温水浴中, 使用乌氏粘度计测得溶液的粘度.1.5 负极电解液的紫外可见吸收光谱配制H2SO4浓度均为2 mol/L, V(III)浓度分别为1.0、1.25、1.5、1.75、2.0、2.5 mol/L, 以2 mol/L H2SO4溶液作参比, 用 1mm玻璃比色皿测试紫外/可见吸收光谱.1.6 负极电解液的电化学性能测试采用以石墨棒为工作电极(有效工作面积0.126 cm2,其余部分用环氧树脂密封), 以石墨板为对电极(2.0 cm×8.0 cm×0.2 cm), 饱和甘汞电极(SCE)为参比电极的三电极体系. 使用电化学工作站对电解液进行循环伏安性能测试. 对工作电极预处理时,分别用6.5 μm砂纸及0.05 μm氧化铝粉对石墨电极进行打磨, 超声清洗 8 min, 风干待用. 测试前, 电解液通氮气15 min除氧. 循环伏安性能测试中, 扫描速度分别取10、30、50、100、300、1000 mV/s, 扫描25圈, 取第25圈数据分析.2 结果和讨论2.1 负极电解液的溶解性情况在搁置过程中, 仅30℃下1 mol/L初始H2SO4浓度的样品管中无肉眼可见沉淀析出, 其余组分的电解液中均可以观察到有沉淀析出.2.2 温度对三价钒盐溶液的影响由图1可以看出, 在相同初始H2SO4浓度条件下, 随着温度升高, V(III)浓度呈现下降趋势. 当H2SO4浓度较低时, V(III)可以高浓度长时间稳定存在; 而在H2SO4浓度大于3 mol/L时, 负极电解液中V(III)很不稳定, 随着搁置时间的延长不断析出,但溶液总体积逐渐减小. 初始 H2SO4浓度是指样品管中的V(III)-H2SO4溶液最初的H2SO4浓度.通过公式可以得到搁置100 d后实际H2SO4浓度. 由V(III)浓度与实际 H2SO4浓度对应值, 可得到图 2关系曲线.由图2可知, 搁置100 d后, 根据实测H2SO4浓度及溶液体积计算得到溶液中H2SO4总量小于初始溶液中的 H2SO4总量, 可以推断在析出的沉淀中不仅含有V2(SO4)3, 并包括一定量的 H2SO4和 H2O, 沉淀可能是以V2(SO4)3·x H2SO4·yH2O的形式存在. 为此进一步将析出的沉淀烘干, 发现表面仍附着一层粘稠的酸性液体, 验证了上述推断.图1 相同初始H2SO4浓度, V(III)在不同温度下的浓度随时间的变化曲线Fig. 1 Concentrations of V(III) with initial concentrations of H2SO4 changing over time at different temperatures图2 搁置100 d负极电解液中V(III)浓度与H2SO4浓度的关系曲线Fig. 2 Variation in solubility of V(III) ions with actual concentrations of H2SO4 after static shelving for 100 d文献[2]中提到 V(III)在低温下比较不稳定, 容易形成沉淀. 图 2为一定 H2SO4浓度下对应 V(III)的临界浓度, 曲线趋势表明 V(III)溶解度随着温度的升高而逐渐降低, 这表明 V(III)的溶解是一个放热的过程.2.3 初始H2SO4浓度对三价钒盐溶液的影响图 3为相同温度下 V(III)溶液在不同初始H2SO4浓度下的浓度随时间变化图. 随着时间的延长, 所有样品中 V(III)浓度均逐渐减小, 且V(III)浓度会随着初始 H2SO4浓度的增大而减小;初始 H2SO4浓度越大, V(III)浓度下降得越快. 只有在 H2SO4浓度较低时, V(III)浓度较高, 且具有较好的稳定性. 30℃时, 1 mol/L的初始硫酸浓度下 V(III)浓度可以达到 2.730 mol/L, 且可以维持稳定 64 d以上; 而 5 mol/L的初始硫酸浓度下V(III)浓度仅有0.195 mol/L.图3 相同温度下V(III)溶液在不同初始H2SO4浓度下的浓度随时间变化曲线Fig.3 Concentrations of V(III) with the same temperature changing over timeat different initial concentrations of H2SO4对V(III)- H2SO4体系, 溶液中存在的反应为:其中H2SO4的一级解离常数为1.0×103, 二级解离常数为1.02×10-2.假设 V2(SO4)3在溶液中完全解离, 且 V3+不与溶液中任何离子有缔合结构(仅以V(H2O)63+形式存在[16]), H2SO4解离的浓度为α, HSO4-解离的浓度为β, c1、c2分别是H2SO4浓度和V2(SO4)3中解离的SO42-浓度, 则由解离常数可以得到:H2SO4的一级解离常数较大, 可以近似认为完全解离, 则α≈c1, 进一步可以求出β, 计算数据见表1.公式(2)表明溶液中影响 V(III)溶解性的物质主要是 SO42-, 随着 SO42-浓度的增大, 预计溶液中V(III)浓度将逐渐减小, 同离子效应将导致溶液中V2(SO4)3浓度的减小. 但经过H2SO4解离这个过程,由表1可以看出, 溶液中实际存在的SO42-浓度是随着H2SO4浓度的增大而减小的.进一步通过对初始 H2SO4浓度为 1 mol/L与2 mol/L溶液pH值进行测量, 结果显示这两种溶液pH值均为负值, 即H+浓度达到了摩尔级. 这与表1中数据不符合. 表1出自一个假设, 即假设V2(SO4)3在溶液中完全解离, 且V3+不与溶液中任何离子有缔合结构. 由此可知, 上面假设不成立, 所以推断V2(SO4)3不完全解离, 或者 V3+与溶液中某个或某些离子有缔合结构, 或者以上两种情况同时存在.2.4 负极电解液的紫外/可见吸收光谱分析为了进一步深入研究, 本实验通过紫外/可见吸收光谱对电解液进行了分析, 从出峰位置来判断电解液中缔合结构的形态.表1 30℃搁置100 d后溶液中组分数据Table 1 Component data of solution after static shelving for 100 d at 30℃?图 4是不同 V(III)溶液的紫外/可见吸收光谱.吸收峰位置在400、612 nm, 这是因为V(III)的电子结构是八面体配位d2组态的离子, d2电子在分裂的d轨道上的三种组态为受激发产生d-d跃迁时会出现两个吸收峰[17].两个吸收峰的位置与文献[18-19]报道的数据比较接近, 说明溶液中的V(III)以V−O−V形式存在形成二聚体, 反应式如下[18]:由图4中612 nm处V(III)溶液吸光度与溶液浓度的对应值, 可得到如图 5所示的线性关系, 这说明在1.00~2.50 mol/L的V(III)溶液高浓度范围内, V(III)溶液的吸光度与浓度之间符合朗伯−比尔定律, 同时可以表明溶液中的缔合结构在1.00~2.50 mol/L的浓度范围内是一致的.2.5 负极电解液电化学性能研究图4 V(III)溶液紫外/可见吸收光谱Fig. 4 UV-visible absorption spectra of V(III) solution图5 V(III)溶液在612 nm处的吸光度与浓度关系图Fig. 5 Relationship between absorbance and concentration of V(III) at 612 nm图6是30℃下搁置100 d后的V (III)溶液的循环伏安曲线, 由图6求得V(III)/V(II) 的氧化峰、还原峰电位差(ΔVp)及氧化峰、还原峰电流的比值 (Ipa/Ipc)列于表2中.由表2可知, 随着初始H2SO4浓度的增大, 峰电位差ΔVp呈降低趋势, 并逐渐接近59 mV, Ipa/Ipc增大并逐渐趋近于1, 说明H2SO4浓度的增大有助于改善V(III)/ V(II)氧化还原电对的可逆性.为考察V(III)溶液体系的可逆性, 进一步通过调节扫描速度对2.730 mol/L的V(III)浓度溶液在石墨电极上做循环伏安测试, 实验结果如图7所示. 可以看出, 随扫描速度增加, ΔVp逐渐增大, 说明V(III)溶液不是可逆体系.对可逆体系有:即jp与v1/2(v为扫描速度)成正比. 由于负极的电极过程是一个单步骤单电子反应, 假如体系不可逆, 应满足图6 30℃不同V(III)浓度的溶液在石墨电极上的循环伏安曲线Fig. 6 Cyclic voltammograms for V(II)/V(III) reaction on a graphite electrode in V(III) solution with various concentrations of V(III)Scan rate: 30 mV/s, Temperature: 30℃表2 30℃不同V(III)浓度的溶液在石墨电极上的循环伏安数据Table 2 Cyclic voltammogram data for V(II)/V(III) reaction on a graphite electrode in V(III) solution with various concentrations of V(III)Scan rate: 30 mV/s, Temperature: 30℃CV(III)H SO 24 /(mol·L−1) C /(mol·L−1) ΔVp /mV Ipa/Ipc 2.730 1 640 0.747 2.385 2 405 0.831 1.380 3 185 0.845 0.585 4 120 0.895 0.195 5 81 0.905图7 30℃ 2.730 mol/L V(III)浓度溶液在石墨电极上的循环伏安曲线Fig. 7 Cyclic voltammograms for V(II)/V(III) reaction on a graphite electrode in V(III) solution with 2.730 mol/L concentration of V(III) at 30℃jp与v1/2也应成正比关系. 式中: n为得失电子数; A为反应面积, A=0.126 cm2; D0扩散系数; C0为反应物的初始浓度; α为传递系数[20-22].图7中峰值电流密度与扫描速度平方根的关系如图8所示, 氧化峰的jp与v1/2关系是一条直线, 拟合后为线性相关系数R=0.998, 峰电流密度与扫描速度平方根的线性相关性很好, 即jp与v1/2成正比关系, 且通过原点, 说明V(III)溶液是可逆体系或者是不可逆体系, 而由循环伏安曲线中峰电位差ΔVp随扫描速度增加而逐渐增大, 说明V(III)溶液不是可逆体系.另外, 由上述实验结果, 可以进一步得到动力学参数. 一般传递系数α≈0.5[16], 由公式(11)及(12),可以计算得到扩散系数D0=9.62×10-4 cm2/s.图8 V(II)氧化峰电流密度对扫描速度平方根的曲线Fig. 8 Density of peak current as a function of the square root of scan rate for V(II) oxidation3 结论低 H2SO4浓度下, V(III)可以高浓度状态长时间稳定存在, 30℃时, 1 mol/L初始H2SO4浓度下V(III)浓度可达2.730 mol/L, 且可以维持稳定64 d以上;而在高H2SO4浓度(≥3 mol/L)时, V(III)浓度较低且稳定性较差, 不利于在钒电池中的有效应用. 在15~40℃范围内, V(III)的溶解性随着温度的升高而逐渐降低, 说明 V(III)的溶解是一个放热的过程; 另外溶液中的V(III)以V−O−V形式存在形成二聚体. 三价钒盐−H2SO4体系的循环伏安实验数据表明该体系是不可逆体系, H2SO4浓度的增大有益于提高V(III)/V(II)反应的可逆性. 为满足钒电池的长期稳定运行, 负极电解液中V(III)及H2SO4的浓度配比还需要综合考虑钒电池的能量效率与能量密度之间的平衡以及正、负极电解液之间的输运规律等因素, 相关实验研究正在进一步进行中.参考文献:【相关文献】[1] Sum E, Rychcik M, Skyllas-Kazacos M. Investigation of the V(V)/V(IV) system for use in the positive half-cell of a redox battery. Journal of Power Source, 1985, 16(8): 85−95. [2] Zhong Z, Skyllas-Kazacos M. Electrochemical behaviour of V(V)/V(IV) redox couple at graphite electrodes. Journal of Power Source, 1992, 39(1): 1−9.[3] Sum E, Skyllas-Kazacos M. A study of the V(II)/V(III) redox couple for redox flow cell application. Journal of Power Source, 1985, 15(5): 179−190.[4] WU Xiong-Wei, PENG Sui, FENG Bi-Jun, et al. Preparation, thermodynamic and electrochemical properties of vanadium solution. Journal of Inorganic Materials. 2011, 26(5): 535−539.[5] Xi J Y, Wu Z H, Qiu X P, et al. Nafion/SiO2 hybrid membrane for vanadium redox flow battery. Journal of Power Sources, 2007, 166: 531−536.[6] 滕祥国, 赵永涛, 席靖宇, 等(TENG Xiang-Guo, et al). 全钒氧化还原液流电池用Nafion/有机硅复合膜. 化学学报(Acta Chim. Sinica), 2009, 67(6): 471−476.[7] 赵永涛, 席靖宇, 滕祥国, 等(ZHAO Yong-Tao, et al). 钒电池电解液体积变化规律研究. 化学学报(Acta Chim. Sinica), 2011, 69(2): 132−136.[8] Skyllas-Kazacos M, Menictas C, Kazacos M. Thermal stability of concentrated V(V) electrolytes in the vanadium redox cell. Journal of Electrochenical Society, 1996, 143(4): L86−L88.[9] Kazacos M, Chen M, Skyllas-Kazacos M. Vanadium redox flow cell electrolyte optimization studies. Journal of Applied Electrochemistry, 1990, 20(3): 463−467.[10] Rahman F, Skyllas-Kazacos M. Solubility of vanadyl sulfate in concentrated sulfuric acid solutions. Journal of Power Sources, 1998, 72(2): 105−110.[11] Rahman F, Skyllas-Kazacos M. Vanadium redox battery: positive half-cell electrolyte studies. Journal of Power Sources, 2009, 189(2): 1212−1219.[12] 文越华, 张华民, 钱鹏, 等(WEN Yue-Hua, et al). 全钒液流电池高浓度下 V(IV)/V(V)的电极过程研究. 物理化学学报(Acta Phys-Chim. Sin.), 2006, 22(4): 403−408.[13] 桑玉. 钒电池用电解液的制备及负极电解液稳定性研究. 长沙:中南大学硕士论文, 2006.[14] 田波, 严川伟, 屈庆, 等. 钒电池电解液的电位滴定分析. 电池, 2003, 33: 261−263.[15] 彭声谦, 蔡世明, 许国镇, 等. 钒电池充电过程中钒价态及其变化的现场分析. 理化检验−化学分册, 1998, 34: 291−294.[16] 刘素琴, 史小虎, 黄可龙, 等(LIU Su-Qin, et al). 钒(IV/V)电对在碳纸电极上的反应机理研究. 无机化学学报(Chinese J. Inorg. Chem.), 2009, 25(3): 417−421.[17] 罗裕基. 无机化学丛书钒分族. 北京: 科学出版社, 1998: 173−279.[18] Kanamori K. Structures and properties of multinuclear vanadium(III) complexes: seeking a clue to understand the role of vanadium(III) in ascidians. Coordination Chemistry Reviews, 2003, 237(1/2): 147−161.[19] 吴雪文. 全钒液流电池高性能稳定电解液的研究. 长沙: 中南大学硕士论文, 2010.[20] Gaku O, Yasushi K, Takashi M. Investigations on V(IV)/V(V) and V(II)/V(III) redox reactions by various electrochemical methods. Journal of Power Sources, 2005, 139(1/2): 321−324.[21] Bae C H, Roberts E P L, Dryfe R A W. Chromium redox couples for application to redox flow batteries. Electrochimica Acta, 2002, 48(3): 279−287.[22] 巴德, 福克纳, 著. 邵元华等, 译. 电化学方法: 原理和应用, 2版. 北京: 化学工业出版社, 2005: 156−178.。
钒电池电解液浓度与稳定性研究

钒电池电解液浓度与稳定性研究史小虎;李君涛;余龙海;彭穗【摘要】分别考察了硫酸浓度为4.3 mol/L,钒离子浓度分别为1.5、1.6、1.7 mol/L的钒电解液,和钒浓度为1.6 mol/L,硫酸浓度分别为4.1、4.3、4.5 mol/L 的钒电解液,在高低温下的稳定性、电化学性能、在隔膜中的钒离子渗透率等.通过考察得知,电解液钒离子浓度为1.6 mol/L,硫酸浓度为4.3 mol/L的电解液综合性能最佳.%In order to study the reasonable vanadium ion and sulfuric acid concentration,the stability of vanadium electrolyte,composed of 4.3 mol/L H2SO4and 1.5,1.6,1.7 mol/L vanadium ion respectively,and composed of 1.6 mol/L vanadium ion and 4.1,4.3,4.5 mol/L H2SO4 respectively,were studied at high temperature and low temperature.Through the investigation of stability and electrochemical performance,it is concluded that the vanadium ion electrolyte,composed of 4.3 mol/L H2,SO4 and 1.6 mol/L vanadium ion is most reasonable.【期刊名称】《电源技术》【年(卷),期】2017(041)011【总页数】3页(P1581-1583)【关键词】钒电池;电解液;钒浓度;硫酸浓度;性能【作者】史小虎;李君涛;余龙海;彭穗【作者单位】大力电工襄阳股份有限公司,湖北襄阳441057;大力电工襄阳股份有限公司,湖北襄阳441057;大力电工襄阳股份有限公司,湖北襄阳441057;攀钢集团研究院有限公司,四川成都610303【正文语种】中文【中图分类】TM911全钒液流电池,具有安全性高、循环寿命长、响应速度快等特点,非常适合大规模储能的需求[1]。
温度和浓度对钒电解液性能的影响

0.25 A,40 ℃时增大到 0.41 A。这一现象可由阿累尼乌斯方程
解释。阿累尼乌斯方程为[10]:
lnk =lnk0-Ea/RT
(1)
式中:k 为反应速率常数,min;k0 为频率因子常数,min;Ea 为
由图 1~ 图 4 还可以发现,随着含钒离子浓度增加,氧化 峰向右移动,而还原峰向左移动,导致两峰之间的电势差增 大。10 ℃时,1.0 mol/L 的钒电解液 V5+/V4+ 电对的还原峰与氧 化峰之间的电势差为 0.451 V,而 2.0 mol/L 的钒电解液中此电 势差则增大到 0.782 V。40 ℃时,1.0 mol/L 的钒电解液 V5+/V4+
会降低电池的能量效率;对于同一浓度下的钒电解液,氧化反应和还原反应的峰值电流值随着温度的升高而增大。适当
提高钒电解液温度,可提高全钒液流电池的输出电流。
关键词:钒电池;钒电解液;电化学;循环伏安
中图分类号:TM 912
文献标识码:A
文章编号:1002-087 X(2014)07-1264-03
Effects of temperature and concentration on vanadium electrolyte performance
I /A
0.6
0.5 0.4 0.3
0.2
0.1 0.0 ? 0.1 −0.2 −0.3 −0.4 −0.5
−1
10
20 30
40
0
1
2
V/V
图 5 1.6 mol/L 的钒电解液在不同温度下测得的循环伏安曲线
I /A
0.5
0.4 0.3 0.2
0.1
0.0 ? 0.1 −0.2 −0.3 −0.4
钒电池用电解液价态钒的电位滴定分析

1 . 3 . 2 V ( V ) N( N ) 体系:
取V m l 待测溶液于烧杯中,搅拌中依次加入适量的水、浓磷酸后进行滴定,到终点
后记下记下消耗硫酸亚铁按溶液体积v i . , l m 直接测杯中 溶液总钒。则电解液中 V ( V ) 浓
度为 :
T V ( V )
V ( N) 浓度为
V ( V) +v ( I I)一 - - 0 v( W)
( 1 )
( 2 )
v ( V) + V( 1 1 )0 v ( W)
( 3 )
1 . 3分析方法
1 . 3 . 1 溶液中总帆离子浓度T V 8 e 取V m l 待测钒电 解液于烧杯中, 搅拌中依次加入适量的 水、 浓磷酸,然后慢速滴加稍
1 . 3 . 4 V ( I I ) N( I ) 体系:
T V ( I V ) = T v a 一 兀 ( I I I )
在氮气保护条件下滴定, 操作步骤同V ( I V ) N( I I I ) 体系。 则电 解液中V ( I I ) 浓度为:
1 . 0 x V " 0. - 1 x 凡一 兀 总 T V ( I I ) = V
1 9 0 1 ’ 一 . 一 . 一 一
口〕 7 6 1 』 U
5 1 0 1 5 2 0 2 5
5 1 0 1 5 2 0 2 5
礴 酸 / m l
磷 酸 / m l
图2 - b确酸对滴定结果影响曲线
F i g . 2 - b E f f e c t t o r e s u I i s o f H , P 氏
钒电池是以钒离子溶液为正负极活性物质的蓄电池[ 1 . 2 [ 。 钒各种价态的化学行为
很活跃 ,邻价 电对 电位差约为 1 . 2 5 v .钒 电池的反应原理如下 :
钒电池用电解液研究现状及展望

860钒电池用电解液研究现状及展望常芳,孟凡明,陆瑞生(中国工程物理研究院电子工程研究所,四川绵阳621900)摘要:钒电池是近年来兴起的高效储能、绿色环保、反复可充放的新兴能源。
钒电解液作为全钒氧化还原液流电池的活性物质是电池最重要组成部分之一,钒的浓度大小和电解液的多少决定了电池的容量,钒电解液性能的好坏对电池性能有直接影响。
对钒电解液的制备、分析、性能优化方面的研究现状及展望作了综述。
关键词:钒电解液;制备;分析;优化;再生中图分类号:TM912.9文献标识码:A文章编号:1002-087X(2006)10-0860-03DevelopmentandprespectofthevanadiumelectrolyteforthevanadiumbatteryCHANGFang,MENGFan-ming,LURui-sheng(InstituteofElectronicEngineering,ChinaAcademyofEngineeringPhysics,MianyangSichuan621900,China)Abstract:Vanadiumbatterydevelopedinresentyearsisastorageenergyinstalls.Ithassomespecificpropertysuchashighstorageefficiency,environmentalfriendlyandcanberecharged.Thevanadiumelectrolyteasaactivematerialisanimportantpartofvanadiumbattery.Theconcentrationandamountofvanadiumelectrolyteinfluencethebatterycapacitydirectly.Thequalityofvanadiumelectrolytecanalsoinfluencethepropertyofbatterydirectly.Thispapersummarizedthemanufacture,analysisandpropertyoptimizationofvanadiumelectrolyteathomeandabroad,andalsolookforwardthedevelopmentofvanadiumelectrolyteinthefuture.Keywords:vanadiumelectrolyte;manufacture;analysis;optimization;regeneration钒电池的全称为全钒氧化还原液流电池,是一种活性物质呈循环流动液态的氧化还原电池。
钒离子价态、pH和稳定剂对二氧化钒溶胶稳定性的影响

钒离子价态、pH和稳定剂对二氧化钒溶胶稳定性的影响李尧【摘要】采用沉淀-胶溶法室温制备得到VO2溶胶,通过Zeta电位系统分钒离子稳定性、pH值、稳定剂等对溶胶稳定性的影响.结果表明,pH值为5时VO2溶胶具有良好的稳定性.在VO2溶胶形成和陈化过程中,VO2+逐渐被离去O2-2的基团氧化成高价离子.使用稳定剂P(MEMA)-N2H4(np(MEMA) /nvO2=0.11,nN2H4/nH2O2=1∶1),可以抑制钒离子被氧化且得到稳定溶胶.在此基础上,提出了评判VO2溶胶稳定性的标准.%A simple precipitation-peptization method was proposed to prepare VO2 sol under room temperature.The effect of stability of vanadium ions,pH,and stabilizers on the stability of sol were systematically analyzed by Zeta potential.The results show that the VO2 sol was stable at pH =5.During formation and aging process of VO2 sol,O2-2 groups gradually left and oxidized the vanadium ions from +4 to high-valence state.When the stabilizer P(MEMA)-N2H4 (np(MEMA / nVO2 =0.11,nN2H4 / nH2O2 =1 ∶ 1) was used,it is possib le to restrain the oxidization of vanadium ions and obtain a stable sol.Based on above results,the judgment standards of the stability of VO2 were proposed.【期刊名称】《化学工程师》【年(卷),期】2017(000)004【总页数】5页(P4-8)【关键词】二氧化钒溶胶;稳定性;pH;Zeta电位【作者】李尧【作者单位】北京科技大学,材料科学与工程学院,北京 100083【正文语种】中文【中图分类】TB381VO2是一种典型的智能相变材料,在接近室温(~68℃)时可以发生半导体-金属态转变。
P204萃取硫酸体系中钒的性能研究_胡建锋 (1)
- 1 - 1
有机相组成 : 20 %P204 , 3 % 仲辛醇 , 77 % 煤 油。 不皂化 。 水相组成 : [ V ] = 4. 54 g・ L
- 1
。 OΠ A=
, 另 配 一 份 高 浓 度 钒 溶 液 , [ V ] = 1519
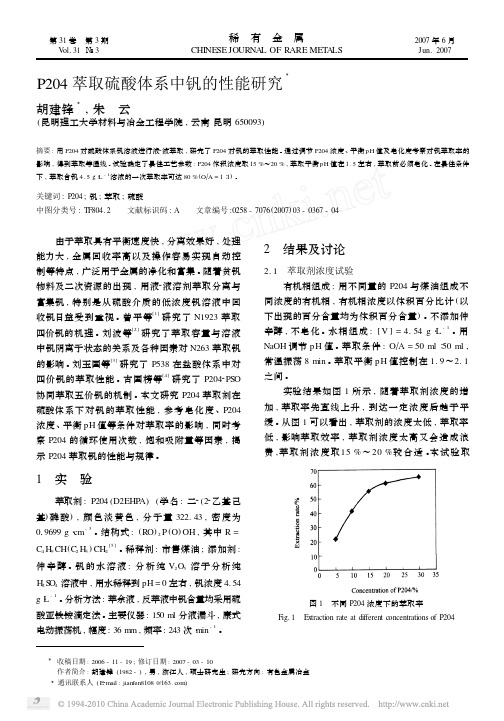
50 ml ∶ 50 ml , 用 NaOH 调节平衡 pH 值 , 使 pH 值为 1. 5 左右 。 每次振荡时间 8 min 。 每萃取一次 , 萃余
从前面试验可知 , 萃取钒的最佳平衡 pH 值为
1~2 之间 , 而由图 4 可知 , 在此 pH 值范围内 , Fe
3+ 3+ 3+以下 , 而 Fe 的萃取率在
60 %左右。 因此 , 萃取钒时 , 应避免 Fe 对其影响 ,
3 结 论
1. P204 在硫酸体系萃取钒 , 相对于萃取剂 N1923 和 N263 , 其循环使用次数更高 , 且适用于酸
表1 不同皂化度下的萃取率
Table 1 Extraction rate at different saponification degrees
Saponification degreeΠ% Extraction rateΠ% 0 60. 65 50 72. 27 100 81. 68
液进行分析 , 负载有机相加入 50 ml 新鲜钒溶液萃 取 , 如此进行 10 次 , 萃余液中钒浓度基本不变后 , 认为有机相达到饱和吸附量 。 实验结果如图 3 所 示。 如图 3 所示 , 有机相浓度随萃取次数的增加 而增加 , 但增加速率逐次递减 。 当萃取 10 次后 , 有
协同萃取五价钒的机制 。 本文研究 P204 萃取剂在 硫酸体系下对钒的萃取性能 , 参考皂化度 、P204 浓度 、 平衡 pH 值等条件对萃取率的影响 , 同时考 察 P204 的循环使用次数 , 饱和吸附量等因素 , 揭 示 P204 萃取钒的性能与规律 。
硫酸氧钒溶解度

硫酸氧钒溶解度一、引言硫酸氧钒(vanadium(IV) sulfate)是一种常见的无机化合物,化学式为VSO4,具有重要的工业和研究应用。
研究硫酸氧钒的溶解度是了解该化合物的物理化学性质以及在不同条件下的溶解行为的关键。
本文将深入探讨硫酸氧钒的溶解度以及影响其溶解度的因素。
二、硫酸氧钒的溶解度测定方法硫酸氧钒的溶解度可以通过实验方法来测定。
以下是一种常用的实验方法:2.1 实验材料和仪器•硫酸氧钒样品•高纯度水•烧杯•称量器•恒温水浴槽•过滤器•pH计2.2 实验步骤1.准备一系列浓度递增的硫酸氧钒溶液。
可以通过称取一定质量的硫酸氧钒样品,逐渐加入到一定量的水中,制备出不同浓度的溶液。
2.将制备好的溶液倒入烧杯中,并将烧杯置于恒温水浴槽中,保持一定的温度。
3.在一定时间间隔内,用过滤器过滤出溶液中的固体硫酸氧钒。
4.将过滤后的溶液用pH计测定pH值,以确定其溶液中硫酸氧钒的浓度。
5.重复实验多次,取平均值,并绘制溶解度与温度的关系曲线。
三、硫酸氧钒溶解度的影响因素硫酸氧钒的溶解度受多种因素的影响,主要包括温度、溶剂性质和溶液的酸碱性等。
下面将详细讨论这些因素的影响。
3.1 温度的影响温度是影响硫酸氧钒溶解度的重要因素。
一般情况下,随着温度升高,硫酸氧钒的溶解度会增加。
这是因为在高温下,溶质分子的平均动能增加,溶解速率加快,导致更多的硫酸氧钒溶解到溶液中。
3.2 溶剂性质的影响不同溶剂对硫酸氧钒的溶解度也有一定影响。
溶剂的极性和溶剂分子与硫酸氧钒分子间的相互作用力是影响溶解度的重要因素。
极性溶剂通常能够更好地溶解极性物质,而非极性溶剂则对非极性物质溶解能力更强。
3.3 溶液的酸碱性溶液的酸碱性也会对硫酸氧钒的溶解度产生影响。
硫酸氧钒在酸性溶液中往往更容易溶解,而在碱性溶液中溶解度较低。
这是因为在酸性条件下,酸性溶液中的H+离子可以与硫酸氧钒分子形成配位键,促进其溶解。
四、硫酸氧钒的应用及意义硫酸氧钒在工业和研究领域具有重要的应用价值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LI Xiangrong1,2, QIN Ye1, LIU Jianguo1, YAN Chuanwei1
(institute of Metal Research of CAS, Shenyang 110016, Liaoning, China; 2 School Metallurgy ofyang 110819, Liaoning, China)
第6卷 第 4期 2017年 7 月
储 能 科 学 与 技 术 Energy Storage Science and Technology
Vol.6 N o .4 Jul.2017
f研究开发1
钒电池中高浓度 voso 4水溶液黏度预测
李 享 容 u ,秦 野 、 刘 建 国 \ 严 川 伟 1
( i 中国科学院金属研究所,辽 宁 沈 阳 110016; 2 东北大学材料学院,辽 宁 沈 阳 110819)
副研究员, 主要研究方向为全钒液流电池电解液, E-mail: yqin@ 。
中,全钒氧化还原液流电池[ 1 _ 3 ] (VRFB) 除具有上述 特点外,因其使用了同一种金属离子( 钒 ),从而避 免了电解液交叉污染的致命问题,理论上具有无限使 用寿命,整体产业已经进入市场化初期阶段。随着大 规模可再生能源应用和电力体制改革的深入,全钒液 流电池将成为具有广泛应用前景的大规模储能系统。 与其它储能系统不同的是, 钒电池的活性物质是以液 态形式存在于电解液中,因此电解液是机电池能量存 储和转化的核心[ 4 _ 6 ] 。 电解液的黏度与钒电池的电池性能密切相关, 降低电解液黏度可以增强传质能力,减小泵耗,提 高能量效率;同时增大离子迁移速率, 提高电解液的
Abstract: Electrolytes play a crucial role in the storage and conversion of energy in a vanadium redox flow battery (VRFB). As an important transport property, the viscosity of electrolyte provides information of inter-particle interactions and solution microstructure. This is of significance to the optimization of the overall performance of the VRFB. We measured the viscosity and density of aqueous based VOSO4 solutions in a concentration range of 0.5〜3.0 mol/kg at 283.15〜323.15 K , calculated the activation energy associated with the viscous flow. Based on Eyring’s theory, a semi-empirical equation was proposed for the viscosity prediction. Such a relationship agreed well with the experimental data within 0.3%. Key words : vanadium redox flow battery;electrolyte;viscosity;semi-empirical predicting equation
收稿日期:2017-01-03 。 修改稿日期:2017-02-16 。 基金项目:国家 自 然 科 学 基 金 项 目 ( 21373009, 21403254 ) 。 第一作者:李 享 容 ( 1988— ) , 女 , 博 士 研 究 生 , 主 要 研 究 方 向 为 全 钒 液 流 电 池 电 解 液 , E-mail: lx rln u @ sin ; 通讯联系人:秦 野 , 博 士 ,
摘 要 :全 机氧化还原液流电池的电解液是能量储存与转化的核心。黏度作为电解质重要的传输性质,不仅是 所需的基础数据,还可以反映出电解质溶液性质, 内部离子间的相互作用机理和溶液的微观结构等。开展机电 池电解液黏度的研究对钒电池整体性能的提高具有重要指导意义。 在 283.15〜323.15 K 温度范围内测量了 0.5〜 3.0mol/kg V 0 S 0 4 水溶液的动力黏度和密度, 计算了 V 0S 04 水溶液的活化能。 在 Eyring 液体黏度理论的基础上, 提出了可以预测高浓度 V 0S04 水溶液黏度的半经验方程,并对实验值和计算值进行了比较,结果良好,平均相对偏 差 为 0.3%。另外此种半经验方法也可以推广到其它电解质体系,同时也是对复杂溶液体系物化理论的重要补充。 关键词:全 钒液流电池; 电解液;黏 度 ;预测方程
doi: 10.12028/j.issn.2095-4239.2017.0014
中图分类号 : 〇 646.1 文献标志码: A 文章编号 : 2095-4239 (2017) 04-776-06
Prediction of viscosity for concentrated aqueous V 0 S 0 4 solutions for vanadium flow batteries
