元素同位素核素的联系和区别
核素

第三节核素1.元素、核素、同位素之间的区别和联系(1)元素、核素、同位素的比较元素核素同位素概念具有相同核电荷数的同类原子的总称具有一定数目的质子和一定数目的中子的一种原子质子数相同而中子数不同的同一种元素的不同原子互称为同位素范围宏观概念,指同类原子,既可是游离态又可是化合态微观概念,指某种原子微观概念,指某种元素的几种原子之间的关系特点只与质子数有关,与中子数、核外电子数无关不同的核素间质子数、中子数、电子数可能有相同处,也可能均不同同位素间质子数相同,化学性质相同,质量数不同,物理性质不同实例168O、188O、168O2-都属氧元素11H、21H、31H、4019K、4020Ca不同核素11H、21H、31H为氢的同位素(2)元素、核素、同位素之间的关系图例12007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。
下列关于20278Pt和19878Pt的说法正确的是( )A.20278Pt和19878Pt的质子数相同,互称为同位素B.20278Pt和19878Pt的中子数相同,互称为同位素C.20278Pt和19878Pt的核外电子数相同,是同一种核素D.20278Pt和19878Pt的质量数不同,不能互称为同位素解析20278Pt与19878Pt是同一种元素的不同原子,因此它们互称为同位素。
质子数相同而中子数不同的同一元素的不同原子之间互称为同位素。
元素原子的质子数和核外电子数相等。
有一定数目的质子和一定数目的中子的一种原子,就是一种核素。
答案 A2.元素的相对原子质量(1)元素的相对原子质量就是按照该元素各种同位素原子所占的一定百分比算出的平均值。
(2)元素的相对原子质量的计算设某元素有多种不同的核素,A、B、C……表示各核素的相对原子质量,a%、b%、c%……为各核素的原子数目百分数,则元素的相对原子质量计算式为Mr=A·a%+B·b%+C·c%+……例如,氯元素有3517Cl 和3717Cl 两种天然、稳定的同位素,3517Cl 的原子数目百分数为75.77%,3717Cl 的原子数目百分数为24.23%;3517Cl 的相对原子质量为34.969,3717Cl 的相对原子质量为36.966。
课时3 核素、元素和同位素

三、元素、核素、同位素 H (氢) 、D (重氢) 、T(超重氢)
35 17
Cl , , ,
37 17
Cl , ,
14 6 C 18 8 O
制造氢弹的材料
12 6 C 16 8 O 235 92 U
13 6 C 17 8 O 238 92 U
相对原子质量标准
制造原子弹和核反 应堆的材料
1、医学中于显影、诊断、治疗、消毒等; 2、农业上的辐射育种技术,提高了农产品 的质量和数量; 3、14 6 C的放射性被应用于考古断代
二、核素、元素、同位素
1.定义:具有一定质子数和一定中子数的 一种原子。 2.元素: 具有相同的核电荷数(即质子数) 的同一类原子的总称 3.同位素:质子数相同而中子数不同的 核素互称为同位素. 物理性质:不同,因其质量不同; 化学性质:相似,因其核电荷数、核外电 子层结构都相同 存在特点:天然存在元素,不论游离态还是 化合态,各种同位素所占的原子 百分比一般是不变的。
第三单元
人类对原子结构的认识
第3课时 核素、元素和同位素
1 1H, (氕)
2 1H, (氘)
3 1H (氚)
阅读p32-33 什么是核素?什么是同位素?
1H ①1
②12 C 6 ⑥1H
3
③16 8O ⑦8O
18
④2 H 1 ⑧6 C
14
⑤8 O
17
8种 上述的粒子中有几种核素________ , 元素有_____ 种;其中互为同位素的有 3 ① ⑥、 ② ⑧、 ③ ⑤ ⑦ _ ④______________ 。
3H是制造氢弹的材料;… 4、 2 H 、 1 1
1、 6 C-NMR(核磁共振)可用于含碳化合物 13 的结构分析,有关 6 C的说法正确的是( A ) A、质子数为6 C、中子数为6 B、电子数为13 D、质量数为6
高中化学 核素和同位素的区别

核素是指具有一定数目质子和一定数目中子的一种原子。同一种同位素的核性质不同的原子核,它们的质子数相同而中子数不同,结构方式不同,因而表现出不同的核性质。
同位素化学性质几乎相同,因为质量数不同,物理性质不同。天然存在的各种同位素所占的原子个数百分比一般不变
具有真实的质量,不同核素的质量不相同
实例
H、Na、S为不同的三种元素
互为同位素
是一种核素, 是一种核素
质子数相同而中子数不同的同一元素的不同原子互称为同位素
具有一定数目质子和一定数目中子的一种原子
描述对象
宏观物质,列同类原子而言,既有游离态,又有化合态
微观物质,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类
微观物质,指某种元素的某种原子
特征
以单质或化合物形式存在,性质通过形成单质或化合物来体现
核素的表示方法
具有一定的质子数和中子数的一种原子叫做核素
的含义: 表示一个质量数为A、质子数为Z的原子。
中A表示质量数,Z表示质子数,a表示粒子所带的电荷数和电性,b表示组成该粒子的原子数目。
核素和同位素的区别
核素和同位素的区别:核素是同一种元素因为中子数不同而形成的不同原子,比如氢有三种核素,同位素是同一种元素的不同核素间的互称,比如氢的三种核素彼此之间互称为同位素。
具有相同质子数,不同中子数的同一元素的不同核素互为同位素。以上定义中的原子是广义的概念,指微观粒子。质子数相同而中子数不同的同一元素的不同核素互称为同位素。例如:氢有三种同位素,H氕、D氘(又叫重氢)、T氚(又叫超重氢)。
高中化学:物质结构 元素周期律知识点

高中化学:物质结构元素周期律知识点一. 原子结构1. 原子核的构成核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数2. 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量3. 原子构成4. 表示方法二. 元素、核素、同位素、同素异形体的区别和联系1. 区别2. 联系【名师点睛】(1) 在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2) 同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。
(3) 自然界中,元素的各种同位素的含量基本保持不变。
三. “10电子”、“18电子”的微粒小结1. “10电子”微粒2. “18电子”微粒四. 元素周期表的结构1. 周期2. 族3. 过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒元素周期表中主、副族的分界线:(1) 第ⅡA族与第ⅢB族之间,即第2、3列之间;(2) 第ⅡB族与第ⅢA族之间,即第12、13列之间。
五. 元素周期表的应用1. 元素周期表在元素推断中的应用(1) 利用元素的位置与原子结构的关系推断。
等式一:周期序数=电子层数;等式二:主族序数=最外层电子数;等式三:原子序数=核电荷数=质子数=核外电子数。
(2) 利用短周期中族序数与周期数的关系推断。
(3) 定位法:利用离子电子层结构相同的“阴上阳下”推断具有相同电子层结构的离子,如a X(n+1)+、b Y n+、c Z(n+1)-、d M n-的电子层结构相同,在周期表中位置关系为则它们的原子序数关系为a>b>d>c。
2. 元素原子序数差的确定方法(1) 同周期第ⅡA族和第ⅢA族元素原子序数差。
(2) 同主族相邻两元素原子序数的差值情况。
①若为ⅠA、ⅡA族元素,则原子序数的差值等于上周期元素所在周期的元素种类数。
高中化学原子结构知识点总结

原子结构知识点总结第1课时原子核核素一、原子的构成1. 原子的质量主要集中在原子核上。
2. 质子和中子的相对质量都近似为1,电子的质量可忽略。
3. 带电特点:微粒质子中子电子带电特点一个质子带一个单位的正电荷不带电一个电子带一个单位的负电荷原子序数=核电核数=质子数=核外电子数4. 质量数(A) = 质子数(Z) + 中子数(N)5. 在化学上,我们用符号A Z X来表示一个质量数为A,质子数为Z的具体的X原子。
二、核素1. 元素、核素、同位素、同素异形体的比较元素核素同位素同素异形体定义具有相同核电荷数(质子数)的同一类原子的总称具有一定数目的质子和一定数目的中子的一种原子称为核素。
一种原子即为一种核素同一种元素的不同核素间互称为同位素相同元素组成,不同形态的单质本质质子数(核电荷数)相同的一类原子质子数、中子数都一定的一类原子质子数相同、中子数不同的核素的互称同种元素的不同单质范畴同类原子,存在游离态、化合态两种形式原子原子单质特性只有种类,没有个数化学反应中的最小微粒物理性质不同化学性质相同一种元素组成,独立存在决定质子数质子数、中子数质子数、中子数组成元素、结构举例H、C、N是三种元素11H、21H、31H是三种核素23492U、23592U、23892U O2与O32. 元素、核素、同位素、同素异形体的联系三、原子或离子中微粒间的数量关系1. 原子或离子中核电荷数、质子数、中子数及核外电子数之间的关系(1)质子数+ 中子数= 质量数= 原子的近似相对原子质量(2)原子的核外电子数= 核内质子数= 核电荷数(3)阳离子核外电子数= 核内质子数–电荷数(4)阴离子核外电子数= 核内质子数+ 电荷数(5)除11H外,其它元素的原子中,中子数≥质子数原子AZX原子核质子Z个中子N个=(A-Z)个核外电子Z个原子的质量数原子的相对原子质量元素的相对原子质量区别原子的质量数是该原子内所有质子和中子数的代数和,都是正整数原子的相对原子质量,是指该原子的真实质量与126C质量的121的比值,一般不是正整数元素的相对原子质量是由天然元素的各种同位素的相对原子质量与其在自然界中所占原子个数的百分比的积的加和得来。
谈“元素、核素、同位素”三素的区别和联系

谈“元素、核素、同位素”三素的区别和联系一、概念区别和联系:元素:把具有相同核电荷数(即质子数)的同一类原子统称为元素。
核素:把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
同位素:同一种元素的不同核素之间互称为同位素。
例如:“同位素”可以这样拆开理解:“素”指核素,“同位”指一种元素(核电荷数相同)的几种核素,在元素周期表中占有同一个位置的意思。
1.核素(原子)的相对原子质量:。
2.核素(原子)的近似相对原子质量:质量数。
3.核素(原子)的平均相对原子质量:各同位素的质量数与天然同位素所占的原子个数百分比的乘积之和。
4.元素的近似平均相对原子质量:各同位素的质量数与天然同位素所占的原子个数百分比的乘积之和。
例、天然铜由63Cu 和65Cu 组成。
已知天然铜中的63Cu 的质量分数为69。
34%,求铜元素的近似平均相对原子质量。
解析:铜元素的平均近似相对原子质量=63×a%+65×b %,其中a%和b%为原子个数百分比,而试题所给的69.34%为同位素的质量百分比,因此在解题量必须将质量百分比转化为原子个数百分比。
设取100g Cu ,则63Cu 为69.34 g ,65Cu 为(100-69.34)g 。
所以63Cu 的原子个数百分比为;65/)34.69100(63/34.6963/34.69-+×100%=70% 故铜元素的近似平均相对原子质量=63×70%+65×(1-70%)=63.6四、 巩固练习1.下列叙述中正确的是( )A.氢有三种核素,即有三种氢原子B.所有元素的原子核均由质子和中子构成C.具有相同的核外电子数的粒子,总称元素D. 是一种同位素2.几种微粒,具有相同的核电荷数,则可说明( )A.可能属于同一种元素B.一定是同一种元素C.彼此之间一定是同位素D.核外电子数一定相等3.设某元素原子的核内质子数为m ,中子数为n ,则下列论断正确的是( ) A.不能由此确定该元素的相对原子质量B.这种元素的相对原子质量为m+nC.若碳原子质量为wg ,此原子的质量为(m+n )wgD.核内中子的总质量小于质子的总质量答案:1.A 2..A 3.A元素:宏观概念,如:1H( 氕) 2H (氘) 3H (氚)都是氢元素,说元素时三者没区别。
元素周期表——核素和同位素汇总

O 18
8
162C 163C
164C
U 234 92
U 235 92
U 238 92
质子数
1 1 1 8 8 8 6 6 6 92 92 92
中子数
0 1 2 8 9 10 6 7 8 142 143 146
质量数
1 2 3 16 17 18 12 13 14 234 235 238
核素关系
同位素 同位素 同位素 同位素
重水反应堆
以重水堆为热源的核电站。重水堆是以重水作 慢化剂的反应堆,可以直接利用天然铀作为核燃 料。重水堆可用轻水或重水作冷却剂,重水堆分 压力容器式和压力管式类。重水堆核电站是发展 较早的核电站,有各种类别,但已实现工业规模 推广的只有加拿大发展起来的坎杜型压力管式重 水堆核电站。
放射性C-14射线测定装置
=2.657x10-26 kg
/[(1/12)x1.993x10-26 kg]
= 16.00 B、核素的近似相对原子质量:
如: 816O的近似相对原子质量为16。
C、元素的相对原子质量:
如:氯元素的同位素有:1735Cl 1737Cl 两种, 相对原子质量为 34.969 36.966
原子个数百分比为 75.77% 24.23%
(2)U的三种同位素:
234 92
U
235 92
U
238 92
U
235 92
U
是造原子弹及核反应堆的材料。
(3)C的三种同位素:
16 2 C
13 6
C
14 6
C
14 6
C
用来测定为文物的年代。
铀-235原子核完全裂变放出的能量是同量 煤完全燃烧放出能量的2700000倍。也就是 说1克U-235完全裂变释放的能量相当于2吨 半优质煤完全燃烧时所释放的能量。
初中九年级(初三)化学 元素、核素和同位素

2019届高三化学一轮考点精讲精析考点8 元素、核素和同位素1.掌握原子的组成和结构。
2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与质子数和中子数之间的关系3.理解元素、核素、同位素的概念及其相互关系4.了解同位素的性质及其应用,掌握核素的表示方法一、原子结构 1.原子组成原子可分为 和 两部分,其中原子核又是由 和 构成的2.构成原子的粒子之间的关系①核电荷数 = = = 元素的原子序数思考:哪些微粒的质子总数才等于核外电子总数? ②质量数 = + 数学表达式:A = +二、元素、核素、同位素1.元素、核素、同位素的区别与联系元素是具有 的同一类原子的总称核素是具有 和 的一种原子同一元素的不同 之间互称为同位素元素、核素、同位素间的关系可用右图表示:2.原子中各粒子的作用① 数决定元素种类,同种元素的不同 ,其 数相同 数不同, ② 数和 数共同决定了原子(核素)的种类③元素的化学性质决定于 和 ,其中 是决定元素化学性质的主要因素 3.同位素的性质及表示方法同位素的 性质几乎完全相同而 性质不同,若某元素的原子核内有6个质子和6个中子,其核素组成符号为 ,说出核素的一个用途 。
思考:为什么同位素的化学性质几乎完全相同而物理性质不同? 元素 同位素 核素 核素4.【例1】下列说法正确的是A .原子核都是由质子和中子构成的B .质子数相同的粒子其化学性质不一定相同C .质子数不同的原子其质量数也一定不同D .质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同 解析:H 中只有质子,没有中子,A 错;Na 、 Na +、 NH 4+质子数相同,化学性质不同,B 正确D 错;质子数不同,但质子数与中子数之和可能相同,C 不对;。
答案:B 。
【例2】简单原子的原子结构可用下图表示方法形象表示:① ② ③ 。
其中表示质子或电子,表示中子,则下列有关①②③的说法正确的是 ( )A .①②③互为同位素B .①②③互为同素异形体C .①②③是三种化学性质不同的粒子D .①②③具有相同的质量数解析:图示可知,①②③是具有相同质子数不同中子数原子答案: A【例3】从下列序号中选择填空:互为同位素的是 ;互为同分异构体的是 ;互为同系物的是 ; 互为同素异形体的是 ;同一物质的是 。
同素异形体与同位素和核素的关系

同素异形体与同位素和核素的关系同素异形体、同位素和核素,这些名词听上去是不是有点高深莫测?别担心,今天咱们就来轻松聊聊这些概念,保证让你听了也能会心一笑,甚至能在朋友面前炫耀一下哦!咱们得从同素异形体说起。
这个名字有点拗口,其实它的意思就是同一种元素,不同的形态。
想象一下,像碳这个家伙,它可以变身成钻石,闪闪发光,人人都爱;可转眼又变成石墨,黑乎乎的,谁都不太愿意接近。
就像变魔术一样,真是让人惊叹。
再说同位素,哎,这个也有趣!同位素呢,就是原子核里中子数不同,但原子序数相同的元素。
举个例子,氢这个小家伙,有三种不同的兄弟姐妹:普通氢、重氢和超重氢。
普通氢就是最常见的那个,重氢里多了一个中子,超重氢则多了两个。
这就好比在一个大家庭里,有的孩子高高瘦瘦,有的矮矮胖胖,虽说都是一家子,但各有各的特色嘛!好啦,接着咱们再聊聊核素。
核素就是指带有特定中子数和质子数的原子,它们可以是稳定的,也可以是不稳定的。
就好比有些人天生就爱风吹雨打,活得风风火火,而有些人就稳稳当当,过得安稳。
核素里有些可不太稳,随时准备着放射性衰变,咱们可要小心应对。
这就像在派对上,有些人总爱玩火,稍不注意就可能引发小插曲,而有些人则总是守规矩,稳稳当当。
这几个概念其实有着密切的关系哦。
想象一下,元素就像是一座大山,而同素异形体、同位素和核素就像是大山里的小溪、树木和岩石。
它们虽然看起来不同,但都在同一个生态系统里相互作用,彼此影响。
就像好朋友一样,虽然各有各的性格,但总能一起玩得开心。
在生活中我们也能看到这些现象的影子。
就拿同素异形体来说吧,很多人会觉得钻石是最珍贵的东西,但石墨却是咱们日常生活中不可或缺的。
铅笔、画笔都少不了它。
这样一想,哎,真是有趣,光鲜亮丽的和朴实无华的,原来都是一家子,都是碳的不同面。
再说同位素,其实在医学上可有大用场。
重氢在一些科学实验中用得很广泛,尤其是在核磁共振成像上,帮助医生看病,真是为人类健康贡献了一份力。
元素周期表中的同位素

元素周期表中的同位素同位素是指具有相同原子序数(即核中所含质子数相同)但质量数不同的元素核素。
在元素周期表中,同一元素的同位素在同一位置,具有相同的化学性质,但因为质量数的不同,物理性质会有所变化。
同位素的研究对于了解元素性质、核反应和放射性等具有重要意义。
以下将从同位素的定义、分类以及应用三个方面来介绍元素周期表中的同位素。
一、同位素的定义同位素是指拥有相同质子数(即具有相同原子序数)的元素核素,但它们的质量数不同,因此在同位素中,质子数相同而中子数不同。
同位素的符号通常由原子序数和质量数组成,用于标示同一元素的不同同位素。
例如,氢的同位素有质子数为1的质子(称为氢-1或1H),以及质子数为1的质子和一个中子(称为氢-2或2H)等。
二、同位素的分类按照同位素的性质和应用,我们可以将同位素分为稳定同位素和放射性同位素两类。
1. 稳定同位素稳定同位素是指具有相同质子数和中子数的同位素,它们的核相对稳定,不会自发发生核反应。
稳定同位素在大自然中相对较为稳定存在,不会衰变。
例如,氮元素的同位素氮-14(14N)就是一个稳定同位素,它的核中含有7个质子和7个中子。
2. 放射性同位素放射性同位素是指核不稳定,会自发发生核反应而转变成其他核素的同位素。
这种同位素的核衰变会伴随着放射性衰变过程,放出射线。
放射性同位素在核能、医学、环境科学以及地质学等领域具有广泛的应用和重要的研究价值。
例如,镭元素的同位素镭-226(226Ra)是一种放射性同位素,它在医学中被用作治疗癌症的放射性药物。
三、同位素的应用同位素的研究和应用涵盖了众多领域。
以下列举几个常见的应用场景:1. 核能领域同位素的核衰变过程可以产生巨大的能量,因此它们在核能领域被广泛应用。
例如,铀-235(235U)和钚-239(239Pu)是两种常用的核燃料,它们的核衰变可以释放出大量的能量。
2. 医学应用同位素在医学诊断、治疗和放射治疗等方面有着重要应用。
元素同位素核素的联系和区别

3、某元素X与非金属元素R形成共价化 合物XRn,已知XRn分子中各原子核外最 外层电子总数为32,若核外电子总数为 74,则XRn的化学式为——;X的化合价 CCl4 为—— 。 +4
一、编排原则 1.按 原子序数 递增的顺序从左到右排列 2.将 电子层数相同 元素排成一个横行 3.把 最外电子数相同 的元素排成一个纵行
例题1: X、Y两元素处于同一主族相邻周期,则X、Y 两元素的原子序数相差不可能为下列哪一数值 A. 2 B. 8 C.10 D.18 例题 2 :第 114 号元素是化学家和物理学家很感 兴趣的尚未发现的元素,试推测此元素在周期 表中的位置 A.第8周期ⅢA族 B.第6周期ⅤA族 C.第7周期ⅣB族 D.第7周期ⅣA族
例题:
1.
1 2 1H 1 H
3 1H
H+、H2是 ( D )
A 氢的五种同位素 B. 五种氢元素 C 氢的五种同素异形体 D. 氢元素的五种不同微粒
例题:
2 .氯的原子序数为 17 , 35Cl 是氯元素的一种 核素,下列说法正确的是 BD
A.35Cl原子所含质子数为18 B . 1/18mol 的 1H35Cl 分 子 所 含 中 子 数 约 为 6.02×1023 C.3.5 g的35Cl2气体的体积为2.24 L D.35Cl2气体的摩尔质量为70 g / mol
二、周期表结构
三长三短一不全,七主七副七周期
3个短周期 (1、2、3周期) 周期(7个) 3个长周期 (4、5、6周期) 元素 1个不完全周期(7周期)
周期 表
主族(7个) IA~VIIA 族(16个) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族( 1 个)最右边一个纵行(惰 性气体元素)
元素、核素、同位素、同素异形体之间的区别ppt课件
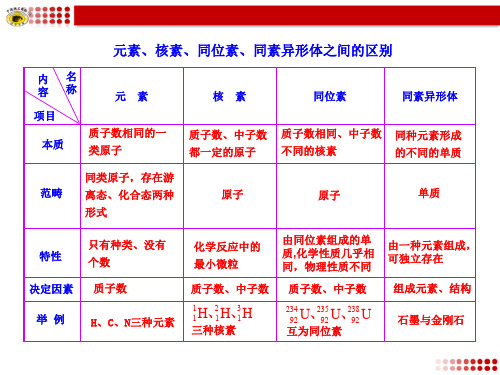
内名 容称
元素
项目 本质
质子数相同的一 类原子
核素
同位素
同素异形体
质子数、中子数 质子数相同、中子数 同种元素形成
都一定的原子 不同的核素
的不同的单质
范畴
同类原子,存在游 离态、化合态两种 形式
ห้องสมุดไป่ตู้原子
原子
单质
特性 决定因素
举例
只有种类、没有 个数 质子数
H、C、N三种元素
化学反应中的 最小微粒
由同位素组成的单 由一种元素组成, 质,化学性质几乎相 可独立存在 同,物理性质不同
质子数、中子数 质子数、中子数 组成元素、结构
1 1
H、21 H、31 H
三种核素
234 92
U、29325
U、29328
U
互为同位素
石墨与金刚石
怎么区分核素和同位素

怎么区分核素和同位素
核素和同位素的区别是什么?
核素是可以单一提出的概念,指具有一定数目质子和一定数目中子的一种原子。
而同位素是相对而言的,具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。
同位素是指的是有相同质子数多种核素的总称。
比如氕氘氚是3种核素,但氕,氘和氚才互为同位素。
核素是怎么产生的?
核素概念最初是为了确切描述元素的原子量而引入的。
最初的化学原子概念是元素原子,即同一种元素对应有同一种原子,因此某种元素的原子量被规定为该元素原子的相对质量。
核素(知识点归纳及典例解析)

第3课时 核素[目标导航] 1.了解质量数和A Z X 的含义。
2.了解核素、同位素的概念,并了解同位素的重要作用。
3.了解原子的结构以及各种微粒数的关系。
一、原子的构成 质量数 1.原子的构成及表示方法 (1)构成原子(A ZX)⎩⎨⎧原子核⎩⎪⎨⎪⎧质子(带正电)中子(不带电)核外电子(带负电)(2)表示方法例如,12 6C 表示的是C 元素中质量数为12、质子数为6、中子数为6的原子;168O 表示的是O 元素中质量数为16、质子数为8、中子数为8的原子。
2.质量数由于原子的质量集中在原子核上,把质子和中子的相对质量分别取其近似整数值1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量的近似整数值相加,所得的数值叫做质量数,符号为A 。
质量数(A )=质子数(Z )+中子数(N )。
点拨 原子或离子中各微粒间的数目关系(1)原子的质子数=核电荷数=原子序数=核外电子数。
(2)阳离子所带电荷数=质子数-核外电子数; 阴离子所带电荷数=核外电子数-质子数。
(3)质子数(Z )=阳离子的核外电子数+阳离子所带的电荷数。
(4)质子数(Z )=阴离子的核外电子数-阴离子所带的电荷数。
议一议判断正误,正确的打“√”,错误的打“×”(1)所有原子都由质子、中子和核外电子构成()(2)原子的种类大于元素的种类()(3)某种氯原子的中子数是18,则其质量数是35,核外电子数是17()答案(1)×(2)√(3)√二、核素同位素1.核素把具有一定数目质子和一定数目中子的一种原子叫做核素。
如12C、13C、14C就是碳元素的三种不同核素。
2.同位素质子数相同而中子数不同的同一元素的不同原子互称为同位素。
即同一元素的不同核素之间互称为同位素,如1H、2H、3H三种核素均是氢元素的同位素。
3.同位素的两个特征(1)同一种元素的各种同位素的化学性质几乎完全相同;(2)在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的比率,即各种同位素所占的原子个数百分比是相同的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、核素:具有一定数目的 质子和一定数目的中子的一 种原子。如1H(H)、2H(D)、
3H(T)就各为一种核素。
2、同位素:同一元素的不同核素 之间互称同位素。 16O、17O、18O是
氧元素的三种核素,互为同位素
注意:
1、同种元素,可以有若干种不同的核素。至今 已发现了110多种元素,但发现了核素远多于110 种 2、 17O是一种核素,而不是一种同位素。16O、 17O、18O是氧元素的三种核素,互为同位素。 3、同一种元素的不同核素原子其质量数不同, 核外电子层结构相同,其原子、单质及其构成的 化合物化学性质几乎完全相同,只是某些物理性 质略有差异。
例题1: X、Y两元素处于同一主族相邻周期,则X、Y 两元素的原子序数相差不可能为下列哪一数值 A.2 B.8 C.10 D.18 例题2:第114号元素是化学家和物理学家很感 兴趣的尚未发现的元素,试推测此元素在周期 表中的位置 A.第8周期ⅢA族 B.第6周期ⅤA族 C.第7周期ⅣB族 D.第7周期ⅣA族
二、周期表结构
三长三短一不全,七主七副七周期
3个短周期 (1、2、3周期) 周期(7个) 3个长周期 (4、5、6周期) 元素 1个不完全周期(7周期)
周期 表
主族(7个) IA~VIIA 族(16个) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰 性气体元素)
例题:
1.
1 2 1H 1 H
3 1H
H+、H2是 ( D )
A 氢的五种同位素 B. 五种氢元素 C 氢的五种同素异形体 D. 氢元素的五种不同微粒
例题:
2.氯的原子序数为17, 35 Cl是氯元素的一种 核素,下列说法正确的是 BD
A.35Cl原子所含质子数为18 B.1/18mol 的 1 H35Cl 分 子 所 含 中 子 数 约 为 6.02×1023 C.3.5 g的35Cl2气体的体积为2.24 L D.35Cl2气体的摩尔质量为70 g / mol
3、某元素X与非金属元素R形成共价化 合物XRn,已知XRn分子中各原子核外最 外层电子总数为32,若核外电子总数为 74,则XRn的化学式为——;X的化合价 CCl4 为——。 +4
一、编排原则 1.按 原子序数 递增的顺序从左到右排列 2.将 电子层数相同 元素排成一个横行 3.把 最外电子数相同 的元素排成一个纵行
【知识总结】 各周期元素的种类及稀有气体 的原子序数
周 期 序数 元 素 种类 稀 有 气 体 原 子 序数
1
2
2
8ห้องสมุดไป่ตู้
3
8
4
5
6
7
18
18
32
32
2
10
18
36
54
86
118
