NO2波动1答案
2023版高考化学微专题小练习专练1阿伏加德罗常数的应用(含答案)

高考化学微专题小练习:专练1 阿伏加德罗常数的应用1.[2022·全国甲卷]N A 为阿伏加德罗常数的值,下列说法正确的是( )A .25 ℃,101 kPa 下,28 L 氢气中质子的数目为2.5N AB .2.0 L 1.0 mol ·L -1AlCl 3溶液中,Al 3+的数目为2.0N AC .0.20 mol 苯甲酸完全燃烧,生成CO 2的数目为1.4N AD .电解熔融CuCl 2,阴极增重6.4 g ,外电路中通过电子的数目为0.10N A2.[2021·全国甲卷]N A 为阿伏加德罗常数的值。
下列叙述正确的是( )A .18 g 重水(D 2O)中含有的质子数为10N AB .3 mol 的NO 2与H 2O 完全反应时转移的电子数为4N AC .32 g 环状S 8()分子中含有的S —S 键数为1N AD .1 L pH =4的0.1 mol ·L -1 K 2Cr 2O 7溶液中Cr 2O 2-7 离子数为0.1N A3.[2021·湖南卷]N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .18 g H 218O 含有的中子数为10N AB .0.1 mol ·L -1HClO 4溶液中含有的H +数为0.1N AC .2 mol NO 与1 mol O 2在密闭容器中充分反应后的分子数为2N AD .11.2 L CH 4和22.4 L Cl 2(均为标准状况)在光照下充分反应后的分子数为1.5N A4.[2021·浙江卷1月]设N A 为阿伏加德罗常数的值。
下列说法正确的是 ( )A .1 mol NH 4F 晶体中含有的共价键数目为3N AB .CH 4和C 2H 4混合气体2.24 L(标准状况)完全燃烧,则消耗O 2分子数目为0.25N AC.向100 mL 0.10 mol ·L -1 FeCl 3溶液中加入足量Cu 粉充分反应,转移电子数目为0.01N AD .0.1 mol CH 3COOH 与足量CH 3CH 2OH 充分反应生成的CH 3COOCH 2CH 3分子数目为0.1N A5.[2021·河北卷]N A 是阿伏加德罗常数的值。
解:(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二...

解:(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,故NO形成硝酸型酸雨的反应为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;C.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;故答案为:ab;(3)①已知:2NH3(g)+CO2(g)⇌H2NCOONH4(s)△H=-159.5kJ/molH2NCOONH4(s)⇌CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol根据盖斯定律,两热化学方程式相加得2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O (l)△H=-131kJ/mol,故尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol,故答案为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol;②释放氨气的反应是吸热反应,升高温度,有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行,故答案为:升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行;Ⅱ.①CO(NH2)2的含量越高,NO的转化率越大,即NO脱除率越高,所以曲线a 对应CO(NH2)2与NO的物质的量比值是3:1,故答案为3:1;②800℃~900℃区间内NO脱除率增大,所以NO是作为反应物参加反应,高温时,尿素分解生成氨气、二氧化碳,氨气和一氧化氮发生氧化还原反应生成氮气,即尿素与NO反应生成N2,同时生成二氧化碳和水,所以反应方程式为:4NH3+6NO═5N2+6H2O 或 2CO (NH2)2+6 NO═2CO2+4H2O+5N2,故答案为:4NH3+6NO═5N2+6H2O 或 2CO(NH2)2+6 NO═2CO2+4H2O+5N2;③900℃~1200℃区间内脱除率下降,所以NO浓度上升,则该反应中应该有NO,尿素分解生成的氨气和烟气中的氧气反应生成一氧化氮和水,导致NO浓度增大,所以反应方程式为:4NH3+5O2═4NO+6H2O,故答案为:4NH3+5O2═4NO+6H2O;④A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3所以NO的脱除速率,故答案为:1.5×10-4.。
考题猜想04物质的特性

专练04 物质的特性1.用如图所示的装置演示气体扩散现象,其中一瓶装有密度比空气大的红棕色二氧化氮气体,另一瓶装有空气.下列说法正确的是()A.装二氧化氮气体的应是A瓶B.扩散现象说明气体分子不停地做无规则运动C.若实验温度为0℃,则不会发生扩散现象D.温度越高,气体扩散越慢【答案】B【解析】A.二氧化氮的密度大于空气的密度,如果把二氧化氮气体放到上方的话,由于自身密度大的缘故,二氧化氮分子会下沉到下方的空气瓶子中去,就不能说明分子在不停地做无规则运动,因此要把密度小的空气瓶子放到上方,把二氧化氮放在下方,故装二氧化氮气体的应是B瓶,此选项错误,不合题意.B.不同的物质在相互接触时彼此进入对方的现象叫做扩散现象,所以扩散现象说明气体分子不停地做无规则运动,此选项正确,符合题意;C.扩散现象在任何温度都能进行,此选项错误,不合题意;D.由于分子的运动跟温度有关,所以分子的无规则运动叫做分子的热运动,温度越高,热运动越剧烈,所以温度越高,气体扩散越快,此选项错误,不合题意.故答案为:B.2.下列现象中,属于扩散现象的有()①放在盐水中的鸡蛋被腌咸了;②在阳光照射下,看见空气中的尘土飞扬;③糖溶解在水中,使水变甜;④在显微镜下,观察到水中的微生物在游动A.②③B.①③C.②④D.以上都是【答案】B【解析】①放在盐水中的鸡蛋被腌咸了,是因为盐扩散到鸡蛋中去了,故①正确;题型一对分子概念的理解②在阳光照射下,看见空气中的尘土飞扬,由于尘土已经是肉眼看得到的宏观物体,这肯定不是分子运动,故②错误;③糖溶解在水中,使水变甜,是因为糖分子和水分子发生了扩散现象,故③正确;④在显微镜下,观察到水中的微生物在游动,这也是宏观物体的运动,肯定不是分子运动,故④错误。
因此属于扩散现象的是①③。
故选B。
3.证据是得出结论的重要依据,下列实验中所获得的事实现象不能作为证据的是()A.图甲中,为了证明铁生锈发生了化学变化,用磁铁分别去吸铁粉和铁锈B.图乙中,为了证明某种组织是动物组织还是植物组织,用显微镜观察C.图丙中,为了证明地球是个球体,用铅笔在篮球上移动进行模拟实验D.图丁中,为了证明分子之间存在引力,把端面锉平的两块铅柱压在一起悬挂起来【答案】C【解析】A.磁铁可以吸引铁粉,但是不能吸引铁锈,说明铁生锈生成了新物质,即发生化学变化,故A正确不合题意;B.用显微镜观察组织中细胞结构的不同,可以证明是动物组织还是植物组织,故B正确不合题意;C.用铅笔在篮球上移动进行模拟实验,只能类比地球是个球体,不能证明地球是个球体,故C错误符合题意;D.两个铅柱可以吸在一起而被悬挂起来,说明分钟之间存在引力,故D正确不合题意。
3.2 氮及其重要化合物(分层练习)(解析版)高一化学同步课件沪教版2020必修一

第三章硫、氮及其循环3.2氮及其重要化合物1.液氮能长时间保存活体组织和生物样品,主要利用氮气的性质是A .密度小B .沸点低C .难溶于水D .无色无味【答案】B【解析】液氮能长时间保存活体组织和生物样品说明氮气的沸点低,故选B 。
2.我国科学家实现了用氮气、二氧化碳和水在常温下合成尿素。
该方法属于A .人工固氮B .自然固氮C .大气固氮D .生物固氮【答案】A【解析】用氮气、二氧化碳和水在常温下合成尿素,该方法是通过化学方法将氮气转化为化合态的尿素,属于人工固氮,答案选A 。
3.下列过程不属于氮的固定的是A .雷电时生成氮的氧化物B .工业上用氢气与氮气合成氨C .植物的根从土壤中吸收铵根离子和硝酸盐D .豆科植物的根瘤把空气中的氮气转化为硝酸盐【答案】C【解析】A .雷电时生成氮的氧化物,即N 2+O 2 放电2NO ,是将游离态氮转化为化合态氮,属于氮的固定,为自然固氮,故A 不符合题意;B .工业上用氢气与氮气合成氨,即N 2+3H 2 催化剂高温高压2NH 3,是将游离态氮转化为化合态氮,属于氮的固定,为工业固氮,故B 不符合题意;C .植物的根从土壤中吸收铵根离子和硝酸盐,不是将游离态氮转化为化合态氮,不属于氮的固定,故C 符合题意;D .豆科植物的根瘤菌把空气中的氮气转化为硝酸盐,是将游离态氮转化为化合态氮,属于氮的固定,为生物固氮,故D 不符合题意;答案为C 。
4.2NO 在火箭燃料中作氧化剂,下列有关二氧化氮的说法正确的是A .2NO 为红棕色且有刺激性气味的气体B .2NO 属于酸性氧化物C .2NO 经转化被植物吸收,属于氮的固定D .常温下空气中2N 与2O 可以化合成2NO【答案】A【解析】A.NO2为红棕色且有刺激性气味的气体,A正确;B.NO2与氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,故不属于酸性氧化物,B错误;C.氮的固定是指N2转化为化合物,C错误;D.常温下空气中N2与O2可以化合成NO,D错误;故答案选A。
二氧化氮一氧化氮和水反应

二氧化氮一氧化氮和水反应
二氧化氮(NO2)和一氧化氮(NO)是两种常见的氮氧化物,它们与水反应时可以产生一系列的化学变化。
二氧化氮和水可以反应生成亚硝酸(HNO2)和硝酸(HNO3)。
这个反应是一个氧化还原反应,其中二氧化氮被氧化为硝酸,而水则被还原为亚硝酸。
反应式如下:
NO2 + H2O → HNO2 + HNO3
亚硝酸和硝酸是两种强氧化剂,它们可以进一步氧化有机物质,产生更多的氮氧化物和其他有害物质。
因此,这个反应产生的亚硝酸和硝酸是大气和水环境中的污染物。
另一方面,一氧化氮和水也可以反应生成亚硝酸和氧气。
这个反应是一个分解反应,其中一氧化氮被氧化为亚硝酸,同时水被分解为氢离子和氧气。
反应式如下:
2NO + 2H2O → HNO2 + H+ + NO3- + O2
这个反应在土壤中也很常见,它可以产生有机氮化合物,为植物提供养分。
总的来说,二氧化氮一氧化氮和水反应可以产生多种化学变化,其中产生的亚硝酸和硝酸是大气和水环境中的污染物,需要引起人们
的重视和处理。
同时,这个反应也在土壤中扮演着重要的生态角色。
高中化学 必修一讲义: 第二单元 第一课时 氮氧化物的产生及转化 Word版含答案

第二单元| 生产生活中的含氮化合物 第一课时 氮氧化物的产生及转化——————————————————————————————————————[课标要求]1.了解氮气的存在和性质及氮的固定。
2.掌握NO 、NO 2的性质。
3.了解氮的氧化物对环境的影响及防治。
1.氮气的化学性质非常稳定,常温下很难与其他物质反应。
2.NO 为无色无味气体,NO 2为红棕色刺激性气味气体,它们均为有毒气体,能引起呼吸系统疾病。
3.NO 、NO 2的产生及转化反应为:N 2+O 2=====放电2NO 2NO +O 2===2NO 2 3NO 2+H 2O===2HNO 3+NO 4.NO 、NO 2分别与O 2、H 2O 反应的化学方程式为4NO +3O 2+2H 2O===4HNO 3 4NO 2+O 2+2H 2O===4HNO 3 5.NO x 会形成酸雨,引起光化学烟雾,破坏臭氧层。
氮气和氮氧化物1.氮元素的存在(1)大部分氮元素以游离态存在于空气中。
(2)少部分化合态的氮元素存在于动、植物体内,土壤及无机盐中。
2.氮气的物理性质无色无味的气体,难溶于水,密度比空气略小。
3.氮气的化学性质氮气的化学性质非常稳定,很难与其他物质反应,只有在高温或放电等特定条件下才能反应,故氮气常用作保护气。
(1)与氧气反应:N 2+O 2=====放电2NO 。
(2)与氢气反应:N 2+3H 2高温、高压催化剂2NH 3(工业合成氨)。
(3)与活泼金属Mg 反应:N 2+3Mg=====点燃Mg 3N 2。
4.氮的固定(1)概念:将游离态的氮转化为化合态的氮。
(2)方式:生物固氮、自然固氮和工业固氮。
5.NO 、NO 2性质的比较[特别提醒](1)实验室里收集NO 气体是用排水集气法而不能用排空气法。
(2)检验NO 气体的方法是向气体中通入O 2(或空气),气体由无色变为红棕色。
将充满NO 2、NO 的试管分别倒置于水槽中,并通过导管通入少量的氧气。
二氧化氮考试题答案

二氧化氮考核试题
姓名:得分:
一、判断题
1.二氧化氮是一种棕红色、高度活性的气态物质,又称过氧化氮。
(√)
2.Saltzman实验系数f是用渗透法制备的二氧化氮校准用混合气体,在采气过程中被吸收液生成的偶氮燃料相当于亚硝酸根的量与通过采样系统的二氧化氮的比值。
(J)
3.吸收液的吸光度不超过0.002。
(X)
二、填空题
1.空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与盐酸蔡乙二胺作
用,生成粉红色的偶氮燃料,于波长540-545nm之间处,测定吸光度。
2.臭氧浓度大于0.25mg∕m3时对本法有正干扰,过氧乙酰硝酸酯(PAN)可增加15-35%的读数,然而,在一般情况下,大气中的PAN浓度较低,不致产生明显的误差。
3新的多孔玻板吸收瓶在使用前,应用(1+1)HCI浸泡24h以上,用清水洗净,每支吸收管在使用前或使用一段时间以后应测定其玻板阻力,检查通过玻板后气泡分散的均匀性。
阻力不符合要求和气泡分散不均匀的吸收瓶不宜使用。
一氧化氮 不稳定 二氧化氮

一氧化氮不稳定二氧化氮?
答:一氧化氮(NO)和二氧化氮(NO2)是氮氧化物中
的两种重要化合物,它们在大气化学、环境科学和生物学等多个领域都具有重要意义。
这两种化合物之间的转化关系也备受关注。
一氧化氮是一种无色、无味、难溶于水的有毒气体。
在常温下,一氧化氮很容易与空气中的氧气反应生成二氧化氮,因此它在大气中的存在时间相对较短。
一氧化氮的不稳定性主要来自于其分子结构中的未成对电子,这使得它很容易与其他分子或自由基发生反应。
二氧化氮是一种红棕色、有刺激性气味的有毒气体,可溶于水生成硝酸和一氧化氮。
在常温下,二氧化氮相对稳定,但在光照或加热条件下,它也可以分解成一氧化氮和氧气。
因此,一氧化氮和二氧化氮之间的转化是一个动态平衡过程,它们在大气中的浓度和分布受到多种因素的影响,如温度、光照、氧气浓度等。
这种转化关系对于理解大气中氮氧化物的循环和污染控制具有重要意义。
2020-2021学年高中苏教版化学必修第二册教师用书:专题7 第1单元 氮的固定

第一单元氮的固定发展目标体系构建1.能依据氮分子的微观结构预测其化学性质。
2.认识人工固氮的化学原理和社会价值。
3.体会化学科学在解决人类社会面临的粮食危机中所发挥的重要作用。
一、氮分子的结构1.物理性质色态气味密度溶解性毒性无色气体无味比空气的略小难溶无毒2.(1)氮气分子是由两个氮原子通过共用三对电子结合而成的,氮气分子的电子式:∶N⋮⋮N∶,结构式为N≡N。
(2)破坏氮气分子中氮原子之间的共价键需要很大的能量,所以氮气分子很稳定。
但在高温或放电等特殊条件下,也能与一些金属或非金属单质发生反应,生成含氮化合物。
二、自然固氮1.氮的固定将空气中游离态的氮转化成含氮化合物,简称固氮。
自然固氮生物固氮:自然界中的一些微生物种群将空气中的氮气通过生物化学过程转化为含氮化合物,约占自然固氮的90%高能固氮:通过闪电、火山爆发等途径产生含氮化合物,约占自然固氮的10%2.高能固氮的实例——“雷雨发庄稼”(1)利用化学方程式解释“雷雨发庄稼”的原理:N 2+O 2=====放电2NO 、2NO +O 2===2NO 2、3NO 2+H 2O===2HNO 3+NO 。
雨水中的硝酸渗入土壤后与矿物质作用生成硝酸盐,其中的硝酸根离子被植物的根系吸收,转化为植物生长所需的养料。
(2)一氧化氮和二氧化氮的性质 ①物理性质:颜色 状态 气味 毒性 水溶性 NO 无色 气态 无味 有毒 微溶 NO 2红棕色气态刺激性气味有毒易溶②危害:大气中NO 和NO 2达到一定浓度时都会对人体造成伤害,能引发上呼吸道及肺部疾病。
③应用:一氧化氮在调节心脑血管、神经和免疫系统等方面有着十分重要的生物学作用和医学前景,受到人们的普遍重视。
二氧化氮在火箭燃料中用作氧化剂,在工业上可以用来制造硝酸。
三、人工固氮——合成氨1.合成氨的反应原理(用化学方程式表示): N 2(g)+3H 2(g)2NH 3(g)ΔH =-92.4_kJ·mol -1。
3.3 硫循环和氮循环(分层练习)(解析版)高一化学同步课件沪教版2020必修一

第三章硫、氮及其循环3.3硫循环和氮循环1.北京时间2022年1月15日,南太平洋岛国汤加境内发生了“21世纪至今最剧烈的火山喷发”,对该国造成了严重的破坏。
火山喷发是硫元素在自然界中转化的重要途径,部分过程如图所示。
下列说法错误的是A.SO2、SO3均是酸性氧化物B.火山喷发易诱发酸雨C.以上硫的转化过程涉及的反应均为氧化还原反应D.火山口可能发生的反应有2H2S+SO2===3S+2H2O【答案】C【解析】SO2、SO3均能与碱反应生成盐和水,则均是酸性氧化物,A正确;火山喷发能够产生大量的SO2,则易诱发硫酸型酸雨,B正确;SO2→H2SO3,SO3→H2SO4,为非氧化还原反应,C错误;由图示可知,火山口放出的气体有H2S、SO2,故火山口可能发生的反应有2H2S+SO2===3S+2H2O,D正确。
2.下列关于自然界中氮循环(如图)的说法不正确的是()A .氮元素均被氧化B .工业合成氨属于人工固氮C .含氮无机物和含氮有机物可相互转化D .碳、氢、氧三种元素也参加了氮循环【答案】A【解析】A 项,人工固氮合成氨反应中,氮元素的化合价降低被还原,错误;B 项,工业合成氨属于人工固氮,正确;C 项,硝酸盐转化为蛋白质及经动物消化使蛋白质转化为氨气和铵盐,实现了含氮无机物和含氮有机物的相互转化,正确;D 项,碳、氢、氧三种元素也参加了氮的循环,正确。
3.下列物质在氧化还原反应中,硫元素只表现还原性的是()A.H 2SB.SO 2C.H 2SO 3D.H 2SO 4【答案】A【解析】S 有-2、0、+4、+6价,-2价是硫的最低价态,只表现还原性。
0、+4价既可以表现还原性,也可以表现氧化性,+6价仅表现氧化性。
4.实验室常用热的NaOH 溶液洗去试管壁上沾有的硫,其反应方程式为6NaOH+3S 2Na 2S+Na 2SO 3+3H 2O 。
在此反应中硫表现的性质是()A.氧化性B.还原性C.既无氧化性又无还原性D.既有氧化性又有还原性【答案】D【解析】依据反应的化学方程式知硫元素的价态变化是S-2S0S +4,故S 既有氧化性又有还原性。
第二节 氮及其化合物第1课时 氮气与氮的固定 一氧化氮和二氧化氮(有答案和详细解析)

第二节 氮及其化合物第1课时 氮气与氮的固定 一氧化氮和二氧化氮(有答案和详细解析)一、选择题:本题共10小题,每小题4分,共40分。
每小题只有一个选项符合题目要求。
1.关于氮气的性质的说法中,错误的是( ) A .氮在自然界中既以游离态存在又以化合态存在 B .通常情况下,氮气性质很不活泼 C .可在氧气中燃烧生成一氧化氮D .在反应3Mg +N 2=====点燃Mg 3N 2中N 2作氧化剂解析 通常情况下氮气的性质很不活泼,不具有可燃性,在放电或高温条件下,能跟氧气反应。
答案 C2.NO 对于心脑血管系统功能的改善具有重要作用。
下列关于NO 的描述不正确的是( ) A .不溶于水B .可由氮气和氧气在放电条件下反应生成C .常温下能与氧气化合D .红棕色气体解析 NO 为无色不溶于水的气体,故D 项错误。
答案 D3.氮气能大量存在于空气中的根本原因是( )A .氮气性质稳定,即使在高温下也很难与其他物质发生反应B .氮气比空气轻,且不溶于水C .氮分子中两个氮原子结合得很牢固,分子结构稳定D .氮气无氧化性,也无还原性,不与其他物质反应解析 N 2性质稳定,但在高温下可与Mg 、Al 、H 2等物质反应表现出氧化性,与O 2在放电条件下反应表现出还原性,A 、D 项不正确;氮气比空气轻且不溶于水不是N 2能大量存在于空气中的根本原因,B 项不正确。
答案 C4.四支试管中分别充满NO 、SO 2、NO 2、Cl 2中的一种,把它们分别倒立于盛有水的水槽中,充分放置后的现象如图所示。
其中原试管充满NO 2的是( )解析 NO 不溶于水,对应D 项;SO 2易溶于水,对应A 项;NO 2与水发生反应3NO 2+H 2O===2HNO 3+NO ,试管剩余13的气体,对应B 项;根据化学方程式Cl 2+H 2OHCl +HClO 和2HClO=====光照2HCl +O 2↑可知,充分反应后剩余的气体是O 2,且Cl 2与O 2之间满足关系式2Cl 2~O 2,对应C 项。
《大气污染控制工程》(郝吉明版)课后习题及答案 :Unlock-1

作业习题第一章概论1.1干结空气中N 2、O 2、Ar 和CO 2气体所占的质量百分数是多少?1.2根据我国的《环境空气质量标准》的二级标准,求出SO 2、NO 2、CO 三种污染物日平均浓度限值的体积分数。
1.3CCl 4气体与空气混合成体积分数为1.50×10-4的混合气体,在管道中流动的流量为10m 3N 、/s ,试确定:1)CCl 4在混合气体中的质量浓度(g/m 3N )和摩尔浓度c (mol/m 3N );ρ2)每天流经管道的CCl 4质量是多少千克?1.4成人每次吸入的空气量平均为500cm 3,假若每分钟呼吸15次,空气中颗粒物的浓度为200/m 3,试计算每小时沉积于肺泡内的颗粒物质量。
已知该颗粒物在肺泡中的沉降系数g µ为0.12。
1.5设人体肺中的气体含CO 为2.2×10-4,平均含氧量为19.5%。
如果这种浓度保持不变,求COHb 浓度最终将达到饱和水平的百分率。
1.6设人体内有4800mL 血液,每100mL 血液中含20mL 氧。
从事重体力劳动的人的呼吸量为4.2L/min ,受污染空气中所含CO 的浓度为10-4。
如果血液中CO 水平最初为:1)0%;2)2%,计算血液达到7%的CO 饱和度需要多少分钟。
设吸入肺中的CO 全被血液吸收。
1.7粉尘密度1400kg/m 3,平均粒径1.4,在大气中的浓度为0.2mg/m 3,对光的折射率为m µ2.2,计算大气的最大能见度。
Chapter 11.On May 18,1980,Mount Saint Helens in Washington ejected into the atmosphere anestimated 540million tons of ash.a.How does that compare with the emissions of from human activities for 199110PM shown in Table 1.1?b.Is it reasonable to make this comparison?Why or why not?Table 1.1National emissions estimates for 1991(tons/yr)Source category10PM XSO COXNO VOCsPbTransportation 1.510.9943.497.265.080.001622.The National Ambient Air Quality Standard for particulate matter (PM,annual10average)is 50.Every time you breathe,you take in about 1liter(1quart)of air .3/g m m »a.Assuming the the air contains 50of particulate mater,how many grams of3/g m m particulate matter do you take in with every breath?b.Assuming that all the particles are spheres with a diameter of 0.5,how many particles m do you take in with every breath?c.If you are an industry representative,which of these numbers will you cite?If you represent an environmental organization,which will you cite?3.The NAAQS for sulfur sulfurdioxidedioxide (annual average)is 80.Every time you breathe,3/g m m you take in about 1liter literof of air.Assume the air is exactly at the NAAQS for 2SO a.Whit every breath,how many grams of do you take in?2SO b.How many molecules of do you take in?A gram of =molecules.2SO 2SO 219.410´4.If an automobile uses 1gallon of fuel for each 25miles traveled,if the fuel density is 6lb/gal,and if the hydrocarbon (unburned gasoline)emission standard for autos is 0.41g/mile(in the exhaust gas)(Federal Standard for 1981and later automobiles)and the emissions equal this standard,what fraction of the fuel fed to the car is emitted (unburned)in the exhaust gas?Fuel combustion 1.1016.55 4.6710.590.670.00045Industrial processes 1.84 3.16 4.690.607.860.00221Solid waste disposal 0.260.02 2.060.100.690.00069Miscellaneous 0.730.017.180.21 2.590.00000Total5.4420.7362.0918.7616.890.00497Percentage of 1982total97%101%69%92%87%9.5%作业习题解答第一章概论1.1解:按1mol 干空气计算,空气中各组分摩尔比即体积比,故n N2=0.781mol ,n O2=0.209mol ,n Ar =0.00934mol ,n CO2=0.00033mol 。
全国通用版高一化学第一章物质及其变化经典大题例题

(每日一练)全国通用版高一化学第一章物质及其变化经典大题例题填空题1、科学家也在尝试用Cu +作催化剂,将汽车尾气中NO 转化为无毒的N 2。
其原理如下图所示:(1)该过程中,还原剂是_______(用化学式表示)。
(2)某辆汽车的NO 排放量为0.18g ⋅km −1,则该车行驶100km ,完成上述转化时,理论上需消耗乙烯的质量为_______g 。
答案:(1)C 2H 4 (2)5.6 解析: (1)根据图示的原理可得a.2NO+O 2=2NO 2,b.6NO 2+2C 2H 4Cu +__3N 2+4CO 2+4H 2O ,将a×3+b 得:6NO+3O 2+2C 2H 4Cu +__3N 2+4CO 2+4H 2O ,该反应中碳元素化合价由C 2H 4中的-2价变化为CO 2中的+4价,化合价升高,失去电子,所以该过程的还原剂是C 2H 4。
(2)100 km 产生NO 的物质的量=0.18g/km ×100km30g/mol=0.6 mol ,根据反应6NO+3O 2+2C 2H 4Cu +__3N 2+4CO 2+4H 2O 可知,0.6molNO 要消耗C 2H 4的物质的量=13×0.6mol= 0.2mol ,0.2molC 2H 4的质量=0.2mol×28g/mol=5.6g ,故理论上需消耗乙烯的质量为5.6g 。
2、I.写出下列反应的离子方程式: (1)鸡蛋壳溶解在醋酸中:___________。
II.对一份稀溶液做初步分析后发现,溶液无色、澄清,其可能含有SO 42-、Na +、Cu 2+、CO 32-、H +、NO 3-、HCO 3-、Cl −等离子中的若干种。
然后做了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2mL 溶液用BaCl 2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO 3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
氮气一氧化氮二氧化氮含答案高中化学必修一
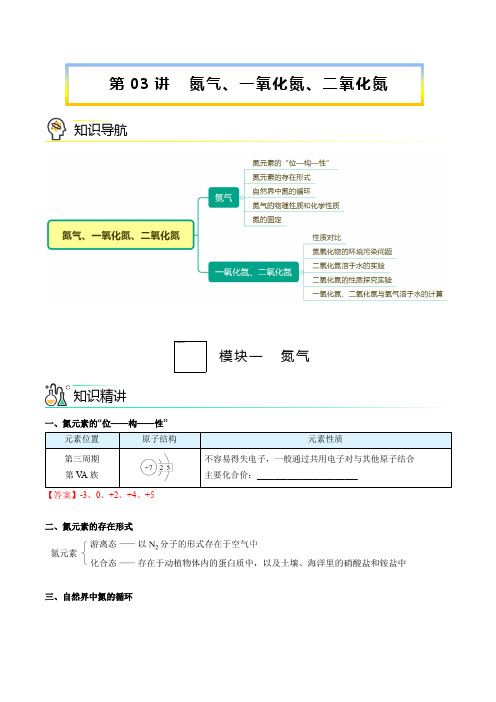
一、氮元素的“位——构——性”元素位置原子结构元素性质第三周期第V A族不容易得失电子,一般通过共用电子对与其他原子结合主要化合价:_______________________【答案】-3、0、+2、+4、+5二、氮元素的存在形式三、自然界中氮的循环第03讲氮气、一氧化氮、二氧化氮知识导航模块一氮气知识精讲四、氮气的物理性质和化学性质物理性质氮气是一种无色无味的气体,难溶于水,密度与空气相近。
化学性质【答案】N 2 + O 2 =====放电2NO N 2 + 3H 2 2NH 3 N 2 + 3Mg =====点燃Mg 3N 2思考与交流:镁条在空气中燃烧,固体产物有几种? 【答案】三种。
Mg 3N 2、MgO 、C (镁条可以在CO 2中燃烧)五、氮的固定1.概念:把空气中游离态的氮转变为氮的化合物的过程。
2.分类:(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或豆科植物根瘤菌将氮气转化为氨。
(2)人工固氮:如工业合成氨。
氮气的性质【例1】下列关于氮气的叙述,正确的是( )经典例题A .氮气性质稳定,即使在高温下也很难跟其他物质发生反应B .氮气比空气轻,且不溶于水C .氮气无氧化性,也无还原性,不跟其他物质反应D .氮气可与许多物质发生化学反应,所以氮气的化学性质活泼 【答案】B氮的循环【例2】氮元素在海洋中的循环是整个海洋生态系统的基础和关键。
海洋中无机氮的循环过程可用下图表示,下列关于海洋中氮循环的说法不正确的是( )A .海洋中的氮循环属于固氮作用的是②B .海洋中的氮循环起始于氮的氧化C .②中的含氮物质转化属于氮的固定化作用D .向海洋排放含-3NO 的废水会影响海洋中+4NH 的含量 【答案】B氮的固定【例3】下列不属于氮的固定的变化是________;属于人工固氮的是_______。
(填序号) ①豆科植物的根瘤菌把空气中的氮气转化为氨 ②氮气和氧气在放电条件下生成NO ③工业上用氨和二氧化碳合成尿素④分离液态空气制氮气⑤工业合成氨 【答案】 ③④;⑤【变3】自然界中时刻存在着氮气的转化。
氮元素的循环解读

通过上一节的学习,我们知道,在一百多种元素中,组成单质及化合物种类最多的元素是碳元素。
那么,你知道地球上含量最丰富的一种元素是什么元素吗?那就是氮元素,氮元素广泛存在于大气、水体、动植物体以及土壤中。
那么,你知道这些氮元素是如何循环的吗?氮元素的循环对我们的环境和地球上的生命又有什么意义呢?研习教材重难点研习点1 氮在自然界中的循环1.自然界中氮元素循环示意图2.主要形式(1)游离态→化合态①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
【领悟·整合】氮是维持高等动植物生命活动的必须元素,因此,氮的循环涉及到地球上生物圈的各个方面。
人类活动也在逐渐的影响到氮循环。
所以,认识氮的循环,就把我们将要学习的物质置于“氮的循环”这个大的背景下,将会更有利于同学们掌握氮及其化合物的性质。
3.氮气与氮的固定(1)氮气的物理性质:无色无味气体,难溶于水,与空气密度相近。
(2)氮气的化学性质:【知识·链接】氮气属于双原子分子,两个氮原子之间的作用非常强。
因此,氮气分子稳定,化学性质不活泼,但要注意,N 2一旦吸收能量变为N 原子则性质较活泼。
在高温或放电时可与某些物质反应,N 表现为既有氧化性,又有还原性。
①与O 2的反应在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮(NO )。
反应式为:N 2+O 22NO说明:在雷雨天气,汽车的发动机中均可以发生该反应。
在该反应中,N 2表现出还原性。
②与H 2反应N 2+3H 2高温、高压催化剂2NH 3说明:a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。
NO2波动1答案之欧阳数创编

NO.2 机械波(1)班级 学号 姓名 成绩 一 选择题1.一沿x 轴负方向传播的平面简谐波在t = 2 s 时的波形曲线如图所示,则原点O(A))21(cos 50.0ππ+=t y , (SI). (B) )2121(cos 50.0ππ-=t y , (SI).(C))2121(cos 50.0ππ+=t y , (SI). (D))2141(cos 50.0ππ+=t y , (SI). 【 C 】2.图示一简谐波在t = 0时刻的波形图,波速u = 200 m/s ,则图中O (A))21cos(4.02π-ππ=t a (SI). (B))23cos(4.02π-ππ=t a (SI). (C))2cos(4.02π-ππ-=t a (SI). (D))212cos(4.02π+ππ-=t a (SI) 【 D 】3.如图所示,一平面简谐波沿x 轴正向传播,已知P 点的振动方程为)cos(0φω+=t A y y (m)(m) y (m)(A) }]/)([cos{0φω+--=u l x t A y . (B) })]/([cos{0φω+-=u x t A y . (C) )/(cos u x t A y -=ω. (D)}]/)([cos{0φω+-+=u l x t A y .【 A 】二 填空题1. 一横波的表达式为:mx t y )]5.2(10cos[01.0-=π,在t =0.1s 时,x =2m 处,质点的位移是 0m ,速度是 -0.25πm/s 。
2.图示为一平面简谐波在t=2s 时刻的波形图,波的振幅为0.2m ,周期为4s ,则图中P 点处质点的振动方程为:mt y P )22cos(2.0ππ-= 。
um )3.如图所示为一平面简谐波在t=2s 时刻的波形图,该简谐波的波动方程是mu x t u A y ]23)2(2cos[πλπ+--=;P处质点的振动方程是mt u A y ]2)2(2cos[πλπ+-= 。
环境监测试题库及答案

环境监测试题库及答案《环境监测》试题(A卷)一、基本概念:(每个2分,共10分)1(等效连续声级2(空白试验3(细菌总数4(生物监测5(静态配气法二、填空题(每空1分,共20分):1(从信息角度看,环境监测的实质是______ 、_____ 、______ 、_____的过程;2(在一条垂线上,当水深 ___时,可设一点,具体位置在____ ,当水深______时,应设两点,具体位置分别是_______ ;3(水样预处理的两个主要目的分别是 ______、_______ ;4(F-选择电极的传感膜是 ________;5(氰化物造成人即刻中毒的原因是__________;6(大气采样时,常用的布点方法分别是______ 、 ______、_____、_______ ;7(4氨基安替比林是测 __________的显色剂,测六价铬的显色剂是 _______;8(大气采样时要求相对高度是 _______;9(今测得大气中的SO2浓度为3.4ppm,其重量浓度为_______mg/l;10(作用于某一点的三个噪声源的声压级分别是75dB、75dB、89dB,则该点的总声压级为__;三、选择题(每题1分,共10分,1—5为单选题,6—10为多选题)1(下列水质监测项目应现场测定的是( )A、 CODB、挥发酚C、六价铬D、pH2(测定某化工厂的汞含量,其取样点应是( )A、工厂总排污口B、车间排污口C、简易汞回收装置排污口D、取样方便的地方3(声音的频率范围是( )A、 20Hz,f,20000HzB、f,200Hz 或 f,20000HzC、f,200Hz 或 f,2000HzD、20Hz,f,2000Hz 4(测定大气中NO2时,需要在现场同时测定气温和气压,其目的是( )A、了解气象因素B、换算标况体积C、判断污染水平D、以上都对5(水样金属、无机非金属、有机物测定时常用的预处理方法分别是( )A、消解、蒸馏、萃取B、消解、萃取、蒸馏C、消解、蒸馏、挥发D、蒸馏、消解、萃取6(大气采样器主要有( )等部件组成A、收集器B、压力计C、抽气泵D、温度计E、流量计7(关于COD测定,正确的描述有( );A、试亚铁灵为指示剂B、加HgSO4掩蔽Cl-C、加Ag2SO4D、加热回流30分钟E、消耗的氧化剂为O28. 在水样中加入 __________ 是为防止金属沉淀。
高二计算题

有关NO2,NO和O2反应的有关计算一.原理:因为这一反应过程是一个多步反应过程,即:2NO + O2 ==2NO2--(1)3NO2 + H2O == 2HNO3 + NO↑ --(2)由上述两式通过加合可以得到4NO2 + O2 + 2H2O == 4HNO3--(3)或: 4NO + 3O2+ 2H2O == 4HNO3 -- (4)二.结论:1、NO2或NO2与N2(非O2)的混合气体溶于水时,可根据反应:3NO2+H 2O=2HNO3+NO,利用气体体积的变化差值进行计算.2、NO2和O2的混合气体溶于水时,根据反应:4NO2+O2+2H2O=4HNO3当V(NO2)∶V(O2)3、NO和O2同时通入水中时,此时的反应为:4NO+3O2+2H2O=4HNO3当V(NO) ∶V(O2)练习:1. 将一充满NO的试管倒扣于水槽中,然后向试管中通入一定量的O2,试管中恰好充满水时,则通入的O2与原NO气体的体积比为。
[答案]3∶4.2. 将盛有10ml二氧化氮和10ml一氧化氮混合气体的大试管倒立于水槽中,向其中缓慢通入氧气,一段时间后,试管内残留2ml气体,求通入的氧气体积(解答详细一点)答案:8.5ml或12ml解题思路:4NO2 + O2 + 2H2O=4HNO3 4NO + 3O2 + 2H2O=4HNO3 10ml 2.5ml 10ml 7.5ml(10-2)ml 6ml因为NO2溶于水,所以残留气体只能是NO或O2,见上式,若NO过量,则消耗O2 2.5ml+6ml=8.5ml,若过量的是氧气,那么消耗氧气量为2.5ml+7.5ml+2ml=12ml3. 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为A.①>②B.①<②C.①=②D.不能确定解析:设烧瓶的容积为V L ,V L NH 3全部溶于水,形成溶液的体积为V L ,V L 的NO 2完全反应后,生成了31V L 的NO 气体,形成的溶液的体积为32V L ,从N 原子守恒角度分析,也有32V L 的NO 2转化生成溶质HNO 3.所以两溶液的物质的量浓度相等。
人教版高一化学必修1练习:第四章 第三节 第2课时 二氧化氮、一氧化氮及酸雨含答案

第2课时二氧化氮、一氧化氮及酸雨课后篇巩固提升基础巩固1.下列关于NO2和SO2的说法中错误的是( )A.它们都是易溶于水的有色气体B.它们都是具有刺激性气味的有毒气体C.大气中的NO2和SO2可以形成酸雨D.提高机动车尾气排放标准有利于提高空气质量,二氧化氮是红棕色气体,A项错误;NO2和SO2都是具有刺激性气味的有毒气体,B项正确;SO2溶于水会与水反应生成亚硫酸,亚硫酸易被氧化为硫酸,NO2溶于水会与水反应生成硝酸和一氧化氮,因此大气中的NO2和SO2可以形成酸雨,C项正确;提高机动车尾气排放标准可以减少二氧化硫和二氧化氮等气体的排放,因此有利于提高空气质量,D项正确。
2.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。
再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )A.N2、NO2、Br2B.NO2、NO、N2C.NO2、NO、O2D.N2、O2、Br2NO2和Br2中的至少一种,溶于水得橙色溶液说明气体中必定含有溴蒸气,所得无色气体遇空气重新变为红棕色说明无色气体含NO。
原气体可能既有NO2也有Br2。
3.在一定温度和压强下,将装有N2和NO2混合气体的试管倒立在水中,经足够长时间后,试管内气体,则原混合气体中N2与NO2的体积比是( ) 体积缩小为原体积的35A.2∶3B.3∶2C.3∶5D.5∶32与水反应使气体的体积减小,设原混合气体的体积为5mL,则:3NO2+H2O2HNO3+NO ΔV3 1 2V(NO2) 5mL×(1-3)5V(NO2)=3mLV(N2)∶V(NO2)=(5mL-3mL)∶3mL=2∶34.下列关于试剂保存或除杂试剂选择的叙述不正确的是( )A.金属钠应该保存在煤油中B.漂白粉可以敞开存放C.除去NO中混有的NO2:排水集气D.除去Cl2中混有的HCl气体:饱和食盐水洗气,钠不与煤油反应,密度大于煤油,因此金属钠可保存在煤油中,A项正确;次氯酸钙容易吸收空气中的水和二氧化碳转化为次氯酸,次氯酸易分解而使漂白粉变质,所以漂白粉不可以敞开存放,B项错误;二氧化氮溶于水生成硝酸和NO,则除去NO中混有的NO2可以用蒸馏水洗气的方法,C项正确;氯化氢极易溶于水,则除去Cl2中混有的HCl气体可以用饱和食盐水洗气,D 项正确。
高一化学一氧化氮和二氧化氮知识点总结

高一化学一氧化氮和二氧化氮知识点总结高中化学课有些内容比较生动有趣,有些内容的确比较枯燥。
对化学缺乏兴趣,其中重要原因是要选择对的学习方法等。
一起来看看一氧化氮和二氧化氮知识点!【一氧化氮和二氧化氮知识点】一氧化氮在自然界形成条件为高温或放电:N2+O2 ========(高温或放电) 2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮: 2NO+O2 == 2NO2 一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:3NO2+H2O == 2HNO3+NO 这是工业制硝酸的方法。
【同步练习题】1.下列氧化物中,不是酸酐的是()A.N2O3B.NO2C.N2O5D.P2O5【答案】B【解析】N+4O2无对应的氮的化合价相同的含氧酸。
2.下列气体中只能用排水法不能用排空气法收集的是()A.SO2B.NOC.NO2D.N2【答案】BD3.的研究表明:一氧化氮吸入治疗法可快速改善SARS中重症患者的缺氧状况,缓解病情。
病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。
下列关于一氧化氮的叙述正确的是A.一氧化氮是一种红棕色的气体B.常温常压下,一氧化氮不能与空气中的氧气直接化合C.一氧化氮可以由氮气和氧气在放电条件下直接化合得到D.一氧化氮易溶于水,不能用排水法收集【答案】C【解析】N2和O2在放电条件下直接化合生成NO,NO为无色气体,不溶于水,能与O2直接化合生成NO2。
4.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为A.3∶1B.1∶3C.1∶2D.2∶1【答案】C【解析】反应中2 mol NO2被氧化,1 mol NO2被还原,即发生还原反应和发生氧化反应的物质都是NO2,物质的量比为1∶2,则质量比也为1∶2。
5.下列物质不属于“城市空气质量日报”报道的是A.SO2B.氮氧化合物C.CO2D.悬浮颗粒【答案】C【解析】属于大气污染物的是二氧化硫、氮的氧化物及悬浮颗粒等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NO.2 机械波(1)
班级 学号 姓名 成绩
一 选择题
1. 一沿x 轴负方向传播的平面简谐波在t = 2 s 时的波形曲线如图所示,则原点O 的振动方程为
(A) )2
1
(cos 50.0ππ+=t y , (SI). (B) )21
21(cos 50.0ππ-=t y , (SI).
(C) )21
21(cos
50.0ππ+=t y , (SI).
(D)
)2
1
41(cos 50.0ππ+=t y , (SI).
【 C 】
2. 图示一简谐波在t = 0时刻的波形图,波速 u = 200 m/s ,则图中O 点的振动加速度的表达式为
(A) )21cos(4.02π-ππ=t a (SI). (B) )23cos(4.02π-ππ=t a (SI).
(C) )2cos(4.02
π-ππ-=t a (SI).
(D) )2
1
2cos(4.02π+ππ-=t a (SI)
【 D 】
3. 如图所示,一平面简谐波沿x 轴正向传播,已知P 点的振动方程为)cos(0φω+=t A y ,则波的表达式为
(A) }]/)([cos{0φω+--=u l x t A y . (B) })]/([cos{0φω+-=u x t A y . (C) )/(cos u x t A y -=ω.
(D) }]/)([cos{0φω+-+=u l x t A y .
【 A 】
二 填空题
y (m) x
y
1. 一横波的表达式为:m x t y )]5.2(10cos[01.0-=π,在t =0.1s 时,x =2m 处,质点的位移是 0 m ,速度是 -0.25π m/s 。
2.图示为一平面简谐波在t=2s 时刻的波形图,
波的振幅为0.2m ,周期
为4 s ,则图中P 点处质点的振动方程为: m t y P )2
2cos(2.0π
π-= 。
3.如图所示为一平面简谐波在t=2s 时刻的波形图,该简谐波的波动方程是
m u x t u A y ]2
3)2(2cos[π
λπ+--=;P 处质点的振动方程是
m t u A y ]2
)2(2cos[π
λπ+-= 。
(该波的振幅A 、波速u 、波长λ为已知量)
u
x (m )
u
x (m )
4. 一平面简谐波在某时刻的波形如图所示,则λ= 30m 。
x(m
三 计算题
1. 设入射波的方程为)//(2cos 1T t x A y +=λπ,在x =0处发生反射,反射点为一固定端,设反射时无能量损失,求反射波的方程式。
2. 如图所示为一平面简谐波在t=0时刻的波形曲线,设此简谐波的频率为250Hz,且此时质点P运动方向向下,求:
(2)在距原点O为100m处质点的振动方程
与振动速度表达式。
