《无菌制剂生产关键控制指导》0711
无菌制剂生产质量管理规范

厂房与设施
物理化学性质如粘度的标准,邻苯二甲酸二辛酯 (DOP)和多聚-α -烯烃是合适的检漏用气溶胶。 完整的HEPA滤器应能够截留至少99.97%的、 直径0.3μm的微粒。 应在适当位置进行检漏试验,用适当的光度计 探针进行下端一侧滤器表面的扫描,取样速度至 少每分钟一立方英尺。 应对整个滤器的表面和边框进行适当扫描,位 置为距滤器表面一到两英寸。应在文件中完整的 记录HEPA滤器的广泛扫描。 单一探针的读数等于上端挑战的0.01%应视为明 显渗漏的指标,应要求更换HEPA滤器,或必要时 在限制区域维修。
组分和容器/密闭系统
在最终密封产品前的检测中,应检测并清除任 何损坏的或有缺陷的装置。 设备适应性问题或新容器或密闭系统缺陷能引 起容器密闭系统完整性的丧失。 在传送装置方面的功能性缺陷(例如注射器设 计缺陷、传送体积)也能导致产品质量问题,应 在相应的生产中检验并监测。 药物制剂成分、容器、密闭系统、贮藏时限和 生产设备均应在内毒素控制说明的范围内。
厂房与设施
适当的设施监测系统将迅速检测到可能危及设 施环境的非典型变化。有效的系统可促进操作条 件在达到作用水平前恢复到已确定的、合格的水 平。 四、空气过滤 1、膜过滤 压缩气体应具有适当的纯度(如果不含油), 过滤后其微生物和微粒质量应等于或优于引入气 体的环境中的空气的微生物和微粒质量。 膜滤器可用来过滤压缩气体以达到适当高标准 的质量。 气体过滤器应保持干燥,气体过滤器上面的冷
厂房与设施
在不同级别相连的房间之间(门关闭下),应 保持至少10~15Pa的压差。 在具有与无菌操作室相邻的未分级别的房间设 计的任何设施中,为了防止污染,应始终保持无 菌操作室的正压至少大于12.5Pa。 FDA建议 (1)应连续监测并在每次转换班时经常记录洁净 室之间的压差,应在文件中记录所有的报警,并 应调查与已确定限度的偏差。 (2)空气交换的速度是另外一个重要的洁净室设 计参数,对于100000级(ISO 8)的支持室,达到 20次/小时的换气次数一般是可以接受的。值得注 意的是,对于10000级和100级的区域,通常需要 更高的空气换气次数。
无菌药品生产过程中的无菌控制解析

无菌药品生产过程中的无菌控制解析【摘要】医疗领域的发展,对于药品生产方面,不管是质量方面,还是安全方面,其要求有明显提高,特别是在生产无菌药品时。
文章针对药品的无菌生活中常见的一些问题进行研究,提出了相应的无菌控制措施,其目的就是保证无菌药品生产的质量,降低风险的产生,实现良好的生产效益。
【关键词】无菌药品;生产质量;无菌控制;新药品的不断出台,对于无菌药品生产过程不断提出了新的要求,尤其在无菌药品控制方面,只有采用响应的控制措施,对每项生产环节进行严格的控制,提升药品的质量,减少存在的安全问题。
且在生产时经常会因为某些因素的影响,产生各种问题或者突发事件,这时就需要及时的进行处理,并且还需要掌握主要关键因素及其注意事项,这样才能消除隐患,提升生产效率,满足医疗领域发展的需求。
一、无菌药品分析无菌药品主要包括注射用制剂、眼用制剂、植入剂等方面,其详细内容如下。
1、注射用制剂注射用制剂主要是由药物制作成药剂,利用医疗设备直接注入肌体内,主要构成:药品、容器、溶剂等。
且类型也非常多,有混悬液、粉针剂等等。
在药品注射时,需要使用注射器,直接注射至患者的肌肉或静脉内,所以必须结合实际情况对药物、溶剂、附加剂等方面进行严格的把控,提升其质量,确保注射用制剂的稳定性和安全性。
2、眼用制剂眼用制剂是眼用药品,也属于无菌制品,主要是因为眼睛敏感性高,易受微生物影响造成一系列的不良反应。
再加上眼用的制剂有凝胶类、滴眼类等不同的制剂类型。
3、植入剂通过植入、针头等,将药品植入至患者的体内、皮下,称之为植入剂,并且主要是以生物剂型聚合物作为主要材料。
同时,植入剂的出现有效解决手术植入载体难度较大的问题。
另外,由于植入剂具有一定的特殊性,一旦有微生物进入,就会出现感染、发炎等不良反应,所以植入剂也属于无菌药品。
二、无菌药品生产要求无菌药品生产的要求相对较高,首先需要在干净的生产洁净车间进行生产,并且一定要经过相应的检测、临床试验、验证,监管部门核查合格,取得生产批文后,才可展开生产工作。
无菌药品生产控制措施技术指南最新版

无菌药品生产控制措施技术指南最新版The latest version of the Technical Guidelines for Aseptic Manufacturing Control Measures in Pharmaceutical Production.With the advancement of pharmaceutical manufacturing and technology, ensuring the safety and quality of aseptic products has become increasingly important. The Technical Guidelines for Aseptic Manufacturing Control Measures in Pharmaceutical Production provides valuable guidance on how to effectively control the production process and maintain product sterility.The guidelines cover various aspects of aseptic manufacturing, including environmental monitoring,personnel training and qualification, equipment validation, and process controls. These measures are essential for minimizing contamination risks and maintaining product sterility throughout the entire production process.Environmental monitoring plays a crucial role in aseptic manufacturing. Regular monitoring of critical areas such ascleanrooms helps identify potential sources of contamination. Airborne viable particle counts, surface sampling, and microbial monitoring are some key methods used to assess the cleanliness of production environments. Through continuous monitoring and analysis, manufacturers can take necessary corrective actions to prevent contamination before it affects product quality.Personnel training and qualification are equally important in maintaining proper aseptic techniques. All personnel involved in aseptic manufacturing should receive thorough training on aseptic practices, gowning procedures, hand hygiene, and other relevant topics. Only trained personnel should be allowed to work in critical production areas to minimize the risk of introducing contaminants into the environment.Validation of equipment used in aseptic manufacturing is another essential aspect covered by the guidelines. Equipment used for processing sterile products must undergo validation processes to ensure its capability to maintain sterility during operation. This includes assessing factorslike temperature control, filter integrity testing, leak testing, and proper equipment cleaning procedures. Routine maintenance and periodic revalidation are also recommended to ensure continued equipment reliability.Process controls are critical for maintaining product sterility throughout manufacturing operations. The guidelines outline recommended measures such as line clearance procedures, effective disinfection techniques, proper use of sterile filters during filling processes, container closure integrity testing (CCIT), and effective labeling and storage practices. These controls help minimize the risk of contamination at each step of the production process.In summary, the Technical Guidelines for Aseptic Manufacturing Control Measures in Pharmaceutical Production provide comprehensive recommendations on how to ensure the safety and quality of aseptic products. By implementing these guidelines, pharmaceutical manufacturers can effectively control contamination risks and maintain product sterility throughout the production process,ultimately providing patients with safe and effective medications.这本无菌药品生产控制措施技术指南的最新版为制药生产过程提供了宝贵的指导,以确保无菌产品的安全性和质量。
无菌工艺生产的无菌药品行业指南

无菌工艺生产的无菌药品行业指南下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!无菌工艺生产的无菌药品行业指南引言无菌药品的生产是药品行业中至关重要的一环。
无菌制剂生产技术

微孔滤膜的滤过器:
圆盘形膜滤器
滤膜安放时,反面朝向被滤过液体,有利于 防止膜的堵塞。
安装前,滤膜应放在注射用水中浸渍润湿12 h(70℃)以上。
安装时,滤膜上还可以加2~3层滤纸,以提 高滤过效果。
2、注射液的滤过装置
高位静压滤过:质量好、慢
2、注射液的滤过装置
减压滤过
加压滤过
设备简单
力不能超过98 kPa。
微孔滤膜滤器: 微孔滤膜是用高分子材料制成的薄膜滤过介质。 孔径从0.025~14 m 特点: ➢ 孔径小、均匀、截留能力强; ➢ 质地轻而薄(0.1~0.15 mm)而且孔隙率高(微孔 体积占薄膜总体积的80%左右),阻力小、滤速快, ➢ 滤过时无介质脱落也不影响药液的pH值; ➢ 滤膜吸附性少,不滞留药液; ➢ 滤膜用后弃去,药液之间不会产生交叉污染等。 ➢ 但易堵塞及有些纤维素类滤膜稳定性不理想。
无菌制剂生产技术
一、洁净室的净化标准
洁净度 级别
尘粒最大允许数 /m3
0.5m 5m
100级
10 000级
3 500 350 000
பைடு நூலகம்
0 2 000
微生物最大允许数
浮游菌/ m3
5
沉降菌 / m3
1
100
3
100 000 3 500 000 20 000 500
10
级
300 000 级
10 500 000
结晶水,含量下降(灭菌),
2)配制用具的选择、处理
配液缸 清洗、灭菌
3)配制方法 浓配法:杂质多、过滤时间 稀配法:原料质量好 新鲜注射用水〈 12h 半成品检测后,灌装。
2、注射液的滤过
(1)滤器种类与特点 粗滤(预滤)及精滤(末端滤过)。 粗滤滤器包括砂滤棒、板框式压滤器、
无菌药品生产过程中的污染与控制

无菌药品生产过程中的污染与控制提纲132一、无菌药品生产简述◆无菌的定义:无菌指没有活的微生物。
◆无菌技术的定义:保持无菌物品、无菌区域不被污染、防止病原微生物侵入人体的一系列操作技术。
◆无菌物品的定义:经过物理或化学方法灭菌后,未被污染的物品的物品。
一、无菌药品生产简述◆无菌药品定义:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
(2010版GMP无菌药品附录)◆常用的无菌药品一、无菌药品生产简述◆无菌生产工艺的基本特点无菌产品的质量不能完全依赖于对成品的无菌度测试。
◆取样检查不能保证支支的合格◆概率上的“无菌”理论上:无菌=没有任何活的微生物实际上:我们无法证明产品中没有活微生物存在实际我们无法明产品中没有活微物存在◆无法对整批产品进行100%检验一、无菌药品生产简述◆无菌制剂的生产工艺:-采用最终灭菌工艺的为最终灭菌产品;-部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
一、无菌药品生产简述◆最终灭菌与非最终灭菌有着本质的区别◆最终灭菌:◆通常是在高质量的环境条件下进行灌装和密封产品容器。
产品在这类环境下灌装和封口是要最大一、无菌药品生产简述◆非最终灭菌的产品:◆在无菌生产工艺中,药品,容器及密封件首先要分别灭菌,然后把其组装起来。
由于在最终容器的产品不再经过灭菌处理,所以容器灌装及封口要在非常高质量的环境下进行。
无菌生产加工较最终灭菌方法有更多的变数。
◆在无菌组装成最终产品前,保证最终产品的各构成部分一一、无菌药品生产简述◆无菌产品生产涉及的内容示意图最终灭菌硬件厂房设施空调净化系统设备、仪器生产管理制约用水系统工艺用气系统物料无菌转运一、无菌药品生产简述◆控制生产过程中质量风险的目标:◆最终灭菌制剂:-灭菌前控制和最大程度减少产品的生物负荷-无菌保证水平为残存微生物污染概率≤10-6非最终灭菌制剂◆非最终灭菌制剂:一、无菌药品生产简述◆实施GMP管理是无菌药品质量保证的基础◆确保持续稳定地生产出合格的药品–适用于预定用途–符合注册要求–不仅限于质量标准最大限度减少药品生产过程中的风险交叉污染!二、无菌药品生产的污染源◆无菌药品GMP管理的基本原则◆2010版GMP无菌药品附录基本要求:◆第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
gmp无菌制剂的控制策略

gmp无菌制剂的控制策略在无菌药品的生产中,确保产品质量和安全性的关键在于对整个生产过程进行全面的控制。
以下是gmp无菌制剂的控制策略:1. 原辅料和包装材料的管理:原辅料和包装材料的质量直接影响产品的质量和安全性。
应对供应商进行严格的评估和审计,确保其符合质量要求。
同时,对物料的验收、存储、发放等环节进行严格控制,确保物料的质量和稳定性。
2. 工艺过程控制:无菌药品的生产过程中,应确保工艺参数的稳定性和一致性。
通过监控关键工艺参数,如温度、压力、时间等,确保工艺的一致性和可重复性。
同时,对生产过程中可能引入的微生物和微粒进行严格控制,确保产品的无菌性和安全性。
3. 环境监控:无菌药品的生产环境要求极高,应对生产环境进行严格监控。
通过定期对空气、表面和人员等进行微生物检测,以及时发现并控制污染源,确保生产环境的洁净度和无菌性。
4. 人员管理:人员是生产过程中的重要因素,也是最容易引入污染的环节之一。
应对人员进入无菌区的程序进行严格控制,确保人员符合规定要求。
同时,对人员进行严格的培训和资质管理,提高人员的操作技能和无菌意识,确保人员的行为符合无菌药品的生产要求。
5. 设备维护和清洗:设备是生产过程中的重要工具,其清洁度和维护状况直接影响产品的质量和安全性。
应定期对设备进行清洗和检查,确保其符合生产和质量要求。
同时,建立设备维修和保养制度,对设备进行全面的维护和管理,确保设备的正常运行和使用寿命。
6. 质量保证体系:建立完善的质量保证体系是确保无菌药品质量和安全性的关键。
应定期对生产过程进行审计和评估,及时发现并处理潜在的问题和风险。
同时,对生产过程和产品进行严格的检验和控制,确保产品符合质量标准要求。
无菌药品生产质量控制

无菌药品生产质量控制目前,无菌药品的生产是药品制作及生产工作中最为严格、风险最大的项目之一。
随着社会发展,药品控制对无菌生产的要求及变化均显著增大,同时提出了新的认知标准及看法。
本文通过分析无菌药品生产质量问题的关键因素,提出了生产质量控制的方法,以对无菌药品的生产质量控制提出保证依据。
關键词:无菌药品;生存;质量控制无菌药品的生产质量控制对药品产量、质量均具有更好保证。
目前,我国制药业的无菌控制水平不断面临新挑战,多数企业是以改造环境、更新生产设备等措施,来提升无菌药品生产质量控制水平。
但报道显示,仅更新药品的生产硬件对提升无菌控制水平仍然不足,如何按照相关法规,合理的优化生产过程控制,实现新版GMP认证要求,对切实提高无菌药品生产质量控制水平十分重要。
本文将以注射用七叶皂苷钠生产为例,通过分析其生产质量问题的关键因素,拟研究和制定生产质量控制的方法。
1 无菌药品物料及供应商的生产质量控制物料是指药品的原料药及药用辅料,其对无菌药品的产品质量十分重要,物料的选用需符合药用要求和法定质量标准,其为无菌药品生产的基础要求。
与其他非无菌制剂相较,注射用七叶皂苷钠使用的物料更多考虑微生物方面的因素。
供应商作为物料提供者,其生产质量管理水平可直接决定物料质量,因此,对物料供应商的供应能力进行管理,也是无菌药品一个重要的生产质量控制点。
注射用七叶皂苷钠使用物料的微生物对无菌保证水平具有重要作用,此外,原辅料中微生物代谢活动可产生热源性物质,因此,需对物料进行微生物限度控制,包括物料在注射用七叶皂苷钠中的用量、处方中物料种类、配制为药液至除菌过滤或灭菌的时间等。
在生产质量控制中,需规定生产一定数量或需要原始物料、包装物料的供应商均注明各项注意事项和生产工艺,同时进行现场审核,经批准后不随意改变;生产过程中,严格按照生产工作规程进行岗位操作和岗位生产记录,即按照工艺要求执行无菌药品生产的具体方法与步骤,并记载执行规程、执行结果、操作参数等文字数据。
无菌制剂生产质量管理规范

组分和容器/密闭系统
除热源,验证数据应证明该操作减少内毒素含量 至少99.9%(3个对数值)。 用于非胃肠道制品的塑料容器也应无热源,必 要时多次热的注射用水冲洗可有效地去除这些容 器的热源。 在证明环氧乙烷和其它气体灭菌操作的作用时, 生物指示剂是特别重要的。 洗涤、干燥(必要时)和灭菌之间的时间应减 少到最大的限度,因为塞子上的残留水分能支持 微生物的生长和内毒素的生成。 还有一种潜在的污染源是橡皮塞的硅化。 (2)容器密封系统的检测 对于允许微生物穿透的容器密闭系统是不适合 于无菌产品的。
人员培训、资质与监督
一、人员 (1)仅用无菌仪器接触无菌材料,在整个操作中 必要时更换器械。在初始穿衣后,无菌手套要经 常消毒或更换,人员不应使其衣服或手套的任何 部分直接接触无菌产品、容器、密闭系统或关键 表面。 (2)在整个洁净区应遵循缓慢、小心移动的原则, 在关键区域的快速移动会产生不可接受的湍流。 (3)单向气流设计是用于保护无菌设备表面、容 器-密闭系统和产品的,应保持整个身体在单向气 流之外。破坏关键区域单向气流可能对产品无菌 度带来危险。
厂房与设施
适当的设施监测系统将迅速检测到可能危及设 施环境的非典型变化。有效的系统可促进操作条 件在达到作用水平前恢复到已确定的、合格的水 平。 四、空气过滤 1、膜过滤 压缩气体应具有适当的纯度(如果不含油), 过滤后其微生物和微粒质量应等于或优于引入气 体的环境中的空气的微生物和微粒质量。 膜滤器可用来过滤压缩气体以达到适当高标准 的质量。 气体过滤器应保持干燥,气体过滤器上面的冷
人员培训、资质与监督
(4)应从产品的侧边而不是上面进行正确的无菌 操作,同时在接近关键区域时,操作人员应避免 说话。 (5)在无菌操作前和整个操作过程中,操作人员 不应从事任何对衣物产生不合理污染危险的活动。 (6)衣服应提供身体和暴露的无菌物料间的屏障, 防止人体产生的微粒和来自人体脱落微生物的污 染。 (7)建议在操作人员的衣物上若干位置进行微生 物表面取样,以保证无菌穿衣技术和状态始终是 可接受的。 (8)对于人员参与最少的自动操作,每年重新合 格认证一次通常是足够的。 二、实验室人员
无菌医疗器械生产质量控制指南

无菌医疗器械生产质量控制指南引言无菌医疗器械生产质量控制的重要性患者安全:无菌医疗器械直接用于手术和治疗过程中,如无菌性不能得到保证,可能导致患者感染和并发症的发生。
法规合规:医疗器械行业存在严格的法规和标准,无菌医疗器械的生产必须符合相关法规,以确保合规性和合法性。
生产效能:无菌医疗器械生产过程中需要进行严格的质量控制,以提高生产效能,降低产品次品率和废品率。
无菌医疗器械生产质量控制的流程1. 设计和规划阶段在无菌医疗器械生产前,需要进行设计和规划阶段的工作。
这包括确定器械的设计需求、制定工艺流程和开展风险评估。
1.1 设计需求根据无菌医疗器械的用途和特性,确定器械的设计需求,包括大小、形状、材料等。
1.2 工艺流程制定无菌医疗器械的生产工艺流程,明确每个步骤和环节的要求,确保无菌状态的保持。
1.3 风险评估对无菌医疗器械生产过程进行风险评估,确定可能存在的风险和危害,并采取措施来控制和减轻风险。
2. 原材料采购和接收检查在无菌医疗器械生产过程中,原材料的质量直接影响产品的无菌性。
因此,对原材料的采购和接收检查非常重要。
2.1 供应商评估评估原材料供应商的质量管理体系和能力,确保供应商符合相关标准和法规要求。
2.2 确认原材料的无菌性对每批原材料进行无菌性检查,确保原材料本身是无菌的。
2.3 外观质量检查对原材料的外观质量进行检查,确保无明显瑕疵和污染。
3. 生产过程控制无菌医疗器械的生产过程需要严格控制以确保产品的无菌性。
3.1 清洁和消毒在生产过程中,对生产环境和设备进行清洁和消毒,以防止污染的引入。
3.2 严格操作规程制定严格的操作规程,规范员工的操作行为,避免操作错误和交叉污染。
3.3 无菌隔离和密封在生产过程中,采取无菌隔离和密封措施,避免外界污染的侵入。
4. 产品监控和质量检查对生产出的无菌医疗器械进行监控和质量检查,确保产品的无菌状态。
4.1 在线监测在生产过程中进行在线监测,及时检测和控制无菌状态。
无菌保证及关键控制点

【质量】无菌保证及关键控制点制药业| 2016-01-18 16:54★无菌药品的生产须满足其质量和预定用途的要求,防止微生物、各种微粒和热原污染——生产人员的技能、所接受的培训及工作态度是达到上述目标的关键因素;无菌药品的生产必须严格按照工艺的设计并经验证的方法及规程进行,产品的无菌或其他质量特性,绝不能只依赖任何形式的最终处理或成品检验。
★药品生产质量管理的要求是制定生产工艺;系统地回顾并证明其可持续稳定地生产出符合要求的产品;生产工艺及其重大变更均经过验证。
药品GMP 对“质量风险管理”引入了质量风险管理的概念。
分别从原辅料采购、生产工艺变更、操作中的偏差处理、发现问题的调查和纠正、上市后药品质量的监控方面,增加了如供应商审计、变更控制、纠正和预防措施、产品质量回顾分析等新制度和措施,对各个环节可能出现的风险进行管理和控制,主动防范质量事故的发生。
在生产质量管理中,依照GMP 的要求,制定相关的规章制度是将企业职工在生产过程中的行为纳入法制轨道的重要举措,工艺规程是制度中的重要一项。
生产工艺规程是产品设计、质量标准和生产、技术、质量管理的集合,是组织生产的法规,是生产管理的主要依据,同时也是技术管理的基础。
任何对规程的违背将使产品质量发生重大问题。
所有药品的生产和包装均应当按照批准的工艺规程和操作规程进行操作并的相关记录,以确保药品达到规定的质量标准,并符合药品生产许可和注册批准的要求。
工艺规程不得任意更改。
如需更改,应当按照相关的程序修订、审核、批准。
图1 对连接产品和工艺的理解无菌药品的质量控制1. 最终灭菌小容量注射剂关键工序的控制要点:●安瓿:清洁度和干燥程度。
●配药:批号划分与编制、主药含量、pH 值、澄明度、色泽、过滤器材的检查等。
●灌封:长度、外观、装量、澄明度。
●灭菌:灭菌柜——标记、装量、温度、时间、真空度、记录。
灭菌前后半成品——外观清洁度、标记、存放区。
●灯检:抽查澄明度、每盘标记、灯检者代号、存放区。
无菌生产控制讲义

无菌制剂无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括注射剂、无菌软膏剂、无菌混悬剂等。
无菌药品需要对可能引起微粒、微生物和内毒素的潜在污染进行严格控制,无菌工艺的本质就是减少或者消除这些潜在污染源。
无菌药品的生产工艺分为最终灭菌工艺和无菌生产工艺,二者之间存在本质区别。
我公司的无菌产品是属于无菌生产工艺。
药品质量源于设计,但实现于制造过程,因此生产管理是保证药品质量形成的关键过程。
法规要求2010 版无菌药品附录第四十六条生产的每个阶段(包括灭菌前的各阶段)应当采取措施降低污染。
第四十八条应当采取措施保证验证不能对生产造成不良影响。
第五十一条当无菌生产正在进行时,应当特别注意减少洁净区内的各种活动。
应当减少人员走动,避免剧烈活动散发过多的微粒和微生物。
由于所穿工作服的特性,环境的温湿度应当保证操作人员的舒服性。
第五十三条洁净区内应当避免使用易脱落纤维的容器和物料;在无菌生产的过程中,不得使用此类容器和物料。
第五十四条应当采取各种措施减少最终产品的微粒污染。
第五十五条最终清洗后包装材料、容器和设备的处理应当避免被再次污染。
第五十九条无菌生产所用的包装材料、容器和设备和任何其它物品都应当灭菌,并通过双扉灭菌柜进入无菌生产区,或以其它方式进入无菌生产区,但应当避免引入污染。
产品生产实现要素1. 物料物料的供应所有物料供应商的确定及变更均应进行质量评估,并经质量管理部门批准后方可采购。
对关键物料进行供应商确认时,应重点评估供应/生产商的无菌保证体系,考察其生产过程对微生物污染、细菌内毒素污染、产品混淆和交叉污染风险的控制措施。
物料的验收、贮存、发放物料验收时,应特别关注包装容器的完整性。
由于生产安排或设备故障等原因,未使用完的领用物料需作退库处理时,应恢复原包装形态,并由质量管理部门评估剩余物料质量是否受到影响,如污染风险、贮藏条件等,并建立相关SOP。
物料的取样检验物料的传递物料的传递方式应经过确认,证明可以有效去除物料内包装表面的微生物或颗粒。
非最终灭菌无菌药品(化学制剂)生产质量技术指导原则
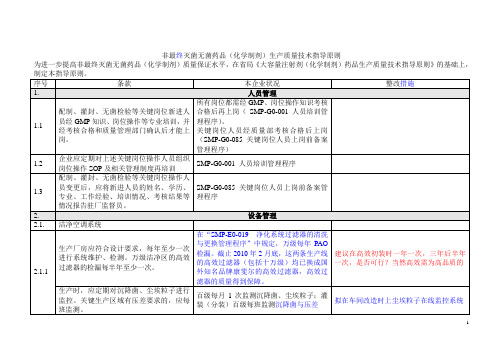
有规定,但次数偏多
修改文件,参照供应商的建议制订使用次数;对每个过滤器进行编号,建立滤芯档案;滤芯专用。
2.4.
灭菌系统
2.4.1
所有灭菌设备应分别开展灭菌验证,所用热电偶等测温设备在使用前后均应校正;对腔室底部有排水口的灭菌柜,应测定并记录该点在灭菌全过程中的温度数据;若灭菌时需真空操作,应经常对腔室进行检漏。
按规定执行
2.5.2
与药品直接接触的气体应进行日常监测,如压缩空气至少检查微生物、微粒、油雾、水分等,氮气至少检查微生物、微粒、纯度等。
SMP-P0-02807洁净区(室)管理程序:规定了直接接触物料的压缩空气的定期检测相关项目
3.
物料管理
3.1
原辅料
3.1.1
外购原辅物料药应严格进行供应商审计,其生产条件应符合GMP要求,并提供生产企业资质证明文件、执行标准、批准生产证明性文件,检验报告等。
制剂生产部水系统采用蒸气消毒,对压力温度等有相关规定,消毒前对管路排空有确认。
2.2.5
应定期对注射用水管路进行检漏试验。
安装完毕时做过,以后未进行
修订《注射用水系统标准操作及维护保养程序》规定大修期间每年检漏一次
2.2.6
工艺用水系统应按规定定期维护,保养即处理,呼吸器的材质应为疏水性材质,定期进行完整性检查;注射用水储罐上的呼吸器应采取必要措施,如对呼吸器加热或将冷凝水排空,防止温差产生的冷凝水的蓄积,造成微生物滋生。
管制瓶和胶塞均需要清洗灭菌后使用,无风险
每年一次现场审计难度较大
3.2.4
变更内包材供应商,应按要求开展相容性试验。
无菌药品制造过程控制

无菌药品制造过程控制无菌药品制造过程控制是保证无菌药品质量的重要环节。
无菌药品是指在制剂过程中没有经过热灭菌处理的药品,因此其无菌性的控制显得尤为重要。
本文将从无菌药品制造过程的准备工作、环境控制、操作流程、设备清洁等方面,详细介绍无菌药品制造过程控制的要点。
无菌药品制造过程的准备工作是保证药品质量的基础。
在准备工作中,首先要对制造环境进行严格的检查和清洁,确保无菌制剂制造区域没有空气中的微生物污染。
此外,还要准备好必要的设备、工具和试剂,以确保制造过程的顺利进行。
环境控制是无菌药品制造过程控制的核心。
在制药厂中,制造无菌药品的区域通常被称为无菌区域。
无菌区域应具备以下条件:一是空气中微生物数量应低于一定标准;二是控制温度、湿度和空气流动等因素,以保证药品制造过程中的微生物污染可以控制在可接受的范围内;三是控制工作人员的行为,防止人为因素对药品质量产生影响。
操作流程是无菌药品制造过程控制的关键。
操作流程应严格遵循制定的标准操作规程,包括严格控制工作人员的行为、使用无菌器具和容器、准确称量试剂、正确操作设备等。
在无菌药品制造过程中,还需要对原辅材料进行检验,并且在制造过程中进行临时检查,以确保药品的质量和无菌性。
设备清洁是无菌药品制造过程控制的重要环节。
设备在制造过程中的清洁程度直接影响到产品的无菌性。
因此,设备在使用前和使用后都应进行彻底的清洁和消毒。
此外,设备的维修和保养也是无菌药品制造过程中的关键步骤,以确保设备的正常运行和无菌性。
在无菌药品制造过程控制中,还要进行必要的记录和文档管理,以便追溯产品质量和过程控制的有效性。
记录内容包括制药人员的操作记录、设备清洁和维修记录、试剂使用记录等,并应保存一定时间。
总之,无菌药品制造过程控制是保证药品质量的重要环节,需要从准备工作、环境控制、操作流程、设备清洁等多个方面进行严格控制。
只有严格按照相关要求进行操作,才能保证无菌药品的无菌性和药品质量的稳定性。
无菌制剂关键工序时限控制管理规程

无菌制剂关键工序时限控制管理规程一、目的建立无菌制剂关键工序完成时限控制管理制度,加强无菌制剂的管理。
二、适用范围适用于无菌制剂车间工序完成时限的管理。
三、责任者各车间车间主任、班组长、车间质检员。
四、正文4.1、最终灭菌制剂(小容量注射剂、大容量注射剂和口服液)4.1.1洗净玻璃瓶在4小时内灭菌。
灭菌后的玻璃瓶贮存时间不得超过24小时,如已超过则必须重新洗涤、干燥及灭菌。
4.1.2经处理后的胶塞24小时内使用完毕。
4.1.3从稀配到灌装结束不超过8小时。
4.1.4灌装后到灭菌结束不超过4小时4.2、非最终灭菌注射剂(粉针剂)4.2.1洗净玻璃瓶、胶塞在4小时内灭菌,灭菌后的玻璃瓶、胶塞百级以下存放时间不能超过8小时,如已超过必须进行重新灭菌。
4.2.2分装结束后,无菌产品轧盖在6小时内完成。
4.3、工时定额以不影响下工序生产为原则,各工序及时、准时、协调生产,药品配制、过滤、灌封、口服液中间产品轧盖目检、小容量注射剂灭菌检漏工序、无菌粉针剂的无菌分装、压塞应在保证药品质量的前提下尽快完成。
4.4、各工序班长应熟练掌握本工序设备生产运行过程中各阶段耗费时间。
4.5、每批生产结束后及时总结,出现异常情况时工序班长应作出合理解释,形成书面文字由QA监督员、车间主任签字,上报生产部备案,并且以备注形式在批生产记录中体现。
5 参考文献制定本规范参考了下列文件中的一些信息,但没有直接引用里面的条文。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
➢好好学习社区➢德信诚培训教材➢进入生产车间的外来人员管理规程➢非车间人员进入洁净区标准操作规程➢物料容器设备进入洁净区管理规程。
无菌药品生产控制策略实施指南

无菌药品生产控制策略实施指南下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!无菌药品是指在生产过程中无菌条件下进行制备的药品,是一种高度纯净且安全有效的药物制剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无菌制剂生产关键控制指导
说明
无菌药品一般指没有活体微生物存在的药品,具有无菌、无热原质、无不溶性微粒和高纯度等特性。
在药品制剂类别中,无菌药品也可称为无菌制剂。
无菌药品一般分为最终灭菌和非最终灭菌的药品。
最终灭菌和非最终灭菌的药品的根本区别是无菌性的过程或内容不同。
最终灭菌药品一般是在完成内包装工艺生产过程最终采取一个可靠的灭菌措施;非最终灭菌药品一般是在完成内包装工艺生产全过程始终未采取单独的灭菌措施。
非最终灭菌药品的生产过程可变因素较多,其生产条件、厂房装饰、生产设备、工艺用水、洁净环境(级别)、操作人员、检验等均有不同的特性要求,但必须保证无菌生产过程的时限性、操作性、完整性、真实性、追溯性,以达到无菌的目的。
无茵药品或无茵制剂主要有注射剂,其次为植入剂、冲洗剂、眼内注射溶液、眼内插入剂及供手术、伤口、角膜穿通伤用的眼用制剂,用于手术、创伤、烧伤或溃殇等的软膏剂、乳膏剂、气雾剂、喷雾剂、局部用散剂、耳用制剂、鼻用制剂、凝胶剂等。
注射剂系指药物与适宜的溶剂或分散介质制成的供注入体内的溶液、乳状液或混悬液及供临用前配制或稀释成溶液或混悬液的粉末或浓溶液的无菌制剂,可分为注射液、注射用无菌粉末、注射用浓溶液。
从给药途径又可分为肌肉注射、静脉注射、鞠内注射等。
为了加强对无菌药品生产过程的管理和监督,我们在分析和总结实践经验的基础上,主要针对注射剂类风险产品的生产企业台帐管理,以及药品行政监督管理部门非现场监控、起草了无菌药品生产关键控制指导模板,仅供参考。
1.培训
1.1确保所有与药品生产有关的各级人员均经过与本岗位工作相适应的培训;
1.2对进入洁净区作业的人员还应进行微生物学基础知识、洁净区无菌控制、洁净区微粒控制、洁
净区人员行为规范等内容的培训;
1.3企业应及时对培训效果进行评估,对与药品生产有关的各级人员应进行持续的再培训。
2.物料
2.1供应商确认
2.1.1所有供应商均应经质量管理部门确认批准;
2.1.2主要的原辅料及内包装材料供应商应进行现场审计。
现场审计内容可根据企业对物料的使
用要求确定,但至少要包括对供应商的质量保证体系、工艺控制、卫生控制等内容进行审
查;
2.1.3质量管理部门应定期对供应商进行再评估,包括对供应商资质的变更情况、所供物料的质
量情况等,并作为再确认的依据。
2.2物料购入
从质量管理部门批准的供应商处采购。
2.3验收
2.3.1仓管员根据质量管理部门颁发的最新的合格供应商清单,确认物料来源符合要求;
2.3.2仓管员检查主要原辅料及关键内包装材料应附有检验报告单(原件或复印件加盖厂家鲜章)
或合格证(属于国家批签发管理的物料应附有批签发报告);
2.3.3根据物料接收SOP要求对物料进行验收;
2.3.4仓库验收合格后,根据企业制订的程序对物料进行请验。
2.4取样
2.4.1物料取样环境洁净度应与生产要求相适应,应定期对取样环境进行洁净度监测;
2.4.2应根据取样要求的不同对取样器具进行处理,如清洗、灭菌、除微粒、除热原等。
应避免
取样过程对物料造成污染;
2.4.3取样应按物料的取样数量要求,按规定进行取样;
2.4.4物料取样后应根据物料的存放要求进行保护,防止污染或变质,并贴取样标识。
2.5检验
2.5.1QC根据企业内控标准对物料进行检验(物料的内控标准宜根据生产工艺的要求增加如细菌
内毒素或微生物限度等项目);
2.5.2检验严格按照标准操作规程进行;
2.5.3根据检验的结果出具检验报告单;
2.5.4委托检验应符合相关规定。
2.6物料放行
物料按企业内控标准检验,且在规定的有效期(或贮存期)内,质量管理部门凭检验报告单或
合格证放行。
2.7储存
物料应按各品种项下规定的储存条件储存。
2.8复验
2.8.1所有物料均需制订复验期,企业应按复验周期对物料进行复验;
2.8.2无有效期规定的物料,企业应制订贮存期。
3.公用系统
3.1饮用水
每年至少送疾病控制中心检验1次。
企业自制的饮用水至少每月按企业的内控标准检验1次。
3.2纯化水
3.2.1纯化水的制备、储存和分配方式应能防止微生物的滋生和污染;
3.2.2应对制水系统进行监控,贮水罐、总送水口、总回水口至少每周按法定标准全检1次,其
它各使用点轮流取样,每个使用点至少每月按企业的内控标准检验1次;
3.2.3内控标准的制订应考虑监测反映纯化水系统质量的关键指标 (如pH值、微生物限度、电
导率或总有机碳等);
3.2.4企业应考虑对监测结果进行趋势分析,并设置警戒限和纠偏标准。
3.3注射用水
3.3.1注射用水的制备、储存和分配方式应能防止微生物的滋生和污染,应在80℃以上保存或
在70℃以上保温循环,应监控循环水的温度,确保循环水温度在70℃以上;
3.3.2应对制水系统进行监控,贮水罐、总送水口、总回水每周至少按法定标准全检1次,其它
各使用点轮流取样,每个使用点至少每2周按企业的内控标准检验1次;
3.3.3内控标准的制订应考虑监测反映注射用水系统质量的关键指标 (如微生物限度、细菌内毒
素、电导率或总有机碳等);
3.3.4企业应考虑对监测结果进行趋势分析,并设置警戒限和纠偏标准。
3.4直接接触药品的气体
3.4.1应根据气体的使用要求建立质量标准并定期监测;
3.4.2氮气的质量标准至少要包括纯度、微粒、微生物限度或无菌;
3.4.3压缩空气的质量标准至少要包括微粒、微生物限度、油份。
4.洁净区环境
4.1定期对洁净区进行环境监测,悬浮粒子、沉降菌、温度、湿度、压差等检测符合标准要求;
4.2定期监测风速、风量符合工艺要求。
百级层流风速宜控制在0.36-0.54m/s;
4.3非最终灭菌产品的无菌生产区域应增加监测的频次,企业应考虑对百级洁净区进行动态监测。
5.仪器、设备
5.1生产设备
主要设备必须经过验证,并在验证有效时间范围内。
大型关键设备(如灭菌柜、冻干机)再验
证周期不超过一年。
5.2除菌过滤器
所有除菌过滤器都应定期进行完整性测试,定期更换,产品生产过程使用的除菌过滤器在生
产前后需进行完整性测试。
5.3生产和检验的仪器、仪表、量具、衡具
其适用范围和精密度符合生产和检验要求,并定期校验,贴有合格标记。
6.生产管理
6.1生产过程中应采用适当的技术或管理措施避免污染和交叉污染。
洁净区内不同产品的生产操作
不在同一房间同时或者连续地进行。
所有物料、主要生产设备及使用的房间均应有状态标志。
6.2应对进入洁净区的总人数进行控制,并对人员及洁净工作服的卫生状况进行监控。
6.3物料和工器具进入洁净区必须经过相应的净化处理,处理方式应能达到其在洁净区的使用要
求。
已清洁消毒的工器具应制订使用有效期。
6.4非最终灭菌产品的清洁工具应经处理或无菌后再传入无菌操作区,使用完毕后应及时传出。
6.5传递窗或缓冲间应设置有效措施避免对洁净区的污染。
6.6无菌生产区用的消毒剂应进行除菌过滤或通过其它方式达到无菌状态,并规定有效期,所使用
的清洁剂和消毒剂不得对产品质量造成影响。
6.7待灭菌的产品和已灭菌的产品应有明显的区分,并有防混淆的措施。
6.8每批生产操作前,应对上次的清场进行确认,生产操作结束后应进行清场。
6.9产品的密封性应经适当的验证。
融封的产品(如安瓿瓶)应作100%的检漏试验。
6.10应对无菌生产的关键工序的时限,清洗、灭菌后物料的使用时限在验证的基础上作出规定。
6.11批生产记录应及时、真实、完整,应能反映生产过程控制的关键工艺参数,反映主要的生产
操作过程,以便对产品的生产过程进行追溯。
原始的灭菌记录或曲线应附在批记录中。
6.12生产过程应符合批准的生产工艺要求,严格按批准的工艺参数组织生产。
6.13高风险产品:鉴于某些高致敏物质如青霉素类、头孢菌素类,高活性物质如避孕药、强效类
固醇、细胞毒素类等产品对人体的健康风险及其清洁效果的局限性,应独立设置,不得与其它
产品共用生产线和设施:
6.13.1青霉素类药品的生产厂房应为独立的建筑物;
6.13.2头孢类药品的生产车间应独立设置;
6.13.3避孕药的生产厂房应独立设置;
6.13.4鞘注抗肿瘤药的生产车间应独立设置;
6.13.5激素类和抗肿瘤类化学药品均应使用独立的生产线;
6.13.6化学药品与生物制品的处理、灌装应彼此分开;
6.13.7不同种类的活疫苗处理、灌装应彼此分开;
6.13.8血液制品生产厂房应独立设置;
6.13.9卡介菌和结核菌素生产厂房应为独立建筑物;
6.13.10放射性药品的生产、包装和储存应使用专用、安全的设备。
7.中间产品控制
符合中间产品检测标准,方可流入下道工序。
8.成品检验
8.1取样
按取样规程进行。
用于无菌检查的样品应具有代表性,所取的样品应包括最初灌装的产品、。
