己二酸的制备
己二酸实验报告

己二酸实验报告实验名称:己二酸制备实验实验原理:己二酸的化学结构式为HOOC(CH2)4COOH,简称H2C6H8O4。
从化学式可以看出,己二酸分子是由两个羧基(COOH)和一个五碳链组成。
因此,己二酸也被称为1,6-己二酸。
己二酸主要应用于合成聚酰胺、橡胶、涂料、染料、塑料等材料的原料。
己二酸的制备方法有多种,如氧化己烷、氧化环己烷和氧化己醇。
在实验中,我们采用的是氧化己醇的方法。
己二酸的制备反应方程式为:C6H14O2 + 3O2 H2C6H8O4 + 3H2O实验器材:己酸、重铬酸钾、稀硫酸、黑色导热管、接口胶、玻璃棒、试管、试剂瓶、量筒、滴管、量杯、热水槽、温度计、搅拌器、草纸、漏斗、净水瓶等。
实验步骤:1、将5.5克己酸粉末加入黑色导热管中。
2、用接口胶将黑色导热管与装有稀硫酸的试管相连。
3、在试管中加入适量的重铬酸钾。
4、将试管置于热水槽中,并开始搅拌。
5、升温至90℃,维持反应30分钟。
6、将试管取出,冷却至室温。
7、用草纸滤去产物中的残余重铬酸钾。
8、用少量水洗涤草纸。
9、将产物与水混合,并用净水瓶洗涤草纸,使其完全溶解。
10、测量产物中己二酸的质量,计算产率。
注意事项:1、实验中生成的Cr(VI)是有毒物质,需要小心操作,防止吸入或误食。
2、实验中反应器的温度不可以超过90℃,避免产生过多的副产物。
实验结果:本次实验中,制备出1.972克的己二酸,产率为76.4%。
实验分析:本次实验中,通过氧化己醇的方法成功制备出己二酸。
实验产物的质量为1.972克,产率为76.4%。
可能的原因是实验过程中反应器的温度不够稳定,影响了反应的进行。
此外,实验中还可以考虑优化反应条件、提高反应的纯度和产率。
结论:通过己二酸制备实验,我们成功地制备出1.972克纯度较高的己二酸。
通过实验,我们了解了己二酸的结构与性质,学习了己二酸的制备方法,掌握了实验操作技能和安全操作规范。
己二酸的制备(KMnO4氧化法).

实验装置
电动搅拌装置图
注意事项
该反应为放热反应,反应一当开始,则会放出 大量的热,开始时温度不能超过40℃,否则不 易控制。
2.移去水浴,在搅拌下,从恒压漏斗中滴入4~ 5D环己醇,反应开始,然后慢慢滴入剩余的 环己醇,控制滴加速度,使瓶内温度维持 40~45℃,温度过高时则用冷水浴冷却,温 度低于40℃时则用温水浴加热。
实验步骤
3. 环己醇加完后,继续搅拌10分钟,然后在 60~70℃的水浴中加热约20分钟,高锰酸钾 紫色完全褪去,同时有大量的褐色二氧化锰 生成,再继续加热搅拌10分钟。
滴加环己醇的速度必须控制1~2D/秒,否则反 应速度太快不易控制。
酸化必须充分pH=2,且加浓硫酸速度不要太 快。
己二酸的制备 (KMnO4氧化法)
实验目的
► 学习用环己醇氧化制备己二酸的 原理和方法
► 掌握电动搅拌(或磁力搅拌)、 浓缩、过滤及重结晶等操作技能KMnO4 + H2O
3HOOC(CH2)4COOH +8MnO2 + KOH
实验步骤
1.在三颈瓶中加入高锰酸钾固体6g和碳酸钠 (1.9 g碳酸钠溶于17.5 mL水中),温水加热 使反应物的温度为40℃,并不断搅拌,使固 体几乎全部溶解。
已二酸的制备

已二酸的制备已二酸(Oxalic Acid)是一种常见的有机化合物,化学式为H2C2O4。
它是一种无色的结晶性固体,具有酸性和还原性。
已二酸的制备方法有多种,下面将介绍其中两种常用的方法。
第一种方法是通过碳酸钙和浓硫酸反应制备已二酸。
首先,将适量的碳酸钙加入到一定量的浓硫酸中,搅拌均匀。
反应开始时会产生大量的气体,这是二氧化碳的释放。
随着反应的进行,产生的碳酸氢根离子进一步与硫酸中的氢离子反应,生成已二酸。
反应结束后,将反应液过滤,得到含有已二酸的溶液。
通过蒸发溶液,得到已二酸的结晶。
第二种方法是利用乙烯的氧化反应制备已二酸。
首先,将乙烯与空气中的氧气在催化剂的作用下进行氧化反应。
催化剂常用的有过渡金属的氧化物或过渡金属的配合物。
氧化反应产生的产物中,含有已二酸。
然后,通过蒸馏或结晶等方法,将已二酸从反应产物中分离出来。
已二酸具有很多重要的应用。
首先,它是一种优良的螯合剂,可以与金属离子形成稳定的配合物。
这些配合物在工业上广泛应用于催化剂、染料、荧光剂等领域。
其次,已二酸也可以用于清洗和去污。
它可以溶解钙、锌、铁等金属的氧化物和水垢,使其变得容易清洗。
此外,已二酸还可以用作草坪的肥料,提供植物所需的营养元素。
已二酸作为一种有机化合物,具有一定的毒性。
因此,在使用和储存已二酸时应当注意安全。
避免接触皮肤和眼睛,以免引起刺激和损伤。
同时,已二酸也是可燃物,应远离火源,存放在阴凉干燥的地方。
已二酸是一种重要的有机化合物,具有广泛的应用。
通过碳酸钙和浓硫酸反应或乙烯的氧化反应,可以制备已二酸。
已二酸的制备方法简单易行,但在操作过程中应注意安全。
已二酸的应用领域广泛,包括催化剂、清洁剂和肥料等。
在今后的研究中,已二酸的制备方法和应用还有很大的发展空间。
己二酸的制备实验报告

己二酸的制备实验报告实验目的,通过化学实验的方法,制备己二酸。
实验原理,己二酸的制备主要是通过己二醇的氧化反应得到。
己二醇在氧化剂的作用下,可以被氧化成己二酸。
实验步骤:1. 将适量的己二醇溶解在适量的乙醛中,搅拌均匀。
2. 将搅拌均匀的混合物加入含有氧化剂的溶液中,反应一段时间。
3. 过滤得到沉淀物,洗净并干燥,即可得到己二酸。
实验器材和试剂:1. 己二醇。
2. 乙醛。
3. 氧化剂。
4. 烧杯、漏斗、玻璃棒、试管等实验器材。
实验结果,通过实验,成功制备了己二酸,得到了白色结晶状的产物。
实验讨论,在实验过程中,我们发现控制氧化剂的使用量对反应的效果有很大影响。
适量的氧化剂可以促进反应进行,但过量的氧化剂可能导致副反应的发生,影响产物的纯度。
因此,在实际制备中需要严格控制氧化剂的使用量。
实验结论,通过本次实验,我们成功制备了己二酸,得到了白色结晶状的产物。
实验结果表明,己二醇的氧化反应可以有效制备己二酸,为后续相关化学实验提供了基础。
实验安全注意事项:1. 实验过程中需佩戴防护眼镜和实验服,避免化学品溅入眼睛和皮肤。
2. 实验结束后,要及时清洗实验器材,避免化学品残留造成安全隐患。
3. 对于化学品的使用和处置,要严格按照实验室安全操作规程进行,避免发生意外。
实验总结,本次实验通过制备己二酸,使我们对己二酸的制备方法有了更深入的了解。
在实验过程中,我们注意到了氧化剂使用量的重要性,同时也加强了实验室安全意识。
希望通过今后的实验学习,能够更加熟练地掌握化学实验的操作技巧,为将来的科研工作打下坚实的基础。
以上就是本次实验的全部内容,谢谢阅读。
己二酸的制备操作规程及流程

【实验目的】1、学习用环己醇氧化制备己二酸的原理和方法。
2、掌握浓缩、过滤、重结晶等操作技能。
【实验原理】己二酸可以用硝酸或高锰酸钾氧化环己醇制得,本实验用环己醇在高锰酸钾的氧化下制备己二酸。
+ 8 KMnO 4 + H 2O OH 3 3 HOOC(CH 2)4COOH + 8 MnO 【实验装置】反应装置图 改进的装置 抽滤装置【仪器和药品】1、仪器:50mL 三颈烧瓶、温度计、冷凝管、烧杯、磁力搅拌器、布什漏斗、抽虑瓶、水泵、加热套。
2、药品:环己醇、碳酸钠、高锰酸钾、10%的碳酸钠溶液、浓硫酸。
【实验步骤】1、配制10%的碳酸钠溶液。
3.8g 碳酸钠溶于35mL 温水中。
2、在50mL 的三颈烧瓶中,加入1.3mL(0.0135mol)环己醇和已配制好的碳酸钠水溶液(约20mL ),在磁力搅拌下分八批加入研细的6g (0.0255 mol )高锰酸钾,约2h 。
加入时控制反应温度始终小于30℃,加完后继续搅拌,直至反应温度不再上升为止,然后在50℃水浴中加热并不断搅拌(约30min )。
3、将反应混合物抽虑,用5mL10%的碳酸钠溶液洗涤滤渣,抽虑,合并滤液,在搅拌下慢慢滴加浓硫酸,直到滤液呈强酸性,己二酸沉淀析出,冷却,抽虑,晾干,称量,计算产率。
【实验注意事项】1、在50mL 三颈烧瓶中加入的水太少影响搅拌效果,使高锰酸钾不能充分反应。
2、反应过程中注意温度的控制和分批加入高锰酸钾。
【主要试剂物理常数】乙醚、苯、乙酸乙酯、二硫化碳和松节油等。
己二酸性状:白色结晶粉末,微溶于水,溶于热水,易溶于甲醇、乙醇、丙酮等,能升华,可用硝酸重结晶。
【作业】P1231、反应体系中加入碳酸钠有何作用?答:(1)开始加入碳酸钠的水溶液,呈碱性,提供OH-,中和反应体系中生成的己二酸,使反应正向进行,让反应进行彻底。
(2)防止己二酸和环己醇反应生成酯。
2、计算产率。
3—OH+8KMnO4+H2O 3 HOOC(CH2)4COOH+8MnO2+8KOH100.16×3 8×158.03 3×146.140.0135×100.6 12 X高锰酸钾过量。
己二酸制备实验报告

己二酸制备实验报告己二酸制备实验报告一、引言己二酸是一种重要的有机化合物,广泛应用于聚酯树脂、塑料、染料等领域。
本实验旨在通过己二酸的制备过程,了解有机合成的基本原理和实验操作技巧。
二、实验原理己二酸的制备主要依靠己二醇和氧化剂的反应。
在实验中,我们选择将己二醇与过氧化苯甲酰(BPO)反应,生成己二酸。
三、实验步骤1. 实验前准备:准备好所需的实验器材和试剂,包括己二醇、过氧化苯甲酰、醋酸、硫酸、冷却水等。
2. 反应装置的组装:将己二醇和过氧化苯甲酰分别加入两个干净的圆底烧瓶中,加入适量的醋酸作为溶剂。
将两个烧瓶连接起来,通过橡皮管连接到水冷冷凝器上。
3. 反应的进行:将反应装置放置在加热器上,控制加热器的温度为80-90摄氏度。
同时,打开冷却水,使其流过冷凝器,确保反应装置中的温度能够保持在适宜的范围内。
4. 反应结束后的处理:将反应装置从加热器上取下,用水冷却。
然后,将反应液倒入蒸馏瓶中,加入适量的硫酸进行酸化处理。
最后,进行蒸馏提取,得到纯净的己二酸。
四、实验结果与讨论通过实验,我们成功地制备了己二酸。
在反应过程中,我们观察到了一些现象:首先,己二醇和过氧化苯甲酰在加热的条件下发生了剧烈的反应,伴随着气泡的产生和溶液的变色。
这是由于过氧化苯甲酰的氧化性,使得己二醇被氧化为己二酸。
其次,通过蒸馏提取,我们得到了纯净的己二酸。
蒸馏是一种常用的分离纯化方法,通过控制温度和压力,将液体组分按照其沸点的差异进行分离。
在实验中,我们还要注意一些操作技巧和安全事项:首先,实验过程中要注意实验器材的清洁和干燥,以避免杂质的干扰。
其次,实验操作要谨慎,遵守实验室的安全规定,避免发生意外。
最后,实验结束后要及时清理实验器材和实验台面,保持实验环境的整洁。
五、实验总结通过本次实验,我们了解了己二酸的制备过程和实验操作技巧。
己二酸是一种重要的有机化合物,在工业生产中有广泛的应用。
通过本次实验,我们对有机合成的基本原理和实验操作有了更深入的了解。
己二酸合成路线

己二酸合成路线
己二酸是一种重要的有机化工原料,主要用于生产聚己内酰胺、聚酯、荧光增白剂等化工产品。
己二酸的合成路线比较多,以下是其中几种主要的合成路线:
1.氧化己烷法
氧化己烷法是目前最为常用的合成己二酸的方法。
其具体步骤为:将己烷氧化为环己酮,然后将环己酮通过氧化反应转化为己二酸。
反应过程中需要使用过氧化氢、氧气等氧化剂。
2.环己酮二聚法
环己酮二聚法也称为Wacker过程,是另一种合成己二酸的方法。
其具体步骤为:将环己酮催化剂存在下,在一定温度和压力下发生二聚反应生成己二酸。
这种方法虽然需要催化剂,但是相对于氧化己烷法而言,反应过程更加简单。
3.乙炔法
乙炔法是己二酸合成的一种传统方法。
其具体步骤为:将乙炔和水在存在钴催化剂的条件下反应生成丙炔醇,接着将丙炔醇通过酸化反应转化为己二酸。
不过,这种方法因为使用了钴等贵金属催化剂,生产成本较高。
己二酸的合成的实验原理

己二酸的合成的实验原理
己二酸(又称己二酸二甲酯)的合成可以通过己二醇与酒石酸二甲酯反应得到,实验原理如下:
1. 己二醇与酒石酸二甲酯反应:
酒石酸二甲酯和己二醇在酸催化条件下可发生酯交换反应。
具体反应方程式为:
酒石酸二甲酯+ 己二醇→己二酸二甲酯+ 甲醇
2. 反应条件:
该反应需要酸催化剂,常用的酸催化剂有硫酸和硫酸铵。
反应通常在高温下进行,一般为150-200摄氏度。
3. 反应机理:
在酸催化条件下,酒石酸二甲酯中的羟基与己二醇中的甲醇发生酯交换反应,生成己二酸二甲酯和反应副产物甲醇。
酸催化剂可以促进该反应的进行。
4. 反应后处理:
反应结束后,需要对反应混合物进行后处理。
通常可以使用蒸馏方法将反应产物己二酸二甲酯和副产物甲醇进行分离。
总的来说,己二酸的合成实验原理是通过酯交换反应将酒石酸二甲酯和己二醇反
应生成己二酸二甲酯。
该反应需要酸催化剂,在高温条件下进行,并且需要对反应产物进行后处理。
己二酸的制备

五、注意事项
1. 制备羧酸采取的都是比较强烈的氧化条件, 一般都是放热反应,应严格控制反应温度, 否则不但倒影响产率,有时还会发生爆炸事 故; 2.环己醇常温下为粘稠液体,可加入适量水 搅拌,便于用滴管滴加。
返回 •7
六、思考题
1. 为什么本实验在加入环己醇之前应预先加热反应 液?实验开始时加料速度较慢,待反应开始后反而 可适当加快加料速度? 2. 反应完后如果反应混合物呈淡紫红色,为什么要 加入亚硫酸氢钠?写出其反应方程式。 3. 本实验得到的溶液为什么要用盐酸酸化?除用盐 酸酸化外,是否还可用其他酸酸化?为什么?
返回 •8
谢谢观赏!
返回 •5
实验步骤
3.趁热抽滤,滤渣二氧化锰用少量热水洗涤3次, 每次尽量挤压掉滤渣中的水分; 4.滤液用小火加热蒸发使溶液浓缩至原来体积的一 半,冷却后再用浓盐酸酸化至pH值为2~4止。冷却 析出结晶,抽滤后得粗产品 ; 5.将粗产物用水进行重结晶提纯。然后在烘箱中烘 干; 6.测量产品的熔点和红外光谱,并与标准光谱比较。
O
OO
[O ]
H O C(C H 2 )4 C O H
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰 酸钾。本实验采用碱性高锰酸钾作氧化剂。
返回 •3
三、试剂及仪器
试剂:
反应装置:
ቤተ መጻሕፍቲ ባይዱ
•环己醇; •高锰酸钾; •亚硫酸氢钠; •浓盐酸; •活性炭; •0.3mol/L氢氧化钠溶液
返回 •4
四、实验步骤
1.安装反应装置,在三口烧瓶中加入6g高锰酸钾和 50mL0.3mol/L氢氧化钠溶液,搅拌加热至35℃使之 溶解,然后停止加热; 2.在继续搅拌下用滴管滴加2.1mL环己醇,控制滴 加速度,维持反应温度43~47℃,滴加完毕后若温 度下降,可在50℃的水浴中继续加热,直到高锰酸 钾溶液颜色褪去。在沸水浴中将混合物加热几分钟 使二氧化锰凝聚;
己二酸生产工艺技术

己二酸生产工艺技术1、合成已二酸的工艺技术1.1 过氧化氢合成已二酸在生产过程中以过氧化氢作为氧源,采用不同的类型的催化剂进行已二酸的合成,当以叔丁醇当作溶剂时,H2WO 4 作为催化剂对过氧化氢进行催化,最后分离出的已二酸较少,大概为62%,并且副产物量高,所以总结这种方法产生已二酸量少且副产物量高。
当将钨酸钠和盐酸作为原料时,可以运用液相沉淀法对钨酸进行收集,此时钨酸可以作为催化剂,过氧化氢氧化环乙烯进而可以生成已二酸,产量可以达到74%。
过氧化氢在生产已二酸时具有重要作用,反应过程较为温和,防止生产过程中氧气含量太高产生许多副产品,比如二氧化碳和水等,这样对生产过程可以进行有效的控制。
1.2 苯酚合成已二酸以苯酚为原料合成已二酸至今已有八十年的历史,但是现如今采用该法进行大量生产已二酸的生产商却比较少。
主要工艺流程是首先利用苯酚与氢反应生成环乙醇,再利用硝酸对其进行氧化产生已二酸。
这种方法使用的设备工艺和相关的生产情况和苯法类似,主要限制是苯酚这种材料比较稀有,只能在苯酚原料充足的区域进行大量生产。
基于此,导致苯酚合成的已二酸占全球生产比例较低。
1.3环己烷合成己二酸前几年有人尝试利用⑴作为催化剂对环己烷进行氧化,从而得到产物已二酸,转化率到达80%,制备效果比较好。
但是存在一个很大的缺点,醋酸的酸性会对反应器产生腐蚀性,这对生产过程是相当不利的。
为了防止这种腐蚀作用,日木某大学对该反应过程进行改进,开发了一种新型的生产工艺,即无溶剂的氧化工艺,同时采用溶解度比较高的NHPI作为催化剂,该催化剂在环己烷中有较高的溶解度。
许多生产厂家均采用此技术进行大批量的工艺生产,不仅可以加快生产速度,而且质量比较有保障。
当醋酸作为催化剂时,当反应温度超过100C同时持续时间达到45min后,此时的环己烷转化率有所变化,大概为21%而选择性达到88%。
环己烷为原料生成已二酸具有许多优势,主要优点是在生产工艺流程中只有一种催化剂,只通过一步氧化反应就可以得到产物已二酸。
己二酸的制备粗产物纯化过程及原理

己二酸的制备粗产物纯化过程及原理下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!己二酸的制备粗产物纯化过程及原理1. 引言己二酸是一种重要的有机化学品,广泛应用于聚酯树脂、涂料、塑料等领域。
己二酸的制备课件

实验室安全
在实验前需要了解实验室安全规定,并穿戴适当的防护装 备,如实验服、化学防护眼镜和化学防护手套等。
实验操作步骤
步骤一
将乙醇和碳酸钠混合 搅拌,然后加入硫酸。
步骤二
将混合物加热至沸腾, 并保持一段时间。
步骤三
冷却混合物,然后加 入适量的水,并进行 搅拌。
步骤四
将混合物进行分液, 收集有机相,并对其 进行洗涤和干燥。
04
在实际生产中,还需要考虑原料的来源和成本、设备的选择和操作方 式等因素。
03
CATALOGUE
己二酸制备工艺流程
原料准 备
1
己二酸制备所需的原料:苯酚、硫酸、硝酸等。
2
原料的质量要求:确保原料纯度、水分等指标符 合工艺要求。
3
原料的储存与运输:确保原料安全、稳定地储存 和运输,防止事故发生。
产物储存与运输
确保己二酸安全、稳定地储存和运输,防止事故发生。
04
CATALOGUE
己二酸制备实验操作
实验前的准备
实验材料
需要准备己二酸、硫酸、乙醇、碳酸钠等实验材料。
实验设备
需要准备烧杯、搅拌器、温度计、分液漏斗等实验设备。
实验试剂的纯化
为了保证实验结果的准确性,需要确保所使用的实验试剂 是高纯度的。
己二酸的制备课件
目 录
• 己二酸制备工艺流程 • 己二酸制备实验操作 • 己二酸制备实验结果分析 • 己二酸制备的工业化生产
01
CATALOGUE
己二酸简介
己二酸的性 质
物理性质
己二酸为白色晶体,熔点较高,易溶 于水,不溶于有机溶剂。
化学性质
己二酸具有羧基和酮羰基,可参与多 种化学反应,如酯化、酰胺化等。
制备己二酸的生物学方法

制备己二酸的生物学方法
制备己二酸常用的方法是环己酮氧化法。
苯酚经过加氢,变成环己醇,环己醇氧化成环己酮,然后经过硝酸氧化,形成己二酸。
这是生产己二酸的最常规的方法。
现在应该有直接采用空气氧化的工艺诞生。
1937年,美国杜邦公司用硝酸氧化环己醇(由苯酚加氢制得),首先实现了己二酸的工业化生产。
进入60年代,工业上逐步改用环己烷氧化法,即先由环己烷制中间产物环己酮和环己醇混合物(即酮醇油,又称KA油),然后再进行KA油的硝酸或空气氧化。
环己烷一步氧化法
以环己烷为原料,以醋酸为溶剂,以钴和溴化物为催化剂,于2MP。
和90℃下反应10~13h。
产率75%。
环己烷分步氧化法
KA油的制备可于1.0~2.5MPa和145~180℃下用空气直接氧化,收率达70%~75%。
也可用偏硼酸作催化剂,1.0~2.0MPa和165℃下进行空气氧化,收率可达90%,醇酮比为10:1;反应物用热水处理,可使酯水解、分层,水层回收硼酸,经脱水成偏硼酸循环使用;有机层用苛性钠皂化有机酯,并除去酸,蒸馏回收环己烷后得醇酮混合物。
KA油的氧化以过量50%~60%的硝酸在两级串联的反应器中,于60~80℃和0.1~0.4MPa下氧化KA油。
催化剂为铜-钒系(铜0.1%~0.5%,钒0.1%~0.2%),收率为理论值的92%~96%。
反应物蒸出硝酸后,经
两次结晶精制可得高纯度己二酸。
己二酸制备

注意事项:
1、环己醇粘稠(m.p. 24 oC),可用NaOH溶液洗量筒,减少原 料损失。 2、高锰酸钾:少量、多次加料,避免剧烈放热造成危险。 3、第一次抽滤用热水洗涤;第二次抽滤用冷水洗涤。
尽量少用洗涤液(冷水),以减少产品损失。
4、盐析法中,若NaCl过量,浓缩过程中可能会析出,应滤掉。
友情提示:
本实验采用高锰酸钾氧化
OH KMnO4 NaOH O KMnO4 NaOH COONa COONa H+ COOH COOH
所用试剂物理性质常数
试剂
环己醇 高 锰 酸 钾 己二酸
性状
比重
mp
25.2 240 分解 153
bp 水
160.9 330.5 (分解) 3.520 微溶 可溶 微溶
溶解度 乙醇
己二酸制备
一、实验目的
1. 了解和掌握以环己醇为原料,通过氧化反应制备己二酸的 原理和方法;
2. 进一步掌握固体有机物的精制方法;
3. 了解盐析作用及高溶解度产品的母液和洗液的处理方法。
二、实验原理
己二酸是合成尼龙-66的主要原料之一。
合成羧酸的主要方法主要有:
1、腈水解法
RCl + NaCN RCN H+ or OHH2O O RCOH
烈放热)时,在沸水浴中加热10min使反应完全。
反应终点判断:
反应温度降至43°C以下 将反应液点在滤纸上,若无紫色则反应完全;若有,可继续
加热几分钟;若紫色仍不消失,说明KMnO4过量,加少量
NaHSO3还原。
尽量反应完全,否则滤液为绿色。
③ 趁热抽滤,滤渣MnO2用热水洗涤两次(可先关掉水泵),
每次用5-l0mL,不可太多;挤压掉滤渣中的水分。
已二酸的制备

已二酸的制备
已二酸的制备方法如下:
1.准备相关试剂和设备。
2.在装有搅拌装置、温度计的250mL烧杯中加入5mL 10%氢氧化钠溶液,和50mL水,边搅拌边加入6g高锰酸钾。
待高锰酸钾溶解后,用滴管缓慢滴加2.1mL环己醇完毕,反应温度开始下降时,在沸水浴上加热5min,促使反应完全。
3.用玻璃棒蘸一滴反应混合物点到滤纸上做点滴实验。
如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量固体亚硫酸氢钠直到点滴试验呈阴性为止。
趁热抽滤混合物,用少量热水洗涤滤渣3次,将洗涤液与滤液合并置于烧杯中,用约4mL浓盐酸酸化,使溶液呈强酸性。
4.将滤液转用电热套加热浓缩至10mL左右,加少量活性炭脱色后放置结晶,得己二酸白色晶体1.5-2g,熔点151-152℃。
以上步骤仅供参考,也可以通过苯酚法、环己烷法或丙烯腈二聚法进行制备。
制备过程需注意安全,要在专业人士指导下进行。
己二酸的制备
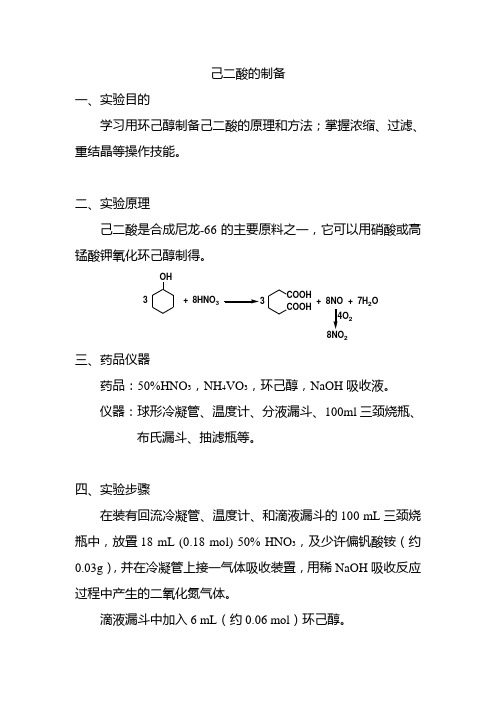
己二酸的制备一、实验目的学习用环己醇制备己二酸的原理和方法;掌握浓缩、过滤、重结晶等操作技能。
二、实验原理己二酸是合成尼龙-66的主要原料之一,它可以用硝酸或高锰酸钾氧化环己醇制得。
OH+8HNO 3COOH COOH 3++7H 2O28NO 2三、药品仪器药品:50%HNO 3,NH 4VO 3,环己醇,NaOH 吸收液。
仪器:球形冷凝管、温度计、分液漏斗、100ml 三颈烧瓶、布氏漏斗、抽滤瓶等。
四、实验步骤在装有回流冷凝管、温度计、和滴液漏斗的100 mL 三颈烧瓶中,放置18 mL (0.18 mol) 50% HNO 3,及少许偏钒酸铵(约0.03g ),并在冷凝管上接一气体吸收装置,用稀NaOH 吸收反应过程中产生的二氧化氮气体。
滴液漏斗中加入6 mL (约0.06 mol )环己醇。
三颈烧瓶用水浴预热到50 o C左右,移去水浴,先滴入5~6滴环己醇,至反应开始放出二氧化氮气体,然后慢慢加入其余部分的环己醇,调节滴加速度,使瓶内温度维持在50~60o C之间。
温度过高时,用冷水浴冷却,温度过低时,则用热水浴加热,滴加完毕约需15min。
加完后继续搅拌,并用80~90 o C的热水浴加热10min,至几乎无棕红色气体放出为止。
然后将此热溶液倒入100ml的烧杯中,冷却后析出己二酸,抽滤,用15ml冷水洗涤两次,干燥,粗产物约6克。
粗制的己二酸可以在水中重结晶。
纯己二酸为白色棱状晶体,产量约5.1 g,mp为153 o C。
五、实验注意点1.环己醇和硝酸切不可用同一量筒量取。
2.偏钒酸铵不可多加,否则产品发黄。
3.本实验为强烈放热反应,所以滴加环己醇的速度不宜过快,以免反应过剧,引起爆炸。
一般可在环己醇中加1ml水,一是减少环己醇因粘稠带来的损失,二是避免反应过剧。
4.实验产生的二氧化氮气体有毒,所以装置要求严密不漏气,并要作好尾气吸收。
【操作要点及注意事项】1.KMnO4要研细,以利于KMnO4充分反应。
己二酸的制备实验现象

己二酸的制备实验现象
实验材料:n-己醇、硫酸、红石碱。
实验步骤:
1. 在一个干净的反应瓶中加入适量的n-己醇。
2. 将红石碱加入反应瓶中,观察到有气泡释放,同时溶液变为红色。
3. 加入硫酸,观察到溶液温度升高,并有较浓烟雾释放。
4. 保持搅拌,并加热反应瓶,观察到溶液逐渐变稠。
5. 继续加热,观察到溶液中出现白色固体。
6. 终止加热,并置于室温下,观察到溶液逐渐结晶并生成白色结晶物质。
7. 过滤并洗涤得到白色结晶物质。
8. 蒸馏结晶物质,获得纯净的己二酸。
实验现象分析:
1. 添加红石碱后产生气泡:红石碱与n-己醇反应,产生二氧化碳气泡的释放。
2. 溶液变为红色:红石碱的颜色通过反应转移到溶液中。
3. 添加硫酸后溶液温度升高:硫酸与n-己醇发生酸碱中和反应,反应释放大量的热量。
4. 较浓烟雾释放:硫酸与n-己醇反应产生硫酸蒸气,与空气中的水蒸气接触形成白烟。
5. 溶液变稠:己二酸的生成使得溶液黏稠。
6. 出现白色固体:己二酸结晶从溶液中析出。
7. 溶液逐渐结晶:由于溶液中的己二酸浓度过高,超过其溶解度,导致结晶过程。
实验安全注意事项:
1. 操作时应佩戴适当的防护实验服、手套和护目镜,避免接触皮肤和眼睛。
2. 硫酸具有强腐蚀性,使用时须小心操作,避免接触皮肤和吸入其蒸气。
3. 加热操作时应注意温度控制,避免烧糊或产生危险性气体。
4. 所有实验废液和废品要妥善处理,避免对环境造成污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
己二酸的制备
一、实验目的
1.掌握用环己醇氧化制备己二酸的基本原理和方法。
2.掌握电动搅拌器的安装及使用方法
3.巩固浓缩、过滤、重结晶等基本操作。
二、实验原理
制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠)的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。
三、实验仪器及药品
仪器:三口烧瓶(250ml)烧杯(1000ml)、温度计(0-150℃)、电动搅拌器、球形冷凝管、抽滤瓶、布氏漏斗、循环水多用真空泵、滴管、滤纸等。
药品:环己醇、高锰酸钾、NaOH;亚硫酸氢钠、浓盐酸、活性炭等。
四、实验步骤
1. 在250mL三口烧瓶上安装电动搅拌器。
在安装电动搅拌装置时应做到:
①.搅拌器的轴与搅拌棒在同一直线上。
②.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
③.搅拌棒下端位于液面以下,以离烧杯底部3~5mm为宜。
④.温度计应与搅拌棒平行且伸入液面以下。
2. 往三口烧瓶中加入1.0gNaOH和50mL水。
搅拌下加入6.0g高锰酸钾。
搅拌加热至35℃使之溶解,然后停止加热;
3. 用滴管慢慢加入3mL的环己醇,控制滴加速度,维持温度在45℃左右。
4. 滴加完毕后若温度下降至43℃以下。
,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
在沸水浴中将混合物加热5分钟,使氧化反应完全,可观察到有大量二氧化锰的沉淀凝结。
5. 用玻璃棒蘸一滴反应物到滤纸上做点滴实验。
如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量固体亚硫酸氢钠直到点滴试验呈阴性为止。
6. 趁热抽滤混合物,用少量热水洗涤滤渣3次。
7. 将洗涤液与滤液合并置于烧杯中,加少量活性炭脱色,趁热抽滤。
8. 将滤液转移至干净烧杯中,并在石棉网上加热浓缩至8ml左右,放置,冷却,冷却后再用浓盐酸酸化至pH值为2~4止。
结晶,抽滤,干燥。
9. 称量计算产率。
五、实验装置图
六、实验操作要点
1.KMnO
4要研细,以利于KMnO
4
充分反应。
2.环己醇要逐滴加入。
滴加速度不可太快。
否则,因反应强烈放热,使温度急剧升高而难以控制。
3.严格控制反应温度,稳定在43~49℃之间。
4.反应终点的判断:
(1)反应温度降至43℃以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO
4。
5.用热水洗涤MnO
2
滤饼时,每次加水量约5~10 ml,不可太多。
6.用浓盐酸酸化时,要慢慢滴加,酸化至pH=2~4。
7.浓缩蒸发时,加热不要过猛,以防液体外溅。
浓缩至10 ml左右后停止加热,让其自然冷却、结晶。
七、注意事项
[1]此反应属强烈放热反应,要控制好滴加速度和搅拌速度,以免反应过剧,引起飞溅或爆炸。
同时,不要在烧杯上口观察反应情况。
[2]反应温度不可过高,否则反应就难于控制,易引起混合物冲出反应器。
[3]二氧化锰胶体受热后产生胶凝作用而沉淀下来,便于过滤分离。
八、实验数据分析
九、思考题
1.制备已二酸时,为什么必须严格控制滴加环已醇的速度和反应的温度?
2.物料较少,为何用250mL三颈瓶?
3. 为什么本实验在加入环己醇之前应预先加热反应液?
4. 反应完后如果反应混合物呈淡紫红色,为什么要加入亚硫酸氢钠?写出其反应方程式。
5. 本实验得到的溶液为什么要用盐酸酸化?除用盐酸酸化外,是否还可用其他酸酸化?为什么?。
