实验3 两条序列比对与多序列比对
序列比对

Clustal的输入输出格式
输入序列的格式比较灵活,可以是前面介绍
过的FASTA格式,还可以是PIR、SWISSPROT、GDE、Clustal、GCG/MSF、RSF等 格式。
输出格式也可以选择,有ALN、GCG、
PHYLIP和NEXUS等,用户可以根据自己的 需要选择合适的输出格式。
以多个物种的抗坏血酸过氧化物酶的的蛋 白质序列进行比对为例
第三章
序列比对
为什么要序列比对?
基于同源物鉴定的功能预测 基本假设:
序列的保守性
因为:
功能的保守性
1. 蛋白质一般在三级结构的层面上执行功能; 2. 蛋白质序列的保守性决定于其编码DNA的保守性。
序列比对中的进化假设
1. 所有的生物都起源于同一个祖先; 2. 序列不是随机产生,而是在进化上,不断发生着 演变; 3. 基本假设: 序列保守性 结构保守性 注意:反之并不为真。 结构保守性 序列保守性
寻找序列中相似度最高的区域,也就是匹
局部比对
配密度最高的部分。
适用于在某些部分相似度较高,而其他部
位差异较大的序列。 如:Smith-Waterman算法
局部相似性比对
局部相似性比对的生物学基础是蛋白质功能位点往
往是由较短的序列片段组成的,这些部位的序列具 有相当大的保守性,尽管在序列的其它部位可能有 插入、删除或突变。
Blast。前面讲的两两比对是一种特殊的blast。
基因组BLAST
基本BLAST有5种。
基本blast
粘贴序列
结 果 显 示
结 果 显 示
结 果 显 示
3.3.2 多重序列的本地化软件对齐
例如:可采用ClustalX软件
实习四:多序列比对(Multiple alignment)

实习四:多序列比对(Multiple alignment)学号姓名专业年级实验时间提交报告时间实验目的:1. 学会利用MegAlign进行多条序列比对2. 学会使用ClustalX、MUSCLE 和T-COFFEE进行多条序列比对分析3. 学会使用HMMER进行HMM模型构建,数据库搜索和序列比对实验内容:多序列比对是将多条序列同时比对,使尽可能多的相同(或相似)字符出现在同一列中。
多序列比对的目标是发现多条序列的共性。
如果说序列两两比对主要用于建立两条序列的同源关系,从而推测它们的结构和功能,那么,同时比对多条序列对于研究分子结构、功能及进化关系更为有用。
例如,某些在生物学上有重要意义的相似区域只能通过将多个序列同时比对才能识别。
只有在多序列比之后,才能发现与结构域或功能相关的保守序列片段,而两两序列比对是无法满足这样的要求的。
多序列比对对于系统发育分析、蛋白质家族成员鉴定、蛋白质结构预测、保守模块的搜寻以及PCR引物设计等具有非常重要的作用。
作业:1.Align the orthologous nucleotide and protein sequences from 5 organisms you found from first practice with MegAlign. Describe the sequences you used (the title of each sequence), explain whether the phylogenetic tree is consistent with the species tree from NCBI taxonomy database. Set the alignment report to show consensus strength and decorate the residues different from consensus with green shade.(Hint: use the taxonomy common tree from NCBI to get the evolutionary relationship among the organisms. Save your organism name in a text file with each organism name in a line, and upload the file, choose Add from file, and you will see the relationship among the specified organisms) /Taxonomy/CommonTree/wwwcmt.cgiHint 2:Change the accession number in your fasta or genPept format sequence file to organism name, so that the phylogenetic tree can be easily understood.方法与结果:打开Megalign,选择FILE下的Enter sequence ,打开之前保存的来自于五个物种的蛋白(或核酸)序列;首先选择打分矩阵,点击“Align”,选择Set residue Weight Table 选择矩阵:PAM100(核酸则设为weighted),通过“method parameters”查看参数,使用Clustal V的默认值;其次进行序列的比对,选择Align下的“by Clustal V Method”开始比对,再次待其结束后,进行比对结果的显示,选择view下的“Phylogenetic Tree”,显示出树形图;(图)与NCBI上找到的树形图进行对比(图);接下来点击View 下的“Alignment reports ”,选择OPTIONS下的“Alignment report contents”勾中“show consensus strength”,即在序列中显示出相似性条块;在OPTIONS下选择“New decorations”对decoration parameters 下选“shade—residues differing from—the consensus”把字符选择现实的颜色为绿色,结果显示如下:(图)同法可以得到核酸的树形图:(图)分析:系统发育树与NCBI上的物种树有很大的差异,因为可能这些物种间含有很多同源序列,我们不能单凭几条相似序列的同源关系来判断物种的亲缘关系,而应该考虑到物种更多相似序列的同源关系。
序列比对的基本方法

序列比对的基本方法序列比对是生物信息学中重要的一项任务,它用于比较和分析不同生物序列之间的相似性和差异性。
序列比对方法既可以应用于DNA序列之间的比较,也可以用于蛋白质序列之间的比较。
本文将介绍序列比对的基本方法,包括全局比对、局部比对和多序列比对。
一、全局比对全局比对是将整个序列进行比对,得到两个序列之间的最佳匹配。
最常用的全局比对方法是Needleman-Wunsch算法,该算法用动态规划的方式计算两个序列之间的最佳匹配。
其基本思想是在两个序列中插入一个空位,并为每个空位赋予一定的惩罚分数,然后通过计算每种插入方式的得分来确定最佳插入位置,从而得到最佳匹配。
二、局部比对局部比对是在两个序列中寻找最佳匹配的子序列。
最常用的局部比对算法是Smith-Waterman算法,该算法也是基于动态规划的方法。
不同于全局比对,局部比对将得分为负值的子序列直接设为0,从而忽略掉匹配较差的部分。
该算法在序列比对中应用广泛,可以用于发现序列中的保守区域以及识别重复序列。
三、多序列比对多序列比对是指将多个序列进行比对,从而得到它们之间的相似性和差异性。
多序列比对方法有多种,包括ClustalW、MAFFT和Muscle等。
这些方法常用于计算进化关系,识别保守区域和功能位点等。
其中,ClustalW是最常用的多序列比对软件之一,它使用的是基于目标函数的方法,在多个序列中寻找最佳的全局匹配。
MAFFT和Muscle则分别使用多种算法来处理不同类型的序列,从而提高比对的准确性和效率。
四、快速比对算法传统的序列比对方法在处理大规模序列数据时效率较低。
为了提高比对速度,研究者提出了一系列快速比对算法,如BLAST、 FASTA和Smith-Waterman-Gotoh算法等。
这些算法常用于初步比对和预测,可以在较短的时间内找到相似序列,从而提高工作效率。
其中,BLAST是最常用的快速比对算法之一,其基本思想是将查询序列与参考数据库中的序列进行比对,并根据匹配得分对结果进行排序,从而找到相似序列。
多序列比对与以及各类常见的序列分析工具介绍

多序列比对与以及各类常见的序列分析工具介绍多序列比对是一种比较多个生物序列之间的相似性和差异性的分析方法,可以揭示它们之间的演化关系和功能差异。
它在生物信息学和分子生物学研究中广泛应用,有助于研究DNA、RNA和蛋白质序列的进化、功能区域和氨基酸残基间相互作用。
本文将介绍多序列比对的基本原理和常见的序列分析工具。
多序列比对的目标是通过寻找序列之间的共有特征,建立它们之间的相似性和差异性关系图。
这种比对分析可以通过多种方式实现,包括基于局部比对和全局比对的算法。
局部比对主要用于短序列比对或存在插入/缺失的序列,而全局比对则适用于较长的序列。
常见的序列分析工具:1. Clustal Omega:Clustal Omega是一种用于多序列比对的工具,具有较高的准确性和较快的计算速度。
它通过整合序列比对和树构建方法来生成相似性矩阵,进而构建进化树、同源家族和功能域簇。
2.MAFFT:MAFFT是一种广泛使用的多序列比对工具,具有较快的速度和较高的准确性。
它适用于较大和较长的序列比对,并在处理有多种长度变化的序列时表现良好。
3. Muscle:Muscle是一种快速而准确的多序列比对工具。
它采用迭代算法,通过比对似然和得分来改善比对准确性。
Muscle还可以生成不同格式的输出文件,便于后续分析。
4. T-Coffee:T-Coffee是一种多序列比对工具,结合了精确性和速度。
它提供了多种比对模式,适用于不同类型的序列数据。
T-Coffee还可以集成结构信息进行序列比对。
5.MUSCLE:MUSCLE能够进行全局和局部序列比对,并自动根据序列间的相似性进行调整。
它广泛应用于DNA、RNA和蛋白质序列比对,并能够处理相对较大的序列集。
6. ClustalW:ClustalW是一种常见的多序列比对工具,旨在生成全局比对。
它提供了多种比对算法和可视化选项,可用于分析相对于参考序列的多个不同序列。
7.BLAST:BLAST是一种常用的序列比对工具,用于快速进行局部序列比对和寻找相似性序列。
生物信息学中的多序列比对方法

生物信息学中的多序列比对方法生物信息学是一门研究生命科学数据的计算机科学学科,主要用于从大量基因组、蛋白质组、代谢组等生命组学数据中发现、分析和研究基因、蛋白质、代谢途径等生命过程的规律。
其中的多序列比对(Multiple Sequence Alignment,MSA)技术是一个比较重要的研究方法,其主要应用于多种生物信息学研究方向,如物种分类、基因结构和功能研究、蛋白质结构和功能研究等。
本文就生物信息学中的多序列比对方法进行简要介绍。
一、多序列比对的意义及难点多序列比对是将多条生物序列进行比对,在把它们对齐之后确定它们之间的共同位点及其差异位点的过程,从而分析出序列间的相似性和异质性等结构、功能上的关联。
这一过程主要分为四步:选择序列、生成比对矩阵、进行比对分析和生成比对结果。
通过多序列比对可以揭示序列进化、注释微小RNA、寻找共同结构域、定位功能残基等关键性生物学问题。
多序列比对的难点主要包括以下几个方面:(1)大数据量。
由于生物序列的数据量是非常庞大的,比如对于人和马之间的比对,需要对他们的约3000万个碱基进行比对,而且每个人的基因组或每个生物的蛋白质组都是高度复杂和大量重复的,因此进行多序列比对的计算复杂度非常大,需要使用高效的计算方法,充分利用计算资源。
(2)序列多样性。
生物序列相互之间具有高度的多样性,包括同一物种内的不同个体、不同物种之间的比对和不同基因家族的比对等,这些差异给多序列比对带来很大的挑战,需要使用不同的比对算法、策略和参数,才能得到最优的结果。
(3)精度和可信度。
生物序列不同的比对方法可能会得到不同的结果,因此必须对比和评估多种方法的参数和性能指标,同时要考虑到数据的来源、质量和格式等,以提高比对结果的精度和可信度。
(4)效率和实时性。
多序列比对通常是大数据、高计算量的任务,因此需要使用高性能计算环境或分布式计算架构,同时要考虑到任务的时间复杂度、并行度和负载均衡等问题,从而提高比对效率和实时性。
第四章:双序列比对

Finding k-tups
position 1 2 3 4 5 6 7 8 9 10 11 protein 1 n c s p t a . . . . . protein 2 . . . . . a c s p r k position in offset amino acid protein A protein B pos A - posB ----------------------------------------------------a 6 6 0 c 2 7 -5 k 11 n 1 p 4 9 -5 r 10 s 3 8 -5 t 5 ----------------------------------------------------Note the common offset for the 3 amino acids c,s and p A possible alignment is thus quickly found protein 1 n c s p t a | | | protein 2 a c s p r k
比对的算法
Needleman-Wunsch Smith-Waterman算
算法适用于整体水平 上相似性程度较高的 2个序列。是整体比 对算法,其结果反映 了两个序列中所有残 基地整体相似性。
法在识别局部相似性 时,具有很高的灵敏 度,但只是寻找序列 中一些小的、具有局 部相似性的片断。
Basic Pairwise Alignment
列片断,称为k-tuple. 用于蛋白质序列比对时,k- tuple长度为1~2个 残基,用于DNA序列比对时, k- tuple长度最多 为6个碱基。 通过比较2个序列中断片断及其相对位置可以构 成一个动态规划矩阵地对角线方向上的一些匹 配片断 期望值E:E值越接近0,表明2序列第匹配不大 可能是由随机因素造成的,即E值越低,置信 度越高。
生物信息学中的序列比对方法

生物信息学中的序列比对方法序列比对是生物信息学中一项非常重要的工具,其主要目的是将两个或更多的DNA、RNA或蛋白质序列进行比较,以找到它们之间的相似性和差异性。
这样的比对可以用来识别基因、预测蛋白质结构、推断进化关系和研究生物系统的复杂性等。
随着DNA测序技术的快速发展,越来越多的生物学家和生物信息学家开始研究序列比对方法。
序列比对是一项复杂而耗时的任务,需要对大量的序列进行计算和分析。
因此,发展高效的序列比对方法对于生物信息学的发展至关重要。
当前,生物信息学界广泛应用的序列比对方法主要包括全局比对、局部比对和多序列比对等。
一、全局比对全局比对是指将整个序列与另一个相似序列进行比对。
它的应用场景通常是在两个相对较短的序列中查找相似片段,以便在进一步的研究中进行详细的分析。
全局比对方法最常用的是Needleman-Wunsch算法和Smith-Waterman算法。
Needleman-Wunsch(NW)算法是第一个被开发出来的全局比对算法。
该算法基于动态编程的思想,通过将整个序列进行比对,计算出最佳匹配的得分和路径。
然而,这种方法的时间复杂度非常高,随着序列长度的增加,其计算成本也会呈指数级增长。
Smith-Waterman(SW)算法是一种优化的全局比对算法,其核心思想与NW算法类似。
不同之处在于SW算法将匹配的得分设置为正数,而将多余的间隔和未匹配的子序列得分设置为负数。
通过这种方式,SW算法可以得到一个全局最佳的比对结果。
然而,该算法的计算成本也比较高,因此其应用场景受到一定的限制。
二、局部比对局部比对是指在比对序列的过程中,只对部分区域进行比对。
与全局比对不同,局部比对更适用于两个序列之间只有一些片段相似的情况。
常用的局部比对方法主要包括BLAST算法和FASTA算法等。
BLAST算法是一种聚集序列算法,它将大量的搜索序列放入一个空间中,通过加速计算找到最匹配的序列。
通过BLAST算法,可以快速搜索数据库中的所有序列,并找到与目标序列相似的匹配。
序列比对(双序列比对)

二:实验内容及操作步骤
1. 进入
/blast/bl 2seq/wblast2.cgi
2. 下载核酸或蛋白质序列分别放在 sequence1和sequence2中 3. 核酸使用blastn程序,蛋白使用blastp程序 4. 设置不同罚分值进行比对,比较结果
二:实验内容及操作步骤
1wblast2.cgi
2. 下载核酸或蛋白质序列分别放在 sequence1和sequence2中 3. 核酸使用blastn程序,蛋白使用blastp程序 4. 设置不同罚分值进行比对,比较结果 5. 自己选取 个序列来比对。 自己选取2个序列来比对 个序列来比对。
cgcggttccg acggcgggga gggggcgagg tggggccgtg gcggcgagcc caccgacgga ggaggcggtg cagatgacgg agccgctcac caaggaggac ctcgtggcct acctcgtctc cgggtgcaag cccaaggaga actggagaat tggcacagaa catgagaagt tcggttttga agttgataca ttgcgtccta taaagtacga tcagatccgt gacatcctga atggacttgc tgagaggttt gattgggaca agatagttga agaaaataac gttatcggtc tcaagcaggg aaaacaaagc atttcactag aacctggcgg tcagtttgaa cttagtggtg ctcctcttga
运用:
请查询(或搜索)Os11g37990的 请查询(或搜索) 的 DNA、mRNA(cDNA)和蛋白质序列。 、 和蛋白质序列。 和蛋白质序列
生物信息学中的序列比对方法研究

生物信息学中的序列比对方法研究序列比对是生物信息学中常用的一项基础技术,用于确定两个或多个生物序列之间的相似性和差异。
这对于理解生物系统的演化关系、预测蛋白质结构和功能以及研究基因组变异等具有重要的意义。
本文将介绍生物信息学中常用的序列比对方法和它们的优缺点。
1. 单序列比对方法单序列比对方法主要用于比较一个序列与数据库中的其他序列的相似性,例如BLAST(Basic Local Alignment Search Tool)和FASTA(Fast All)。
BLAST是一种快速而准确的比对算法,它通过在查询序列与目标序列中找到相似的片段并计算分数来确定序列之间的相似性。
BLAST将查询序列与目标序列比对的过程分为两步:首先,寻找高分数的核苷酸(或氨基酸)片段;其次,对这些片段进行扩展以确定整个比对序列。
BLAST是一种非常快速的比对方法,适用于大规模的数据库搜索。
FASTA是另一种常用的序列比对方法,它通过计算两个序列之间的局部相似性来确定它们的相似性。
FASTA使用快速而高效的算法,可以找到目标序列中完全或部分匹配的片段,并通过得分来评估相似性。
FASTA比对方法适用于较小规模的数据库搜索,并具有较高的灵敏度。
2. 多序列比对方法多序列比对方法主要用于比较多个序列之间的相似性,例如ClustalW、MUSCLE和MAFFT。
ClustalW是一种经典的多序列比对算法,它通过将多个序列进行两两比对并计算相似性得分来构建一个序列矩阵。
然后,ClustalW将该矩阵用于构建进化树,并生成一种优化的多序列比对结果。
ClustalW适用于较小规模、低复杂度的序列。
MUSCLE(Multiple Sequence Comparison by Log-Expectation)是一种基于概率模型的多序列比对方法。
它通过最大化序列之间的整体相似性得分来构建多序列比对结果。
MUSCLE相对于ClustalW而言,能够获得更准确的多序列比对结果。
多序列比对

实验六:多序列比对- Clustal、MUSCLE西北农林科技大学生物信息学中心实验目的:学会使用Clustal 和MUSCLE 进行多序列比对分析。
实验内容:多序列比对是将多条序列同时比对,使尽可能多的相同(或相似)字符出现在同一列中。
多序列比对的目标是发现多条序列的共性。
如果说序列两两比对主要用于建立两条序列的同源关系,从而推测它们的结构和功能,那么,同时比对多条序列对于研究分子结构、功能及进化关系更为有用。
例如,某些在生物学上有重要意义的相似区域只能通过将多个序列同时比对才能识别。
只有在多序列比对之后,才能发现与结构域或功能相关的保守序列片段,而两两序列比对是无法满足这样的要求的。
多序列比对对于系统发育分析、蛋白质家族成员鉴定、蛋白质结构预测、保守motif 的搜寻等具有非常重要的作用。
我们这节课主要学习两个广泛使用的多序列比对软件-Clustal、MUSCLE。
一、Clustal/Clustal 是一种利用渐近法(progressive alignment)进行多条序列比对的软件。
即先将多个序列两两比较构建距离矩阵,反应序列之间的两两关系;随后根据距离矩阵利用邻接法构建引导树(guide tree);然后从多条序列中最相似(距离最近)的两条序列开始比对,按照各个序列在引导树上的位置,由近及远的逐步引入其它序列重新构建比对,直到所有序列都被加入形成最终的比对结果为止(Figure 6.1)。
Clustal 软件有多个版本。
其中Clustalw 采用命令行的形式在DOS 下运行;Clustalx 是可视化界面的程序,方便在windows 环境下运行;Clustal omega 是最新的版本,优点是比对速度很快,可以在短短数小时内比对成百上千的序列,同时由于采用了新的HMM 比对引擎,它的比对准确性也有了极大的提高,有DOS 命令行和网页服务器版。
我们今天主要学习clustalx 的使用。
范例1. 采用clustalx 进行多序列比对。
多序列比对的实验报告

一、实验目的1. 掌握多序列比对的基本原理和方法。
2. 熟悉使用BLAST、CLUSTAL W等工具进行多序列比对。
3. 分析比对结果,了解序列间的进化关系。
二、实验原理多序列比对是指将两个或多个生物序列进行排列,以揭示序列间的相似性和进化关系。
通过比对,可以识别保守区域、功能域和结构域,为生物信息学研究和进化生物学研究提供重要依据。
多序列比对的方法主要包括以下几种:1. 动态规划法:通过构建一个动态规划表,计算最优比对路径,实现序列的比对。
2. 人工比对法:通过分析序列结构、功能域等信息,人工进行比对。
3. 基于启发式算法的比对:通过寻找序列间的相似性,快速进行比对。
三、实验材料1. 仿刺参EGFR基因氨基酸序列(Fasta格式)。
2. 同源序列数据库(如NCBI)。
3. 多序列比对软件(如BLAST、CLUSTAL W)。
四、实验步骤1. 使用BLAST工具进行同源序列搜索。
(1)在NCBI网站上,选择“BLAST”功能。
(2)将仿刺参EGFR基因氨基酸序列粘贴到“Query Sequence”框中。
(3)选择合适的比对参数,如“MegaBLAST”。
(4)点击“BLAST”按钮,等待结果。
(5)在结果页面,找到相似度最高的几个序列,下载下来。
2. 使用CLUSTAL W进行多序列比对。
(1)将下载的同源序列整合到一个Fasta格式的文本文件中。
(2)在CLUSTAL W软件中,选择“Multiple Sequence Alignment”功能。
(3)上传Fasta格式的文本文件。
(4)选择合适的比对参数,如“Gap Penalty”和“Gap Reward”。
(5)点击“Align”按钮,等待结果。
3. 分析比对结果。
(1)观察比对结果,分析序列间的相似性和进化关系。
(2)绘制系统进化树,展示序列的进化历程。
五、实验结果与分析1. 使用BLAST工具,找到与仿刺参EGFR基因氨基酸序列相似度最高的几个序列,如Anopheles gambiae、Nasonia vitripennis等。
生物信息学实验报告

生物信息学实验报告班级::学号:日期:实验一核酸和蛋白质序列数据的使用实验目的了解常用的序列数据库,掌握基本的序列数据信息的查询方法。
教学基本要求了解和熟悉NCBI 核酸和蛋白质序列数据库,可以使用BLAST进行序列搜索,解读BLAST 搜索结果,可以利用PHI-BLAST 等工具进行蛋白质序列的结构域搜索,解读蛋白质序列信息,可以在蛋白质三维数据库中查询相关结构信息并进行显示。
实验容提要在序列数据库中查找某条基因序列(BRCA1),通过相关一系列数据库的搜索、比对与结果解释,回答以下问题:1. 该基因的基本功能?2. 编码的蛋白质序列是怎样的?3. 该蛋白质有没有保守的功能结构域 (NCBI CD-search)?4. 该蛋白质的功能是怎样的?5. 该蛋白质的三级结构是什么?如果没有的话,和它最相似的同源物的结构是什么样子的?给出示意图。
实验结果及结论1. 该基因的基本功能?This gene encodes a nuclear phosphoprotein that plays a role in maintaining genomic stability, and it also acts as a tumor suppressor. The encoded protein combines with other tumor suppressors, DNA damagesensors, and signal transducers to form a large multi-subunit protein complex known as the BRCA1-associated genome surveillance complex (BASC). This gene product associates with RNA polymerase II, and through the C-terminal domain, also interacts with histone deacetylase complexes. This protein thus plays a role in transcription, DNA repair of double-stranded breaks, and recombination. Mutations in this gene are responsible for approximately 40% of inherited breast cancers and more than 80% of inherited breast and ovarian cancers. Alternative splicing plays a role in modulating the subcellular localization and physiological function of this gene. Many alternatively spliced transcript variants, some of which are disease-associated mutations, have been described for this gene, but the full-length natures of only some of these variants has been described. A related pseudogene, which is also located on chromosome 17, has been identified. [provided by RefSeq, May 2009]2. 编码的蛋白质序列是怎样的?[Homo sapiens]1 mdlsalrvee vqnvinamqk ilecpiclel ikepvstkcd hifckfcmlk llnqkkgpsq61 cplcknditk rslqestrfs qlveellkii cafqldtgle yansynfakk ennspehlkd121 evsiiqsmgy rnrakrllqs epenpslqet slsvqlsnlg tvrtlrtkqr iqpqktsvyi181 elgsdssedt vnkatycsvg dqellqitpq gtrdeislds akkaacefse tdvtntehhq241 psnndlntte kraaerhpek yqgssvsnlh vepcgtntha sslqhenssl lltkdrmnve301 kaefcnkskq pglarsqhnr wagsketcnd rrtpstekkv dlnadplcer kewnkqklpc361 senprdtedv pwitlnssiq kvnewfsrsd ellgsddshd gesesnakva dvldvlnevd421 eysgssekid llasdpheal ickservhsk svesniedki fgktyrkkas lpnlshvten481 liigafvtep qiiqerpltn klkrkrrpts glhpedfikk adlavqktpe minqgtnqte541 qngqvmnitn sghenktkgd siqneknpnp ieslekesaf ktkaepisss isnmelelni601 hnskapkknr lrrksstrhi halelvvsrn lsppnctelq idscssseei kkkkynqmpv661 rhsrnlqlme gkepatgakk snkpneqtsk rhdsdtfpel kltnapgsft kcsntselke721 fvnpslpree keekletvkv snnaedpkdl mlsgervlqt ersvesssis lvpgtdygtq781 esisllevst lgkaktepnk cvsqcaafen pkglihgcsk dnrndtegfk yplghevnhs 841 retsiemees eldaqylqnt fkvskrqsfa pfsnpgnaee ecatfsahsg slkkqspkvt 901 feceqkeenq gknesnikpv qtvnitagfp vvgqkdkpvd nakcsikggs rfclssqfrg 961 netglitpnk hgllqnpyri pplfpiksfv ktkckknlle enfeehsmsp eremgnenip 1021 stvstisrnn irenvfkeas ssninevgss tnevgssine igssdeniqa elgrnrgpkl 1081 namlrlgvlq pevykqslpg snckhpeikk qeyeevvqtv ntdfspylis dnleqpmgss 1141 hasqvcsetp ddllddgeik edtsfaendi kessavfsks vqkgelsrsp spfththlaq 1201 gyrrgakkle sseenlssed eelpcfqhll fgkvnnipsq strhstvate clsknteenl 1261 lslknslndc snqvilakas qehhlseetk csaslfssqc seledltant ntqdpfligs 1321 skqmrhqses qgvglsdkel vsddeergtg leennqeeqs mdsnlgeaas gcesetsvse 1381 dcsglssqsd ilttqqrdtm qhnliklqqe maeleavleq hgsqpsnsyp siisdssale 1441 dlrnpeqsts ekavltsqks seypisqnpe glsadkfevs adsstsknke pgversspsk 1501 cpslddrwym hscsgslqnr nypsqeelik vvdveeqqle esgphdltet sylprqdleg 1561 tpylesgisl fsddpesdps edrapesarv gnipsstsal kvpqlkvaes aqspaaahtt 1621 dtagynamee svsrekpelt astervnkrm smvvsgltpe efmlvykfar khhitltnli 1681 teetthvvmk tdaefvcert lkyflgiagg kwvvsyfwvt qsikerkmln ehdfevrgdv 1741 vngrnhqgpk raresqdrki frgleiccyg pftnmptdql ewmvqlcgas vvkelssftl 1801 gtgvhpivvv qpdawtedng fhaigqmcea pvvtrewvld svalyqcqel dtylipqiph 1861 shy3. 该蛋白质有没有保守的功能结构域 (NCBI CD-search)?有保守的供能结构域。
两条序列比对与多序列比对
实验三:两条序列比对与多序列比对实验目的:学会使用MegAlign,ClustalX和MUSCLE进行两条序列和多条序列比对分析实验内容:双序列比对是使两条序列产生最高相似性得分的序列排列方式和空格插入方式。
两条序列比对是生物信息学最基础的研究手段。
第一次实验我们用dotplot方法直观地认识了两条序列比对。
但是dotplot仅仅是展示了两条序列中所有可能的配对,并不是真正意义上的序列比对。
这里介绍进行两条序列比对的软件-MegAlign。
多序列比对是将多条序列同时比对,使尽可能多的相同(或相似)字符出现在同一列中。
多序列比对的目标是发现多条序列的共性。
如果说序列两两比对主要用于建立两条序列的同源关系,从而推测它们的结构和功能,那么,同时比对多条序列对于研究分子结构、功能及进化关系更为有用。
多序列比对对于系统发育分析、蛋白质家族成员鉴定、蛋白质结构预测、保守模块的搜寻等具有非常重要的作用。
我们这节课主要学习多条序列比对的软件-ClustalX, MUSCLE。
一、MegAlignDNASTAR公司的Lasergene软件包是一个比较全面的生物信息学软件,它包含了7个模块。
其中MegAlign可进行两条或多条序列比对分析。
1. 两条序列比对1.1 安装程序解压DNASTAR Lasergene软件压缩包,双击Lasergene710WinInstall.exe文件,按照默认路径安装软件到自己电脑上。
1.2 载入序列a.点击开始-程序-Lasergene-MegAlign,打开软件。
我们首先用演示序列(demo sequence)学习软件的使用。
演示序列所在位置:C:\Program files\ DNASTAR\ Lasergene\ Demo Megalign\ Histone Sequences\。
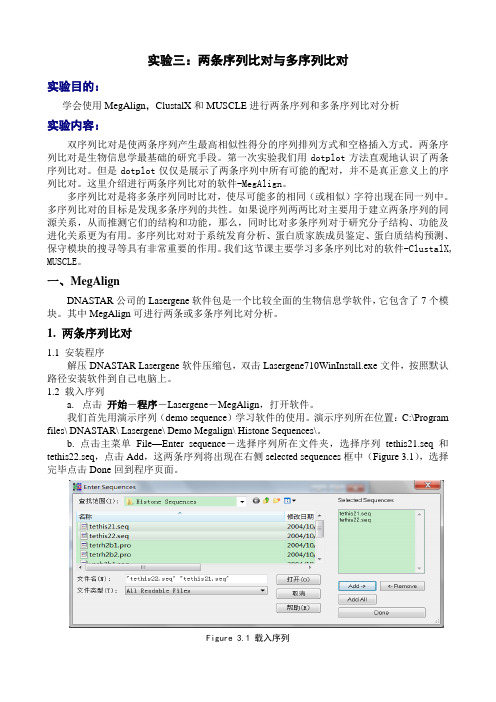
b. 点击主菜单File—Enter sequence-选择序列所在文件夹,选择序列tethis21.seq和tethis22.seq,点击Add,这两条序列将出现在右侧selected sequences框中(Figure 3.1),选择完毕点击Done回到程序页面。
生物信息学和基因组学中的序列比对和拼接

生物信息学和基因组学中的序列比对和拼接序列比对和拼接是生物信息学和基因组学研究中的重要技术。
通过比对和拼接,可以研究基因组中的基因序列、RNA序列、蛋白质序列等生物分子序列信息。
序列比对是指将两条或多条生物分子序列进行对比,找出它们之间的相似性和差异性。
通常通过计算相似性分数来衡量序列的相似性,常用的相似性评估方法包括百分比相似性、编辑距离、曼哈顿距离等。
其中,百分比相似性是最常用的方法,其计算公式为“相同碱基的数量 / 总碱基数× 100%”。
序列比对的方法包括全局比对和局部比对。
全局比对是将整条序列进行比对,适用于序列差异较大的情况。
局部比对是将序列中的片段进行比对,适用于序列存在重复区域或异构体等复杂情况。
序列拼接是指将两条或多条生物分子序列拼接起来形成一条完整的序列。
在基因组测序中,常用的拼接方法包括Overlap-Layout-Consensus(OLC)和De Bruijn图。
OLC方法将测序产生的大量短序列通过比对形成序列重叠区域,再根据重叠区域构建一张序列图形,最后生成最长的序列。
De Bruijn图方法将测序产生的短序列进行碎片化,然后根据这些碎片构建De Bruijn图,最后生成最长的序列。
序列比对和拼接在研究生物分子序列中具有广泛的应用。
比对和拼接结果可以用于推断序列之间的进化关系、预测序列的结构和功能,以及发掘新的序列之间的关联性等。
利用序列比对和拼接,可以更深入地了解生物体内复杂的分子交互,从而为研究生物体的生长和发育等生命过程提供理论基础。
目前,随着生物信息学和基因组学技术的发展,序列比对和拼接算法也在不断地改进和优化,增强了对生物体内分子行为的研究能力。
这一领域未来的发展趋势将会更加普及化和多样化,便于更多科研人员探究生物体内复杂的分子行为,为生命科学进一步发展做出贡献。
多序列比对的原理以及clustal在多序列比对中的应用

a.多序列比对模式。
b.剖面(profile)比对模式。
3.一个实际的例子。
多序列比对实例
输入文件的格式(fasta): >KCC2_YEAST NYIFGRTLGAGSFGVVRQARKLSTN…… >DMK_HUMAN DFEILKVIGRGAFSEVAVVKMKQTGQVYAMKIMNK……. >KPRO_MAIZE TRKFKVELGRGESGTVYKGVLEDDRHVAVKKLEN…… >DAF1_CAEEL QIRLTGRVGSGRFGNVSRGDYRGEAVAVKVFNALD…… >1CSN HYKVGRRIGEGSFGVIFEGTNLLNN……
多序列比对的方法
基本上多序列比对可以分为 1.手工比对(辅助编辑软件如bioedit, seaview,Genedoc等)
通过辅助软件的不同颜色显示不同残基,靠分 析者的观察来改变比对的状态。
2.计算机程序自动比对
通过特定的算法(如同步法,渐进法等),由 计算机程序自动搜索最佳的多序列比对状态。
自动多序列比对的算法
第一步:输入序列文件。
第二步:设定比对的一些参数。
参数设定窗口。
第三步:开始序列比对。
第四步:比对完成,选择保存结果文件的格式
在线的clustalw分析
1.EBI提供的在线clustalw服务
/clustalw/
2.我们构建的在线clustalw服务
多序列比对工具 -clustalX
Clustal是一个单机版的基于渐进比对的 多序列比对工具,由Higgins D.G. 等开发。 有应用于多种操作系统平台的版本,包括 linux版,DOS版的clustlw,windows版本 的clustalx等。
多序列比对

2.同步法
同步法实质是把给定的所有序列同时进行比对, 而不是两两比对或分组进行比对。 其基本思想是将一个二维的动态规划矩阵扩展 到三维或多维。矩阵的维数反映了参与比对的序 列数。这类方法对于计算机的系统资源要求较高, 通常是进行少量的较短的序列的比对
3.步进法 这类方法中最常用的就是Clustal,它是由Feng和 Doolittle于1987年提出的(Feng和Doolittle,1987)。由 于对于实际的数据利用多维的动态规划矩阵来进行序列的 比对不太现实,因此大多数实用的多序列比对程序采用启 发式算法,以降低运算复杂度。 Clustal的基本思想是基于相似序列通常具有进化相关性 这一假设。比对过程中,先对所有的序列进行两两比对并 计算它们的相似性分数值,然后根据相似性分数值将它们 分成若干组,并在每组之间进行比对,计算相似性分数值。 根据相似性分数值继续分组比对,直到得到最终比对结果。 比对过程中,相似性程度较高的序列先进行比对,而距离 较远的序列添加在后面。作为程序的一部分,Clusal可以 输出用于构建进化树的数据。
一般来说,对于具有较高相似性的一组序列之间的比 对,自动比对方法是很有效的。一旦序列的亲缘关系变 得较远,所得结果就不那么可信。若要得到比较可靠而 又具有明确生物学意义的比对结果,比较有效的方法是 对比对结果进行手工编辑和调整。这对于构建二次数据 库是非常重要的信息。在选择现有的序列模式或序列模 体公开数据库构建自己的数据库系统时,对这些现有数 据库的可靠性必须采取谨慎的态度
比对方法
1.手工比对方法 手工比对方法在文献中经常看到。因为难免加入 一些主观因素,手工比对通常被认为有很大的随意 性。其实,即使用计算机程序进行自动比对,所得 结果中的片面性也不能予以忽视。在运行经过测试 并具有比较高的可信度的计算机程序基础上,结合 实验结果或文献资料,对多序列比对结果进行手工 修饰,应该说是非常必要的
Clustalx 实验指南(一步一步很详细)

实验三:多条序列比对——Clustalx(一)ClustalXClustal是一种利用渐近法(progressive alignment)进行多条序列比对的软件。
即从多条序列中最相似(距离最近)的两条序列开始比对,按照各个序列在进化树上的位置,由近及远的将其它序列依次加入到最终的比对结果。
(Figure 3.1)/1.安装clustalx程序。
双击安装clustalx-2.0.12-win.msi.exe文件到自己的电脑上。
也可从/download/current/下载,列表中的倒数第二个文件。
clustalx-2.0.12-win.msiFigure 3.1 clustal 算法2.准备要比对的序列请查找至少存在于5个物种中的同源序列(核酸或蛋白质皆可),并保存为fasta格式,存为文本文件(所有的序列请粘贴到同一个文本文件中)。
选择NM、XM或NP打头的序列,不要选择NC或NW打头的序列,那是全基因组序列。
做法可参照邮箱中的preparations for practice3.doc文件。
3.打开clustalX程序开始菜单-程序-clustalX2- clustalX24.载入序列点最上方的File菜单,选择Load Sequence-选择你刚保存的序列文件,点打开。
在左侧窗口里是fasta格式序列的标识号,取自序列第一行“>”后的字符。
(Figure 3.2) 注意:ClustalX程序无法识别汉字,无法识别带空位的文件夹名,如 my document。
各位同学保存的序列文件不要保存在桌面上或带汉字的文件夹中,推荐保存在D盘根目录下。
常见文件打开错误原因:1.序列格式有问题,非正确的fasta格式。
2.文件中有序列重复粘贴。
TIPS: 想要方便识别序列所属物种,可在每条序列“>”后输入物种名,加空位即可。
EXAMPLE:原格式:>gi|262050536|ref|NM_002218.4| Homo sapiens inter-alpha (globulin) inhibitor H4 (plasma Kallikrein-sensitive glycoprotein) (ITIH4), transcript variant 1, mRNA改为:>human gi|262050536|ref|NM_002218.4| Homo sapiens inter-alpha (globulin) inhibitor H4 (plasma Kallikrein-sensitive glycoprotein) (ITIH4), transcript variant 1, mRNAFigure 3.2 载入序列5.比对参数的选择可以对两条序列比对的参数和多条序列比对的参数进行设置。
序列比对多序列试验的流程和方法

序列比对多序列试验的流程和方法下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!深入理解:序列比对多序列试验的流程与方法序列比对是生物信息学中的核心问题,尤其在基因组学和蛋白质组学研究中扮演着重要角色。
实验3两条序列比对与多序列比对

实验三:两条序列比对与多序列比对实验目的:学会使用MegAlign,ClustalX和MUSCLE进行两条序列和多条序列比对分析实验内容:双序列比对是使两条序列产生最高相似性得分的序列排列方式和空格插入方式。
两条序列比对是生物信息学最基础的研究手段。
第一次实验我们用dotplot方法直观地认识了两条序列比对。
但是dotplot仅仅是展示了两条序列中所有可能的配对,并不是真正意义上的序列比对。
这里介绍进行两条序列比对的软件-MegAlign。
多序列比对是将多条序列同时比对,使尽可能多的相同(或相似)字符出现在同一列中。
多序列比对的目标是发现多条序列的共性。
如果说序列两两比对主要用于建立两条序列的同源关系,从而推测它们的结构和功能,那么,同时比对多条序列对于研究分子结构、功能及进化关系更为有用。
多序列比对对于系统发育分析、蛋白质家族成员鉴定、蛋白质结构预测、保守模块的搜寻等具有非常重要的作用。
我们这节课主要学习多条序列比对的软件-ClustalX, MUSCLE。
一、MegAlignDNASTAR公司的Lasergene软件包是一个比较全面的生物信息学软件,它包含了7个模块。
其中MegAlign可进行两条或多条序列比对分析。
1. 两条序列比对1.1 安装程序解压DNASTAR Lasergene软件压缩包,双击Lasergene710WinInstall.exe文件,按照默认路径安装软件到自己电脑上。
1.2 载入序列a.点击开始-程序-Lasergene-MegAlign,打开软件。
我们首先用演示序列(demo sequence)学习软件的使用。
演示序列所在位置:C:\Program files\ DNASTAR\ Lasergene\ Demo Megalign\ Histone Sequences\。
b. 点击主菜单File—Enter sequence-选择序列所在文件夹,选择序列tethis21.seq和tethis22.seq,点击Add,这两条序列将出现在右侧selected sequences框中(Figure 3.1),选择完毕点击Done回到程序页面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验三:两条序列比对与多序列比对实验目的:学会使用MegAlign,ClustalX和MUSCLE进行两条序列和多条序列比对分析实验内容:双序列比对是使两条序列产生最高相似性得分的序列排列方式和空格插入方式。
两条序列比对是生物信息学最基础的研究手段。
第一次实验我们用dotplot方法直观地认识了两条序列比对。
但是dotplot仅仅是展示了两条序列中所有可能的配对,并不是真正意义上的序列比对。
这里介绍进行两条序列比对的软件-MegAlign。
多序列比对是将多条序列同时比对,使尽可能多的相同(或相似)字符出现在同一列中。
多序列比对的目标是发现多条序列的共性。
如果说序列两两比对主要用于建立两条序列的同源关系,从而推测它们的结构和功能,那么,同时比对多条序列对于研究分子结构、功能及进化关系更为有用。
多序列比对对于系统发育分析、蛋白质家族成员鉴定、蛋白质结构预测、保守模块的搜寻等具有非常重要的作用。
我们这节课主要学习多条序列比对的软件-ClustalX, MUSCLE。
一、MegAlignDNASTAR公司的Lasergene软件包是一个比较全面的生物信息学软件,它包含了7个模块。
其中MegAlign可进行两条或多条序列比对分析。
1. 两条序列比对1.1 安装程序解压DNASTAR Lasergene软件压缩包,双击Lasergene710WinInstall.exe文件,按照默认路径安装软件到自己电脑上。
1.2 载入序列a.点击开始-程序-Lasergene-MegAlign,打开软件。
我们首先用演示序列(demo sequence)学习软件的使用。
演示序列所在位置:C:\Program files\ DNASTAR\ Lasergene\ Demo Megalign\ Histone Sequences\。
b. 点击主菜单File—Enter sequence-选择序列所在文件夹,选择序列tethis21.seq和tethis22.seq,点击Add,这两条序列将出现在右侧selected sequences框中(Figure 3.1),选择完毕点击Done回到程序页面。
Figure 3.1 载入序列此时程序窗口分为三部分,最左侧较窄的是sequence name,中间显示的是序列起始位置,最右侧显示序列末尾部分,可以通过拖动窗口底部滚动条,查看序列其它部分(Figure 3.2)。
若想改变字体显示方式,点击主菜单OPTIONS,选择Font改变字体,选择Size改变字号大小。
若要移除序列,选中sequence name的序列名,右击,选clear。
Figure 3.2 载入序列后(注意标注的绿色箭头,即为坐标位置)1.3 设定序列比对位置MegAlign允许使用者选择序列的一部分进行比对分析,例如,可以根据GenBank格式的序列中Features部分关于编码区(CDS)位置的描述,设定只对此编码区进行分析。
a. 点击最左侧Sequence Name框中的第一条序列tethis,然后选择主菜单OPTIONS-Set sequence limits-from feature table。
(Figure 3.3)此时根据feature内容,出现四个可以选择的片段,第一个为全长,从序列起始到末尾(1-906),其它三个则只包括序列的一部分,选择最后一个Histone H2B-1—CDS,点击Change the Reset,点击OK,同样对第二条序列进行上述操作,回到主界面工作区,此时窗口中的序列起始和终止位置已经发生了变化。
(Figure 3.4)Figure 3.3 利用Feature Table选择序列特定部分Figure 3.4 选择序列特定部分b. 我们还可以通过设定序列坐标进行部分序列比对,首先选定序列,选择主菜单OPTIONS-Set sequence limits-by coordinates,输入起始和终止位置坐标来选择部分序列进行分析。
注意:只有genbank格式的序列才可以Set sequence limits from feature table,fasta格式的序列因为没有feature那一项内容,只可以Set sequence limits by coordinates。
1.4 进行两条序列比对如果输入两条序列后不设置序列起始和终止位置,默认是全长序列进行比对。
按住Shift选择序列tethis21和tethis22,然后点击主菜单Align-One pair,由于目前输入的是核酸序列,此时有两个选项,Wilbur-Lipman Method和Martiner NW Method。
如果输入的是蛋白质序列,这两个选项将是灰色,只能用Lipman-Pearson Method进行比对。
Wilbur-Lipman Method是一种以word为单位的(word-based)启发式局部比对方法;Martiner NW Method是一种改进了的全局动态规划算法。
Lipman-Pearson Method是序列相似度搜索软件Fasta的比对算法,也是一种以word为单位的快速启发式算法。
选择其中一个,出现比对参数设定窗口(Figure 3.5),选择默认参数不做更改,直接点击OK即可。
Figure 3.5 Wilbur-Lipman比对方法参数设定这时出现一个新窗口,即为比对结果。
可以选择OPTION-size,放大字号观察比对结果。
可以看到在窗口上部显示的是比对方法名称,所用参数,两条序列各自的起止位置,相似度值,比对结果中空位数目,长度和一致序列的长度。
随后就是比对结果部分,其中第一行是第一条序列,它上面的v70是标尺,其中的“V”的位置对应的是第一条序列的第70个核苷酸所在位置;第三行是第二条序列,它下方的数字同样对应该序列位置坐标;中间那行是根据两条序列比对结果中匹配部分推断出来的一致序列(consensus sequence),错配或空位显示为空白(Figure 3.6)。
Figure 3.6 Wilbur-Lipman方法比对结果设置比对结果显示方式:点击比对结果窗口最左侧的按钮,出现Alignment View Options窗口,可以选择匹配,错配和一致序列的字符颜色和其它显示选项。
推荐使用设置:选择match为红色,mismatch为绿色,consensus为蓝色,并选择show identities as vertical bars (一致序列显示为竖线),则得到Figure 3.7。
还可以尝试选中或不选show header, show ruler,show names,show contest四个选项,看看显示结果有何变化。
Figure 3.7 Alignment View OptionsTIP:MegAlign分析自己下载的序列时要注意序列扩展名如果是从NCBI直接下载的fasta格式文件,可以象上面一样,用enter sequence直接将序列读入程序。
但是如果序列文件是复制粘贴到txt文档中的,MegAlign程序是无法识别扩展名为txt的文件。
此时可将每条序列文件(fasta或genbank格式皆可)扩展名改为MegAlign可以识别的类型(核酸序列为seq,蛋白质序列为pro),即可从File-Enter sequence 载入。
更改文件扩展名的方法:找到你要更改扩展名的文件,将.txt改为.seq或 .pro,此时会弹窗口,提示“如果改变文件扩展名,可能会导致文件不可用。
确实要更改吗?”选择“是”,文件图标会变成MegAlign特定图标,说明修改成功。
若扩展名自动隐藏,打开文件夹,点击窗口上的主菜单工具-文件夹选项,在打开的页面选择选项卡查看,去掉“隐藏已知文件类型的扩展名”前面的对勾,确定退出。
然后再用上述方法更改扩展名。
2. 多序列比对2.1 载入序列进行多条序列比对的演示序列(demo sequence)在c:\program files\ dnastar\ lasergene\ demo megalign\ Calmodulin Sequences\ 文件夹里。
点击主菜单File-Enter Sequence-根据路径到达Calmodulin Sequences文件夹,点击Add All,此时14条序列全都出现在右侧的selected sequences框中,点击Done,回到主程序工作区。
(Figure 3.8)这是来自14个物种的钙调蛋白。
Figure 3.8载入14条序列2.2 序列比对第一步,选择比对所用的打分矩阵。
点击主菜单Align-Set residue Weight Table,由于钙调蛋白比较保守,我们选择PAM100作为打分矩阵,点击OK结束设定(Figure 3.9)。
Figure 3.9 选择打分矩阵此时还可以通过点击Align-Method Parameters设定比对所用的其它参数。
打开的新窗口中包含三个选项卡,Jotun Hein、Clustal V和Clustal W,对应程序中多条序列比对可用的三种算法。
推荐大家不做修改,使用默认参数即可。
第二步,比对。
点击Align-by Clustal V Method,此时出现窗口显示比对进度,比对结束后,回到原来工作窗口,显示比对结果。
注意序列上方彩色条块,颜色代表对应列中相似程度,相似度由低到高,依次以深蓝、浅蓝、绿、黄、桔、红几种颜色代表。
(Figure 3.10)Figure 3.10 比对后结果2.3 查看比对结果此时可以通过几种方式观察比对结果。
a.点击View-Sequence Distances出现新窗口,显示两两序列percent identity(上半部分)和divergence(下半部分)。
Figure 3.11 比对结果-一致度(identity)b.点击View-Residue Substitutions出现新窗口,显示比对中所有替换的类型和数目。
Figure 3.12 比对结果-替换情况c.点击View-Phylogenetic Tree出现新窗口,显示根据14条序列比对结果构建出的进化树。
Figure 3.13 比对结果-进化树d.点击View-Alignment Reports出现新窗口,显示比对结果报告。
点击OPTIONS-Alignment report contents,选中show consensus strength,其它不变,点击OK。
在序列上方出现条块,显示每一列序列的相似程度。
Figure 3.14选择show consensus strength显示结果设置比对结果显示方式:突出显示匹配或错配的氨基酸。
