高等化工热力学-第1章
合集下载
高等化工热力学-第一章

热机,等做的功。因此
W Ws [( PV )m ]
d (mU ) dt
Q Ws [(U 1 u2 gz )m ] [( PV )m ] 2
Q Ws [(U PV 1 u2 gz )m] 2
因为 H = U + PV,得到
Note: Hin is constant and the subscript i denotes the initial state.
Integration
H in U i n H in U ni
Considering the air as an ideal gas, then n PTi ni PiT
d (mU ) dt
Q Ws [( H 1 u2 gz )m ] 2
d ( mU ) dt
[( H
1 u2 2
gz )m ] Q Ws
这就是敞开体系热力学第一定律的通用形式。
Problem
An insulated, electrically heated tank for hot water contains 190 kg of liquid water at 60 0C when a power outage occurs. If water is withdrawn from the tank at a steady rate of 0.2 kg/s, how long will it take for the temperature of the water in the tank to drop from 60 to 35 0C? Assume that cold water enters the tank at 10 0C, and Cv=Cp=C, independent of T and P. (一个保温很好、容量为190kg 的电热水器将水加热到60 0C 时,突然断电。如果此时电热水器以0.2 kg/s的质量流速放 出热水,问需要多长时间电热水器里面的水由60 0C 降到 35 0C?假设:电热水器进口的冷水温度为10 0C,水的CV = CP = C,与温度无关。)
高等工程热力学第1章
附: 华氏温标和摄氏温标
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
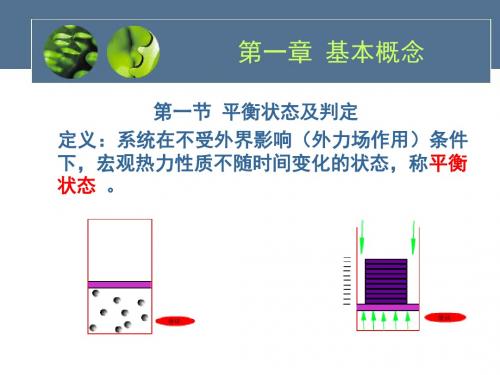
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
化工热力学Ⅱ(高等化工热力学)——第一章 绪论

离子液体CO2吸收剂 离子液体
超临界CO2在离子液体中的溶解度很大,CO2溶解导致 在离子液体中的溶解度很大, 超临界 离子液体体积膨胀比传统溶剂小得多, 离子液体体积膨胀比传统溶剂小得多,CO2和离子液体的相 互作用中阴离子起主要作用,能形成弱的路易斯酸碱络合物. 互作用中阴离子起主要作用,能形成弱的路易斯酸碱络合物. 低压低浓度CO2在离子液体中的溶解度和溶解动力学的 低压低浓度 研究尚不多.引入胺基基团似乎是必须的. 研究尚不多.引入胺基基团似乎是必须的. 离子液体的高粘度是其应用的重大障碍. 离子液体的高粘度是其应用的重大障碍.
超级活性炭CO2吸附剂 超级活性炭
Content of CO2(%)
7 6
超高比表面积活性炭, 超高比表面积活性炭, 比表面积2000~4000 m2/g可调; 可调; 比表面积 可调 3800m2/g的超级活性炭对 的超级活性炭对CO 的超级活性炭对
2的
5 4 3 2 1 0
0 20 40 60 80 100 120 140 160 180 200 220
目前成本:30~50美元/吨CO2 目前成本:30~50美元/ 美元 目标成本:10美元/吨CO2 目标成本:10美元/ 美元
CO2溶剂吸收分离
吸收溶剂必须具备的性能: 吸收溶剂必须具备的性能:
◆ CO2的溶解度大 ◆ 选择性好 ◆ 沸点高 无腐蚀, ◆ 无腐蚀,无毒性 ◆ 化学性能稳定 粘度小, ◆ 粘度小,扩散系数大
CH2 CH OH n
+
CH2O
CH2
CH O
CH2
CH O
.........
+
H2O
CH2
聚乙烯醇
例7.我国利用新能源"干空气能 获重要突破 .我国利用新能源"干空气能"获重要突破 干燥的空气也是一种能源,可用于空调制冷: 干燥的空气也是一种能源,可用于空调制冷:由清华大 学和新疆一公司联合研发的"干空气能间接蒸发冷水机" 学和新疆一公司联合研发的"干空气能间接蒸发冷水机", 日前在乌鲁木齐通过建设部研究开发成果验收.(摘自2007 .(摘自 日前在乌鲁木齐通过建设部研究开发成果验收.(摘自 日的《 年7月27日的《科技文摘报》) 月 日的 科技文摘报》 例8.2007年10月10日《Nature》一篇研究论文认为:全球变 . 年 月 日 》一篇研究论文认为: 暖提高空气湿度 英国科学家在该论文中写到, 年至2004年间,地球 年间, 英国科学家在该论文中写到,1976年至 年至 年间 表面平均温度升高了0.49摄氏度,大气水蒸气浓度升高了2.2 表面平均温度升高了 摄氏度,大气水蒸气浓度升高了 摄氏度 %.此前 科学家已经注意到,随着气温的升高, 此前, %.此前,科学家已经注意到,随着气温的升高,陆地和海 洋表面蒸发的水分增多, 洋表面蒸发的水分增多,从而导致空气湿度在过去几十年间 有所提高.论文采用了一套新的湿度观察数据. 有所提高.论文采用了一套新的湿度观察数据.该数据是在 20世纪末通过"地球气候系统"这一强大的计算机模拟计算 世纪末通过" 世纪末通过 地球气候系统" 得出的.(摘自2007年10月12日的《参考消息》) 得出的.(摘自 年 月 日的《参考消息》 .(摘自 日的
化工热力学第1章绪论-热力学

系。
微观研究方法
(统计热力学)
特点:建立在大量粒子群的统
计性质的基础上,从物质的微
观结构观察与分析问题,预
测与解释平衡情况下物质的
宏观性质。从分子间的相互
作用出发,建立宏观性质与
微观性质的关系。
37
➢化工热力学的局限性
经典热力学局限性之一
不能定量预测物质的宏观性质;
不能解释微观本质及其产生某种现象的内部原因。
➢
进行过程的能量衡算;
➢
研究化工过程能量的有效利用;
➢
热力学数据与物性数据的测量、关联和预测。
u2
H mg Z m
Q Ws
2
、c、 s、 E、 、 c、 HP ......
Q p H C P dT
T2
T1
f H 、C H 、 f G、Cigp 、 H vap ......
也实施不了;热力学证明是可以行通的事情,
在实际当中才能够行的通。
N 2 3 H 2 2 NH 3
G 0( 25o C、
0.1MPa)
G 0( 500o C ,20 50 MPa )
33
1.3热力学特性及局限性
➢热力学的四大特性
⑵完整性:
• 热力学第一定律:能量守恒定律
• 热力学第二定律:熵增原理(热效率)
G的计算。
31
1.2 热力学的分支
⑶ 化工热力学(Chemical Engineering Thermodynamics)
研究在化学工程中的热力学问题,化工热力学具有
化学热力学和工程热力学的双重特点。它既要解决
能量的利用问题,又要研究解决相际之间质量传递
微观研究方法
(统计热力学)
特点:建立在大量粒子群的统
计性质的基础上,从物质的微
观结构观察与分析问题,预
测与解释平衡情况下物质的
宏观性质。从分子间的相互
作用出发,建立宏观性质与
微观性质的关系。
37
➢化工热力学的局限性
经典热力学局限性之一
不能定量预测物质的宏观性质;
不能解释微观本质及其产生某种现象的内部原因。
➢
进行过程的能量衡算;
➢
研究化工过程能量的有效利用;
➢
热力学数据与物性数据的测量、关联和预测。
u2
H mg Z m
Q Ws
2
、c、 s、 E、 、 c、 HP ......
Q p H C P dT
T2
T1
f H 、C H 、 f G、Cigp 、 H vap ......
也实施不了;热力学证明是可以行通的事情,
在实际当中才能够行的通。
N 2 3 H 2 2 NH 3
G 0( 25o C、
0.1MPa)
G 0( 500o C ,20 50 MPa )
33
1.3热力学特性及局限性
➢热力学的四大特性
⑵完整性:
• 热力学第一定律:能量守恒定律
• 热力学第二定律:熵增原理(热效率)
G的计算。
31
1.2 热力学的分支
⑶ 化工热力学(Chemical Engineering Thermodynamics)
研究在化学工程中的热力学问题,化工热力学具有
化学热力学和工程热力学的双重特点。它既要解决
能量的利用问题,又要研究解决相际之间质量传递
化工热力学第一章内工大

相,则应更完整地表达出每一个相的 s、V 、Yk 和每一组
分的数量 ni ( 1,2, , )
当系统进行了一个任意的无穷小变化,不论是封闭系统中的
变化,还是有物质进出的敞开系统中的变化,也不论是可逆
过程还是不可逆过程,可根据式(l-6)写出全微分式,
1.25
dU
( U S
)V ,Y ,n dS
(U V
1.12
当然,热力学也有它的短处,由于热力学不涉及物质 的微观结构或模型,因此对某一系统的特性,例如P-V-T关 系、热容、生成热、相平衡常数等,不能给出具体的知识。 有关这些特性的理论,需要统计力学的帮助,这将在以后 章节介绍。
本章的标题是流体的热力学,表明我们研究的对象主 要是气体和液体,当然有关的原理原则上也可以用于固体。 在本章中,我们将从热力学基本方程开始,接着讨论平衡 准则与稳定性判据,然后介绍适用于多组分系统的一些特 殊规律。如偏摩尔量与整体量的关系,吉布斯一杜亥姆方 程、过量函数与逸度、活度等,最后着重讨论热力学在多 组分气液平衡中的应用。
由这四个方程得到的式(1---16)即为化学位的定义式。
1.32
三、化学位的应用
化学位是一个状态函数,并且应该是一个强度性质。下 面简要介绍它的一些特性。 1、对只做膨胀功的化学反应的封闭系统,将式(1-13) 与式( 1-17)比较,可得:
K
idni 0
i 1
(1 18 )
这就是熟知的用化学位表达的平衡准则。当应用于化学反应
)S ,Y ,n dV
L k 1
U ( Yk
)
dYk
S ,V ,Y [k ],n
K i 1
U ( ni
)
dni
S ,V ,Y ,n[i]
分的数量 ni ( 1,2, , )
当系统进行了一个任意的无穷小变化,不论是封闭系统中的
变化,还是有物质进出的敞开系统中的变化,也不论是可逆
过程还是不可逆过程,可根据式(l-6)写出全微分式,
1.25
dU
( U S
)V ,Y ,n dS
(U V
1.12
当然,热力学也有它的短处,由于热力学不涉及物质 的微观结构或模型,因此对某一系统的特性,例如P-V-T关 系、热容、生成热、相平衡常数等,不能给出具体的知识。 有关这些特性的理论,需要统计力学的帮助,这将在以后 章节介绍。
本章的标题是流体的热力学,表明我们研究的对象主 要是气体和液体,当然有关的原理原则上也可以用于固体。 在本章中,我们将从热力学基本方程开始,接着讨论平衡 准则与稳定性判据,然后介绍适用于多组分系统的一些特 殊规律。如偏摩尔量与整体量的关系,吉布斯一杜亥姆方 程、过量函数与逸度、活度等,最后着重讨论热力学在多 组分气液平衡中的应用。
由这四个方程得到的式(1---16)即为化学位的定义式。
1.32
三、化学位的应用
化学位是一个状态函数,并且应该是一个强度性质。下 面简要介绍它的一些特性。 1、对只做膨胀功的化学反应的封闭系统,将式(1-13) 与式( 1-17)比较,可得:
K
idni 0
i 1
(1 18 )
这就是熟知的用化学位表达的平衡准则。当应用于化学反应
)S ,Y ,n dV
L k 1
U ( Yk
)
dYk
S ,V ,Y [k ],n
K i 1
U ( ni
)
dni
S ,V ,Y ,n[i]
化工热力学第一章.

化工热力学是理论和工程实践性都较强的学科。
化工热力学 第一章 绪 论
化工热力学解决的实际问题可以归纳为三类: (1) 过程进行的可行性分析和能量的有效利用; (2) 相平衡和化学反应平衡问题; (3) 测量、推算与关联热力学性质。
化工热力学 第一章 绪 论
2. 热力学在化工过程开发中的作用
局限:对物质结构必须采用一些假设的模型,这 些假设模型只是物质实际结构的近似描写。
化工热力学 第一章 绪 论
四、化工热力学研究内容及在化工过程开发中的作用 1. 化工热力学的研究内容
化工热力学的主要任务是以热力学第一、第二定律 为基础,研究化工过程中各种能量的相互转化及其有效利 用的规律,研究物质状态变化与物质性质之间的关系以及 物理或化学变化达到平衡的理论极限、条件和状态。
7 了解热力学在化工过程中的主要实际应用。
化工热力学 第一章 绪 论
预备知识(复习名词、概念)
体系与环境
体系:研究的对象 环境:研究对象以外的部分
敞开体系(开系):体系与环境之间有能量与物质的交换。
体系 封闭体系(闭系):体系与环境之间只有能量交换而无物质的交换。
孤立体系:体系与环境之间既无能量交换也无物质的交换。
化工热力学 第一章 绪 论
过程与循环
过程:状态的变化历程 按可逆程度分:可逆过程、不可逆过程。 按状态参数变化分:等温、等压、等容、等焓、绝热过程等。
循环: 正向循环:热能变为机械能的热力循环。PV图上以顺时针 方向循环。所有热机都是。
逆向循环:消耗能量迫使热量从低温流向高温。 V图上以逆 时针方向循环。所有制冷、热泵都是。
3.化工热力学在化工过程开发中的作用
降低原料消耗,减少环境污染; 降低能耗(利用夹点技术); 提高产品的质量(利用新型分离技术); 为化工单元操作提供多元相平衡数据; 为实验成果的放大,实现工业化提供基础
化工热力学 第一章 绪 论
化工热力学解决的实际问题可以归纳为三类: (1) 过程进行的可行性分析和能量的有效利用; (2) 相平衡和化学反应平衡问题; (3) 测量、推算与关联热力学性质。
化工热力学 第一章 绪 论
2. 热力学在化工过程开发中的作用
局限:对物质结构必须采用一些假设的模型,这 些假设模型只是物质实际结构的近似描写。
化工热力学 第一章 绪 论
四、化工热力学研究内容及在化工过程开发中的作用 1. 化工热力学的研究内容
化工热力学的主要任务是以热力学第一、第二定律 为基础,研究化工过程中各种能量的相互转化及其有效利 用的规律,研究物质状态变化与物质性质之间的关系以及 物理或化学变化达到平衡的理论极限、条件和状态。
7 了解热力学在化工过程中的主要实际应用。
化工热力学 第一章 绪 论
预备知识(复习名词、概念)
体系与环境
体系:研究的对象 环境:研究对象以外的部分
敞开体系(开系):体系与环境之间有能量与物质的交换。
体系 封闭体系(闭系):体系与环境之间只有能量交换而无物质的交换。
孤立体系:体系与环境之间既无能量交换也无物质的交换。
化工热力学 第一章 绪 论
过程与循环
过程:状态的变化历程 按可逆程度分:可逆过程、不可逆过程。 按状态参数变化分:等温、等压、等容、等焓、绝热过程等。
循环: 正向循环:热能变为机械能的热力循环。PV图上以顺时针 方向循环。所有热机都是。
逆向循环:消耗能量迫使热量从低温流向高温。 V图上以逆 时针方向循环。所有制冷、热泵都是。
3.化工热力学在化工过程开发中的作用
降低原料消耗,减少环境污染; 降低能耗(利用夹点技术); 提高产品的质量(利用新型分离技术); 为化工单元操作提供多元相平衡数据; 为实验成果的放大,实现工业化提供基础
化工热力学-第一章

四、热力学的研究方法
抽象的、 方法来处理 (2)利用抽象的、概括的、理想的方法来处理 )利用抽象的 概括的、理想的方法 问题,当用于实际时,加以修正。 问题,当用于实际时,加以修正。
如:理想气体 实际气体 剩余性质 超额性质 PV=RT PV=Z PV=ZRT =M- 实际的MR=M-M*=实际的-理想的 (气体) 气体)
=M实际的-理想的(液体) ME=M-Mid=实际的-理想的(液体)
修正项: , , 修正项:Z,MR,ME
五、学习化工热力学的目的、要求 学习化工热力学的目的、
1.目的 两个) 1.目的 ( 两个) (1)了解化工热力学的基本内容 (2)提高利用化工热力学的观点、方法来 提高利用化工热力学的观点、 分析、解决化工生产、工程设计、 分析、解决化工生产、工程设计、科学研究中 有关实际问题的能力。 有关实际问题的能力。
2.热力学的分支 2.热力学的分支
(1)工程热力学(Engineering 工程热力学( Thermodynamics) Thermodynamics) 主要研究功、热转化, 主要研究功、热转化,以及能量利用率的 高低。 高低。 Thermodynamics) (2)化学热力学(Chemical Thermodynamics) 化学热力学( 应用热力学原理研究有关化学中各类平 衡问题。 衡问题。 主要侧重于热力学函数的计算,主要是H 主要侧重于热力学函数的计算,主要是H、 的计算。 S、U、 F和G的计算。
工程热力学 化学热力学 化工热力学 经典热力学
3.化工热力学在化学工程中的地位 3.化工热力学在化学工程中的地位
原料 反应 反应工程 分离提纯 分离工程 产品
工艺学
化工动力学 催化工程
化工热力学
化工热力学-第1-2章

2.1 引言
热力学性质的计算需要流体最基本的性质 流体最基本的性质: (1)P、V、T、组成和热容数据; (2)热数据(标准生成焓和标准生成熵等) 积累了大量纯物质及其混合物的P-V-T数据 大部分纯物质的临界参数、正常沸点、饱 和蒸汽压的基础数据
2.2 纯物质的 –V –T相图 纯物质的p 相图
第一章 绪论
主要任务: 主要任务:是运用经典热力学原理解决
(1)过程进行的可行性分析和能量有效利用; )过程进行的可行性分析和能量有效利用; (2)平衡问题,特别是相平衡; )平衡问题,特别是相平衡; (3)平衡状态下的热力学性质计算。 )平衡状态下的热力学性质计算。 (4)热力学性质与压力、温度和组成等能够直接测量的物理量联系起来; 热力学性质与压力、温度和组成等能够直接测量的物理量联系起来; 热力学性质与压力 V=V(T,P) ( , ) M=M(T,P) M=U,H,A,G,Cp,…… ( , ) , , , , , (5)检验实验数据质量 )
有穿过相界面,这个变化过程是渐变的过程, 即从液体到流体或从气体到流体都是渐变的 过程,不存在突发的相变。超临界流体的性质
B
非常特殊,既不同于液体,又不同于气体,它 的密度接近于液体,而传递性质则接近于气 体,可作为特殊的萃取溶剂和反应介质。近些 年来, 利用超临界流体特殊性质开发的超临界 分离技术和反应技术成为引人注目的热点。
第一章 绪论
1.5 热力学性质计算的一般方法
[例题 例题1-1] 计算例图1-1所示的纯流体单相区的强度性质M的变 例题
化量.系统从(T1,p1)的初态变化至(T2,p2)的终态。
解决问题的一般步骤: P (1)变量分析 M=(T,P) (T2,p2) (2)将热力学性质与能直接测量的P-V-T 性质和理想气体热容Cpig联系起来 △M=M(T2,p2)-M (T1,p1) (T1,p1) ig(T ,p )] =[M(T2,p2)-M 2 0 T - [M(T1,p1)-M ig(T1,p0)] 例图1-1 均相纯物质的 均相纯物质的P-T图 例图 图 + [M ig (T2,p0)-M ig(T1,p0)] (3)引入表达系统特性的模型 (4)数学求解
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14
第一章 热力学原理和函数
1.2 系统、过程和状态变量
三、齐次函数 1.定义 若函数F(x,y,z,...)的自变量x,y,z, ...同时扩大k倍,函 数比原函数扩大km倍,即 F(kx,ky,kz,...)=kmF(x,y,z,...) 则称此函数为m级齐次函数。 如e(x+y)/z为零级齐次函数。 性质:若F(x,y,z)为l级齐次函数,φ (x,y,z)为m级齐 次函数,则 F ( x, y, z ) ( x, y, z ) ( x , y , z ) 为l-m级齐次函数。
7
绪 论
再比如一个单相系统,如果T、P、x确定了, V应该怎样呢?也就是说状态方程应该有什么 样的具体形式呢? 这些问题并不是宏观性质的普遍联系问题, 而要涉及到每一个具体系统的特性,不同的系 统有不同的状态方程,有不同的相平衡关系。 显然,他们不能用不考虑系统特性的经典热力 学来解决。即经典热力学最终没能解决前面所 提到的问题——当独立变量确定后,其他性质 应该具有怎样的数值?
四、热力学性质 1.强度性质 与系统内物质的量无关的性质称为强度性质,如温度, 压力,密度等,显然强度性质满足: I(T,P,λn1,λn2,…,λnc)=I(T,P,n1,n2,…,nc) (1-1) 即强度性质是系统内物质量ni的零级齐次函数。 2.广度性质 与系统内物质的量成正比的性质成为广度性质,如系 统内能、焓、熵等,显然容量性质满足: E(T,P,λn1,λn2,…,λnc)=λE(T,P,n1,n2,…,nc) (1-2) 即容量性质是系统内物质量ni的一级齐次函数。 由齐次函数的性质可知,两个容量性质相除为强度性质。
10
绪 论
目前采用的研究方法
由于目前对分子间的相互作用了解还不够,数 学上也验 的微观模型,需要采取简化的数学处理方法。 也就是说,目前对流体平衡性质或热力学性质 的研究,是综合运用经典热力学、统计热力学 以及一些半经验的模型和方法。
2
绪 论
教材
1.赵广绪,R A 格林肯.流体热力学平衡理论的 导论.化学工业出版社 2.许文.高等化工热力学.天津大学出版社, 2004 主要参考书: 1.胡英.流体的分子热力学.高等教育出版社 2.朱自强.流体相平衡原理及其应用. 3.朱自强,陈新志.本科化工热力学教材.第三版, 化学工业出版社, 2009
则: x ( F ) y ( F ) z ( F ) ( m 1) F
x x y x
F x
z x
x
由Euler定律可知, 是m-1级齐次函数, F F 同理可证,y 和 z 均为m-1级齐次函数。
17
第一章 热力学原理和函数
1.2 系统、过程和状态变量
11
第一章 热力学原理和函数
1.1 引言 1.2 体系、过程和状态变量 1.3 热力学基本定律 1.4 势函数和响应函数 1.5 平衡判据和稳定性
12
第一章 热力学原理和函数
1.2 系统、过程和状态变量
一、系统和环境 在热力学分析中,我们往往研究宇宙内的一 部分物质和空间,这部分物质或空间就成为系 统。那么,其余的物质或空间则称为环境。 系统可以分为三种类型 1.孤立系统:若系统与环境间没有物质和能量 交换,则此系统称为孤立系统。 2.敞开系统:若系统与环境间既有物质交换又 有能量交换,则此系统成为敞开系统。 3.封闭系统:若系统与环境间只有能量交换没 有物质交换,则此系统称为封闭系统系。
18
第一章 热力学原理和函数
1.2 系统、过程和状态变量
五、恰当微分和非恰当微分 对独立变量为x1和 x2的函数F=F(x1, x2)微分,
F F dx1 x x dx2 C1 ( x1 , x 2 )dx1 C 2 ( x1 , x 2 )dx2 1 x2 2 x1
6
绪 论
经典热力学的局限性
经典热力学所建立的热力学关系式只规定了 各种性质变化间所必须遵循的相互依赖关系, 而并没有指出各种性质与独立变量间的关系的 具体函数形式,而具体的函数形式是随具体系 统而异的。 比如一个两相平衡体系,只要已知一个相的组 成x及T(或P),体系就可以确定了。但是如 果我们不知道P及另一个相的组成y与T、x之间 的具体函数关系,就不能确定P与y的具体数值。
4
绪 论
流体的性质
(1)热力学性质(平衡性质) 主要研究流体处于平衡时温度、压力、体积、 组成及各种热力学函数。如内能、焓、熵、自 由能等的变化规律。这种规律是蒸馏、萃取、 吸收等单元操作的理论基础,也是处理一些包 含流体的过程时所必须具备的知识。化工热力 学的研究在此范畴内。 (2)迁移性质(非平衡性质) 物质的扩散系数
令k=1,则
x
F F F y z mF x y z
16
第一章 热力学原理和函数
1.2 系统、过程和状态变量
性质:若F(x,y,z)为m级齐次函数,则
F F F , , x y z
是m-1级齐次函数。
证明:Euler定律对x求导,得
F F F F F x ( ) y ( ) z ( )m x x x y x z x x
15
第一章 热力学原理和函数
1.2 系统、过程和状态变量
2. 欧拉Euler定律 设F(x,y,z)为m级齐次函数,则
x F F F y z mF x y z
证明:∵F(x,y,z)是m级齐次函数 ∴F(kx,ky,kz)=kmF(x,y,z) 上式两边对k求导
F ( kx, ky, kz) ( kx) F ( kx, ky, kz) ( ky) F ( kx, ky, kz) ( kz) mk m1 F ( x , y , z ) ( kx) k ( ky) k ( kz) k
(1-3)
若F及其导数连续,且
F F x2 x1 x x1 x2 x 2 x 1 x 1 2
或
C 1 C 2 x 2 x x1 x 1 2
2
1
D
比较以上各式,得
2
1
(C1dx1 C2dx2 ) A (C1dx1 C2dx2 ) B (C1dx1 C2dx2 )C
1 1
2
2
即状态函数F(x1,x2)的变化值只与始态和终态有关,与 过程无关。
21
第一章 热力学原理和函数
1.2 系统、过程和状态变量
2.过程函数 以非恰当微分表示的函数称为过程函数。 过程函数的数值与途径即过程有关。我们用温度T和 膨胀功P进一步做以证明: 当压力为P、体积变化无限小时,流体所作的膨胀功 为δ w=pdv,则从状态1变化到状态2的总功为
2
1 2
(C1dx1 C 2 dx2 ) A (C1dx1 C 2 dx2 ) D 0
2
1
B 1 C 2
1 2
(C1dx1 C 2 dx2 ) B (C1dx1 C 2 dx2 ) D 0
2
1
1
(C1dx1 C 2 dx2 )C (C1dx1 C 2 dx2 ) D 0
C1 C 2 (C1dx1 C 2dx2 ) ( x2 x1 )dx1dx2
对于状态函数,因为
C 1 C 2 x 2 x1
所以C1dx1+C2dx2沿封闭途径的积分永远等于零。
20
第一章 热力学原理和函数
1.2 系统、过程和状态变量
对于图中的1→2状态我们可以设置很多个途径,则 有: A
(1-4)
则此微分称为恰当微分,用算符d表示,即 dF=C1dx1+C2dx2 (1-5) 而若 C1 C 2 x 2 x x1 x 则为非恰当微分,用算符δ 表示。
1 2
19
第一章 热力学原理和函数
1.2 系统、过程和状态变量
六、状态函数和过程函数 1.状态函数 以恰当微分表示的函数称为状态函数。 由格林理论沿封闭途径的积分为:
8
绪 论
统计热力学的解决方法
要研究系统的特性,必须应用统计力学。统计 力学从物质的微观结构出发,运用统计的方法 将宏观性质看作是相应微观量的统计平均值, 因而建筑起了联系微观结构与宏观性质间的桥 梁。应用统计热力学,原则上可以预测宏观性 质,可以预测系统的特性。 统计热力学是由微观结构预测宏观性质,而经 典热力学是由一些宏观性质推测另一些宏观性 质。即预测是应用统计力学原理,推测是使用 经典热力学方法。
9
绪 论
对于流体来说,如果从微观考察,最基本的 问题是分子间的相互作用,不同结构的分子有 着不同类型间相互作用,并决定了他们所形成 的系统有不同的宏观特性。如果对分子间的作 用了解得很清楚,又能克服运用统计力学时数 学处理上的困难,应该可以从根本上解决上面 提出的问题,应该可以完全由分子参数预测状 态方程,并进而预测所有热力学性质,预测平 衡关系。
13
第一章 热力学原理和函数
1.2 系统、过程和状态变量
二、过程 状态变化的途径称为过程。 可逆过程 当过程在无限小的净推动力和无限小的速度下进行 时则此过程称为可逆过程。在可逆过程中,系统所有 的状态均为平衡状态。可逆过程是对实际过程而言的, 是一理想的速度为零的极限值。 不可逆过程 实际过程必定是在有限速度下发生的,一切实际过 程均是不可逆的。
5
绪 论
在相平衡和化学平衡的研究中遇到的问题
在一个平衡系统中,当能够决定系统特性的那些独立变 量或性质确定后,其他的那些变量或性质应该具有怎样 的数值? 经典热力学的解决方法 经典热力学由热力学定律建立了一套联系各种宏观性质 的普遍联系式,由于并不涉及还不清楚的微观结构或模 型,因此这种关系式高度可靠。 经验表明,只要我们知道几个变量,就能利用这些热力 学关系式将所有其他的从属变量推算出来。例如,单相 系统中知道了V的变化规律,即P-V-T-X关系或状态方程, 以及Cp,我们就能推算出其他所有热力学性质。
第一章 热力学原理和函数
1.2 系统、过程和状态变量
三、齐次函数 1.定义 若函数F(x,y,z,...)的自变量x,y,z, ...同时扩大k倍,函 数比原函数扩大km倍,即 F(kx,ky,kz,...)=kmF(x,y,z,...) 则称此函数为m级齐次函数。 如e(x+y)/z为零级齐次函数。 性质:若F(x,y,z)为l级齐次函数,φ (x,y,z)为m级齐 次函数,则 F ( x, y, z ) ( x, y, z ) ( x , y , z ) 为l-m级齐次函数。
7
绪 论
再比如一个单相系统,如果T、P、x确定了, V应该怎样呢?也就是说状态方程应该有什么 样的具体形式呢? 这些问题并不是宏观性质的普遍联系问题, 而要涉及到每一个具体系统的特性,不同的系 统有不同的状态方程,有不同的相平衡关系。 显然,他们不能用不考虑系统特性的经典热力 学来解决。即经典热力学最终没能解决前面所 提到的问题——当独立变量确定后,其他性质 应该具有怎样的数值?
四、热力学性质 1.强度性质 与系统内物质的量无关的性质称为强度性质,如温度, 压力,密度等,显然强度性质满足: I(T,P,λn1,λn2,…,λnc)=I(T,P,n1,n2,…,nc) (1-1) 即强度性质是系统内物质量ni的零级齐次函数。 2.广度性质 与系统内物质的量成正比的性质成为广度性质,如系 统内能、焓、熵等,显然容量性质满足: E(T,P,λn1,λn2,…,λnc)=λE(T,P,n1,n2,…,nc) (1-2) 即容量性质是系统内物质量ni的一级齐次函数。 由齐次函数的性质可知,两个容量性质相除为强度性质。
10
绪 论
目前采用的研究方法
由于目前对分子间的相互作用了解还不够,数 学上也验 的微观模型,需要采取简化的数学处理方法。 也就是说,目前对流体平衡性质或热力学性质 的研究,是综合运用经典热力学、统计热力学 以及一些半经验的模型和方法。
2
绪 论
教材
1.赵广绪,R A 格林肯.流体热力学平衡理论的 导论.化学工业出版社 2.许文.高等化工热力学.天津大学出版社, 2004 主要参考书: 1.胡英.流体的分子热力学.高等教育出版社 2.朱自强.流体相平衡原理及其应用. 3.朱自强,陈新志.本科化工热力学教材.第三版, 化学工业出版社, 2009
则: x ( F ) y ( F ) z ( F ) ( m 1) F
x x y x
F x
z x
x
由Euler定律可知, 是m-1级齐次函数, F F 同理可证,y 和 z 均为m-1级齐次函数。
17
第一章 热力学原理和函数
1.2 系统、过程和状态变量
11
第一章 热力学原理和函数
1.1 引言 1.2 体系、过程和状态变量 1.3 热力学基本定律 1.4 势函数和响应函数 1.5 平衡判据和稳定性
12
第一章 热力学原理和函数
1.2 系统、过程和状态变量
一、系统和环境 在热力学分析中,我们往往研究宇宙内的一 部分物质和空间,这部分物质或空间就成为系 统。那么,其余的物质或空间则称为环境。 系统可以分为三种类型 1.孤立系统:若系统与环境间没有物质和能量 交换,则此系统称为孤立系统。 2.敞开系统:若系统与环境间既有物质交换又 有能量交换,则此系统成为敞开系统。 3.封闭系统:若系统与环境间只有能量交换没 有物质交换,则此系统称为封闭系统系。
18
第一章 热力学原理和函数
1.2 系统、过程和状态变量
五、恰当微分和非恰当微分 对独立变量为x1和 x2的函数F=F(x1, x2)微分,
F F dx1 x x dx2 C1 ( x1 , x 2 )dx1 C 2 ( x1 , x 2 )dx2 1 x2 2 x1
6
绪 论
经典热力学的局限性
经典热力学所建立的热力学关系式只规定了 各种性质变化间所必须遵循的相互依赖关系, 而并没有指出各种性质与独立变量间的关系的 具体函数形式,而具体的函数形式是随具体系 统而异的。 比如一个两相平衡体系,只要已知一个相的组 成x及T(或P),体系就可以确定了。但是如 果我们不知道P及另一个相的组成y与T、x之间 的具体函数关系,就不能确定P与y的具体数值。
4
绪 论
流体的性质
(1)热力学性质(平衡性质) 主要研究流体处于平衡时温度、压力、体积、 组成及各种热力学函数。如内能、焓、熵、自 由能等的变化规律。这种规律是蒸馏、萃取、 吸收等单元操作的理论基础,也是处理一些包 含流体的过程时所必须具备的知识。化工热力 学的研究在此范畴内。 (2)迁移性质(非平衡性质) 物质的扩散系数
令k=1,则
x
F F F y z mF x y z
16
第一章 热力学原理和函数
1.2 系统、过程和状态变量
性质:若F(x,y,z)为m级齐次函数,则
F F F , , x y z
是m-1级齐次函数。
证明:Euler定律对x求导,得
F F F F F x ( ) y ( ) z ( )m x x x y x z x x
15
第一章 热力学原理和函数
1.2 系统、过程和状态变量
2. 欧拉Euler定律 设F(x,y,z)为m级齐次函数,则
x F F F y z mF x y z
证明:∵F(x,y,z)是m级齐次函数 ∴F(kx,ky,kz)=kmF(x,y,z) 上式两边对k求导
F ( kx, ky, kz) ( kx) F ( kx, ky, kz) ( ky) F ( kx, ky, kz) ( kz) mk m1 F ( x , y , z ) ( kx) k ( ky) k ( kz) k
(1-3)
若F及其导数连续,且
F F x2 x1 x x1 x2 x 2 x 1 x 1 2
或
C 1 C 2 x 2 x x1 x 1 2
2
1
D
比较以上各式,得
2
1
(C1dx1 C2dx2 ) A (C1dx1 C2dx2 ) B (C1dx1 C2dx2 )C
1 1
2
2
即状态函数F(x1,x2)的变化值只与始态和终态有关,与 过程无关。
21
第一章 热力学原理和函数
1.2 系统、过程和状态变量
2.过程函数 以非恰当微分表示的函数称为过程函数。 过程函数的数值与途径即过程有关。我们用温度T和 膨胀功P进一步做以证明: 当压力为P、体积变化无限小时,流体所作的膨胀功 为δ w=pdv,则从状态1变化到状态2的总功为
2
1 2
(C1dx1 C 2 dx2 ) A (C1dx1 C 2 dx2 ) D 0
2
1
B 1 C 2
1 2
(C1dx1 C 2 dx2 ) B (C1dx1 C 2 dx2 ) D 0
2
1
1
(C1dx1 C 2 dx2 )C (C1dx1 C 2 dx2 ) D 0
C1 C 2 (C1dx1 C 2dx2 ) ( x2 x1 )dx1dx2
对于状态函数,因为
C 1 C 2 x 2 x1
所以C1dx1+C2dx2沿封闭途径的积分永远等于零。
20
第一章 热力学原理和函数
1.2 系统、过程和状态变量
对于图中的1→2状态我们可以设置很多个途径,则 有: A
(1-4)
则此微分称为恰当微分,用算符d表示,即 dF=C1dx1+C2dx2 (1-5) 而若 C1 C 2 x 2 x x1 x 则为非恰当微分,用算符δ 表示。
1 2
19
第一章 热力学原理和函数
1.2 系统、过程和状态变量
六、状态函数和过程函数 1.状态函数 以恰当微分表示的函数称为状态函数。 由格林理论沿封闭途径的积分为:
8
绪 论
统计热力学的解决方法
要研究系统的特性,必须应用统计力学。统计 力学从物质的微观结构出发,运用统计的方法 将宏观性质看作是相应微观量的统计平均值, 因而建筑起了联系微观结构与宏观性质间的桥 梁。应用统计热力学,原则上可以预测宏观性 质,可以预测系统的特性。 统计热力学是由微观结构预测宏观性质,而经 典热力学是由一些宏观性质推测另一些宏观性 质。即预测是应用统计力学原理,推测是使用 经典热力学方法。
9
绪 论
对于流体来说,如果从微观考察,最基本的 问题是分子间的相互作用,不同结构的分子有 着不同类型间相互作用,并决定了他们所形成 的系统有不同的宏观特性。如果对分子间的作 用了解得很清楚,又能克服运用统计力学时数 学处理上的困难,应该可以从根本上解决上面 提出的问题,应该可以完全由分子参数预测状 态方程,并进而预测所有热力学性质,预测平 衡关系。
13
第一章 热力学原理和函数
1.2 系统、过程和状态变量
二、过程 状态变化的途径称为过程。 可逆过程 当过程在无限小的净推动力和无限小的速度下进行 时则此过程称为可逆过程。在可逆过程中,系统所有 的状态均为平衡状态。可逆过程是对实际过程而言的, 是一理想的速度为零的极限值。 不可逆过程 实际过程必定是在有限速度下发生的,一切实际过 程均是不可逆的。
5
绪 论
在相平衡和化学平衡的研究中遇到的问题
在一个平衡系统中,当能够决定系统特性的那些独立变 量或性质确定后,其他的那些变量或性质应该具有怎样 的数值? 经典热力学的解决方法 经典热力学由热力学定律建立了一套联系各种宏观性质 的普遍联系式,由于并不涉及还不清楚的微观结构或模 型,因此这种关系式高度可靠。 经验表明,只要我们知道几个变量,就能利用这些热力 学关系式将所有其他的从属变量推算出来。例如,单相 系统中知道了V的变化规律,即P-V-T-X关系或状态方程, 以及Cp,我们就能推算出其他所有热力学性质。
