无机化学(天津大学第四版答案)
第四版 无机化学 答案

第一章原子结构和原子周期系1-1根据原子序数给出下列元素的基态原子的核外电子组态:(a)K (b)Al (c)Cl (d)Ti(Z=22)(e)Zn(Z=30)(f)As(Z=33)答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p31-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。
(a)Be (b)N (c)F (d)Cl-(e)Ne+(f)Fe3+(g)As3+1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何1-4以下+3价离子那些具有8电子外壳Al3+、Ga3+、Bi3+、Mn3+、Sc3+答:Al3+和Sc3+具有8电子外壳。
1-5已知电中性的基态原子的价电子层电子组态分别为:(a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。
答:(a)p区,ⅦA族,第三周期(b)d区,Ⅷ族,第四周期(c)s区,ⅡA族,第五周期(d)f区,ⅢB族,第六周期(e)ds区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。
答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2;Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2;Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1;Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1;Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。
1-7某元素的基态价层电子构型为5d36s2,给出比该元素的原子序数小4的元素的基态原子电子组态。
答:该元素的基态原子电子组态为[Xe] 4f126s2。
天津大学无机化学教研室《无机化学》(第4版)课后习题(原子结构与元素周期性)【圣才出品】

价层电子构型为 为相似。
所以它属于第七周期、ⅣA 族,可能与已知元素 Pb 的性质最
5 / 13
圣才电子书
十万种考研考证电子书、题库视频学习平
台
(2)电子最先填充在第一个 59 轨道上的元素的原子序数可能是 121。
推测:根据电子填充轨道的次序为
可知出
现第一个 59 电子的元素的电子分布式应为
8.(1)试写出 S 区、P 区、d 区及 ds 区元素的价层电子构型。 (2)具有下列价层电子构型的元素位于周期表中哪一个区?它们各是金属还是非金 属?
答:(1)
表 5-2
(2)
表 5-3
3 / 13
圣才电子书
十万种考研考证电子书、题库视频学习平 台
9.已知某副族元素的 A 原子,电子最后填入 3d,最高氧化数为+4;元素 B 的原子, 电子最后填入 4p,最高氧化数为+5。回答下列问题:
所以该元素原子序数是 121。
(3)118。第七周期最后一种元素的价层构型应为
其电子分布式为
所以第七周期最后一种元素的原子序数应为 118。
(4)50。第八周期的元素种数应该是第八能级组可填充的电子数,即
,所以第八周期应该包括(2+18+14+10+6)=50 种元素。
(二)习题 1.在下列各组量子数中,恰当填入尚缺的量子数。 (1) (2) (3) (4) 解:(1)n≥3 正整数; (2)l=1;
(1)写出 A、B 元素原子的电子分布式; (2)根据电子分布,指出它们在周期表中的位置(周期、区、族)。 答:(1)A: B: (2)A:四周期、d 区、ⅣB 族元素;B:四周期、p 区、ⅤA 族元素。
10.不参看周期表,试推测下列每一对原子中哪一个原子具有较高的第一电离能和较 大的电负性值?
天大第4版无机化学-教学课件-无机化学电子教案 简介

无机化学电子教案
崔建中 主编 崔建中 鲁凡丽 田昀 编制
高等教育出版社
无机化学电子教案 无机化学电子教案 无机化学电子教案
简 介
《无机化学电子教案》为天津大学无机化学教学组编 写的《无机化学》( 第四版 ,2010 年高等教育出版社出版 ) 教材配套的教学软件。 内容涵盖教材中的化学反应基本原理、物质结构基本 理论和元素化学基础知识等内容,其章节划分与教材完全 对应,综合运用了文字、图形、图像、动画、视频录像等 多种媒体技术。适用于高等院校本科(专科)各专业无机化 学教学使用,也可作为学生自学无机化学的参考软件。 本教案由崔建中、鲁凡丽和田昀等修订编制,崔建中 担任主编,杨宏孝、颜秀茹审定。
目 录
第七章 固体的结构与性质 第八章 配位化合物 第九章 氢、稀有气体
第十章 碱金属和碱土金属
第十一章 卤素和氧族元素 第十二章 氮族、碳族和硼族元素
第十三章 过渡元素(一)
无机化学电子教案 无机化学电子教案 无机化学电子教案
目 录
第十四章 过渡元素(二) 第十五章 元素化学综述 第十六章 无机合成
无机化学电子教案 无机化学电子教案 无机化学电子教案
运行环境
1. Windows XP中文系统 2. Microsoft Office 2002 XP中的 PowerPoint 2002 3. Windows media player 和 Realplayer 媒体播放器 4. Flashplayer 动画播放软件
无机化学电子教案 无机化学电子教案 无机化学电子教案
目 录
第〇章 绪论 第一章 化学反应中的质量关系和能量关系 第二章 化学反应的方向、速率和限度
天津大学_化工导论_第二章_无机化工

无机化工原料
无机化学工业的原料来源很广,大致可分五大类:空气、水、化学矿物、化石燃料 (煤、石油、天然气等)及生物质资源。
主要无机化工产品和用途
一、酸、碱(三酸、两碱) 二、化肥(氮肥、磷肥、钾肥) 三、无机盐产品(电池原料、水处理剂等) 四、无机非金属材料(先进陶瓷、炭材料、
人造金刚石等)
一、酸和碱
圆形 碳纤维
碳纤维 增强机
翼
螺旋状炭纤维
人造金刚石----通常以纯石墨为原料,铁、铬等为催化剂,在高温高压下合成人造金刚石。 近年出现新的低压合成方法:热丝化学气相沉积法(CVD法)、等离子体气相沉积法等。用 于磨料、切削工具、电子器件涂膜等。
C60家族
碳纳米管----由碳原子组成的管状大分子,单壁纳米管的直径在0.4至1.8纳米。其抗 张强度是高强合金钢的20倍;具有优异的场致发射功能。可用于纳米电路、更薄更省 电的平面显示器、扫描电镜的探针、氢气储存等用途。
碳 纳 米 管
用导 电大分 子碳制 作的超 细导线
典型产品生产工艺
接触法生产硫酸工艺
(1)二氧化硫的制备 (2)含二氧化硫原料气的净化 (3)二氧化硫氧化为三氧化硫 (4)三氧化硫的吸收
硫铁矿
接触法生产硫酸工艺 二氧化硫制备
原料气的净化
三氧化硫制备
二氧化硫吸收
4FeS + 7O2 2Fe2O3 + 4SO2 + Q
1、硫酸 (H2SO4)、硝酸 (HNO3)、盐酸 (HCl); 2、烧碱 (氢氧化钠,NaOH)、纯碱 (碳酸钠,
Na2CO3); 3、无机盐 (由金属离子或铵离子与酸根离子组
成的物质)
二、化 肥
1、氮肥(尿素、硝酸铵、氯化铵、硫 酸铵等);
第四版无机化学 章课后答案

第21章 p区金属思考题21-1如何制备无水AlCl3?能否用加热脱水的方法从AlCl3·6H2O中制取无水AlCl3?解:制备无水AlCl3,可采用干法,即用Al和Cl2在加热的条件下反应制得。
2Al + 3Cl2 === 2AlCl3也可在HCl气氛下,由AlCl3·6H2O加热脱水得到。
但不能直接由AlCl3·6H2O 加热脱水得到无水AlCl3,因为铝离子的强烈水解性,在加热过程中,发生水解,不能得到无水AlCl3。
21-2矾的特点是什么?哪些金属离子容易成矾?解:矾在组成上可分为两类:M I2SO4·M II SO4·6H2O(M I=K+、Rb+、Cs+和NH4+等,M II=Mg2+、Fe2+等);M I M III(SO4)2·12H2O(M I=Na+、K+、Rb+、Cs+和NH4+等,M II=Al3+、Fe3+、Cr3+、Co3+、Ga3+、V3+等),都为硫酸的复盐,形成复盐后,稳定性增强,在水中的溶解性减小。
21-3 若在SnCl2溶液中含有少量的Sn4+,如何除去它?若在SnCl4溶液中含有少量Sn2+,又如何除去?解:(1) SnCl2中含有少量的Sn4+,可加入锡粒将其除去。
发生的化学反应是:SnCl4+Sn === 2SnCl2(2) 在SnCl4中含有少量的Sn2+,可利用Sn2+的还原性,用H2O2将其氧化为Sn4+。
21-4比较Sb、Bi的硫化物和氧化物的性质,并联系第16章内容,总结归纳砷分族元素的氧化物及其水合物、硫化物的酸碱性、氧化还原性的递变规律。
解:砷分族元素的氧化物及其水合物的酸碱性和氧化还原性的递变规律与其对应的硫化物相似。
即:从上到下,酸性减弱,碱性增强;+V氧化值的氧化性从上到下增强,+III 氧化值的还原性从上到下减弱;同一元素+V氧化值的酸性比+III氧化值的强。
21-5 说明三氯化铝在气态及在水溶液中的存在形式。
(完整版)天津大学无机化学考试试卷(下册)及答案

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。
大学《无机化学》第四版-上册 习题答案

无机化学(第四版)答案第一章物质得结构1-1在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素得水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟就是单核素(19F)元素,而天然碳有两种稳定同位素(12C与13C),在质谱仪中,每一质量数得微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+得峰?1—3用质谱仪测得溴得两种天然同位素得相对原子质量与同位素丰度分别为79Br 789183占50、54%,81Br 80。
9163占49。
46%,求溴得相对原子质量(原子量)。
1-4 铊得天然同位素203Tl与205Tl得核素质量分别为202、97u与204、97u,已知铊得相对原子质量(原子量)为204。
39,求铊得同位素丰度。
1-5 等质量得银制成氯化银与碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银与氯得相对原子质量(原子量)分别为107。
868与35。
453,求碘得相对原子质量(原子量)、1-6表1-1中贝采里乌斯1826年测得得铂原子量与现代测定得铂得相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球得人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有得元素得相对质量(原子量)得有效数字得位数多达9位,而有得元素得相对原子质量(原子量)得有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应得产物只有氢,应怎样理解这个事实?1—10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”得物质,“元气生阴阳,阴阳生万物",请对比元素诞生说与这种古代哲学。
1—11 “金木水火土”就是中国古代得元素论,至今仍有许多人对它们得“相生相克”深信不疑。
与化学元素论相比,它出发点最致命得错误就是什么?1—12 请用计算机编一个小程序,按1、3式计算氢光谱各谱系得谱线得波长(本练习为开放式习题,并不需要所有学生都会做)。
无机化学第四版第五章思考题与习题

思考题1.“原子”为什么不像过去那样定义为组成的基本粒子?2.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?3.波函数与原子轨道有何关系?与电子云有何关系?4. .量子力学原子模型是如何描述核外电子运动状态的?解:用四个量子数:主量子数--------描述原子轨道的能级副量子数------ 描述原子轨道的形状角量子数-------描述原子轨道的伸张方向自旋量子数---------描述电子的自旋方向.5.下列各组量子数哪些是不合理的?为什么?n l m(1) 2 1 0(2) 2 2 -1(3) 3 0 +1解:(2),(3)不合理。
当n=2时,l只能是0,1,而(2)中的l =2,当l =0时,m只能是0,而(3)中的m却为+16. 为什么任何原子的最外层最多只能有8个电子,次外层最多只能有18个电子?7. 为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数(2n2)?因为存在能级交错现象8. 量子数n=3,l=1的原子轨道的符号是怎样的?该类原子轨道的形状如何?有几种空间取向?共有几个轨道?可容纳多少个电子?9. 在下列各组电子分布中哪种属于原子的基态?哪种属于原子的激发态?哪种纯属错误?(1) 1s22s1 (2)1s22s22d1(3)1s22s22p43s1 (4)1s22s42p2(1)属于原子的基态;(3)属于原子的激发态;(2),(4)纯属错误。
10.(1) 试写出s区,p区,d区及ds区元素的价层电子构型.(2) 具有下列价层电子构型的元素位于周期表中哪一个区?它们各是金属还是非金属?ns2 ns2np5 (n-1)d2ns2 (n-1)d10ns2解:(1)所在区价层电子构型s ns1-2p ns2np1-6d (n-1)d1-10ns1-2ds (n-1)d10ns1-2(2) 价层电子构型ns2 ns2np5 (n-1)d2ns2 (n-1)d10ns2所在区s p d ds金属或非金属 金属 非金属 金属 金属11. 已知某副元素的A 原子,电子最后填入3d,最高氧化数为+4,元素B 的原子,电子最后填入4p, 最高氧化数为+5.回答下列问题: (1) 写出A,B 元素原子的电子分布式;(2) 根据电子分布,指出它们周期表中的位置(周期,区,族). 解:(1)A :1s 22s 22p 63s 23p 63d 24s 2B: 1s 22s 22p 63s 23p 63d 104s 24p 3 (2) A: 四周期,d 区,IVB 族元素 B :四周期,p 区,V A 族元素12. 不参看周期表,试推测下列每一对原子中哪一个原子具有较高的第一电离能和较大的电负性值?(1) 19和29号元素原子 (2) 37和55号元素原子(3) 37和38号元素原子 解:(1) 电子分布式 周期 族 19 [Ar]4s 1 四 IA29 [Ar]3d 104s 1 四 IB故29号元素具有较高的第一电离能和较大的电负性; (2) 电子分布式 周期 族 37 [Kr]5s 1 五 IA 55 [Xe]6s 1 六 IA故37号元素具有较高的第一电离能和较大的电负性 (3) 电子分布式 周期 族 37 [Kr]5s1 五 IA 38 [Kr]5s2 五 IIA故38号元素具有较高的第一电离能和较大的电负性。
(完整版)天津大学无机化学考试试卷(上册)答案
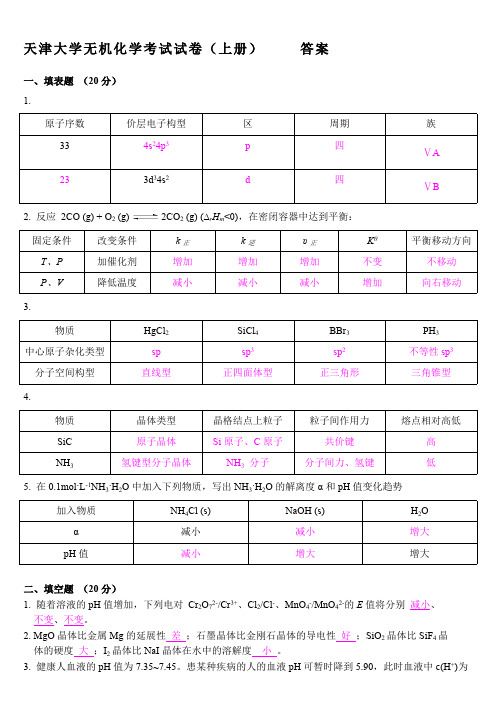
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族334s24p3p四ⅤA233d34s2d四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P加催化剂增加增加增加不变不移动P、V降低温度减小减小减小增加向右移动3.物质HgCl2SiCl4BBr3PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si原子、C原子共价键高NH3氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s)NaOH (s)H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为s o 正常状态的 28~35 倍。
4. 已知B 2轨道的能级顺序为σ1s σ*1s σ2s σ*2s π2py π2pz σ2px π*2py π*2pz σ*2px ,则B 2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。
(完整版)无机化学(天津大学版)

(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。
无机化学第四版下册16章习题答案

(3) 欲将一定质量的Ag 溶于最少量的硝酸,应使用何种浓度(浓或稀)的硝酸?
12、解:(1)HNO3分子中由于一个质子与NO3-相连,键长和键角也发生了变化,与H相连的N-O键较长,所以HNO3分子的对称性较低,不如NO3- 离子稳定,氧化性较强.
(2) Ca3(PO4)2 P4 PH3 H3PO4
(3) As2O3 Na3AsO4 Na3AsS4
20、解:
(1)NH4NO3N2+O2+H2O
N2+O2
2NO+O2=2NO2
NO+NO2+H2O=2HNO2
NO2+H2O=HNO3+NO
16-11 在同素异形体中,菱形硫和单斜硫有相似的化学性质,而 O2 与O3 ,黄磷与红磷的化学性质却有很大差异,试加以解释。
11、解:单斜硫和菱形硫都是由S8环状分子构成.而O2和O3,黄磷和白磷的构成分子不同,其性质当然不同.
16-12 回答下列有关硝酸的问题:
(1) 根据HNO3 的分子结构,说明HNO3 为什么不稳定?
(9) Hg2+2+PO43-
(10) Cu2O+PO43-
(11) Ag+AsO43-
(12) Zn2++AsO33-
16-23有一种无色气体 A ,能使热的CuO 还原,并逸出一种相当稳定的气体B ,将A 通过加热的金属钠能生成一种固体C ,并逸出一种可燃性气体D 。 A能与Cl2 分步反应,最后得到一种易爆的液体E 。指出A﹑B﹑C﹑D 和E 各为何物?并写出各过程的反应方程式。
16、解:两种情况下,反应的介质不同,从而电极电势不同,两者均满足,所以反应都能进行,并不矛盾.
天津大学智慧树知到“药学”《无机化学》网课测试题答案卷5

天津大学智慧树知到“药学”《无机化学》网课测试题答案(图片大小可自由调整)第1卷一.综合考核(共10题)1.下列电对中,若H⁺浓度增大,哪种电对的电极电势增大?()A.Cl₂/Cl⁻B.MnO⁴⁻/Mn²⁺C.Fe(OH)₃/Fe(OH)₂D.I₂/I⁻2.关于pz原子轨道角度分布图与电子云角度分布图,下列叙述中错误的是()。
A.前者有正、负,后者全为正(习惯上不标出)B.前者为"双球形",后者为"双纺锤"形C.前者"胖些",后者"瘦些"D.前者值小,后者值大3.分子间力的本质是()。
A.化学键B.电性作用C.磁性作用D.原子轨道重叠4.某副族元素的A原子,电子最后填入3d,最高氧化数为+4,该元素的原子序数为()。
A.22B.32C.40D.295.在一定标准下,CO₂(g)为下列哪个反应的值?()A.C(金刚石)+O₂(g)→CO₂(g)B.CO(g)+1/2O₂(g)→CO₂(g)C.C(石墨)+O₂(g)→CO₂(g) 6.某反应的速率方程式是,当A的浓度减少50%时,v降低至原来的1/4,当B的浓度增大至2倍时,v增大1.41倍,则x=2,y=0.7。
()A.正确B.错误7.下列分子或离子中,呈反磁性的是()。
A.B₂B.O₂C.N₂D.N₂⁻8.下列各组量子数中,不合理的一组是()。
A.n=2,l=1,m=0B.n=2,l=2,m=-1C.n=3,l=1,m=1D.n=3,l=2,m=09.下列各说法正确的是()。
A.质量作用定律适用于任何化学反应B.反应速率常数取决于反应温度,与反应物的浓度无关C.反应活化能越大,反应速率也越大D.要加热才能进行的反应一定是吸热反应10.下列反应式达到平衡时,,保持温度、压力不变,加入稀有气体He,使总体积增加一倍,则()。
A.平衡向左移动B.平衡向右移动C.平衡不发生移动D.条件不充足,不能判断第1卷参考答案一.综合考核1.参考答案:B2.参考答案:D3.参考答案:B4.参考答案:A5.参考答案:C6.参考答案:B7.参考答案:C8.参考答案:B9.参考答案:B10.参考答案:A。
天津大学无机化学考试试卷及答案

天津大学无机化学考试试卷〔下册〕答案一、是非题〔推断以下表达是否正确,正确的在括号中画√,错误的画X〕(每题 1 分,共 10 分) 1、( X )在周期表中,处于对角线位置的元素性质相像,这称为对角线规章。
2、( X )SnS 溶于Na S 溶液中,生成硫代亚锡酸钠。
2 23、( X )磁矩大的协作物,其稳定性强。
4、( X )氧族元素氢化物的沸点凹凸次序为H O>H S>H Se>H Te。
2 2 2 35、(√)[HgCl ]2-的K= 10-16,当溶液中c(Cl-)=·L-1 时,c(Hg2+)/c([HgCl ]2-)的比值为10-12。
4 46、( √)假设某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X )硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO -可以被 OH-复原为 MnO 2-。
4 49、(√)协作物 Na [Ag(S O ) ]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
3 2 3 210、(X )Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题〔在以下各题中,选择出符合题意的答案,将其代号填入括号内〕 (每题 1 分,共20 分) 1、在以下各种酸中氧化性最强的是............... ( B )。
(A)HClO ;(B)HClO;(C)HClO ;(D)HCl。
3 42、以下浓酸中,可以用来和KI(s)反响制取较纯 HI(g)的是...............( C )。
(A)浓HCl;(B)浓H SO ;(C)浓H PO ;(D)浓HNO 。
2 434 33、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D )。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是由于钛镍合金. ............... ( C )。
无机化学(第四版)(2019年高等教育出版社出版的图书)

教材目录
(注:目录排版顺序为从左列至右列)
教学资源
配套教材
课程资源
《无机化学(第四版)》有配套教学参考书——《无机化学习题解答(第四版)》。
《无机化学(第四版)》的数字课程是纸质教材的配套资源,为读者提供电子教案、书中插图、矿物标本图 片、实验视频等资源。
《无机化学(第四版)》配有慕课——无机化学原理、无机元素化学。 《无机化学(第四版)》各章章末“拓展学习资源”模块配有二维码资源。
该书共24章,分上、下两册出版。上册11章,讲述普通化学原理;下册13章,讲述元素化学中核心的内容。
成书过程
修订情况
出版工作
为适应新时代的变化,跟上时代前进的潮流,该书编委会于2018年8月在昆明召开了第四版的编写启动会。 与会编者听取并分析了高等教育出版社相关人员关于该书第三版使用情况的反馈,以及教材建设的趋势,决定该 次修订工作在保持前三版教材可读性、可讲授性和较完整资料性特色的前提下,完成进一步向新形态教材的转化, 同时根据学科进展,对部分内容进行更新。具体有以下几点:
徐家宁,吉林大学化学学院教授、博士生导师,中国国家理科基地吉林大学化学基地负责人,吉林大学国家 级化学实验教学示范中心主任。
张丽荣,吉林大学化学学院副教授、硕士生导师,从事无机-有机多孔材料的合成及结构、性质的研究工 作。
程功臻,武汉大学化学与分子科学学院教授,博士生导师,国家级教学名师,从事“无机化学”相关课程的 教学工作。
王莉,女,吉林大学化学学院副教授、硕士生导师,研究方向:金属有机骨架化合物的合成与发光性能研究、 三价金属有机骨架化合物的合成与催化性能研究。
感谢观看
参与该书第四版数字化资源建设的教师有:吉林大学宋天佑(第1、2、3和4章),南开大学程鹏(第5、6和 7章),吉林大学张丽荣(第8、9、10、11、13和18章),武汉大学程功臻(第12章),吉林大学徐家宁(第14、 15、16、17、21、22、23和24章),吉林大学王莉(第19和20章)。徐家宁负责选编物质与矿物图片,王莉负 责选编科学家简介等内容,吉林大学范勇和王莉负责摄制实验视频。
第四版无机化学22章课后答案

3Cu + 8HNO3 === 3Cu(NO3)2 + 2NO + 4H2O Cu(NO3)2 + 2NaOH === Cu(OH)2↓ + 2NaNO3
Cu(OH)2 △ CuO + H2O
22-8 解释下列实验事实: (1)铁能使 Cu2+还原,铜能使 Fe3+还原,这两件事实有无矛盾?并说明理由;
要有 Cu2+存在,Ni2+ 、Fe2+ 、Zn2+就不会在阴极沉积出来。
22-4 有一份硝酸铜和硝酸银的混合物,设计一个分离它们的方案。 解: 可根据 Cu(NO3)2、AgNO3 的热分解温度的不同进行分离。硝酸银的热分解温度 是 713K,而硝酸铜的热分解温度是 473K,可见将混合物加热至 473~573K 之间,此 时硝酸铜分解为黑色不溶于水的 CuO,而硝酸银不分解。将混合物中的硝酸银溶解后 过滤出 CuO,然后将滤液溶缩结晶得到纯的硝酸银。再将过滤出来的 CuO,用硝酸溶 解,然后溶缩结晶,得到硝酸铜纯品。
0.1 0.079 0.1 x
0.2 0.2+0.079×2
[Cu2+]= K sp (CuS )[H + ]2 = K sp (CuS ) × 0.3582 =2.4×10-14mol·L-1
天津大学无机化学教研室《无机化学》(第4版)配套题库名校考研真题+课后习题+章节题库+模拟试题下册

1.完成并配平反应方程式:硼砂(N2B4O7)溶液与稀硝酸混合[北京航 空航天大学2010研]
答:Na2B4O7 + 2HNO3(稀) + 5H2O=4H3BO3 + 2NaNO3
2.完成并配平反应方程式:在碱性条件下,红磷与次氯酸钠反应,生 成连二磷酸二氢根离子[中国科学技术大学2008研] 答: 3.完成并配平反应方程式:五氯化磷的氢解[中国科学技术大学2008研] 答:
目 录
第一部分 名校考研真题 第9章 氢、稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素和氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡金属(一) 第14章 过渡金属(二) 第15章 元素化学综述(自学为 主)
第16章 无机物合成 第17章 生态环境与无机化学 第二部分 课后习题 第9章 氢及稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素与氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡元素(一) 第14章 过渡元素(二) 第15章 元素化学综述(自学为
2.下面哪个说法是错误的( )。[首都师范大学2010研]
A.碳纳米管具有半导体性
B.碳纳米管具有金属导电性
C.金刚石具有半导体性
D.硅具有半导体性
【答案】B
【解析】碳纳米管具有导电性,是非金属导电性。
3.天然硅酸盐的结构复杂,其基本结构单元为( )。[首都师范大 学2010研] A.SiO2分子 B.SiO32平面三角形 C.SiO4四面体 D.Si2O76-共其用顶点的两个四面体 【答案】C 4.石墨、金刚石、碳纳米管皆为碳单质,其中在碳纳米管中碳原子的 杂化类型 ( )。[电子科技大学2010研] A.与石墨相同 B.与金刚石相同 C.部分与石墨相同部分与金刚石相同 D.与石墨金刚石皆不相同 E.无正确答案可选 【答案】A 【解析】在碳纳米管中,碳原子的杂化轨道类型与石墨相同,皆为sp2 杂化。
无机化学(第四版)课后答案

无机化学课后答案 第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1章化学反应中的质量关系和能量关系习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g。
3.解:一瓶氧气可用天数4.解:= 318 K℃5.解:根据道尔顿分压定律p(N2) = 7.6104 Pap(O2) = 2.0104 Pap(Ar) =1103 Pa6.解:(1)0.114mol;(2)(3)7.解:(1)p(H2) =95.43 kPa(2)m(H2) == 0.194 g8.解:(1) = 5.0 mol(2) = 2.5 mol结论: 反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:U = Qp pV = 0.771 kJ10.解:(1)V1 = 38.310-3 m3= 38.3L(2) T2 == 320 K(3)W = (pV) = 502 J(4) U = Q + W = -758 J(5) H = Qp = -1260 J11.解:NH3(g) +O2(g)NO(g) +H2O(g)= 226.2 kJ·mol112.解:= Qp = 89.5 kJ=nRT= 96.9 kJ13.解:(1)C (s) + O2 (g) → CO2 (g)=(CO2, g) = 393.509 kJ·mol1CO2(g) +C(s) → CO(g)= 86.229 kJ·mol1CO(g) +Fe2O3(s) →Fe(s) + CO2(g)= 8.3 kJ·mol1各反应之和= 315.6 kJ·mol1。
(2)总反应方程式为C(s) + O2(g) +Fe2O3(s) →CO2(g) +Fe(s)= 315.5 kJ·mol1由上看出:(1)与(2)计算结果基本相等。
所以可得出如下结论:反应的热效应只与反应的始、终态有关,而与反应的途径无关。
14.解:(3)=(2)×3-(1)×2=1266.47 kJ·mol115.解:(1)Qp === 4(Al2O3, s) -3(Fe3O4, s) =3347.6 kJ·mol1(2)Q = 4141 kJ·mol116.解:(1)=151.1 kJ·mol1(2)= 905.47 kJ·mol1(3)=71.7 kJ·mol117.解:=2(AgCl, s)+(H2O, l)(Ag2O, s)2(HCl, g)(AgCl, s) = 127.3 kJ·mol118.解:CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)=(CO2, g) + 2(H2O, l)(CH4, g)= 890.36 kJ·mo 1Qp = 3.69104kJ第2章化学反应的方向、速率和限度习题参考答案1.解:= 3347.6 kJ·mol1;= 216.64 J·mol1·K1;= 3283.0 kJ·mol1 < 0该反应在298.15K及标准态下可自发向右进行。
2.解:= 113.4 k J·mol1 > 0该反应在常温(298.15 K)、标准态下不能自发进行。
(2)= 146.0 kJ·mol1;= 110.45 J·mol1·K1;= 68.7 kJ·mol1 > 0该反应在700 K、标准态下不能自发进行。
3.解:= 70.81 kJ·mol1 ;= 43.2 J·mol1·K1;= 43.9 kJ·mol1(2)由以上计算可知:(298.15 K) = 70.81 kJ·mol1;(298.15 K) = 43.2 J·mol1·K1=T ·≤ 0T ≥= 1639 K4.解:(1)===(2)===(3)===(4)===5.解:设、基本上不随温度变化。
=T ·(298.15 K) = 233.60 kJ·mol1(298.15 K) = 243.03 kJ·mol1(298.15 K) = 40.92, 故(298.15 K) = 8.31040(373.15 K) = 34.02,故(373.15 K) = 1.010346.解:(1)=2(NH3, g) = 32.90 kJ·mol1 <0该反应在298.15 K、标准态下能自发进行。
(2)(298.15 K) = 5.76,(298.15 K) = 5.81057. 解:(1)(l) = 2(NO, g) = 173.1 kJ·mol1== 30.32, 故= 4.81031(2)(2) = 2(N2O, g) =208.4 kJ·mol1== 36.50, 故= 3.21037(3)(3) = 2(NH3, g) = 32.90 kJ·mol1= 5.76, 故= 5.8105由以上计算看出:选择合成氨固氮反应最好。
8.解:=(CO2, g)(CO, g)(NO, g)= 343.94 kJ·mol1< 0,所以该反应从理论上讲是可行的。
9.解:(298.15 K) =(NO, g) = 90.25 kJ·mol1(298.15 K) = 12.39 J·mol1·K1(1573.15K)≈(298.15 K) 1573.15(298.15 K)= 70759 J ·mol1(1573.15 K) = 2.349,(1573.15 K) = 4.4810310.解: H2(g) + I2(g)2HI(g)平衡分压/kPa 2905.74 χ 2905.74χ2χ= 55.3χ= 2290.12p (HI) = 2χkPa = 4580.24 kPan == 3.15 mol11.解:p (CO) = 1.01105 Pa, p (H2O) = 2.02105 Pap (CO2) = 1.01105 Pa, p (H2) = 0.34105 PaCO(g) + H2O(g) CO2(g) + H2(g)起始分压/105 Pa 1.01 2.02 1.01 0.34 J = 0.168,= 1>0.168 = J,故反应正向进行。
12.解:(1) NH4HS(s) NH3(g) + H2S(g)平衡分压/kPa== 0.070则= 0.26100 kPa = 26 kPa平衡时该气体混合物的总压为52 kPa(2)T不变,不变。
NH4HS(s) NH3(g) + H2S(g)平衡分压/kPa25.3+== 0.070= 17 kPa13.解:(1) PCl5(g) PCl3(g) + Cl2(g)平衡浓度/(mol·L1)== 0.62mol· L1,(PCl5) = 71%PCl5(g) PCl3(g) + Cl2(g)平衡分压 0.200.50.5== 27.2(2) PCl5(g) PCl3(g) +Cl2(g)新平衡浓度/(mol·L1) 0.10 +0.250.25 +=mol·L1 = 0.62mol· L1 (T不变,不变)=0.01 mol·L1,(PCl5) = 68%(3) PCl5(g) PCl3(g) + Cl2(g)平衡浓度/(mol·L1)0.050 +== 0.62 mol·L1= 0.24 mol·L1,(PCl5) = 68%比较(2)、(3)结果,说明最终浓度及转化率只与始、终态有关,与加入过程无关。
14.解: N2(g) + 3H2(g) 2NH3(g)平衡浓度/(mol·L1) 1.0 0.50 0.50==若使N2的平衡浓度增加到1.2mol· L1,设需从容器中取走摩尔的H2。
N2(g) + 3H2(g)2NH3(g)新平衡浓度/(mol·L1) 1.2 0.50+(30.2)0.5020.20===0.9415. 解:(1)α(CO)=61.5%;(2)α(CO)=86.5%; (3)说明增加反应物中某一物质浓度可提高另一物质的转化率;增加反应物浓度,平衡向生成物方向移动。
16.解: 2NO(g) + O2(g)2NO2(g)平衡分压/kPa 10179.2 = 21.8 286 79.2/2 =246 79.2(673K)== 5.36=,(673 K) = 9.39 kJ·mol117.解:(298.15 K) = 95278.54 J·mol1(298.15 K) =(298.15 K) 298.15 K·(298.15 K)(298.15 K) = 9.97 J·mol1·K1,(500 K) ≈97292 J·mol1(500 K) = 0.16,故=1.41010或者≈,(500 K) = 1.4101018.解:因(298.15 K) =(1) +(2) = 213.0 kJ·mol1 <0, 说明该耦合反应在上述条件可自发进行。
第3章酸碱反应和沉淀反应习题参考答案解:(1)pH=-lg c(H+)=12.00(2)0.050mol·L-1HOAc溶液中,HOAcH+ + OAc-c平/(mol·L-1) 0.050-x x xc(H+) = 9.5×10-4mol·L-1pH = -lg c(H+) = 3.022.解:(1)pH = 1.00 c(H+) = 0.10mol·L-1pH = 2.00 c(H+) = 0.010mol·L-1等体积混合后:c(H+) =(0.10mol·L-1+0.010mol·L-1)/2 = 0.055 mol·L-1pH = -lgc(H+) = 1.26(2)pH = 2.00 c(H+) = 0.010mol·L-1pH = 13.00 pOH = 14.00-13.00 = 1.00, c(OH-) = 0.10mol·L-1 等体积混合后:酸碱中和后:H+ + OH- → H2Oc(OH-) = 0.045mol·L-1pH =12.653.解:正常状态时pH = 7.35 c(H+) = 4.5×10-8mol·L-1pH = 7.45 c(H+) = 3.5×10-8mol·L-1患病时pH = 5.90 c(H+) = 1.2×10-6mol·L-1患此种疾病的人血液中c(H+)为正常状态的27~34倍。
