分析化学 (1)
分析化学试题1(含答案)

分析化学试题1(含答案)一、选择题(每小题 1 分,共20 分)】1.测得邻苯二甲酸pKa1=, pKa2=,则Ka1,Ka2值应表示为:( B )A. Ka1=1×10-3, Ka2=3×10-6;B. Ka1=×10-3, Ka2=×10-6 ;C. Ka1=×10-3, Ka2=×10-6;D. Ka1=1×10-3, Ka2=×10-6;…2.由计算器算得的结果为,按有效数字运算规则将结果修约为:( B ) A. ; B. ;C. ;D. ;3.测定中出现下列情况, 属于偶然误差的是:( B )!A. 滴定时所加试剂中含有微量的被测物质;B. 某分析人员几次读取同一滴定管的读数不能取得一致;C. 某分析人员读取滴定管读数时总是偏高或偏低;D.滴定管体积不准确;<4. 从精密度好就可断定分析结果可靠的前提是(B )A. 随机误差小;B. 系统误差小;C. 平均偏差小;D. 相对偏差小;!5.下列有关NaHCO3在水溶液中质子条件的叙述,哪个是正确的( C )A. [H+]+[HCO3-]+[Na+]=[OH-];B. [H+]+[Na+]=[OH-]+[CO32-];C. [H+]+[H2CO3]= [OH-]+[CO32-];D. [HCO3-]+[Na+]=[OH-]+[CO32-];—6.在EDTA配位滴定中,下列有关EDTA酸效应的叙述,何者是正确的(B )A. 酸效应系数愈大,配合物的稳定性愈高;B. 酸效应系数愈小,配合物稳定性愈高;)C. 反应的pH愈大,EDTA酸效应系数愈大;D. 选择配位滴定的指示剂与酸效应无关;7.当被滴定溶液中有M和N两种离子共存时,欲使EDTA滴定M而N不干扰,则在%的误差要求下滴定反应要符合: ( C )A. KMY/KNY104;B.KMY/KNY105;C.KMY/KNY106;D. KMY/KNY108;~8.在EDTA滴定中,下列有关掩蔽剂的应用陈述,哪一个是错误的(A )A. 当Al3+、Zn2+离子共存时,可用NH4F掩蔽Zn2+而测定Al3+;~B. 测定钙镁时,可用三乙醇胺掩蔽少量Fe3+、Al3+;C. 使用掩蔽剂时,要控制一定的酸度条件;D. Bi3+、Fe3+共存时,可用盐酸羟胺掩蔽Fe3+的干扰;{9.今有A,B相同浓度的Zn2+-EDTA溶液两份:A为pH = 10的NaOH溶液;B为pH=10的氨性缓冲溶液。
分析化学 (1)

1下列数据各包括两位有效数字的是( ),包括四位有效数字的是A.pH=2. 0; 8.7X10-6B. 0.50%; pH=4. 74C.114.0; 40. 02 %D. 0.003 00:1. 0522下列论述中不正确的是A. 偶然误差具有随机性B.偶然误差服从正态分布C.偶然误差具有单向D.偶然误差是由不确定的因素引起的3指出下列表述中错误的是( )A.置信度越高,测定的可靠性越高B.置信度越高,置信区间越宽C.置信区间的大小与测定次数的平方根成反比D.置信区间的位置取决于测定的平均值4下列()情况不属于系统误差(A)滴定管未经校正(B)所用试剂中含有干扰离子(C)天平两臂不等长(D)砝码读错5减小偶然误差的方法A.回收试验B.多次平均测定取平均值C.空白试验D.对照试验6根据有效数字运算规则,213.64+4.4+0.3244的计算结果应为()A.218.3 B.218. 4 C.218. 36 D.218.3647准确度与精密度之间的关系是A.准确度与精密度无关 B.消除系统误差后,精密度好,准确度才高 C.精密度高则准确度一定高 D.消除偶然误差后,精密度好,准确度才好8在下列情况下,引起偶然误差的是()A.砝码腐蚀 B.加错试剂 C.指示剂变色不敏锐 D.电流不稳9下列符号代表试剂的级别正确的是()A.GR:分析纯 B.AR:优级纯 C.CP:化学纯 D.LR:生物试剂10下列各项定义中不正确的是( )(A)绝对误差是测定值和真值之差B)相对误差是绝对误差在真值中所占的百分率(C)偏差是指测定值与平均值之差(D)总体平均值就是真值11如果要求分析结果达到0.1%的准确度,使用灵敏度为0.1mg的天平称取试样时,至少应称取A.0.1gB.0.2gC.0.05gD.0.5g12下列数据中有效数字为4位的是A.pH=10.04 B.6.532 C.0.0200 D.1.0×10313滴定管的读数误差为±0.02ml,滴定时用去标准溶液20.00ml,则相对误差是A.±0.001%B.±0.01%C.±0.1%D.±1.014用加热驱除水分法测定CaSO4·1/2H2O中结晶水的含量时,称取试样0.2000g,已知天平称量误差为±0.1mg,分析结果的有效数字应取A.一位B.四位C.两位D.三位15用千分之一分析天平称量物质的质量,结果应记录为()A.0.3g B.0.30g C.0.304g D.0.3040g16由于沉淀不完全造成的误差属于()A.偶然误差 B.操作误差 C.方法误差 D.仪器误差17鉴定物质的组成属于A.定性分析B.定量分析C.常量分析D.化学分析18在定量分析中,精密度与准确度之间的关系是A. 精密度高,准确度必然高B. 准确度高,精密度也就高C.精密度是保证准确度的前提D. 准确度是保证精密度的前提19定量分析中,精密度与准确度之间的关系是 ( )A.精密度高,准确度必然高B.准确度高,精密度也就高C.精密度是保证准确度的前提 D准确度是保证精密度的前提20下列不属于能减少测量中的系统误差的方法是A.空白试验B.对照试验C.校准仪器 D.多测几次21在标定盐酸浓度时,某同学的4次测定结果分别为0.1018mol/L,0.1017mol/L,0.1018mol/L,0.1019mol/L,而准确浓度为0.1036mol/L,该同学的测量结果为A.准确度较好,精密度较差B.准确度较好,精密度也好C.准确度较差,精密度较好D.准确度较差,精密度也较差下列关于偶然误差遵循的正太分布规律的描述正确的是()A.小误差出现的概率小 B.大误差出现的概率大C.绝对值相等的正负误差出现的概率基本相等 D.数值固定不变22下列哪项更能反映个别偏差较大的数据对测定结果重现性的影响A.相对误差 B.绝对偏差 C.平均偏差 D.标准偏差23 217.64+4.5+0.3234的计算结果有效数字应取()A.一位 B.两位 C.三位 D.四位24精密度表示方法不包括A.绝对偏差 B.相对误差 C.相对平均偏差 D.标准偏差25下列()情况不属于系统误差A.滴定管未经校正B.所用试剂中含有干扰离子C.天平两臂不等长D.砝码读错26若分析天平的称量误差为±0.1mg,用减重法称取试样0.1000g,则乘凉的相对误差为A.0.20%B.0.10%C.0.2%D.0.1%27精密度表示方法不包括A.绝对偏差B.相对误差C.相对平均偏差D.标准偏差28下列有关偶然误差的论述中不正确的是A.偶然误差具有随机性B.偶然误差具有单向性C.偶然误差在分析中是无法避免的D. 偶然误差的数值大小、正负出现的机会是均等29 2.0L溶液表示为毫升,正确的表示是()A.2000ml B.2000.0ml C.20×102ml D.2.0×103ml30 称取0.2g食盐试样,测得其中氯化钠的含量为0.1%,此分析过程属于A.微量分析和微量组分分析 B.常量分析和常量组分分析C.常量分析和微量组分分析 D.微量分析常量组分分析31 滴定分析是属于A.重量分析B.电化学分析C.化学分析D.光学分析32砝码被腐蚀引起的误差属于A.方法误差B.试剂误差C.仪器误差D.操作误差33在进行样品称量时,由于汽车经过天平室附近引起天平震动是属于()A.系统误差 B.偶然误差C.过失误差D.操作误差34在分析工作中要减小测定的偶然误差可采取方法(A)空白试验 (B) 对照试验 (C) 校准仪器 (D)多次平行试验36 2.0L溶液用毫升表示,正确的表示方法是A.2000mlB.2000.0mlC.2.0*103mlD.20*102ml37 按任务分类的分析方法是()A.无机分析与有机分析 B.常量分析与微量分析C.定性分析、定量分析和结构分析 D.化学分析与仪器分析38 有两组分析数据,要比较它们的精密度有无显著性差异,则应当用A. F检验B. t检验C. u检验D. Q检验39有效数字的运算规则是A.四舍六入五留双 B.四舍六入 C.四舍五入 D.四舍五入六留双40可用下法中哪种方法减小分析测定中的偶然误差?A.进行对照试验B.进行空白试验C.进行仪器校准D.增加平行试验的次数41 可用下列何种方法减免分析测试中的系统误差()A.进行仪器校正B.增加测定次数C.认真细心操作D.测定时保证环境的湿度一致42 下列是四位有效数字的是A.3.125B.3.10000C.pH=10.00D.3.125043 在半微量分析中对固体物质称量范围的要求是A.0.01-0.1克B.0.1-1克C.0.001-0.01克D.0.00001-0.0001克44对置信区间的正确理解是( )A.一定置信度下以真值为中心包括测定平均值的区间B.一定置信度下以测定平均值为中心包括真值的范围C.真值落在某一个可靠区间的概率D.一定置信度下以真值为中心的可靠范围45 某同学用Q检验法判断可疑值的取舍,以下步骤中错误的是A.将测量数据按大小顺序排列 B.计算出可疑值与邻近值之差C . 计算舍弃商Q计 D.查表得Q表,Q表≥Q计,舍弃可疑值46 试样用量为0.1 ~ 10 mg的分析称为A.常量分析B. 半微量分析C. 微量分析D. 痕量分析在进行样品\ 47称量时,由于汽车经过天平室附近引起天平震动是属于()(A)系统误差(B)偶然误差(C)过失误差(D)操作误差48.测定0.2mg样品中被测组分的含量,按取样量的范围属于A.常量分析B.半微量分析C.超微量分析D.微量分析49.用pH计测定溶液的酸度,属于A.定性分析B.滴定分析C.结构分析D.仪器分析50由滴定终点与计量点不吻合造成的误差属于A.偶然误差B.仪器误差C.操作误差D.方法误差51按被测组分含量来分,分析方法中常量组分分析指含量()A.<0.1%B.>0.1%C.<1%D.>1%52对定量分析结果的相对平均偏差的要求通常是A.Rd≤0.2%B.Rd≥0.2%C.Rd≥0.02%D. Rd≤0.02%53对某试样进行三次平行测定,得CaO平均含量为30.6%,而真实含54量为30.3%,则30. 6 % - 30. 3 % = 0.3%为A.绝对误差B.绝对偏差 c.相对误差 D.相对偏差55定量分析中,精密度和准确度的关系是A.精密度高准确度也一定高B.准确度高要求精密度一定高C.准确度是保证精密度的前提D.精密度是表示测定值和真实值的符合程度56有两组分析数据要比较他们的测量精密度有无显著性差异,应当用A.Q检验法B.t检验法C.F检验法D.w检验法57下列论述中错误的是A.方法误差属于系统误差B. 系统误差具有单向性C.系统误差又称可测误差D..系统误差呈正态分布58下列有关置信区间的定义,正确的是A.以真值为中心的某一区间包括测定结果的平均值的概率B.在一定置信度时,以测量值的平均值为中心包括总体平均值的59范围C.真值落在某一可靠区间的概率D.以测量值的平均值为中心的区间范围60按被测组分含量来分,分析方法中常量组分分析指含量()(A)<0.1%(B)>0.1%(C)<1%(D)>1%61.增加重复测定次数,取其平均值作为测定结果,可以减少()A.系统误差 B.仪器误差 C.方法误差 D.偶然误差62当置信度为95%时测得Al2O3的μ的置信区间为(35.21±0.10)%其意义是A. 在所有测定的数据中有95%在此区间内B. 若再进行测定,将有95%的数据落在此区间内C. 总体平均值μ落入此区间的概率为0.95D.无法确定63试样的采取原则应具有A. 典型性B. 代表性C. 统一性D. 不均匀性64如果待测组分的实际组成不确定,则最好用哪种形式的含量来表示分析结果()A.氧化物 B.元素 C.分子式 D.氧化物或元素65某同学用Q检验法判断可疑值的取舍,以下步骤中错误的是()A.将测量数据按大小顺序排列 B.计算出可疑值与邻近值之差C.计算舍弃商Q计 D.查表得Q表,Q表≥Q计舍弃可疑值66测定0.1mg样品中被测组分的含量,按取样量的范围是A.常量分析 B.半微量分析 C.超微量分析 D.微量分析67NaOH溶液的浓度为0.2040mol/L,它的有效数字为A.一位 B.两位 C.三位 D.四位68偶然误差具有()A.可测性B.重复性C.非单向性D.可校正性69以下各项措施中可以减小偶然误差的是A.进行仪器校正B.作对照实验C.增加平行测定次数D.作空白实验70在定量分析中,对误差的要求是A.越小越好B.在允许的误差范围内C.等于零D.接近于零71用有效数字规则对下式进行计算0.0213+13.56+5.37469的运算结果应该取几位有效数字A.1位 B.2位 C .3位 D.4位72用20毫升移液管移出的液体体积应记录为A.20mlB.20.0mlC.20.00mlD.20.000ml73定量分析的一般程序中,哪一步必须具有代表性()A.制定计划 B.科学取样 C.处理试样 D.分析测定74由于指示剂选择不当造成的误差属于A.偶然误差 B.方法误差 C.操作误差 D.仪器误差75下列哪项不能有效消除系统误差()A.对照试验 B.空白实验 C.校准仪器 D.增加平行测定的次数76不加试样,按测定试样中待测组分的方法和步骤进行的试验称为()A.空白试验 B.对照试验 C.回归试验 D.平行试验简答题,分值3.0分。
分析化学 (1)

分析化学1. 48.酸碱滴定中需要用溶液润洗的器皿是 [单选题] * A)锥形瓶B)移液管C)滴定管D)以上B和C(正确答案)E)烧杯2. 49.下列属于两性溶剂的是 [单选题] *A)乙二胺B).乙醇(正确答案)(C)丁胺乙酸D.乙酸E)乙醛3. 50.下列属于惰性溶剤的是 [单选题] *( A)乙二肢B)乙醇C)苯(正确答案)D)乙酸E)乙挙4. 17.下列属于緘性溶剤的是 [单选题] *A)乙二按(正确答案)B)乙醇C)笨D乙酸E)乙醛5. 18.下列属于酸性溶剤是 [单选题] *A乙二按B)乙醇C)苯(D)乙酸(正确答案)E)乙至6. 19.能作高氣酸、硫酸、益酸、硝酸区分性溶剤的是 [单选题] *(A乙二按B)乙醇C)苯D)冰醋酸(正确答案)E)丙胴7. 20.能作高氣酸、硫酸、益酸、硝酸均化溶剤的是 [单选题] *A)甲酸B)乙醇C)苯D)水(正确答案)E)乙醛8. 21.下列物质若作溶剂,其中使滴定突跃范围改变最大的是 [单选题] * ( A)乙醇(Ksp=7.9x10 -20)B)冰醋酸(Ksp=3.6x10-15)C)甲酸(Ksp = 6x10-7)D )乙睛(Ksp= 3x10-27)(正确答案)E)以上都不对9. 22.在非水溶液酸碱滴定中既能增强样品的溶解性又能增大滴定突跃的溶剂是 [单选题] *A)混合溶剂B)两性溶剂(正确答案)C)惰性溶剂D)质子性溶剂E)非质子性溶剂.10. 24.若要测定B不同强度混合酸的总量应利用 [单选题] *A)均化效应.(正确答案)B)盐效应C)区分效应D)同离子效应E)以上都不对11. 25.若要测定混合酸中各组份的含量应选择下列哪种方法 [单选题] *A)均化效应B)盐效应.C)区分效应(正确答案)D)同离子效应E)以上都是12. 26.除去冰醋酸中少量的水,常用的方法是 [单选题] *A)加热B)加干燥剂C)蒸馏D)加入醋酐(正确答案)E)萃取13. 28.配制高氯酸滴定液时醋酐的加入量不能过多其原因是 [单选题] *A)增强高氯酸的酸性B)除去高氯酸中的水C)增大滴定突跃D)避免发生乙酰化反应(正确答案)E)以上都不是14. 29.用非水溶液酸碱滴定法测定乳酸钠,应选用的溶剂为 [单选题] *A)乙二胺B)乙醇C)苯D)冰醋酸(正确答案)E)丙酮15. 30.下列酸在冰醋酸中酸性最强的是 [单选题] *A)高氯酸.(正确答案)B)次氯酸C)硫酸D)盐酸E)硝酸16. 31.在下列哪种溶剂中苯甲酸、醋酸、硝酸的酸性相似 [单选题] *(A)乙二胺(正确答案)B)乙醇C)苯D)盐酸E)碳酸17. 32.高氯酸冰醋酸滴定液在测定样品时和标定时的温度若有差别,则应重新标定或将浓度重新校正,其原因为 [单选题] *A)高氯酸具有挥发性B )冰醋酸具有挥发性C)样品具有挥发性D)冰醋酸的体膨胀系数较大(正确答案)E)以上都不对18. 33.用邻苯= -甲酸氢钾作为标定高氯酸的基准物,根据非水滴定的特点在标定前估算邻苯二甲酸氢钾的称量范围,是以消耗高氯酸的体积多少作为依据 [单选题] * A) 20~25mI(正确答案)B10~ 25mlC)8~ 10m1D)5~I0mlE ) 10~15ml19. 34.已知某二酸其(K1/K2)= 103,若用非水滴定分别测定各级酸的含量,应选用的溶剂是 [单选题] *(A)乙醇(正确答案)B)甲基异丁酮C)液氨D)水E)乙醛20. 37.对于酸碱指示剂下列哪种说法是不恰当的 [单选题] *A)指示剂本身是一种有机弱.酸B)指示剂本身是一种有机弱碱C)指示剂的颜色变化与溶液的pH有关D)指示剂的变色与其KHIn有关E)指示剂的变色范围必须全部落在突跃范围内(正确答案)21. 40.下列哪一-种酸不能用NaOH滴定液直接滴定 [单选题] *A) HCOOH(Ka=1.77x10-4)B)H3BO3(Ka=7.3x10-10)(正确答案)C)H2C4O4(Ka1=6.4x10-5,Ka2=2.7x10-6)( D )苯甲酸(Ka=6.46x10-5)( E)以上A和C都不可以22. 43.用HCI滴定硼砂溶液其计量点时的pH =5.0,若要使终点误差最小,应选用的指示剂是 [单选题] *A)甲基橙B)甲基红(正确答案)C)酚酞(D)百里酚酞E)以上A和D都可以23. 47.下列关于指示剂的论述错误的是 [单选题] *A)指示剂的变色范围越窄越好B)指示剂的用量应适当(C)只能用混合指示剂(正确答案)D)指示剂的变色范围应恰好在突跃范围内(E)以上都是错误的24. 49.滴定分析中需要用待装溶液润洗的量器是 [单选题] *A)锥形瓶(B容量瓶C)滴定管(正确答案)D)量筒E)以上A和C都可以25. 50.用NaOH(0.1000mol/L)测定苯甲酸0.2500g,需NaOH滴定液多少毫升?(M=122g/mol) [单选题] *( A ) 19.98mlB)20.50m|C)21.50m|D)30.20mlE ) 20.0ml(正确答案)26. 51.用双指示剂法测定可能含有NaOH、Na2C03、NaHCO3或它们的混合物,若用盐酸滴定液滴定至酚酞变色时消耗盐酸滴定液的体积为V1ml,滴定至甲基橙变色时消耗盐酸滴定液的体积为V2ml,已知V1=V2,试判断物质的组成 [单选题] *A)NaOHB)Na2CO3(正确答案)( C ) NaOH+ Na2CO3D)Na2CO3 + NaHCO3 (E) NaOH+ NaHCO327. 54.下列物质若作溶剂,其中可使滴定突跃范围改变最大的是 [单选题] *A )乙醇(Ks=7.9x10-20B )乙腈(Ks=3x10-27)(正确答案)C)甲酸(Ks=6x10-7)D乙二胺(Ks=5x10-16)E )以上都不对28. 59.当HCI溶于液氨时溶液中最强酸是 [单选题] *A) H3O+B)HCIC)NH3D)N H4+(正确答案)( E)以上A和D29. 60.工业氨基Z酸含量的测定可采用冰乙酸作溶剂,以HCIO4标准滴定溶液进行非水滴定。
分析化学参考答案(1)

选择题1. 下列表述正确的是(D )。
A 因仪器不够精确造成的误差属偶然误差;B 因分析方法本身不够完善造成的误差属偶然误差;C 因试剂不纯造成的误差属偶然误差;D 偶然误差是由不确定因素造成的,与仪器、分析方法、试剂均无关。
2. 减少随机误差常用的方法是( D )。
A 空白实验B 对照实验C 校准仪器D 多次平行实验3. 称取1.0000g CuSO4·5H2O试样,溶解后定容成100mL溶液,吸取20.00 mL 试样溶液用碘量法测其Cu的含量,此测定属于( A )。
A 常量分析B 半微量分析C 微量分析D 超微量分析4. 已知:4.178×0.0037÷0.04=0.386465 ,按有效数字运算规则,正确的答案应该是( D )。
A 0.3865B 0.386C 0.39D 0.45. 消除或减少试剂中微量杂质引起的误差,常用的方法是(A )。
A 空白实验B 对照实验C 平行实验D 校准仪器6.测定结果的精密度很高,说明( C )。
A 系统误差大B 系统误差小C 随机误差小D 随机误差大7. 下列说法中,正确的是( B )。
A 只要多做几次平行测定,就可以避免随机误差对测定结果的影响B 测定结果精密度高,准确度不一定高C 做平行测定的目的是减小系统误差对测定结果的影响D 由于随机误差符合统计规律,所以在实验中可以完全清除随机误差8. 按有效数字运算规则,0.387×4.000÷0.60等于(B )。
A 3B 2.6C 2.58D 2.5809. 下列说法中,不正确的是( A )。
A 测定结果准确度高,精密度不一定高。
B 测定结果精密度高,准确度不一定高。
C 做平行测定的目的是减小随机误差对测定结果的影响。
D 准确度与随机误差和系统误差都有关。
10. 若无仪器和试剂误差,从( B )的结果一般可判断是否存在方法误差。
A:空白试验B:对照试验C:平行试验D:校准仪器11.某人用EDTA直接滴定法测出铁矿石中铁的质量分数,由计数器算得结果为35.628195%,你认为此时应取几位有效数字( C )A:3 B:5 C:4 D:212. 分析某样品得到四个分析数据,为了衡量其精密度优劣,可用(C )评价。
分析化学课件(1)
其他学科相互渗透、相互交叉、有机融合;在分析
技术上趋于各种技术扬长避短、相互联用、优化组
合;在分析手段上更趋向灵敏、快速、准确、简便
和自动化。
28
第二章
误差及分析数据的处理
最可靠的分析方法
最精密的仪器
熟练的操作人员
不能得到绝对准确的结果 误差是客观存在的
误差产生的原因及出现规律,减小误差 第二章内容
子、化合物等)
有机分析
结构)
生化分析
析、氨基酸分析、核酸分析、糖类分析等)
22
分析化学的分类-3
根据应用领域分类
药物分析 Pharmacological analysis
水质分析 Water analysis 食品分析 Food analysis 工业分析 Industrial analysis 刑侦分析 Forensic analysis
离不开分析化学。分析化学不但为它们提供了
物质的组成,而且还提供了精细的结构与功能
之间的关系,探索了现象的本质。
19
五、分析化学的分类-1
根据任务分类: 定性分析 Qualitative analysis 物质的组成 定量分析 Quantitative analysis 成分的含量 结构分析 Structure analysis 物质的结构 分子结构,晶体结构,分子聚集体的高级结构 蛋白质的构象(-螺旋、型结构,球状蛋白的 三级结构)Conformation analysis DNA测序(DNA Sequencing) 形态分析 Speices analysis 物质的形态 能态分析 Energy-state analysis 物质的能态
分析化学复习题(1)

βn=
(自己写!)
(4)写出下列物质在水溶液中的质子表达式 P93 NH4CN 选 NH4+,CN-,H2O 为零基准 [H3O+]+[HCN]=[OH-]+[NH3]
(5)葡萄糖酸钙的含量测定如下:城区葡萄糖酸钙试样 0.5500g,滴定用去 0.04985mol/L EDTA 溶液 24.50ml,试计算葡萄糖酸钙的含量 (M 葡萄糖酸钙=448.4g/mol)
答:因 EDTA 与葡萄糖酸钙反应的化学计量比为 1:1 所以 n(EDTA)=n(葡萄糖酸钙)=C(EDTA)·V(EDTA)=0.00122mol M(葡萄糖酸钙)=n·M=0.54764g 葡萄糖酸钙的含量=0.54764/0.55g*100%=99.571%
(6)简述用 AgNO2 标准溶液直接滴定 Cl(- 或 Br-)时,铬酸钾指示剂(K2CrO4) 法的原理。 答:滴定反应:Ag+ + Cl- → AgCl↓ 指示终点反应:2Ag + CrO42- → AgCrO4↓ 由于 AgCl 的溶解度小于 Ag2CrO4,因此根据分步沉淀的原理,首先 发生滴定反应析出 AgCl 沉淀,待 Cl-被定量沉淀侯,稍过量的 Ag+ 就会与 CrO42-反应,产生转红色的 Ag2CrO4 沉淀二指示滴定终点。
(3)什么是络合稳定常数、离解稳定常数?它们之间的关系是什么? 答:稳定常数是一定温度时金属离子与 EDTA 络合物的形成常数,以 KMY 表示,KMY=[MY]/ ([M][Y]) 离解常数是水溶液中具有一定离解度的溶质的极性参数 K 离=([M][Y])/[MY] K 离=1/KMY 累计稳定常数β表示络合物与配体之间的关系
(4) HCl,H2SO4,HNO3 及 HClO4 的区分性溶剂分别是( ) A. 水 B. 乙醇 C. 冰醋酸 D. 液氮
分析化学(一)计算3-2

1100;79.2%
2)
1200;78.2%
3)
1000;77正确答案:4
《分析化学Ⅰ》《分析化学Ⅰ》P051第3-2次计算(121)
单选题(分数:15分)
1、安络血的摩尔质量为236,将其配成每100ml含0.4962mg的溶液,盛于1cm吸收池中,在 max为355nm处测得A值为0.557,试求安络血的E1cm1%和 值。(单选题5分)
1)
1100;2.65×104
1)
98.4%
2)
96.4%
3)
97.4%
4)
99.4%
此题正确答案:1
3、精密称取0.0500g样品,置于250ml容量瓶中,加入0.02 mol/L HCl溶解,稀释至刻度。准确吸取2ml,稀释100ml。以0.02 mol/L HCl为空白,在263nm处用1.0cm吸收池测得透光率为41.7%,其 为12000,被测物摩尔质量为100.0,试计算263nm处的E1cm1%和样品的百分含量。(单选题5分)
2)
1123;2.65×104
3)
1123;2.12×104
4)
1123;1.65×104
此题正确答案:2
2、称取维生素C0.05g,溶于100ml的0.005mol/L的硫酸溶液中,再量取此溶液2.0ml稀释至100ml,取此溶液于1cm吸收池中,在 max245nm处测得A值为0.551,求样品中维生素C的百分含量(E1cm1%245nm=560)?(单选题5分)
分析化学(一)试卷

分析化学(一)试卷1. 测得值与真实值之间的差值为() [单选题] *A. 绝对误差(正确答案)B. 相对误差C. 绝对偏差D. 相对偏差2. 下列术语不能表示精密度的是() [单选题] *A. 平均偏差B. 相对平均偏差C. 相对误差(正确答案)D. 相对偏差3. 比较两组测定结果的精密度()甲组:0.19%,0.19%,0.20%,0.21%,0.21%乙组:0.18%,0.20%,0.20%,0.21%,0.22% [单选题] *A. 甲、乙两组相同B. 甲组比乙组高(正确答案)C. 乙组比甲组高D. 无法判别4. 定量分析工作要求测定结果的误差() [单选题] *A. 越小越好B. 等于零C. 在允许误差范围之内(正确答案)D. 略大于允许误差5. 终点误差的产生是由于() [单选题] *A. 滴定终点与化学计量点不符(正确答案)B. 滴定反应不完全C. 试样不够纯净D. 滴定管读数不准确6. 下列不正确的叙述是() [单选题] *A. 系统误差是可以测定的B. 随机误差是偶然发生的C. 方法误差属于系统误差D. 随机误差给分析结果带来的影响是一定的(正确答案)7. 下列各措施可减小偶然误差的是() [单选题] *A. 校准砝码B. 进行空白试验C. 增加平行测定次数(正确答案)D. 进行对照试验8. 测定过程中出现下列情况,导致系统误差的是() [单选题] *A. 砝码未经校正(正确答案)B. 滴定管的读数读错C. 实验温度突然发生变化D. 容量瓶定容时有溶液溅出9. 下列数据中不是三位有效数字的有() [单选题] *A. 61.5B. 0.203C. 7.90D. 15×104(正确答案)10. 下列数据均保留两位有效数字,修约结果错误的是() [单选题] *A. 1.25修约为1.3(正确答案)B.1.35修约为1.4C. 1.454修约为1.5D. 1.6456修约为1.611. 0.0234×4.303×71.07÷127.5的计算结果是() [单选题] *A. 0.055891B. 0.056C. 0.05589D. 0.0559(正确答案)12. 算式(30.582-7.44)+(1.6-0.5263)中,绝对误差最大的数据是() [单选题] *A. 30.582B. 7.44C. 1.6(正确答案)D. 0.526313. 分析工作中实际能够测量到的数字称为() [单选题] *A. 精密数字B. 准确数字C. 可靠数字D. 有效数字(正确答案)14. 某标准滴定溶液的浓度为0.5010 mol/L,它的有效数字是() [单选题] *A. 5位B. 4位(正确答案)C. 3位D. 2位15. 测定某铁矿石中硫的含量,称取样品0.2952g,下列分析结果合理的是() [单选题] *A. 32%B. 32.4%C. 32.42%(正确答案)D. 32.420%16. 由于天平不等臂造成的误差属于() [单选题] *A. 方法误差B. 试剂误差C. 仪器误差(正确答案)D. 操作误差17. 下列数据中,“0”不是有效数字的是() [单选题] *A. 0.86(正确答案)B. 3.402C. 6.00D. 9.8018. 标定NaOH时,平行三次实验,测得其浓度(mol/L)分别为0.1010、0.1012、0.1011,则测定结果的相对平均偏差为() [单选题] *A. 0.0007%B. 0.007%C. 0.07%(正确答案)D. 0.7%19. 检验方法是否可靠的办法() [单选题] *A. 校正仪器B. 加标回收率(正确答案)C. 增加测定的次数D. 空白试验20. 使用分析天平用差减法进行称量时,为使称量的相对误差在0.1%以内,试样质量应() [单选题] *A. 在0.2g以上(正确答案)B. 在0.2g以下C. 在0.1g以上D. 在0.4g以上1. 器皿不洁净,溅失试液,读数或记录差错都可造成偶然误差。
南师期末分析化学试卷1(含答案)

1.将0.089gMg 2P 2O 7沉淀换算为MgO 的质量,计算下列换算因数(2M (MgO )/M (Mg 2P 2O 7))时应取 ( )A .0.3423B .0.342C .0.34D .0.32.从误差的正态分布曲线表明:标准偏差在±2σ外的分析结果,占全部分析结果的( )A .69.3%B .95.5%C .99.7%D .4.5%3.欲配制250mL 0.008000 mol/LK 2Cr 2O 7溶液,应称取K 2Cr 2O 7 (M (K 2CrO 7)=294.2g/mol) ( )A .0.5884gB .0.5gC .0.6gD .2.3536g4.以NaOH 滴定H 3PO 4(K a1=7.6×10-3;K a2=6.3×10-8;K a3=4.4×10-13)至生成Na 2HPO 4时溶液的pH 为( )A .10.7B .9.8C .8.7D .7.75.用0.1mol/LNaOH 滴定0.1mol/LHCOOH (p K a =3.74)。
对此滴定适用的指示剂是( )A .酚酞(p K a =9.1)B .中性红(p K a =7.4)C .甲基橙(p K a =3.4)D .溴酚蓝(p K a =4.1)200 年 月江苏省高等教育自学考试284634201定量分析化学(一)一、单项选择题(每小题 1 分,共 20分)在下列每小题的四个备选答案中选出一个正确的答案,并将其字母标号填入题干的括号内。
6.用0.1mol/LHCl滴定0.1mol/LNaOH时的突跃范围是9.7~4.3。
用0.01mol/LHCl 滴定0.1mol/LNaOH时的pH突跃范围是( )A.9.7~4.3 B.8.7~4.3C.9.7~5.3 D.8.7~5.37.某碱样为NaOH和Na2CO3的混合液,用HCl标准溶液滴定。
先以酚酞为指示剂,耗去HCl溶液体积为V1,继以甲基橙为指示剂,又耗去HCl溶液体积为V2。
分析化学教材(系列一)Word版
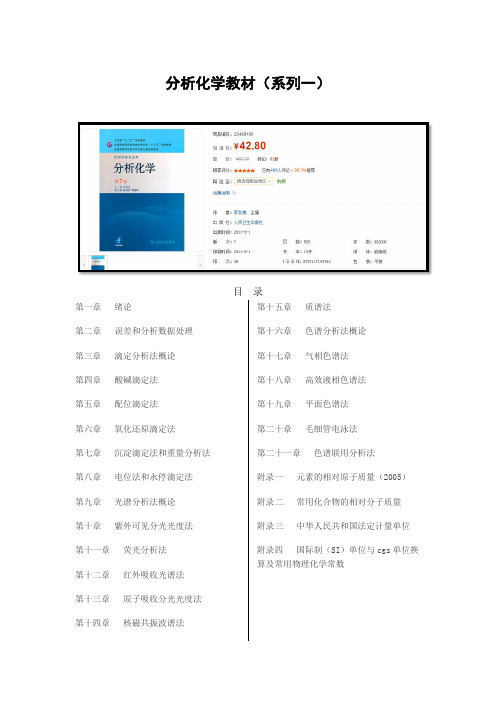
分析化学教材(系列一)目 录第一章 绪论第二章 误差和分析数据处理 第三章 滴定分析法概论 第四章 酸碱滴定法 第五章 配位滴定法 第六章 氧化还原滴定法 第七章 沉淀滴定法和重量分析法 第八章 电位法和永停滴定法 第九章 光谱分析法概论 第十章 紫外可见分光光度法 第十一章 荧光分析法 第十二章 红外吸收光谱法 第十三章 原子吸收分光光度法第十四章核磁共振波谱法第十五章 质谱法 第十六章 色谱分析法概论 第十七章 气相色谱法 第十八章 高效液相色谱法 第十九章 平面色谱法 第二十章 毛细管电泳法 第二十一章 色谱联用分析法 附录一 元素的相对原子质量(2005) 附录二 常用化合物的相对分子质量 附录三 中华人民共和国法定计量单位 附录四 国际制(SI )单位与cgs 单位换算及常用物理化学常数附录五常用酸、碱在水中的离解常数(25℃)附录六配位滴定有关常数附录七常用电极电位附录八难溶化合物的溶度积常数(25℃,I=0)附录九标准缓冲溶液的pH(0—95℃)附录十主要基团的红外特征吸收峰附录十一质子化学位移表附录十二质谱中常见的中性碎片与碎片离子附录十三气相色谱法用表参考文献英文索引中文索引目录第三版前言第二版前言第一版前言第1章绪论第2章误差和分析数据处理第3章重量分析法第4章滴定分析法概论第5章酸碱滴定法第6章络合滴定法第7章沉淀滴定法第8章氧化还原滴定法第9章取样与样品预处理方法附录附录Ⅰ中华人民共和国法定计量单位附录Ⅱ分析化学中常用的物理化学常数及物理量附录Ⅲ国际相对原子质量表附录Ⅳ常用相对分子质量表附录Ⅴ酸、碱在水中的离解常数附录Ⅵ常用标准缓冲溶液的pH(0~60℃)附录Ⅶ络合滴定有关常数附录Ⅷ标准电极电位及条件电位表附录Ⅸ难溶化合物的溶度积(Ksp) 符号表第1章概论1.1 定量分析概述1.1.1 分析化学的任务和作用1.1.2 定量分析过程1.1.3 定量分析方法1.2 滴定分析法概述1.2.1 滴定分析法对反应的要求和滴定方式1.2.2 基准物质和标准溶液1.2.3 滴定分析中的体积测量1.2.4 滴定分析的计算思考题习题第2章误差与分析数据处理2.1 有关误差的一些基本概念2.1.1 误差的表征——准确度与精密度2.1.2 误差的表示——误差与偏差2.1.3 误差的分类——系统误差与随机误差2.2 随机误差的分布2.2.1 频率分布2.2.2 正态分布2.2.3 随机误差的区间概率2.3 有限数据的统计处理2.3.1 数据的集中趋势和分散程度的表示——对μ和σ2.3.2 总体均值的置信区间——对μ的区别间估计2.3.3 显著性检验2.3.4 异常值的检验2.4 测定方法的选择与测定准确度的提高2.5 有效数字思考题习题第3章酸碱平衡与酸碱滴定法3.1 酸碱反应3.1.2 酸碱反应的平衡常数3.1.3 活度与浓度,平衡常数的几种形式3.2 酸度对弱酸(碱)形态分布的影响3.2.1 一元弱酸溶液中各种形态的分布3.2.2 多元酸溶液中各种形态的分布3.2.3 浓度对数图3.3 酸碱溶液的H+浓度计算3.3.1 水溶液中酸碱平衡处理的方法3.3.2 一元弱酸(碱)溶液pH的计算3.3.3 两性物质溶液pH的计算3.3.4 多元弱酸溶液pH的计算3.3.5 一元弱酸及其共轭碱(HA+A)混合溶液pH的计算3.3.6 强酸(碱)溶液pH的计算3.3.7 混合酸和混合碱溶液pH的计算3.4 酸碱缓冲溶液3.4.1 缓冲容量和缓冲范围3.4.2 缓冲溶液的选择3.4.3 标准缓冲溶液3.5 酸碱指示剂3.5.1 酸碱指示剂的作用原理3.5.2 影响指示剂变色间隔的因素3.5.3 混合指示剂3.6 酸碱滴定曲线和指示剂的选择3.6.1 强碱滴定强酸或强酸滴定强碱3.6.2 一元弱酸(碱)的滴定3.6.3 滴定一元弱(弱碱)及其与强酸(强碱)混合物的总结3.6.4 多元酸和多元碱的滴定3.7 终点误差3.7.1 代数法计算终点误差图及其应用3.7.2 终点误差公式和终点误差图及其应用3.8 酸碱滴定法的应用3.8.1 酸碱标准溶液的配制与标定……第4章络合滴定法第5章氧化还原滴定法第6章沉淀重量与沉淀滴定法第7章分光光度法第8章分析化学中常用的分离方法第9章其他常用仪器分析方法附录目录编写说明第1章绪论第1节分析化学的任务与作用第2节分析化学方法的分类第3节试样分析的基本程序第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节误差第2节测量值的准确度和精密度第3节有效数字及其运算法则第4节分析数据的统计处理与分析结果的表示方法第5节相关与回归思考与练习第3章重量分析法第1节挥发法第2节萃取法第3节沉淀法思考与练习第4章滴定分析法概论第1节滴定反应类型与滴定方式第2节基准物质与标准溶液第3节滴定分析的计算思考与练习第5章酸碱滴定法第1节水溶液中的酸碱平衡第2节基本原理第3节滴定终点误差第4节应用与示例第5节非水滴定法思考与练习第6章沉淀滴定法第1节基本原理第2节应用与示例思考与练习第7章配位滴定法第1节配位平衡第2节基本原理第3节滴定条件的选择第4节应用与示例思考与练习第8章氧化还原滴定法第9章电位法和永停滴定法参考资料附录目录符号缩写或简称第一篇概述第1章分析化学的目的及其对社会的重要性1.1 分析化学的目的:对社会的基本重要性1.2 分析化学的目的:作为问题解决者的分析化学家1.3 非常规实验实应用分析化学的目的参考文献第2章分析过程2.1 概述2.2 全分析过程2.3 工作特性2.4 分析化学中的误差参考文献第3章质量保证和质量控制3.1 分析化学的质量和目标3.2 分析方法3.3 如何保证准确度3.4 质是保证和质是控制受规章限制的方面3.5 结论参考文献第二篇化学分析第4章化学分析的基本原理第5章色谱法第6章动力学与催化第7章化学分析的方法及其应用第三篇物理分析第8章元素分析第9章化合物和分子特效分析第10章微束流和表面分析第11章结构分析第四篇基于计算机的分析化学(COBAC)第12章化学计理学第13章计算机软硬件及分析仪器接口第五篇全分析系统第14章联用技术第15章微分析系统第16章过程分析化学VI. 附录汉英索引英汉索引目录总序出版说明第二版前言第一版前言符号表绪论0.1 分析化学的任务与作用0.2 分析方法的分类0.3 发展中的分析化学1 分析质量保证1.1 分析化学中关于误差的一些基本概念 1.2 有效数字及其运算规则1.3 分析数据的统计处理1.4 提高分析结果准确度的方法小结习题分析化学前沿领域简介——化学计量学2 化学分析法2.1 滴定分析概述2.2 滴定分析的基本理论2.3 确定滴定终点的方法2.4 滴定条件选择2.5 滴定分析的应用2.6 重理分析法小结习题化学大师Liebig3 分离分析方法3.1 分析试样的制备和分解3.2 沉淀分离法3.3 溶齐萃取分离法3.4 离子交换分离法3.5 挥发和蒸馏分离法3.6 气相色谱法3.7 高效液相色谱法3.8 色谱分离技术发展简介3.9 膜分离法3.10 激光分离法3.11 复杂试样分析实例3.12 分离技术的发展趋势小结习题科学家及其思维方法简介——色谱学家马丁4 原子光谱分析法4.1 原子吸收分光光度法4.2 原子发射光谱分析法小结习题著名化学家本生对分析化学的贡献5 分子光谱分析法5.1 紫外-可见分光光度法5.2 红外光谱法5.3 分子发光分析法小结习题光分析化学前沿简介——光化学传感器6 核磁共振谱法6.1 基本原理6.2 核磁共振谱仪6.3 化学位移6.4 自旋偶合与自旋裂分6.5 核磁共振谱图解析6.6 13C核磁共振谱小结习题生物分子的革命性分析方法7 质谱法7.1 基本原理7.2 质谱仪7.3 离子的主要类型7.4 有机化合物质谱7.5 质谱图解析7.6 飞行时间质谱简介7.7 UV、IR、NMR和MS四谱综合解析小结习题科学展望——2000年诺贝尔化学奖简介8 电化学分析法8.1 电位分析法8.2 极谱法和伏安法8.3 库仑分析法8.4 电分析化学新进展小结习题2003年诺贝尔化学奖得主阿格雷和麦金农参考文献附录后记目录第1篇分析化学基础第1章分析化学导言1.1 分析化学的定义、任务和作用1.2 分析化学的特点和分类1.3 分析化学的发展趋势1.4 学习分析化学课程的方法思考题第2章试样的采集、制备与分解2.1 试样的采集2.2 固体物料试样的制备2.3 试样的分解思考题第3章定量分析中的误差及数据处理3.1 误差的基本概念3.2 误差的传递3.3 有效数字的表示与运算规则3.4 随机误差的正态分布3.5 少量数据的统计处理3.6 数据的评价——显著性检验、异常值的取舍3.7 回归分析3.8 提高分析结果准确度的方法思考题习题第2篇化学分析法第4章化学分析法概述4.1 化学分析法概述4.2 滴定分析法概述4.3 标准溶液与基准物4.4 化学分析法的计算思考题习题第5章酸碱滴定法第6章配位滴定法第7章氧化还原滴定法第8章沉淀滴定法第9章重量分析法第3篇仪器分析法第10章仪器分析法概述第11章紫外可见吸收光谱法第12章原子吸收光谱法第13章电位分析法第14章气相色谱法第4篇复杂物质分析第15章定量分析中的分离及富集方法第16章复杂物质分析示例附录参考文献目录第1章绪论第1节分析化学的任务和作用第2节分析化学的分类一、化学分析与仪器分析二、定性分析、定量分析和结构分析三、无机分析和有机分析四、常量分析、半微量分析和微量分析五、例行分析和仲裁分析第3节试样分析的基本程序一、取样二、分析试液的制备三、分析测定四、分析结果的计算与评价第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节概述第2节定量分析误差一、系统误差和偶然误差二、绝对误差和相对误差三、准确度与精密度四、提高分析准确度的方法第3节有效数字及其运算法则一、有效数字二、有效数字的运算法则三、有效数字的运算法则在分析化学中的应用第4节分析数据的统计处理与分析结果的表示方法一、偶然误差的正态分布二、实验数据的统计处理三、可疑值的取舍四、分析数据处理与报告第3章重量分析法第1节概述第2节挥发法一、定义二、操作过程三、应用第3节萃取法一、定义及分类二、操作过程三、应用第4节沉淀法一、沉淀重量法二、沉淀的溶解度及影响因素三、沉淀的纯度及其影响因素四、沉淀的类型与沉淀条件五、沉淀法中的计算第5节应用一、药物含量测定二、药物纯度检查第4章滴定分析法概论第1节概述第2节滴定方式一、直接滴定法二、反滴定法三、置换滴定法四、间接滴定法第3节基准物质和标准溶液一、基准物质二、标准溶液三、标准溶液浓度的表示第4节滴定分析中的计算一、计算依据二、计算示例第5章酸碱滴定法第1节概述第2节水溶液中的酸碱平衡一、酸碱质子理论二、溶液中酸碱组分的分布三、酸碱溶液中H+浓度的计算第3节酸碱指示剂一、酸碱指示剂的变色原理二、酸碱指示剂的理论变色点和变色范围三、影响指示剂变色范围的因素四、混合指示剂第4节酸碱滴定法的基本原理……第6章沉淀滴定法第7章配位滴定法第8章氧化还原滴定法第9章电位分析法第10章紫外-可见分光光度法第11章荧光分析法第12章红外分光光度法第13章原子吸收分光光度法第14章经典液相色谱法第15章气相色谱法第16章高效液相色谱法第17章其他分析方法实验部分参考文献附录《分析化学》教学基本要求目录第一章绪论第一节分析化学的任务和作用第二节分析方法的分类一、定性分析、定量分析和结构分析二、无机分析和有机分析三、常量、半微量、微量、超微量分析四、化学分析和仪器分析五、例行分析、仲裁分析和快速分析第三节分析化学的发展趋势一、分析理论与其他学科相互渗透二、分析技术的发展趋势本章小结思考题与习题第二章定量分析误差和分析数据的处理第一节定量分析误差的种类和来源一、系统误差二、随机误差第二节准确度与精密度一、准确度与误差二、精密度与偏差三、准确度与精密度的关系第三节随机误差的正态分布一、频率分布二、正态分布三、随机误差的区间概率第四节有限测定数据的统计处理一、置信度与μ的置信区间二、可疑测定值的取舍三、显著性检验第五节提高分析结果准确度的方法一、选择适当的分析方法二、减小测量的相对误差三、检验和消除系统误差四、减小随机误差第六节有效数字及其运算规则一、有效数字的意义和位数二、数字修约规则三、有效数字的运算规则本章小结思考题与习题第三章滴定分析法概论第一节滴定分析法的分类及滴定方式一、滴定分析法的分类二、滴定分析法对化学反应的要求三、滴定方式第二节滴定分析的标准溶液一、标准溶液浓度的表示方法二、化学试剂的规格与基准物质三、标准溶液的配制第三节滴定分析的有关计算一、滴定分析计算的理论依据二、滴定分析计算示例本章小结思考题与习题第四章酸碱滴定法第一节酸碱反应及其平衡常数一、酸碱反应及其实质二、酸碱反应的平衡常数以及共轭酸碱对Ka与Kb的关系第二节酸碱溶液中各型体的分布系数与分布曲线一、一元弱酸(碱)溶液中各型体的分布系数与分布曲线二、多元酸(碱)溶液中各型体的分布系数与分布曲线第三节酸碱溶液pH的计算一、质子等衡式(质子条件式)二、酸碱溶液pH的计算第四节酸碱指示剂一、酸碱指示剂的作用原理二、影响酸碱指示剂变色范围的因素三、混合酸碱指示剂第五节酸碱滴定原理及指示剂选择一、强碱与强酸的滴定二、强碱(酸)滴定一元弱酸(碱)三、多元酸(碱)的滴定四、酸碱滴定中CO2的影响第六节酸碱滴定法的应用一、酸(碱)标准溶液的配制及标定二、酸碱滴定法应用实例本章小结思考题与习题第五章配位滴定法第一节概述第二节 EDTA及其配合物一、乙二胺四乙酸(EDTA)的结构与性质二、EDTA在水溶液中各存在型体的分布系数三、EDTA与金属离子形成螯合物的特点第三节 EDTA与金属离子的配位平衡一、配合物的稳定常数二、溶液中各级配合物浓度的计算第四节影响配位平衡的主要因素一、酸效应及酸效应系数二、配位效应及配位效应系数三、配合物的条件稳定常数第五节配位滴定原理一、配位滴定曲线二、影响配位滴定突跃范围的主要因素三、准确滴定金属离子的判据四、配位滴定中适宜pH范围第六节金属指示剂一、金属指示剂的作用原理二、金属指示剂应具备的条件三、金属指示剂的选择四、金属指示剂的封闭、僵化和氧化变质现象五、常用的金属指示剂第七节提高配位滴定选择性的方法一、控制溶液酸度二、利用掩蔽和解蔽作用三、采用其他配位剂四、分离干扰离子第八节配位滴定法的应用一、EDTA标准溶液的配制、标定二、各种配位滴定方式三、配位滴定法应用实例本章小结思考题与习题第六章氧化还原滴定法第一节氧化还原反应的特点一、标准电极电势和条件电极电势二、氧化还原反应进行的方向三、氧化还原反应进行的程度四、氧化还原反应速率第二节氧化还原滴定原理一、氧化还原滴定曲线二、化学计量点时溶液电势的计算三、影响氧化还原滴定突跃范围的因素第三节氧化还原滴定的指示剂一、自身指示剂二、特殊指示剂三、氧化还原指示剂第四节常见氧化还原滴定法及其应用一、高锰酸钾法二、重铬酸钾法三、碘量法本章小结思考题与习题第七章沉淀滴定法第一节沉淀滴定法基本原理第二节银量法一、莫尔法二、佛尔哈德法三、法扬司法第三节沉淀滴定法的应用一、标准溶液的配制与标定二、应用示例本章小结思考题与习题第八章分析化学中的常用分离方法第一节沉淀分离法一、无机沉淀剂分离二、有机沉淀剂分离三、共沉淀分离第二节液?液萃取分离法一、萃取分离法的基本原理二、萃取体系的分类和萃取条件的选择三、萃取分离技术四、溶剂萃取在分析化学中的应用第三节离子交换分离法一、离子交换剂的种类和性质二、离子交换树脂的亲和力三、离子交换分离操作技术四、离子交换分离法的应用第四节常规色谱法一、柱色谱法二、纸色谱法三、薄层色谱法本章小结思考题与习题第九章电势分析法第一节电势分析法基本原理一、直接电势法二、电势滴定法三、电池电动势的测量第二节参比电极和指示电极一、参比电极二、指示电极第三节直接电势法及应用一、溶液pH值的测定二、离子活度(浓度)的测定三、直接电势法的应用第四节电势滴定法一、电势滴定法的原理二、电势滴定终点的确定三、电势滴定法的应用本章小结思考题与习题第十章吸光光度分析法第一节吸光光度法的基础知识一、光的基本性质二、光的互补作用与溶液的颜色三、光的吸收曲线第二节光的吸收定律一、朗伯?比耳定律二、朗伯?比耳定律的推导三、吸光度与透光度四、吸光系数、摩尔吸光系数及桑德尔灵敏度第三节显色反应及影响因素一、吸光光度法对显色反应的要求二、影响显色反应的主要因素三、显色剂第四节吸光光度分析法及仪器一、吸光光度分析的类型二、吸光光度分析的定量分析方法三、分光光度计的构造四、分光光度计的类型第五节吸光光度法测量误差及测量条件的选择一、吸光光度法的测量误差二、测量条件的选择第六节吸光光度法的应用一、示差吸光光度法二、多组分的分析三、配合物组成的测定本章小结思考题与习题第十一章原子吸收分光光度法第一节基本原理一、共振发射线与吸收线二、基态原子与激发态原子的关系三、原子吸收线的宽度四、原子吸收的测量五、灵敏度和检出限第二节原子吸收分光光度计一、光源二、原子化器三、分光系统四、检测系统五、读数装置六、原子吸收分光光度计的类型第三节仪器测量条件的选择一、分析线的选择二、灯电流的选择三、原子化条件的选择四、燃烧器高度的选择五、进样量六、单色器狭缝宽度与光谱通带的选择第四节定量分析方法一、标准工作曲线法二、标准加入法第五节干扰及消除方法一、光谱干扰二、化学干扰、物理干扰及电离干扰第六节原子吸收分光光度法的应用一、测定生物样品中的化学元素二、有机物分析本章小结思考题与习题第十二章气相色谱分析法第一节色谱法概述一、色谱法原理介绍二、色谱法的分类第二节气相色谱法的特点及基本原理一、气相色谱法的特点二、气相色谱法的基本原理第三节气相色谱的实验技术一、色谱系统二、实验技术要点三、程序升温和衍生物制备第四节气相色谱法的应用一、定性分析二、定量分析三、气相色谱分析误差产生的原因第五节气相色谱法的新进展一、顶空气相色谱二、气相色谱?质谱联用技术三、气相色谱?红外光谱联用技术本章小结思考题与习题第十三章高效液相色谱法第一节高效液相色谱法的技术参数一、速率理论二、柱外效应三、分离度四、系统适应性实验第二节高效液相色谱法的色谱系统一、高压泵二、梯度洗脱装置三、进样器四、色谱柱五、检测器六、数据处理系统和结果处理第三节高效液相色谱法的分离方式一、吸附色谱法二、分配色谱法三、离子色谱法四、尺寸排阻色谱法五、亲和色谱法第四节样品预处理与色谱柱的保护一、样品预处理二、色谱柱的保护第五节液相色谱分析技术的新进展一、液相色谱?质谱联用技术概述二、超临界流体色谱法概述三、高效毛细管液相色谱法概述本章小结思考题与习题第十四章现代仪器分析简介第一节光分析法导论一、电磁波的辐射能特性二、光分析法的分类第二节原子发射光谱法一、基本原理二、原子发射光谱仪三、应用第三节原子荧光光谱法一、基本原理二、原子荧光光谱仪三、应用第四节分子荧光和磷光分析法一、荧光和磷光的产生二、荧光和磷光强度的影响因素三、荧光/磷光分析仪器四、荧光/磷光分析法应用第五节红外分光光度法一、分子的红外吸收二、红外光谱解析程序第六节核磁共振波谱法一、基本原理二、1HNMR谱的解析三、13CNMR谱的特点与解析第七节流动注射分析本章小结思考题与习题第十五章样品分析的一般过程第一节试样采集和制备一、试样的采集二、试样的制备第二节试样的分解与处理一、无机试样的分解处理二、有机试样的分解处理三、试样分解处理方法的选择四、干扰组分的处理第三节测定方法的选择一、测定的具体要求二、被测组分的性质三、被测组分的含量四、共存组分的影响五、实验室条件第四节分析结果的计算和数据评价一、分析结果的计算及表示方法二、分析结果的报告与评价本章小结思考题与习题附录附录一相对原子质量表(2001年国际原子量)附录二化合物的相对分子质量表附录三弱酸在水中的离解常数(25℃)附录四弱碱在水中的离解常数(25℃)附录五常用浓酸浓碱的密度和浓度附录六几种常用缓冲溶液的配制附录七常用标准缓冲溶液不同温度下的pH值附录八金属离子与EDTA配合物的lgKf(25℃)附录九标准电极电势表(25℃)附录十部分氧化还原电对的条件电极电势(25℃)附录十一难溶化合物的溶度积常数(25℃)参考文献目录绪论0.1 分析化学的任务和作用0.2 分析方法的分类0.2.1 无机分析和有机分析0.2.2 化学分析和仪器分析0.2.3 常量分析、半微量分析和微量分析。
分析化学1

第四章 酸碱平衡和酸碱滴定法思考题 设计下列混合物的分析方案: (1)HCl+NH 4Cl 混合液; (2)硼酸+硼砂混合物; (3)HCl+H 3PO 4混合液。
练习题 一、填空题1.用0.20 mol · L - 1NaOH 溶液滴定0.10 mol · L - 1H 2SO 4和0.10 mol · L - 1 H 3PO 4的混合溶液时 在滴定曲线上,可以出现 个突跃范围。
2. 用吸收了CO 2 的标准NaOH 溶液测定工业HAc 的含量时,会使分析结果 ;如以甲基橙为指示剂,用此NaOH 溶液测定工业 HCl 的含量时,对分析结果___ ____(填偏高,偏低,无影响)。
3.已知柠檬酸的p K a1-p K a3 分别为3.13,4.76,6.40。
则p K b2= ; p K b3= 。
4. 列出下溶液的质子平衡方程; 浓度为c (mol · L - 1)(NH 4)2 CO 3 浓度为c (mol · L - 1)NH 4H 2PO 4 —— 5. 温度一定时,当离子强度增大,则HAc 的浓度常数K a c , 活度常K aa 。
6. 用0.100 mol · L - 1HCl 滴定同浓度NaOH 的pH 突跃范围为9.7 - 4.3。
若HCl 和NaOH 的浓度均减小10倍, 则pH 突跃范围是 。
7. 对缓冲溶液,影响缓冲容量(β)大小的主要因素是 和 . 8. 用双指示剂法(酚酞、甲基橙)测定混合碱样时,设酚酞变色时消耗HCl 的体积为V 1,甲基橙变色时,消耗HCl 的体积为V 2,则:(l)V 1>0, V 2=0时,为 。
(2)V 1=0, V 2>0时,为 。
(3)V 1= V 2=0时,为 。
(4)V 1> V 2>0时,为 。
(5)V 2> V 1>0时,为 。
分析化学实验集锦(一)

分析化学实验集锦(一)引言概述:分析化学实验是分析化学学科中的重要组成部分,通过实验手段对物质进行定性和定量的分析。
本文将介绍一些常见的分析化学实验方法及其应用,以帮助读者更好地理解和掌握这些实验技巧。
正文内容:一、物质的酸碱性检测1. pH试纸的使用方法2. 酸碱指示剂的选择与应用3. 酸碱滴定法的原理及步骤4. pH计的操作与校准5. 酸碱性的应用:酸度调节、中和反应等二、溶液浓度测定1. 重量法的浓度计算2. 体积法的浓度测定3. 比色法的原理与操作4. pH滴定法的浓度计算5. 标准曲线法的建立与使用三、氧化还原反应实验1. 氧化还原反应的基本概念2. 氧化还原指示剂的应用3. 氧化还原滴定法的原理与步骤4. 电化学法的应用:电解、电沉积等5. 氧化还原反应的实际应用:电池、腐蚀等四、金属离子的定性分析1. 金属离子的通用试剂检测方法2. 硫化物沉淀法的实验步骤3. 氨水溶液的使用与作用4. 硝酸银法的应用与限制5. 钠石碱法的应用:铝离子分析等五、有机物质的分析检测1. 质谱仪的基本原理与操作2. 红外光谱仪的使用与解析3. 气相色谱法的分析原理4. 液相色谱法的应用:高效液相色谱法、毛细管电泳等5. 融点测定法的实验步骤及分析结果判读总结:本文介绍了分析化学实验中常见的方法和技巧,包括物质的酸碱性检测、溶液浓度测定、氧化还原反应实验、金属离子的定性分析以及有机物质的分析检测。
这些实验方法在化学分析和实际应用中具有十分重要的价值,希望读者通过学习和实践,能够熟练掌握和应用这些技术,提高实验操作水平和分析能力。
分析化学名词解释 (1)

名词解释
分析化学是研究物质化学组成的分析方法及有关理论的一门学科,是人们获得物质的化学组成和结构信息的科学
其任务是采用各种方法和手段,获取分析数据,确定物质体系是化学组成、测定其中的有效成分的含量和鉴定体系中物质结构和形态,解决关于物质体系构成及其性质的问题
分析化学的方法分类定性分析、定量分析、结构分析和形态分析这是按照分析任务分类无机和有机按照分析对象分化学分析和仪器分析按照测定原理分常量 > 0.1g >10ml、半微量0.1-0.01g 10-1ml、微量10-0.1mg 1-0.01ml、和超微量 < 0.1mg < 0.01ml分析按照试样用量分常量组分 >1%、微量组分0.01%-1%、痕量组分分析 <0.01% 按照试样中被测组分的含量高低进行分类
相对误差绝对误差δ与真实值μ的比值称相对误差
有效数字是指咋分析工作中实际上能测量到的数字
可变波长检测器可变波长紫外检测器是目前配置最多的检测器,一般采用氘灯为光源
使用注意事项1 应使用高纯度载气,。
分析化学(1)

分析化学(1)分析化学1-21.分析化学任务:定性分析、定量分析、结构分析2.分析化学分类:定性分析、定量分析、结构分析化学分析、仪器分析⽆极分析、有机分析常量分析、半微量分析、微量分析、超微量分析例⾏分析、仲裁分析3.应树⽴观念:量和误差观念4.定量分析程序:(1)试样采集(2)试样分离富集(3)分析⽅法的选择与分析测定、误差数据处理(4)质量保证与控制5.切乔特公式:Q≥Kd2Q(kg):平均试样采集量的最⼩值d(mm):试样中最⼤颗粒直径K:反应物料特性的系数6.等物质的量反应规则:对滴定反应:aA+bB=cC+dD选择包括反应式在内的化学式为反应单元,即选aA、bB、cC、dD为基本单元,则:n aA=n bB=n cC=n dD上式即为等物质的量反应规则。
7.化学因数:计算结果时,通过“CaCO3含量”可计算出“CaO含量”,所使⽤的换算系数,称为“化学因数”(或化学因⼦),记为F。
(CaO/CaCO3)F=待测化学式的摩尔质量/已知化学式摩尔质量8.基准物质:能⽤于直接配制标准溶液或标定溶液准确浓度的物质9.标准溶液(滴定剂):已知其准确浓度的试剂溶液10.物质的量浓度:单位体积溶液中所含溶质的物质的量11.滴定度:每毫升滴定剂相当于被测物质的质量(克或毫克)12.滴定⽅法:酸碱滴定法、配位滴定法、氧化还原滴定法、沉淀滴定法13.滴定⽅式:直接滴定法、返滴定法、置换滴定法、间接滴定法⽤⾼锰酸钾法测定不纯CaCO3样品的含量时,可采⽤间接滴定法。
称取试样0.2300g,溶于盐酸,加⼊过量的草酸铵溶液,使钙离⼦转化为草酸钙沉淀,将沉淀过滤、洗涤后溶于硫酸溶液。
此溶液中的草酸根离⼦⽤0.04000mol/L的⾼锰酸钾标准溶液滴定⾄终点,所消耗的体积为20.03mL。
计算试样中CaCO3和CaO的含量。
解:CaCO3+2H+=H2O+CO2+Ca2+Ca2++C2O42-=CaC2O4CaC2O4+2H+=H2C2O4+2Ca2+5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O根据“等物质的量反应规则”:n(CaO)=n(CaCO3)=n(C2O42-)=n(2/5MnO4-)=5/2n(MnO4-)CaCO3%=5/2C(MnO4-)V(MnO4-)M(CaCO3)100/ms=88.35CaO%=5/2C(MnO4-)V(MnO4-)M(CaO)100/ms=49.50试求0.02000mol/L的K2Cr2O7标准液对Fe、Fe2O3和Fe3O4滴定度?解: 相关反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O根据“等物质的量反应规则”:n(Cr2O72-)=n(6Fe2+)=n(3Fe2O3)= n(2Fe3O4)T(Fe/S)=CSM(6Fe)/1000=6.702mg/mLT(Fe2O3/S)=CSM(3Fe2O3)/1000=9.581mg/mLT(Fe3O4/S)=CSM(2Fe3O4)/1000=9.260mg/mL31.误差类型:系统误差(⽅法误差、仪器和试剂误差、操作误差、主观误差)随机误差系统误差:由固定的因素所造成的误差称为系统误差。
分析化学重点(1)

分析化学二、三章没提到的基本上都是重点,4、5章没提到的既不否认也不肯定它会考,祝好运。
2.3误差传递不考2.5回归分析法不考习题1、2、3、4、5、8、11、12、133.2.2.2不要求计算,重点在图3-2、3-33.2.5.3不考3.2.5.5不考3.4.1主要考影响因素3.4.2不要求计算,考条件3.4.4不考3.4.5.1注意公式3-86、3-873.4.5.2注意重铬酸甲相关反应及铁含量的计算3.4.5.3注意公式3-883.4.5.4不考3.4.5.5不考3.5不考3.6.1不考,但注意108页“由式(3-91)可以看出,······终点误差越大。
”这短话3.6.2.3不考3.6.2.4不考习题1、2、8、9、10、12、13、14、16、17、18、21、25、264.1.1不考4.1.2不考4.1.3重点看4.1.4.1不考4.1.4.2重点图4-9重点4.3.1不考4.3.2.1、4.3.2.2、4.3.2.4重点,注意公式4-36图4-15重点4.3.3.2重点4.3.3.3不考4.3.3.4重点4.3.3.5不考4.4.1掌握TISAB4.4.2重点4.4.3不考注意144页“可见,浓度测定的······电位分析误差就越小”这段话习题1、2、10、11、12、13注意151页“当一束阳光通过棱镜后······若透过所有颜色的光则为无色。
”这段话5.2.3重点5.3.3重点公式5-235.6.1选择显色反应的一般原则;影响显色反应的因素5.6.2重点5.7.4.3重点分析化学学习指导21页五题全部;63页五题2、3、4、7、8、9、10、11、12、13、14;111页13题;116页五题1设计题1、根据分析物质的性质选择方法2、碳酸根、碳酸氢根、磷酸二氢根、磷酸一氢根、NH4+酸碱滴定法的反应方程、标准溶液的物质、指示剂、计量关系3、测N强碱蒸馏法4、测P5、K+、Na、Cl、f电位分析法的步骤,参比电极、指示电极6、Ca+、mg+EDTA滴定。
分析化学选择题 (1)

分析化学选择题1. 硝酸银滴定液应储存于 [单选题] *无色塑料瓶具玻璃塞的棕色玻璃瓶(正确答案)具玻璃塞的无色玻璃瓶棕色容量瓶2. 沉淀滴定法以()为基础的滴定分析方法 [单选题] *酸碱反应沉淀反应(正确答案)氧化还原反应配位反应3. 根据的不同银量法共分三种分别以创立者的姓名来命名为莫尔法(铬酸钾指示剂法)佛尔哈德法(铁铵钒指示剂法)和法扬司法(吸附指示剂法) [单选题] *终点颜色指示剂(正确答案)被测离子滴定液4. 卤化银对卤化物和各种吸附指示剂的吸附能力如下:I->二甲基二碘荧光黄>Br->曙红>Cl->荧光黄,用吸附指示剂法测氯化物含量可选择的指示剂是 [单选题] *二甲基二碘荧光黄蜀红荧光黄(正确答案)二氯荧光黄5. 标定硝酸银滴定液的基准物质是 [单选题] *氯化钠(正确答案)铬酸钾碳酸钠硫氢酸氨6. 莫尔法测量氯离子所用的指示剂是 [单选题] *铬酸钾(正确答案)重铬酸钾铁安凡荧光黄7. 以铁安凡为指示剂用硫氢酸标定标准液滴定银离子时应在哪种条件进行 [单选题] *酸性(正确答案)弱碱性中性碱性8. 用莫尔法测定氯离子控制ph=4.0 ,其滴定终点将 [单选题] *不受影响提前到达推迟到达(正确答案)刚好等于化学计量点9. 用吸附指示剂法测定氯化钠含量时将计量点前氯化银沉淀优先吸附 [单选题] *银离子氯离子(正确答案)钠离子荧光黄指示剂阴离子10. 用硝酸银滴定氯化物以荧光黄指示剂的终点现象是 [单选题] *沉淀为微红色(正确答案)溶液为橙色沉淀为黄绿色溶液为蓝色11. 用法扬司法测定氯化钠含量是在计量点前氯化银沉淀优先吸附 [单选题] *银离子氯离子(正确答案)钠荧光黄指示剂阴离子12. 下列哪些要求不是重量分析对称量形式的要求 [单选题] *要稳定颗粒要粗大(正确答案)相对分子质量要大组成要与化学式完全符合13. 以SO4²-沉淀Ba²+时,加入适量的过量的SO4²-可以使Ba²+离子沉淀更完全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LOGO
光谱分析
分子光谱分析法研究进展
分子光谱分析不仅局 限于紫外-可见和红 图1. 等温循 环链置换聚 合反应的荧 光信号放大 技术用于核 酸的检测
Q Guo, X Yang, K Wang, Nucleic Acids Research Advance, 2009
外光谱分析,近年来,
随着纳米技术、光电 转换技术和激光技术 的发展,分子光谱分 析在有机小分子荧光 探针、荧光量子点探 针和光化学传感器等 研究领域得到了广泛 应用。
400MHz 500MHz 600MHz 800MHz
LOGO
核磁分析
NMR方法学进展:异核多共振谱应用于生物大 分子结构研究
最优横向弛豫谱(TROSY):高场谱仪 下大分子结构解析最常用的NMR技术 之一; 顺磁弛豫增强(PRE):适用于观测瞬态 蛋白构象变化及生物大分子间相互作 用; 饱和转移差谱(STD):高通量筛选药物 与靶点蛋白的结合 横向弛豫谱解析分子量高达 弛豫弥散技术(RD):用于蛋白质中间 900KDa的蛋白质复合体 GroEL-GroES部分结构 态的结构研究和动力学过程;
2008年诺贝尔化学奖—发现和研究绿色荧光蛋白GFP (Roger Y. Tsien,Osamu Shimomura,Martin Chalfie)
LOGO
分析化学的作用
2014年诺贝尔化学奖
研制出超分辨率荧光学显微
Eric Betzig
Stefan W. Hell
William E. Moerner
LOGO
核磁分析
肺癌组下调↓ N-甲基烟酸 马尿酸盐
肺癌组上调↑ 肌酐 N-乙酰谷氨酰胺 β-羟基异戊酸 α-羟基异丁酸
基于NMR代谢组学的尿液中 肺癌代谢标志物发现 Joana Carrola.et al. J. Proteome Res., 2011
子化系统
LOGO
色谱分析
• 相吸附:固相萃取(SPE)、固相微萃取(SPME) • 相分配:液相微萃取(LPME) • 场辅助:微波辅助萃取(MAE)、加速溶剂萃取 (ASE)、 超临界流体萃取(SFE) • 膜分离:渗析、电渗析 • 绿色溶剂:CO2,室温离子液体 • 高选择性吸附剂:免疫亲和吸附剂、分子印迹 吸附剂 • 纳米和多孔材料:碳纳米管、磁性纳米粒子 • 整体柱
测定 物理量
PH计
电位 电流 电导 电量
确定
参与反应的化 学物质的量
葡萄糖仪
LOGO
电化学分析
常见的电化学传感器的应用
DNA传感器 免疫传感器 核酸适体传感器 酶传感器
通过溶出伏安法、 夹心式三明治结 构检测目标DNA 示意图(右)
Biosens. Bioelectron. 2009, 24: 3113.
仪器硬件
低温探头:通过降低电子线圈温度来减小电信号噪声,提高信噪比 流动探头:LC-MS-NMR联用技术使多种方法的技术优势得以整合 高分辨魔角旋转技术(HR-MAS):生物组织样品高分辨NMR谱图; 溶剂压制脉冲序列:去重叠信号等化学噪声;
实验方法
数据分析
数据预处理:调整相位,校正基线,化学位移定标,分段积分等; 谱图解析:统计全相关谱(STOCSY)---混合物信号指认
图2. 皮下注射不同浓度亚甲基蓝二氧化硅核壳纳米颗粒 的活体荧光成像图 X He, X Wu, K Wang, Biomaterials, 2009
LOGO
电化学分析
是主要研究电的作用和化学作用相互关系的化学分支 是一个跨学科的典范:分析化学与物理化学 优点:响应快、仪器简单、易小型化。
横向弛豫谱表征去乙酰化酶 LpxC与药物CHR90复合物 ----Adam W. Barb, et.al. PNAS.
LOGO
核磁分析
基于NMR技术的代谢组学研究
样品“无损分析”
基于NMR代 谢组学特点 检测“无偏向性” 结果“高重现性” 实验方法“灵活性”
适用于各类生物样品: 生物体液样品(血浆,尿液) 生物组织样本(器官,肿瘤) 细胞样品
中国科学家在ACS上发表的论 文2002-2009共1090篇,占 4.5%,排第7位
中国科学家在ACS上发表的论文专业领域 分布(右)
光谱
电化学
色谱
核磁 质谱
LOGO
光谱分析
光谱分析分类及应用研究领域
原子光谱分析法
1、主要包括:原子吸收光谱(AAS)分析法
原子发射光谱(AES)分析法 原子荧光光谱(AFS)分析法
色谱分析
采用LCMS和GC-MS 分析了262个 前列腺癌症 患者的体液 和组织样品, 证明肌氨酸 在前列腺癌 发展过程中 有重要作用。
NATURE, 2009, 457(12):910-915.
LOGO
核磁分析
NMR仪器硬件发展
(1)强磁场:现阶段大程度降低电子噪声, 探头检测灵敏度提高4倍以上 微量探头:微量样本,特别适用于天 然产物研究; 流动探头:LC-NMR-MS联用仪;
LOGO
色谱分析
毛细管电泳(CE)
提高柱容量,加大进样量 采用在线柱上浓缩方法 采用高灵敏度检测器和检测方法:电化学检测器、化学发光检 测器
多维色谱
全二维气相色谱与质谱联用系统:二维气相色谱与四级杆联用
二维液相色谱优化方法:帕累托最优(Parcto-Optimality)参
数优化 集成在微流控芯片上的二维液相色谱—毛细管电泳—电喷雾离
样品前处理 新方法研究
样品前处理分 离介质研究
在线采样/分离 分析联用技术
• 原位采样分析联用技术:微透析、固相微萃取 (SPME) • 在线分离分析联用技术:顶空固相微萃取与GC 联用
LOGO
色谱分析
蛋白质组学分离鉴定:多维LC 分离技术
第一维:离子交换色谱 第二维:反相高效液相色谱(RPLC)
色谱分析
一维GC GC×GC
气相 色谱
多维 液相 色谱
液相 色谱
毛细 管电 泳
HPLC/UPLC 毛细管液相色谱 (CapLC) 纳流液相色谱 (nanoLC)
HILIC +RPLC NPLC+RPLC
毛细管区带电泳 (CZE) 毛细管胶束电动 色谱(MEKC)
LOGO
电感耦合等离子体质谱(ICP-MS)分析法等
2、优势:优异的灵敏度和检出限,又具有很高的选择性, 3、应用研究领域:被广泛应用于元素、元素形态及金属组学分析中。
分子光谱分析法
1、主要包括:常见:紫外-可见吸收(UV-Vis)光谱、红外吸收(IR)光谱 2、应用研究领域:在物质定性、定量分析方面发挥重要作用,尤其IR光谱
分析化学的作用
社会经济发展和国家重大需求
产品质量控制 国家安全、 食品安全、环境分析、材料分析、 临床检验、药物/毒物分析、医学分析
分析化学是前沿科学发展的重要支柱
生命科学、材料科学、能源科学、环境科学和空间科学向分 析化学提出了更高、更严峻的挑战。
我国分析化学研究现状
中国科学家在AC上发表的论文统 计(上)及专业领域分布(右)
IUPAC对金属组学研究领域发表了一份技术报告,指出金属组
学是针对生物系统中金属离子或金属元素的各种形态与基因、 蛋白质、代谢物或其它生物分子的相互作用和功能联系的金
2010年
属组研究。
金 属 组 学 分 析 流 程
Joanna Szpunar, Analytical and Bioanalytical Chemistry, 2003
LOGO
电化学分析
电化学发展:联用技术
微流控芯片与电化学检测联用技术 电化学与质谱联用技术 电化学与表面等离子体共振联用技术 电化学与拉曼光谱联用技术
基于纳米氧化钛 电极MALDI靶板 的电化学诱导肽 段裂解反应
Chem. A Euro. J. 2009, 15: 6711.
LOGO
---Jocelyne Fiaux,et al. Nature
742 kDa complex section
LOGO
核磁分析
Native state Intermediate state
弛豫弥散技术确定了在蛋白质折叠过 程中寿命仅mn级的中间体结构 ---Lewis E. Kay, et.al. Science.
是物质分子结构分析中不可缺少的手段。
LOGO
光谱分析
原子光谱分析法最新发展
仪器小型化、多 元素同时测定
连续光源原子吸收光谱仪contrAA 微型DBD-AES
将具有元素选择性 的原子光谱分析技 术与高效的分离技 术联用可解决复杂 基体中的元素化学 形态分析问题
接口是联 用技术的 “心脏”
GC、HPLC、CE等与原子光谱联用技术的发展
LOGO
光谱分析
原子光谱分析法前景和展望
金属组学、金属基因组学、金属糖组学和金属类脂组学的 发展刚刚起步,给原子光(质)谱联用技术带来了新的机 遇和挑战。
2002年 2003年 Haraguchi提出了“金属组学”的概念,引起研究者的关注;
Science推出了第300期专刊Metals: Impacts on Health and the Environment, Ash 和 Stone再次提到了金属组的概念;
首先利用阴阳 离子二维分离系 统,将在阳离子 交换柱上没有保 留的组分用阴离 子交换柱富集分 析,再进行 RPLC分析实现 了磷酸化和非磷 酸化蛋白质的同 时大规模分析。
LOGO
色谱分析
蛋白质组学分离定量:基于色谱分离为基础的稳定同位素标 记技术
iTRAQTM
标记定量
SILAC
标记定量
LOGO
分析化学学科前沿与展望
