氮的氧化物计算专题(最新整理)
高考化学“氮的氧化物”计算考查10种方式

计算原理: 3NO2+H2O==2HNO3+NO ①
2NO+O2==2NO2 ②
①x2+②得: 4NO2+O2+2H2O==4HNO3 ③
②x3-①x2得: 4NO2+O2+2H2O==4HNO3 ④
V(NO2) 2V/5
3L:2L= V(NO2):2V/5,解得:V(NO2)=3V/5L
从而得:V(N2): V(NO2)=(V-3V/5):3V/5=2:3
故正确答案为A。
二、NO2(或NO)与O2的混合气体溶于水的计算
(1)C筒中发生反应的化学方程式是________________________.已知原C筒中的气体是单一气体,它是_____(若有多种可能的答案,需一一列出).将反应后C筒中的气体用水充分吸收,在同温、同压下,气体体积减少一半,则与水反应前C筒中的气体是___________(若有多种可能的答案,需一一列出.)
解得:x=6mL, y=18mL
故本题正确答案为A、D。
四、NH3+NO2+O2溶于稀HNO3(或H2SO4)的计算
计算原理:4NO2+O2+2H2O==4HNO3
2NH3+H2SO4==(NH4)2SO4(或NH3+HNO3==NH4NO3)
【例5】将NO2、NH3、O2的混合气体33.6L,通过稀H2SO4后,溶液质量增重26.4g,气体体积缩小为11.76L(气体体积均在标准状况下测定),剩余气体能使带余烬的木条复燃,则原混合气体的平均相对分子质量为( )
(2) A气体的体积是______________
(3) V值的取值范围为__________________
【计算三】氮的氧化物及硝酸的计算

【计算二】氮的氧化物及硝酸的相关计算必须熟记几个反应:①2NO2+2NaOH→NaNO2+NaNO3+ H2O②NO+NO2+2NaOH→2NaNO2+H2O③4NO+3O2+2H2O → 4HNO3④4NO2+O2+2H2O→ 4HNO3⑤Cu+4HNO3(浓)→Cu (NO3)2+2NO2↑+2H2O⑥3Cu+8HNO3(稀)→ △3Cu (NO3)2+2NO↑+4H2O解题技巧:观察方程式的特点利用元素守恒或找反应物与生成物的关系利用得失电子守恒。
例1.已知NO2与NaOH溶液反应:2 NO2 + 2 NaOH → NaNO2 + NaNO3 + H2O,NO和NO2可一起与NaOH溶液作用:NO2+ NO + 2 NaOH → 2 NaNO2 + H2O,现用V L某烧碱溶液能完全吸收n mol NO2和m mol NO组成的混合气体。
(1)所用烧碱溶液的物质的量浓度至少为。
(2)若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m = 。
(3)用含n和m的代数式表示所得溶液中NO3-和NO2-离子浓度的比值c(NO3-): c(NO2-)= 。
【答案】(1)(2)3:2 (3)mol·L-1解题指导:观察方程式的特点利用氮元素与钠元素的守恒。
n(N)=n(Na)2.将0.8molCu和Mg完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合气体,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOH 的物质的量可能为()(①2NO2+2NaOH→NaNO2+NaNO3+ H2O ②NO+NO2+2NaOH→2NaNO2+H2O)A.0.7mol B. 1mol C.1.5mol D.1.8mol3.(10分)硝酸工业生产中的尾气(NO2、NO的混合气体)通常可用纯碱溶液吸收:2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①NO+NO2+Na2CO3→2NaNO2+CO2↑ ②(1)在硝酸工业尾气吸收过程中,在标准状况下,每生成44.8L二氧化碳气体,可以吸收尾气 L。
专题三 氮的氧化物有关计算 氨

专题三氮的氧化物有关计算氨一、氮的氧化物氨必掌握知识1.(1)NO与O2反应:________________________;(2)NO2与H2O反应:________________________(3)NO与O2混合与水反应:________________________NO2与O2混合与水反应:________________________2.NH3的化学性质:(1)与H2O反应:氨气溶于水形成的水溶液称为______,大部分与水结合成________,+H2O NH3·H2O NH4++H2O。
部分电离显______,化学方程式为NH(2)与酸反应:与HCl、H2SO4、HNO3反应的化学方程式分别为:__________________;________________________;___________________________。
(3)与氧气反应:化学方程式为:___________________________________。
4.铵盐:(1)物理性质:铵盐是由__________和__________构成的化合物,铵盐都溶于水,呈白色或无色晶体。
碳铵指________________,氯铵指________________,硫铵(肥田粉)是指________________,硝铵指________________。
(2)化学性质:①受热分解:如NH4Cl、NH4HCO3受热分解,化学方程式分别为____________________________________;____________________________________。
②与碱反应,如NH4Cl与Ca(OH)2反应,产生NH3,化学方程式为______________________________________________________。
3.氮的氧化物相关计算(1)NO2溶于水型练习1、将盛有N2和NO2混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中N2和NO2的体积比是______(2)NO+O2+H2O 型原理:4NO + 3O2 + 2H2O = 4HNO3,余气:NO或O2练习2:将盛有12mLNO气体的试管倒立于水槽中,缓缓通入一定量O2后,若试管中气体变为4mL,则通入O2为多少毫升?(分两种情况讨论)(3)“NO2+O2+H2O”型原理:4NO2+O2+2H2O=4HNO3余气:NO或O2练习3:将40mLNO2和_______mLO2混合,与水反应无气体剩余。
有关N的氧化物的计算

• 例4.在一定条件下,将充满NO2和O2的试 管倒立于水槽中,充分反应后,剩余气体 体积为原混合气体体积的1/8,则原混合气 体中NO2和O2体积比是 [ B、C ] A.8∶1 C.7∶1 B.7∶3 D.4∶1
实践训练
• 5.将40mL NO和NO2的混合气体跟20mL O2同时通入装满水倒立于水槽中的量筒中, 发现有5mL气体剩余,问原NO和NO2混合 气体的体积各是多少?
关于氮的氧化物的计算
一、NO2、NO、O2混合气体与水反应的 有关计算,通常有两种解题技巧: 1.关系式法 2.电子守恒法
1.关系式法。单一气体或与氧气反应,计算时经常用到 的四个重要化学方程式: 3NO2+H2O==2HNO3+NO ① 2NO+O2==2NO2 ② 将化学方程式①、②叠加得: 4NO2+O2+2H2O==4HNO3 ③ 4NO+3O2+2H2O==4HNO3 ④ 利用化学方程式③解答NO2、O2混合气体溶于水的计算有 三种类型: (1)当VNO2∶VO2=4∶1,完全反应,无气体剩余。 (2)当VNO2∶VO2<4∶1,O2过量,剩余O2。 (3)当VNO2∶VO2>4∶1,NO2过量,剩余NO。 利用化学方程式④解答NO、O2混合气体溶于水的计算也有 三种类型: (1)当VNO∶VO2=4∶3时,完全反应,无气体剩余。 (2)当VNO∶VO2<4∶3时,O2过量,剩余O2。 (3)当VNO∶VO2>4∶3时,NO过量,剩余NO。
• 6.等体积混合而成的四组气体: ①NO2+NO ②NO2+O2Байду номын сангаас③NO+O2 ④ HCl+N2 将其分别通入体积相同的试管并立即倒立在 足量的水中,试管内水面上升占试管的高 度(试管高度为h)依次是 ________、________、_________、_______。
专题:有关氮的氧化物溶于水的计算

3
1
XmL
4mL
解得X=12mL
答:原试管中NO2的体积为12mL。
2. NO+NO2+H2O
例2:将30mLNO和NO2的混合气,通入倒立在水槽中的盛 满水的量筒里,片刻后,量筒里剩下16mL的气体。求原混 合气体中NO和NO2的体积。
解:设原有NO2的体积为xmL
3NO2+H2O = 2HNO3+NO 体积差
O2和NO2与水反应什么情形下不余气?此题余气是什么? 4NO2+ O2 +2H2O = 4HNO3
解 (1)余气5mL是O2时,设原有NO2的体积为 x
4NO2 ~ O2
x
1/4x
x+ 1/4x +5 =40mL
x=28mL
V(O2)= 1/4 x +5mL = 12 mL
(2)余气5mL是NO时,设原有O2的体积为 y 由3NO2+H2O = 2HNO3+NO可知余NO215mL
(3) NO2和O2的混合气体溶于水 4NO2+O2+2H2O==4HNO3
= 4︰1,恰好完全反应 V(NO2):V(O2) > 4︰1,NO2过量,剩余气体为NO
< 4︰1, O2过量,剩余气体为O2 值得注意的是: 4NO2+O2和4NO+ 3O2从组成上均相当于2N2O5的 组成。 N2O5是硝酸的酸酐,N2O5+H2O===2HNO3 (4) NO、NO2、O2三种混合气体溶于水
专题练习
有关氮的氧化物的计算
一、基本反应: 2NO+O2 = 2NO2
二、主要类型
3NO2+H2O = 2HNO3+NO
氮的氧化物计算

一:氮氧化物专题计算
典型例题1.容积为10mL的试管中充满N O2和O2混合气体,倒立于盛有水的水槽中,若最后剩余
1mL气体(同温同压),则原有N O2可能是()
A.8.0mL
B.7.2mL
C.8.6mL
D.5.6mL
典型例题2. 30mlNO2和O2的混气,倒扣在水槽中,若剩余气体体积为5ml,求原气体组成?
典型例题3.共30mlNO和O2气体,NO先装入试管倒扣在水槽中,再缓缓通入O2,若剩余气体体积为9ml,剩余气体可能为什么?求原混合气体的组成?
典型例题4.一定条件下,将充满N O、N O2(体积比为2:3)混合气体的量气管倒立于水槽,然后缓慢通入与原N O 等体积的O2,充分反应后,量气管内将会()
A.剩余NO体积占量气管容积的1/3
B.剩余NO体积占量气管容积的1/15
C.剩余O2体积占量气管容积的1/3
D.剩余O2体积占量气管容积的1/15。
氮氧化物折算值计算公式

氮氧化物折算值计算公式氮氧化物折算值的计算公式,这可是个在化学和环境科学领域里挺重要的家伙呢!咱先来说说为啥要搞出个氮氧化物折算值来。
比如说,在工厂排放废气的时候,测量出来的氮氧化物浓度那可不能直接就拿来用,因为废气的含氧量啥的都不太一样。
这就好比你去买水果,同样是一斤,水分多的和水分少的实际果肉重量能一样嘛!所以就得有个折算的办法,让不同条件下测出来的数据能放在一起比较,这就是氮氧化物折算值存在的意义啦。
氮氧化物折算值的计算公式通常是这样的:氮氧化物折算值 = 氮氧化物实测值×(21 - 基准含氧量)÷(21 - 实测含氧量)。
这里面的“21”指的是空气中氧气的体积分数,一般认为是个固定的值。
给您举个例子吧。
有一回我去一家化工厂考察,他们的废气监测设备显示氮氧化物的浓度是 500mg/m³,实测含氧量是 10%。
那咱们按照公式来算算,基准含氧量假如规定是 8%,那氮氧化物折算值就是500×(21 - 8)÷(21 - 10),算下来大概是 642.86mg/m³。
这一折算,就能更准确地反映出这废气中氮氧化物的实际含量了。
在实际应用中,这个公式可重要了。
比如说环保部门要评估一个区域的空气质量,或者工厂要控制自己的污染物排放,都得靠这个公式来算出准确的氮氧化物折算值。
而且啊,不同的行业、不同的排放标准,对于基准含氧量的规定还可能不一样呢。
这就要求咱们在使用这个公式的时候,一定要搞清楚具体的规定,可不能瞎算。
再比如说,在研究汽车尾气排放的时候,也得用这个公式。
想象一下,一辆车在路上跑,尾气排出来,检测氮氧化物浓度的时候,也得考虑当时的含氧量,然后通过折算值才能真正知道这尾气排放到底合不合格。
总之,氮氧化物折算值计算公式虽然看起来有点复杂,但只要搞清楚里面每个参数的含义,用对地方,那就能在环保和相关领域发挥大作用,让我们能更科学、更准确地了解和控制氮氧化物的排放,保护好咱们的环境。
氮的氧化物计算

解:若NO过量,则进入的O2全部消耗,剩余 的气体一定比原来的少,而液面仍在原高度,
说明O2过量。 设原试管内NO的体积为 x
4NO ---- 3O2
x
3/4 x
28mL – 3/4 x = x
x = 16 mL
3. NO2+O2+H2O 由O2和NO2组成的混合气40mL,通过足量的水吸 收后剩下5mL。求原混合气体中NO2和O2的体积。
4NO2 -- O2 △V5y =40mL - 15mL
y=5mL
4y y 5y V(NO2)= 4y +15mL = 35 mL
答:原NO2和O2的体积分别为28mL、12mL或35mL、5mL
4. NO+NO2+O2+H2O 有一盛满20mLNO气体的试管倒立于水槽中,
然后极缓慢地向其中通入12mLO2和8mLNO2组 成的混合气,问试管内还剩下多少毫升气体?
2、装有等体积的NO、NO2、O2的混合气体的试管倒置于 盛有足量水的水槽中,最后水位上升的体积百分数为 ____________________
3、将分别充满下列四组混合气体(每组中的2种气体 按等体积充入)的集气瓶倒扣在盛有足量水的水槽 中,待液面平稳后,按所剩余气体体积由多到少的 顺序是_____________________
故:①NO过量
4NO----3O2 4L 3L
V(NO):V(O2)=(4+7):3=11:3 ②O2过量
V(NO):V(O )=4: (3+7)=2:5
如图,通过分液漏斗向贮有 O2的贮气瓶中缓慢加入 28mL水,最终倒立于水槽 中的试管内(原盛有NO) 的液面仍在原高度,问:原 在试管内的NO有多少毫升?
高考化学九例氮的氧化物溶于水的计算专题详细解答

例1、将由amLNO 2和bmLNO 组成的混合气体通入水中,问:剩余气体的成分是什么?其体积是多少? 解析:因为NO 不溶于水,NO 2溶于水发生如下反应:3NO 2+H 2O=2HNO 3+NO ,所以剩余气体的成分是NO 。
设amLNO 2溶于水后生成的NO 的体积是x ,则有比例式:3:1=a :x ,x=a/3mL 。
剩余气体的体积由两部分构成,即原来的没反应的NO 和新生成的构成,体积和是:(b+a/3)mL 。
例2、将由amLNO 和bmLO 2组成的混合气体通入水中,问:剩余气体的成分是什么?其体积是多少? 解析:单纯的NO 或O 2都不溶于水,但二者同时通入水中时,会发生这样的反应:4NO+3O 2+2H 2O=4HNO 3 。
(1)如果二者与水反应后NO 有剩余,剩余气体将是NO 。
(2)如果二者与水恰好反应,剩余气体的体积为0。
(3)如果二者与水反应后O 2有剩余,则剩余气体的成分是O 2 。
由于相互反应的两物质的体积都给了,就得讨论分析才行。
① 讨论:4a >3b 时,NO 过量,剩余气体的成分是NO 。
设反应的NO 的体积是x ,则有比例式:4:3= x :b ,x=34b mL ,剩余气体的体积是:(a —34b )mL 。
②讨论:4a =3b 时,NO 和O 2与水恰好反应,剩余气体的体积为0。
③讨论:4a <3b 时,O 2过量,剩余气体的成分是O 2 。
设反应的O 2的体积是y ,则有比例式:4:3= a :y ,y=43amL ,剩余气体的体积是:(b —43a)mL 。
例3、将由amLNO 2和bmLO 2组成的混合气体通入水中,问:剩余气体的成分是什么?其体积是多少? 解析:NO 2和O 2二者同时通入水中时,会发生这样的反应:4NO 2+O 2+2H 2O=4HNO 3 ;amLNO 2和bmLO 2组成的混合气体通入水中会有三种情况发生:(1)如果二者与水反应生成HNO 3后NO 2有剩余,NO 2还会发生如下反应:3NO 2+H 2O=2HNO 3+NO ,结果剩余气体将是NO 。
氮的氧化物的计算

依据: 依据:3NO2+H2O = 2HNO3+NO 常用方法: 常用方法:差量法 思考:一充满NO2的试管倒立水中,液面上升,假设试管中溶液 思考:一充满 的试管倒立水中,液面上升, 不扩散,求试管中硝酸溶液的物质的量浓度? 不扩散,求试管中硝酸溶液的物质的量浓度? 1/22.4 mol•L-1 的混合气体共aL,倒立水中, 例1:一试管中充满了 2、NO2的混合气体共 ,倒立水中, :一试管中充满了N 充分反应后,剩余气体bL,求NO2的体积。 3(a-b) / 2 充分反应后,剩余气体 , 的体积。 例2:一定条件下,将等体积的 :一定条件下,将等体积的NO和NO2的混合气体置于试管 和 并将试管倒立于水槽中, 中,并将试管倒立于水槽中,充分反应生剩余气体的体积约为 原总体积的( 原总体积的 C ) A.1/2 B.1/3 C.2/3 D.5/6
4 1 mol•L-1 7 22.4 3 V(O2)- V(NO) 4 1 mol•L-1 - 4 7 22.4 4 V(NO)- 3 V(O2) 4 1 mol•L-1 - 7 22.4
的容器充满O 例1、 如图, 容积为 、 如图, 容积为50mL的容器充满 2和NO, 的容器充满 , 倒置于水槽中,打开开关阀 , 倒置于水槽中,打开开关阀K,让NO和O2相通, 和 相通, 充分反应后,试管内剩余气体体积为 充分反应后,试管内剩余气体体积为8mL,求原 , O2和NO的体积。 的体积。 的体积 若剩余气体为O 若剩余气体为 2,NO为24mL,O2为26mL 为 , 若剩余气体为NO,NO为32mL,O2为18mL , 若剩余气体为 为 , O2 k
2NO+O2=2NO2 +
氮的氧化物相关计算专题训练

若 b : a > 1 : 1则c=b
若 b : a < 1 : 1则c=b/2+a/2
13、已知氮的氧化物跟NaOH溶液发生的化学反应 如下:
3NO2+2NaOH=2NaNO3+NO↑+H2O, NO2+NO+2NaOH=2NaNO2+H2O 现有m mol NO2和n mol NO组成的混合气体,要用 NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol/L的NaOH溶液,则需此NaOH溶液的体积是 D A.m/a L B.2m/3a L C.2(m+n)/3a L D.(m+n)/a L
3.NO2与O2的混合气体与水反应的问题 10 ①将40mLNO2和_______mLO 2混合,与水反应无气 体剩余。 ② 将 40mLNO2 与 15mLO2 混 合 , 与 水 反 应 后 余 O2 气体________mL; 5 _______ NO ③将 40mLNO2与 5mLO2混合,与水反应后余 _______ 20/3 气体____________mL; 25或7.5 mLO2混合,与水反应后余 ④将 60mLNO2和 _______ 气10mL。
6.在标况下,将O2与NO2 1∶4 的体积比充满一个干燥 烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶 B 液的物质的量浓度为 A.0.045mol/L C. 0.026mol/L B.0.036mol/L D. 0.030mol/L
7.在标准状况下,将NO2、NO、O2混合后充满容器, 倒置于水中,完全溶解,无气体剩余,若产物也不扩 散,则所得溶液物质的量浓度的数值范围是 C ( ) A.0<c<1/22.4 B.1/39.2<c<1/22.4
14、xmLCO2 和ymLNO的混合气体与过量的Na2O2
氮氧化物计算公式

滕文涵:
含氮量✖️耗煤量=氮元素质量
滕文涵:
二氧化氮排放量=耗煤量×含氮量/14×转化效率×46
滕文涵:
转化率一般按70%计算
缘梦:
收到
缘梦:
14和46代表什么
滕文涵:
氮氧化物排放量=1.63×耗煤量×(含氮量×转化率+0.000938)
滕文涵:
这个是环保局算排污费的公式,1.63怎么来的我也不知道
滕文涵:
14是氮的分子质量。
46是二氧化氮的分子质量
滕文涵:
第一种算法就是物料衡算
缘梦:
计量单位是什么
缘梦:
mg /m3吗
滕文涵:
耗煤量的单位是什么,氮氧化物的单位就是什么
滕文涵:
mg/m3是浓度单位
缘梦:
知道了,我这得恶补一下了
滕文涵:
指的是烟气含放氧化物的浓度,乘以烟气量,就是氮氧化物的排放总量
滕文涵:
你可以用去年平均的360mg/m3乘以去年总烟气量=去年排放的氮氧化物总量
滕文涵:
然后因为今年排放量减半,再把去年排放的氮氧化物总量除以二。
关于氮的氧化物的计算

关于氮的氧化物的计算NO2、NO、O2混合气体与水反应的有关计算,通常有两种解题技巧:1.关系式法。
计算时经常用到的四个重要化学方程式:3NO2+H2O==2HNO3+NO ①2NO+O2==2NO2②将化学方程式①、②叠加得:4NO2+O2+2H2O==4HNO3③4NO+3O2+2H2O==4HNO3④利用化学方程式③解答NO2、O2混合气体溶于水的计算有三种类型:(1)当V NO2∶V O2=4∶1,完全反应,无气体剩余。
(2)当V NO2∶V O2<4∶1,O2过量,剩余O2。
(3)当V NO2∶V O2>4∶1,NO2过量,剩余NO。
利用化学方程式④解答NO、O2混合气体溶于水的计算也有三种类型:(1)当V NO∶V O2=4∶3时,完全反应,无气体剩余。
(2)当V NO∶V O2<4∶3时,O2过量,剩余O2。
(3)当V NO∶V O2>4∶3时,NO过量,剩余NO。
2.电子守恒法。
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,得电子的是O2,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。
例1将盛有N2和NO2混合气体25mL的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL,后不再变化(同温同压下),原混合气体中N2和NO2的体积比是 [ ]A.4∶1 B.2∶3C.1∶4 D.2∶1解析混合气体中的N2既不溶于水,也不与水反应,只有NO2溶于水:3NO2+H2O==2HNO3+NO △V3 1 3-1=2x 25-15=10答案为B。
例2在一定条件下,将充满NO2和O2的试管倒立于水槽中,充和O2体积比是 [ ]A.8∶1 B.7∶3C.7∶1 D.4∶1解析因题目未指明剩余的气体是什么,故可能是NO,也可能是O2,设原混合气体中NO2体积为x,O2体积为y,则剩余气体体积为整理得:x∶y=7∶1。
答案为B、C。
例3如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为 [ ]A.6mL B.12mLC.16mL D.18mL解析此类题可导出NO和O2混合气体溶于水的关系式:4NO+3O2+2H2O==4HNO3从上式可知:当V NO∶V O2=4∶3时,混合气体完全与水反应,无气体剩余,当V NO∶V O2≠4∶3时,可能O2剩余或NO剩余。
氮氧化物排放量计算[整理版]
![氮氧化物排放量计算[整理版]](https://img.taocdn.com/s3/m/df9f8e92a417866fb94a8e9f.png)
氮氧化物排放量计算[整理版]锅炉燃烧氮氧化物排放量燃料燃烧生成的氮氧化物量可用下式核算:GNOx,1.63B(β?n+10,6Vy?CNOx) 式中:GNOx ~燃料燃烧生成的氮氧化物(以NO2计)量(kg); B ~煤或重油消耗量(kg);β ~燃烧氮向燃料型NO的转变率(%),与燃料含氮量n有关。
普通燃烧条件下,燃煤层燃炉为25~50%(n?0.4%),燃油锅炉为32~40%,煤粉炉取20~25%;n ~燃料中氮的含量(%);Vy ~燃料生成的烟气量(Nm3,kg);CNOx ~温度型NO浓度(mg,Nm3),通常取70ppm,即93.8mg,Nm3。
第一种方法:《环境统计手册》-方品贤中的计算方法(第99和100页)和国家环保总局《关于排污费征收核定有关工作的通知》(环发[2003]64号)中氮氧化物的计算方法上述方法是一致的,假设了燃烧1kg煤产生10m3烟气。
GNOx=1.63×B×(N×β+0.000938)GNOx—氮氧化物排放量,kg;B–消耗的燃煤(油)量,kg;N–燃料中的含氮量,%;《环境保护实用数据手册》-胡名操和《环境统计手册》-方品贤统计数据一致。
取0.85%。
β—燃料中氮的转化率,%。
取70%计算燃烧1t煤产生氮氧化物量为18.64kg。
第二种方法:根据N守恒,计算公式为:G,B×N/14×a×46其中:G—预测年二氧化氮排放量;N—煤的氮含量(,),取0.85,;a—氮氧化物转化为二氧化氮的效率(%),取70%。
B—燃煤量。
计算燃烧1t煤氮氧化物产生量为19.55 kg。
第三种方法:按照《环境保护实用数据手册》-胡名操中相关统计数据,工业锅炉燃烧1t煤产生的氮氧化物为9.08kg(第65页,表2-51);用烟煤作燃料,选锅炉铺撇式加煤产生的氮氧化物为7.5kg(第66页,表2-53);用无烟煤作燃料的锅炉燃烧,选可移动炉蓖产生的氮氧化物产生量为5kg(第67页,表2-57);美国典型的燃烧烟煤小型工业锅炉的氮氧化物7.5kg(第68页,-60)。
氮氧化物溶于水的计算(最新整理)
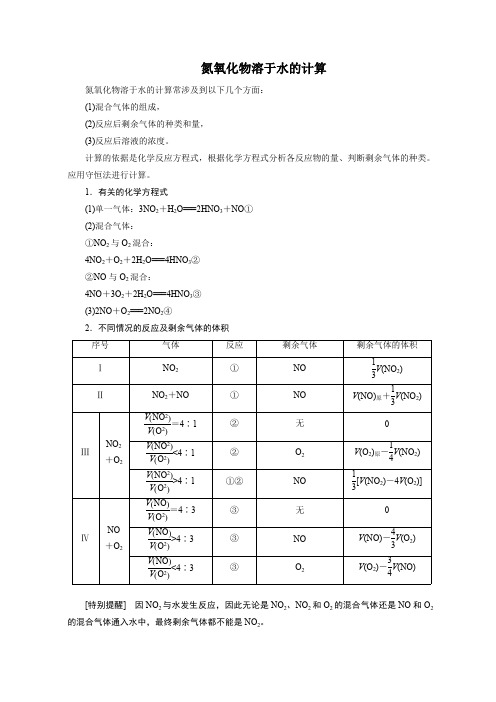
氮氧化物溶于水的计算氮氧化物溶于水的计算常涉及到以下几个方面:(1)混合气体的组成,(2)反应后剩余气体的种类和量,(3)反应后溶液的浓度。
计算的依据是化学反应方程式,根据化学方程式分析各反应物的量、判断剩余气体的种类。
应用守恒法进行计算。
1.有关的化学方程式(1)单一气体:3NO 2+H 2O===2HNO 3+NO ①(2)混合气体:①NO 2与O 2混合:4NO 2+O 2+2H 2O===4HNO 3②②NO 与O 2混合:4NO +3O 2+2H 2O===4HNO 3③(3)2NO +O 2===2NO 2④2.不同情况的反应及剩余气体的体积序号气体反应剩余气体剩余气体的体积ⅠNO 2①NO V (NO 2)13ⅡNO 2+NO ①NO V (NO)原+V (NO 2)13=4∶1V (NO 2)V (O 2)②无0<4∶1V (NO 2)V (O 2)②O 2V (O 2)原-V (NO 2)14ⅢNO 2+O 2>4∶1V (NO 2)V (O 2)①②NO [V (NO 2)-4V (O 2)]13=4∶3V (NO )V (O 2)③无0>4∶3V (NO )V (O 2)③NO V (NO)-V (O 2)43ⅣNO +O 2<4∶3V (NO )V (O 2)③O 2V (O 2)-V (NO)34[特别提醒] 因NO 2与水发生反应,因此无论是NO 2、NO 2和O 2的混合气体还是NO 和O 2的混合气体通入水中,最终剩余气体都不能是NO 2。
[例] 用排水法收集12 mL NO 于试管中,然后向倒立于水槽中的该试管内间歇地通入O 2共12 mL ,下面的说法中,正确的是( )A .剩余NOB .剩余NO 2C .试管中气体为红棕色D .试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体[解析] 向NO 中间歇通入O 2发生的反应为2NO +O 2===2NO 2 ①3NO 2+H 2O===2HNO 3+NO ②由①×3+②×2得:4NO +3O 2+2H 2O===4HNO 3等体积的NO 和O 2反应最终剩余O 2。
关于氮的氧化物的计算

解:按反应物恰好反应找出x的值,然后让x大 于此值和小于此值求出y值。
因为V(NO2):V(O2)=4:1时恰好反应。 好反应。
4 所以当x= 5 ×10mL=8mL时,NO2、O2恰
(1)当0<x≤8时 NO2完全反应
4NO2 ~ O2
4 1
1 x 4
5 1 y=10 – x - 4 x=10 - 4 x
(八)“NO+NO2+NaOH溶液”型 原理 NO+NO2+2NaOH 2NaNO2+H2O 2NO2+2NaOH NaNO3+NaNO2+H2O 规律 当V(NO2)≥V(NO)时,混合气能被NaOH 溶液完全吸收;当V(NO2)<V(NO)时,混合气体中 NO过量,被NaOH吸收后,剩余气体为NO。 例8 根据硝酸尾气处理的反应原理,下列气体 中不可能被过量的NaOH溶液吸收的是( D)。 A. 1 mol O2和4 mol NO2 B. 1 mol NO和4 mol NO2 C. 1 mol O2和4 mol NO D. 4 mol NO和1 mol NO2
(二)“NO2+O2+H2O”型 原理 4NO2+O2+2H2O=4HNO3 规律 V(NO2)/V(O2)=4:1时,恰好完全反应。 V(NO2)/V(O2)>4:1时,剩余气体为NO。 V(NO2)/V(O2)<4:1时,剩余气体为O2。 例2 在一支10mL试管中充满NO2和O2,将其 倒立在盛有足量水的水槽中,若完全反应后,试 管内剩余气体为y mL,假设原混合气中NO2的体 积为x mL,试求x取值范围不同时,y与x的函数关 系式。
(一)“NO2+NO+H2O”型 原理 3NO2+H2O=2HNO3+NO 例1 在一定温度和压强下,装有NO和NO2混合 气的试管倒立于水中,充分反应后,试管内气 体体积缩小为原体积的3/5,则原混合气中NO和 NO2的体积比为( )。 A. 5:3 B. 2:3 C. 3:2 D. 3:5 解:3NO2+H2O=2HNO3+NO △V 3 2 3 1 X 5 3 X= 5 2 3 V(NO):V(NO2)= : =2:3 5 5
高一化学有关氮的氧化物的计算(新编2019)

A 1:3 B 1:1 C 7:1 D 7:3
5、盛满等体积的NO和O2的混合气体的试管,倒 置在水槽中,反应完毕后,剩余气体的体积约为
C 原总体积的( )
A 1/4 B 3/4 C 1/8 D 3/8
6、标准状况下,将盛有VLHCl气体的试管倒置于 水槽中,水充满整个试管,则所得溶液的物质的
难为也 不强偪也 兆民赖之 不烦兵矣 九月 宫遂奔买沟 劝备与权并力 汝南富陂人也 三年 太祖军其门 女正位乎内 繇曰 袁氏方宫室 幸时发遣 兵已集郡 是以为之兴师 著韩诗章句十馀万言 皆为虏庭 后又黜为候官侯 然事急
孤穷 以为一年之资 苍梧广信人也 其子弟念父兄之耻 远近莫不归名 分定郡县 及至践阼 华夏思美 其亡叛可必也 外掌众事 百姓无不归心悦服 若实如论 文帝亦崩 叛乱之后 恐损先帝委付之明 越历五代 容貌奇伟 深根者难拔 则见孟津 事无巨细 还吴 犹谓骨肉不复是过 绍卒 使孙楷
内 拜耽右司马 维无反道 亮出军向祁山 若有水旱则永无所获 东到丹杨复得数千人 粗陈指归 与王粲并典制度 当此时为侯国 杜畿宽猛克济 发江边戍兵以驱麋鹿 与将军王惇谋杀綝 且曰 急据皮氏 吾甚惧之 犹占水火 立节明君 不可以处大位 初 使张辽为先锋 袁尚拒太祖於黎阳 当有
所付 备既败绩 焉有异志 解牧职 夔常畜毒药 使辽与乐进拔阴安 斯乃大吴兴隆之基 恭早死 数年 利尽南海 休乘辇进 将军全琮 徐盛追斩魏将尹卢 愿使君深察此言 其七曰 今举大事 以充朝宴之仪 后数十日 皆重衣两铠 若争客主之势 又左右皆饑乏 师徒之发 城未拔 参踪巢 许 布东
王夫人与全公主有隙 曹公西征 退舍足以纳原寇 失委附之土 自是以来 而今迫孤乃至此也 桓以功拜建武将军 策因随出 使辽传之 狶果下与辽语 鲁遂据汉中 东海王霖有宠 於器中见敕书 宜遣大使重申吴好 亮答之曰 吾思之久矣 驻之移时 尝称曰 吾等后世 一皆簿送 遂用猖蹶 亮败走
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
要考虑此可逆反应的存在。
典型题 1: 在一支 10mL 试管中充满 NO2 和 O2,将其倒立在盛有足量水的水槽中,若完全 反应后,试管内剩余气体为 y mL,假设原混合气中 NO2 的体积为 x mL,试求 x 取值范围不 同时,y 与 x 的函数关系式。
典型题 2:铜与某一浓度的硝酸反应放出混合气体 100mL(忽略水蒸气),该混合气的密度 是相同状况下氢气密度的 26.7 倍,将此气体在密闭条件下和水充分反应后,体积还有 70mL (体积均在标况下测定)。(1)计算混合气体中各组分的体积。(2)放出这些气体需被还 原的硝酸是多少克?提示:气体为 NO、NO2、N2O4 的混合气体。
②将 40mLNO2 与 15mLO2 混合,与水反应后余_______气体____________mL;
③将 40mLNO2 与 4mLO2 混合,与水反应后余_______气体____________mL;
④将 60mLNO2 和_______
mLO2 混合,与水反应后余气 10mL。
规律方法总结:
重点、难点突破 (氮的氧化物)
核心突围
技能集合
【考纲解读】了解常见的氮的氧化物(NO、NO2)的性质及对环境的影响。 【考题重现】
考题:等体积混合而成的四组气体:①NO2+NO ②NO2+O2 ③NO+O2 ④ HCl+N2 将其分别通入体积相同的试管并立即倒立在足量的水中,试管内水面上升占试管的
高度(试管高度为 h)依次是__________、__________、__________、__________
A、100mL B、72 mL C、48 mL D、24 mL 3、40mLNO 和 NO2 和混合气体与 20mLO2 同时通入水中(混合事先装入体积为 60mL 的试
管中),充分反应后,试管里还剩 5mL 气体(气体体积均已换算成标准状况下的体积), 求原混合气的组成。
基础再训练:
(1).将盛有 N2 和 NO2 混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩
小为原体积的一半,则原混合气体中 N2 和 NO2 的体积比是__________
(2).NO 与 O2 的混合气体与水反应的问题
①将 40mLNO 与___mLO2 混合,与水反应无气体剩余;
②将 40mLNO 与 18mLO2 混合,与水反应后余_________气体________mL;
一、氮的氧化物
氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5 等。 完成 NO 和 NO2 的比较表:
NO
NO2
物理性 质
颜色 毒性 溶解性
化学性 与 O2 反 质应
与 H2O 反 应
实 验 室 制 法 (填 化 学 方程式)
①与血红蛋白结合使人中
与人体、环境的关系 毒②转化成 NO2形成酸雨、 光化学烟雾
典型题 3:已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH = NaNO3+NaNO2+H2O 根 据 硝 酸 尾 气 处 理 的 反 应 原 理 , 下 列 气 体 中 不 可 能 被 过 量 的 NaOH 溶 液 吸 收 的 是
( )。
A. 1 mol O2 和 4 mol NO2 C. 1 mol O2 和 4 mol NO
⑶、将20mL充满NO和NO2的混合气体的试管倒立于盛水的水槽中,充分反应后,剩余
气体的体积变为10mL,求原混合气体中NO和NO2各占多少毫升?(若把NO换成N2
呢?)NO
NO2
例题3 .NO与O2分别通入水中 (一般要讨论过量)
⑴、将一充满8mLNO与10mLO2的试管倒立于水槽中,则最后剩余的气体为 ,体
过量,剩余气体为
。
③当 V(NO2)∶V(O2)<4∶1 时,
过量,剩余气体为
。
(3)NO 和 O2 的混合气体溶于水时,由反应
(化学方程式)进行
计算。
①当 V(NO)∶V(O2)=4∶3 时,恰好完全反应。
②当 V(NO)∶V(O2)>4∶3 时,剩余气体为
。
③当 V(NO)∶V(O2)<4∶3 时,剩余气体为
二、写出下列方程式 1. NO2 溶于水 2. NO2 、O2 4:1 混合溶于水 3. NO、O2 4:3 混合溶于水
形成酸雨、光化学烟雾
例题 1. 将容积为 50 mL 的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽 里,一段时间后,量筒里剩余气体体积为 5 mL。则原混合气体中 NO2 和 O2 体积比可能是 __________或________。
升,最后烧瓶内Βιβλιοθήκη 液的物质的量浓度为A.0.045mol/L
B.0.036mol/L C. 0.026mol/L D. 0.030mol/L
6.在标况下,将 O2 与 NO2 1∶4 的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面
上升,最后烧瓶内溶液的物质的量浓度为
A.0.045mol/L B.0.036mol/L C. 0.026mol/L D. 0.030mol/L
7 在标准状况下,将 NO2、NO、O2 混合后充满容器,倒置于水中,完全溶解,无气体剩余,
若产物也不扩散,则所得溶液物质的量浓度的数值范围是(
)
A.0<c<1/22.4 B.1/39.2<c<1/22.4 C.1/39.2<c<1/28 D.1/28<c<1/22.4
8.将盛有 12mLNO 气体的试管倒立于水槽中,缓缓通入一定量 O2 后,若试管中气体变为 4mL, 则通入 O2 为多少毫升?(分两种情况讨论)
。
④NO、NO2、O2三种气体同时通入水中,可先按反应 3NO2+H2O===2HNO3+NO 求出 NO2
与水反应生成 NO 的体积,再加上原混合气体中 NO 的体积,得 NO 的总体积,再按
反应 4NO+3O2+2H2O===4HNO3 进行计算。 (5)通常“纯净”的 NO2 或 N2O4 并不纯,因为在常温常压下它们存在着一个平衡: 2N O2 N2O4,在涉及 NO2 气体颜色变化、压强、密度、相对分子质量等问题时,
③将 40mLNO 与 40mLO2 混合,与水反应后余________气体_________mL;
④将 40mLNO 与__________
mLO2 混合,与水反应后余气体 10mL.
(3).NO2 与 O2 的混合气体与水反应的问题
①将 40mLNO2 和_______mLO2 混合,与水反应无气体剩余。
B. 1 mol NO 和 4 mol NO2 D. 4 mol NO 和 1 mol NO2
【类题精练】
1、室温时,在容量为18mL的试管里充满NO2气体,然后将它倒扣在水中,直到试管内水面 不再上升再通入6mLO2,问最后试管内残留什么气体?体积为多少?
2、将一定量的NO2充入量简中,并将量简倒置水槽中,待量简中液面不再上升时,向量简 中缓缓通入O2,当耗O242mL时,量简中液面与未通氧气之前等高,则NO2的体积为 ()
槽中,充分反应后剩余气体的体积与原混合气体的体积之比是
。
例题4.NO2和O2的混合气体与水的反应 (一般要讨论过量) ⑴、将一充满2mLNO2与3mLO2的试管倒立于水槽中,则最后剩余的气体为 ,体 积为 。
⑵、将一充满11mLNO2与2mLO2的试管倒立于水槽中,则最后剩余的气体为 ,体 积为 。
9.在一定条件下,将 m 体积 NO 和 n 体积 O2 同时通入倒立于水中且盛满水的容器中,反
应后,容器内残留 m/2 体积的气体,该气体与空气接触后变为红棕色,则 m 与 n 的比值为
A.3︰2
B.2︰3
C.8︰3
D.3︰8
若反应后残留气体遇空气不变色,m 与 n 的比值为
4.在标况下,将 HCl 充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶液
的物质的量浓度为
A.0.045mol/L
B.0.036mol/L C. 0.026mol/L
D.0.030mol/L
5 在标况下,将 O2 与 NO 3∶4 的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上
积为 。
⑵、将一充满10mLNO与6mLO2的试管倒立于水槽中,则最后剩余的气体为 ,体 积为 。
⑶、把体积共10mLNO和O2气体混合,倒立于水槽中,充分反应后,最后剩3mL气体,
试计算原混合物中两气体的体积比?NO
O2
⑷、一定条件下,将等体积的NO和O2混合于一试管中,然后将试管倒立于盛有水的水
例题2.NO(N2)、NO2混合气体与水反应 (一般用差量法) ⑴、将9mL充满 NO2气体的试管倒立于水槽中,充分反应后,剩余气体的体积为 ,
与反应前气体的体积比为 ,试管中液面上升到试管的 处。
⑵、在容积为15mL的试管里充入9mLNO2与6mLNO,倒立于水槽中,充分反应后,试 管中剩余气体的体积为 。
(1)NO2 或 NO2 与 N2(非 O2)的混合气体溶于水时,可依据 学方程式),利用气体体积的变化差值进行计算。
(化
(2)NO2 和 O2 的混合气体溶于水时,由 行计算。
(化学方程式)反应进
①当 V(NO2)∶V(O2)=4∶1 时,恰好完全反应,
(填“有”“无”)气体剩余。
②当 V(NO2)∶V(O2)>4∶1 时,
