次氯酸、亚氯酸、氯酸、高氯酸教程文件
《氯的氧化物和含氧酸》 讲义

《氯的氧化物和含氧酸》讲义一、氯的氧化物氯是一种非常活泼的元素,能形成多种氧化物,常见的有一氧化二氯(Cl₂O)、二氧化氯(ClO₂)、三氧化二氯(Cl₂O₃)、五氧化二氯(Cl₂O₅)和七氧化二氯(Cl₂O₇)。
1、一氧化二氯(Cl₂O)一氧化二氯是黄棕色气体,有刺激性气味。
它可由氯气和新制的氧化汞反应制得。
在化学性质方面,一氧化二氯是一种强氧化剂,能与许多物质发生氧化还原反应。
2、二氧化氯(ClO₂)二氧化氯是一种黄绿色到橙黄色的气体,具有强烈刺激性气味。
它在工业上有广泛的应用,例如用于饮用水的消毒、纸浆漂白等。
二氧化氯的制备方法多样,其中一种常见的方法是用氯酸钠和盐酸反应。
二氧化氯具有很强的氧化性,能有效地杀灭细菌、病毒和真菌等微生物。
与传统的消毒剂氯气相比,二氧化氯的消毒效果更好,且不会产生对人体有害的氯化副产物。
3、三氧化二氯(Cl₂O₃)三氧化二氯是一种不稳定的液体,容易分解。
它的制备较为困难,在化学研究中相对较少涉及。
4、五氧化二氯(Cl₂O₅)五氧化二氯是一种白色固体,具有强氧化性。
它可以通过氯酸和五氧化二磷反应制得。
5、七氧化二氯(Cl₂O₇)七氧化二氯是一种无色油状液体,在室温下会挥发。
它是氯的最高价氧化物,具有很强的氧化性和腐蚀性。
二、氯的含氧酸氯的含氧酸包括次氯酸(HClO)、亚氯酸(HClO₂)、氯酸(HClO₃)和高氯酸(HClO₄)。
1、次氯酸(HClO)次氯酸是一种很弱的酸,只存在于溶液中。
它具有强氧化性和漂白性,常用于消毒和漂白。
次氯酸可以通过氯气与水反应生成,反应方程式为:Cl₂+ H₂O ⇌ HCl + HClO 。
次氯酸不稳定,容易分解,光照条件下分解速度加快,分解方程式为:2HClO ⇌ 2HCl + O₂↑ 。
2、亚氯酸(HClO₂)亚氯酸是一种中强酸,具有较强的氧化性。
它的稳定性较差,容易分解。
3、氯酸(HClO₃)氯酸是一种强酸,具有强氧化性。
它可以通过氯酸钡和硫酸反应制得。
次氯酸、亚氯酸、氯酸、高氯酸

次氯酸HClO亚氯酸HClO2氯酸HClO3高氯酸HClO4区别::次氯酸,亚氯酸,氯酸,高氯酸化学式不同,次氯酸的氧化性最强,高氯酸氧化性最弱。
次氯酸的酸性最弱,高氯酸酸性最强。
高氯酸,无机化合物,六大无机强酸之首,氯的最高价氧化物的水化物。
是无色透明的发烟液体。
高氯酸在无机含氧酸中酸性最强。
可助燃,具强腐蚀性、强刺激性,可致人体灼伤。
工业上用于高氯酸盐的制备,人造金刚石提纯,电影胶片制造,医药工业,电抛光工业,用于生产砂轮,除去碳粒杂质,还可用作氧化剂等。
氯酸,化学式为HClO3,是氯元素的含氧酸之一,其中氯的化合价为+5价。
它具有强酸性与强氧化性,可用于制取多种氯酸盐,亦可用作氧化剂。
它可由氯酸钡与硫酸反应制取。
氯酸水溶液在真空中可浓缩到密度1.282,即浓度40.1%。
稀的氯酸溶液是无色的,常温时没有气味,浓溶液呈黄色,有类似硝酸的刺激性气味。
浓度在30%以下的氯酸冷溶液都是稳定的,40%的溶液也可由减压条件下蒸发制取,但是在加热至40℃时或在浓度在超过40%时会发生分解,并剧烈爆炸,产物不一,因此氯酸仅存在于溶液中。
氯酸是不稳定的,会自发发生歧化反应。
亚氯酸,一种氯元素的含氧酸,化学式为HClO2,结构式为H-O-Cl=O,其中氯元素的化合价为+3价。
它的氧化性在各种氯元素的含氧酸中为第二强,但酸性比氯酸和高氯酸弱,强于次氯酸,是一种中强酸。
次氯酸,一种氯元素的含氧酸,化学式为HClO,结构式H-O-Cl,其中氯元素的化合价为+1价,是氯元素的最低价含氧酸,但其氧化性在氯元素的含氧酸中很强,仅次于高氯酸。
它仅存在于溶液中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的、类似氯气的气味,而且极不稳定,是一种很弱的酸,比碳酸弱,和氢硫酸相当。
次氯酸也有很强的漂白作用,它的盐类可用做漂白剂和消毒剂。
次氯酸亚氯酸氯酸高氯酸

次氯酸百科名片次氯酸化学式HClO,结构式H-O-Cl,仅存在于中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的,极不稳定,是很弱的酸,比碳酸弱,和相当;有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂;简介管制信息次氯酸本品根据受公安部门管制,但低浓度产品如消毒液不受管制;名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量性状常温下状态:仅存在于中;水溶液在真空中可浓缩到,即浓度%;加热到40℃时即分解,并发生爆炸;有刺激性气味,溶解性:1:2用途消毒剂,氧化剂;理化性质物质类别:下状态:仅存在于水中;水溶液在真空中可浓缩到密度,即浓度%; 加热到40℃时即分解,并发生爆炸;颜色:无色到浅黄绿显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因:有刺激性气味溶解性与水的体积比:1:2次氯酸是一种化学式为HClO的不稳定;它仅能存在于溶液中,一般用作、、和;在水溶液中,次氯酸部分电离为ClO也称为次氯酸盐和氢离子H+;含有次氯酸根的盐被称为;最广为人知的一种家用次氯酸盐消毒剂是NaClO;化学式HClO;很不稳定,只存在于水溶液中;在光照下,它按下式分解:2HClO─→2HCl+O2因此,次氯酸具有强氧化作用和漂白作用,常用漂白粉的主要成分就是; 当纯净的氯气通入水中时,会形成次氯酸和HCl,:Cl2 + H2O → HClO + HCl次氯酸HClO是游离氯的较强形式,盐酸的pH和碱度均低于它;次氯酸不稳定,易分解,放出;当氯水受日光照射时,次氯酸的分解加速了;次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和相当;有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉次氯酸钙和碱式氯化钙的的有效成分;漂白粉可由氯和消石灰反应而制得:3CaOH2+2Cl2=CaClO2+CaCl2·CaOH2·H2O+H2O在放置漂白粉的地方具有氯的气味,就是因为有氧化二氯放出的缘故;次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:一,在阳光直接作用下,按第一种形式分解;在有脱水物质如CaCl2存在时,按第二种形式分解;加热时特别容易按第三种形式分解;如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O 二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO三,氯气与水反应生成次氯酸:H2O+Cl2=HCl+HClO将氯气通入混有粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液;制法实验室制法:由次氯酸钙与二氧化碳或作用后过滤可得高纯滤液;高中课本制法:与浓盐酸加热制取氯气氯酸钾与浓盐酸反应制备氯气再与水作用工业制法:由氯气、四氯化碳·水与氧化汞共摇荡后蒸馏而得;用途次氯酸是一种, 能杀死水里的细菌,所以自来水常用氯气 1L水里通入约氯气来杀菌消毒;次氯酸能使和有机色质褪色,一般用作漂白剂、氧化剂、除臭剂和消毒剂;在生物学中,次氯酸被嗜白细胞Neutrophil用来杀灭;它被广泛用于游泳池的产品;亚氯酸亚氯酸HClO2,英文名:chlorous acid氧化性很强,比和,氧化性 HClO>HClO2>HClO3>HClO4;是目前所知唯一的亚卤酸;同时,它也是氯的含氧酸中最不稳定的; 亚氯酸很不稳定,容易分解,在几分钟之内便可生成Cl2、ClO2和H2O;HClO2→Cl2+ClO2+H2O ,但生成的盐类——亚氯酸盐相对稳定,亚氯酸钠是生产二氧化氯的原料之一1制备①ClO2在水中分解:2ClO2 + H2O → HClO2 + HClO3②通ClO2于Na2O2或NaOH与H2O2可得亚氯酸盐2ClO2 + Na2O2 → 2NaClO2 + O2;2ClO2 + H2O2 + OH-→ 2ClO2- +O2 + H2O三、HClO2可由亚氯酸钡与稀硫酸的反应制备:BaClO22 + H2SO4 → BaSO4 + 2HClO2滤去沉淀即可得亚氯酸溶液;2性质与用途①非常不稳定的,但亚氯酸盐较稳定;②具有漂白性HClO,HClO2,HClO3都有漂白性,一般用NaClO2加到水中从而生成HClO2补充:亚氯酸化学式:HClO2酸性:高氯酸>氯酸>亚氯酸>次氯酸氧化性与酸性的排列相反由氯的+3氧化态的形成的含氧酸,只存在与溶液中;理论上酸酐为Cl2O3,实际上不存在这种物质;可由一氧化二氯和按1:1混合后与碱反应制得其盐:6NaOH+Cl2O+4ClO2=6NaClO2+3H2O亚氯酸的盐在水中普遍较稳定,但都是危险的,加热或撞击会立刻发生爆炸,分解为氯酸盐等产物;例如4NaClO2=2NaCl+2NaClO3+O2↑;氯酸拼音:lvsuan英文名称:chloric acidCAS RN:7790-93-4分子式:HClO3分子量:说明:化学式:HClO3,其中氯为正五价.HClO3 仅存在于中,是一种pKa: ;在真空中可浓缩到密度,即%;加热到40℃时即分解,并发生爆炸;浓酸浅黄色,有类似的刺激性气味;稀酸无色,在常温时没有气味;有强烈,常用作;由溶液与作用后,经过滤、蒸浓而得;方程式:BaClO32+H2SO4=====2HClO3+BaSO4沉淀氯酸浓度在超过40%时发生分解,并剧烈爆炸:8HClO3=====4HClO4+2H2O+3O2↑+2Cl2↑产生大量气体,爆炸效果与类似有强烈氧化性略弱于但强于碘酸,硫酸,常用作强氧化剂.它与金属反应一般不生成氢气,浓度较高的氯酸与铜反应会生成ClO2气体;高氯酸百科名片高氯酸高氯酸,无机化合物,氯的含氧酸;是无色透明的发烟液体;高氯酸在无机酸中最强;可,具强腐蚀性、强刺激性,可致人体灼伤;工业上用于高氯酸盐的制备,人造金刚石提纯,制造,医药工业,电抛光工业,用于生产砂轮,除去碳粒杂质,还可用作氧化剂等;高氯酸简介管制信息高氯酸腐蚀本品根据受公安部门管制;名称中文名称:高氯酸中文别名:过氯酸英文别名: perchloric acid化学式HClO4相对分子质量成分/组成信息有害物成分含量 CAS No.高氯酸 70~72% 7601-90-3编码信息CAS号7601-90-3EINECS号231-512-4InChIInChI=1/ClHO4/c2-13,45/hH,2,3,4,5理化性质性状无水酸为无色透明液体;有;不稳定,易分解;极易吸湿;大气压下蒸馏分解,有时会发生强烈爆炸;能与水任意混溶,并与水起猛烈作用而放出热;一般商品为70%~72%的水溶液;相对密度 d22;熔点-112℃;沸点19;受热130℃易爆炸;对皮肤和粘膜有腐蚀性,误服或吸入后,会引起强烈刺激症状;可灼伤人体;高氯酸是;与、、易燃物如、等接触或混合时有引起燃烧爆炸的危险;在室温下分解,加热则爆炸,产生气体;酸性无机纯酸中酸性最强;键角109°28′高氯酸根离子的结构 1张熔点-122沸点130爆炸相对密度水=1:溶解性与水混溶氧化性虽然中心氯原子为+7价,但此氯原子由于周围的氧而成,因此氧化性不强,但在浓热时为强氧化剂,可将多种还原剂氧化,与有机物爆炸性反应,甚至在加热条件下能将MnO2氧化为HMnO4,稀溶液的氧化性较硝酸、次氯酸、亚氯酸、氯酸、硫酸、、弱,和碘酸类似;浓酸氧化产物为氯化氢、氯酸,还有等气体,稀溶液被还原得氯离子和水;氯的含氧酸的氧化性比较>>>高氯酸酸性高氯酸的酸性是自然形成的中酸性最强的;用途分析上用作氧化剂和从中分离;分析铁合金中磷、、和;钾的定量;溶解;危险性及安全措施危险性概述健康危害:本品有强烈;皮肤粘膜接触、误服或吸入后,引起强烈刺激症状;燃爆危险:本品,具强腐蚀性、强刺激性,可致人体灼伤;安全措施泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入;建议应急处理人员戴自给正压式呼吸器,穿;不要直接接触泄漏物;勿使泄漏物与还原剂、有机物、易燃物接触;尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间;小量泄漏:用砂土、干燥石灰或苏打灰混合;也可以用大量水冲洗,洗水稀释后放入废水系统;大量泄漏:构筑围堤或挖坑收容;用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置;消防措施燃烧性:不燃危险特性:强氧化剂;与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险;在室温下分解,加热则爆炸;无水物与水起猛烈作用而放热;具有强氧化作用和腐蚀性;有害燃烧产物:氯化氢;灭火方法:考虑到火场中可能存在有机物会引起爆炸,不可轻易接近;灭火剂:、泡沫、、砂土;灭火注意事项:考虑到火场中可能存在有机物会引起爆炸,不可轻易接近;紧急处理吸入:迅速脱离现场至新鲜空气处;保持呼吸道通畅;如呼吸困难,给输氧;如呼吸停止,立即进行人工呼吸;就医;食入:误服者用水漱口,给饮牛奶或蛋清;如没有胃溃疡,应饮用1%碳酸氢钠溶液,如有胃溃疡或不清楚时,服用氢氧化铝或氢氧化镁片剂;就医;皮肤接触:立即脱去被污染衣着,用大量流动清水冲洗,至少15分钟;就医;浓高氯酸碰到手时有强烈的灼热感;手接触高氯酸后具有特征性离皮现象,一般发生在接触24小时后陆续发生离皮,皮脱去后应注意防止进一步感染,一般一周后会痊愈;眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟;就医;泄漏应急处理应急处理:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入;建议应急处理人员戴自给,穿防毒服;不要直接接触泄漏物;勿使泄漏物与有机物、还原剂、易燃物接触;尽可能切断泄漏源;防止流入下水道、排洪沟等限制性空间;小量泄漏:用砂土、干燥石灰或苏打灰混合;大量泄漏:构筑围堤或挖坑收容;用泵转移至或专用收集器内,回收或运至废物处理场所处置;操作处置与储存操作注意事项:密闭操作,局部排风;操作尽可能机械化、自动化;操作人员必须经过专门培训,严格遵守操作规程;建议操作人员佩戴过滤式防毒面具全面罩或自给式呼吸器,穿防毒服,戴;远离火种、热源,工作场所严禁吸烟;防止蒸气泄漏到工作场所空气中;避免与酸类、碱类、胺类接触;尤其要注意避免与水接触;搬运时要轻装轻卸,防止及容器损坏;禁止震动、撞击和摩擦;配备相应品种和数量的消防器材及设备;倒空的容器可能残留有害物;稀释或制备溶液时,应把酸加入水中,避免沸腾和飞溅;储存注意事项:储存于阴凉、通风的库房;远离火种、热源;库温不宜超过30℃;保持容器密封;应与酸类、碱类、胺类等分开存放,切忌混储;储区应备有泄漏应急处理设备和合适的收容材料;接触控制/个体防护MACmg/m3:未制定标准MACmg/m3:未制定标准TLVTN:未制定标准TLVWN:未制定标准监测方法:工程控制:密闭操作,局部排风;尽可能机械化、自动化;提供安全淋浴和洗眼设备;呼吸系统防护:可能接触其蒸气时,必须佩戴过滤式防毒面具全面罩或自给式呼吸器;紧急事态抢救或撤离时,建议佩戴空气呼吸器;眼睛防护:呼吸系统防护中已作防护;身体防护:穿聚乙烯防毒服;手防护:戴橡胶手套;其他防护:工作现场禁止吸烟、进食和饮水;工作完毕,淋浴更衣;单独存放被毒物污染的衣服,洗后备用;保持良好的卫生习惯;毒理学资料急性毒性: LD50:1100 毫克/千克大鼠经口;400 毫克/千克犬经口生态学资料生态毒理毒性:生物降解性:非生物降解性:生物富集或生物积累性:其它有害作用:无资料;废弃处置废弃物性质:废弃处置方法:处置前应参阅国家和地方有关法规;用安全掩埋法处置;废弃注意事项:运输信息危险货物编号:51015UN编号:1873包装类别:O51包装方法:玻璃瓶或塑料桶罐外全开口钢桶;磨砂口玻璃瓶或螺纹口玻璃瓶外普通木箱;安瓿瓶外普通木箱;运输注意事项:铁路运输时应严格按照铁道部危险货物运输规则中的危险货物配装表进行配装;运输时单独装运,运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏;严禁与酸类、易燃物、有机物、还原剂、自燃物品、遇湿易燃物品等并车混运;运输时车速不宜过快,不得强行超车;公路运输时要按规定路线行驶;运输车辆装卸前后,均应彻底清扫、洗净,严禁混入有机物、易燃物等杂质;法规信息法规信息 1987年2月17日国务院发布,化学危险物品安全管理条例实施细则化劳发1992 677号, 1996劳部发423号等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用的分类及标志将该物质划为第类氧化剂;。
元素化学02氯的氧化物和含氧酸及盐

元素化学02氯的氧化物和含氧酸及盐氯是一种常见的元素,具有丰富的化合态。
在化学反应中,氯常常会与氧化物、含氧酸和盐反应,形成不同的化合物。
氯的氧化物包括三种不同的氯氧化物,分别是亚氯酸盐(Cl2O)、次氯酸盐(ClO2)和高氯酸盐(ClO3)。
亚氯酸盐(Cl2O)是由氯和氧直接反应而成的氯氧化物。
它是无色气体,有刺激性气味。
亚氯酸盐与水反应生成亚氯酸(HClO)和次氯酸(HClO2):Cl2O+H2O→2HClO+HClO2次氯酸盐(ClO2)是一种黄色气体,具有强烈的漂白能力。
它与水反应生成次氯酸(HClO2)和酸性氯酸盐(HClO3):ClO2+H2O→HClO2+HClO3高氯酸盐(ClO3)是一种无色晶体,可溶于水。
它与水反应生成高氯酸(HClO3)和高氯酸盐酸(HClO4)。
氯的含氧酸包括次氯酸(HClO)、氯酸(HClO3)和高氯酸(HClO4)。
次氯酸(HClO),也被称为次氯酸,是一种弱酸。
它是一种无色液体,在水中呈弱酸性。
次氯酸具有很强的氧化性,可用作漂白剂、消毒剂和氯化剂。
氯酸(HClO3)是一种无色液体,在水中呈酸性。
氯酸可通过氯气与浓硝酸反应制备。
它是一种强氧化剂,在实验室中被用作制备其他化合物的中间体。
高氯酸(HClO4),也被称为高氯酸,是一种无色液体,在水中呈酸性。
它是一种强氧化剂,具有强烈的腐蚀性。
高氯酸广泛用于有机合成和分析化学中。
氯的盐包括氯化物和高氯酸盐。
氯化物是由氯和其他金属或非金属元素形成的盐类。
常见的氯化物包括氯化钠(NaCl)、氯化钾(KCl)、氯化铜(CuCl2)等。
氯化物具有广泛的应用,包括食盐、水处理和工业冶金等。
高氯酸盐是由高氯酸与其他金属或非金属元素形成的盐类。
高氯酸盐具有很强的氧化性,广泛应用于化学反应和实验室试剂中。
总之,氯的氧化物、含氧酸和盐具有丰富的化合态和多样的应用。
这些化合物在日常生活中具有广泛的用途,例如漂白剂、消毒剂、配制染料等。
次氯酸、亚氯酸、氯酸、高氯酸

次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:一,在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl2)存在时,按第二种形式分解;加热时特别容易按第三种形式分解。
如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O 二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO三,氯气与水反应生成次氯酸:H2O+Cl2=HCl+HClO将氯气通入混有碳酸钙粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液。
制法实验室制法:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液。
高中课本制法:二氧化锰与浓盐酸加热制取氯气氯酸钾与浓盐酸反应制备氯气再与水作用工业制法:由氯气、四氯化碳·水与氧化汞共摇荡后蒸馏而得。
用途次氯酸是一种强氧化剂, 能杀死水里的细菌,所以自来水常用氯气(1L水里通入约0.002g氯气)来杀菌消毒。
次氯酸能使染料和有机色质褪色,一般用作漂白剂、氧化剂、除臭剂和消毒剂。
在生物学中,次氯酸被嗜中性白细胞(Neutro phil)用来杀灭细菌。
它被广泛用于游泳池的含氯消毒剂产品。
亚氯酸亚氯酸(HClO2,英文名:chloro us acid)氧化性很强,比氯酸和高氯酸,氧化性 HClO>HClO2>HClO3>HClO4。
是目前所知唯一的亚卤酸。
同时,它也是氯的含氧酸中最不稳定的。
亚氯酸很不稳定,容易分解,在几分钟之内便可生成C l2、ClO2和H2O。
HClO2→Cl2+ClO2+H2O ,但生成的盐类——亚氯酸盐相对稳定,亚氯酸钠是生产二氧化氯的原料之一(1)制备①ClO2在水中分解:2ClO2+ H2O → HClO2+ HClO3②通ClO2于Na2O2或NaOH与H2O2可得亚氯酸盐2ClO2+ Na2O2→ 2NaClO2 + O2;2ClO2+ H2O2 + OH-→ 2ClO2- +O2 + H2O三、HClO2可由亚氯酸钡与稀硫酸的反应制备:Ba(ClO2)2 + H2SO4→ BaSO4+ 2HClO2滤去硫酸钡沉淀即可得亚氯酸溶液。
次氯酸亚氯酸氯酸高氯酸

次氯酸百科名片次氯酸化学式HClO,结构式H-O-Cl,仅存在于中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂。
简介管制信息次氯酸()本品根据《》受公安部门管制,但低浓度产品如消毒液不受管制。
名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量性状常温下状态:仅存在于中。
水溶液在真空中可浓缩到,即浓度%。
加热到40℃时即分解,并发生爆炸。
有刺激性气味,溶解性:1:2用途消毒剂,氧化剂。
理化性质物质类别:下状态:仅存在于水中。
水溶液在真空中可浓缩到密度,即浓度%。
加热到40℃时即分解,并发生爆炸。
颜色:无色到浅黄绿(显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因):有刺激性气味溶解性(与水的体积比):1:2次氯酸是一种化学式为HClO的不稳定。
它仅能存在于溶液中,一般用作、、和。
在水溶液中,次氯酸部分电离为ClO?(也称为次氯酸盐)和氢离子H+。
含有次氯酸根的盐被称为。
最广为人知的一种家用次氯酸盐消毒剂是(NaClO)。
化学式HClO。
很不稳定,只存在于水溶液中。
在光照下,它按下式分解:2HClO─→2HCl+O2因此,次氯酸具有强氧化作用和漂白作用,常用漂白粉的主要成分就是。
当纯净的氯气通入水中时,会形成次氯酸和(HCl,):Cl2 + H2O → HClO + HCl次氯酸(HClO)是游离氯的较强形式,盐酸的pH和碱度均低于它。
次氯酸不稳定,易分解,放出。
当氯水受日光照射时,次氯酸的分解加速了。
次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的)的有效成分。
次氯酸 亚氯酸 氯酸 高氯酸

次氯酸百科名片强的氧化性和漂白作用,它的盐类可用做漂白剂和消毒剂。
简介管制信息次氯酸(易制爆)本品根据《危险化学品安全管理条例》受公安部门管制,但低浓度产品如消毒液不受管制。
名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量52.5性状常温下状态:仅存在于水溶液中。
水溶液在真空中可浓缩到密度1.282,即浓度40.1%。
加热到40℃时即分解,并发生爆炸。
有刺激性气味,溶解性:1:2用途消毒剂,氧化剂。
理化性质物质类别:无机酸常温下状态:仅存在于水溶液中。
水溶液在真空中可浓缩到密度1.282,即浓度40.1%。
加热到40℃时即分解,并发生爆炸。
颜色:无色到浅黄绿(显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因)气味:有刺激性气味溶解性(与水的体积比):1:23Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O在放置漂白粉的地方具有氯的气味,就是因为有氧化二氯放出的缘故。
次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:一,在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl2)存在时,按第二种形式分解;加热时特别容易按第三种形式分解。
如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O 二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO三,氯气与水反应生成次氯酸:H2O+Cl2=HCl+HClO将氯气通入混有碳酸钙粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液。
制法实验室制法:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液。
高中课本制法:二氧化锰与浓盐酸加热制取氯气氯酸钾与浓盐酸反应制备氯气再与水作用工业制法:由氯气、四氯化碳·水与氧化汞共摇荡后蒸馏而得。
氯酸

的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的混合物)的有效成分。
漂白粉可由氯和消石灰反应而制得:3Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O在放置漂白粉的地方具有氯的气味,就是因为有氧化二氯放出的缘故。
次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:一,在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl2)存在时,按第二种形式分解;加热时特别容易按第三种形式分解。
如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO三,氯气与水反应生成次氯酸:H2O+Cl2=HCl+HClO将氯气通入混有碳酸钙粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液。
制法实验室制法:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液。
高中课本制法:二氧化锰与浓盐酸加热制取氯气氯酸钾与浓盐酸反应制备氯气再与水作用工业制法:由氯气、四氯化碳·水与氧化汞共摇荡后蒸馏而得。
用途次氯酸是一种强氧化剂, 能杀死水里的细菌,所以自来水常用氯气(1L水里通入约0.002g氯气)来杀菌消毒。
次氯酸能使染料和有机色质褪色,一般用作漂白剂、氧化剂、除臭剂和消毒剂。
在生物学中,次氯酸被嗜中性白细胞(Neutrophil)用来杀灭细菌。
它被广泛用于游泳池的含氯消毒剂产品。
亚氯酸亚氯酸(HClO2,英文名:chlorous acid)氧化性很强,比氯酸和高氯酸,氧化性HClO>HClO2>HClO3>HClO4。
是目前所知唯一的亚卤酸。
同时,它也是氯的含氧酸中最不稳定的。
亚氯酸很不稳定,容易分解,在几分钟之内便可生成Cl2、ClO2和H2O。
HClO2→Cl2+ClO2+H2O ,但生成的盐类——亚氯酸盐相对稳定,亚氯酸钠是生产二氧化氯的原料之一(1)制备①ClO2在水中分解:2ClO2 + H2O → HClO2 + HClO3②通ClO2于Na2O2或NaOH与H2O2可得亚氯酸盐2ClO2 + Na2O2 → 2NaClO2 + O2;2ClO2 + H2O2 + OH-→ 2ClO2- +O2 + H2O三、HClO2可由亚氯酸钡与稀硫酸的反应制备:Ba(ClO2)2 + H2SO4 → BaSO4 + 2HClO2滤去硫酸钡沉淀即可得亚氯酸溶液。
高氯酸
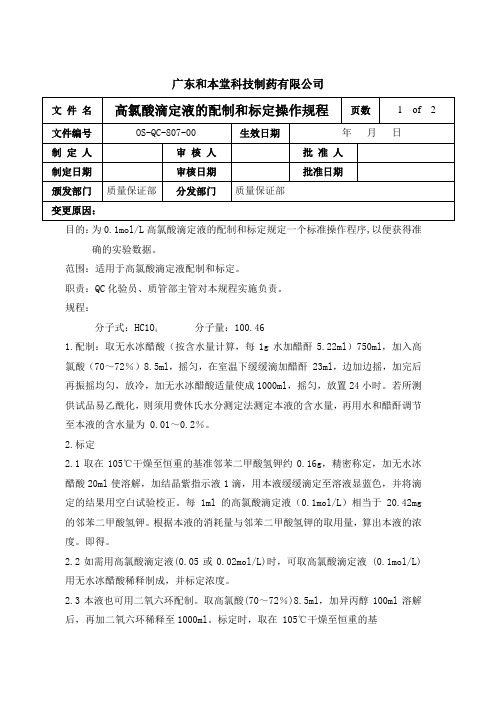
广东和本堂科技制药有限公司目的:为0.1mol/L高氯酸滴定液的配制和标定规定一个标准操作程序,以便获得准确的实验数据。
范围:适用于高氯酸滴定液配制和标定。
职责:QC化验员、质管部主管对本规程实施负责。
规程:分子式:HC1O分子量:100.4641.配制:取无水冰醋酸(按含水量计算,每1g水加醋酐5.22ml)750ml,加入高氯酸(70~72%)8.5ml,摇匀,在室温下缓缓滴加醋酐 23ml,边加边摇,加完后再振摇均匀,放冷,加无水冰醋酸适量使成1000ml,摇匀,放置24小时。
若所测供试品易乙酰化,则须用费休氏水分测定法测定本液的含水量,再用水和醋酐调节至本液的含水量为 0.01~0.2%。
2.标定2.1取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解,加结晶紫指示液1滴,用本液缓缓滴定至溶液显蓝色,并将滴定的结果用空白试验校正。
每 1ml的高氯酸滴定液(0.1mol/L)相当于20.42mg 的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
即得。
2.2如需用高氯酸滴定液(0.05或0.02mol/L)时,可取高氯酸滴定液 (0.1mol/L)用无水冰醋酸稀释制成,并标定浓度。
2.3本液也可用二氧六环配制。
取高氯酸(70~72%)8.5ml,加异丙醇100ml溶解后,再加二氧六环稀释至1000ml。
标定时,取在 105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加丙二醇25ml与异丙醇5ml,加热使溶解,放冷,加二氧六环30ml与甲基橙-二甲苯蓝FF混合指示液数滴,用本液滴定至溶液由绿色变为蓝灰色,并将滴定的结果用空白试验校正,即得。
4.计算公式103WF=────(V1-V)×TF:高氯酸滴定液(0.1mol/L)的浓度校正因子,即实际摩尔浓度与理论浓度的比值;V1:高氯酸滴定液的消耗体积(ml);V:空白溶液消耗高氯酸滴定液的体积(ml);W:基准邻苯二甲酸氢钾的称样量(g);T:每1ml的高氯酸滴定液(0.1mol/L)相当于邻苯二甲酸氢钾20.42mg。
次氯酸亚氯酸氯酸高氯酸

次氯酸亚氯酸氯酸高氯酸Pleasure Group Office【T985AB-B866SYT-B182C-BS682T-STT18】次氯酸百科名片次氯酸化学式HClO,结构式H-O-Cl,仅存在于中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂。
简介管制信息次氯酸()本品根据《》受公安部门管制,但低浓度产品如消毒液不受管制。
名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量性状常温下状态:仅存在于中。
水溶液在真空中可浓缩到,即浓度%。
加热到40℃时即分解,并发生爆炸。
有刺激性气味,溶解性:1:2用途消毒剂,氧化剂。
理化性质物质类别:下状态:仅存在于水中。
水溶液在真空中可浓缩到密度,即浓度%。
加热到40℃时即分解,并发生爆炸。
颜色:无色到浅黄绿(显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因):有刺激性气味溶解性(与水的体积比):1:2次氯酸是一种化学式为HClO的不稳定。
它仅能存在于溶液中,一般用作、、和。
在水溶液中,次氯酸部分电离为ClO(也称为次氯酸盐)和氢离子H+。
含有次氯酸根的盐被称为。
最广为人知的一种家用次氯酸盐消毒剂是(NaClO)。
化学式HClO。
很不稳定,只存在于水溶液中。
在光照下,它按下式分解:2HClO─→2HCl+O2因此,次氯酸具有强氧化作用和漂白作用,常用漂白粉的主要成分就是。
当纯净的氯气通入水中时,会形成次氯酸和(HCl,):Cl2 + H2O → HClO + HCl次氯酸(HClO)是游离氯的较强形式,盐酸的pH和碱度均低于它。
次氯酸不稳定,易分解,放出。
当氯水受日光照射时,次氯酸的分解加速了。
次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和相当。
次氯酸 亚氯酸 氯酸 高氯酸

次氯酸百科名片次氯酸化学式HClO,结构式H-O-Cl,仅存在于中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂。
简介管制信息次氯酸()本品根据《》受公安部门管制,但低浓度产品如消毒液不受管制。
名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量性状常温下状态:仅存在于中。
水溶液在真空中可浓缩到,即浓度%。
加热到40℃时即分解,并发生爆炸。
有刺激性气味,溶解性:1:2用途消毒剂,氧化剂。
理化性质物质类别:下状态:仅存在于水中。
水溶液在真空中可浓缩到密度,即浓度%。
加热到40℃时即分解,并发生爆炸。
颜色:无色到浅黄绿(显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因):有刺激性气味溶解性(与水的体积比):1:2次氯酸是一种化学式为HClO的不稳定。
它仅能存在于溶液中,一般用作、、和。
在水溶液中,次氯酸部分电离为ClO?(也称为次氯酸盐)和氢离子H+。
含有次氯酸根的盐被称为。
最广为人知的一种家用次氯酸盐消毒剂是(NaClO)。
化学式HClO。
很不稳定,只存在于水溶液中。
在光照下,它按下式分解:2HClO─→2HCl+O2因此,次氯酸具有强氧化作用和漂白作用,常用漂白粉的主要成分就是。
当纯净的氯气通入水中时,会形成次氯酸和(HCl,):Cl2 + H2O → HClO + HCl次氯酸(HClO)是游离氯的较强形式,盐酸的pH和碱度均低于它。
次氯酸不稳定,易分解,放出。
当氯水受日光照射时,次氯酸的分解加速了。
次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的)的有效成分。
氯元素的氧化物范文

氯元素的氧化物范文氯元素的氧化物是指由氯原子和氧原子组成的化合物。
氯元素可以形成的氧化物有三个主要的,分别是氯氧化物(Cl2O)、次氯酸(HClO)和高氯酸(HClO3)。
下面将对这三种氯元素的氧化物逐个进行详细介绍。
首先是氯氧化物(Cl2O)。
氯氧化物是由两个氯原子和一个氧原子组成的化合物。
氯氧化物是一种黄色气体,在室温下会迅速分解为氯气和氧气。
氯氧化物在水中溶解时会生成亚氯酸(HClO),所以它也可看做是亚氯酸的酸酐。
氯氧化物在实验室中用作有机合成的试剂和漂白剂。
次氯酸(HClO)是由氯原子、氧原子和氢原子组成的化合物。
次氯酸是一种无色液体,具有较强的氧化性和漂白性。
次氯酸在水中可以形成次氯酸溶液,常温下使物质褪色、褪味和杀灭细菌。
次氯酸是一种重要的漂白剂和消毒剂,广泛应用于水处理、医疗卫生等方面。
高氯酸(HClO3)是由氯原子、氧原子和氢原子组成的化合物。
高氯酸是无色晶体,可溶于水。
高氯酸是一种强氧化剂,在化学实验中常用于氧化反应。
高氯酸也可以被还原为次氯酸和氯酸,具有较强的腐蚀性。
高氯酸在工业中用作氧化剂、杀菌剂和发射火箭燃料的组成部分。
除了这三种主要的氯元素氧化物,还有其他一些次要的氯氧化物,如四氧化二氯(ClO2)、三氧化氯(Cl2O3)和氯酸(HClO4)。
这些氯元素氧化物在化学反应中也有一定的应用价值。
总的来说,氯元素的氧化物是由氯原子和氧原子组成的化合物,具有较强的氧化性和漂白性,广泛应用于有机合成、水处理、医疗卫生等领域。
对于氯元素的氧化物的研究和应用有助于我们更好地理解氯元素的化学性质和利用价值。
cl含氧酸根立体结构

cl含氧酸根立体结构一、氯的含氧酸根有哪些呢?氯有多种含氧酸根哦,像次氯酸根(ClO⁻)、亚氯酸根(ClO₂⁻)、氯酸根(ClO₃⁻)还有高氯酸根(ClO₄⁻)。
这些含氧酸根在化学世界里就像一个个独特的小家族,各有各的特点呢。
二、次氯酸根(ClO⁻)的立体结构。
次氯酸根的结构比较简单。
它是一个直线型的结构哦。
氯原子在中间,氧原子在一侧,就像两个小伙伴手拉手站成一排。
氯原子和氧原子之间有一个共价键,这个键就像它们之间的小绳子,把它们紧紧地连在一起。
在这个结构里,氯原子最外层有7个电子,它和氧原子共用一对电子,这样氯原子就达到了8电子的稳定结构啦。
氧原子呢,最外层本来有6个电子,和氯原子共用一对后,也变得稳定了。
三、亚氯酸根(ClO₂⁻)的立体结构。
亚氯酸根的结构就有点不一样啦。
它是V形的结构哦。
中间是氯原子,周围有两个氧原子。
这两个氧原子和氯原子的连接方式就像是一个小夹角。
氯原子在这个结构里,它的电子分布发生了有趣的变化。
它和两个氧原子之间有共价键,而且由于氧原子的吸引电子的能力比较强,会让氯原子周围的电子云有一点偏向氧原子呢。
这种结构使得亚氯酸根有它独特的化学性质,就像它有自己的小脾气一样。
四、氯酸根(ClO₃⁻)的立体结构。
氯酸根的立体结构是三角锥形的。
氯原子在中心,三个氧原子在它的周围。
想象一下,氯原子像一个小头目,周围有三个氧原子小弟围着它。
每个氧原子和氯原子之间都有共价键相连。
在这个结构里,氯原子的杂化方式是sp³杂化哦。
这种杂化方式就决定了它是三角锥形的结构。
而且由于氧原子的存在,整个氯酸根离子带有一个负电荷,这个负电荷使得它能够在溶液中自由移动,和其他离子或者分子发生各种有趣的化学反应。
五、高氯酸根(ClO₄⁻)的立体结构。
高氯酸根的结构是正四面体结构呢。
氯原子在正四面体的中心,四个氧原子在正四面体的四个顶点上。
这就像是一个非常完美对称的结构。
每个氧原子和氯原子之间的共价键都是一样的,它们之间的键长和键角都非常稳定。
《走进含氯消毒剂——次氯酸盐》课件人教版共22页文档

16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰
次氯酸 亚氯酸 氯酸 高氯酸

次氯酸百科名片次氯酸化学式HClO,结构式H-O-Cl,仅存在于中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂。
简介管制信息次氯酸()本品根据《》受公安部门管制,但低浓度产品如消毒液不受管制。
名称中文名称:次氯酸英文名:hypochlorous acid化学式分子式HClO结构式:H-O-Cl相对分子质量性状常温下状态:仅存在于中。
水溶液在真空中可浓缩到,即浓度%。
加热到40℃时即分解,并发生爆炸。
有刺激性气味,溶解性:1:2用途消毒剂,氧化剂。
理化性质物质类别:下状态:仅存在于水中。
水溶液在真空中可浓缩到密度,即浓度%。
加热到40℃时即分解,并发生爆炸。
颜色:无色到浅黄绿(显色有变化是因为反应Cl2+H2O=HCIO+HCl是可逆反应,在不同状态下平衡状态也不同,显黄绿色是因为溶有氯气的原因):有刺激性气味溶解性(与水的体积比):1:2次氯酸是一种化学式为HClO的不稳定。
它仅能存在于溶液中,一般用作、、和。
在水溶液中,次氯酸部分电离为ClO?(也称为次氯酸盐)和氢离子H+。
含有次氯酸根的盐被称为。
最广为人知的一种家用次氯酸盐消毒剂是(NaClO)。
化学式HClO。
很不稳定,只存在于水溶液中。
在光照下,它按下式分解:2HClO─→2HCl+O2因此,次氯酸具有强氧化作用和漂白作用,常用漂白粉的主要成分就是。
当纯净的氯气通入水中时,会形成次氯酸和(HCl,):Cl2 + H2O → HClO + HCl次氯酸(HClO)是游离氯的较强形式,盐酸的pH和碱度均低于它。
次氯酸不稳定,易分解,放出。
当氯水受日光照射时,次氯酸的分解加速了。
次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和相当。
有很强的和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的)的有效成分。
高氯酸滴定液配制和标定标准操作规程
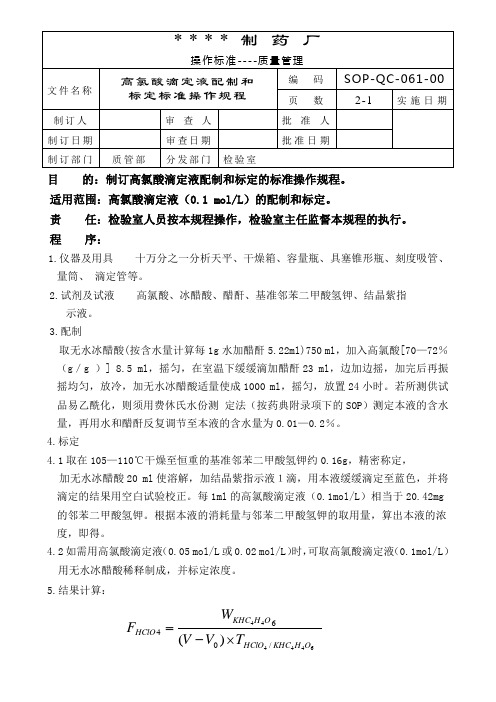
目 的:制订高氯酸滴定液配制和标定的标准操作规程。
适用范围:高氯酸滴定液(0.1 mol/L )的配制和标定。
责 任:检验室人员按本规程操作,检验室主任监督本规程的执行。
程 序:1.仪器及用具 十万分之一分析天平、干燥箱、容量瓶、具塞锥形瓶、刻度吸管、量筒、 滴定管等。
2.试剂及试液 高氯酸、冰醋酸、醋酐、基准邻苯二甲酸氢钾、结晶紫指 示液。
3.配制 取无水冰醋酸(按含水量计算每1g 水加醋酐5.22ml)750 ml ,加入高氯酸[70—72%(g /g )] 8.5 ml ,摇匀,在室温下缓缓滴加醋酐23 ml ,边加边摇,加完后再振摇均匀,放冷,加无水冰醋酸适量使成1000 ml ,摇匀,放置24小时。
若所测供试品易乙酰化,则须用费休氏水份测 定法(按药典附录项下的SOP )测定本液的含水量,再用水和醋酐反复调节至本液的含水量为0.01—0.2%。
4.标定4.1取在105—110℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g ,精密称定, 加无水冰醋酸20 ml 使溶解,加结晶紫指示液1滴,用本液缓缓滴定至蓝色,并将滴定的结果用空白试验校正。
每1ml 的高氯酸滴定液(0.1mol/L )相当于20.42mg 的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
4.2如需用高氯酸滴定液(0.05 mol/L 或0.02 mol/L )时,可取高氯酸滴定液(0.1mol/L )用无水冰醋酸稀释制成,并标定浓度。
5.结果计算:644444/064)(O H KHC HClO O H KHC HClO T V V W F ⨯-=式中:F 表示滴定液的校正因子。
W 表示基准物的取样量。
V 表示基准物消耗滴定液的体积。
V 0表示空白消耗滴定液的体积。
T 表示滴定度。
6.注意事项6.1非水溶液滴定,所用仪器、试剂均不得含有水分,实验室内要绝对防止氨气。
6.2冰醋酸试剂一般都含有水分,可加入醋酐脱水,反应如下: CH 3C =OO + H 2O → 2CH 3COOHCH 3C =O但必须注意不能直接将醋酐加至高氯酸中,因高氯酸与醋酐混合,反应剧烈,放出大量热,故配制时应先用冰醋酸将高氯酸稀释后,再缓缓滴加醋酐。
2.1.3氯化氢盐酸次氯酸课件高一上学期化学沪科版(2020)(1)
【微点拨】
盐酸是HCl的水溶液,属于一元强酸。浓盐酸(37%或12mol·L-1)具有极强的 挥发性,因此盛有浓盐酸的容器打开后挥发出的HCl气体与空气中的水蒸气结合产 生盐酸小液滴,形成白雾。盐酸是胃酸的主要成分,它能够促进食物消化、抵御 微生物感染
3.HCl的制法
(1)实验室制HCl的原理是__高__沸__点___酸__制__低__沸___点__酸___;多余的HCl应__用___水__吸__收_____
①漂白粉应__密__封______、__避___光____保存;并置于___阴__凉____干燥处。
②含氯漂白剂与洁厕剂(含有盐酸)不能混合使用,因为两者混合会反应生 成_氯__气___。
③新型灭菌消毒剂——二氧化氯:杀菌、消毒能力比____氯__气______强。
ClO2在水中的杀菌消毒能力比Cl2强,持效久,受水体酸碱性变化的影响小, 一般无副作用,被世界卫生组织列为安全高效消毒剂。相比于84消毒液等传统的 消毒产品,次氯酸消毒液无任何刺激性,可直接对手部、口腔等人体表皮肌肤处 进行杀菌,被应用为食品级除菌产品。
2.化学性质 (1)水溶液的酸性:: 盐酸是一元强酸,具有酸的通性:_使__指__示___剂__变__色___、与__碱___性__氧__化__物___生__成__盐__和___水___、 _与__碱___生__成__盐__和___水___、_与__活__泼__金___属__放__出__H__2_、__与__盐__生___成__新__酸__和___新__盐___;在盐酸中,
【难点】
1.喷泉实验原理 2.制备氯化氢气体装置的选择、尾气吸收中的防倒吸问题 3.漂白粉和漂白液的生效原理
一.氯化氢、盐酸 1.物理性质: (1)HCl是一种_无___色、_有__刺__激___性___气味的__气__体;_极__易__溶__于___水__(_1_:_5_0_0__)_于水。
高氯酸 分解

高氯酸分解
高氯酸(perchloric acid)是一种无机化合物,化学式为HClO4,常用于实验室中作为一种强酸。
高氯酸具有强氧化性和腐蚀性,是一种危险品,在处理和储存时需要特别小心。
高氯酸可以通过氯气和水反应制备而成。
这个反应过程需要慎重操作,因为氯气具有毒性和刺激性。
首先,将氯气通入水中,生成次氯酸(HClO)。
然后,将次氯酸进一步氧化,得到高氯酸。
这个过程需要在低温下进行,以避免产生不稳定的氯酸盐。
高氯酸是一种无色液体,具有刺激性气味。
它在常温下可以溶于水,生成高氯酸溶液。
高氯酸溶液是一种强酸,具有强烈的腐蚀性。
它可以与金属反应,产生氯气和相应的金属盐。
在实验室中,高氯酸溶液常用于清洗实验器皿和去除金属表面的氧化物。
高氯酸在有机合成中也有广泛的应用。
它可以用作氧化剂,将有机物氧化为相应的羧酸。
由于高氯酸的强氧化性,这个反应也是高选择性的。
除了氧化反应,高氯酸还可以用于酯化反应和酰化反应等有机合成反应。
在实验室中使用高氯酸时,需要注意其腐蚀性和毒性。
高氯酸溶液应该放置在密闭容器中,并远离可燃物和有机物。
在操作时,应佩戴防护眼镜和手套,以防止高氯酸溅入眼睛或接触皮肤。
如果不小心接触到高氯酸,应立即用大量清水冲洗,并寻求医疗帮助。
高氯酸是一种具有强氧化性和腐蚀性的化合物。
它可以通过氯气和水反应制备而成,并在实验室和有机合成中有广泛的应用。
然而,由于其危险性,使用高氯酸时需要严格遵守安全操作规程,以确保实验的安全进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:一,在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl2)存在时,按第二种形式分解;加热时特别容易按第三种形式分解。
如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O 二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO三,氯气与水反应生成次氯酸:H2O+Cl2=HCl+HClO将氯气通入混有碳酸钙粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液。
制法实验室制法:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液。
高中课本制法:二氧化锰与浓盐酸加热制取氯气氯酸钾与浓盐酸反应制备氯气再与水作用工业制法:由氯气、四氯化碳·水与氧化汞共摇荡后蒸馏而得。
用途次氯酸是一种强氧化剂, 能杀死水里的细菌,所以自来水常用氯气(1L水里通入约0.002g氯气)来杀菌消毒。
次氯酸能使染料和有机色质褪色,一般用作漂白剂、氧化剂、除臭剂和消毒剂。
在生物学中,次氯酸被嗜中性白细胞(Neutrophil)用来杀灭细菌。
它被广泛用于游泳池的含氯消毒剂产品。
亚氯酸亚氯酸(HClO2,英文名:chlorous acid)氧化性很强,比氯酸和高氯酸,氧化性 HClO>HClO2>HClO3>HClO4。
是目前所知唯一的亚卤酸。
同时,它也是氯的含氧酸中最不稳定的。
亚氯酸很不稳定,容易分解,在几分钟之内便可生成Cl2、ClO2和H2O。
HClO2→Cl2+ClO2+H2O ,但生成的盐类——亚氯酸盐相对稳定,亚氯酸钠是生产二氧化氯的原料之一(1)制备①ClO2在水中分解:2ClO2 + H2O → HClO2 + HClO3②通ClO2于Na2O2或NaOH与H2O2可得亚氯酸盐2ClO2 + Na2O2 → 2NaClO2 + O2;2ClO2 + H2O2 + OH-→ 2ClO2- +O2 + H2O三、HClO2可由亚氯酸钡与稀硫酸的反应制备:Ba(ClO2)2 + H2SO4 → BaSO4 + 2HClO2滤去硫酸钡沉淀即可得亚氯酸溶液。
(2)性质与用途①非常不稳定的化合物,但亚氯酸盐较稳定。
②具有漂白性(HClO,HClO2,HClO3都有漂白性,一般用NaClO2加到水中从而生成HClO2)补充:亚氯酸化学式:HClO2酸性:高氯酸>氯酸>亚氯酸>次氯酸氧化性与酸性的排列相反由氯的+3氧化态的形成的含氧酸,只存在与溶液中。
理论上酸酐为Cl2O3,实际上不存在这种物质。
可由一氧化二氯和二氧化氯按1:1混合后与碱反应制得其盐:6NaOH+Cl2O+4ClO2=6NaClO2+3H2O亚氯酸的盐在水中普遍较稳定,但都是危险的,加热或撞击会立刻发生爆炸,分解为氯酸盐等产物。
例如4NaClO2=2NaCl+2NaClO3+O2↑。
氯酸拼音:lvsuan英文名称:chloric acidCAS RN:7790-93-4分子式:HClO3分子量:84.45说明:化学式:HClO3,其中氯为正五价.HClO3 仅存在于溶液中,是一种强酸(pKa: -2.7)。
水溶液在真空中可浓缩到密度1.282,即浓度40.1%。
加热到40℃时即分解,并发生爆炸。
浓酸浅黄色,有类似硝酸的刺激性气味。
稀酸无色,在常温时没有气味。
有强烈氧化性,常用作化学试剂。
由氯酸钡溶液与硫酸作用后,经过滤、蒸浓而得。
[方程式:Ba(ClO3)2+H2SO4=====2HClO3+BaSO4(沉淀)]氯酸浓度在超过40%时发生分解,并剧烈爆炸:8HClO3=====4HClO4+2H2O+3O2↑+2Cl2↑(产生大量气体,爆炸效果与硝酸铵类似)有强烈氧化性(略弱于溴酸但强于碘酸,硫酸),常用作强氧化剂.它与金属反应一般不生成氢气,浓度较高的氯酸与铜反应会生成ClO2气体。
高氯酸百科名片高氯酸高氯酸,无机化合物,氯的含氧酸。
是无色透明的发烟液体。
高氯酸在无机酸中酸性最强。
可助燃,具强腐蚀性、强刺激性,可致人体灼伤。
工业上用于高氯酸盐的制备,人造金刚石提纯,电影胶片制造,医药工业,电抛光工业,用于生产砂轮,除去碳粒杂质,还可用作氧化剂等。
高氯酸简介管制信息高氯酸(*)(腐蚀)(易制爆)本品根据《危险化学品安全管理条例》受公安部门管制。
名称中文名称:高氯酸中文别名:过氯酸英文别名: perchloric acid化学式HClO4相对分子质量100.46成分/组成信息有害物成分含量 CAS No.高氯酸 70~72% 7601-90-3编码信息CAS号7601-90-3EINECS号231-512-4InChIInChI=1/ClHO4/c2-1(3,4)5/h(H,2,3,4,5)理化性质性状无水酸为无色透明液体。
有挥发性。
不稳定,易分解。
极易吸湿。
大气压下蒸馏分解,有时会发生强烈爆炸。
能与水任意混溶,并与水起猛烈作用而放出热。
一般商品为70%~72%的水溶液。
相对密度 (d22)1.768。
熔点-112℃。
沸点19(1.47kPa)。
受热(130℃)易爆炸。
对皮肤和粘膜有腐蚀性,误服或吸入后,会引起强烈刺激症状。
可灼伤人体。
高氯酸是强氧化剂。
与有机物、还原剂、易燃物(如硫、磷等)接触或混合时有引起燃烧爆炸的危险。
在室温下分解,加热则爆炸,产生氯化氢气体。
酸性无机纯酸中酸性最强。
键角109°28′高氯酸根离子的结构 (1张)熔点-122沸点130(爆炸)相对密度(水=1):1.76溶解性与水混溶氧化性虽然中心氯原子为+7价,但此氯原子由于周围的氧而成惰性,因此氧化性不强,但在浓热时为强氧化剂,可将多种还原剂氧化,与有机物爆炸性反应,甚至在加热条件下能将MnO2氧化为HMnO4,稀溶液的氧化性较硝酸、次氯酸、亚氯酸、氯酸、硫酸、硒酸、过氧化氢弱,和碘酸类似。
浓酸氧化产物为氯化氢、氯酸,还有二氧化氯等气体,稀溶液被还原得氯离子和水。
氯的含氧酸的氧化性比较次氯酸>亚氯酸>氯酸>高氯酸酸性高氯酸的酸性是自然形成的酸性物质中酸性最强的。
用途分析上用作氧化剂和从钠中分离钾。
分析铁合金中磷、铬、铁和硅。
钾的定量。
溶解金属。
危险性及安全措施危险性概述健康危害:本品有强烈腐蚀性。
皮肤粘膜接触、误服或吸入后,引起强烈刺激症状。
燃爆危险:本品助燃,具强腐蚀性、强刺激性,可致人体灼伤。
安全措施泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。
不要直接接触泄漏物。
勿使泄漏物与还原剂、有机物、易燃物接触。
尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄漏:用砂土、干燥石灰或苏打灰混合。
也可以用大量水冲洗,洗水稀释后放入废水系统。
大量泄漏:构筑围堤或挖坑收容;用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
消防措施燃烧性:不燃危险特性:强氧化剂。
与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。
在室温下分解,加热则爆炸。
无水物与水起猛烈作用而放热。
具有强氧化作用和腐蚀性。
有害燃烧产物:氯化氢。
灭火方法:考虑到火场中可能存在有机物会引起爆炸,不可轻易接近。
灭火剂:雾状水、泡沫、二氧化碳、砂土。
灭火注意事项:考虑到火场中可能存在有机物会引起爆炸,不可轻易接近。
紧急处理吸入:迅速脱离现场至新鲜空气处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:误服者用水漱口,给饮牛奶或蛋清。
如没有胃溃疡,应饮用1%碳酸氢钠溶液,如有胃溃疡或不清楚时,服用氢氧化铝或氢氧化镁片剂。
就医。
皮肤接触:立即脱去被污染衣着,用大量流动清水冲洗,至少15分钟。
就医。
浓高氯酸碰到手时有强烈的灼热感。
(手接触高氯酸后具有特征性离皮现象,一般发生在接触24小时后陆续发生离皮,皮脱去后应注意防止进一步感染,一般一周后会痊愈。
)眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
泄漏应急处理应急处理:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
不要直接接触泄漏物。
勿使泄漏物与有机物、还原剂、易燃物接触。
尽可能切断泄漏源。
防止流入下水道、排洪沟等限制性空间。
小量泄漏:用砂土、干燥石灰或苏打灰混合。
大量泄漏:构筑围堤或挖坑收容。
用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
操作处置与储存操作注意事项:密闭操作,局部排风。
操作尽可能机械化、自动化。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴过滤式防毒面具(全面罩)或自给式呼吸器,穿聚乙烯防毒服,戴橡胶手套。
远离火种、热源,工作场所严禁吸烟。
防止蒸气泄漏到工作场所空气中。
避免与酸类、碱类、胺类接触。
尤其要注意避免与水接触。
搬运时要轻装轻卸,防止包装及容器损坏。
禁止震动、撞击和摩擦。
配备相应品种和数量的消防器材及泄漏应急处理设备。
倒空的容器可能残留有害物。
稀释或制备溶液时,应把酸加入水中,避免沸腾和飞溅。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
库温不宜超过30℃。
保持容器密封。
应与酸类、碱类、胺类等分开存放,切忌混储。
储区应备有泄漏应急处理设备和合适的收容材料。
接触控制/个体防护职业接触限值中国MAC(mg/m3):未制定标准前苏联MAC(mg/m3):未制定标准TLVTN:未制定标准TLVWN:未制定标准监测方法:工程控制:密闭操作,局部排风。
尽可能机械化、自动化。
提供安全淋浴和洗眼设备。
呼吸系统防护:可能接触其蒸气时,必须佩戴过滤式防毒面具(全面罩)或自给式呼吸器。
紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿聚乙烯防毒服。
手防护:戴橡胶手套。
其他防护:工作现场禁止吸烟、进食和饮水。
工作完毕,淋浴更衣。
单独存放被毒物污染的衣服,洗后备用。
保持良好的卫生习惯。
毒理学资料急性毒性: LD50:1100 毫克/千克(大鼠经口);400 毫克/千克(犬经口)生态学资料生态毒理毒性:生物降解性:非生物降解性:生物富集或生物积累性:其它有害作用:无资料。
废弃处置废弃物性质:废弃处置方法:处置前应参阅国家和地方有关法规。
用安全掩埋法处置。
废弃注意事项:运输信息危险货物编号:51015UN编号:1873包装类别:O51包装方法:玻璃瓶或塑料桶(罐)外全开口钢桶;磨砂口玻璃瓶或螺纹口玻璃瓶外普通木箱;安瓿瓶外普通木箱。
运输注意事项:铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。
运输时单独装运,运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。
