包涵体纯化方案
包含体纯化步骤(精)

同样采用Ni-NTA His结合树脂亲和纯化重组目的蛋白,1、200mL菌液离心收集大量诱导的菌体,并用1×PBS缓冲液洗涤两次。
2、将保存的菌体沉淀用总体积为20mL的1×Bind Buffer (300mM NaCl,50MmNaH2PO4; 10mM imidazote,pH8.0)重悬,在冰浴中超声波破菌至溶液呈白色澄清。
3、4℃12,000rpm离心30分钟,然后用20mL的包涵体洗涤Buffer (50mmol/L Tris-HCl,100mmol/L NaCl,1mmol/L EDTA,0.5% Triton x-100,pH8.0)洗涤沉淀两次。
4、加20mL的包涵体溶解Buffer(50mmol/L Tris-HCl,100mmol/L NaCl,8mol/L Urea,pH8.0)充分溶解,(旋涡溶解,最好溶解时间长一点,1h左右,也可以用冰盒装放摇床上1h),4℃10,000 r/min离心30min,收集上清。
2.2.2 亲和层析纯化表达的蛋白pQE40和pET-32a(+)载体表达的蛋白C﹑N端均融合了6个组氨酸的tag,可用金属螯和层析纯化,也可用抗6个组氨酸的单克隆抗体检测表达蛋白的正确性。
根据表达蛋白的溶解情况分两种方法对蛋白进行纯化。
2.2.3 天然条件下纯化可溶形式的目的蛋白目的蛋白的表达和收获:用3.2.2.1所述的方法大量表达目的蛋白。
4℃下10,000 rpm离心5min弃上清,向细菌沉淀中加入4℃用冰预冷的1×Ni-NTA结合缓冲液(50 mmol/L NaH2PO4, 300 mmol/L NaCl, 10 mmol/L咪唑, pH8.0),每100mL培养液加入4mL结合缓冲液,重悬菌体。
-40℃冷冻,室温溶解,反复冻融三次。
再在冰水浴中超声10min(超声10s, 间隔10s),破碎菌体。
4℃下10,000 rpm离心20min,保留上清液。
包涵体的纯化和复性总结--最全的前人经验

<包涵体的纯化和复性总结二、包涵体的洗涤1、包涵体的洗涤问题通常的洗涤方法一般是洗不干净的,我以前是这么做的,先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,你可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,我觉得比通常的直接洗脱效果好。
包涵体一般难溶解,所以你要注意未溶解的部分,你可以跑电泳对比,因为有时候难溶解的就是你的目标蛋白,所以每次处理都要把上清和沉淀跑电泳对比,免得把目标蛋白弄丢了。
此外刚处理完的包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量的溶剂。
如果说是不少不溶解的不是你要的,那就不用管了。
2、如何得到比较纯的包涵体对于包涵体的纯化,包涵体的前处理是很重要的。
包涵体中主要含有重组蛋白,但也含有一些细菌成分,如一些外膜蛋白、质粒DNA和其它杂质。
洗涤常用1%以下的中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取的包涵体纯度至少可达50%以上,而且可保持元结构。
也可用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附的大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用的还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度的变性剂如尿素充分洗涤去除杂质,这一步很重要,因为大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中可导致重组蛋白质的降解。
对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
包涵体产物的纯化工艺

包涵体产物的纯化工艺
纯化涉及从原料中分离和去除杂质以获得纯净化合物的工艺。
对于包含有机或无机物的体产物,其纯化工艺可以根据具体情况进行调整,但以下是一般常用的几种纯化工艺:
1. 结晶:通过温度控制和溶剂选择,使目标化合物从溶液中结晶出来,然后进行过滤、洗涤和干燥等步骤,以获得纯净的产物。
2. 蒸馏:利用成分之间的沸点差异来分离和纯化混合物。
通过加热混合物,使成分按照沸点的高低逐渐蒸发和冷凝,从而分离目标化合物。
3. 萃取:利用不同物质在不同溶剂中的溶解度差异,将目标化合物从混合物中分离提取出来。
常见的萃取方法包括溶剂萃取、液液萃取和固相萃取等。
4. 色谱:利用样品成分在移动相和固定相之间的差异,通过一系列分离和纯化步骤来分离和纯化产物。
常见的色谱方法包括薄层色谱、柱层析、高效液相色谱和气相色谱等。
5. 活性炭吸附:通过将目标化合物吸附在活性炭上,去除混合物中的杂质物质,从而纯化产物。
这种方法常用于水处理、空气净化和溶剂回收等领域。
6. 晶体化学:通过对化合物晶体结构的解析和再合成,消除晶体中的杂质,实
现产物纯化。
以上是一些常见的纯化工艺,具体选择哪种工艺取决于产物性质、目标纯度要求、经济性和实际应用等因素。
包涵体的纯化和复性总结--最全的前人经验

包涵体旳纯化和复性总结ﻫ二、包涵体旳洗涤ﻫ1、包涵体旳洗涤问题ﻫ一般旳洗涤措施一般是洗不干净旳,我此前是这样做旳,先把包涵体用6M盐酸胍溶解充足,过滤除去未溶解旳物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以始终稀释到合适旳浓度,你可以找到一种合适清除杂质旳措施,其实这就是梯度沉淀旳措施,我觉得比一般旳直接洗脱效果好。
ﻫﻫ包涵体一般难溶解,因此你要注意未溶解旳部分,你可以跑电泳对比,由于有时候难溶解旳就是你旳目旳蛋白,因此每次解决都要把上清和沉淀跑电泳对比,免得把目旳蛋白弄丢了。
ﻫ此外刚解决完旳包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量旳溶剂。
如果说是不少不溶解旳不是你要旳,那就不用管了。
2、如何得到比较纯旳包涵体对于包涵体旳纯化,包涵体旳前解决是很重要旳。
ﻫ包涵体中重要具有重组蛋白,但也具有某些细菌成分,如某些外膜蛋白、质粒DNA和其他杂质。
洗涤常用1%如下旳中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取旳包涵体纯度至少可达50%以上,并且可保持元构造。
也可用低浓度旳盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附旳大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用旳还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度旳变性剂如尿素充足洗涤清除杂质,这一步很重要,由于大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体旳溶解和复性过程中可导致重组蛋白质旳降解。
对于尿素和盐酸胍旳选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强旳可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
包涵体纯化实验报告

一、实验目的1. 掌握包涵体纯化的基本原理和操作步骤。
2. 学习利用离子交换层析法对包涵体进行纯化。
3. 评估包涵体纯化效果,并探讨优化纯化条件的方法。
二、实验原理包涵体是细菌表达外源蛋白时形成的一种不溶性蛋白质聚集体。
由于包涵体中的蛋白质缺乏生物活性,因此需要通过一系列操作将其溶解、复性,并最终纯化得到具有生物活性的蛋白质。
本实验采用离子交换层析法对包涵体进行纯化,通过改变缓冲液中的离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合,从而实现蛋白质的分离和纯化。
三、实验材料1. 包涵体样品2. 离子交换层析柱3. 标准蛋白样品4. 标准缓冲液5. 蛋白质浓度测定试剂盒6. 超声波破碎仪7. 离心机8. 荧光分光光度计9. 数据处理软件四、实验步骤1. 包涵体样品的处理将包涵体样品用超声波破碎仪处理,使包涵体溶解。
然后将溶液离心,取上清液作为后续实验的样品。
2. 样品预处理将样品用缓冲液稀释,调整离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合。
3. 离子交换层析将预处理后的样品上柱,用缓冲液进行洗脱,收集洗脱液。
4. 蛋白质纯化效果评估采用蛋白质浓度测定试剂盒对洗脱液进行蛋白质浓度测定,比较不同洗脱液中的蛋白质浓度,评估纯化效果。
5. 数据处理与分析利用数据处理软件对实验数据进行统计分析,探讨优化纯化条件的方法。
五、实验结果1. 包涵体样品经过超声波破碎后,溶液变得清澈,说明包涵体已成功溶解。
2. 通过离子交换层析法,成功将包涵体中的蛋白质与层析柱上的亲和基团结合,实现了蛋白质的分离和纯化。
3. 通过蛋白质浓度测定,发现洗脱液中的蛋白质浓度明显高于未处理的样品,说明纯化效果良好。
4. 通过数据分析,发现改变缓冲液中的离子强度和pH值对包涵体纯化效果有显著影响。
在一定范围内,增加离子强度和降低pH值有利于提高蛋白质的纯化效果。
六、实验结论1. 本实验成功实现了包涵体的纯化,并获得了具有生物活性的蛋白质。
包涵体纯化方法及包涵体蛋白制备
包涵体纯化方法及包涵体蛋白制备重组蛋白在大肠杆菌、酵母、哺乳动物中的表达可分为三种形式:胞外分泌表达、胞内可溶性表达和胞内不溶性表达(即产物以包涵体形式存在)。
以包涵体形式存在的重组蛋白是无生物活性的,需要进行复性处理,然后再进行分离纯化。
包涵体纯化与传统生物大分子的分离纯化方法相似,即以分子的等电点、溶解性、亲疏水性以及与其它分子的亲和性等特征为基础进行纯化。
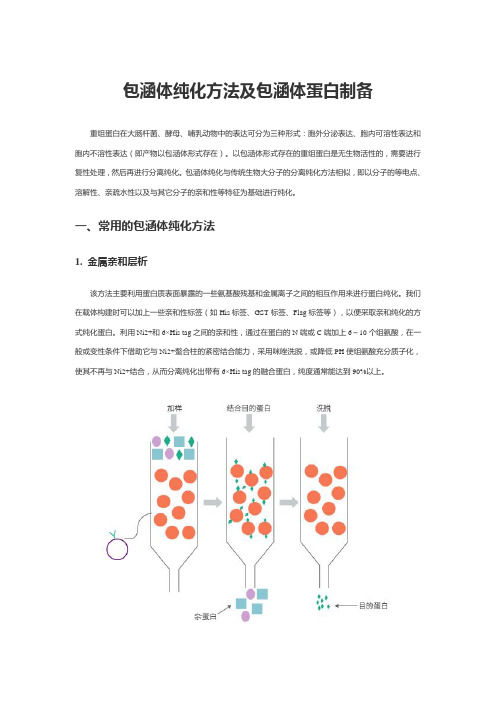
一、常用的包涵体纯化方法1. 金属亲和层析该方法主要利用蛋白质表面暴露的一些氨基酸残基和金属离子之间的相互作用来进行蛋白纯化。
我们在载体构建时可以加上一些亲和性标签(如His标签、GST标签、Flag标签等),以便采取亲和纯化的方式纯化蛋白。
利用Ni2+和6×His tag之间的亲和性,通过在蛋白的N端或C端加上6~10个组氨酸,在一般或变性条件下借助它与Ni2+螯合柱的紧密结合能力,采用咪唑洗脱,或降低PH使组氨酸充分质子化,使其不再与Ni2+结合,从而分离纯化出带有6×His tag的融合蛋白,纯度通常能达到90%以上。
2.离子交换层析离子交换层析是根据在一定pH条件下,蛋白质所带电荷不同而进行的分离的方法。
常用的离子交换剂有羧甲基纤维素(阳离子交换剂,弱酸型)和二乙基氨基乙基纤维素(阴离子交换剂,弱碱型)。
阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,需要通过提高洗脱液中的盐浓度等措施将其洗脱下来。
根据蛋白质结合能力不同,洗脱的速度会存在差异,通常结合较弱的蛋白质先被洗脱。
反之,阳离子交换基质会结合带有正电荷的蛋白质,可以通过提高洗脱液的PH或增加洗脱液中的盐浓度将蛋白洗脱下来。
3.凝胶过滤层析凝胶过滤层析通常又称为分子筛方法,主要是根据蛋白质的大小和形状达到分离和纯化的目的。
一般是大分子先流出来,小分子后流出来。
此方法的优点在于层析所用的凝胶属于惰性载体,不带电荷并且吸附力弱,可较广的温度范围内进行。
基因工程包涵体的纯化方法

基因工程包涵体的纯化方法基因工程可真是个神奇的领域,像是现代科技的魔法师,把DNA这个小家伙们玩弄得团团转。
在这片神秘的土地上,包涵体就像是隐藏的宝藏,得先把它们找出来,再通过纯化的方法把这些小宝贝洗净,才能让它们为我们所用。
今天,我们就来聊聊基因工程包涵体的纯化方法,让这趟旅程轻松愉快。
1. 什么是包涵体?首先,包涵体可不是某种古怪的生物,它们其实是细胞在生产某些蛋白质时,形成的一种颗粒。
就像是做饭时,锅里油烟聚集的那些小油滴,虽然它们看起来不太好,但里面可藏着好东西。
你要知道,包涵体里面有大量的目标蛋白质,但通常它们会和其他杂质混在一起,像是大海捞针,得费点功夫才能捞出来。
1.1 包涵体的形成当细胞用上基因工程的技术,强行让某种蛋白质“上班”时,有时候它们就会不太乖,聚集成包涵体。
这就像你在做作业时,有的题目就特别难,结果一堆答案写错了,最后只好把它们堆到一边。
虽然包涵体一开始可能看起来像个废物,但其实它们是生产特定蛋白质的一种“副产品”。
1.2 包涵体的用途那包涵体有什么用呢?别小看了它们,它们可是制药、疫苗开发的重要角色。
有的包涵体能转化为活跃的蛋白质,成为我们需要的药物,甚至可以用于研究新治疗方法,简直就是科研界的“黑马”。
所以,找到它们、纯化它们,那可是相当重要的任务。
2. 包涵体的纯化步骤接下来,我们就要聊聊如何把这些包涵体给纯化出来,步骤其实不复杂,但得有点耐心。
2.1 细胞裂解首先,得把细胞给撬开,就像剥开一个鸡蛋,才能见到里面的蛋黄。
这里我们通常会用一些裂解缓冲液,像是加盐的水,帮助细胞膜变得松软。
然后,咱们可以用超声波处理、化学试剂或者冷冻融化的方式把细胞打散,让包涵体慢慢浮出来。
2.2 离心分离一旦细胞裂解,包涵体就会在液体中游荡。
这时候,就要用离心机来大显身手了。
离心机就像是一位厨师,用强大的“旋转功力”把细胞残骸和包涵体分开。
你可以想象,把一大锅汤放进离心机,旋转后,沉淀物就会在底下,清汤会在上面。
包涵体蛋白纯化步骤

包涵体蛋白纯化步骤引言:包涵体蛋白纯化是生物技术和生物制药领域中重要的工艺步骤之一。
通过纯化包涵体蛋白,可以获得高纯度的目标蛋白,为后续的研究和应用提供了基础。
本文将介绍包涵体蛋白纯化的一般步骤,包括细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等。
一、细胞破碎:细胞破碎是包涵体蛋白纯化的第一步。
通常使用机械方法(如超声波破碎或高压均质)或化学方法(如洗涤剂破碎)来破碎细胞,释放包涵体蛋白。
需要注意的是,破碎条件应该使得包涵体蛋白能够充分溶解而不会发生蛋白质降解。
二、包涵体回收:包涵体蛋白通常以包涵体的形式存在于细胞裂解液中。
包涵体回收是将包涵体从其他细胞成分中分离出来的过程。
一种常用的方法是通过离心将细胞碎片和其他细胞成分与包涵体分离。
此外,还可以使用过滤、沉淀或超滤等技术来实现包涵体的回收。
三、包涵体溶解:包涵体蛋白在还原条件下通常以不溶性的形式存在。
为了使包涵体蛋白能够溶解,通常需要添加变性剂(如尿素或胍氯酸)和还原剂(如二硫醇)。
通过调节溶解条件,可以使得包涵体蛋白迅速溶解为可溶性蛋白。
四、亲和层析:亲和层析是包涵体蛋白纯化的关键步骤之一。
通过将目标蛋白与亲和层析介质上的亲和配体结合,可以实现目标蛋白的富集和纯化。
亲和配体可以是金属离子、抗体或亲和标签等。
在亲和层析过程中,需要注意选择合适的亲和配体和适宜的洗脱条件,以实现对目标蛋白的高效纯化。
五、蛋白质再折叠:由于包涵体蛋白在还原条件下溶解,其折叠状态通常不完整。
为了使得目标蛋白具有正确的结构和功能,需要对其进行再折叠。
常用的再折叠方法包括逐渐降低变性剂浓度、添加折叠辅助剂和调节pH 值等。
通过适当的再折叠条件,可以使得目标蛋白恢复到天然的折叠状态。
结论:包涵体蛋白纯化是一项复杂的工艺步骤,需要经过细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等步骤。
通过这些步骤的有序进行,可以得到高纯度和高活性的包涵体蛋白。
随着生物技术和生物制药的不断发展,对包涵体蛋白纯化技术的要求也越来越高,希望通过不断的研究和创新,能够进一步提高包涵体蛋白纯化的效率和纯度,为生物医药领域的研究和应用提供更好的支持。
包涵体蛋白的纯化及复性讨论专贴

包涵体蛋白的纯化及复性讨论专贴!zbbnet wrote:最近实验遇到了大麻烦,说出来大伙帮忙想想法。
实验所用菌株为BL21,载体pMAL-p2X,与MBP融合表达,目的蛋白有三对二硫键。
最初的设计思想是想通过MBP的信号肽实现可分泌表达,但实验发现主要是包涵体表达。
菌体超声破碎后12000rpm离心,所获得的沉淀不能很好的贴在离心管底,而是处于部分溶解状态,对沉淀再作如下处理:1、2M尿素洗涤,pH8.5,12000rpm离心,获得的上清不是澄清透明而是略显混浊,这次的沉淀能够牢固的贴在管底。
2、4M尿素洗涤,pH9.0,12000rpm离心,获得的上清不是澄清透明而是略显混浊,这次的沉淀为半溶状态的冻状物。
3、8M尿素溶解上述2中的沉淀,几乎不见不溶的颗粒,但溶液还是略显混浊。
上述三溶液取样电泳,均见较多的目的蛋白。
对3中的溶液取样调pH至12溶液依然混浊。
0.22um过滤,无法去除混浊物。
考虑到混浊物是多聚体,样品中加入1%SDS和0.2%β-Me,都无法改善。
做上述处理,主要考虑到混浊物是目的蛋白,因为目的蛋白设计了6HIS但不能成功的结合Ni柱。
主要想请教这样几个问题:1、有没有那位战友也碰上我上述的问题,这种问题是如何解决的?2、我所描述的包涵体的状态说明了什么问题?3、对与蛋白溶液混浊有什么好的处理方法?暂不讨论分泌表达的问题。
回答:1. 你的情况很正常,根据三次沉淀处理情况,应该可以肯定你的蛋白在8MUrea中是完全可以裂解的。
并且该蛋白如若作复性应该可溶性较佳。
但根据我个人的经验。
如果MBP融合蛋白还是以包含体表达的话是很没有意思的,建议作单独表达,除非单独表达不行。
否则即使完全复性,目的蛋白活性也大打折扣。
另可优化表达条件,有可能可容表达的,不要放弃,你的破菌上清也可以跑胶看看有没有目的蛋白。
2. 说明蛋白蔬水性不强。
3。
有些蛋白裂解后有浑浊非常正常,尤其是MBP融合的,即使做到可容也会有白乎乎浑浊的现象,只要不影响使用就行,没必要在意。
包涵体纯化试剂配方

✧ Buffer A 裂解液 500ml1M Tris (pH 6.8)母液 25 ml5M Nacl 母液( M:58.5) 15mlH 20 435ml5%甘油 25ml✧ 1M Tris 母液 ( M:121.14 PH:6.8 )的配置100ml称量12.114gTris 加50ml 水,PH 由浓Hcl 调节至6.8,定容至100ml✧1M Tris-HCl (M:121.14 PH 7.9)母液配置100ml称量12.114gTris 加50ml 水,PH 由浓Hcl 调节至7.9,定容至100ml✧ 5M Nacl 母液( M:58.5) 配置100ml称量29.25g Nacl 加水定容至100ml✧ 2M 尿素(M:60.06)裂解缓冲液250ml1M Tris (pH 6.8)母液12.5 ml + 5M Nacl 母液 7.5ml + 甘油 12.5ml+30.030g Urea定容至250ml✧ 1% T ri t on X-100裂解缓冲液250ml1MTris (pH6.8)母液12.5ml +5M Nacl 母液7.5ml +甘油12.5ml+Triton X-100(M:646.86 ) 2.5ml✧ 1M 咪唑(M:68.0773)母液配置称量6.80773g 咪唑定容至100ml✧ 透析袋处理液(PH8.0)500ml2%NaHCO3 称量NaHCO3 10g1mM EDTA (M:292.248 称量0.14624g )(若为EDTA 二钠M :372.2 称量0.1861g )✧Binding BufferElution Buffer 各100ml ,定容至100ml 注:Elution Buffer 咪唑梯度浓度:20mM 加母液2ml ;40mM 加母液4ml ;80mM 加母液8ml ;150加母液15ml ;250mM 加母液25ml ;300加母液30ml ;500加母液50ml成 分Tris-HCl (PH 7.9) 咪唑 NaCl 尿素 Binding Buffer 1MTris-HCl(M:121.14 PH7.9)母液 2ml1M 咪唑(M:68.0773)母液 0.5ml 5M Nacl 母液 10ml 8M(即称48.048gUrea) Elution Buffer1MTris-HCl(M:121.14 PH7.9)母液 2ml 1M 咪唑(M:68.0773)母液 50ml 5M Nacl 母液 10ml 8M(即称48.048gUrea)。
包涵体纯化

1. 融合蛋白上清液及包涵体溶解液的制备1) 按照摸索出的最佳表达条件集菌400mL,6000rpm离心10min,收集菌体;2) 用40ml的缓冲液重悬菌体进行洗涤,重离心弃上清;3) 加40ml冰浴的缓冲液,重悬菌体沉淀4) 冰上超声破碎菌体,超声2s,间隔10s,功率800W,超声40次;5) 18000rpm离心30min,取上清备用;6) 向离心后沉淀中加入40ml的包涵体洗涤液,重悬沉淀,冰浴超声洗涤一次:超声2s,间隔10s,功率1200W,超声40次;7) 12000rpm离心10min,弃上清,留沉淀;8) 包涵体沉淀的溶解:向洗涤后的包涵体沉淀中加入20ml的包涵体溶解液,用5mL枪头吹散沉淀,室温下放置1个小时使其充分溶解,18000rpm离心30min,取上清即得包涵体溶解液;9) 将包涵体溶解液装入透析袋中(透析范围:8000-14000),置于含4mol/L尿素的透析液中,4℃透析2h,然后转入含2mol/L尿素的透析液中,4℃透析12h,最后转入含0mol/L尿素的透析液中,4℃透析24h,充分脱尿素。
2. 利用凝血酶切割融合蛋白得到目的蛋白按照10bp凝血酶/mg融合蛋白的比例加入凝血酶,25℃水浴切割12h。
3. 利用GST亲和层析纯化融合蛋白菌体破碎后上清或者透析后包涵体溶解液1) 30ml的1×PBS预平衡Glutathione-Sepharose 2ml柱(含1ml Glutathione-Sepharose亲和介质),液体的流速0.4ml/min;2) 上样:菌体破碎后上清或者透析后包涵体溶解液过Glutathione-Sepharose 2ml柱,反复过两次;3) 洗涤杂蛋白:用10ml的1×PBS洗涤杂蛋白;4) 洗脱:向柱子中加入洗脱液(10mM reduced Glutathione)进行洗脱,利用记录仪记录洗脱峰;5) 收集洗脱液,利用Bradford法检测蛋白浓度;6) 用30ml的1×PBS洗涤Glutathione-Sepharose 2ml柱;7) 用10ml的含有20%乙醇的1×PBS洗涤Glutathione-Sepharose 2ml柱,4℃保存。
包涵体分离纯化

包涵体分离纯化1. 2×YT 液体培养基:Tryptone 8gY east Extract 5gNaCl 2.5g定容至500ml,高压灭菌挑取单菌落接种于3 ml 2YT 液体培养基(加Amp)(不加蔗糖)中,于37℃,180rpm/min 摇床培养过夜。
取过夜培养物按1:100 接种于新鲜的2×YT 液体培养基(加蔗糖)(Amp50μg/ml)中,在37℃摇床培养,在菌种长到OD600约为0.4 时,向培养基中加入IPTG,使IPTG 的终浓度为0.5mM,诱导表达4h。
2.0.1MTris-HCL 缓冲液(PH7.5):称取6.05gTris,水溶解,PH7.5,定容至500ml。
20mMTris-HCL 缓冲液(PH7.5):0.1MTris-HCL 缓冲液稀释五倍。
包涵体洗涤液Ⅰ:TritonX-100 1ml NaCl 0.585g Urea 6g 0.1MTris-HCl20ml 定容至100ml,PH7.5。
包涵体洗涤液Ⅱ:将包涵体洗涤液Ⅰ稀释10 倍。
将诱导表达后的菌液离心收集菌体,,用事先预冷的20mM Tris-HCl(PH7.5)将菌体洗涤一次,将菌体重悬于20mM Tris-HCl(PH7.5)缓冲液中(或者加1mg/ml 溶菌酶),-80℃,反复冻融后,超声波破碎菌体,12000 rpm/min 离心5min,收集包涵体。
将收集的包涵体依次用洗液(溶液Ⅰ和溶液Ⅱ)洗涤,每种溶液洗涤三次。
DS-PAGE 检测洗涤效果。
洗涤后的包涵体重悬于20mMTris-HCl (PH7.5)中保存,每克湿重包涵体加入10ml 20mM Tris-HCl (PH7.5)。
3.包涵体溶解将20mM Tris-HCl溶解的包涵体离心收集沉淀,每克包涵体湿重加20ml 20mM Tris-HCl,8M 尿素,PH7.5 的包涵体溶解液,悬涡震荡2 小时,使包涵体充分溶解,12000rpm/min 离心5min,取上清,过滤除杂。
包涵体蛋白提取

包涵体蛋白提取纯化20070808步骤一提取包涵体1. 母菌培养后,接种20ml于2L LB液中,37℃培养至OD600=0.4-0.6,加入IPTG至终浓度为1mM,37℃继续培养3-5小时。
2. 收菌(接下去步骤都在低温下进行),用60ml左右1×PBS悬浮,超声裂解(超6S,间隔12S,99次,300W左右)。
3. 12000rpm,30min,用玻棒将细菌碎片拨掉,washing buffer悬浮。
4. 离心后可看细菌有无完全裂解,若无可以再次超声:4S,10S,43次,300W左右,超声条件可以自行调整。
5. 12000rpm,10-20min,washing buffer洗涤,尽量去除细菌碎片。
6. 同上,称重。
7. 12000rpm,10-20min,resuspension buffer悬浮。
8. 12000rpm,10-20min,按30mg/ml用盐酸胍或尿素溶解,4℃搅拌溶解。
9. 12000rpm,10-20min,倒出上清或分装成1ml/管于-20℃或-80℃保存备用。
二包涵体复性(稀释复性法)1. 配制refolding buffer(100-1000ml等体系,视复性效果而定),于冰上或4℃预冷。
2. 用5ml或10ml注射器将溶解后的包涵体(约3-5ml,可分两次加,每次间隔8小时左右)加入注射器内,使之一滴一滴的往refolding buffer内滴下(如果用的是尿素溶解的话,包涵体应该会冻了起来,可用injection buffer溶解后再加入注射器内),慢慢搅拌8-10小时(可适当延长时间)。
(在4℃条件下进行)3. 复性后,可用浓缩杯浓缩样品换液(适合于此蛋白的缓冲液),再转到浓缩管内浓缩,如果复性体系小的话可直接用浓缩管浓缩换液。
(复性后如果复性液变得浑浊,可低温离心去除沉淀后再浓缩。
)(4℃条件下进行)4. 将样品过柱子,检测复性效果,用于下一步的工作。
包涵体蛋白的纯化和复性

包涵体蛋白的纯化和复性包涵体蛋白的纯化和复性1.菌体的收集和破碎用50 ml离心管分别收集诱导表达后的培养物,8000 rpm 4℃离心10 min。
沉淀用适量的超声破菌缓冲液重悬。
【备注】超声破菌缓冲液(20 mmol/L Tris-HCl pH8.0、0.5 mol/L NaCl、1 mmol/L EDTA、1 mg/mL溶菌酶)重悬后的菌液于冰浴中进行超声波破碎,其条件为:功率为300W,占空比50%,每个循环30 s,总时间20 min。
破碎后的匀浆,4℃、 12000 rpm离心15 min。
分别取上清液和沉淀进行12% SDS-PAGE分析,确定目的蛋白是否以包涵体的形式表达。
2.包涵体的处理洗涤:沉淀用适量的包涵体洗涤缓冲液重悬后,搅拌洗涤20~30 min,于4℃,12000 rpm离心15 min,弃去上清液。
重复一次。
再用适量的50 mmol/L Tris pH8.0溶液洗涤一遍(以去除残留的EDTA),于4℃ 12000 rpm离心15 min,弃去上清液。
【备注】包涵体洗涤缓冲液(20 mmol/L Tris-HCl pH 8.0,0.5 mol/L NaCl,2 mol/L尿素,2% Triton)2%Triton X-100溶液:量取2mlTriton X-100(聚乙二醇辛基苯基醚)液,加M缓冲液98ml即可。
溶解:沉淀用适量的包涵体溶解缓冲液重悬,室温搅拌5-6小时或过夜。
12000 rpm 4℃离心15 min,收集上清液。
【备注】包涵体溶解缓冲液(20 mmol/L Tris-HCl pH 8.0,0.5 mol/L NaCl,8 mol/L尿素,0.2 mmol/L DTT或100 mmol/L β-巯基乙醇,2%Triton)3.目的蛋白的纯化亲和层析基于目的蛋白与固相化的配基特异结合而滞留,其他杂蛋白会流过柱子。
谷胱甘肽S-转移酶(GST)是最常用的亲和层析纯化标签之一,带有此标签的重组蛋白可用交联谷胱甘肽的层析介质纯化,但本方法有以下缺点:首先,蛋白上的GST必须能合适的折叠,形成与谷胱甘肽结合的空间结构才能用此方法纯化;其次,GST标签多达220个氨基酸,如此大的标签可能会影响表达蛋白的可溶性,使形成包涵体,这会破坏蛋白的天然结构,难于进行结构分析,有时即便纯化后再酶切去除GST标签也不一定能解决问题。
包涵体的纯化

关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG 频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
包涵体变性、复性及纯化

一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG 频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
这是标准配方:裂解液:50mM Tris-HCl(pH8.5~9.0), 2mM EDTA, 100mM NaCl, 0.5% Triton X-100, 1mg /ml溶菌酶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
包涵体纯化方案
缓冲液配方:
1.变性复性缓冲液
缓冲液A:50mM Tris-HCl (pH8.5), 1mM EDTA①, 100mM NaCl②,1%Triton X-100③
缓冲液B:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl,1%Triton X-100,2M脲素④
缓冲液C:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl,1%Triton X-100
缓冲液D:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl,1%Triton X-100,2M盐酸胍④
溶解缓冲液E:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl,10mM β-巯基乙醇/DTT⑤,2mM脱氧胆酸钠⑥,
8M脲素
复性缓冲液:50mM Tris-HCl (pH8.5),100mM NaCl ,6M/4M/2M脲素,1%甘氨酸⑦,5%甘油⑧,0.2%PEG⑨,1mM氧
化型谷胱甘肽,1mM还原型谷胱甘肽⑩
2.纯化缓冲液
Binding buffer:50mM Tris-HCl, 100mM NaCl, 10mM 咪唑,pH8.5
Elution buffer:50mM Tris-HCl, 100mM NaCl, 不同浓度梯度咪唑, pH8.5
具体实施步骤:
1.大量诱导表达的菌液7000rpm离心10min。
弃上清,用1×PBS重悬,洗涤菌体细胞,7000rpm,离心10min。
再用PBS重复洗一遍。
离心后留菌体沉淀。
2.将菌体细胞用缓冲液A重悬,液氮中反复冻融后,超声破碎。
13000rpm 离心10min,弃上清,收集包涵体沉淀。
2.分别用缓冲液B、C、D超声清洗包涵体沉淀。
13000rpm离心10min 收集沉淀。
3.用缓冲液E溶解包涵体,缓慢摇动使其缓慢溶解,室温放置30min,然后13000rpm离心10min。
取上清。
4.将上清稀释至0.1-1.0mg/ml,装入透析袋中,放置于梯度复性缓冲液中,4℃缓慢透析24-36h。
最后在纯化binding buffer中透析,确保蛋白稳定可溶。
5.对溶解的包涵体蛋白进行亲和层析。
附注:
①EDTA防止蛋白降解
②NaCl一定的盐离子可降低某些带电基团间的斥力
③Triton X-100除去其他细菌成分,如膜外蛋白,质粒DNA和其他杂质
④脲素,盐酸胍,洗掉包涵体表面的不溶性杂蛋白
⑤β-巯基乙醇/DTT作为还原剂打开错配的二硫键
⑥脱氧胆酸钠作为离子型去垢剂能促溶蛋白
⑦⑧甘氨酸、甘油促溶
⑨PEG可逆修饰折叠中间体的疏水基团
⑩氧化型和还原型谷胱甘肽促进二硫键的形成。
(11)1g菌使用35ml液体重悬即可。
