水解反应计算与选型 100立
化学物质的水解反应

化学物质的水解反应化学物质的水解反应是一种常见的化学反应类型,它涉及到物质与水之间的相互作用,导致物质分解为更简单的成分。
水解反应不仅在日常生活中常见,也在工业生产和科学研究中得到广泛应用。
本文将介绍水解反应的基本概念、机制以及一些实际应用。
一、水解反应的基本概念水解反应是指物质在水或水溶液中发生分解的化学反应。
在水解反应中,水充当了重要的反应介质,通过与物质分子间的相互作用,将原有的化学键打断,使分子分解为离子或更简单的分子。
水解反应通常遵循质子传递机制,也可以涉及氢氧根离子的参与。
二、水解反应的机理水解反应的机理因物质的性质而异。
在酸性条件下,往往涉及质子传递机制。
例如,酸性环境下的碳酸氢钠水解反应可以表达为:HCO3- + H3O+ → H2O + CO2↑碳酸氢钠在水中与溶液中的酸分子产生反应,生成水和二氧化碳。
这个反应过程涉及到酸分子给出质子(H+),碳酸氢根离子得到质子并释放二氧化碳的过程。
在碱性条件下,水解反应可能涉及氢氧根离子的参与。
以铝离子为例,可以表达为:Al3+ + 3OH- → Al(OH)3↓铝离子与氢氧根离子发生反应,生成氢氧化铝。
此反应过程中,氢氧根离子给出氢离子,铝离子与氢氧根离子结合形成沉淀。
三、水解反应的实际应用1. 日常生活中的水解反应:水解反应在食物消化中起着重要作用。
蛋白质、淀粉和脂肪等营养物质在人体内通过水解反应进行分解,以便人体吸收和利用。
例如,蛋白质水解产生氨基酸,淀粉水解产生葡萄糖。
2. 工业生产中的水解反应:工业上广泛利用水解反应来制备化学品。
例如,酯水解反应可以生产醇和酸。
酯是一类常用的溶剂和香精,通过水解反应可以得到酯的原始原料。
此外,水解反应也经常用于染料的制备、合成聚合物等工艺。
3. 科学研究中的水解反应:科学研究中的水解反应是深入了解化学反应机制的重要方法。
通过分析反应物和产物之间的差异,可以揭示反应的机理和动力学。
水解反应在药物研发、环境化学等领域都有广泛应用。
蔗糖水解反应实验

一.原理与说明:蔗糖水溶液在离子存在时,按下式进行水解:蔗糖葡萄糖果糖在此反应中离子为催化剂。
当离子浓度一定时,此反应的速度与蔗糖及水的浓度乘积成反比,为而级反应。
但当蔗糖的浓度小时,则在反应过程中水的浓度改变很小,可作为常数,这样此反应就可看作是一级反应,而符合一级反应动力学方程式:如在反应过程中的不同时间,测得蔗糖的相应浓度,代入上式就可求出此反应的速度常数K。
在测定各时间的反应物浓度时,可应用化学方法或物理方法:化学方法是在反应过程中没过若干时间,取出一部分反应混合物,并使取出的反应混合物迅速停止反应,记录时间,然后,分析与此时间对应的反应物浓度。
但是要使反应迅速停止是有困难的,因而所分析的浓度与相应的时间之间总有些偏差,所以此法是不够准确的。
物理方法是利用反应物与生成物的某一物理性质(如电导,折射率,旋光度,吸收光谱,体积,气压等)在量上有很大的差别。
因此随差反应的进行,这个物理性质的量将不断改变。
在不同的时间测定这个物理性质的量,就可计算出反应物浓度的改变。
这个方法优点是不需要停止反应而连续进行分析。
本实验中是利用了反应与生成物旋光性的差别。
当偏振光通过一旋光物质溶液时,偏振光的振动面旋转一角度,此角度的大小和偏振光所通过的溶液浓度和液层厚度成正比:代表旋光角,(旋转的角度);C代表溶液的浓度;代表液层厚度,或写成:称此物质的比旋光度,即当此旋光物质溶液为单位浓度(1克/每毫升)。
液层厚度为单位长度(一分米)时所引起的旋光角。
又因同样溶液浓度和液层厚度,如在不同温度下,或对不同波长的偏振光其旋光角亦不同,所以平常规定以用钠光D(波长5896豪微米),在20摄氏度时为标准,并用以上符号表示。
能使偏振光按顺时针旋转的物质算右旋物质,反之成为左旋物质。
右旋的旋光角用正号表示,左旋则用负号表示。
蔗糖是右旋的,比旋光度葡萄糖也是右旋的,比旋光度;果糖则为左旋时,比旋光度。
现在设用单位浓度的蔗糖进行水解,并用单位长度的液层进行旋光测定,则在最初测定得旋光角为。
水解程度计算公式

水解程度计算公式水解程度(Degree of Hydrolysis, DH)是衡量某种物质被水解程度的一个通用概念,可以帮助测定有机物质分子中键的水解特征。
它定义为水解物与未发生水解的原始物质总量的比,分子式如下:DH=m/M×100%。
水解程度是有机化学领域中非常重要的框架,描述了有机物质被水解或缩聚的性质。
它也可以用来测定陶瓷材料的溶解度,这种测定方法又叫做袋式法。
水解程度对分子大小的影响也很大,大分子的水解更加容易。
同时,水解程度也可以从人体的微生物数量中获得,以此来查看某种有机物质水解的程度。
水解程度是由不同种类水解反应来实现的。
常见的水解反应有水解反应、电解质反应和离子交换反应。
这些反应在物质的分子结构中的不同链条,会对水解程度产生不同的影响。
举个例子,有机物质甲醇(Methanol)是不容易被水解的,这种物质究竟被水解了多少呢?我们可以生成一组实验数据,从中推断出水解程度的值,新生成的数据可以用于验证预测值。
水解程度的实验测定方法十分有效。
它们可以用于应对水解性能和物质质量之间的变化,如食品中的水解淀粉,检查有机物质的电子结构,还能用于有机合成反应。
通过这些试验,可以获得更准确的水解程度结果。
在实际应用中,无论是工业还是家庭,水解程度总是一个非常重要的因素。
例如,在饮料制造业,企业必须让食品中的淀粉达到一定的水解程度,这样才能得到高质量的口感和风味。
同样,在家庭酿酒制作中,需要把糖溶液水解一定的程度,才能得到理想的效果。
因此,测定水解程度的研究分析,对实际的应用企业来说是非常重要的。
总之,水解程度是由物理和化学反应控制的特征,是衡量某种物质被水解程度的重要指标。
它不仅有助于研究有机物质的键的水解特征,而且应用于食品工业、酒精饮料业以及家庭制作行业等,是作为重要指标被广泛采用的。
尽管水解程度的测定有很多分析方法,但它们都是有效的。
随着水解程度的深入研究,必将更好地应用于工业和家庭生活中。
最新高中化学——常见水解反应总结教学内容
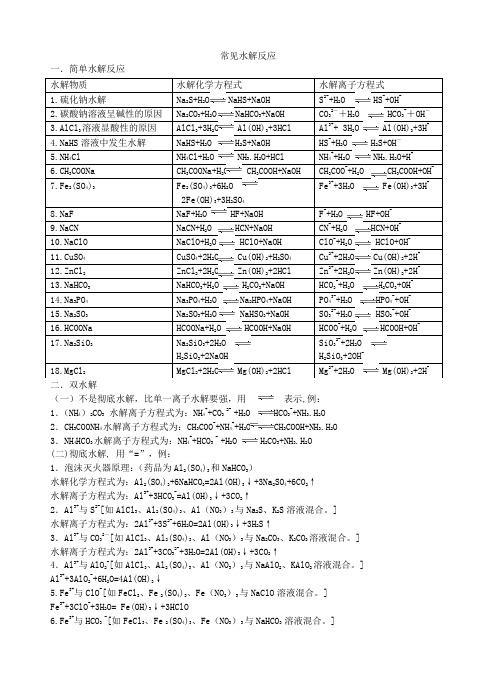
常见水解反应一.简单水解反应 二.双水解(一)不是彻底水解,比单一离子水解要强,用 表示,例:1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2- +H 2O HCO 3-+NH 3.H 2O 2.CH 3COONH 4水解离子方程式为:CH 3COO -+NH 4++H 2O CH 3COOH+NH 3.H 2O3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+NH 3.H 2O(二)彻底水解, 用“=”,例: 1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3)水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al(OH)3↓+3Na 2SO 4+6CO 2↑水解离子方程式为:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。
]水解离子方程式为:2Al 3++3S 2-+6H 2O=2Al(OH)3↓+3H 2S ↑3.Al 3+与CO 32-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2CO 3、K 2CO 3溶液混合。
]水解离子方程式为:2Al 3++3CO 32-+3H 2O=2Al(OH)3↓+3CO 2↑4.Al 3+与AlO 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与NaAlO 2、KAlO 2溶液混合。
] Al 3++3AlO 2-+6H 2O=4Al(OH)3↓ 5.Fe 3+与ClO -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaClO 溶液混合。
] Fe 3++3ClO -+3H 2O= Fe(OH)3↓+3HClO 6.Fe 3+与HCO 3 -[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaHCO 3 溶液混合。
高中化学物质的水解计算题解析与应用

高中化学物质的水解计算题解析与应用在高中化学学习中,水解是一个重要的概念。
水解反应是指溶液中的某种物质与水发生化学反应,生成溶液中的离子。
水解计算题是化学考试中常见的题型之一,要求学生通过计算来解决问题。
本文将以具体的题目为例,详细解析水解计算题的解题方法和应用。
题目:某化学实验室将0.1mol的氨基酸A溶解在1000mL的水中,求该氨基酸在水中的水解度。
解析:水解度是指溶液中发生水解反应的物质的量与初始物质的量之比。
根据题目的描述,我们知道溶液中的氨基酸A发生了水解反应。
首先,我们需要了解氨基酸的水解反应方程式。
一般来说,氨基酸在水中会发生酸碱中和反应,生成相应的酸和碱。
以氨基酸A为例,其水解反应方程式可以表示为:A + H2O ⇌ HA + OH-其中,A表示氨基酸分子,HA表示氨基酸的酸性离子,OH-表示氨基酸的碱性离子。
根据水解反应方程式,我们可以得知,氨基酸A在水中的水解度等于HA离子的浓度与氨基酸A的初始浓度之比。
因此,我们需要计算出HA离子的浓度和氨基酸A的初始浓度。
首先,计算HA离子的浓度。
根据水解反应方程式,HA离子的浓度等于氨基酸A的初始浓度减去水解反应中生成的OH-离子的浓度。
由于题目中未给出氨基酸A的pKa值,我们无法直接计算出OH-离子的浓度。
但是,我们可以利用氨基酸的酸碱性质来近似计算。
氨基酸是一种具有酸性和碱性的化合物,其pKa值可以用来描述其酸碱性。
当氨基酸的pH值等于其pKa值时,酸性离子和碱性离子的浓度相等。
因此,我们可以假设在水中,氨基酸A的HA离子浓度等于OH-离子浓度。
根据这个假设,我们可以计算出HA离子的浓度。
其次,计算氨基酸A的初始浓度。
根据题目的描述,我们知道氨基酸A的物质量为0.1mol,溶解在1000mL的水中。
因此,氨基酸A的初始浓度为0.1mol/L。
最后,计算水解度。
根据水解度的定义,水解度等于HA离子的浓度与氨基酸A的初始浓度之比。
将HA离子的浓度和氨基酸A的初始浓度代入计算公式,即可得到水解度的值。
水解反应

盐类的水解
简单水解; 不彻底双水解; 彻底双水解;
2019/1/19
水解反应规律总结
5
非盐类无机物的水解
单质的水解; 氧化物的水解; 非盐类离子化合物的水解; 非金属卤化物的水解(卤素互化物、氮 族卤化物)
2019/1/19
水解反应规律总结
2019/1/19 水解反应规律总结 2
有机物的水解
有机物盐类(醇钠、酚钠、羧酸钠); 卤代烃 酯类(包括油脂类) 糖类 多肽、蛋白质类
2019/1/19 水解反应规律总结 3
方程式操练
蔗糖水解; 淀粉水解; 甘甘二肽水解; 溴乙烷水解; 1,2-二溴乙烷水解; 乙酸乙酯在稀酸作用下水解; 甲酸丙酯与氢氧化钠溶液反应; 皂化反应; 酯水解变化题
水解反应
2019年1月19日星期六
2019/1/19
水解反应规律总结
1
哪些有机物能发生水解反应?
酯水解的条件是?如何能让酯水解得更彻底? 卤代烃水解的条件是? 糖类水解的条件的条件是?如何让纤维素水解? 蛋白质或多肽水解的条件是? 写出乙醇钠、苯酚钠水解的离子方程式。 相关问题:如何确定淀粉是完全水解或是部分 水解? 相关问题:如何检验卤代烃中的卤元素? 为何用热的纯碱溶液能洗涤油污?
6
无机物石与水 氮化镁与水 硫化铝与水 过氧化钙与水 氢化钙与水反应 NCl3与水
2019/1/19 水解反应规律总结 7
蔗糖水解反应

一级反应——蔗糖水解反应速率常数的测定一、实验目的1.用旋光仪测定当蔗糖水解时,其旋光度变化与时间的关系,从而推算蔗糖水解 反应的速率常数和半衰期。
2.了解旋光仪的基本原理,掌握其使用方法。
二、实验原理:蔗糖水解反应的计量方程式为:C 12H 22O 11+H 2O ==== C 6H 12O 6+C 6H12O 6蔗糖 葡萄糖 果糖蔗糖水解速率极慢,在酸性介质中反应速率大大加快,故H 3O +为催化剂。
反应中,H 2O 是大量的,反应前后与溶质浓度相比,看成它的浓度不变,故蔗糖水解反应可看做一级反应。
其动力学方程式如下:-dtdc =K 1C 积分式为: ln CC O=K 1 tK 1 =t 1ln CC O 或 K=t303.2lg C C O反应的半衰期2/1t =k2ln K 1 速率常数 t 时间Co 蔗糖初始浓度 C 蔗糖在t 时刻的浓度可见一级反应的半衰期只决定于反应速率常数K ,而与反应物起始浓度无关。
若测得反应在不同时刻时蔗糖的浓度,代入上述动力学的公式中,即可求出K和2/1t 。
测定反应物在不同时刻浓度可用化学法和物理法,本实验采用物理法即测定反应系统旋光度的变化。
蔗糖及其水解产物均为旋光性物质,蔗糖是右旋的,但水解后的混合物葡萄糖和果糖则为左旋,这是因为左旋的果糖比右旋的葡萄糖旋光度稍大的缘故。
因此,当蔗糖开始水解后,随着时间增长,溶液的右旋光度渐小,逐渐变为左旋,即随着蔗糖浓度减小,溶渡的旋光度在改变。
因此,借助反应系统旋光度的测定,可以测定蔗糖水解的速率。
所谓旋光度,指一束偏振光,通过有旋光性物质的溶液时,使偏振光振动面旋转某一角度的性质。
其旋转角度称为旋光度(a )。
使偏振光按顺时针方向旋转的物质称为右旋物质,a 为正值,反之称为左旋物质,a 为负值。
物质的旋光度,除决定于物质本性外,还与温度、浓度、液层厚度、光源波长等因素有关,当光源用钠灯,波长一定,λ=D(5890nm ),实验温度t =20℃时,旋光度与溶液浓度和溶层厚度成正比,a ∝c.l 写成等式 a=[a]t D ·c·l 式中比例常数[a] tD ,称为比旋光度。
《乙酸乙酯水解速率》课件

水解反应的基本原理
水解反应是指物质与水分子之间发生化学反应,产生新的化学物质。在乙酸乙酯的水解反应中,酯键被水分子 齐切断。
乙酸乙酯的水解方式
乙酸乙酯的水解可以通过碱性水解和酸性水解两种方式进行。碱性水解生成 乙醇和乙酸盐,而酸性水解生成乙醇和乙酸。
水解速率的影响因素
1 温度
提高温度可以加快水解速 率。
乙酸乙酯水解速率
这是一份关于乙酸乙酯水解速率的课件,我们将探讨乙酸乙酯的作用、分子 结构以及水解反应的基本原理。
Байду номын сангаас
乙酸乙酯的作用和应用
乙酸乙酯是一种常用的溶剂,广泛应用于涂料、胶水、油漆、香水等行业。它还可用作有机合成中的重要中间 体。
乙酸乙酯的分子结构
乙酸乙酯的分子式为C4H8O2,它由两个乙酸基团和一个乙酯基团组成。其特 殊的结构赋予了它独特的性质。
2 甲酸的形成
甲酸是水解反应副产物, 其存在会降低水解速率。
3 酸碱催化剂
酸性催化剂可以加快水解 速率,碱性催化剂则相反。
溶剂对水解速率的影响
溶剂的选择会对乙酸乙酯的水解速率产生影响。通常,极性溶剂可以加快水解反应,而非极性溶剂则会减慢水 解速率。
各种解离离子对水解速率的影响
某些解离离子,如氢离子、氢氧根离子和金属离子,能够催化乙酸乙酯的水解反应,从而显著影响水解速率。
安全使用乙酸乙酯的建议
在使用乙酸乙酯时,应注意适当的通风和个人防护措施。严格遵循操作规程,避免与其他化学物品发生反应。
异构体对水解速率的影响
乙酸乙酯存在多种异构体,不同异构体的结构差异导致其水解速率有所不同。某些异构体水解速率较快,而其 他异构体较慢。
水解速率的测定方法
有多种方法可以测定乙酸乙酯的水解速率,包括酸碱滴定法、比色法、气相色谱法、液相色谱法、红外光谱法 以及原子吸收法。
烟气脱硝用尿素水解的计算与中试

烟气脱硝用尿素水解的计算与中试针对烟气脱硝用尿素水解反应体系,依托已搭建的尿素水解中试试验台,在建立水解反应平衡常数和NH3-CO2-H2O-CO(NH2)2四元体系相平衡计算方法的基础上,利用ASPEN软件建立模型来计算反应器的产氨能力,与装置实际运行结果进行对比。
结果表明,设计的尿素水解反应装置运行参数与计算结果一致,模型建立和计算方法可行,控制工况150℃、0.6MPa时,尿素溶液浓度越高反应器产氨能力越大,出口气H2O含量越少,装置经济性较高,符合理论计算。
据中电联月报统计,截至2016年3月末,全国6000千瓦及以上电厂火电装机容量10.1亿千瓦。
预计到2020年,我国火电装机容量将有可能超过12亿千瓦。
其中,减少燃煤电厂的NOx排放对环境造成的污染问题,将越来越受到重视。
随着环保行业的制度约定愈加严格,对液氨潜在的危险性进行了规定,燃煤电厂脱硝用尿素水解制氨技术作为一个脱硝还原剂制备方法已经受到普遍关注。
由于国内技术的欠缺,电厂基本直接采购国外U2A尿素水解制氨反应器,近年来国内某些机构研发了自主产权的尿素水解反应器。
但因为技术的保密性和水解反应器的使用限制性,公开的资料几乎没有。
为了填堵这一技术空白,2012年以来,以“千人计划”海外专家为课题负责人的科研团队开展尿素水解技术攻关,通过理论计算初步设计水解反应工艺和水解反应器参数,搭建燃煤电厂脱硝用尿素水解制氨中试试验台,分析操作温度、操作压力、质量流量等对尿素水解率和产氨量的影响,验证设计方案和理论计算方法的适用性,从而开发出一套拥有完全自主知识产权与多项国家发明专利的尿素水解制氨工艺。
本文首先在建立尿素水解反应平衡常数(假设遵循尿素合成过程的反应平衡常数)和NH3-CO2-H2O-CO(NH2)2四元体系相平衡计算方法的基础上,采用PR状态方程结合修正的UNIQUAC模型,利用ASPEN 软件模拟计算,不仅验证了方法的可行性,还在搭建的中试试验台上对脱硝用尿素水解工艺进行试验模拟,优化反应控制因素和条件,获得较高的尿素水解转化率和较高的装置产氨能力。
最新水解平衡常数计算资料

练习3.(2013·福建)(5)HR是一元酸.室温 时,0.250mol/LNaOH溶液滴定25.0mL HR溶液时,溶液 的pH变化情况如图所示。其中,a点表示两种物质恰 好完全反应。
①上图中x______7(填“>”、“<”或“=”)。 ②室温时,HR的电离常数Ka=_____(填数值)。
解析:
水解平衡常数计算
CH3COO-(aq)+H2O(l)==CH3COOH(aq)+OH-(aq), Kh=c(CH3COOH)×c(OH-)/c(CH3COO-) c(OH-)=Kw /c(H+)代入上式, Kh1=c(CH3COOH)×Kw /c(H+)×c(CH3COO-) = Kw/Ka。
同理, 氯化铵:可得Kh2=Kw/ Kb。 醋酸铵:可得Kh3= Kw/(Ka×Kb)。
解析:由电荷守恒知:c(H+)+c(NH4+)=c(Cl-)+c(OH-), 因为c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液显中性。 NH3·H2O的电离常数由电离平衡式决定: NH3·H2O ==NH4++OH-,由于氨水与盐酸等体积中和, 故混合溶液中的NH4+与NH3·H2O的浓度均减半, c(NH4+)=c(Cl-)=0.01/2mol·L-1, c(NH3·H2O)=(a﹣0.01)/2mol·L-1;因溶液显中性, c(OH-)=10-7mol·L-1; Kb=[c(NH4+).c(OH -)]/c(NH3·H2O)= (0.01/2mol·L-1×10-7mol·L1)/[(a﹣0.01)/2mol·L-1]=[10-9/(a﹣0.01)]mol·L-1。
根据水解反应化学方程式配平的常用方法

根据水解反应化学方程式配平的常用方法
在化学反应中,水解反应是一种常见的反应类型。
水解反应是指由水分解化合物所产生的反应。
为了正确描述水解反应的化学方程式,需要对方程式进行配平。
下面介绍几种常用的水解反应方程式配平方法。
1. 代数法配平:代数法是最常见和最简单的水解反应方程式配平方法之一。
该方法通过设定反应物和生成物的系数,使得方程式中的原子数目保持平衡。
通过逐步调整反应物和生成物的系数,可以得到配平的化学方程式。
2. 半反应法配平:半反应法在配平水解反应方程式中也是一种常用的方法。
此方法将水解反应方程式分解为氧化半反应和还原半反应。
然后,针对氧化半反应和还原半反应分别进行配平,最后将两个反应式结合,得到完整的配平方程式。
3. 离子电荷法配平:离子电荷法是针对含有离子的水解反应方程式的一种配平方法。
该方法通过调整反应物和生成物中离子的电
荷数目,使得整个方程式中的电荷保持平衡。
通过逐步调整离子的系数和电荷数目,可以得到配平的方程式。
需要注意的是,在配平水解反应方程式时,应遵循化学反应平衡的原则,确保方程式中的质量、电荷和原子数目都得到平衡。
同时,要根据实验数据或理论计算结果进行验证,确保配平后的方程式准确无误。
以上是一些常用的水解反应方程式配平方法,选择合适的方法并灵活运用,可以帮助我们正确描述和理解水解反应的化学过程。
水解器出力计算

水解器出力计算
一、引言
水解器是用于处理水中的各种污染物的设备,其出力决定了处理能力的大小。
本文将介绍水解器的出力计算方法,帮助读者了解如何计算水解器的处理能力。
二、水解器出力计算公式
水解器的出力计算公式如下:
Q = (m×q) / (1000×3600×t)
其中,Q为水解器出力,单位为立方米每小时;m为设备质量,单位为吨;q为设备质量与处理水量的比值,单位为吨/吨;t为设备工作时间,单位为小时。
三、参数确定
1.设备质量m:根据设备的型号和规格确定。
2.设备质量与处理水量的比值q:根据设备的性能参数确定。
3.设备工作时间t:根据实际需要确定,一般为24小时。
四、实例计算
假设某型号的水解器,其设备质量m为10吨,设备质量与处理水量的比值q为0.01吨/吨,设备工作时间t为24小时。
则该水解器的出力计算如下:Q = (10×0.01) / (1000×3600×24) = 1/864000立方米每小时。
五、结论
通过以上计算,可以得到该水解器的出力为1/864000立方米每小时。
在实际应用中,需要根据水质、水量等实际情况进行调整和优化,以保证水解器的处理效果和处理能力达到最佳状态。
高中化学——常见水解反应总结

高中化学——常见水解反应总结编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学——常见水解反应总结)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学——常见水解反应总结的全部内容。
常见水解反应一.简单水解反应二.双水解 (一)不是彻底水解,比单一离子水解要强,用表示,例: 1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2—+H 2O HCO 3—+NH 3。
H 2O2.CH 3COON H 4水解离子方程式为:CH 3COO-+NH 4++H 2O CH 3COOH+NH3.H 2O 3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+NH 3.H2O(二)彻底水解, 用“=”,例:1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3)水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al (OH )3↓+3Na 2SO 4+6CO 2↑水解离子方程式为:Al 3++3HCO 3-=Al (OH)3↓+3CO 2↑2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。
]水解离子方程式为:2Al 3++3S 2-+6H 2O=2Al (OH )3↓+3H 2S↑3.Al 3+与CO 32-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2CO 3、K 2CO 3溶液混合.]水解离子方程式为:2Al 3++3CO 32—+3H 2O=2Al (OH )3↓+3CO 2↑4.Al 3+与AlO 2—[如AlCl 3、Al 2(SO 4)3、Al(NO 3)3与NaAlO 2、KAlO 2溶液混合。
2017执业药师西药学知识点:水解反应

2017执业药师西药学知识点:水解反应执业药师栏目整理了“2017执业药师西药学知识点:水解反应”大家快做好准备吧。
水解反应可分为离子型水解和分子型水解两大类,离了型水解是强酸一弱碱型盐或强碱一弱酸盐等具有离子键的药物与水的瞬时反应速度一般比较缓慢,在H+或OH-催化下,反庆加速并趋于完全。
分子型水引起分子结构的断裂,可使药物失效或减效。
例如(用通式表示)1、酯类药物的分解;很多含有酯的药物,在溶液中容易被水解生成有机羧酸和醇的混俣物。
这种水解主要是碳原子和氧原子之间即酰一氧键之间的共价键的。
虽然个别酯类(主要是低分子量的伯醇酯类药物)在单纯的水中也能产生明显的水解,但大多数酯解酶)的催化下才能加速其反庆,使反太进行完全。
酯的酸或碱催化水解的动力学方程式通式:d【酯】/dt=-k【酯】【H+】d【酯】/dt=-k【酯】O【H-】故为二级反应。
但如【H-】或【OH+】>>【酯】,或用缓冲盐保持【H-】或【OH+】于几乎不变,则:d【酯】/dt=-k【酯】【酯】故为伪一级反应。
酯的水解常为一级或伪一级动力学反庆但有时是二级反应。
琥珀酰氯化胆碱较氯化乙酰胆碱稳定,注射液(PH3-5)可以98-1000,30分钟灭菌粉剂安瓿为宜。
医学教育网|搜集整理琥珀酰氯化胆碱溶液在PH3.7左右时最为稳定,在P0.9-8.5不解反应是一级反应,反应速度常数可用嗵式K=1.36×10“exp(-17230/RT)计算。
本品水解酸一碱催化,例如醋酸盐缓冲液(600,离子强度=0.2,PH=4.69,3.98)分解为二级反应,反应速度数为5×10(升/克分子小时)。
故该注射液不应含有缓冲剂;。
羧酸酯(R-C-OR)的水解程度与R的结构关系很大,R基愈大或碳上的烷基或其他基团占据的间愈大,则阻碍H或OH 对酯寒攻的作用愈大,故该酯尖药物愈不易被水解所以溴本辛、普鲁本辛就比较稳定,但要制成可以以久使用的水溶液还是困难的,制成片剂时水分也应注意,普鲁本辛片剂的水份如果超过3%,贮藏一年以后咕吨酸的含量将超过药典规定(>2%)。
高中化学中的水解反应

高中化学中的水解反应1、单水解---可逆水解NH4Cl+H2O NH3·H2O+HCl NH4++H2O H++NH3·H2OFeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+ AlCl3+3H2O Al(OH)3+3HCl Al3++3H2O Al(OH)3+3H+CuSO4+2H2O Cu(OH)2+H2SO4(金属活动顺序表中Mg2+以后的阳离子均水解)NaHCO3+H2O H2CO3+NaOH (NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O NaHCO3+NaOH CO32-+H2O HCO3-+OH–NaHCO3+H2O H2CO3+NaOH(第一步远远大于第二步,二步不能叠加)Na2SO3+H2O NaHSO3+NaOH SO32-+H2O HSO3-+OH–NaHSO3+H2O H2SO3+NaOH(第一步远大于第二步,二步不能叠加)HSO3-+H2O H2SO3+OH- Na2S+H2O NaHS+NaOH S2-+H2O HS-+OH–NaHS+H2O H2S+NaOH(第一步远远大于第二步,二步不能叠加) HS-+H2O H2S+OH-Na3PO4+H2O Na2HPO4+NaOH PO43-+H2OHPO42-+OH–Na2HPO4+H2O NaH2PO4+NaOH HPO42-+H2OH2PO4-+OH–NaH2PO4+H2O H3PO4+NaOH H2PO4-+H2OH3PO4+OH–CH3COONa+H2O CH3COOH+NaOH CH3COO-+H2OCH3COOH+OH–C6H5ONa+H2O C6H5OH+NaOH C6H5O-+H2OC6H5OH+OH–2、双水解CH3COONH4+H2O CH3COOH+NH3·H2ONH4F+H2O HF+NH3·H2OAl2S3+6H2O==Al(OH)3↓+H2S↑(隔绝空气,密封保存)Mg3N2+6H2O==Mg(OH)2↓+NH3↑(隔绝空气,密封保存)Na3P+3H2O==3NaOH+PH3↑(隔绝空气,密封保存)Zn3P2+6H2O=Zn(OH)2↓+PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==Ca(OH)3↓+C2H2↑(隔绝空气,密封保存)C2H5ONa+H2O==C2H5OH+NaOH。
化学溶液水解常数计算公式

化学溶液水解常数计算公式在化学领域中,溶液水解常数是指溶液中一种化合物水解成离子的速率常数。
水解常数的计算对于理解溶液中化合物的性质和反应速率具有重要意义。
本文将介绍溶液水解常数的计算公式以及相关的理论知识。
溶液水解常数的定义。
溶液水解常数通常用K表示,它是描述溶液中一种化合物水解成离子的速率常数。
对于一般的水解反应:A + H2O → B+ H+。
其中A表示原始化合物,B-表示水解产物的阴离子,H+表示水解产物的阳离子。
水解反应的速率可以用以下公式表示:r = k[A]其中r表示反应速率,k表示水解常数,[A]表示原始化合物的浓度。
水解常数k的单位通常为mol/L/s。
溶液水解常数的计算公式。
溶液水解常数的计算需要考虑溶液中化合物的浓度以及水解反应的速率。
一般来说,水解常数可以通过以下公式计算:K = (k[A])/[A]其中k表示水解反应的速率常数,[A]表示原始化合物的浓度。
通过测定水解反应的速率常数k以及原始化合物的浓度[A],就可以计算出溶液水解常数K的数值。
溶液水解常数的影响因素。
溶液水解常数的数值受到多种因素的影响,主要包括温度、溶剂、离子强度等。
在一定温度下,水解常数随着溶液中化合物浓度的增加而增加,这是因为水解反应的速率与原始化合物的浓度成正比。
此外,溶液中的离子强度也会影响水解常数的数值,一般来说,离子强度越大,水解常数越大。
溶液水解常数的应用。
溶液水解常数的计算和应用在化学领域中具有重要意义。
首先,它可以用来描述溶液中化合物的水解速率,从而帮助我们理解化学反应的机理。
其次,溶液水解常数还可以用来预测溶液中化合物的稳定性,对于溶液的稀释和稀释过程也有一定的指导意义。
此外,溶液水解常数还可以用来计算溶液中离子的浓度,为溶液的配制和调节提供依据。
总结。
溶液水解常数是描述溶液中一种化合物水解成离子的速率常数,它的计算需要考虑溶液中化合物的浓度以及水解反应的速率。
溶液水解常数的数值受到多种因素的影响,包括温度、溶剂、离子强度等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水解反应计算与选型
水解反应池的计算
处理重金属废水时,因为金属离子在水中可以发生水解反应,在本设计重金属废水本身呈酸性,添加生物制剂后pH值在3.0左右,其水解过程是一个向酸性体系中滴加碱的过程,向此酸性重金属废水中投加碱,可促进重金属废水所含的金属离子发生水解反应,生成难溶的氢氧化物沉淀。
此过程是水解反应的过程。
因为该设计中流量属于小流量废水,机械反应池反应效果好,损失比较小可适应水质变化,所以选机械反应池其分为水平轴式和垂直轴式两种,垂直轴式应用较广,而水平轴操作和维修不方便,目前较少应用。
最终我们选用垂直轴式机械搅拌池。
设计任务与原始数据:
水解反应池分为三级,PH=10,总的水解时间为45min
进水流量 Q
=100.0632m3/h 取100m3/h
5
添加质量浓度为80g/LNaOH溶液。
NaOH溶液与重金属发生水解反应为均相反应。
本设计分为三级,反应池采用两格串联,设置2台搅拌机,反应池分格隔墙上的过水孔道山下交错布置。
反应池尺寸计算
Qmax=1.2Q=120m3/h,每个池子停留时间t=45/3=15min
每个池子体积V=Q5t/60=120×15/60=30m3。
每格有效尺寸:B=2m,L=2m,H=3.75m.
V=BLH=2×2×2×3.75=30m3.
反应池超高取0.45m,池子的总高度为4.2m
搅拌器的设计与计算
①叶轮直径及桨板尺寸
叶轮外缘距池子内壁距离取0.25m,叶轮直径为:
D1=2-2×0.25=1.5m
L·=1.13×2=2.26m。
以当量直径De替代D,当量直径De=1.13W
为了加强混合效果,在内壁设4块挡板。
每块挡板宽度b=De/10=0.226m。
②桨板中心点旋转半径及转速 搅拌器的有关参数见表一:
项 目
符
号 单 位 推荐参数 搅拌器外缘线速
度 ν m/s 0.1~0.5
搅拌器直径 d m (31~3
2)D 搅拌器距池底高
度 E m (0.5~1.0)d 搅拌器叶浆数 Z 2,4.6 搅拌器宽度 b m
(0.1~0.25)d
搅拌器层数 e 当
D H ≤1.2~1.3时,e =1;当D
H >1.2~1.3时,e >1 搅拌器层间距离 S 0 m (1.0~1.5)d 安装位置要求
相邻两层叶浆交叉90o 安装
R=d/2=De/4=2.26/4=0.565m
搅拌器桨板宽度b=0.1d=0.113m,b/l=1/10桨板长度l=10b=1.13m 每台搅拌机桨板中心点旋转线速度取: 第一格 v 1=0.5m/s 第二格 v 2=0.35m/s
则每台搅拌机每分钟转数为:
第一格 n 1=R v π2601
=8.45(rad/min)
第二格 n 2=R v π2602
=5.95(rad/min)
③桨板旋转功率计算
a 桨板旋转线速度按表二。
桨板外缘线速度v=2πr i n/60(m/s)
分格 外侧浆板
v=2πr i n i /60=0.11n i 内侧桨板
V=2πr j n j /60=0.063n j 第一格 0.11n i =0.929 0.063n j =0.532 第二部
0.11n i =0.655 0.063n j =0.374
b 、每台搅拌机上桨板总面积为: A=8 bl=8×0.113×1.13=1.02(m 2) 桨板总面积与反应池截面积之比为: BH
A
=1.02/(2.5×2)=20.4%<25%.符合要求。
C 、求桨板宽径比系数K 值(两台台搅拌器完全相同) 外侧桨板 b/r i =0.113/0.75=0.15 查图得k i =3.3 内侧桨板 b/r 2=0.113/0.6=0.19 查图得kj=3
d 、求每台搅拌器的功率
每一格 P1=58A (Kiv i 3+K j v j 3)=123.35w 第二格 P2=58A (Kiv i 3+K j v j 3)=78.65w e 、配用电动功率
电动机总机械效率η1=0.75η2=0.7
第一格 N1=P1/η1η2=123.35/(0.75×0.7)=234.95w 第二格 N2=P2/η1η2=78.65/(0.75×0.7)=149.80w 4、G 和Gl 的核算
第一格 G1=
υμ
1
3P =64/s
第二格 G2=υμ
2
3P =50/s
G=
2
/2
212G G +=57/s
G t =57×45×60=15.3×104/s 经验算 G 和G t 均符合。
