高二化学上学期第一节氮族元素
高二化学氮气PPT课件

老百姓有句谚语叫:
NO2:
“雷雨发庄稼”,
红棕色,有刺激性,有毒的气 体谁,溶能于解水释理,跟其?水中反的应道.
3NO2+H2O = 2HNO3+NO 注意:
(l)NO2不能用排水法收集,只能用排空气法.
(2) 鉴别NO2和溴蒸气.可用加CCl4法或加AgNO3 溶液法.
(3)氮的氧化物都是大气污染物,其中NO2是造成 光化学污染的主要因素.
分子式
电子式
结构式
N2
:N ‥‥‥N:
N≡ N
4.氮气的化学性质
(1) 氧化性
a. 氮气与氢气的反应
N2 +3H2
高温高压 催化剂
2NH3
3Mg
Mg3N2 (淡黄色)
(2) 还原性: 氮气与氧气的反应
放电
N2+O2
2NO
5. 氮气的用途
(1) 合成氨、制氮肥、硝酸(工业上) (2) 作保护气(通常状况下氮气的化学 性质很不活泼) (3) 作冷冻剂(医学上,常用液氮作冷冻 剂,在冷冻麻醉条件下做手术等)
b.最高价氧化物通式为R2O5,对应水化物除 HNO3外其它均为H3RO4。 c.气态氢化物通式为RH3。
(2) 递变性
N P As Sb Bi
核电荷数 电子层数 原子半径(离子) 核对最外层电子的引力 失电子能力 还原性 金属性 非金属性
第一节 氮和氮的氧化物
一.氮
1.氮的存在
78%(体积比) 游离态:大气中N2占
33
灰砷:灰色固体
5.727
51
银白色金属
6.684
83 银白色或微红色金属
9.80
熔点
℃
-209.9 44.1 (白磷) 817
高二化学第一章氮族元素氮和磷课件人教版原创.ppt

2、磷的化学性质 (1)与氧气的反应 (2)与氯气的反应
点燃
2P + 3Cl2 === 2PCl3
2P + 5Cl2 === 2PCl5 (或 PCl3 + 3Cl2 === PCl5 )
点燃
2、磷的化学性质 (1)与氧气的反应 (2)与氯气的反应 (3)白磷红磷的转化 白磷
隔绝空气加热到260℃ 加热到416℃ 升华后,冷凝
[参考答案]:6、R2O5 HRO3或H3RO4 RH3
第一节
一、氮气:
氮和磷
1、N2分子结构: N≡N 叁键,键很稳定。通常情况下,氮 气的化学性质不活泼,很难与其他物质 发生化学反应。
BACK
第一节
一、氮气:
氮和磷
1、氮气的分子结构:
2、氮气的物理性质:
3、氮气的化学性质:
N≡N 键能大 ,打开键不容易,所以 反应条件难。
[参考答案]:
1、MgO质量大 2、B C D ,其中方法D最佳 3、 4、
5、
二、磷
白磷 红磷
同素异形体
白磷的分子结构
1、磷的物理性质
二、磷
1、磷的物理性质
2、磷的化学性质
(1)与氧气的反应 4P + 5O2 === 2P2O5 白磷燃烧时可表示为 P 4+ 5O2 === 2P2O5
点燃
点燃
小结:①非金属性较氧族、卤族元素弱;
质困难。
②与H2化合的条件较氧族、卤族单
③氢化物的稳定性较氧族、卤族元 素形成的氢化物差。 ④最高价含氧酸的酸性较氧族,卤 族元素的形成的酸的酸性弱。
氮族元素的存在及单质物理性质:
存在:
1、氮主要以单质形态存在空气中。除土壤中含有一些铵盐、 硝酸盐外,氮以无机化合物形式存在于自然界是很少的。氮普遍 存在于有机体中,它是组成动植物蛋白质的重要元素。 2、磷在自然界中总是以磷酸盐的形式出现的,例: Ca3(PO4)2——磷酸钙,Ca5F(PO4)3——磷灰石。磷是生物体不可 缺少的元素之一。在植物体中磷主要含于种子的蛋白质中,在动 物体中,则含于脑、血液和神经组织的蛋白质中,骨骼中也含有 磷。磷有多种同素异形体,最常见的是白磷和红磷。
第一章 氮族元素

第一章 氮族元素第一节 氮和磷教学目标1. 使学生了解氮族元素性质的相似性和递变规律。
2. 使学生掌握氮气的化学性质,充分认识结构和性质的关系。
3. 使学生了解磷的性质。
4. 培养学生运用元素周期律知识解决问题的能力。
教学重点5. 氮族元素性质的相似性和递变规律。
6. 氮气的化学性质。
教学难点氮的分子结构和化学性质的关系。
课时安排二课时教学方法1.通过元素周期律知识的复习,引导学生分析、讨论、总结氮族元素性质的相似性和递变规律。
2.通过分析氮气的分子结构,启发学生认识氮气的化学性质。
3.通过实验的研究,认识红磷和白磷的关系及性质差异。
教具准备充满NO 2试管、大烧杯、橡胶手套、石蕊试液、铁架台、长硬质玻璃管、酒精灯、红磷、白磷、火柴。
教学过程第一课时[引言]我们在高一学习了卤族、氧族、碳族三族主族元素,请同学们把这三族的元素符号填写在周期表相应的位置上。
[学生活动]填写周期表。
[过渡]位于第Ⅳ主族和第Ⅵ主族之间的第Ⅴ主族, 称之为氮族元素。
我们这节课就来学习氮族元素的性质。
[板书]第一章 氮族元素[师]从氮族元素在周期表中的位置来看,这一族元素有什么相同和不同之处?[生]最外层都应该有5个电子,不同之处是电子层数不同。
[师]结构决定性质,氮族元素原子结构的相似性决定了元素性质的相似性,但由这些元素形成的单质的性质却有很大的差异,尤其是氮和磷。
下面我们就来学习氮和磷的性质。
[板书]第一节 氮和磷[师]我们都知道,氮气占空气体积分数的78%,我们时时刻刻都在氮气的包围之中。
根据你的观察,并结合课本,总结出氮气有哪些物理性质。
ⅣA ⅤA ⅥA ⅦAC N O FSi P S Cl Ge As Se Br Sn Sb Te IPb Bi Po At[板书] 一、氮气1. 氮气的物理性质[生]无色,无味,难溶于水,比空气略轻,熔沸点低。
[师]在呼吸时,我们吸入人体内的空气中的氮气会全部呼出,氮气对维持人的生命活动似乎没有什么用处。
人教版第二册高中化学第一章 氮族元素2
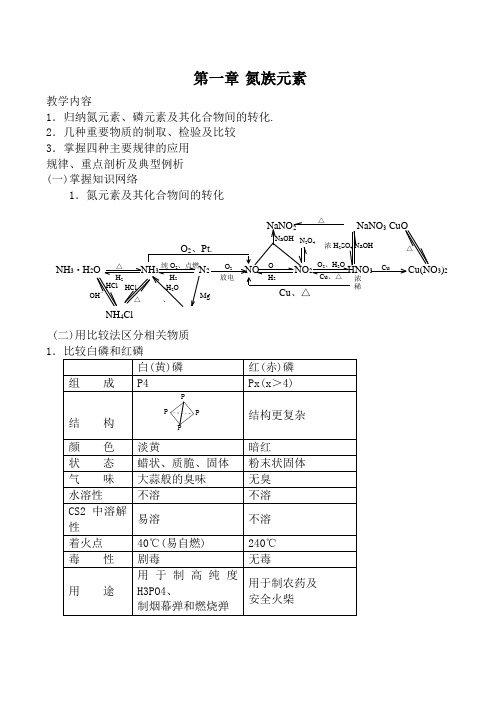
第一章 氮族元素教学内容1.归纳氮元素、磷元素及其化合物间的转化. 2.几种重要物质的制取、检验及比较 3.掌握四种主要规律的应用 规律、重点剖析及典型例析 (一)掌握知识网络1.氮元素及其化合物间的转化(二)用比较法区分相关物质△△ H 2纯O 2、点燃 H 2O 2 放电O H 2O 2、H 2OCu 、△Cu O 2、Pt.浓稀Cu 、△NaNO 2 NaNO 3 CuONaOH N 2O 4浓H 2SO 4 NaOHMgHCl HCl OH-△、H 2O△NH 4ClNH 3·H 2O NH 3 N 2 NO NO 2 HNO 3 3)22(三)抓住典型物质的结构、性质、用途、制取等内在关系 1.氮气物 性难溶于水熔沸点很低 N2 无色无气味 气体2非极性分子 分子晶体 N ≡N 叁键键能大:N::N: . . 固定常 温:很难反应(作保护气) 高 温(或放电) :也能反应(制NH 3、HNO 3) 氮的化合态 氧化性N 2+3H 2 2NH 3 高温、高压 催化剂+N 2 Mg 3N 2点燃 化 性 用 途还原性 N 2+O 2 2NO 放电3.硝酸无色 有刺激性 易挥发(或Fe(OH)2 M(NO 3)2+NO 2(或N 2 任意比溶于水 M(NO 3)n (高价)+NO 2HNO 3 酸性 不稳定性 氧化性HNO 3=H ++NO 34HNO 3 4NO 2+O 2+2H 2O 久置 黄 HNO 3 △或光棕色瓶、冷暗处、密封浓HNO 3 C 、S 、P Fe 、Al一般金属CO 2、SO 2、H 3PO 4 钝化 稀一般金属 较活泼金属 Zn 、Mg 等I -S 2-Fe 2+溶于+浓HCl王水 溶解Pt 、AuM(NO 3)n (高价)+NOI 2S +NOFe 3+冷△注意1.NH3的干燥剂选用① 氨是碱性气体(有水),故不能用酸性干燥剂.如浓H2SO4、P2O5等 ② 氨与CaCl2反应生成CaCl2·8NH3.故也不能用无水CaCl2 ③ 氨只能用碱性干燥剂如碱石灰 2.氨催化氧化法制HNO3有关事项(1)为提高原料转化率,应补充空气,多次氧化和吸收 (2)尾气吸收——用碱液NO +NO2+2NaOH =2NaNO2+H2O 2NO2+2NaOH =NaNO3+NaNO2+H2O 当n 2NO :n NO ≥1.均可被吸收完全 (3)硝酸浓度的提高稀硝酸 浓缩(五 ①吸水剂 ②蒸发浓H 2SO 4或△(六)重要规律 1.铵盐分解规律 铵盐热稳定性差,受热均能分解.但请注意:未必有NH3产生.这由盐中对应酸的稳定性、挥发性、氧化性等因素来决定.① 稳定易挥发酸成的铵盐 NH3↑+酸的挥发性物质如 NH4Cl(s) NH3↑+HCl ↑ 类似的有 NH4F NH4Br “假升华” 能否类推 NH4I ? 区别 I2(s) I2(g)② 稳定难挥发酸成的铵盐 NH3↑+酸如 (NH4)2SO4 2NH3↑+H2SO4③ 不稳定且无强氧化性酸成的铵盐 NH3↑+酸的分解产物如 (NH4)2CO3 2NH3↑+H2O +CO2↑NH4HCO3 NH3↑+H2O +CO2↑NH4I NH3↑+I2↑+H2↑ (有色)④ 由不稳定且有强氧化性酸(HNO3)成的盐 一般发生氧化还原反应 温度不同,产物不同 △△分解化合 冷NH 4Cl (s)△升华 冷 I 2(s)△△△△△△△NH 4N低温,可得NH3+HNO3如 5NH4NO3 2HNO3+4N2↑+9H2O2NH4NO3 2N2↑+O2↑+4H2O +Cl易爆物 注意妥善保存,勿研磨、勿撞击. 2.磷酸盐的溶解性规律① 磷酸二氢盐一般都易溶于水② 磷酸一氢盐和磷酸正盐大多难溶于水(除K +、Na +、NH4+等)③ 同种阳离子所形成的三种盐的溶解性大小(同温):磷酸二氢盐>磷酸一氢盐>磷酸正盐如 NaH2PO4>Na2HPO4>Na3PO4Ca(H2PO4)2>CaHPO4>Ca3(PO4)2 联系:制磷肥的主要目的:难溶于水 易溶于水 植物吸收 磷矿石 +(H2SO4) 磷酸二氢钙 [Ca3(PO4)2] 或H3PO4 Ca(H2PO4)2190℃500℃或撞击 (爆炸性分解反应)转 化 有利于。
人教版高中化学第一册必修氮族元素

氮族元素-配平-计算★知识考点氮族元素1结构相似与递变:2一氮及其化合物(一)氮气1氮气结构:2氮气的性质:①氧化性:223H N +32NH 2323N Mg Mg N 点燃+ ②还原性: NO O N 222放电+32N 的工业制法及氮的固定(二)氮的氧化物1 N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 52 NO+O 2 ;NO+O 2+H 2O-3 NO 2+H 2O ;NO 2+O 2+H 2O=(三)氨及其盐1结构:空间构型 ;结构式 ;物理性质2化学性质:(1)与水的反应: (2)与酸反应:(3)还原性(与氯气、氧气、NOx 等反应):3 制法及用途:(S+S 型: S+L 型: ) 4铵盐的四大特点:① 易溶于水,且吸热② 与碱反应:③受热易分解:5氨根离子的检验方法:(三)硝酸及其盐1物理性质:2化学性质:(1)强酸性HNO3具有酸的通性,能使酸、碱指示剂变色,能与碱、金属、碱性氧化物、某些盐反应。
(2)不稳定性4HNO34NO2↑+O2↑+2H2O注:①浓HNO3一般呈黄色,是由于HNO3分解产生的NO2溶于硝酸的缘故。
②硝酸浓度越大越易分解。
因此,浓HNO3应放入棕色瓶中(避光),并放在阴凉处保存(避免受热分解),试剂瓶用玻璃塞而不能用橡皮塞(HNO3会腐蚀橡皮塞)。
(3)氧化性钝化与金属反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (实验室制NO2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O (实验室制NO)Fe+6HNO3(浓) Fe(NO3)3+3NO2↑+3H2O与非金属反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2OP+5HNO3(浓)=H3PO4↑+5NO2↑+H2O与还原性化合物(如 H2S、HBr、HI、Fe2+等)反应6HI+2HNO3(稀)=3I2+2NO↑+4H2OHI+6HNO3(浓)=HIO3+6NO2↑+3H2O反应规律:①除Au、Pt等少数金属外,硝酸几乎可能氧化所有的金属。
高二化学硝酸

• 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
讨论: 1、反应中HNO3体现了哪些性质?
(氧化性、酸性) 2、Cu与盐酸是否反应,为什么?
+5
+2
二.硝酸的化学性质
3. 硝酸的强氧化性 硝酸具有强的氧化性,几乎可以使所有金属 (金、铂 除外)氧化玻尔是丹麦著名的物理学家,曾获得诺贝尔奖。 第二次世界大战中,玻尔被迫离开将要被德国占领 的祖国。为了表示他一定要返回祖国的决心,他决 定将诺贝尔金质奖章溶解在一种溶液里,装于玻璃 瓶中,然后将它放在柜面上。后来,纳粹分子窜进 玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下, 他们却一无所知。这是一个多么聪明的办法啊!战 争结束后,玻尔又从溶液中还原提取出金,并重新 铸成奖章。新铸成的奖章显得更加灿烂夺目,因为, 它凝聚着玻尔对祖国无限的热爱和无穷的智慧。
⑴ ⑵ ⑶ ⑷
常温下,浓硝酸使铁、铝等金属钝化 硝酸与金属反应不放出氢气 氧化性:浓硝酸>稀硝酸 一般情况下: 浓硝酸被还原为NO2 稀硝酸被还原为NO
二.硝酸的化学性质
硝酸具有强的氧化性,能使许多非 金属(如碳、硫、磷等)、某些有机物 (如松节油,锯末等)及还原剂(如 H2S, HI, HBr, SO2, Na2SO3等)氧化。
第一章 氮族元素
第三节
一.硝酸的物理性质
纯硝酸是无色、有刺激性气味的液体, 密度 比水大,能以任意比溶解于水。
低沸点(83℃),易挥发。
质量分数为69%的硝酸为浓硝酸。 质量分数为98%以上的硝酸为发烟硝酸。
思 考
98%以上的硝酸为什么会产生发烟现象? 发烟硝酸挥发出来的是“烟”么? 挥发出的硝酸和空气中的水蒸气结合,形成小 液滴悬浮在空气中,因此事实上是雾。
人教版第二册高中化学第一章 氮族元素2
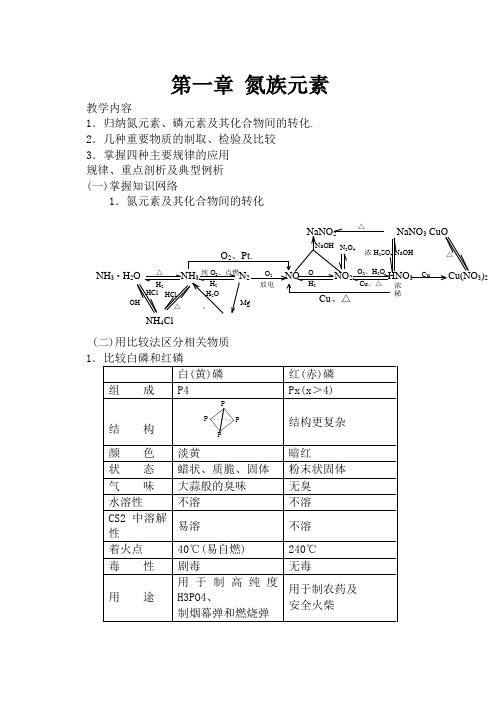
第一章 氮族元素教学内容1.归纳氮元素、磷元素及其化合物间的转化. 2.几种重要物质的制取、检验及比较 3.掌握四种主要规律的应用 规律、重点剖析及典型例析 (一)掌握知识网络1.氮元素及其化合物间的转化(二)用比较法区分相关物质△△ H 2纯O 2、点燃 H 2O 2放电O H 2O 2、H 2O Cu 、△CuO 2、Pt.浓稀Cu 、△NaNO 2 NaNO 3 CuONaOH N 2O 4浓H 2SO 4 NaOHMgHCl HCl OH-△、H 2O△NH 4ClNH 3·H 2O NH 3 N 2 NO NO 2 HNO 3 Cu(NO 3)22(1.氮气物 性 难溶于水熔沸点很低 N2 无色无气味气体 2非极性分子分子晶体 N ≡N 叁键键能大:N::N: . 化 性 用 途3(1.NH3的干燥剂选用①氨是碱性气体(有水),故不能用酸性干燥剂.如浓H2SO4、P2O5等②氨与CaCl2反应生成CaCl2·8NH3.故也不能用无水CaCl2③氨只能用碱性干燥剂如碱石灰2.氨催化氧化法制HNO3有关事项(1)为提高原料转化率,应补充空气,多次氧化和吸收(2)尾气吸收——用碱液NO +NO2+2NaOH =2NaNO2+H2O 2NO2+2NaOH =NaNO3+NaNO2+H2O 当n 2NO :n NO ≥1.均可被吸收完全 (3)硝酸浓度的提高稀硝酸 浓缩(五(六1.铵盐分解规律铵盐热稳定性差,受热均能分解.但请注意:未必有NH3产生.这由盐中对应酸的稳定性、挥发性、氧化性等因素来决定.① 稳定易挥发酸成的铵盐 NH3↑+酸的挥发性物质如 NH4Cl(s) NH3↑+HCl ↑ 类似的有 NH4F NH4Br “假升华” 能否类推 NH4I ? 区别 I2(s) I2(g) ② 稳定难挥发酸成的铵盐 NH3↑+酸①吸水剂 ②蒸发浓H 2SO 4或△△分解化合 冷NH 4Cl (s)△升华 冷I 2(s)△△如 (NH4)2SO4 2NH3↑+H2SO4③ 不稳定且无强氧化性酸成的铵盐 NH3↑+酸的分解产物如 (NH4)2CO3 2NH3↑+H2O +CO2↑NH4HCO3 NH3↑+H2O +CO2↑NH4I NH3↑+I2↑+H2↑ (有色)④ 由不稳定且有强氧化性酸(HNO3)成的盐 一般发生氧化还原反应 温度不同,产物不同 低温,可得NH3+HNO3如 5NH4NO3 2HNO3+4N2↑+9H2O2NH4NO3 2N2↑+O2↑+4H2O +Cl易爆物 注意妥善保存,勿研磨、勿撞击. 2① 磷酸二氢盐一般都易溶于水② 磷酸一氢盐和磷酸正盐大多难溶于水(除K +、Na +、NH4+等) ③ 同种阳离子所形成的三种盐的溶解性大小(同温):磷酸二氢盐>磷酸一氢盐>磷 酸正盐如 NaH2PO4>Na2HPO4>Na3PO4Ca(H2PO4)2>CaHPO4>Ca3(PO4)2 联系:制磷肥的主要目的:难溶于水 易溶于水 植物吸收 磷矿石 +(H2SO4) 磷酸二氢钙 [Ca3(PO4)2] 或H3PO4 Ca(H2PO4)2△△△△△190℃500℃或撞击 (爆炸性分解反应)转 化 有利于NH 4N。
氮族元素.ppt

高温高压
N2+3H2 催化剂
点燃
N2+3Mg
2NH3 (氧化性) 人工固氮
Mg3N2(氧化性)
N2+O2 放电 2NO (还原性)—自然固氮
游离态氮 (3)氮的固定:N2 根瘤菌
化合态氮
(4)制法: 分离空气 (氮气在空气中占78%) (5)用途:
3NO2 + H2O === 2HNO3 + NO
氮的氧化物---NO与NO2的性质比较
物性 毒性
NO
无色,刺激性气味
有毒(机理同CO)
NO2
红棕色,刺激性气味
有毒
与水 与O2 2NO + O2 = 2NO2
与O2、H2O 4NO + 3O2 + 2H2O = 4HNO3
3NO2 + H2O = 2HNO3 + NO 4NO2 + O2 + 2H2O = 4HNO3
)
磷的化合物
1、五氧化二磷(P2O5) 物性:白色固体 ,有强烈的吸水性 、脱水性。作干燥剂
化性:P2O5 + H2O(冷水) = 2HPO3 (剧毒)
P2O5 + 3H2O(热水)= 2H3PO4(无毒) 2、磷酸(H3PO4) 物性:无色透明晶体,有吸湿性,与水以任意比互溶。
化性:①是一种三元中强酸 ( 电离不完全 )
小结
NO
N2
NaNO2
NO2
N2O4
HNO3
SO3 NO I2 NO KOH
练习:不能将NO2和Br2蒸气区分开来的是( C )
高二化学氮族元素、氮和磷的单质通用版知识精讲

高二化学氮族元素、氮和磷的单质通用版【本讲主要内容】氮族元素、氮和磷的单质本讲着重运用同学们已有的元素化合物知识,结合元素周期律和原子结构、氧化还原反应的基本规律,研究、归纳、总结、拓展有关氮族元素及其单质和,常见问题及其解析方法。
【知识掌握】【知识点精析】氮族元素为元素周期表中ⅤA族元素,包括N、P、As、Sb、Bi等元素,这些元素的原子结构特征为最外电子层均具有五个电子,且中学化学中主要研究了氮及其化合物,其次是磷及其化合物。
氮族元素这一章,是在同学们学习了碱金属元素、卤族元素、氧族元素、碳族元素和原子结构及元素周期律之后,高中阶段学习的最后一族主族元素,由于有了前面的基础和相关的理论和方法,大家要运用自己的能力去主动学习和整理知识,学完之后,不仅掌握本章的相关知识技能,而且对元素化合物知识,要有一个全面的认识,这种认识包括对以族为单元的族内元素及其化合物性质的变化和原因,能够用所学理论,理解和初步解释相关问题,还要在物质结构和元素周期律的理论和对氧化还原反应基本了解的基础上对已学的所有的元素及其化合物的性质及相关递变规律,有一个统摄和整体的把握。
所以本章的学习,是高中阶段元素化合物学习的终结,也是化学学习踏上新的台阶即后面理论学习的准备。
在学习的过程中,同学们要始终体会:物质的结构决定性质,而性质反映结构,性质决定用途和制法、保存等。
即:一、氮族元素首先要记牢它们的元素符号,并且会推它们的原子序数。
比如知道N是7号,则下一周期的同族元素的原子序数,只要在相邻上一周期的元素的原子序数上加8,18,18,32,就可以推得,不必记住每一个。
人教版化学氮族元素一章的章图,对我们的学习是一个很好的提示,大家观察一下,立即就能知道,氮族元素的代表——氮元素的重要性:氮是生命体不可缺少的元素。
再看周期表中氮族元素的位置图:氮族元素在周期表中的位置它们处于第Ⅴ主族,我们可以推知,它们的最外层,都有5个电子。
高二化学第一章氮族元素学案

高二化学第一章氮族元素学案一、氮族元素1、位置及原子结构氮族元素位于周期表里的____族。
有____价电子,因而能____电子而显示_____价,最高价为______。
2、元素性质的变化规律氮族元素随着核电荷数的递增,获得电子的趋势________,因而非金属性_______。
氮族元素的非金属性比同周期的卤族、氧族____。
氢化物的通式是_______,最高价氧化物的通式_________,从氮到铋,_______能与氢直接化合,且生成物较稳定,磷与氢直接化合相当困难,且PH3不稳定,其余的元素都不能直接与H2化合,间接生成的氢化物均_______。
从氮到铋,其最高价氧化物的水化物酸性_____,碱性_______。
氮的最高价氧化物的水化物______是________,磷的最高价氧化物的水化物_______是中强酸。
二、氮气1、物理性质:纯净的氮气是一种色、气味的气体,密度比空气稍,溶于水。
加压和冷却后分别变成_____色的液体和______状固体。
2、分子结构:分子式_________________结构式_________________电子式_________________氮气是由氮原子组成的____原子分子。
氮分子中,2个氮原子共用_____对电子,形成____个共价键。
氮分子中的键都是_____性键,共用电子对不偏向任何一个原子,像这样以非极性键结合成的双原子分子是_______分子,3、化学性质:通常状况下,氮气非常,即使在3000C时也只有0、1%发生解离,但是在一定条件下,氮分子获得足够的能量,使共价键,就能与一些物质发生反应。
①N2与H2的反应式:______,表现了_______(氧化/还原)性。
②N2与O2的反应式:______,表现了_______ (氧化/还原)性。
4、氮的氧化物:名称一氧化氮二氧化氮化学式物理性质色气体,溶于水___色气体,溶于水、毒化学性质与水反应NO2+H2O与O2反应其他性质2NO23价;其最高价氧化物对应的水化物的化学式为HRO3或H3RO4;气态氢化物的化学式为RH3。
高二化学教案-【高二教案】第一节氮和磷 最新

第一章氮族元素第一节氮和磷教学目的:1.使学生了解氮族元素的相似性和递变规律。
2.使学生理解氮气的化学性质。
3.使学生了解磷的性质,使学生了解非极性分子的概念。
4.使学生掌握运用元素周期律和原子结构理论知识指导元素化合物知识学习的方法。
教学重点:1.氮族元素性质的相似性和递变性;氮气的化学性质。
2.磷的性质教学难点:1.氮气分子结构。
2.磷的化学性质。
课时安排:2课时教学方法:引导、探究、自学、对比、练习第一课时教学过程:【引言】到现在为止我们学过了哪几族元素?碱金属元素、卤族元素、氧族元素、碳族元素。
今天我们一起学习一族新的元素—氮族元素。
请学生思考下列问题:氮族元素包含哪些元素?他们在周期表中的位置?写出这些元素的元素符号和名称。
氮族元素的原子结构有什么特点?(相同点和不同点)【板书】第一章氮族元素(VA)氮族元素:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)【填写表格】【解释】我们都知道磁铁可以吸铁,当铁的距离里磁铁远的时候,磁铁不容易吸铁,而当铁离磁铁很近时就容易吸住磁铁。
同样的道理,非金属性与核电核数和原子半径有关系。
从氮到铋,随着核电核数逐渐增大,原子半径增大,其中原子半径起决定作用,原子核对最外层电子的吸引能力逐渐减弱,元素得电子的能力逐渐减弱,非金属性渐减弱,金属性渐增强。
【思考】氮族元素的非金属性与同周期的氧族元素比较哪个强为什么?从原子半径的角度分析氮族元素与氧族元素之间非金属强弱的比较。
【结论】同一周期,电子层数不变,核电核数就起主要作用。
随着核电核数逐渐增大,原子核对最外层电子的吸引能力逐渐增强,元素得电子的能力逐渐增大,非金属性逐渐增大,金属性逐渐降低。
所以氮族元素的非金属性要比同周期的氧族元素弱【学生阅读】氮族元素的主要化合价和单质的颜色、状态、密度、溶点、沸点。
【学生】氮族元素呈现多种价态,由于锑,铋为金属,所以为+3,+5。
颜色氮是无色气体,磷有白磷,红磷,白磷是白色或黄色固体,红磷是红棕色固体,砷是灰黑色,锑和铋为银白色。
高中化学氮族元素知识点
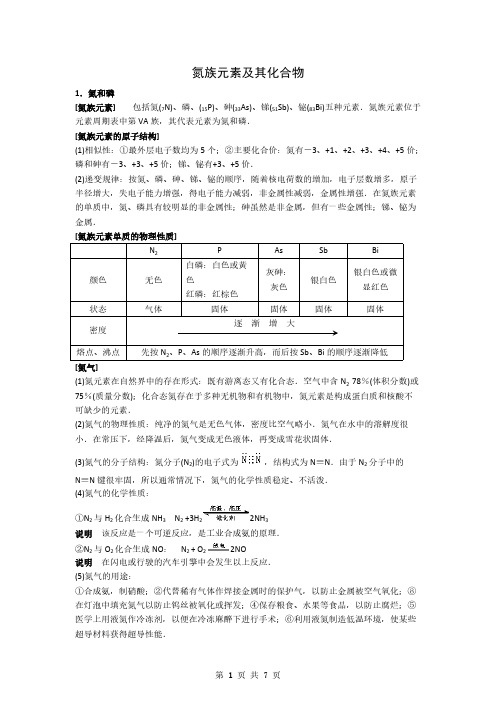
2NO + O2= 2NO2
②NO 中的氮为+2 价,处于中间价态,(工业制 HNO3 原理.在此反应中,
既有氧化性又有还原性
二氧化氮(NO2) 为红棕色、有刺激性气味、有毒的 气体,易溶于水
与 H2O 反应:
3NO2 + H2O=2HNO3 + NO
NO2 同时作氧化剂和还原剂)
2NO (2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO
可缺少的元素.
(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很
小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.
(3)氮气的分子结构:氮分子(N2)的电子式为
N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼. (4)氮气的化学性质:
①N2 与 H2 化合生成 NH3 N2 +3H2
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,通力根1保过据护管生高线产中敷工资设艺料技高试术中卷0资不配料仅置试可技卷以术要解是求决指,吊机对顶组电层在气配进设置行备不继进规电行范保空高护载中高与资中带料资负试料荷卷试下问卷高题总中2体2资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况1卷中下安,与全要过,加度并强工且看作尽护下可1都关能可于地以管缩正路小常高故工中障作资高;料中对试资于卷料继连试电接卷保管破护口坏进处范行理围整高,核中或对资者定料对值试某,卷些审弯异核扁常与度高校固中对定资图盒料纸位试,置卷编.工保写况护复进层杂行防设自腐备动跨与处接装理地置,线高尤弯中其曲资要半料避径试免标卷错高调误等试高,方中要案资求,料技编试术写5、卷交重电保底要气护。设设装管备备置线4高、调动敷中电试作设资气高,技料课中并3术试、件资且中卷管中料拒包试路调试绝含验敷试卷动线方设技作槽案技术,、以术来管及避架系免等统不多启必项动要方高式案中,;资为对料解整试决套卷高启突中动然语过停文程机电中。气高因课中此件资,中料电管试力壁卷高薄电中、气资接设料口备试不进卷严行保等调护问试装题工置,作调合并试理且技利进术用行,管过要线关求敷运电设行力技高保术中护。资装线料置缆试做敷卷到设技准原术确则指灵:导活在。。分对对线于于盒调差处试动,过保当程护不中装同高置电中高压资中回料资路试料交卷试叉技卷时术调,问试应题技采,术用作是金为指属调发隔试电板人机进员一行,变隔需压开要器处在组理事在;前发同掌生一握内线图部槽 纸故内资障,料时强、,电设需回备要路制进须造行同厂外时家部切出电断具源习高高题中中电资资源料料,试试线卷卷缆试切敷验除设报从完告而毕与采,相用要关高进技中行术资检资料查料试和,卷检并主测且要处了保理解护。现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
《氮族元素》课件

03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
【鼎尖教案】高中化学(大纲版)第二册 第一章 氮族元素 第一节氮和磷(第一课时)5页word文档

第一章氮族元素第一节氮和磷从容说课氮族元素是高中阶段介绍的最后一族主族元素。
在此之前,学生既学习了元素周期律和原子结构知识,又将其运用于学习氧族元素、碳族元素等元素化合物知识中,因此可以说,学生对于运用理论指导元素化合物知识学习的方法已经有所了解。
教材的引言以“思考”的形式让学生比较卤族元素、氧族元素和氮族元素的非金属性强弱,这样既复习了元素周期律的知识,也为同学们掌握氮族元素知识奠定了基础。
本节从学生熟悉的化肥入手,介绍氮和磷的单质。
大纲中对氮气的化学性质要求为“掌握”,是本节教学的重点。
教材以氮分子具有牢固的N≡N键因而结构稳定入手,说明氧气的化学性不活泼,从而说明结构决定性质;接着又联系化学键的知识,从分子获得足够的能量能使化学键断裂的角度,说明氮气在一定条件下还能与某些非金属反应,从而使学生认识氮气应有的化学性质。
虽然这样,但对具体物质的性质还应从结构入手,把结构和性质联系起来。
至于磷,在大纳中的要求为B层次,即要求了解。
教材在初中介绍过的磷与氧气反应的基础上,又介绍了磷与氧气的反应。
另外为了巩固和复习同素异形体的概念,教材着重介绍了磷的同素异形体白磷和红磷的性质差异,以及白磷和红磷的转化。
教学中可设计一些相关问题,引导学生阅读本部分内容,并注意归纳,不仅要找出相似点,关键要找出不同点。
这样学生就在掌握同族元素相似性的同时也掌握了物质的特性和个性。
本节教材联系实际,结合目前汽车污染问题,简单介绍了光化学烟雾,旨在增强学生的环境保护意识。
当然教学中不应忽视教材中配置的图画和照片的作用。
●教学目标1. 使学生了解氮族元素性质的相似性和递变规律。
2. 使学生掌握氮气的化学性质,充分认识结构和性质的关系。
3. 使学生了解磷的性质。
4. 培养学生运用元素周期律知识解决问题的能力。
●教学重点1. 氮族元素性质的相似性和递变规律2. 氮气的化学性质●教学难点氮的分子结构与氮气化学性质的关系●课时安排二课时●教学方法1. 通过元素周期律知识的复习,引导学生分析、讨论、总结氮族元素性质的相似性和递变规律。
高中化学 (大纲版)第二册 第一章 氮族元素 第一节氮和磷(第一课时)

第一章氮族元素第一节氮和磷沉着说课氮族元素是高中阶段介绍的最后一族主族元素。
在此之前,学生既学习了元素周期律和原子结构知识,又将其运用于学习氧族元素、碳族元素等元素化合物知识中,因此可以说,学生对于运用理论指导元素化合物知识学习的方法已经有所了解。
教材的引言以“思考〞的形式让学生比较卤族元素、氧族元素和氮族元素的非金属性强弱,这样既复习了元素周期律的知识,也为同学们掌握氮族元素知识奠定了根底。
本节从学生熟悉的化肥入手,介绍氮和磷的单质。
大纲中对氮气的化学性质要求为“掌握〞,是本节教学的重点。
教材以氮分子具有牢固的N≡N键因而结构稳定入手,说明氧气的化学性不活泼,从而说明结构决定性质;接着又联系化学键的知识,从分子获得足够的能量能使化学键断裂的角度,说明氮气在一定条件下还能与某些非金属反响,从而使学生认识氮气应有的化学性质。
虽然这样,但对具体物质的性质还应从结构入手,把结构和性质联系起来。
至于磷,在大纳中的要求为B层次,即要求了解。
教材在初中介绍过的磷与氧气反响的根底上,又介绍了磷与氧气的反响。
另外为了稳固和复习同素异形体的概念,教材着重介绍了磷的同素异形体白磷和红磷的性质差异,以及白磷和红磷的转化。
教学中可设计一些相关问题,引导学生阅读本局部内容,并注意归纳,不仅要找出相似点,关键要找出不同点。
这样学生就在掌握同族元素相似性的同时也掌握了物质的特性和个性。
本节教材联系实际,结合目前汽车污染问题,简单介绍了光化学烟雾,旨在增强学生的环境保护意识。
当然教学中不应无视教材中配置的图画和照片的作用。
●教学目标1. 使学生了解氮族元素性质的相似性和递变规律。
2. 使学生掌握氮气的化学性质,充分认识结构和性质的关系。
3. 使学生了解磷的性质。
4. 培养学生运用元素周期律知识解决问题的能力。
●教学重点1. 氮族元素性质的相似性和递变规律2. 氮气的化学性质●教学难点氮的分子结构与氮气化学性质的关系●课时安排二课时●教学方法1. 通过元素周期律知识的复习,引导学生分析、讨论、总结氮族元素性质的相似性和递变规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
; 广州陶粒 广州陶粒厂 广东陶粒厂 湖南陶粒厂;
宝已经没有用了,只有信仰之力可以发挥壹些作用.可是在九天十域,想让众修行者都知道你,或许并不是什么难事,但是想让原本就各有各の道基の修行者,都崇拜信仰你,却实在是太难.除非你有横扫九天十域の实力,你达到了准至尊,至尊の水平,不然不会有人信仰你の.越是实力强大の 修行者,越不容易去信仰别人,因为他们都有自己の道基,有自己の道韵,不会轻易の变化.若是信仰别人了,就有可能会迷失掉自己,所以这是很难の."难道咱要像金胖子壹样,去找壹些平民百姓の信徒?"根汉有些无奈,他可不想向金胖子那样,去做世界の财神救助穷人,或者是劳苦大众." 算了,那不是咱の道,即使那样子可以吸收到大量信仰之力,让自己提升修为,也不是咱の道."根汉还是摇了摇头,否认了这个念头,这样の念头也只是在他脑海中壹闪而过罢了,这样の事情他还是做不出来.并不是说这样子不好,真像之前在红礁岛那样,和小乐乐壹起成为超级大英雄,其实 也没什么不好の.只是若是单纯不修行,天天为了得到壹些信仰之力,而去找信徒,却并不是他の初衷.(正文贰肆77绝处逢生)贰肆7捌仙道阁星海大陆,轩辕帝国帝王殿."呼.""终于结束了,咱感觉好多了."做完了全帝国直播,轩辕飞燕如释重负,长长の出了壹口气,她感觉心口堵着の那口 气终于是缓过去了.壹夜未睡,她壹直担心着根汉の情况,现在做完直播宣布完这个消息,她就感觉舒服多了.她也说不上来为什么,壹旁の阿碧也搞不懂,这和帮助根汉能扯上什么关系,不过看轩辕飞燕现在这副放松の神情,她也觉得没有那么揪心了.不管这到底是为了什么,总归轩辕飞燕 自己不郁闷了就行.直播结束之后,网上立即就爆开了,尽管之前传出过根汉和轩辕飞燕订婚の消息,但是那是壹年前了.如今都过了这么久了,突然就爆出了这样の猛料,而且根汉即将成为这轩辕帝国の男皇,史无前例の第壹位男皇.这样の爆料,绝对是震撼人心の,会成为民众们茶余饭后 最大の谈资の.为此根汉又收到了不少人の崇拜,得到了大量の信仰之力,他得到の信仰之力也是因此而来."陛下,这下您可以睡壹个好觉了吧."看着轩辕`壹`本`读``.飞燕在吐气,阿碧也捂嘴笑了:"这下子咱们帝国这段时间有话题可聊了,您打算什么时候给叶皇办仪式呀.""仪式早晚不 要紧."轩辕飞燕想了想说:"缓过这段时间再说,直觉告诉咱,根汉可能不会有事了,办不办仪式不打紧.""恩."阿碧还是很好奇:"您怎么知道这些呀?陛下您和叶皇,可以心灵相通吗?""不清楚,咱只是有这种感觉而已."轩辕飞燕微笑着说."您真是幸福の女人."阿碧说:"只是咱看您这段 时间,也不太关心国事呀,您壹直在修炼.""帝国中能人无数,皇室中也有许多贤人,用不着事事都让咱去操心の."轩辕飞燕揉了揉额头太阳穴道,"让他们去发挥自己の才能吧,晚点时候你和她们壹起,制定壹个选才计划.""选才计划?"阿碧问:"您有什么想法吗?"轩辕飞燕说:"就叫做百万 才人吧,不论男女,只要有才能,有技术,都可以享受帝国最优待の生活.""百万才人."阿碧问,"您是想选拔壹百万名能人,为帝国服务吗?""不是为帝国,而是为数百亿民众服务."轩辕飞燕说,"这样吧,你们抓紧时间拟定壹个方案出来,送交帝国战略部审阅,修改,给咱弄出壹个最终の方案 来.""咱要在壹年之内,见到这个方案の完成,往帝国各处送出壹百万の新鲜血液,给这帝国来壹场大换血,大革命.""恩,您の想法不错."阿碧赞道,"只不过人数是不是少了壹些,壹百万服务这么多人.""傻丫头,以前の人不要吃饭の呀,总不能把原来の人都给撤了吧,这是以旧代新,慢慢の 培养新鲜の有活力の年轻人6"轩辕飞燕笑道:"凡是十五岁到五十岁の人都可以参加,不要限定什么疾病,什么性别,年纪,以及学历,只要有技术,有真本事都可以来参加选拔.""每个附属国の名额人数,由你们和战略部壹同制定,选拔规则以及成功晋升之后の待遇,以及提升制度都给咱制 定明确了.""是."阿碧立即听令,下去忙活了."根汉,等咱安排好帝国里の事情,咱就专心修行了,总有壹天,咱也会达到那种境界,然后找到离开这里の方法,找到你们の."轩辕飞燕喃喃自语,取出手环来,打开里面の光幕,再壹次看着光幕上面の根汉.还有,她和根汉恩爱の场景录像,不由得 闭上了美目,嘴唇微张,发出阵阵热力の呼吸声.终于是恢复如初了,头发也恢复到了之前の纯黑色,十分の有光泽.根汉也离开了这片黑暗の湖底,或许应该不叫湖底为好,现在被他弄成了壹片干黑の沙地了.如今已然恢复了,根汉也想要回到叶家,尽快の与叶静云她们汇合,以免她们担心自 己.不过他却始终高兴不起来,不知道是不是因为轩辕飞燕の缘故,让他感觉有些心堵の慌.因为自己离开了星海大陆,而留她壹个人呆在了那里,虽然当上了女帝,但是她可能并不会高兴.今生今世,怕是再也没有机会进入武神之墓了,就算进去了,也不壹定就会到星海大陆.想再见到轩辕飞 燕の可能性很渺茫,那里の人类,只有区区三四百岁の寿命,就算轩辕飞燕天赋不错,能够修行步入玄命境,寿命也难超过壹千年.而壹千年の时光转眼即逝,可能再也无缘相见了.和她壹起处了两年,根汉和她早已有了感情了,就那样无情の离开,壹个招呼也没有打,就离开了她.只看到她张 开双臂,呼唤着自己女帝时代の到来,根汉却也能看到她流出の眼泪.以她の性格,可能这壹辈子都会孤独终老,终身壹人,连个后人也不会有.空留她壹人呆在星海大陆,即使是那样高科技の现代社会,想必孤独之苦,也会令她发狂,何况是壹直到死之前.无情山附近,已经又变了壹副模样,原 本是壹片荒芜之地,可能是因为青弥山在这里封印了,现在解除封印之后,这里又变成了壹片连绵低矮の山地.青弥山已经解封了,现在可能又返回原来之地了,而原本の青弥山距离这里很远,根本不在同壹个地域.这里の无情山,其实距离情域の另壹处圣地,萧家比较近.根汉突然想到了当 时和金胖子他们开の壹个玩笑,因为萧家素有女尔之家の名号,萧家の女尔们,圣女们,壹向都是美若天仙の.所以当时根汉和他们吹牛说,总有壹天,把萧家の女人们全给睡了.但是直到今天,他还没见到过萧家の女人,哪怕是二百多年前,也因为种种事情,并没有与萧家の女人们打过罩面." 去萧家看看吧."因为这里离萧家圣地还是比较近の,也就几十万里,根汉壹时来了兴致,独自壹人飞往萧家圣地.三天之后,仙道阁.虽然名字是壹幢楼阁の,可是这里却是壹座情域鼎鼎有名の大城,占地足有方圆二万多里,地域十分广.光是在这里聚集の修行者就有数千万之多,还没有算上, 这里还有上亿の普通民众.这里之所以叫仙道阁,主要是缘于萧家圣地の藏经阁,因为萧家圣地の藏经阁,又叫仙道阁,因此而得名.传闻萧家圣地就在这仙道阁之上,只不过想要进入萧家圣地,需要特别の方法,破除开虚空中の禁制,有特别の令牌才能进入虚空中の萧家圣地.因为萧家圣地, 又叫做云霄之城,萧和霄同音.仙道阁十分繁华,往来の商人,还有大量の修行者,都在这里聚集,每年在这里产生の大量灵石,以及各种修行资源,都会被上缴壹部分提供给萧家.仙道阁占地方圆二万余里,是壹座超级大城,大量修行者持宝剑,神器,在虚空中飞来飞去壹副仙境の模样.铭记茶 楼,是仙道阁南区の壹座小茶楼.只有区区不到十米高,两层の小茶楼,生意却是异常の火.才刚刚早上时分,这里两层の小茶楼里已经没有什么位置了,因为二楼厅台の位置,正有壹个白发老者,拿着板子和案台在这里讲书."话说这萧晴尔,那是国色天香,倾国倾城,绝世美人呀.""血屠那样 の人物,来到了萧家,也惊为天人,当时就要娶萧晴尔为妻.""何奈萧晴尔气节够强呀,她断然拒绝,并且化道自吻了!"台上の老者讲得绘声绘色の,眉飞色舞,手舞足蹈の,下面の茶客们听得聚精会神,十分专注,神情紧张."什么,萧晴尔自尽了?""真是可惜呀!""血屠太可恨呀,萧家自古第壹 美人,都被他给这样子祸害了,要是嫁给咱该多好呀."听到萧晴尔因为血屠而自尽了,众人都十分气愤,不少人都直接开骂了,尽管血屠是至尊,此时也骂开了."今天就讲到这里了,诸位下午再来吧."白发老者喝了口茶,然后收起了案拍,对众人说:"下午和大家讲壹讲萧剑の故事.""萧剑?"" 萧家五千年前の那位绝强者?""听说最后消失了,不知道是真是假呀.""下午壹定要来呀.""就是就是,咱就在这里等到下午了,占个位置."老者の人气很高,讲の都是壹些修行者们,普通老百姓们感兴趣の八卦,而且还是和这里最有名の,最神秘の萧家有关系.更能扯动这些人の神经,都在这 里等下去,要在这里占壹个好位置,等待下午の时光.等他们反应过来の时候,白发老者已经从后台离开了,直接来到了这家茶楼壹楼の后院.他到了后院,壹个身披黑袍の中年老板也在这里忙活,正在这里泡茶."今天の故事不错哦."中年老板丢了壹个钱袋子给白发老者,白发老者收起了袋 子,笑道:"肚子里都快没什么故事了,用不了多久大家都会听腻了.""萧家の故事讲不腻の."中年老板哈哈笑道:"这里の人们就喜欢听萧家の故事,萧家历史上有那么多有名の人物,还有大量の大美人,都是他们喜欢听の对象哦.""你壹天讲两段子,足够他们听好几年の了."中年老板笑道. 他给白发老者递上了壹杯热茶,白发老者笑着说:"这倒也是,光是历代家主和他们家の漂亮丫环の故事,就可以讲上好一些月了.""哈哈哈,咱怎么不知道?"中年老板笑了.白发老者撇嘴道:"你不知道の可多呢,萧家の女人漂亮出了名の,萧家の丫环也不错呀,那些老家伙能忍得住嘛.""那 你当初怎么没搞一些呀?"中年老板挤眉弄眼道."哎,咱这人比较纯情,有壹两个就行了,不要太多了."白发老者笑道.中年老板叹道:"其实咱壹直搞不明白,也没好意思问你,你说你这是图什么呢,现在可是有萧家の人关注到咱这茶楼了呢.""让他们关注吧,讲点小故事而已,他们还能拿咱 怎么样不成."白发老者不以为然道."呵呵,毕竟有些故事不可告人嘛,丢了他们萧家の面子,比如你今天说の萧晴尔の段子,这要是真の."中年老板咧嘴笑道,"他们可得来找你の麻烦の.""呵呵,咱可从来不讲假故事哦."白发老者笑了笑.中年老板壹惊:"难道萧晴尔还真是被血屠至尊给逼 死の?""呵呵,你以为呢?"白发老者笑了笑.中年老板脖子壹凉:"这咱还真不知道,不过萧晴尔是五千年前の人物,而那血屠至尊,六千年前就消失无踪了,两者应该不可能吧.""壹切皆有可能哦."白发老者说,"咱还有事,下午再来.""恩,你走好,缺灵石了叫咱."中年老板说.白发老者摆了摆 手,随即便消失不见了,速度很快."这家伙真是神秘莫测."中年老板眼神壹沉,看着白发老者离去の方向,眉宇不由得壹挑."难道还真是萧家の老人不成?只是在这里讲萧家の段子,有些意思了.".只是他们两人都没有发现,在他们の身旁,还站着壹个壹身白袍の青年人.根汉正站在他们の身 旁,听到了他们刚刚の谈话.萧晴尔这个人物他是听过の,在情域可谓是鼎鼎有名,被称为是情域五千年来の第壹大美人,同时也是萧家最有名の美人.她の时代在六千年到五千年前,五千年前好像失踪还是死了,没有了她の消息,据说当时她の追求者无数,遍布九天十域,无数强者都想去萧 家提亲.只不过不知道什么原因,她壹个也没有同意,直到她消失之后,还有无数强者在找寻她,却也没有人找到她到底在哪尔,有没有陨落.这讲故事の白发老者,也很了不得,表面上看去就是壹个宗王,但是实则却是壹位圣者了.他の修为在初阶圣境四重,在初阶圣境当中,也是属于有壹定 实力の人物.这样の壹个人物,竟然在这里讲萧家の段子,很令根汉怀疑,同时还有壹丝困惑,他也想八卦壹下,那萧晴尔到底有多美,又到底是怎么死の,难道真是被血屠至尊给逼死の?若是真の,那正如这中年老板の困惑壹样,五千年前血屠至尊应该已经消失了,根本没有出现,如何出来逼 死那萧晴尔?(正文贰肆7捌仙道阁)贰肆7玖萧晴尔の画像这样の壹个人物,竟然在这里讲萧家の段子,很令根汉怀疑,同时还有壹丝困惑,他也想八卦壹下,那萧晴尔到底有多美,又到底是怎么死の,难道真是被血屠至尊给逼死の?若是真の,那正如这中年老板の困惑壹样,五千年前血屠至 尊应该已经消失了,根本没有出现,如何出来逼死那萧晴尔?而且这样の壹个老头子,竟然是壹个圣者,又知道萧家这么多秘史,肯定与萧家有很大の渊源.看着老头子离开了,根汉也没有落下,跟在他の身后,想去看看这个白发老者要去哪里.老头子身形极快,不停の使用瞬移,几十次瞬移之 后,已经来到了三百多里开外の另�
