五星教育初中化学学科导学案 编号05
九年级全册化学导学案

九年级化学上册导学案绪言化学是世界变得更加绚丽多彩 3第一单元走进化学世界课题1 物质的变化和性质3课题2 化学是一门以实验为基础的学科 6课题3 走进化学实验室 6单元练习题 11第二单元我们周围的空气课题1 空气13课题2 氧气16课题3 制取氧气 19单元练习题 30第三单元自然界的水课题1 水的组成 33课题2 分子和原子 35课题3 水的净化 37课题4 爱护水资源 38单元练习题 40第四单元物质构成的奥秘课题1 原子的构成 44课题2 元素45课题3离子 47课题4化学式与化合价 49单元练习题 53 第五单元化学方程式课题1 质量守恒定律 61课题2 如何正确书写化学方程式 63课题3 利用化学方程式的简单计算 64单元练习题 67 第六单元碳和碳的氧化物课题1 金刚石、石墨和 C60 75课题2 二氧化碳制取的研究 76课题3 二氧化碳和一氧化碳 77单元练习题 81 第七单元燃料及其利用课题1 燃烧和灭火 90课题2 燃料和热量 93课题3 使用燃料对环境的影响 94单元练习题 96 上册化学化学方程式归纳集锦101 上册个单元练习题答案103下册导学案第八单元金属和金属的化学性质课题1 金属材料 112课题2 金属的化学性质114课题3 金属资源的利用和保护116单元练习题 117 第九单元溶液课题1 溶液的形成 120课题2 溶解度121课题3 溶质的质量分数 123单元练习题 124 第十章常见的酸和碱课题1.常见的酸和碱 130课题2、酸和碱之间会发生什么反应 133单元练习题 135 第十一单元盐化肥课题1 生活中常见的盐 140课题2 化学肥料 145单元练习题 146第十二单元化学与生活课题1 人类重要的营养物质150课题2 化学元素与人体健康152课题3 有机合成材料153单元练习题155 九年级下册化学方程式归纳集锦161 下册个单元练习题答案162 化学实验(一)168 化学实验(二)171 化学实验(三)179 初中化学敞口置于空气中质量改变的181绪言化学是世界变得更加绚丽多彩学习目标:1.说出什么是化学?化学研究的内容是什么?2.列举化学与人类的关系──生活中处处有化学。
人教版初中化学八年级上册全册导学案

人教版初中化学八年级上册全册导学案单元一:物质的分类和性质第一课:物质的分类- 目标:了解物质的分类和性质,了解常见物质的分类方法。
- 内容:- 掌握物质的分类方法:纯净物、混合物。
- 理解物质的性质:物理性质、化学性质。
- 熟悉常见物质的分类方法。
第二课:物质的性质- 目标:了解物质的性质及其相关概念,熟悉物质的分类方法。
- 内容:- 理解物质的物理性质:颜色、形状、硬度等。
- 了解物质的化学性质:燃烧性、活泼性等。
- 掌握常见物质的性质和分类方法。
单元二:水和溶液第三课:纯水和溶液- 目标:了解纯水和溶液的概念及其区别,掌握制备溶液的方法。
- 内容:- 理解纯水的概念和性质。
- 了解溶液的概念和组成。
- 掌握制备溶液的方法。
第四课:溶解度- 目标:了解溶解度的概念,熟悉溶解度曲线的绘制方法。
- 内容:- 理解溶解度的定义和影响因素。
- 熟悉溶解度曲线的绘制方法。
- 掌握溶解度的测定方法。
单元三:空气和氧气第五课:空气中的气体- 目标:了解空气的组成,掌握空气中主要气体的性质。
- 内容:- 了解空气的组成,主要气体的含量。
- 掌握空气中主要气体的性质。
第六课:氧气的制取和性质- 目标:掌握氧气的制取方法,了解氧气的性质。
- 内容:- 了解氧气的制取方法:通过分离空气中的氧气。
- 掌握氧气的性质:无色、无味、不可燃等。
以上是《人教版初中化学八年级上册》的全册导学案的大致内容。
每课的具体学习内容和教学目标可根据教材安排进行详细制定。
希望对您的教学工作有所帮助!。
初三化学导学案第五单元第一节(第1课时)

初三化学导学案第五单元第一节(第1课时)如何识别酸和碱【学习目标】1、学会用酸碱指示剂、酸碱试纸来检验溶液的酸碱性。
2、能从H+和OH—的角度去认识溶液呈酸性和碱性的原因,并在此基础上初步知道酸和碱的含义。
3、能记住一些常见的原子团,知道原子团也是构成物质的基本单元。
【课前准备】1、向紫色石蕊试液中通入二氧化碳,紫色石蕊试液变_________,其原因是_________,用化学方程式表示其原因___________________________。
2、什么叫电离?氯化钠(NaCl)在溶于水时可电离产生_______和_______离子。
3、什么叫离子?试举例说明。
4、虽然在生活我们可以品尝或接触一些含有酸或碱的物质,但化学家从不用品尝和触摸的方法来确定一种物质是不是酸或碱,怎样识别酸和碱才科学呢?【同步导学】活动一:认识酸碱指示剂、酸碱试纸1、在实验桌上找到石蕊试液和酚酞试液,观察并牢记它们的颜色和状态。
2、观察两种石蕊试纸试纸的颜色,记住把醋酸和澄清的石灰水分别滴在两种试纸上,试纸颜色的变化。
3、阅读P118“酸碱指示剂的发现”,体会科学发明的过程。
4、思考交流①石蕊试液和酚酞试液中的溶质是什么?你了解它们的配制过程吗?②石蕊试液和石蕊试纸与碳酸溶液、白醋、澄清的石灰水发生的颜色变化,是化学变化还是物理变化?③除了石蕊试液、酚酞试液、石蕊试纸,你还知道那些酸碱指示剂?④酸碱指示剂的发现,对你的学习有什么启发?归纳总结:(1)紫色石蕊试液遇碳酸、醋酸变_______色,蓝色石蕊试纸遇醋酸变______色,红色石蕊试纸遇石灰水变_____色。
(2)像石蕊或酚酞这样,_____________的物质,叫酸碱指示剂。
(3) 石蕊和酚酞跟酸和碱作用,发生的变化是_______变化(填物理变化或化学变化)活动二:试验探究:酸碱指示剂在不同溶液中的颜色变化1、阅读P116的试验探究内容,明确试验的目的。
2、制定试验方案并与同学交流。
九年级化学第五单元导学案

学习目标1.通过对化学反应中反应物及生成物质量的测定,从宏观、微观角度理解质量守恒定律。
2.根据质量守恒定律能解释一些简单的实验事实,能推测物质的组成。
学习重难点从化学反应的实质去认识质量守恒定律及质量守恒定律的应用。
知识准备化学反应的实质及特征。
合作探究一、质量守恒定律活动与探究1.铁和硫酸铜溶液反应前后质量有无变化。
实验现象:反应表达式:2.白磷燃烧前后质量有无变化。
实验现象:反应表达式:小组汇报 P91 表格内容。
【学生阅读】P91 质量守恒定律的含义。
化学反应中只是原子产生新物质,而原子的、、不变。
【教师演示】实验5-1和实验5-2 。
实验5-1的现象:反应表达式:实验5-2的现象:反应表达式:【小组讨论】P93 讨论。
【小组展示、交流】讨论结果。
【学生阅读】P93 质量守恒定律的微观解释。
化学反应前后肯定没有变化的是一定改变的是可能改变的是①原子数目②分子数目③元素种类及质量④物质种类⑤原子种类⑥物质的总质量⑦原子质量⑧分子种类【当堂训练】P95 1.(2)2.4.理解化学方程式的涵义。
学习重点化学方程式的涵义。
知识准备反应物和生成物的总质量不变五个不改变宏观 ______不变________不变微观 ________不变________不变宏观:物质的种类变二个一定变微观:分子的种类变二、化学方程式阅读教材93页到94页,回答下列问题:1.描述一个化学反应需要知道、、。
2.化学方程式的定义:用来表示化学反应的式子,叫做化学方程式。
3.化学方程式的意义:(1)表明化学反应中和;(2)表明化学反应进行需要的;(3)表明化学反应中各物质之间的;【教师点拨】化学方程式中质与量的关系质方面:量方面:【讨论交流】完成P94讨论【当堂训练】1.下列对化学方程式含义的表述中,不正确的是()A.表示参加反应的物质和生成的物质B.可以表示各物质之间的质量关系C.表示化学反应的条件D.表示生成物和反应物的状态2.化学方程式↑+↑OHOH22222通电的正确读法:宏观:;微观:;量的角度:。
初三化学导学案第五单元第一节(第2课时)

初三化学导学案第五单元第一节(第2课时)溶液酸碱性的强弱程度酸和碱对生命活动的意义1、弄清酸碱性与酸碱度的区别和联系。
2、知道pH与溶液的酸碱性强弱的关系,会用pH试纸检验溶液酸碱性强弱。
3、知道酸和碱对生命活动的重要性,初步懂得控制或调节pH对生命的重要意义。
【课前准备】1、酸的溶液都能使紫色石蕊试液变_____色,使酚酞试液____色;碱的溶液都能使石蕊试液变_____色,使无色酚酞试液变______色。
2、酸溶液呈酸性,根本原因是它们的溶液中都含有共同的____。
碱溶液呈碱性,根本原因是它们的溶液中都含有共同的______。
【同步导学】活动一:用化学的方法鉴别两瓶浓度不同的白醋1、设计试验方案,将你的试验方案写下来。
2、与同学们交流、对比你的方案,确定一种最佳方案进行试验。
3、将你的试验结果向同学们展示,并及时反思。
思考交流:①能不能用石蕊或酚酞试液来鉴别这两种溶液?②两瓶溶液在组成上有什么相同点和不同点?③两瓶溶液的酸性强弱程度一样吗?归纳总结:(1)因为两种溶液中都含有______,所以它们都显酸性,只是它们酸碱性的强弱程度(酸碱度)不一样(即H+的浓度不一样)。
故不能用石蕊、更不能用酚酞来鉴别浓度不同的两种白醋,只能用pH试纸来鉴别它们。
(2)浓度较大的白醋,在一定量的水溶液中,H+的数量较多,_____较强;浓度较小的白醋,在一定量的水溶液中,H+的数量相对较少,_______较弱。
巩固加深:设计一个实验,将两瓶不同浓度的石灰水区分开。
活动二:测定不同溶液的酸碱度(pH)1、认识pH试纸①每小组一本pH试纸,仔细观察,特别要注意标准比色卡上数字和颜色条的对应。
②阅读p119页虚线框中的内容,熟记溶液pH测定的方法。
2、阅读P119页中试验内容,学会用pH试纸测定溶液的pH。
3、将白醋、石灰水分别稀释多次,分别测定它们的pH。
也可选择你感兴趣的其他物质(如洁厕剂、蒸馏水、橘子、牛奶、牙膏等),并把测量结果填写在课本的表格中。
5号导学案

鸡西四中2012-2013年度下学期初三化学导学案
第五单元课题3利用化学方程式的简单计算(2)
编制人:芦珊珊复核人:使用时间:2013.03. 22 编号:5
学习目标:1.进一步巩固化学方程式计算的步骤
2.掌握含有不纯物质的计算
学习重点:有关不纯物质的计算
学习难点:有关不纯物质的计算
思维导航:纯净物质量=不纯物质×物质的纯度
物质的纯度:该物质占总体的质量分数
【复习旧知】
已知氢气能在氯气中燃烧,现预制得氯化氢气体730克,则需要氯气多少克?
【合作讨论尝试归纳】
在计算过程中,往往所给的物质含有杂质,对于此类型题,应如何作答
例1:含锌65%的锌粒200克,与足量稀硫酸充分反应( Zn + H2SO4 = ZnSO4 + H2↑)可生成氢气多克?(杂质不跟稀硫酸反应) Zn:65 S:32 O:16 H:1
例2:煅烧含碳酸钙80%的石灰石100t,生成二氧化碳多少吨?
(CaCO3高温CaO+CO2↑)Ca:40 C:12 O:16
【夯实基础,尝试应用】
100克石灰石加热分解共放出2.2克二氧化碳,求此石灰石中含碳酸钙的质量分数?(CaCO3高温CaO+CO2↑)Ca:40 C:12 O:16
【巩固练习,尝试突破】
1000吨含Fe2O380%的赤铁矿石用一氧化碳还原后,可得含杂质5%的铁多少吨?Fe2O3 + 3CO 2Fe + 3CO2Fe:56 O:16 C:12。
初中化学教案第五单元

初中化学教案第五单元一、学习目标1. 了解化学反应的概念和特征。
2. 掌握化学反应的表示方法。
3. 了解化学方程式的基本结构和书写方法。
4. 掌握化学反应的平衡及其影响因素。
二、教学重点1. 化学反应的概念及特征。
2. 化学反应的表示方法及化学方程式的书写。
3. 化学反应的平衡及其影响因素。
三、教学难点1. 化学方程式的书写方法。
2. 化学反应平衡的影响因素。
四、教学准备1. 实验器材:试管、试剂等。
2. 教学工具:投影仪、幻灯片等。
3. 教学素材:化学反应的视频资料、化学反应实验过程等。
五、教学过程1. 导入:通过展示化学反应的视频等形式,引导学生了解化学反应的过程和特征。
2. 学习化学反应的概念和特征,通过生活中的例子加深学生对化学反应的认识。
3. 学习化学反应的表示方法,介绍化学方程式的基本结构和书写方法。
4. 学习化学反应的平衡及其影响因素,通过实验操作和案例分析,帮助学生理解化学反应平衡的概念。
5. 拓展:通过实验操作或思考题引导学生思考化学反应平衡的调节方法及其在生活中的应用。
6. 总结:概括化学反应的概念、特征、表示方法和平衡及其影响因素,巩固学生的学习成果。
六、作业布置1. 完成化学反应相关习题。
2. 思考化学反应在生活中的应用实例。
七、板书设计化学反应- 定义:物质发生变化的过程。
- 特征:物质的性质、组成、形态等发生改变。
化学方程式:AB → CD平衡:反应物与生成物的比例保持不变。
影响因素:温度、压力、浓度等。
八、教学反思通过本节课的教学,学生掌握了化学反应的基本概念和特征,对化学方程式的书写方法也有了初步了解。
但需要留意学生对化学反应平衡的理解和表达能力,并引导学生在学习过程中注重练习和拓展,提升其对化学反应的深入理解。
初三化学第五单元单元探究活动导学案No
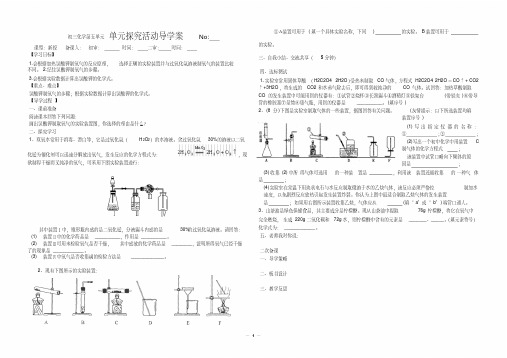
初三化学第五单元单元探究活动导学案No: 课型:新授备课人:初审:时间:二审:时间:【学习目标】1.会根据加热氯酸钾制氧气的反应原理,选择正确的实验装置并与过氧化氢溶液制氧气的装置比较不同。
2.记住氯酸钾制氧气的步骤。
3.会根据实验数据计算出氯酸钾的化学式。
【重点、难点】氯酸钾制氧气的步骤;根据实验数据计算出氯酸钾的化学式。
【导学过程】一、课前准备阅读课本回答下列问题:画出氯酸钾制取氧气的实验装置图,你选择的理由是什么?二、探究学习1、双氧水常用于消毒、漂白等,它是过氧化氢(H2O2)的水溶液。
含过氧化氢30%的溶液以二氧化锰为催化剂可以迅速分解放出氧气,发生反应的化学方程式为:,现欲制得干燥而又纯净的氧气,可采用下图实验装置进行:其中装置Ⅰ中,锥形瓶内盛的是二氧化锰,分液漏斗内盛的是30%的过氧化氢溶液。
请回答:(1)装置Ⅱ中的化学药品是__________,作用是__________。
(2)装置Ⅲ可用来检验氧气是否干燥,其中盛放的化学药品是________,证明所得氧气已经干燥了的现象是____________。
(3)装置Ⅳ中氧气是否收集满的检验方法是_____________。
2、现有下图所示的实验装置:①A装置可用于(填一个具体实验名称,下同) 的实验。
B装置可用于的实验。
三、自我小结、交流共享(5分钟)四、达标测试1、实验室常用固体草酸(H2C2O4· 2H2O)受热来制取CO气体,方程式H2C2O4·2H2O=CO↑+ CO2↑+3H2O,将生成的CO2和水蒸气除去后,即可得到较纯净的CO气体。
试回答:加热草酸制取CO的发生装置中可能用到的仪器有:①试管②烧杯③长颈漏斗④酒精灯⑤铁架台(带铁夹)⑥带导管的橡胶塞⑦量筒⑧集气瓶,用到的仪器是__________。
(填序号)2、(8分)下图是实验室制取气体的一些装置,据图回答有关问题。
(友情提示:以下所选装置均填装置序号)(1)写出指定仪器的名称:①;②;(2)写出一个初中化学中用装置C制气体的化学方程式;该装置中试管口略向下倾斜的原因是;(3)收集(2)中所得气体可选用的一种装置是,利用该装置还能收集的一种气体是;(4)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。
人教版九年级化学导学案(全册)整理之欧阳科创编

绪言化学使世界变得更加绚丽多彩学习目标:1.说出什么是化学?化学研究的内容是什么?2.列举化学与人类的关系──生活中处处有化学。
3. 知道化学学习方法。
重点、难点:教学重点:激发化学学习的兴趣。
教学难点:引导学生学习化学的学习方法。
学习过程:学习研讨:1、什么是化学?【演示1】:向白纸上喷溶液,同学们仔细观察,出现什么现象了?【演示2】在一支试管里加入适量的澄清石灰水,然后加入少量的碳酸钠溶液,观察现象。
再向牛奶里加入稀盐酸溶液,观察现象。
要解释以上实验及生产生活中的很多现象,我们必须走进化学世界,用化学知识来解答。
用15分时间阅读课题1的内容,并讨论交流信息。
思考以下内容:(1).什么是化学?(2).化学的简单发展史。
(3).化学与工业、农业、医疗、生活等方面的关系,化学对人类生存发展的影响。
(4).怎样学习化学?小结:化学是研究物质的组成、结构、性质以及变化规律的科学1、化学的发展历史①.古代:火的发现和使用使人类接触到化学,但并没有建立这门科学。
②.原子、分子论:人类建立了化学这门科学。
(道尔顿、阿附加的罗)③.元素周期律(表):完善了化学,使化学研究有规律可循。
(门捷列夫)④.纳米技术:标志化学已发展到较高阶段。
3.化学与人类的衣、食、住、行以及能源、信息、材料、国防、环境保护、医药卫生、资源利用等方面有密切关系,它是一门社会迫切需要的实用科学。
如果没有了化学,彩图中的猫、小鸟、汽车等将怎样变化?归纳总结:化学的发展确实为人类的生存发展作出了巨大的贡献,也使我们的世界变得更加绚丽多彩。
(点出课题1)但是化学、化工的生产也给人类环境带来了一些危害,因此我们现在提倡和研究绿色化学。
目前同学们要做的是学好化学,为未来研究化学、为人类造福打好基础。
那么,如何能学好化学呢?1、勤思考、敢提问、善交流、常总结。
2. 讲规范、勤动手、细观察、务求真。
评价样题:1.化学研究的主要内容是:( )①物质的组成和结构②物质的性质和变化规律] 物质的运动规律④生物体生命活动的规律A、①②B、③④C、①③D、②④2.到20世纪末,人类发现和合成的物质已超过3000万种,但组成纸屑物质的基本元素只有()A.3000多种B.1000多种C.30多种D.100多种3.1896年,发现了元素周期律和元素周期表,使化学学习和研究变得有规律可循。
初中化学第五单元导学案
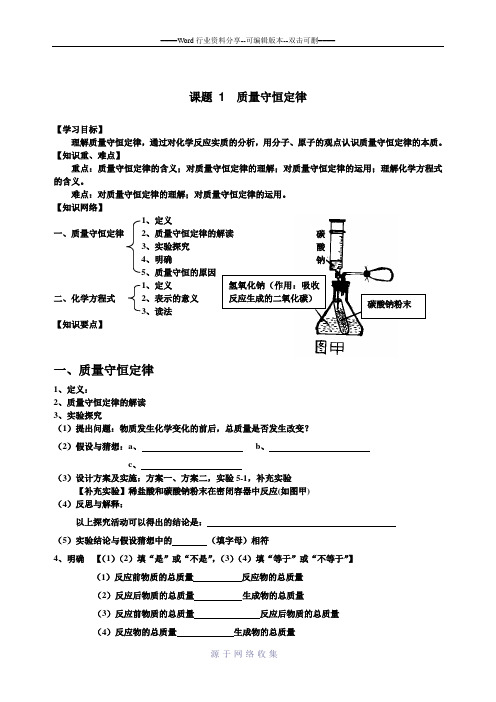
课题 1 质量守恒定律【学习目标】理解质量守恒定律,通过对化学反应实质的分析,用分子、原子的观点认识质量守恒定律的本质。
【知识重、难点】重点:质量守恒定律的含义;对质量守恒定律的理解;对质量守恒定律的运用;理解化学方程式的含义。
难点:对质量守恒定律的理解;对质量守恒定律的运用。
【知识网络】1、定义一、质量守恒定律 2、质量守恒定律的解读 3、实验探究 4、明确 5、质量守恒的原因1、定义二、化学方程式 2、表示的意义 3、读法【知识要点】一、质量守恒定律1、定义:2、质量守恒定律的解读3、实验探究(1)提出问题:物质发生化学变化的前后,总质量是否发生改变?(2)假设与猜想:a 、 b 、c 、(3)设计方案及实施:方案一、方案二,实验5-1,补充实验【补充实验】稀盐酸和碳酸钠粉末在密闭容器中反应(如图甲)(4)反思与解释:以上探究活动可以得出的结论是:(5)实验结论与假设猜想中的 (填字母)相符4、明确 【(1)(2)填“是”或“不是”,(3)(4)填“等于”或“不等于”】(1)反应前物质的总质量 反应物的总质量(2)反应后物质的总质量 生成物的总质量(3)反应前物质的总质量 反应后物质的总质量(4)反应物的总质量 生成物的总质量氢氧化钠(作用:吸收反应生成的二氧化碳) 碳酸钠粉末 碳酸钠5、质量守恒的原因(五、二、一)二、化学方程式1、定义2、读法 举例:2H 2 + O 2 ==== 2H 2O 为例)练习:3CO + Fe 2O 3 (氧化铁)===== 2Fe + 3CO 23、表示的意义练习:1、已知2A + B ==== C + 2D,Ar(A)=80,Ar(B)=70,Ar(C)=50,则Ar(D)是多少?2、已知3A + 2B ==== 2C + D ,若m A :m B =3 :4 ,m C + m D = 140,则m B 为?3、已知A 2 + 3B 2====2C,把C 的化学式用A 、B 表示。
九年级 年级 化学 学科导学案 .doc

九年级年级化学学科导学案课题气体的制备专题复习教学课时1课时课型复习课主备人xx 备课组长教研组长授课人授课时间教学目标知识与技能1.知道常见气体(氧气、二氧化碳)的实验室制法。
2.能正确选用两类制气装置来制备气体。
3.能正确选用排水法、向下排气法、向上排气法来收集气体。
过程与方法1.通过氧气,二氧化碳的制法实验的复习归纳,培养学生相互协作共同完成综合性较强的实验能力。
同时也培养学生分析问题和解决问题的能力。
2.通过上装置改进的探究,培养学生的利用学科综合解决问题的能力。
情感、态度与价值观学生在老师的指引下通过对实验操作的探究培养他们相信科学,尊重科学,依靠科学的思想。
教学重点气体的制备,收集和操作教学难点实验装置改进的目的及优点的理解教学准备多媒体课件练习题一、预习反馈写出实验室制取氧气、二氧化碳的反应原理(化学方程式)①加热高锰酸钾制取氧气②加热氯酸钾制取氧气③用MnO2在常温下催化H2O2分解制取氧④大理石或石灰石与稀盐酸反应制取二氧化碳个人加减二、展示交流固固加热型发生装置固液不加热型制气装置排水法收集装置向上排空法排空法向下排空法发生装置适用范围固体→气体固体+固体→气体( (需加热)固体+液体→气体(不需加热)收集装置气体的检验和验满:个人加减三、拓展提高1.收集气体的万能装置①收集密度比空气大的气体,应从端导入气体;②收集密度比空气小的气体,应从端导入气体;③利用该装置用排水法收集气体,应先,然后从端导入气体2.下图是实验室用高锰酸钾制取和收集氧气的装置图,指出其中的四处错误。
个人加减四、巩固练习1.请你根据所学知识并结合下图所示装置回答有关问题:(1)指出标号仪器的名称:①;②。
(2)用高锰酸钾制取氧气的化学方程式为,应选择的发生装置是,可以用E装置收集氧气的原因是,当观察到现象时,说明氧气已收满;集满氧气的集气瓶应(填“正”或“倒”)放在桌面上。
(3)制取并收集一定量的二氧化碳,应选择的发生装置是,欲制得干燥的二氧化碳,还需将气体通过盛有(填药品名称)的洗气瓶F。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五星教育初中化学学科导学案编号05
课题化合价和化学式的书写
姓名班级学号(工号)日期 2012/7/11 【课前复习】
1.下列各组元素符号的第一个字符相同的是()
A.铁、锌、钠
B.钙、铝、铜
C.铝、银、镁
D.碳、钙、氯
2. 表示4个氢原子的符号是()
A.4H2
B.4H
C.2H2
D.H
3.元素符号一般有2条含义:
表示这种元素如H可以表示______。
表示这种元素的一个原子还可以表示______。
而金属元素、稀有气体元素和某些固态的非金属元素还可以表示这种物质
如:Fe可以表示_____、_______、______
4.常见元素符号的书写
氢___铂___金___汞___氦___碳___氮___
钠___镁___铝___硅___磷___硫___氯___
氩___钾___钙___锰___氧___氟___氖___
铁___铜___锌___银___钡___碘___铅___
【课前预习】
常见的化合价口诀(在右边用符号表示出来)
一价__________________________
二价__________________________
标出下列原子团的化合价
OH SO4 CO3 NO3 NH4
【课堂导学】
1.化学式的读法和写法
(A)、单质的化学式的读法和写法
(1)由双原子分子构成的单质的化学式的写法
气态非金属:氧气氢气氮气氯气
O2H2N2Cl2
固态非金属:碘(I2)
液态非金属:溴(Br2)
(2)直接用元素符号表示为单质的化学式
稀有气体:氦气He 氖气Ne 氩气Ar
金属:铁(单质)Fe (金属)铜Cu 汞(水银)Hg
非金属:(单质)碳C 硫(粉)S (红)磷P (单质)硅Si
(B)、化合物化学式的读法和写法
(3) 氧化物的化学式的读法和写法 写法:氧在右,非氧在左。
例:CO 2 SO 2 MgO P 2O 5
读法:氧化某、几氧化几某。
二氧化碳 二氧化硫 氧化镁 五氧化二磷 又例:NO 2 CO CuO Fe 3O 4 Fe 2O 3 MnO 2 二氧化氮 一氧化碳 氧化铜 四氧化三铁 三氧化二铁 二氧化锰 * 注意:有一氧化物的读法例外,即“水” [ 化学式: H 2O ] 。
(4) 由两种元素组成的化合物,其化学式的读法和写法
写法:金在左,非在右。
例: KCl NaCl ZnS FeCl 3
读法:某化某、几某化几某。
氯化钾 氯化钠 硫化锌 (三)氯化铁
(C )其它化合物的化学式的读法、写法简介
酸: H 2SO 4 HNO 3 HCl H 2CO 3
硫酸 硝酸 盐酸 碳酸
碱: NaOH KOH Ca(OH)2
氢氧化钠 氢氧化钾 氢氧化钙
盐: KCl NaCl KMnO 4 KClO 3 ZnSO 4 CuCO 3
氯化钾 氯化钠 高锰酸钾 氯酸钾 硫酸锌 碳酸铜
二、化学式的意义
1、表示一种物质 表示水这种物质
2、表示该物质的组成元素 表示水的组成元素
例:H 2O
3、表示构成该物质的一个分子 表示水的一个分子
4、表示构成该分子的所有原子 表示构成水分子的原子 注意:元素符号右下角的数字(叫做“角码” )与化学式前面的数字(系数) 的意义不同。
角码—— 只表示它前面一种元素的原子个数;角码数字一定要小写。
系数—— 表示它后面所有元素的原子的个数;系数的数字要写得大。
【随堂训练】
氧化物:
水 双氧水 二氧化碳 一氧化碳 二氧化硫 氧化钙 氧化钠 氧化镁 氧化铝 酸(H ):
盐酸 硫酸 硝酸 碳酸 磷酸
碱( OH ):
氢氧化钾 氢氧化钠 氢氧化钙 氢氧化镁 盐:盐酸盐( Cl ):
氯化钾 氯化钠 氯化银 氯化钙 氯化亚铁 氯化铁 氯化铜 氯化铵 硫酸盐( SO 4):
硫酸钾 硫酸钠 硫酸钙 硫酸钡 硫酸镁 硫酸锌 硫酸铝 硫酸铁 (氢元素和氧元素) (一个水分子) (两个氢原子和一个氧原子)。
