铝三角铁三角化学方程式总结
铁三角_铝三角_金属钠

Fe3Fe+4H2O(g)高温Fe3O4+4H2Fe + 2H+ = Fe2+ + H2↑Fe + Cu2+ == Cu + Fe2+Fe + 2Fe3+ == 3Fe2+Fe2+ + 2OH- == Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3(生成白色沉淀,迅速变成灰绿色,最后变成红褐色)2Fe2+ + Cl2 == 2Fe3+ + 2Cl-2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2OFe3+ + 3OH- == Fe(OH)3↓2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓ + 3CO2↑(双水解)2Fe3+ + Cu == 2Fe2+ + Cu2+2Fe3+ + 2I- == 2Fe2+ + I2Fe3+ + 3SCN- == Fe(SCN)3 (红色溶液,Fe3+离子检验)Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+ (氢氧化铁胶体制备)FeO + 2H+ == Fe2+ + H2O Fe2O3 + 6H+ == Fe3+ + 3H2OFe3O4 + 8H+ == Fe2+ + 2Fe3+ + 4H2OAl2Al + 6H+ == 2Al3+ + 3H2↑2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑O Al(OH)3(胶体)+ 3H+(明矾净水)Al3+ + 3HAl3+ + 3OH- == Al(OH)3↓Al3+ + 4OH- == AlO2- + 2H2OAl3+ + 3NH3.H2O == Al(OH)3↓+ 3NH4+(实验室制备氢氧化铝,白色胶状沉淀)2Al3+ + 3CO32- + 3H2O == 2Al(OH)3↓ + 3CO2↑ (双水解)2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓ + 3H2S↑(双水解)Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓(双水解)2AlO2- + CO2 + 3H2O ==2 Al(OH)3↓+ CO32-(CO2少量)AlO2- + CO2 + 2H2O == Al(OH)3↓+ HCO3-(CO2过量)Al2O3 + 6H+ == 2Al3+ + 3H2OAl2O3 + 2OH- == 2AlO2- + H2OAl(OH)3 + 3H+ == Al3+ + 2H2OAl(OH)3 + 2OH- == AlO2- + 2H2O①过量OH —②过量H+③H + ④OH —⑤H + ⑥OH — 2Al+Fe 2O 3高温Al 2O 3+2Fe (铝热反应)Al+3O 2点燃2Al 2O 3(纯氧) 2Al(OH)3 △Al 2O 3+3H 2OFe 或Al 与H 2SO 4(浓)或HNO 3(浓)室温下钝化Na2H 2O + 2Na = 2Na + +2OH - + H 2↑ 4Na+TiCl 4(熔融)=4NaCl+Ti 2H 2O + 2Na 2O 2 = 4NaOH+ O 2↑ 2Na 2O 2+2CO 2=2Na 2CO 3+O 2 2NaR+ Ca 2+ = CaR 2 +2Na +2NaR+ Mg 2+ = MgR 2 +2Na + ( 离子交换法软化水) CaR 2 +2Na + =2NaR+ Ca 2+ (再生) NaH + H 2O = NaOH + H 2↑CO 2+NH 3+NaCl+H 2O =NaHCO 3↓+NH 4Cl (侯氏制碱法)一、镁、铝的工业制法1、镁的工业制法:(从海水中提取镁)2、铝的工业制法:(以铝土矿为原料)二、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系Al 3+Al(OH)3AlO 2— 石灰过滤 海水Mg(OH)2 盐酸 MgCl 2 电解 熔融Mg铝土矿 除杂质 Al 2O 3 熔融、电解冰晶石作熔剂 Al有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+:B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存;b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
铝三角和铁三角(高一章节总结)

学方程式或离子方程式
(3)2Fe2++Cl2=2Fe3++2Cl(4)2Fe3++H2S=2Fe2++S+2H+ (5)FeO+C=Fe+CO (6)Fe2O3+3CO=2Fe+3CO2
铝和铁的化合物
总结:Fe→Fe2+加弱氧化剂,例如:S、H+(非氧化性酸、Cu2+等) Fe→Fe3+加强氧化剂,例如:Cl2、HNO3等 Fe2+主要体现还原性;Fe3+主要体现氧化性
铝和铁的化合物
例4、 0 +2 +3 Fe、 Fe 、 Fe 三者之间的相互转化关系,各举一例写出有关的化
学方程式或离子方程式
铝和铁的化合物
例4、 0 +2 +3 Fe、 Fe 、 Fe 三者之间的相互转化关系,各举一例写出有关的化 (1)Fe+2H+=Fe2++H2↑ (2)2Fe+3Cl2=2FeCl3
(6) AlO2- + 4H+ = Al3+ + 2H2O
铝和铁的化合物
例2 请同学们回忆下面两个我们曾经做过的实验 NaOH溶液 AlCl溶液 【要求】 1.A、B中的反应现 象是否相同?(用离 子方程式表示)
AlCl溶液 A
NaOH溶液 B
铝和铁的化合物
答案: (A)Al3++3OH- =Al(OH)3 ↓ Al(OH)3 + OH- = AlO2- + 2H2O
Fe3+,高锰酸钾溶液本身显紫色,故应选C。 注:学生容易忽视高锰酸钾的颜色。
高三-化学-铁和铝之考点总结
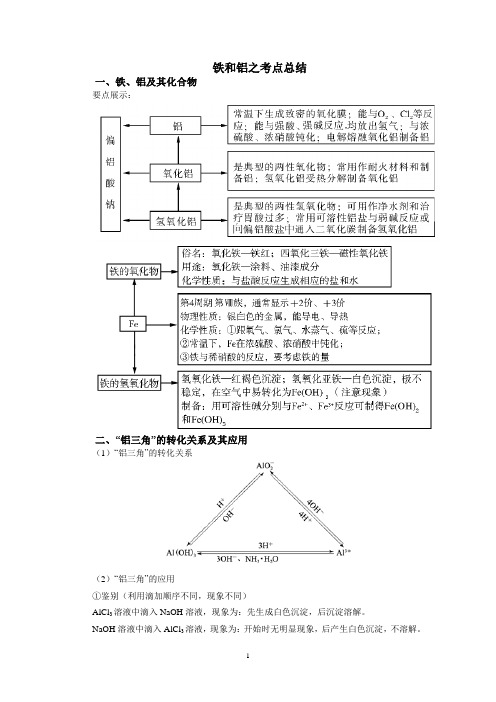
铁和铝之考点总结一、铁、铝及其化合物要点展示:二、“铝三角”的转化关系及其应用(1)“铝三角”的转化关系(2)“铝三角”的应用①鉴别(利用滴加顺序不同,现象不同)AlCl3溶液中滴入NaOH溶液,现象为:先生成白色沉淀,后沉淀溶解。
NaOH溶液中滴入AlCl3溶液,现象为:开始时无明显现象,后产生白色沉淀,不溶解。
②分离提纯利用Al能溶于强碱溶液的性质,分离Al与其他金属的混合物。
利用Al2O3能与强碱反应的性质,分离Al2O3与其他金属氧化物。
利用Al(OH)3的两性,分离Al3+与其他金属离子。
③制取Al(OH)3Al3++3NH3·H2O=Al(OH)3↓+3NH4+2AlO-2+CO2+3H2O=2Al(OH)3↓+CO32-Al3++3AlO-2+6H2O=4Al(OH)3↓④铝盐净水:Al3++3H2O Al(OH)3(胶体)+3H+⑤离子共存问题与Al3+不共存的离子:OH-、HCO3-、S2-、CO32-、AlO-2与AlO-2不共存的离子:H+、HCO3-、Al3+三、“铁三角”及其应用1. “铁三角”的转化关系2. “铁三角”的应用(1)判断离子共存①Fe3+与S2-、HS-、I-因发生氧化还原反应而不能大量共存。
NO、ClO-、MnO4-等离子因发生氧化还原反应而不能大量共②Fe2+与酸性溶液中的3存。
(2)解决实际问题①用FeCl3溶液腐蚀铜箔制造印刷线路板:2Fe3++Cu=2Fe2++Cu2+②配制含Fe2+的溶液时,向溶液中加入铁钉或铁粉使被氧气氧化形成的Fe3+还原为Fe2+:2Fe3++Fe=3Fe2+。
配制Fe3+的盐溶液:加少量相应的酸防止Fe3+水解。
③人体只能吸收Fe2+,维生素C可将Fe3+还原成Fe2+,适量服用维生素C有利于铁元素的吸收。
④为除去废水中的Fe2+,常先将废水中的Fe2+氧化为Fe3+,再调节溶液的pH使Fe3+转化为Fe(OH)3沉淀析出。
铁三角所有化学方程式

铁三角所有化学方程式
嘿,咱来说说铁三角的那些化学方程式哈!比如铁和氧气反应,生成四氧化三铁,那方程式就是 4Fe + 3O₂ → 2Fe₃O₄呀!就好像你在一个大熔炉里,把铁丢进去,再通上氧气,“噗”的一下就变成四氧化三铁啦!还有铁和盐酸反应,生成氯化亚铁和氢气,方程式是Fe + 2HCl → FeCl₂ + H₂↑ 呢!这就好比铁和盐酸在那“噼里啪啦”地打了一架,然后就产生了氯化亚铁和氢气呀!再来说说氧化铁和一氧化碳反应,能生成铁和二氧化碳,3CO + Fe₂O₃ → 2Fe + 3CO₂。
这就像是一氧化碳这个“大力士”把氧化铁给“征服”了,最后得到了铁和二氧化碳。
哎呀,这些化学方程式可真是太有意思啦,你们说是不是呀?。
铁三角的化学方程式

铁三角的化学方程式
(原创实用版)
目录
1.铁三角的定义与构成
2.铁三角的化学性质
3.铁三角的化学方程式及其应用
正文
铁三角(Fe3O4)是一种由 FeO、Fe2O3 和 Fe3O4 组成的矿物,通常呈黑色或暗褐色。
它是一种具有磁性的氧化物,具有很高的磁导率。
铁三角广泛应用于磁性材料、磁性传感器、磁性储存器等领域。
铁三角的化学性质主要表现在其氧化还原性上。
在空气中,铁三角可以与氧气反应生成 Fe3O4,反应方程式为:
4FeO + O2 → 2Fe3O4
在高温下,铁三角可以与碳反应生成 Fe2O3 和 CO,反应方程式为:2Fe3O4 + 3C → 6FeO + 3CO
此外,铁三角还可以与其他化合物发生反应,如与盐酸反应生成FeCl2 和 FeCl3,反应方程式为:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
铁三角的化学方程式及其应用广泛,不仅可以用于研究铁的氧化还原反应,还可以应用于制备磁性材料、磁性传感器、磁性储存器等领域。
例如,在磁性材料制备中,可以通过控制铁三角的组成和结构,调节磁性材料的磁性能。
在磁性传感器和磁性储存器中,铁三角的高磁导率特性可以提高器件的灵敏度和性能。
总之,铁三角作为一种具有磁性的氧化物,具有广泛的应用前景。
