2011届高考化学二轮专题复习课件:专题9 电化学(新课标)
高考化学二轮复习专题突破:电化学原理化学课件PPT

础
记 忆
铁的腐蚀速率更快。(
)
试 做
真
4.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳 题
热 极电化学保护法。( )
点
盘 点
5.不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬。
提
()
能 专
训
题
6.纯锌与稀硫酸反应时,加入少量 CuSO4 溶液,可使反应
源
追 跟
速率加快。(
)
[二轮备考讲义] 第一部分 第9讲 第7页
提
铁锈生成过程中的化学反应方程式:
能 专
训
题 ①_______________________________________________;
源
追 跟
②_______________________________________________;
③_______________________________________________。
础
记 忆
电池反应方程式:2Li+FeS===Li2S+Fe
试 做
真
负极:___________________________________________, 题
热
反应类型:________;
点
盘 点
正极:___________________________________________,
提
反应类型:________。
题
热
负极:___________________________________________;
点
盘 点
正极:___________________________________________。
高二电化学专题复习课件.ppt

化学能与电能的相互转化 专题复习
新型燃料 电池汽车
电解法 冶炼金属
被腐蚀 的轮船
被腐蚀的 机械部件
探寻本质 钢铁腐蚀的最主要方式
吸氧腐蚀
Fe
C
溶有空气的NaCl溶液
原理示意图
梳理回顾 列举常用金属防护措施
1
牺牲阳极 的阴极保
护法
2
外加电流 的阴极保
护法
3
改变金属 的内部结 构,如不锈
D 2.下列说法正确的是( )
A.电解池中发生的反应均为非自发的氧化还原反应 B.电解池中,电子从负极出发,经溶液到达电源正极 C.在电解池中,阳极一定是溶液中的阴离子失电子 D.电解质溶液导电时一定有化学反应发生
当堂检测
3.铅蓄电池是一种典型的可充电电池,电池总反应
式为:Pb+PbO2+4H++2SO42请写出其放电时正极反应式:
3.根KO据H参溶加液反应的F离eC子l3溶确液定电解质饱和食盐水 4.某些情况需要考虑使用盐桥或隔膜
多孔石墨电极
CuSO4溶液
总结提升
本专题思维导图
能 应用
量 •外加电流的 阴极保护法
转 •物质制备 化 •电冶金
•电解饱和食
观 盐水
化学能
能量转化
电
原
解 电极判断 电
池 池 电子/离子流向
电极反应
负正 极极 MFge
负正 阴 CAl 极极 极 Fe
装置1
装置2
阳 C极
溶有空Na气O的H溶Na液Cl溶液
NaCl溶液
(2)若将装置1中的两极和溶液分别改用Mg 、 Al
和NaOH溶液,则该装置的负极是
高中化学《电化学二轮专题复习》优质课教学设计、教案

D.a 电极的反应为 3CO2+18H+-18e-===C3H8O+5H2O 规律总结 1:
【我会做】1、某电池以 K2FeO4 和Zn 为电极材料,KOH 溶液为电解质溶液。下列说法正确的是(
Reference source not found 混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:Error: Reference
source not found D.硫酸根离子在电解过程
中向阳极移动
★4、(2015·江苏)一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( ) A. 反应 CH4+H2O=====3H2+CO,每消耗 1 mol CH4 转移 12 mol 电
B.氢燃料电池
C.铅蓄电池
D.镍镉电池
2. 烧杯 A 中盛入 0.1mol·L-1 的 H2SO4 溶液,烧杯 B 中盛放 0.1mol·L-1 的 CuCl2 溶液(两种溶液均 足量),装置如图所示,下列说法不正确的是( )
A.A 中 Fe 极质量减少,C 极有气体产生 B.A 为电解池,B 为原电池 C. 当 A 烧杯中产生 0.1mol 气体时,B 烧杯中产生气体的物质的量也为 0.1mol D. 经过一段时间,B 烧杯中溶液的 pH 增大 3、用电解氧化法可以在铝制品表面形成致密、 耐腐蚀的氧化膜,电解质溶液一般为 Error:
授课教师: 课型: 专题复习 教学目标:
班级: 高三 二班 课题: 电化学专题复习
1. 了解原电池、电解池和二次电池的工作原理。
电化学专题 高考二轮复习经典习题

电化学(一)一、原电池工作原理1.(2012福建∙9)将右图所示实验装置的K 闭合,下列判断正确的是A .Cu 电极上发生还原反应B .电子沿Zn →a →b →Cu 路径流动C .片刻后甲池中c (SO 42−)增大D .片刻后可观察到滤纸b 点变红色2.(2011山东∙)以KCl 和ZnCl 2混合液为电镀液在铁制品上镀锌,下列说法正确的是A .未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B .因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C .电镀时保持电流恒定,升高温度不改变电解反应速率D .镀锌层破损后对铁制品失去保护作用 3.(09福建卷∙11) 控制适合的条件,将反应2Fe 3++2I -2Fe 2++I 2设计成如右图所示的原电池。
下列判断不正确的是A .反应开始时,乙中石墨电极上发生氧化反应B .反应开始时,甲中石墨电极上Fe 3+被还原 C .电流计读数为零时,反应达到化学平衡状态D .电流计读数为零后,在甲中溶入FeCl 2固定,乙中石墨电极为负极 4.(2010广东卷∙23)铜锌原电池(如图9)工作时,下列叙述正确的是A 正极反应为:Zn -2e -=Zn 2+B 电池反应为:Zn +Cu 2+=Zn 2++Cu C 在外电路中,电子从负极流向正极 D 盐桥中的K +移向ZnSO 4溶液石墨KI 溶液FeCl 3溶液灵敏电流计盐桥甲乙5.(2010福建卷∙11)铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O研读右图,下列判断不正确的是A.K 闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 molC.K闭合时,II中SO42-向c电极迁移D.K闭合一段时间后,II可单独作为原电池,d电极为正极6.(2010江苏卷∙8)下列说法不正确的是A.铅蓄电池在放电过程中,负极质量减小,正极质量增加B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱二、新型电源7.(13安徽)热激活电池可用作火箭、导弹的工作电源。
高考化学二轮高频考点精讲 专题9 电化学原理课件

线
只允许阳离子、阴离子通过):
①写出阳极的电极
反应式:
______________。
②分析产品室可
得到H3PO2的原因: _____。
图Z9-2
精选ppt
5
返回目录
专题九 电化学原理
典
③早期采用“三室电渗析法”制备H3PO2:将“四室电
型 真 题
渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳 极室与产品室之间的阳膜,从而合并了阳极室与产品室。
典
型
真
题
在
线
高 频
专题九 电化学原理
考
点
探
究
精选ppt
1
返回目录
知识网络构建
精选ppt
2
返回目录
专题九 电化学原理
典
型
1.[2014·新课标全国卷Ⅱ] 2013年3月我国科学家报道了
真 题
如图Z9-1所示的水溶液锂离子电池体系。下列叙述错误的
在
是( )
线
A.a为电池的正极
B.电池充电反应为
LiMn2O4===Li1-xMn2O4+
点
考向一 原电池的工作原理及应用
探 究
1.原电池解题的一般思路
精选ppt
10
返回目录
专题九 电化学原理
高
频
考
2.确定原电池正负极方法
点
探
究
精选ppt
11
返回目录
专题九 电化学原理
高
频
3.原电池电极反应式的书写步骤及方法
考
点
探
究
4.燃料电池电极反应产物及电板反应式书写 (1)燃料电池中的氧化产物、还原产物的确定
2011年高考第二轮专题复习 电化学
2.(2010·重庆理综,29 改编 全钒液流储能电池是利用不同价态离 . 重庆理综, 改编)全钒液流储能电池是利用不同价态离 重庆理综 子对的氧化还原反应来实现化学能和电能相互转化的装置, 子对的氧化还原反应来实现化学能和电能相互转化的装置,其 原理如下图所示。 原理如下图所示。
黄色 +5 VO2+ 蓝色 +4 VO2+
电极反应 对象
电解 水型
阴极:2H +2e =H2↑ 阳极:4OH -4e =2H2O+O2↑
一 -
+
-
H2O
增大 增大
HCl
减小
CuCl2 NaCl 和 H2O CuSO4 和 H2O
减小 生成新
减小
★加氯化铜
电解电 解质和 水型
放 H2 生碱型: 阴极:2H++2e-=H2↑ NaCl 阳极:2Cl -e =Cl2↑
一 -
增大 电解质 生成新 减小 电解质
★加氯化氢
放 O2 生酸型: 阴极:Cu2++2e-=Cu CuSO4 阳极:4OH -4e =2H2O+O2↑
一 -
★加氧化铜
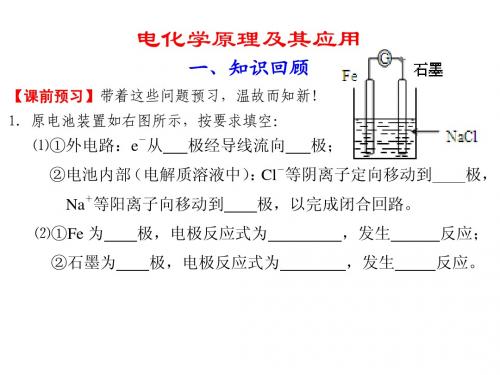
电化学原理及其应用
二、考情调研
【真题回眸】看看以前怎么考,知己知 真题回眸】 彼! 1. (2010·江苏, 11)下图是一种航天器 . 江苏, 下图是一种航天器 江苏 能量储存系统原理示意图。 能量储存系统原理示意图。下列说 法正确的是( 法正确的是 转化
极,电极反应式为 极,电极反应式为
反应; 反应。
电化学原理及其应用
一、知识回顾
课前预习带着这些问题预习,温故而知新! 课前预习 2.电解池装置如右图所示,按要求填空: ⑴①外电路:e 从外接电源 电子由电解池 ⑵①Fe 为 ②石墨为
高考二轮复习-电化学(正式)

2018考试大纲
理解原电池和电解池的构成、工作原理及应用, 能书写电极反应和总反应方程式。了解常见化 学电源的种类及其工作原理。 了解金属发生电化学腐蚀的原因,金属腐蚀的 危害,防止金属腐蚀的措施。
备考指导
1.客观题。 (1)以新型化学电源为载体,考查电极反应式的正误 判断及电子、离子的移动方向等。 (2)考查电化学在金属腐蚀与防护方面的应用。 2.主观题。 (1)考查电极反应式、电池反应式的书写。 (2)考查原电池、电解池原理在工业生产中的应用。 (3)考查电子转移、两极产物、pH等的相关计算。
关闭
C
解析 答案
1.(2017全国Ⅰ)支撑海港码头基础的钢管桩,常用外加电流的阴极 保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳 极。下列有关表述不正确的是( )
训练6 (2014安徽皖南八校三次联考)一种太阳能电池的工作原理 如图所示,电解质为铁氰化钾K3[Fe(CN)6]和 亚铁氰化钾K4 [Fe(CN)6]的混合溶液。下列说法中不正确的是( )
关闭
✔ A由.K电+子移流向向可催知化a 为剂负b极,发生失电子的氧化反应:Fe(CN)64--e-
Fe(CN) 63-;b 为正极,
考纲提炼:
1.电化学装置的判断——原电池及电解池的区分 2.电极的判断:正极和负极、阳极和阴极 3.电化学中的“方向”问题:电流、电子、离子 4.电极方程式及电池方程式的判断及书写 5.电化学题型中的相关计算问题:电子转移、两 极产物、pH的计算等
思路一 思路二 思路三 思路四
解题思路一:电化学装置类型的判断
原电池
1.没有电源,两极用导线互相连接, 直接插入连通的电解质溶液里
2.活泼性不同的电极
[优选]专题电化学课件高考化学二轮复习
![[优选]专题电化学课件高考化学二轮复习](https://img.taocdn.com/s3/m/46be67ec5a8102d277a22fb2.png)
返回导航
2.(2020·全国卷Ⅱ·12)电致变色器件可智能调控太阳光透过率,
从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注
入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过
程,下列叙述错误的是
( C)
A.Ag为阳极 B.Ag+由银电极向变色层迁移 C.W元素的化合价升高 D.总反应为:WO3+xAg═══AgxWO3
返回导航
( 名【师名整校理课课堂本】专获题奖)P专PT题-专电题化电学化课学件课高件考高化考学化二学轮二复轮习复pp习t优(质最说新课版稿本()精推选荐) )
ห้องสมุดไป่ตู้
返回导航
下列说法错误的是
( D)
A.放电时,负极反应为 Zn-2e-+4OH-═══Zn(OH)24-
B.放电时,1 mol CO2 转化为 HCOOH,转移的电子数为 2 mol
( 名【师名整校理课课堂本】专获题奖)P专PT题-专电题化电学化课学件课高件考高化考学化二学轮二复轮习复pp习t优(质最说新课版稿本()精推选荐) )
( 名【师名整校理课课堂本】专获题奖)P专PT题-专电题化电学化课学件课高件考高化考学化二学轮二复轮习复pp习t优(质最说新课版稿本()精推选荐) )
( 名【师名整校理课课堂本】专获题奖)P专PT题-专电题化电学化课学件课高件考高化考学化二学轮二复轮习复pp习t优(质最说新课版稿本()精推选荐) )
返回导航
1.了解原电池和电解池的工作原理,能写出电极反应式和电池 反应方程式。
2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因及金属腐蚀的危害,防止金 属腐蚀的措施。
( 名【师名整校理课课堂本】专获题奖)P专PT题-专电题化电学化课学件课高件考高化考学化二学轮二复轮习复pp习t优(质最说新课版稿本()精推选荐) )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题九 电化学
主干知识整合 一、原电池电极反应:正极得电子,发生还原反应;负 原电池电极反应:正极得电子,发生还原反应; 极失电子,发生氧化反应。一般相对活泼的金属为负极, 极失电子,发生氧化反应。一般相对活泼的金属为负极,相 对不活泼的金属(有时是被钝化的金属)或碳棒作正极。 对不活泼的金属(有时是被钝化的金属)或碳棒作正极。燃料 电池通氧气的一极为正极,因为氧气总被还原; 电池通氧气的一极为正极,因为氧气总被还原;通燃料的一 极为负极,因为燃料总被氧化。 极为负极,因为燃料总被氧化。 在电解池中,阳离子移向阴极,阴离子移向阳极; 二、在电解池中,阳离子移向阴极,阴离子移向阳极; 在原电池中,阳离子移向正极,阴离子移向负极。 在原电池中,阳离子移向正极,阴离子移向负极。 可充电电池在放电时是原电池, 三、可充电电池在放电时是原电池,遵循原电池工作原 在充电时是电解池,遵循电解原理。 理;在充电时是电解池,遵循电解原理。给可充电电池充电 外加电源的负极连接电池的负极。 时,外加电源的负极连接电池的负极。
2006年 2006年,科学家们发明了一种能够给电子 设备提供动力的生物燃料电池。 设备提供动力的生物燃料电池。该电池包括两个涂覆着酶 的电极,它们处于充满空气和少量氢气的玻璃槽中。由于 的电极,它们处于充满空气和少量氢气的玻璃槽中。 气体可以混合从而省去了昂贵的燃料隔离膜, 气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理 如图1 所示。下列说法正确的是( 如图1-9-2所示。下列说法正确的是( )
专题九 │ 要点热点探究
(4)固体氧化物燃料电池 ( 以固体氧化锆— 氧化钇为 (4)固体氧化物燃料电池( 以固体氧化锆 — 固体氧化物燃料电池 电解质, 在其间通过) 电解质,这种固体电解质在高温下允许 O2-在其间通过) ===2H 负极: 负极:2H2+2O2-===2H2O+4e- 正极: ===2O 正极:O2+4e-===2O2- 总反应式: ===2H 总反应式:2H2+O2===2H2O (5)熔融盐燃料电池 熔融盐燃料电池( (5)熔融盐燃料电池(该电池用 Li2CO3 和 Na2CO3 的熔融 盐混合物作电解质, 为阳极燃气, 盐混合物作电解质,CO 为阳极燃气,空气与 CO2 的混合气 为阴极助燃气, ℃下工作的燃料电池 下工作的燃料电池。 为阴极助燃气,制得在 650 ℃下工作的燃料电池。 负极:2CO+ 2 ===4CO 负极:2CO+2CO3-===4CO2+4e- 正极: ===2CO2 正极:O2+2CO2+4e-===2CO3- 总反应式:2CO+ ===2CO 总反应式:2CO+O2===2CO2
•装置 装置 特征
•电极 电极 反应
+ •阳极:M-ne-=Mn+ 阳极: - 阳极 •阴极:Mn++ne-=M 阴极: + 阴极
•电解 电解 质溶 液的 浓度
•不变 不变
•基本不变 基本不变
要点热点探究 ► 探究点一 原电池原理及重要应用
2.原电池工作时粒子流向 电子:负极→导线→正极。 电子:负极→导线→正极。 电解质溶液中)离子:阳离子向正极移动, (电解质溶液中)离子:阳离子向正极动,阴离子向 负极移动。 负极移动。 原电池可加快氧化还原反应的反应速率。 3.原电池可加快氧化还原反应的反应速率。 原电池反应是能源开发的一个重要的发展方向。 4.原电池反应是能源开发的一个重要的发展方向。
下列关于该电池叙述错误的是( 下列关于该电池叙述错误的是( ) 电池工作时, A.电池工作时,是将太阳能转化为电能 电池工作时, B.电池工作时,I-在镀铂导电玻璃电极上放电 C.电池中镀铂导电玻璃为正极 电池的电解质溶液中I D.电池的电解质溶液中I-和I的浓度不会减少
B 【解析】 从示意图可看出,在外电路中电子由负极 解析】 从示意图可看出, 流向正极,也即镀铂电极作正极,发生还原反应: - 流向正极 , 也即镀铂电极作正极 , 发生还原反应 : I3 + 2e- ===3I-,B 错误, C 正确;这是个太阳能电池,从装置示意 错误, 正确;这是个太阳能电池, 图可看出是个原电池,最终是将光能转化为化学能, 正确; 图可看出是个原电池,最终是将光能转化为化学能,A 正确; 根据电池反应,电池工作时, 根据电池反应,电池工作时, I-在负极放电和正极的物质的 量相等, -在正极放电和负极生成的物质的量相等, 量相等, I3 在正极放电和负极生成的物质的量相等,故二者 在电解质溶液中的浓度不变, 正确。 在电解质溶液中的浓度不变,D 正确。
注意】 如果离子浓度相差十分悬殊的情况下, 【注意】 如果离子浓度相差十分悬殊的情况下, 离子浓度大的有可能先放电。 离子浓度大的有可能先放电。如:理论上 H+的放电能 力大于 Fe2+、Zn2+,但在电解浓度大的硫酸亚铁或硫酸 锌溶液时, 锌溶液时,由于溶液中 c(Fe2+)或 c(Zn2+)大于 c(H+), 因此, 则先在阴极上放电的是 Fe2+或 Zn2+,因此,阴极上的主 Zn。但在水溶液中, 要产物则为 Fe 和 Zn。但在水溶液中,Al3+、Mg2+、Na+ 等是不会在阴极上放电的。 等是不会在阴极上放电的。
【点评】 考查新型原电池,原电池的两电极反应式,电 点评】 考查新型原电池,原电池的两电极反应式, 子流向与电流流向,太阳能电池的工作原理, 子流向与电流流向,太阳能电池的工作原理,原电池的总反 应式等,还考查考生变通能力和心理素质, 应式等,还考查考生变通能力和心理素质,能否适应陌生的 情境下应用所学知识解决新的问题等。 情境下应用所学知识解决新的问题等。
► 探究点二
常见的化学电源
(2)碱性( (2)碱性(电解质 KOH) 碱性 ===Zn(OH) 总反应式:Zn+ 总反应式:Zn+2MnO2+2H2O===Zn(OH)2+2MnOOH 正极: ===2MnOOH =2MnOOH+ 正极:2MnO2+2H2O+2e-===2MnOOH+2OH- 负极:Zn+2OH-===Zn(OH)2+2e- 负极:Zn+ ===Zn(OH) 铅蓄电池(属于二次电池) 2.铅蓄电池(属于二次电池) 负极:Pb+ 2 ===PbSO 负极:Pb+SO4-===PbSO4+2e- 2 ===PbSO 正极: 正极:PbO2+4H++SO4-+2e-===PbSO4+2H2O 总反应式:Pb+ 总反应式:Pb+PbO2+2H2SO4 2PbSO4+2H2O
四、电解、电镀及电解精炼 电解、 电解反应的规律、 1.电解反应的规律、溶液浓度及溶液复原的措施
2.电解、电镀及电解精炼的比较 电解、 电解
•池型 池型 •电解池 原理 电解池(原理 电解池 原理) •阳极:惰性电极 Pt、 阳极: 阳极 、 Au、C、Ti(或活性电极 或活性电极) 、 、 或活性电极 •阴极:惰性、活性电 阴极:惰性、 阴极 极均可 •电解液:任意 电解液: 电解液 •阳极:易放电的阴离 阳极: 阳极 子首先放电(或电极参 子首先放电 或电极参 与反应) 与反应 •阴极:易放电的阳离 阴极: 阴极 子首先放电 •改变 改变 •电镀池 电镀池 • (应用电解原理 应用电解原理) 应用电解原理 •阳极:镀层金属(M) 阳极:镀层金属 阳极 •阴极:镀件 阴极: 阴极 •电镀液:含镀层金属离 电镀液: 电镀液 + 子(Mn+) •铜的精炼池 铜的精炼池 •(应用电解原理 应用电解原理) 应用电解原理 •阳极:粗铜(含Zn、Fe、Ni、 阳极:粗铜 含 、 、 、 阳极 Ag、Pt、Au等) 、 、 等 •阴极:精铜 阴极: 阴极 •电解液:CuSO4溶液 电解液: 电解液
溶液作电解质溶液) (2)甲烷燃料电池(用 KOH 溶液作电解质溶液) 甲烷燃料电池( 负极: === 2 负极:CH4+10 OH-===CO3-+7H2O+8e- 正极: === 正极:2O2+4H2O+8e-===8OH- 总反应式: 2KOH== === 总反应式:CH4+2O2+2KOH===K2CO3+3H2O 甲醇燃料电池(强碱作为电解质溶液) (3)甲醇燃料电池(强碱作为电解质溶液) OH+ === 2 负极: 负极:2CH3OH+16OH-===2CO3-+12H2O+12e- 正极: === 正极:3O2+6H2O+12e-===12OH- - 总反应式: OH+ === 2- 总反应式:2CH3OH+3O2+4OH ===2CO3 +6H2O
► 探究点三
电解规律及其应用
1.电解产物的判断 阴极放电的总是溶液中的阳离子,与电极材料无关。 阴极放电的总是溶液中的阳离子,与电极材料无关。 阳极:若是惰性电极作阳极,则溶液中的阴离子放电。 阳极:若是惰性电极作阳极,则溶液中的阴离子放电。 若是非惰性电极作阳极,则是电极本身失电子。 若是非惰性电极作阳极,则是电极本身失电子。
A.左边为该电池的负极 . B.该电池可在高温环境下使用 . C. 该电池负极反应为 : H2===2H+ . 该电池负极反应为: +2e- D . 该 电 池 正 极 反 应 为 O2 + 4e - ===2O2-
C 【解析】 从题图分析,这个电池实际上一个氢 解析】 从题图分析, 氧燃料电池。在负极上是氢气失去电子, 氧燃料电池。在负极上是氢气失去电子,正极上是氧气得 到电子, 存在, 到电子,但因为有 H+存在,不会生成游离的 O2-。又因 为题目中“ 该电池包括两个涂覆着酶的电极” 为题目中 “ 该电池包括两个涂覆着酶的电极 ” 提示有 存在,故不能在高温时使用。 “酶”存在,故不能在高温时使用。
【点评】 题目的切入点新颖,问题情境对考生是陌 点评】 题目的切入点新颖, 生的, 很好的体现了高考命题的公正性。 生的, 很好的体现了高考命题的公正性。 但解决问题的思 方法均是高中化学学习的常规知识。 路、 方法均是高中化学学习的常规知识。 只要将分析氧化 还原反应和电池反应的方法迁移到本题的解答中即可。 还原反应和电池反应的方法迁移到本题的解答中即可。
