热力学与统计物理第三章PPT
合集下载
热力学统计物理 第三章 课件

故而,由δS=0可以得到平衡条件,由δ2S<0可以得到 平衡的稳定性条件。
熵判据是基本的平衡判据,适用于孤立系统。 自由能判据和吉布斯函数判据 自由能判据:等温等容系统处在稳定平衡状态的必要 和充分条件为 ΔF > 0
将F作泰勒展开,准确到二级,有 1 F F 2 F 2 由δF=0和δ2F>0可以确定平衡条件和平衡的稳定性条件。
在平衡曲线上两相的化学势相等,两相可以以任意比 例共存。两相平衡是一种中性平衡。
当系统缓慢地从外界吸收或放出热量时,物质将由一
相转变到另一相而始终保持在平衡态,称为平衡相变。
单元系三相共存时,三相的温度、压强和化学势都必须相等,即 Tα = Tβ = Tγ = T , p α = p β = p γ = p
δS = 0
因为δUα、δVα、δnα是可以独立改变的,这要求 1 1 p p 0, 0, 0 T T T T T T 即
Tα = Tβ(热平衡条件)
pα = pβ(力学平衡条件)
μα =μβ(相变平衡条件)
上式指出,整个系统达到平衡时,两相的温度、压强和化 学势必须分别相等。
吉布斯函数是一个广延量,当物质的量发生变化时,吉布斯函 数也将发生变化。
对于开系,上式应推广为
dG = -SdT + Vdp +μdn 式中第三项代表由于物质的量改变dn所引起的吉布斯函数 的改变,而
称为化学势。
G n T , p
由于吉布斯函数是广延量,系统的吉布斯函数等于物
H和F分别是以S、p、n和T、V、n为独立变量的特性函数。
定义一个热力学函数 J = F -μn 称为巨热力势。
热力学与统计物理学第三讲

2、开系的热力学方程 、 (1)吉布斯函数 )吉布斯函数G 根据吉布斯函数的全微分式子: 根据吉布斯函数的全微分式子: dG = −SdT +VdP ——此式适用于物质的量不发生变化的情况 此式适用于物质的量不发生变化的情况 由于G是广延量,所以对于开系,上式推广为: 由于 是广延量,所以对于开系,上式推广为: 是广延量
δUα,δVα,δnα和δU β,δV β,δnβ
又孤立系统要求: 又孤立系统要求:
δUα +δUβ = 0,δVα +δV β = 0,δnα +δnβ = 0
又QdU = TdS − PdV + µdn dU + PdV − µdn ⇒dS = T
由此可得出:两相的熵分别为: 由此可得出:两相的熵分别为:
由前面讨论可知: 由前面讨论可知:
δ S〈0
2
为系统的平衡的稳定条件
而系统的总的熵函数的变化为: 而系统的总的熵函数的变化为:
~ δ S = δ 2S +δ 2S0 〈0
2
由于媒质比系统大得多,所以有: 由于媒质比系统大得多,所以有: 故此忽略
δ 2S0
δ S0 << δ S
2 2
∂2S δ 2S ∂2S 根据泰勒展开公式得: 根据泰勒展开公式得: δ 2S = [( )(δU)2 + 2 δUδV + ∂V
δ 2S
对于各种可能的虚变动都小于零,应有: 对于各种可能的虚变动都小于零,应有:
1 1 − 2 〈0 ⇒CV 〉0 T CV ——平衡的稳定条件之一 平衡的稳定条件之一
平衡的稳定条件之二: 平衡的稳定条件之二:
∂P ( )T 〈0 ∂V
同理可得。 同理可得。
热力学统计物理第三章1

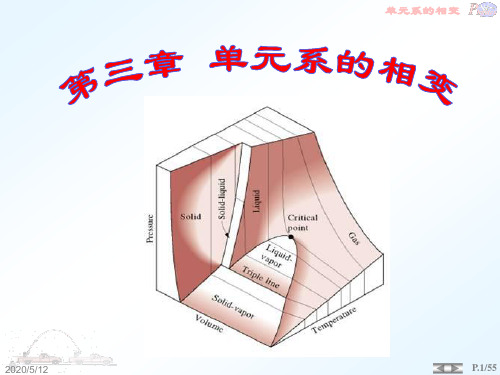
第三章 单元系相变
§3.1 热动平衡判据
这一节的中心问题是如何判定一个系统是否达到了平衡状态。 这一节的中心问题是如何判定一个系统是否达到了平衡状态。 如何判定一个系统是否达到了平衡状态
一、熵判据
熵增加原理指出, 孤立系统的熵永不减少。 孤立系统中发 熵增加原理指出 , 孤立系统的熵永不减少 。 生的任何实际的宏观过程,包括趋向平衡的过程, 生的任何实际的宏观过程 , 包括趋向平衡的过程 , 都朝着使系 统的熵增加的方向进行。 统的熵增加的方向进行。 不平衡状态 熵
∆S < 0
将S为泰勒展开,准确到二级。有 为泰勒展开,准确到二级。
1 2 ∆ S = δS + δ S 2
根据数学上熟知的结果: 根据数学上熟知的结果:当熵函数的一级变分 δS = 0 ,熵 时 函数有极值;可以由此得到平衡条件。 函数有极值;可以由此得到平衡条件。当熵函数的一级变分 时熵函数有极大值, δS = 0 ,二级变分 δ 2 S < 0时熵函数有极大值,由可以得到 稳定条件。如果熵函数的极大不止一个, 稳定条件。如果熵函数的极大不止一个,则其中最大的极大 相应稳定平衡。 相应稳定平衡。
泰勒展开: 泰勒展开:
f ( x ) = f ( x 0 ) + f ′( x ) x = x0 ( x − x 0 ) +
f ( x , y ) = f ( x0 , y0 ) + ∂f ( x , y ) ∂x
f ′′ ( x ) x = x 0 ( x − x 0 ) 2!
2
+ ⋯⋯
x = x0
∂p 假如子系统的体积由于某种原因发生收缩, 假如子系统的体积由于某种原因发生收缩,根据平衡稳定条件 <0 ∂p ∂V T <0 ∂V T 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。
§3.1 热动平衡判据
这一节的中心问题是如何判定一个系统是否达到了平衡状态。 这一节的中心问题是如何判定一个系统是否达到了平衡状态。 如何判定一个系统是否达到了平衡状态
一、熵判据
熵增加原理指出, 孤立系统的熵永不减少。 孤立系统中发 熵增加原理指出 , 孤立系统的熵永不减少 。 生的任何实际的宏观过程,包括趋向平衡的过程, 生的任何实际的宏观过程 , 包括趋向平衡的过程 , 都朝着使系 统的熵增加的方向进行。 统的熵增加的方向进行。 不平衡状态 熵
∆S < 0
将S为泰勒展开,准确到二级。有 为泰勒展开,准确到二级。
1 2 ∆ S = δS + δ S 2
根据数学上熟知的结果: 根据数学上熟知的结果:当熵函数的一级变分 δS = 0 ,熵 时 函数有极值;可以由此得到平衡条件。 函数有极值;可以由此得到平衡条件。当熵函数的一级变分 时熵函数有极大值, δS = 0 ,二级变分 δ 2 S < 0时熵函数有极大值,由可以得到 稳定条件。如果熵函数的极大不止一个, 稳定条件。如果熵函数的极大不止一个,则其中最大的极大 相应稳定平衡。 相应稳定平衡。
泰勒展开: 泰勒展开:
f ( x ) = f ( x 0 ) + f ′( x ) x = x0 ( x − x 0 ) +
f ( x , y ) = f ( x0 , y0 ) + ∂f ( x , y ) ∂x
f ′′ ( x ) x = x 0 ( x − x 0 ) 2!
2
+ ⋯⋯
x = x0
∂p 假如子系统的体积由于某种原因发生收缩, 假如子系统的体积由于某种原因发生收缩,根据平衡稳定条件 <0 ∂p ∂V T <0 ∂V T 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。
热力学与统计物理学第三章 相平衡与相变

18
(3) 范氏气体出现一个不稳定区,是任何一个物态方程均有 的共同性质。事实上,T TK ,气液二相的可逆转变必 然经历一个双相共存的区域。
(4) p-T-V的函数关系的物态方程,它只能描写系统的一种性 质,而不能同时反映体系具有两种不同的状态:相变。
(5) 等面积法则:饱和蒸气压的数值由该法则确定。
解:设2相为气体,1相为液体,则有 v2 v1,与气相的比容 相变可以忽略液相的比 容,气体近似为理想气 体,它的物态
方程是
v2
RT p
。将这些事实代入到克
拉珀龙方程之中,有
dp dT
L
T
RT p
Lp RT 2
dp p
LdT RT 2
假设潜热与温度无关, 对以上方程进行不定积 分
ln
p
L RT
C
p
24
第三章 相平衡与相变
动机和目的 一、开放系统与相律 二、克拉珀龙方程 三、气液两相的平衡与转变 四、相变的分类
小结和习题课
25
第三章习题课
[3.1]温度为T的长圆柱形物质处于重力场中,圆柱分成 两部分,上部是液体,下部是固体。温度降低 T时,
发现固-液分界面上升了 l,如果忽略固体的热膨胀并设
15
再加大压强,液体难以压缩,p很大,而v的变化很小。
2.0
p/p c
1.5
T=1.2Tc
T=1.0Tc
1.0
T=0.9Tc
0.5
T=0.85Tc
0.0 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
v/vc
(2)等温线中的水平段随温度的升高而缩短,说明液、气两相 的比容随温度的升高而接近;
(3) 范氏气体出现一个不稳定区,是任何一个物态方程均有 的共同性质。事实上,T TK ,气液二相的可逆转变必 然经历一个双相共存的区域。
(4) p-T-V的函数关系的物态方程,它只能描写系统的一种性 质,而不能同时反映体系具有两种不同的状态:相变。
(5) 等面积法则:饱和蒸气压的数值由该法则确定。
解:设2相为气体,1相为液体,则有 v2 v1,与气相的比容 相变可以忽略液相的比 容,气体近似为理想气 体,它的物态
方程是
v2
RT p
。将这些事实代入到克
拉珀龙方程之中,有
dp dT
L
T
RT p
Lp RT 2
dp p
LdT RT 2
假设潜热与温度无关, 对以上方程进行不定积 分
ln
p
L RT
C
p
24
第三章 相平衡与相变
动机和目的 一、开放系统与相律 二、克拉珀龙方程 三、气液两相的平衡与转变 四、相变的分类
小结和习题课
25
第三章习题课
[3.1]温度为T的长圆柱形物质处于重力场中,圆柱分成 两部分,上部是液体,下部是固体。温度降低 T时,
发现固-液分界面上升了 l,如果忽略固体的热膨胀并设
15
再加大压强,液体难以压缩,p很大,而v的变化很小。
2.0
p/p c
1.5
T=1.2Tc
T=1.0Tc
1.0
T=0.9Tc
0.5
T=0.85Tc
0.0 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
v/vc
(2)等温线中的水平段随温度的升高而缩短,说明液、气两相 的比容随温度的升高而接近;
热力学统计物理第三章

可能的变动。孤立系统与外界没有热量和功的交换, 若只有体积功,其约束条件是内能和体积不变。
孤立系统处在稳定平衡状态的必要和充分条件是,虚 变动引起的熵变
S 0
将S作泰勒展开,准确到二级,有 S S 1 2S
2
由数学上的极值条件:
当 S 0, 2S 0 时,熵函数有极大值。
可得
S 0 2S 0
( 相变平衡条件)
即整个系统达到平衡时,两相的温度、压强和化 学势分别相等。
分析:若平衡条件未满足,复相系的变化将朝着熵增加 ( S 0 )的方向进行:
(1)若只有热平衡条件未满足,则向 的方向变化:
U
(
1 T
1 T
)
0
如 T T 则 U 0 即能量从高温的相传到低 温的相。
(2)若只有力学平衡条件未满足,则向 的方向变化:
•因为两相的化学势相等,所以两相可以以任意比例共存; •整个系统的吉布斯函数保持不变,系统处在中性平衡。
(3)单元三相平衡共存,必须满足
T T T p p p
(T , p) (T , p) (T , p)
由上面的方程可以唯一地确定温度和压强的一组解
TA和PA ,即单元系的三相平衡共存的三相点。 水的三相点为:TA = 273.16 K, pA = 610.9 Pa .
dH TdS Vdp
若S, p不变,则 dH 0 ,即过程向焓H减少的方向 进行,因此平衡态的焓H最小。
热力学判据 过程遵循规律
U
dU TdS pdV
H
dH TdS Vdp
F
dF SdT pdV
G
dG SdT Vdp
TdS dU pdV S
TdS dH Vdp
孤立系统处在稳定平衡状态的必要和充分条件是,虚 变动引起的熵变
S 0
将S作泰勒展开,准确到二级,有 S S 1 2S
2
由数学上的极值条件:
当 S 0, 2S 0 时,熵函数有极大值。
可得
S 0 2S 0
( 相变平衡条件)
即整个系统达到平衡时,两相的温度、压强和化 学势分别相等。
分析:若平衡条件未满足,复相系的变化将朝着熵增加 ( S 0 )的方向进行:
(1)若只有热平衡条件未满足,则向 的方向变化:
U
(
1 T
1 T
)
0
如 T T 则 U 0 即能量从高温的相传到低 温的相。
(2)若只有力学平衡条件未满足,则向 的方向变化:
•因为两相的化学势相等,所以两相可以以任意比例共存; •整个系统的吉布斯函数保持不变,系统处在中性平衡。
(3)单元三相平衡共存,必须满足
T T T p p p
(T , p) (T , p) (T , p)
由上面的方程可以唯一地确定温度和压强的一组解
TA和PA ,即单元系的三相平衡共存的三相点。 水的三相点为:TA = 273.16 K, pA = 610.9 Pa .
dH TdS Vdp
若S, p不变,则 dH 0 ,即过程向焓H减少的方向 进行,因此平衡态的焓H最小。
热力学判据 过程遵循规律
U
dU TdS pdV
H
dH TdS Vdp
F
dF SdT pdV
G
dG SdT Vdp
TdS dU pdV S
TdS dH Vdp
热力学与统计物理学.pptx

具体来说有:全微分法、系数比较法、循环关系法、 复合函数微分、混合二阶偏导法
系数比较法(适用对象:求U、H、F、G的偏导数) 复合函数的偏导数法(适用对象:求两个函数偏导数之差)
f f f y (x)z (x)y(y)x(x)z
循环关系法(适用对象:求脚标为U、H、F、G的偏导数) x y z
例、求能态方程和焓态方程及Cp 、 Cv
熵变的计算
S是状态函数。在给定的初态和终态之间,系统 无论通过何种方式变化(经可逆过程或不可逆过程), 熵的改变量一定相同。
当系统由初态A通过一可逆过程R到达终态B时求熵
变的方法:直接用
SB SA
B dQ
(
A
T
)R
来计算。
当系统由初态A通过一不可逆过程到达终态B时求熵变
的方法:
(1)把熵作为状态参量的函数表达式推导出来,再将
T V
V T
UFTSFTF
CV
U T V
H=U+pV
TV ,G=F+pV
(2)吉布斯函数G=G(T、p)
由G=G(T、p)和dG=—SdT+Vdp
例:求表面系统的热力学函数
表面系统指液体与其它相的交界面。
表面系统的状态参量: 、A、T 表面系统的实验关系: =(T) 分析:对于流体有f(p,V,T)=0, 对应于表面系统:p,AV
PA
p p(T)
B
固 A
液 C
气
在T—p图中,描述复相系统平衡热力学性Βιβλιοθήκη OLALC T
B P
固
液
PC
C
PA
A
气
O
LA
LC T
A---三相点 C---临界点
系数比较法(适用对象:求U、H、F、G的偏导数) 复合函数的偏导数法(适用对象:求两个函数偏导数之差)
f f f y (x)z (x)y(y)x(x)z
循环关系法(适用对象:求脚标为U、H、F、G的偏导数) x y z
例、求能态方程和焓态方程及Cp 、 Cv
熵变的计算
S是状态函数。在给定的初态和终态之间,系统 无论通过何种方式变化(经可逆过程或不可逆过程), 熵的改变量一定相同。
当系统由初态A通过一可逆过程R到达终态B时求熵
变的方法:直接用
SB SA
B dQ
(
A
T
)R
来计算。
当系统由初态A通过一不可逆过程到达终态B时求熵变
的方法:
(1)把熵作为状态参量的函数表达式推导出来,再将
T V
V T
UFTSFTF
CV
U T V
H=U+pV
TV ,G=F+pV
(2)吉布斯函数G=G(T、p)
由G=G(T、p)和dG=—SdT+Vdp
例:求表面系统的热力学函数
表面系统指液体与其它相的交界面。
表面系统的状态参量: 、A、T 表面系统的实验关系: =(T) 分析:对于流体有f(p,V,T)=0, 对应于表面系统:p,AV
PA
p p(T)
B
固 A
液 C
气
在T—p图中,描述复相系统平衡热力学性Βιβλιοθήκη OLALC T
B P
固
液
PC
C
PA
A
气
O
LA
LC T
A---三相点 C---临界点
热力学统计物理第三章PPT课件

S
U
pV
T
n
S
U
pV
T
n
根据熵的广延性,整个系统的熵变
SSS
UT 1T 1VT p T p nT T
CHENLI
14
整个系统达到平衡时,总熵有极大值,必有
δS = 0
因为δUα、δVα、δnα是可以独立改变的,这要求
T 1 T 1 0 ,
T p T p 0 ,
T T 0
G n
T , p
由于吉布斯函数是广延量,系统的吉布斯函数等于物 质的量n与摩尔吉布斯函数Gm(T,p)之积
因此
G(T,p,n) = nGm(T,p)
G n
T
,
p
Gm
即是说,化学势μ等于摩尔吉布斯函数。
由上面开系吉布斯函数的全微分可知,G是以T、p、n
为独立变量的特性函数。若已知G(T,p,n) ,则
即
Tα = Tβ(热平衡条件)
pα = pβ(力学平衡条件)
μα =μβ(相变平衡条件)
上式指出,整个系统达到平衡时,两相的温度、压强和化 学势必须分别相等。
这就是单元复相系达到平衡所要满足的平衡条件。
整个系统孤立,则总内能等应是恒定的,即 Uα + Uβ = 常量 Vα + Vβ = 常量 nα + nβ = 常量
设想系统发生一个虚变动。在虚变动中两相的内能、 体积和物质的量均有变化,但孤立条件要求
CHENLI
13
δUα + δUβ = 0
δVα + δVβ = 0
δnα + δnβ = 0
由上节内能全微分知,两相的熵变分别为
CHENLI
3
热力学与统计物理第三章PPT课件

24.07.2020
2
• 熵判据
一个系统在内能和体积都保持不变的情况下, 对于各种可能的变动,以平衡态的熵为最大。
孤立系统处在稳定平衡状态的必要且充分条件为: Δ~S0
泰勒级数展开为: Δ~S δS1δ2S 2
根据数学知识可知,熵S有极大值的条件应为:
δS0
熵函数有极值
δS0 δ2S 0
24.07.2020
CV 0,
p VT
0
稳定性条件
平衡满足稳定性条件时,系统对平衡发生偏离时,系
统将自发产生相应的过程,以恢复系统的平衡。适用于均 匀系统的任何部分。
24.07.2020
10
气体的范德瓦耳斯方程: pVa2 VbRT
p
V 气体的等温曲线
24.07.2020
11
§3.2 开系热力学基本方程
一、单元复相系平衡性质的描述及特点
24.07.2020
T U
p
U
U
S V , n
V S, n
n S,V
14
3、开系的焓
HGT SUpV
d H T d S V d p d n HH(S,p,n)
T H S p, n
V
H p
S,n
4、开系的自由能
H
n S, p
FGpV UTS
d F S d T p d V d n
16
§3.3 单元系的复相平衡 1.由熵判据推导平衡条件
考虑一单元两相系统( 相与 相 )组成一孤立系,则有:
24.07.2020
17
由开系的基本热力学方程知: d U T d Sp d V d n
SUpTV n SUpTV n 由熵的广延性质: SSS
热学第三章ppt大学物理

例4:已知:一气缸如图,A、B内各有1mol理想气 体N2 ,VA=VB,TA=TB。有335J的热量缓慢地 传给气缸,活塞上方的压强始终是1atm。 (忽略导热板的吸热,活塞重量及摩擦)
求:(1)A,B两部分温度的增量及净吸的热量.
(2)若导热隔板换成可自由滑动的绝热隔板,
1atm.
再求第(1)问的各量.
原平衡态
非平衡态
新平衡态
热力学中研究过程时,为了在理论上能利用系 统处于平衡态时的性质,引入准静态过程的概念.
二.准静态过程: 1.准静态过程是由无数个平衡态组成的过程. 2.准静态过程是实际过程的理想化模型. (无限缓慢)有理论意义,也有实际意义. 2
3.准静态过程可以用 P-V图上的一条曲线 (过程曲线)来表示.
间接法 A=-Δ E=CV.m(T1-T2)……(1)
可见,绝热过程靠减少系统的内能来对外做功.
A也可由直接计算法计算:
A
V2 PdV
V1
V2 C
V V1
dV
C V2
V V1
dV
C
1-
V21-
C -
1
P1V1
-
P2V2
- V11-
……(2)
请大家课下证明(1),(2)的结果是一样的。 22
0
e
1
2
d
3
v(10-3m3)
6
§3.3 内能、热量、 热力学第一定律
一.内能
微观上,热力学系统的内能是指其分子无规则运动 的能量(应含分子动能、分子间的势能)的总和.
内能是状态量 对于一定质量的某种气体: 理想气体的内能是
热力学统计物理_第五版_汪志诚_完整ppt课件

注意
1)理动态平衡。
2020/4/18
.
17
三、状态参量
定义:系统处于平衡态时,可以表征、描述系统状态的变量
状态参量
几何参量:体积 力学参量:压强 化学参量:摩尔数,浓度,摩尔质量 电磁参量:电场强度,电极化强度,磁场强度,磁化强度 热学参量:温度(直接表征热力学系统的冷热程度)
热力学第二定律 卡诺循环 热力学温标 克劳修斯等式和不等式 熵和热力学基本方程 理想气体的熵
热力学第二定律的数学 表达式
熵增加原理的简单应用 自由能和吉布斯函数
2020/4/18
.
13
§1. 1 热力学系统的平衡状态及其描述
一 、热力学系统(简称为系统)
定义:热力学研究的对象——宏观物质系统 系统分类: ⑴ 孤立系统:与外界没有任何相互作用的系统 ⑵ 封闭系统:与外界有能量交换,但无物质交换的系统 ⑶ 开放系统:与外界既有能量交换,又有物质交换的系统
处在平衡态的大量分子仍在作热运动,而且因 为碰撞,每个分子的速度经常在变,但是系统的宏 观量不随时间改变。
例如:粒子数
箱子假想分成两相同体积的部分, 达到平衡时,两侧粒子有的穿越 界线,但两侧粒子数相同。
2020/4/18
.
16
平衡态的特点
1)单一性( p , T 处处相等);
2)物态的稳定性—— 与时间无关; 3)自发过程的终点; 4)热动平衡(有别于力平衡).
2020/4/18
.
18
宏观量 表征系统宏观性质的物理量
如系统的体积V、压强P、温度T等,可直接测量 可分为广延量和强度量 广延量有累加性:如质量M、体积V、内能E等 强度量无累加性:如压强 P,温度T等
《热力学第三章》PPT课件_OK

活塞有摩擦完全导热且经历准静态等温过程141活塞移动距离laa1020802080突然不是准静态pdvlnln可求s状态参数1活塞移动距离laa1020802080lnln教材313题氧气瓶v004m20迅速放气p取氧气瓶为开口系试用开口系能量方程求tpvmrt开口系能量方程cvoutoutininnetqdumhmhwcvoutoutdumh2v21v1outoutmctmctmh是不是可逆不敢确定气体减少dm本身为正cvoutoutdumhdudmuuhm指瓶中气体状态outdmuhdmmcdtrtdmdmdt绝热钢瓶放气瓶内气体遵循ln1lntkvconstdmdtdmdvdvdtdtdtdvtvconstpvconst小瓶绝热保温箱初为真空由于小瓶漏气某时刻小瓶内温度为t
R s0
T1
pr (T2 ) pr (T1)
R
定义
pr
exp sT0 R
f (T )
相对压力
已知p1,T1,T2 ,查附表2,得pr(T1)和pr(T2),求p2
vr用得较少,自学
2021/8/21
36
§3-5理想混合气体
37
研究对象
无化学反应的理想气体混合物 例:锅炉烟气 CO2, CO, H2O, N2
T
v
cpdT R dp
T
p
2、按真实比热计算
3、按平均比热法计算
2021/8/21
26
1、按定比热计算理想气体热容
分子运动论
Um
i 2
RmT
运动自由度
Cv,m
dU m dT
i 2
Rm
Cp,m
dH m dT
d (Um RmT ) dT
i
2
R s0
T1
pr (T2 ) pr (T1)
R
定义
pr
exp sT0 R
f (T )
相对压力
已知p1,T1,T2 ,查附表2,得pr(T1)和pr(T2),求p2
vr用得较少,自学
2021/8/21
36
§3-5理想混合气体
37
研究对象
无化学反应的理想气体混合物 例:锅炉烟气 CO2, CO, H2O, N2
T
v
cpdT R dp
T
p
2、按真实比热计算
3、按平均比热法计算
2021/8/21
26
1、按定比热计算理想气体热容
分子运动论
Um
i 2
RmT
运动自由度
Cv,m
dU m dT
i 2
Rm
Cp,m
dH m dT
d (Um RmT ) dT
i
2
《热力学与统计物理》第三章 单元系的相变

三.化学势分析
Vm
O K
范氏方程的平衡曲线
B T, p A T, p
J
J
K O
G
B G+L
D
N
L
A
M
R
p
D NR BA M
p
d SmdT Vmdp
p
dT 0 O pO Vmdp
NDJ段:Gm 最大, 不稳定 OKBAMR段:Gm 最小, 稳定
BN段: 亚稳 过饱和蒸气
JA段:
过热液体
两相平衡曲线:两相平衡共存,温 度和压强只有一个独立。
三相点:三相平衡共存,温度和压 强完全确定。
临界点:汽化线终点,温度高于此 点,无液相。由于临界点的存在, 从两相中任意一相的某一个状态出 发,可以经绕过临界点的任意路径 连续进行气—液的过渡而无需经过 相分离(或两相共存)的状态。
固 三相点 •
RT ln pr p
将上式代入*,以及p 2 ,得 :
r
2 v ln pr
r 107 m, pr r 108 m, pr r 109 m, pr
RTr
p
可见,液滴的平衡蒸汽压与液滴的半径有关
p 1.011; p 1.115; p 2.966;
三.中肯半径与过饱和蒸气
S U pV ,
T
S0
U0
p0V0
T0
2.稳定性条件
2S0 2S
系统的平衡条件
2S 2S 0
TdS
dU
pdV
S U
V
1 T
,
S V
U
p T
以 T,V 为自变量,有:
1 T
T
1 T
V
T
热力学与统计物理第3章

α2 C P CV = Tv , 得到C P > CV > 0 κT
(五),单元系的复相平衡 ),单元系的复相平衡
1.单元系两相平衡共存时,满足: 单元系两相平衡共存时,满足:
T =T =T
P =P =P
α β
α
β
(热平衡条件) 热平衡条件) (力学平衡条件) 力学平衡条件)
α (T , P) = β (T , P) = (T , P)
如果( s, P )选为独立变量;δT和δv用δP和δs展开 T v T v 2 2 (δs ) + δsδP (δP) > 0 s P P s P s s P T v 利用麦克斯韦关系: = P s s P T v 2 得到: (δs ) 2 (δP ) > 0 cP P s 由于δs和δP彼此独立:得到 v c P > 0; < 0 P s 绝热压缩系数:κ s = 1 v > 0;根据前面的知识: v P s
λ dp = dT T (v v / ) λ = h h/
h dp h / dλ h = + p dT p dT T p T h / h 利用: p = c p; T p = c /p p v / = v/ T T T λ v v/ p h / p p dp dT T
作业:谈谈你对气- 作业:谈谈你对气-液相变的理解
(六),正常-超导相变的热力学理论 ),正常- 正常
α α
利用:δα = sα δTα + vα δP α
δ 2U = ∑ Nα (δTα δsα δPα δvα ) > 0
α
δTα δsα δP δvα > 0 α
省去α后得到:δTδs-δPδv > 0 令:(T , v)为独立变量: s s P P δs = δT + δv;δP = δT + δv T v v T T v v T s P 利用麦克斯韦关系: = v T v T cv P 2 得到: (δT ) (δv) 2 > 0 T v T 由于δT和δv独立的: P 得到:cv > 0; < 0 v T 1 v 等温压缩系数:κ T = >0 v P T
热力学与统计物理第三章
P.6/55
单元系的相变
等温等容系统处在稳定平衡状态 的必要和充分条件为
G 0
将G作泰勒展开,准确到二级,有
F 0
将F作泰勒展开,准确到二级,有
1 2 G G G 2
由 G 0 和 2 G 0 可以确定平衡 条件和平衡的稳定性条件。
1 2 F F F 2
泰勒展开,准确到二级有:
1 1 p p s U V 0 T T0 T T0 由于U和V 可独立变化,所以上
式成立,必有平衡条件:
1 S S 2 S 2 1 2 S 0 S 0 S 0 2
2013-7-31
T T0 ,
p p0
意义:达到平衡时,子系统与媒质 具有相同的温度和压强。子系统是 任选的,所以达到平衡时整个系统 的温度和压强是均匀的。
P.9/55
s S S0
平衡时有:
1 2 S 2 S0 2
单元系的相变
2、平衡的稳定性条件 平衡的稳定性条件应满足:
2 S0 2 S
2 ①式近似为: s S 0 2
p 0 V T
讨论:系统处于稳定平衡时,由 于扰动偏离时,系统将自动回落 到平衡态。
根据泰勒展开公式: 2S 2 2 S 2 U U
2S 2 U V
2S 2 U V
2S 2 U V 2 V 0 V P.10/55
单元系的相变
2、平衡的稳定性条件 平衡的稳定性条件应满足:
通过导数变换将上式化为平方和:
s 0 T T0 ; p p0 2 s 2S 2S 0 ①
热力学统计物理第三章

五十五分。
第九页,编辑于星期二:十一点 五十五分。
第十页,编辑于星期二:十一点 五十五分。
第十一页,编辑于星期二:十一点 五十五分。
第十二页,编辑于星期二:十一点 五十五分。
第十三页,编辑于星期二:十一点 五十五分。
第十四页,编辑于星期二:十一点 五十五分。
第十五页,编辑于星期二:十一点 五十五分。
第十六页,编辑于星期二:十一点 五十五分。
第十七页,编辑于星期二:十一点 五十五分。
第十八页,编辑于星期二:十一点 五十五分。
第十九页,编辑于星期二:十一点 五十五分。
第二十页,编辑于星期二:十一点 五十五分。
第二十一页,编辑于星期二:十一点 五十五分。
第二十二页,编辑于星期二:十一点 五十五分。
第一页,编辑于星期二:十一点 五十五分。
第二页,编辑于星期二:十一点 五十五分。
第三页,编辑于星期二:十一点 五十五分。
第四页,编辑于星期二:十一点 五十五分。
第五页,编辑于星期二:十一点 五十五分。
第六页,编辑于星期二:十一点 五十五分。
第七页,编辑于星期二:十一点 五十五分。
第八页,编辑于星期二:十一点 五十五分。
第九页,编辑于星期二:十一点 五十五分。
第十页,编辑于星期二:十一点 五十五分。
第十一页,编辑于星期二:十一点 五十五分。
第十二页,编辑于星期二:十一点 五十五分。
第十三页,编辑于星期二:十一点 五十五分。
第十四页,编辑于星期二:十一点 五十五分。
第十五页,编辑于星期二:十一点 五十五分。
第十六页,编辑于星期二:十一点 五十五分。
第十七页,编辑于星期二:十一点 五十五分。
第十八页,编辑于星期二:十一点 五十五分。
第十九页,编辑于星期二:十一点 五十五分。
第二十页,编辑于星期二:十一点 五十五分。
第二十一页,编辑于星期二:十一点 五十五分。
第二十二页,编辑于星期二:十一点 五十五分。
第一页,编辑于星期二:十一点 五十五分。
第二页,编辑于星期二:十一点 五十五分。
第三页,编辑于星期二:十一点 五十五分。
第四页,编辑于星期二:十一点 五十五分。
第五页,编辑于星期二:十一点 五十五分。
第六页,编辑于星期二:十一点 五十五分。
第七页,编辑于星期二:十一点 五十五分。
第八页,编辑于星期二:十一点 五十五分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10
气体的范德瓦耳斯方程:
p
a V2
V
b
RT
p
V 气体的等温曲线
2020/7/14
11
§3.2 开系热力学基本方程
一、单元复相系平衡性质的描述及特点
1. 复相系中的任一相都是均匀的开系,由于有相变发生 ,因而一个相的质量或摩尔数是可变的。
2. 复相系中每一相的平衡态热力学性质都可按均匀系统 同样的办法描述,即,可用四类参量来描述。
9
2S
2S U 2
U
2
2
2S U V
U
V
2S V 2
V
2
0
2S
CV T2
T
2
1 T
p V
T
V
2
0
CV 0,
p V
T
0
稳定性条件
平衡满足稳定性条件时,系统对平衡发生偏离时,系 统将自发产生相应的过程,以恢复系统的平衡。适用于均 匀系统的任何部分。
2020/7/14
熵函数有极大值
2020/7/14
3
说明:
• 该判据实际上就是熵增加原理,也是热动平衡判据中的
基本判据。
• 平衡状态有:稳定平衡、亚稳平衡、中性平衡。
δS 0 δ2S 0
Δ~S 0 极大值 稳定平衡
最大极值 稳定平衡较小极值 亚稳平衡
Δ~S 0 常数值 中性平衡
2020/7/14
4
二、自由能判据和吉布斯函数判据
1. 自由能判据
在等温等容过程中,系统的自由能永不增加。这就 是说,在等温等容条件下,对于各种可能的变动,以平 衡态的自由能为最小。
等温等容系统处在稳定平衡状态的必要且充分条件为:
Δ~F 0
泰勒级数展开为: Δ~F δF 1 δ2F
δF 0
δ2F 0
2 平衡条件和平衡稳定性条件。
2020/7/14
2020/7/14
6
3、其他判据
内能判据:
定熵定容系发生的一切过程朝着内能减小的方向进行。
~U 0
δU 0
δ2U 0
焓判据:
定熵定压系发生的一切过程朝着焓减小的方向进行。
Δ~H 0
δH 0
δ2H 0
2020/7/14
7
三、热动平衡及其稳定性条件
1. 平衡条件
系统: T, P 媒质: T0 , P0
第三章 单元系的相变
单元系:化学上纯的物质系统。 相:被一定边界包围,性质均匀的部分。
2020/7/14
1
§3.1 热动平衡判据
一、熵判据
• 虚变动
为了对系统的平衡态作出判断,必须考虑系统在平衡态 附近的一切可能的变动,这里面就有趋向平衡态的变动和 离开平衡态的变动。在热力学范围内,不考虑涨落现象, 系统一旦达到平衡态以后,其性质就不再发生变化了。因 此,在平衡态附近的一切可能的变动就是理论上虚拟的, 并不代表系统真实的物理过程,引进它的目的完全是为了 从数学上方便地导出系统的平衡条件。这类似于理论力学 中的“虚位移”概念。并以δ表示之。
2020/7/14
17
由开系的基本热力学方程知: dU TdS pdV dn
5
2. 吉布斯函数判据
经等温等压过程后,系统的吉布斯函数永不增加。也 即,在等温等压条件下,对于各种可能的变动,以平衡态 的吉布斯函数为最小。 等温等压系统处在稳定平衡状态的必要且充分条件为:
Δ~G 0 泰勒级数展开为: Δ~G δG 1 δ2G
2 δG 0 δ2G 0 平衡条件和平衡稳定性条件。
3. 各相的态参量不完全独立,因为整个复相系要处于平 衡状态,必须满足一定的平衡条件。
2020/7/14
12
二、开系的热力学基本方程
对于开系,不仅对系统做功和向系统传热可使系统的内 能发生改变,而且系统与外界的物质交换也将使其内能发 生改变。
1、开系的吉布斯函数 物质量不变时: dG SdT Vdp
V
G p
T , n
G
n T , p
dU TdS pdV dn
开系的热力学 基本方程。
U U (S, V , n)
2020/7/14
T U p U U
S V , n
V S, n
n S,V
14
3、开系的焓
H G TS U pV
dH TdS Vdp dn
U +U0 0 V +V0 0
U , V, S
U0 , V0 , S0
Δ~S δS 1 δ2S
2
Δ~S0
δS0
1 2
δ2S0
媒质 系统
媒质很大,有恒定 的温度和压强。
ΔS δS δS0 0
δS U pV
T
2020/7/14
8
ΔS
δU
1 T
1 T0
δV
p T
p0 T0
15
5、巨热力势
J F n F G pV
dJ SdT pdV nd
J J (T , V , )
S J T V ,
p J V T , nJ NhomakorabeaT
,
V
2020/7/14
16
§3.3 单元系的复相平衡 1.由熵判据推导平衡条件
考虑一单元两相系统( 相 与 相 )组成一孤立系,则有:
2020/7/14
2
• 熵判据
一个系统在内能和体积都保持不变的情况下, 对于各种可能的变动,以平衡态的熵为最大。
孤立系统处在稳定平衡状态的必要且充分条件为: Δ~S 0
泰勒级数展开为:Δ~S δS 1 δ2S 2
根据数学知识可知,熵S有极大值的条件应为:
δS 0
熵函数有极值
δS 0 δ2S 0
0
1 T
1 T0
0T
T0
热平衡条件
p T
p0 T0
0
p
p0
力平衡条件
系统平衡时,系统与媒质有相同的温度和压强,且整
个系统温度和压强是均匀的。
2. 平衡稳定条件
ΔS δS δS0
若熵函数的二级微分为负,则:
Δ2S δ2S δ2S0 0 δ2S δ2S0
δ2S δ2S
2020/7/14
H H (S, p, n)
T H S p, n
V
H p
S, n
4、开系的自由能
H
n S, p
F G pV U TS
dF SdT pdV dn
F F(T, V , n)
S F T V , n
p F V T , n
F
n T ,V
2020/7/14
开系的推广: dG SdT Vdp dn
G n
T ,
p
——化学势,T、p不变时,增加1mol物质 时吉布斯函数的改变。
2020/7/14
13
G(T , p, n) nGm (T , p)
只适用于
单元系。
G n
T , p
Gm
G G(T, p, n)
S G T p, n
2、开系的内能 U G TS pV
