利多卡因药典标准
盐酸利多卡因注射液

盐酸利多卡因注射液
Yansuan Liduokayin Zhusheye
Lidocaine Hydrochloride Injection
书页号:中国药典2005版二部-518
[增订]
【鉴别】(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】有关物质取本品,加流动相溶解并稀释制成每1ml中约含2mg的溶液,作为供试品溶液;精密量取供试品溶液1.0ml,置100ml量瓶中,加流动相稀释至刻度,作为对照溶液(1);另取2,6-二甲基苯胺对照品适量,加流动相溶解并稀释制成每1ml中约含0.8mg的溶液,作为对照品溶液(2),照含量测定项下的色谱条件,取对照溶液(1)20μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的10~20%;再分别精密量取上述溶液各20μl,注入液相色谱仪,记录色谱图至主成分保留时间的3.5倍,供试品溶液所得色谱图中如显杂质峰,2,6-二甲基苯胺峰的峰面积应不得过对照品溶液(2)的主峰面积(0.04%),单一杂质峰面积不得过对照溶液(1)主峰面积的1/2(0.5%),其他各杂质峰面积的总和应不得过对照溶液(1)主峰面积(1.0%)。
细菌内毒素取本品,依法检查(附录ⅪE),每1mg盐酸利多卡因中含内毒素的量应小于1.0 EU;用于鞘内注射应小于0.04 EU。
[修订]
【鉴别】取本品,照盐酸利多卡因项下的鉴别(1)、(3)项试验,显相同结果。
盐酸利多卡因检验标准操作规程

文件编号:
起草:
日期:
审核:
日期:
批准:
日期:
生效日期:
颁发部门:质控部
分发部门:检验室
变更记载 修改号
批准日期 执行日期
变更原因及目的
标准依据:《中国药典》2005年版二部
目的:建立盐酸利多卡因检验操作规程。
范围:本规程适用于盐酸利多卡因的检验。
职责:检验员、质控部经理对本规程的实施负责。
4.4 计算
式中:V1为供试品消耗高氯酸滴定液的ml数
V2为空白消耗高氯酸滴定液的ml数
C为高氯酸滴定液的浓度(mol/L)
W为称取供试品的重量(g)
按无水物计算,本品含的C14H22N2O·HCl不得少于99.0%。
5.[贮藏] 密封保存
3.3.6微生物限度
取本品5g,加入45℃的pH7.0的无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:20的供试液。取供试液2ml,照微生物限度检查薄膜过虑法(《中国药典》2005版二部附录Ⅺ J)检查,细菌数、霉菌和酵母菌数分别不得过100个/g,金黄色葡萄球菌、铜绿假单胞菌不得检出。
4.[含量测定]
4.1仪器与用具
分析天பைடு நூலகம் 滴定管 锥形瓶
4.2 试药与试液
冰醋酸醋酸汞试液结晶紫指示液高氯酸滴定液(0.1mol/L)
4.3 操作方法
取本品约0.2g,精密称定,加冰醋酸10ml溶解后,加醋酸汞试液5ml与结晶紫指示液1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显绿色,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于27.08mg的C14H22N2O·HCl。
3.3.3 水分
药物分析 利多卡因

药效学本品属ⅠB类抗心律失常药。
具有局麻作用。
可抑制心肌细胞舒张期除极,减低心室肌及心肌传导纤维的自律性及兴奋性,但对心房及窦房结作用很轻。
相对地延长有效不应期,降低心室肌兴奋性,提高室颤阈值。
治疗剂量不减慢正常心肌的房室传导速度,也不减低心肌收缩力及血压,甚至加快心肌传导纤维的传导速度,减轻单向阻滞,从而消除折返性室性心律失常。
药动学口服生物利用度低,经肝脏首次通过效应即锐减。
肌注后吸收完全。
吸收后迅速分布入心、脑、肾及其他血运丰富的组织,然后分布至脂肪及肌肉组织。
表观分布容积约1L/kg,心力衰竭时分布容积减低。
蛋白结合率约51%。
吸烟者结合率可比不吸烟者高些。
肌注后5~15分钟起效,一次肌注200mg后15~20分钟达治疗浓度,持续60~90分钟;静注后立即起效(约45~90秒),持续10~20分钟。
治疗血药浓度为1.5~5μg/ml,中毒血药浓度为5μg/ml以上。
持续静滴3-4小时达稳态血药浓度,急性心肌梗塞者需8-10小时。
90%经肝脏代谢,代谢物单乙基甘氨酰二甲苯胺(MEGX)及甘氨酰二甲苯胺(GX)具有药理活性,持续静滴24小时以上者,代谢产物可产生治疗及中毒作用。
静注后半衰期α约10分钟,β约1~2小时。
GX半衰期较长约10小时,MEGX半衰期近似原药。
心衰、肝病患者、老年人及持续静滴24~36小时以上,本品的清除减慢。
由肾脏排泄,10%为原药,58%为代谢物(GX),不能被血液透析清除。
利多卡因的局麻效能与持续时间均较普鲁卡因强,但毒性也较大。
在肝内代谢的去乙基代谢产物(单乙基甘氨酰胺二甲苯),仍具有局麻性能,毒性加大,再经酰胺酶进一步降解随尿排出,用量的10%则以原形排出。
适应症:静注适用于因急性心肌梗塞、外科手术、洋地黄中毒及心脏导管等所致急性室性心律失常,包括室性早搏、室性心动过速及室颤。
其次也用于癫痫持续状态用其他抗惊厥药无效者及局部或椎管内麻醉。
用法用量:成人常用量:①肌内注射,一次按体重4.3mg/kg,60—90分钟后可重复一次;②静脉注射,按体重1mg/kg(一般用50—100mg)作为首次负荷量静注2—3分钟,必要时每5分钟后再重复注射1—2次,一小时内最大量不超过300mg;③静脉滴注,用负荷量后可继续以每分钟1—4mg速度静滴维持;或以每分钟按体重0.015—0.03mg/kg速度静脉滴注。
国家食品药品监督管理局国家药品标准修订颁布件(简版)

一定量流动相作为吸收液的适宜烧杯中,将导管浸入吸收液液面下(至少25 mm),揿射10 次(注意每
次揿射间隔5 秒并缓缓振摇),取出,用流动相淋洗导管内外,合并吸收液与洗液,定量转移至100 mL
量瓶中,用流动相稀释至刻度,摇匀,精密量取1 ,置 mL 10 mL 量瓶中,用流动相稀释至刻度,摇匀,精
年版有关事宜的公告(2015 年第105 号)”执行。
标准编号:WS1 XG0452016
· · 2 62 中 国 药 品 标 准 Drug Standards of China 2019, 20(3)
典》2015 年版有关事宜的公告(2015 年第105 号)”执行。
标准编号: ( ) WS10001 HD1459 20032016
异丙托溴铵吸入气雾剂
Yibingtuoxiu′an XiruQiwuji Ipratropium Bromide Inhalation Aerosol
本品为异丙托溴铵的溶液型吸入气雾剂,贮藏于有定量阀门系统的密封容器中。本品平均每揿含异丙 托溴【铵性(状C20】H 30本Br品NO在3)耐应压为容标器示中量的的药85液 0为%无~色11澄5清0%液。体;揿压阀门,药液即呈雾粒喷出。
【含量测定】 照高效液相色谱法(中国药典2015 年版四部通则0512)测定。
· · 2 60 中 国 药 品 标 准 Drug Standards of China 2019, 20(3)
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取1 mol·L-1磷
一致。
【检查】 有关物质 取本品,用乙醇将表面淋洗干净,冷冻10 分钟,取出,在铝盖上钻一小孔,插入注
射针头(勿与液面接触),放至室温,待抛射剂气化挥尽后,除去铝盖,加流动相分次淋洗容器,合并溶液与洗
利多卡因氯己定气雾剂

精密称重(W1),再在室温放置72小时(精确至30分钟),分别精密称重(W2),置2~8℃冷 却后,迅速在铝盖上钻一小孔,放置至室温,待抛射剂完全气化挥尽后,瓶与阀分离,用
乙醇洗净,干燥,分别精密称定重量(W3),按下式计算每瓶年泄露率。平均年泄露率应小 于3.5%,并不得有一瓶大于5%。
年泄露率=365×24×(W1-W2)/[72×(W1-W3)] ×100% 喷射速率 取本品,依法检查(中国药典 2010 年版二部附录ⅠL),每瓶的平均喷射速率
【类别】 局部麻醉药。 【规格】 每瓶总量60g,内含利多卡因1.2g、醋酸氯己定0.3g 【贮藏】 密闭,在阴凉处保存。
起草所:中检院 复核所:上海所
稿 见 意 求 征
用甲醇-水(60:40)稀释制成每1ml中约含利多卡因0.24mg与醋酸氯己定0.06mg的溶液,摇 匀,作为供试品溶液,精密量取20µl,注入液相色谱仪,记录色谱图,将空瓶连同阀门铝盖 一起烘干,精密称定重量,与原来重量之差即为药液的重量;另取利多卡因对照品与醋酸氯 己定对照品适量,精密称定,加甲醇-水(60:40)溶解并定量稀释制成每lml中约含利多卡因 0.24mg与醋酸氯己定0.06mg的溶液,同法测定。按外标法以峰面积计算,即得。
应为 0.7g/s~1.3 g/s。
其他 应符合气雾剂项下有关的各项规定(中国药典2010年版二部附录ⅠL)。
【含量测定】 照高效液相色谱法(中国药典2010年版二部附录V D)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以乙腈-缓冲溶液(取
水950ml,加冰醋酸50ml,混匀,用1mol/L氢氧化钠溶液调节pH值至3.4)(30:70)为流动相;
检测波长为260nm。理论板数按氯己定峰计算不低于6000。
盐酸利多卡因

药品简介
01
药理毒理
02
药代动力学
03
适应症
04
用法用量
06
禁忌
05
不良反应
01
注意事项
02
孕妇及哺乳 期妇女用药
03
儿童用药
04
老年患者用 药
药物过量
05
药物相互作 用
当血药浓度超过5μg·mL-1可发生惊厥,在低剂量时,可促进心肌细胞内k+外流,降低心肌的自律性,而具 有抗室性心律失常作用;在治疗剂量时,对心肌细胞的电活动、房室传导和心肌的收缩无明显影响;血药浓度进 一步升高,可引起心脏传导速度减慢,房室传导阻滞,抑制心肌收缩力和使心排血量下降。
2、本品的红外光吸收图谱应与对照的图谱(光谱集357图)一致。 3、本品的水溶液显氯化物鉴别1的反应(通则0301)。
酸度 取本品0.20g,加水40mL溶解后,依法测定(通则0631),pH值应为4.0~5.5。 溶液的澄清度 取本品1.0g,加水10mL溶解后,溶液应澄清,如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得 更浓。 硫酸盐 取本品0.20g,加水20mL溶解后,加稀盐酸2mL,摇匀,分成2等份,1份中加水1mL,摇匀,作为对照液,另 1份中加25%氯化钡溶液1mL,摇匀,与对照液比较,不得更浓。 2,6-二甲基苯胺 照高效液相色谱法(通则0512)测定,临用新制。 供试品溶液:取本品适量,加流动相溶解并定量稀释制成每1mL中约含5mg的溶液。 对照品溶液:取2,6-二甲基苯胺对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含0.
本品为白色结晶性粉末,无臭。 本品在水或乙醇中易溶,在三氯甲烷中溶解,在乙醚中不溶。 熔点 本品的熔点(通则0612第一法)为75-79°C。
利多卡因说明书

利多卡因说明书一、药品名称利多卡因二、药品成分每毫升注射液含有利多卡因5毫克(或10毫克)。
三、适应症利多卡因适用于以下疾病或情况的疼痛缓解:1. 表面麻醉:用于切口、针刺、分娩、烧伤、皮肤移植等小手术操作前的局部浸润或浸湿。
2. 泌尿外科:用于尿道扩张、膀胱造口术、肾脏切割术等手术操作时的局部或局部阻滞麻醉。
3. 耳鼻喉科:用于鼻腔手术、扁桃体切除术等手术操作时的局部或浸润麻醉。
4. 口腔科:用于牙齿拔除术、修补术及其他口腔手术操作时的局部麻醉。
5. 其他部位:用于其他部位的局部麻醉。
四、用法和用量1. 表面麻醉:将利多卡因注射液适量涂抹于患处,放置几分钟即可产生麻醉作用。
2. 局部注射:根据手术或治疗需要确定注射剂量和注射方法。
3. 浸润麻醉:将利多卡因注射液逐渐注入切口周围组织,以实现局部麻醉作用。
4. 局部阻滞麻醉:根据手术或治疗需要将利多卡因注射液注入相应神经或组织周围,以实现局部麻醉作用。
五、不良反应1. 呼吸系统:过敏反应可能导致呼吸困难、支气管痉挛等。
2. 循环系统:高剂量使用可能引起心脏毒性反应,出现心动过缓、心脏抑制等。
3. 神经系统:过量使用会出现神经毒性反应,表现为震颤、抽搐、昏迷等。
4. 其他:少数患者可能出现过敏反应、局部红肿、瘙痒等。
六、注意事项1. 使用前需确保无过敏史,对利多卡因或其他类似药物过敏者慎用。
2. 药品应保存在阴凉干燥处,避免阳光直射。
3. 使用过程中应遵医嘱,遵守剂量和用法规定,以免产生不良反应。
4. 孕妇、哺乳期妇女和儿童使用前应咨询医生。
5. 注射时应注意无菌操作,避免交叉感染。
七、药物相互作用1. 利多卡因与乙醇、普鲁卡因、丙酮和肝素等药物同时使用可能增加麻醉效果。
2. 非酒精性饮料、感冒药物和抗酸药可能降低麻醉效果。
3. 利多卡因与普鲁卡因同时使用可能增加药物毒性作用。
八、药物过量如发生药物过量,应立即停止使用,并根据病情进行治疗。
严重药物过量可能导致心脏毒性反应和神经系统毒性反应。
盐酸利多卡因质量标准

CHP2015
水分
5.0~7.5%
CHP2015
炽灼残渣
≤0.1%
CHP2015
重金属
≤10ppm
CHP2015
含量测定
≥99.0%(干品计)
CHP2015
微生物限度
细菌数≤100个/g
霉菌和酵母菌数≤100个/g
金黄色葡萄球菌、铜绿假单胞菌不得检出。
CHP2015
盐酸利多卡因质量标准
题目:盐酸利多卡因质量标准
编码:
起草:
日期:
审核:
日期:
批准:
日期:
生效日期:
颁发部门:研发部
分发部门:质控部、生产部
变更记载:修改号:
批准日期:执行日期:
变更原因及目的:
标准来源依据:《中国药典》2015版二部
目的:建立一个盐酸利多卡因的质量标准。
范围:适用于盐酸利多卡因的质量检验。
职责:质控部、物料部对本标准的实施负责。
检验项目
质量标准
检验依据
性状
本品为白色结晶性粉末,
无臭、味苦,继有麻木感,
CHP2015
熔点
75~79℃
CHP2015
鉴别
符合规定
CHP2015
呈正反应
CHP2015
红外光吸收图谱
应与对照的图谱一致
CHP2015
显氯化物的鉴别反应
CHP2015
检查
pH
4.0~5.5
盐酸利多卡因检验标准

盐酸利多卡因检验标准盐酸利多卡因检验标准【通用名称】盐酸利多卡因【其他名称】盐酸利多卡因盐酸利多卡因拼音名:Yansuan Liduokayin 英文名:Lidocaine Hydrochloride 书页号:2000年版二部-610 C14H22N2O.HCl.H2O 288.82 本品为N-(2,6-二甲苯基)-2-(二乙氨基)乙酰胺盐酸盐一水合物。
按无水物计算。
含C14H22N2O.HCl 不得少于99.0%。
【性状】本品为白色结晶性粉末;无臭,味苦,继有麻木感。
本品在水或乙醇中易溶,在氯仿中溶解,在乙醚中不溶。
熔点本品的熔点(附录Ⅵ C)为75~79℃。
【鉴别】取本品0.2g,加水20ml溶解后,照下述方法试验。
(1) 取溶液10ml,加三硝基苯酚试液10ml,即生成沉淀;滤过,沉淀用水洗涤后,干燥,依法测定(附录Ⅵ C),熔点为228 ~232 ℃,熔融时同时分解。
(2) 取溶液2ml ,加硫酸铜试液0.2ml 与碳酸钠试液1ml,即显蓝紫色;加氯仿2ml, 振摇后放置,氯仿层显黄色。
(3) 溶液显氯化物的鉴别反应(附录Ⅲ)。
(4) 本品的约外光吸收图谱应与对照的图谱(光谱集357图)一致。
【检查】酸度取本品0.20g ,加水40ml溶解后,依法测定(附录Ⅵ H),pH值应为4.0 ~5.5 。
溶液的澄清度取本品1.0g,加水10ml溶解后,溶液应澄清;如显浑浊,与1 号浊度标准液(附录Ⅸ B)比较,不得更浓。
水分取本品,照水分测定法(附录Ⅷ M第一法A)测定,含水分为5.0%~7.5 %。
炽灼残渣不得过0.1 %(附录Ⅷ N)。
重金属取本品2.0g,加冰醋酸盐缓冲液(pH3.5)2ml与水适量使溶解成25ml,依法检查(附录Ⅷ H第一法),含重金属不得过百万分之十。
【含量测定】取本品约0.2g,精密称定,加冰醋酸10ml溶解后,加醋酸汞试液 5 ml与结晶紫指示液1 滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显绿色,并将滴定的结果用空白试验校正。
化妆品中利多卡因等7种物质的检测方法-中国食品药品检定研究院
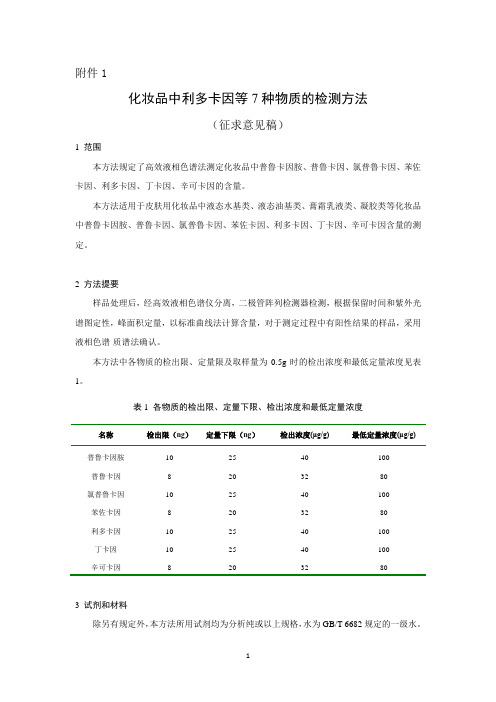
附件1化妆品中利多卡因等7种物质的检测方法(征求意见稿)1 范围本方法规定了高效液相色谱法测定化妆品中普鲁卡因胺、普鲁卡因、氯普鲁卡因、苯佐卡因、利多卡因、丁卡因、辛可卡因的含量。
本方法适用于皮肤用化妆品中液态水基类、液态油基类、膏霜乳液类、凝胶类等化妆品中普鲁卡因胺、普鲁卡因、氯普鲁卡因、苯佐卡因、利多卡因、丁卡因、辛可卡因含量的测定。
2 方法提要样品处理后,经高效液相色谱仪分离,二极管阵列检测器检测,根据保留时间和紫外光谱图定性,峰面积定量,以标准曲线法计算含量,对于测定过程中有阳性结果的样品,采用液相色谱-质谱法确认。
本方法中各物质的检出限、定量限及取样量为0.5g时的检出浓度和最低定量浓度见表1。
表1 各物质的检出限、定量下限、检出浓度和最低定量浓度名称检出限(ng)定量下限(ng)检出浓度(μg/g)最低定量浓度(μg/g)普鲁卡因胺10 25 40 100普鲁卡因8 20 32 80氯普鲁卡因10 25 40 100苯佐卡因8 20 32 80利多卡因10 25 40 100丁卡因10 25 40 100辛可卡因8 20 32 803 试剂和材料除另有规定外,本方法所用试剂均为分析纯或以上规格,水为GB/T 6682规定的一级水。
3.1 甲醇,色谱纯。
3.2 乙腈,色谱纯。
3.3 正己烷,色谱纯。
3.4 三氯乙酸,优级纯。
3.5 甲酸,优级纯。
3.6 磷酸,相对密度=1.685,w(H3PO4)=85%,优级纯。
3.7 磷酸氢二钠。
3.8 氨水,优级纯,含量(NH3)= 25%~28%。
3.9 混合标准储备溶液:称取普鲁卡因胺、氯普鲁卡因、丁卡因、利多卡因标准品各0.05g (精确到0. 00001g),普鲁卡因、苯佐卡因、辛可卡因标准品各0.04g(精确到0. 00001g)置于同一50 mL容量瓶中,加甲醇(3.1)使溶解并定容至刻度,摇匀。
3.10 流动相的配制:流动相A:0.01 moL/L Na2HPO4 水溶液,H3PO4调pH值至7.0流动相B:甲醇4 仪器和设备4.1 高效液相色谱仪,二极管阵列检测器。
利多卡因药典标准

利多卡因药典标准
利多卡因药典标准
利多卡因是一种强效局部麻醉药,用于外科、牙科和其他手术和
治疗。
它主要通过有效成分利多卡因来实现诱导麻醉、麻醉和抗痛觉
效果。
利多卡因的临床应用通常需要遵从药典规定,下面简要介绍利
多卡因药典标准。
1. 利多卡因的性质与作用
利多卡因是一种强力的双氢胍乙酸盐局部麻醉药,具有快速、持
久的麻醉作用,以及强烈的抗痛觉特性。
此外,它也用于抗肿瘤药物
的中枢镇静等治疗中。
2. 药物分类
利多卡因可以分为牙科和外科两大类,牙科利多卡因多为2%和4%
溶液,外科利多卡因多为0.5%或者1%溶液。
3. 主要成分
利多卡因的主要成分是双氢胍乙酸盐,其中无水物不超过98.0%,
乙醇不超过2.0%,氯化物、氢氧化物和其他有机物的总量不超过1.0%,甜菜碱含量不超过0.1%。
4. 用药指南
在牙科外科手术中,利多卡因可注射于皮肤表面或者局部淋巴结内,也可以与其他麻醉药混合使用。
在外科手术中,利多卡因可以分
三次频玴注射,或者一次性滴静脉注射,也可以作为局部麻醉剂与强
心剂配伍使用。
5. 副作用
利多卡因具有通常的药物副作用,如头晕、烦躁、呼吸微弱、急
性呼吸抑制、心律失常、肌张力减弱、皮疹以及抗体的形成等,并可
能导致过敏反应。
所以使用利多卡因时应当仔细考虑利弊,并在严格指导下使用。
6. 注意事项
利多卡因的频度和剂量与临床情况有关,有时需要根据患者的敏感程度和反应进行调整。
此外,利多卡因可能会引起急性呼吸抑制,对有头晕、发热或者有心脏病史患者应谨慎使用,还应当小心使用毒药和诱发剂。
利多卡因药典标准

利多卡因药典标准
利多卡因药典标准是提供行业准确性和有效性的明确的质量要求。
利多卡因是一种镇痛,局部麻醉和镇静的药物,被广泛用于手术前后
以及一些内科疾病的治疗中。
利多卡因药典标准主要是小分子药物,
注射剂形式,用于治疗诸如哮喘,类风湿性关节炎,痉挛性疼痛,癫痫,唐氏综合征等疾病。
利多卡因药典标准主要集中在组成、质量、性能和储存条件等方面。
尤其是质量特点,生产厂家应遵守利多卡因药典标准,如激活正
确的稀释,使用放射性示踪随后的分析,控制气体流量的火焰诱导,
以及使用相应的分析测试把握凝固物和水分等组分参数。
结果将写入
病历,以保证质量。
此外,利多卡因药典标准还要求在生产过程中严格检查溶液的清
晰度,透明度,颜色,浊度,PH值,PH值随变化而变化,去污测试,
氯化物,硼酸盐,亚硝酸盐,结晶,固形残渣,蛋白质,亚硝酸盐,
高纯度,非活性蛋白质,不溶性碱质和悬浮等指标,确保符合质量标准。
最后,利多卡因药典标准也要求有效保存,质量稳定性和收率。
建议保存在2至8摄氏度(35.6至46.4华氏度)之间,省略号,光照,湿度和温度变化,避免冻结和加热。
此外,利多卡因药典标准要求批
准收率不低于95%,失效收率低于5%,失效率不高于1%。
利多卡因药典标准

利多卡因药典标准
利多卡因药典标准是指有效利多卡因类制剂(以下称乳剂)的限定
性质量标准。
此药典标准适用于具有一定浓度的利多卡因和任何有效
添加剂的制剂,包括利多卡因口服混合物、利多卡因糖衣贴剂、利多
卡因水溶性片剂及其他处方利多卡因制剂。
利多卡因药典标准所列出的特定形态和组分是对有效利多卡因制
剂进行质量控制和评价的依据,以确保产品质量稳定并符合要求和要求。
1、有效成分含量:乳剂中有效成分的含量在每克乳剂中应不少于90.0 %。
2、流动性:根据《中国药典》(2015版)第三部分中温度为20℃时的流动性测定。
3、粘度:根据《中国药典》(2015版)第三部分中的温度为25℃的粘度测定。
4、溶出度:根据《中国药典》(2015版)第三部分中的溶出度测定。
5、比重:根据《中国药典》(2015版)第三部分中的比重测定规定,测定比重应不小于1.20 g/cm3。
6、过敏原:在药典检查中,不允许有过敏原存在。
7、游离利多卡因:乳剂中有效成分中游离利多卡因(即偏离进料
时的化学稳定性)应小于0.30%。
8、放射性物质:乳剂中应不含任何放射性物质。
9、重金属:乳剂中重金属总量应小于10 ppm。
10、毒理性:乳剂应符合《中国药典》(2015版)第三部分中规
定的毒理测定和筛选指标。
11、菌落总数:乳剂的菌落总数应小于100 CFU/g。
12、农药残留:不允许乳剂中有任何农药残留。
13、其他试验:乳剂应按《中国药典》(2015版)第三部分中规定进行其他必要试验。
含有利多卡因的凝胶检测标准

含有利多卡因的凝胶检测标准
本标准规定了含有利多卡因的凝胶的各项检测指标和检测方法,以确保其质量和安全性。
1.性状
含有利多卡因的凝胶应为均匀的半透明状,无杂质、气泡和颜色不均匀等现象。
2.鉴别
通过高效液相色谱法等手段对利多卡因进行定性鉴别。
具体方法可参考有关文献或标准操作规程。
3.精密度的检查
采用标准物质或对照品进行精密度的检查,包括重现性、稳定性等指标。
4.含量测定
采用高效液相色谱法等手段对利多卡因进行定量分析,以确定其含量。
具体方法可参考有关文献或标准操作规程。
5.稳定性试验
对含有利多卡因的凝胶进行加速和长期稳定性试验,以评估其在不同条件下的稳定性。
6.最低装量检查
对每个批次的产品进行最低装量检查,确保其符合规定要求。
7.微生物限度检查
按照《药典》规定的方法进行微生物限度检查,包括细菌、霉菌、
酵母菌等指标。
8.异常毒性检查
采用小鼠或大鼠进行异常毒性检查,以评估产品的安全性。
9.细菌内毒素检查
采用鲎试验等方法对细菌内毒素进行检查,以确保产品无内毒素污染。
10.溶血与凝聚检查
对含有利多卡因的凝胶进行溶血与凝聚检查,以评估其是否具有溶血和凝聚作用。
11.无菌检查
按照《药典》规定的方法对产品进行无菌检查,以确保产品无菌。
12.渗透压摩尔浓度检查
对含有利多卡因的凝胶进行渗透压摩尔浓度检查,以评估其渗透压是否符合规定要求。
具体方法可参考有关文献或标准操作规程。
国家食品药品监督管理局办公室关于盐酸利多卡因胶浆药品标准执行问题的通知

国家食品药品监督管理局办公室关于盐酸利多卡因胶
浆药品标准执行问题的通知
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2008.10.09
•【文号】食药监办函[2008]268号
•【施行日期】2008.10.09
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局办公室关于盐酸利多卡因胶浆药品
标准执行问题的通知
(食药监办函[2008]268号)
河北、江苏、浙江省食品药品监督管理局:
目前,国家药品标准收载两个“盐酸利多卡因胶浆”标准,一为部颁标准“盐酸利多卡因胶浆”〔标准号WS1-(X-116)-96Z〕,一为中国药典2005年版“盐酸利多卡因胶浆(I)”,两标准分别由不同企业的新药试行标准转正、修订而来。
由于该产品通用名称、制剂处方、检验项目、作用与用途等项目均有所不同,相关药品生产企业应当根据本企业由药品注册部门批准的标准正确执行,不可混用。
请你们通知辖区内相关药品生产企业,根据药品标准注册审批来源情况明确本企业应当执行的现行国家标准,严格执行相应国家标准的各项规定。
对存在执行标准混淆问题的,应责令企业立即改正。
企业在执行国家标准中发现问题或需要修订标准,应及时向药品注册部门反映或按规定提出修改标准的申请。
国家食品药品监督管理局办公室
二○○八年十月九日。
利多卡因药典标准

利多卡因药典标准利多卡因药典标准是一种常用的麻醉药。
它是一种可以使患者快速进入和恢复麻醉状态的药物,可以用于控制手术或诊断时的疼痛、紧张和焦虑。
利多卡因可以以不同的形式使用,包括注射剂、口服剂和鼻用剂。
利多卡因的药典标准要求具有特定的化学成分和性质,如一水合物、一族磺酰胺、两个烷基环糊精醚及其衍生物、瞬间和慢解释剂。
其中,磺酰胺类利多卡因(如止痛磺胺剂)的药典标准检测项目包括:活性成分的含量应≥90.0%,水不超过7.0%,无机盐不超过0.5%,余氯不超过2.0%,光度应符合要求(偏振度≤0.25%),沉淀物及分析结果应符合药典规定。
另一类环糊精醚衍生物的药典标准检测项目包括:有效成分的含量应≥90.0%,水不超过0.4%,乙醇不超过3.0%,无机盐不超过0.2%,余氯不超过0.8%,蒸发残渣不超过1.0%,沉淀物及分析结果应符合药典规定。
瞬间释放利多卡因的药典标准检测项目包括:有效成分的含量应≥90.0%,水不超过7.0%,无机盐不超过0.5%,余氯不超过2.0%,光度应符合要求(偏振度≤0.25%),沉淀物及分析结果应符合药典规定。
此外,慢释放利多卡因的药典标准检测项目包括:有效成分的含量应≥90.0%,水不超过7.0%,无机盐不超过0.5%,余氯不超过2.0%,光度应符合要求(偏振度≤0.25%),沉淀物及分析结果应符合药典规定,磺酰氯应<0.2%,大豆磷脂应<0.1%,衍生物有芬太尼或/和灭多美地应<2.0%,其他衍生物应<10.0%。
总之,利多卡因药典标准是一套实用的规范,确保药品的化学成分、性质和有效性都符合国家标准,以便更好地保障患者的病情治疗和疼痛控制。
利多卡因药典标准

利多卡因药典标准
利多卡因药典标准是一套被全球认可的质量标准,旨在评估利多
卡因以及使用它治疗医学问题的合法性。
它涉及到利多卡因的生产、
应用、安全性以及影响它治疗病症的因素。
与此同时,它也规定了如
何以有效的方式使用利多卡因来治疗疾病。
质量标准的内容主要集中在利多卡因的组分、活性成分、制剂、
添加剂、用法、储存安全性和操作指南等方面。
此外,还涉及关于利
多卡因的药效评估、使用潜力、副作用和其他安全性的规定。
利多卡因药典标准明确规定,所使用的利多卡因产品必须遵守安全、有效以及符合国际标准的要求。
所有生产和销售利多卡因的人员
都必须符合药典标准的要求,并接受严格的监管。
最后,生产和使用利多卡因的医师应该依据药典标准给病患施药,确保病患安全有效地得到改善。
医师也应该注意不同病患的不同病情,选择合适的剂量,尽量减少潜在的副作用。
利多卡因药典标准

利多卡因药典标准
利多卡因药典标准是一种用于检验利多卡因的质量和有效性的国际标准。
它被广泛用于药物研发、临床实验、制药生产和药品质量检验中。
利多卡因药典标准是经过国际规范化,在国际协调下,由专家会议根据实验测定和理论计算得出的利多卡因近似质量标准。
利多卡因药典标准定义了利多卡因各种质量参数,包括氢氧化钾盐(钾法)、氢氧化钠盐(钠法)、氢氧化钙盐(钙法)等,以及利多卡因的熔点、溶解度、用量等参数的规定。
此外,还规定了一些具体的技术检测要求,如利多卡因的气相色谱检测方法、溶液的酸-碱检测法、溶解度的测定法,以及可选择的有机溶剂的检测方法等。
根据不同的需求,可以选择不同的技术来检测利多卡因的性质。
利多卡因药典标准还规定了利多卡因在各种条件下不同程度的变质及形态变化所必需的技术检测要求,保证该药品在应用和运输过程中,可以得到最佳的质量保障。
以上就是利多卡因药典标准大概的概述,未来利多卡因药典标准还会不断发展完善,以保障利多卡因的质量和有效性。
希望本次介绍能给大家带来帮助,我们继续努力,祝愿大家健康!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利多卡因药典标准
利多卡因是一种合成麻醉药,它是从植物材料中提取出的植物类
麻醉剂。
它具有非常强大的镇痛作用,可以被用于消除全身性疼痛、
局部疼痛以及手术后的疼痛。
此外,利多卡因还可以用于治疗头痛、
发热、呼吸困难等症状。
根据药典标准,利多卡因具有以下几种形式:
1. 利多卡因注射液:利多卡因注射液是非常常用的,它具有针对
性较强的镇痛作用。
它有不同的浓度,按照浓度的不同分为2mg/ml,
5mg/ml,10mg/ml,20mg/ml等不同的浓度。
2. 利多卡因片剂:利多卡因片剂是由利多卡因粉末制成,目前有
10毫克的片剂,用于内服治疗疼痛或其他症状。
3. 利多卡因口服液:利多卡因口服液是把利多卡因粉末加入适量
的水溶液中,由口服的形式给药,它的浓度有5mg/ml,10mg/ml,
20mg/ml等不同浓度。
4. 利多卡因散剂:利多卡因散剂包含了混合物中的利多卡因粉末,用于镇痛、发热、呼吸等症状的治疗,它的浓度有1mg/ml,2mg/ml,
3mg/ml,4mg/ml等不同浓度。
5. 利多卡因青霉素:利多卡因青霉素是将利多卡因和青霉素结合
在一起,用于治疗感染性疼痛以及心肌梗死等疾病,它的浓度有
0.5mg/ml,1mg/ml,2mg/ml等不同浓度。
6. 利多卡因乳膏:利多卡因乳膏是由纯利多卡因粉末和乳液组成,可以用于局部外用,例如治疗皮肤疼痛、创伤性疼痛、过敏性疼痛等,它的浓度有0.5%,1%,2%等不同浓度。
7. 利多卡因整体病灶:利多卡因整体病灶是将利多卡因和乳膏或
者乳霜组合在一起,用于治疗骨折、烧伤、肿瘤等较大面积的疼痛,
它的浓度有0.5%,1%,2%等不同浓度。
以上是药典标准中关于利多卡因的重要内容,它们都有着不同的特性,有了这些药典标准之后,使得患者在使用利多卡因时能够更安全,更有效的达到治疗的目的。
