化学 镁及其化合物的专项 培优易错试卷练习题含答案(1)
化学镁及其化合物的专项培优 易错 难题练习题(含答案)附详细答案

化学镁及其化合物的专项培优易错难题练习题(含答案)附详细答案一、镁及其化合物1.置换反应的通式可表示为:请回答下列问题:(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为:;(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3Al2O3+2Fe。
该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是:;(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式:;(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为:。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。
工业上制取硅单质所用的化合物A是,A非常细,导光能力很强,可用作。
【答案】(1)2I-+ Cl2 = I2+ 2Cl-(2)NaOH溶液(3)3Fe + 4H2O(g)Fe3O4+ 4H2(4)2Mg+CO22MgO+C(5)SiO2光导纤维【解析】【分析】置换反应的反应物、生成物中都有单质和化合物,一定属于氧化还原反应,因而有化合价的升高和降低。
【详解】(1)黄绿色气体甲为氯气,能使淀粉溶液变蓝色的单质乙为碘,则反应的离子方程式为2I-+ Cl2 = I2+ 2Cl-;(2)Al、Al2O3都能溶于强碱溶液,而Fe、Fe2O3不溶。
要除去反应后混合物中剩余的铝粉与生成的Al2O3可使用NaOH溶液;(3)常见的金属单质有钠、铝、铁、铜等,磁性黑色晶体B为Fe3O4,则反应的化学方程式为3Fe + 4H2O(g)Fe3O4+ 4H2 ;(4)黑色非金属固体单质为焦炭,耐高温材料有MgO、Al2O3等高熔点物质,则该反应的化学方程式为2Mg+CO22MgO+C。
(5)工业上制取硅单质通常用焦炭和石英砂高温反应,则化合物A是SiO2,因其导光能力很强,可用作光导纤维。
2.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):(1)若A是一种金属,C是淡黄色固体,则B的化学式为_______,A→C反应的化学方程式为__________________________;若将金属A与金属铝同时加入足量水中,充分反应后,发现溶液中既无沉淀生成又无残留金属剩余,经测定溶液中只含有一种溶质,则投入水中的金属A与金属Al的物质的量之比为_________。
备战高考化学镁及其化合物(大题培优易错试卷)含答案

备战高考化学镁及其化合物(大题培优易错试卷)含答案一、镁及其化合物1.下图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:(1)A的化学式_____________B的电子式_______________。
(2)写出下列反应的化学方程式:D+G→ H_____________________________。
B+镁→ E + F______________________________。
(3)写出A + NaOH →D的离子方程式_________________________________。
【答案】(1) NH4HCO3(2) 4NH3+5O24NO + 6H2O CO2+ 2Mg ="==" 2MgO+C(3) NH4++ HCO3-+2OH-= NH3+CO32-+2H2O【解析】【分析】已知A与碱反应生成气体化合物,则A含有铵根离子;A加热分解生成等物质的量的2种气体和1种液体,液体与过氧化钠反应则为水,可确定A为碳酸氢铵,D为氨气,C为水,B为二氧化碳;二氧化碳与镁反应生成氧化镁和碳;【详解】(1)分析可知,A为碳酸氢铵,化学式为:NH4HCO3;B为二氧化碳,其电子式为:;(2)D与G分别为氨气、氧气,在一定条件下反应生成一氧化氮和水,方程式为:4NH3+5O24NO+6H2O;镁与二氧化碳反应生成氧化镁和碳,方程式为:CO2+2Mg 点燃2MgO+C;(3)碳酸氢钠与NaOH反应生成氨气、水和碳酸钠,其反应的离子方程式为:NH4+ + HCO3-+2OH-= NH3 +CO32-+2H2O;2.有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体。
请回答下列问题:(1)C的化学式为:______________。
【化学】化学镁及其化合物的专项培优易错试卷练习题(含答案)

【化学】化学镁及其化合物的专项培优易错试卷练习题(含答案)一、镁及其化合物1.某固体试样A是由一定量的Al、Mg均匀组成的混合物,为验证混合物的组成,进行如下实验:①取m g试样A,全部溶于0.5L 2mol·L-1稀硫酸溶液中,放出11.2 L气体(已换算成标准状况),同时生成溶液B;②另取m g试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成;③往溶液B中加入2mol/L NaOH,至沉淀不再发生变化。
根据以上过程回答下列问题:(1)溶液B中是否含有H+_____________(填“是”或“否”);(2)写出②中发生反应的离子方程式____________________________________;(3)下列能表示过程③产生的沉淀质量W与加入NaOH溶液体积V的关系是_____;(4)m g试样A中含Mg的质量为________g;(5)林同学通过查阅资料,发现浓硫酸与铝发生钝化,但与Mg能剧烈反应生成SO2,如果忽略钝化的反应过程,可以通过测定浓硫酸与固体试样反应产生的气体体积,来确定混合物A中镁的质量分数。
郭同学认为林同学的方案可行,但考虑到如果反应结束后硫酸未保持“浓”的状态,测定结果会____________(填“偏大”、“偏小”或“不变”),其依据是_______________________________________________________。
【答案】是 2Al+2OH-+2H2O=2AlO2-+3H2↑ D 4.8 偏大浓硫酸变稀后会与铝反应,使生成的气体偏多,镁的质量分数测定结果偏大【解析】【分析】镁和铝均能与稀硫酸反应生成氢气,铝只能与氢氧化钠溶液反应生成氢气,氢氧化铝是两性氢氧化物,氢氧化镁不溶于强碱,结合有关物质的物质的量和反应的方程式分析解答。
【详解】(1)0.5L2mol·L-1稀硫酸溶液中硫酸的物质的量是0.5L×2mol/L=1.0mol,最终放出氢气的物质的量是11.2L÷22.4L/mol=0.5mol,根据氢原子守恒可知硫酸过量,所以溶液B中含有H+;(2)另取m g试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成,该过程中只有铝和氢氧化钠溶液反应,则②中发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)由于溶液中B中含有硫酸、硫酸镁和硫酸铝,因此往溶液B中加入2mol/L NaOH,至沉淀不再发生变化时首先发生中和反应,然后氢氧根沉淀镁离子和铝离子,最后氢氧化钠溶解氢氧化铝,则能表示过程③产生的沉淀质量W与加入NaOH溶液体积V的关系是图像D,答案选D;(4)与铝反应的氢氧化钠的物质的量是2mol/L×0.1L=0.2mol,根据方程式可知2Al+2OH-+2H2O=2AlO2-+3H2↑生成氢气是0.3mol,由于相同质量的铝与稀硫酸反应也产生0.3mol氢气,则镁生成的氢气是0.5mol-0.3mol=0.2mol,所以根据方程式Mg+2H+=Mg2++H2↑可知镁的质量是0.2mol×24g/mol=4.8g;(5)由于浓硫酸变稀后会与铝反应,使生成的气体偏多,从而导致镁的质量分数测定结果偏大。
化学 镁及其化合物的专项 培优 易错 难题练习题含答案(1)

化学镁及其化合物的专项培优易错难题练习题含答案(1)一、镁及其化合物1.已知X溶液有如图所示转化关系:(1)根据上述转化关系,写出下列物质的化学式:X_____、Y_______、Z________、试剂甲________,试剂乙__________。
(2)写出上述各步反应①~④的离子方程式:①__________________________________;②____________________________;③___________________________________;④_____________________________。
【答案】MgSO4 Mg(OH)2 MgCl2 BaCl2 AgNO3 SO42-+Ba2+═BaSO4↓ Mg2++2OH-═Mg(OH)2↓ Mg(OH)2+2H+═Mg2++2H2O Ag++Cl-═AgCl↓【解析】【分析】X与硝酸钡反应得到硝酸镁,则X含有镁离子,且阴离子与钡离子反应生成沉淀,可推知X为MgSO4,结合转化关系,可知Y为Mg(OH)2、Z为MgCl2、试剂甲为 BaCl2,试剂乙为AgNO3,据此解答。
【详解】(1)X与硝酸钡反应得到硝酸镁,则X含有镁离子,且阴离子与钡离子反应生成沉淀,可推知X为MgSO4,结合转化关系,可知Y为Mg(OH)2、Z为MgCl2、试剂甲为 BaCl2,试剂乙为AgNO3;(2)反应①的离子方程式为:SO42-+Ba2+═BaSO4↓;反应②的离子方程式为:Mg2++2OH-═Mg(OH)2↓;反应③的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O;反应④的离子方程式为:Ag++Cl-═AgCl↓。
2.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:(1)C与D形成的化合物的电子式.(2)写出D的单质与CO2反应的化学方程式.(3)“嫦娥一号”发射所用的液体燃料是上述(填元素名称)元素的单质.(4)工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为.(5)在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0. 3 mol/L.[此时间内A2表示的化学反应速率为0. 45 mol/(L·s).则此段反应时间为 s【答案】(1) (2) 2Mg+CO22MgO+C (3)氢 (4)接触室(5) 2【解析】【分析】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的原子核无中子,则A为H,能与B、C分别形成10电子的化合物,B、C的族序数为奇数,则B为N,C为F,B、C的质子数之和与E的质子数相等,则E为S,D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数,则D为Mg,据此答题。
备战高考化学 镁及其化合物 培优 易错 难题练习(含答案)(1)

备战高考化学镁及其化合物培优易错难题练习(含答案)(1)一、镁及其化合物1.有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体。
请回答下列问题:(1)C的化学式为:______________。
(2)B的电子式为:______________。
(3)写出③的离子方程式:__________________。
(4)写出②的化学方程式,并用“单线桥”标出电子转移的方向和数目________________。
【答案】MgO H2O+3NO2=== 2H++2NO3-+NO【解析】A是金属单质在无色气体B中燃烧生成非金属单质D,则A是Mg、B是CO2、C是MgO、D是C;碳可以和浓硫酸、浓硝酸在加热条件下反应生成CO2,结合F与水化合能生成E,可知E为浓硝酸,F为NO2;(1)C的化学式为MgO;(2)CO2是共价化合物,其的子式为;(3)NO2溶解于水生成硝酸和NO的离子方程式为H2O+3NO2=== 2H++2NO3-+NO;(4)碳与浓硝酸反应生成CO2的反应是氧化还原反应,其反应化学方程式及电子转移的方向和数目为。
点睛:此类题的解答一般有以下步骤:思维起点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一下是否符合题中条件;金属在无色气体中燃烧生成非金属单质这一特殊反应现象,及时与Mg在二氧化碳中燃烧建立联系,展开思维的空间,寻找目标答案。
2.用C、Mg和Al组成的混合物进行如下图所示实验。
填写下列空白。
(1)气体X为_________,固体Z为_____________。
【化学】化学镁及其化合物的专项培优易错试卷练习题含答案(1)

【化学】化学镁及其化合物的专项培优易错试卷练习题含答案(1)一、镁及其化合物1.镁铝合金在交通、航空、电子等行业有着广泛的应用。
某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。
镁铝合金废料转化为硫酸铝晶体实验流程如下:试回答下列问题:(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式,固体B的化学式。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、、、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。
计算得硫酸铝晶体的化学式为。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知:。
根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式,第三阶段反应化学方程式。
【答案】(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2)Al(OH)3(3)冷却结晶(4)过滤减少晶体的溶解(5)洗去晶体表面杂质(6)有利于晶体的干燥(7)Al2(SO4)3·18H2O(8)Al2(SO4)3·3H2O (9)Al2(SO4)3Al2O3+3SO3↑【解析】【分析】向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再通过过量进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应;(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;(3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥;(4)Al的质量为9g-4.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据Al元素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算n的值,确定化学式;(5)根据(4)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高温下,最终硫酸铝分解,根据失重%计算判断各阶段分解产物,再书写化学方程式;【详解】(1)在镁铝合金中加入NaOH溶液,Al可以与强碱溶液发生反应,而Mg不能反应,该反应的化学反应方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;所以固体A是Mg;向滤液中通入过量的CO2气体,由于酸性H2CO3>Al(OH)3,会发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;所以固体B是Al(OH)3;(2)用硫酸溶解该固体,发生反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;得到的溶液C是Al2(SO4)3溶液;由于其溶解度随温度的升高而增大,所以从溶液中获得晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,来洗去表面的杂质离子,选用无水乙醇的原因是减少晶体的溶解;洗去晶体表面杂质;有利于晶体的干燥;(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,金属发生反应,而镁不反应,减少的质量为金属铝的质量,则m(Al)= 9.00g—4.95 g=4.05g,n(Al)=4.05 27/gg mol=0.15mol,硫酸铝晶体的质量为49.95 g,硫酸铝晶体中含有SO42-的物质的量为n(SO42-)=32n(Al3+)=32×0.15mol=0.225mol, Al2(SO4)3的质量是m(Al2(SO4)3)= (0.15mol2)×342g/mol=25.65g,则含有的结晶水的物质的量是n(H2O)=49.95g25.65g18g/mol)(=1.35mol,则n(Al2(SO4)3):n(H2O)= (0.15mol2):1.35mol=1: 18,所以该结晶水合物的化学式是:Al2(SO4)3·18H2O。
化学镁及其化合物的专项培优易错试卷练习题(含答案)及答案解析

化学镁及其化合物的专项培优易错试卷练习题(含答案)及答案解析一、镁及其化合物1.镁铝合金在交通、航空、电子等行业有着广泛的应用。
某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。
镁铝合金废料转化为硫酸铝晶体实验流程如下:试回答下列问题:(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式,固体B的化学式。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、、、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。
计算得硫酸铝晶体的化学式为。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知:。
根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式,第三阶段反应化学方程式。
【答案】(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2)Al(OH)3(3)冷却结晶(4)过滤减少晶体的溶解(5)洗去晶体表面杂质(6)有利于晶体的干燥(7)Al2(SO4)3·18H2O(8)Al2(SO4)3·3H2O (9)Al2(SO4)3Al2O3+3SO3↑【解析】【分析】向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再通过过量进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应;(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;(3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥;(4)Al的质量为9g-4.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据Al元素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算n的值,确定化学式;(5)根据(4)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高温下,最终硫酸铝分解,根据失重%计算判断各阶段分解产物,再书写化学方程式;【详解】(1)在镁铝合金中加入NaOH溶液,Al可以与强碱溶液发生反应,而Mg不能反应,该反应的化学反应方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;所以固体A是Mg;向滤液中通入过量的CO2气体,由于酸性H2CO3>Al(OH)3,会发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;所以固体B是Al(OH)3;(2)用硫酸溶解该固体,发生反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;得到的溶液C是Al2(SO4)3溶液;由于其溶解度随温度的升高而增大,所以从溶液中获得晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,来洗去表面的杂质离子,选用无水乙醇的原因是减少晶体的溶解;洗去晶体表面杂质;有利于晶体的干燥;(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,金属发生反应,而镁不反应,减少的质量为金属铝的质量,则m(Al)= 9.00g—4.95 g=4.05g,n(Al)=4.05 27/gg mol=0.15mol,硫酸铝晶体的质量为49.95 g,硫酸铝晶体中含有SO42-的物质的量为n(SO42-)=32n(Al3+)=32×0.15mol=0.225mol, Al2(SO4)3的质量是m(Al2(SO4)3)= (0.15mol2)×342g/mol=25.65g,则含有的结晶水的物质的量是n(H2O)=49.95g25.65g18g/mol)(=1.35mol,则n(Al2(SO4)3):n(H2O)= (0.15mol2):1.35mol=1: 18,所以该结晶水合物的化学式是:Al2(SO4)3·18H2O。
化学镁及其化合物的专项培优易错试卷练习题(含答案)含答案解析

化学镁及其化合物的专项培优易错试卷练习题(含答案)含答案解析一、镁及其化合物1.有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体。
请回答下列问题:(1)C的化学式为:______________。
(2)B的电子式为:______________。
(3)写出③的离子方程式:__________________。
(4)写出②的化学方程式,并用“单线桥”标出电子转移的方向和数目________________。
【答案】MgO H2O+3NO2=== 2H++2NO3-+NO【解析】A是金属单质在无色气体B中燃烧生成非金属单质D,则A是Mg、B是CO2、C是MgO、D是C;碳可以和浓硫酸、浓硝酸在加热条件下反应生成CO2,结合F与水化合能生成E,可知E为浓硝酸,F为NO2;(1)C的化学式为MgO;(2)CO2是共价化合物,其的子式为;(3)NO2溶解于水生成硝酸和NO的离子方程式为H2O+3NO2=== 2H++2NO3-+NO;(4)碳与浓硝酸反应生成CO2的反应是氧化还原反应,其反应化学方程式及电子转移的方向和数目为。
点睛:此类题的解答一般有以下步骤:思维起点的选择:思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:将上述思维过程的结果代入题中,检查一下是否符合题中条件;金属在无色气体中燃烧生成非金属单质这一特殊反应现象,及时与Mg在二氧化碳中燃烧建立联系,展开思维的空间,寻找目标答案。
2.实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾。
除蒸馏水、试管和胶头滴管外,无其他任何试剂和仪器。
化学镁及其化合物的专项培优 易错 难题练习题(含答案)含答案

化学镁及其化合物的专项培优易错难题练习题(含答案)含答案一、镁及其化合物1.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量A l2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:己知:①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:pH值Mg(OH)2Mn(OH)2MnO(OH)2Fe(OH)2Al(OH)3Fe(OH)3开始沉淀时9.37.17.87.6 3.7 2.3沉淀完全时10.810.89.89.6 4.7 3.7②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取(2)“浸取”时,MgSi O3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
【答案】ac MgSi O3+2HCl+(n-l)H2O=MgCl2+Si O2·n H2O4.7<pH<7.1Mn2++H2O2+2O H-=MnO(OH)2↓+H2O Mg(OH)2氨水挥发加剧,导致溶液中氨水浓度降低。
【解析】(1)此处主要考查反应速率的影响因素,所以要想加快酸溶解速率可以从外因浓度、温度、接触面积等考虑,可以采取升温、把硼镁泥粉碎、搅拌等措施,答案选ac。
(2)根据滤渣1可知:MgSiO3与盐酸反应生成SiO2·nH2O,还有产物MgCl2、H2O方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2·nH2O(3)加入双氧水后,Fe2+转化为Fe3+,要使Fe3+、Al3+完全沉淀,pH必须大于或等于4.7,Mn2+不沉淀,pH小于或等于7.1,所以答案为4.7<pH<7.1(4)Mn2+在碱性下被H2O2氧化生成MnO(OH)2,H2O2被还原为H2O,离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O 。
【化学】化学 镁及其化合物的专项 培优 易错 难题练习题含答案(1)

【化学】化学镁及其化合物的专项培优易错难题练习题含答案(1)一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
【化学】化学 镁及其化合物的专项 培优易错试卷练习题及详细答案

【化学】化学镁及其化合物的专项培优易错试卷练习题及详细答案一、镁及其化合物1.A、B、C、D、E、X 都是短周期元素组成的常见无机物根据上框图关系,完成下列问题:(1)A可作漂白剂,X是含有某种阳离子(此阳离子具有净水作用)的溶液,且M(A)=M(D),则A与H2O反应的化学方程式为___________,C转化成D的离子方程式为___________(2)A的某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为________________,C转化成D的化学方程式为______________(3)A是单质,X是Na2CO3溶液,E可用消毒剂,则A与H2O反应的离子方程式为_______________,(4)A是单质,X是单质(它的同素异形体是原子晶体),则E与SiO2反应的化学方程式为________________(5)A是化合物,X是O2,C转化成D还需要催化剂,E具有两性,则A与H2O反应的化学方程式为_____________(6)A是化合物(Mr(A)=100),X是O2,B转化成C还需要催化剂,E是中强碱,则A与H2O反应的化学方程式为___________【答案】2Na2O2+ 2H2O =4NaOH + O2↑ 3AlO2-+ Al3+ + 6H2O = 4Al(OH)3↓ 2Na + 2H2O =2Na++ 2OH-+H2↑ Na2CO3 + CO2 + H2O = 2NaHCO3 Cl2 + H2O =H++Cl-+ HCl SiO2 +4HF=SiF4↑+ 2H2O Al2S3 + 6H2O = 2Al(OH)3+ 3H2S↑ Mg3N2 + 6H2O = 3Mg(OH)2+ 2NH3↑【解析】【分析】A和水反应生成两种物质,B和X反应生成C,C再与X反应生成D,可推测可能是连续两次氧化,或者与量有关的反应。
【详解】(1)A可以做漂白剂,在短周期中有Na2O2、NaClO,SO2等,但是能够与水反应生成两种物质的有Na2O2,X含有的某种阳离子具有净水作用,在短周期中为Al3+。
【化学】化学镁及其化合物的专项培优易错试卷练习题及详细答案

【化学】化学镁及其化合物的专项培优易错试卷练习题及详细答案一、镁及其化合物1.已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B 的化学式为,由C转化为D的化学方程式为,上述反应中属于氧化还原反应的有。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为,加热蒸干并灼烧C的溶液可得D的原因是。
【答案】(1)Mg3N24NH3+ 5O2 4NO +6H2O ①②③⑤(2)2Fe2++Cl2= 2Fe3++2Cl-FeCl3水解吸热,且水解产物HCl易挥发,从而彻底水解生成Fe(OH)3,灼烧时分解生成Fe2O3。
【解析】试题分析:(1)镁条在空气中燃烧的主要产物有氧化镁和氮化镁,因B可与水反应生成气体C,所以A为N2,B为Mg3N2,C为NH3,D在空气中由无色变红棕色,故D为NO,NH3与HCl气体反应生成NH4Cl时产生大量白烟,所以E为NH4Cl。
根据反应过程中是否存在元素化合价变化,可判断出氧化还原反应有①②③⑤。
(2)由C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,且B为A与盐酸反应的产物,可判断A为Fe,B为FeCl2,C为FeCl3,D为Fe2O3,E为Fe(OH)3。
考点:元素化合物2.X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。
(1)若X的摩尔质量是W的2倍,工业上Z可作优质的耐高温材料。
W为黑色固体,则Y 的化学式________________。
(2)若固体W是紫红色,且向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色。
【化学】化学镁及其化合物的专项培优 易错 难题练习题(含答案)附答案解析

【化学】化学镁及其化合物的专项培优易错难题练习题(含答案)附答案解析一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
化学镁及其化合物的专项培优易错试卷练习题含详细答案
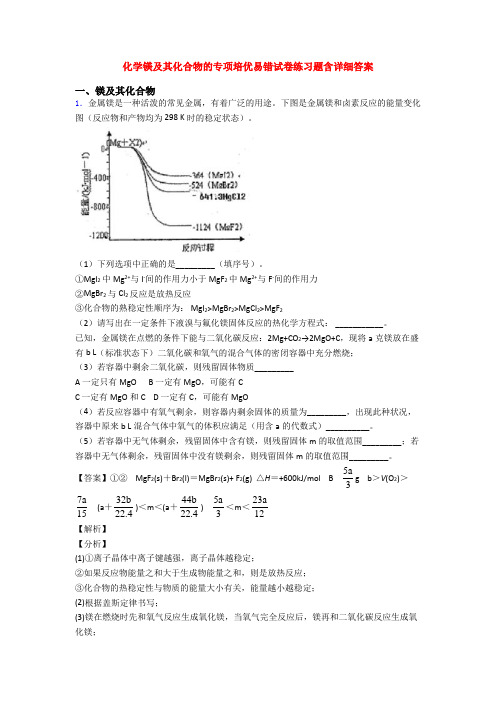
化学镁及其化合物的专项培优易错试卷练习题含详细答案一、镁及其化合物1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力②MgBr2与Cl2反应是放热反应③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;(3)若容器中剩余二氧化碳,则残留固体物质_________A 一定只有MgOB 一定有MgO,可能有CC 一定有MgO和CD 一定有C,可能有MgO(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①② MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol B 5a3g b>V(O2)>7a 15 (a+32b22.4)<m<(a+44b22.4)5a3<m<23a12【解析】【分析】(1)①离子晶体中离子键越强,离子晶体越稳定;②如果反应物能量之和大于生成物能量之和,则是放热反应;③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;(2)根据盖斯定律书写;(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。
化学镁及其化合物的专项培优易错试卷练习题含答案(1)

化学镁及其化合物的专项培优易错试卷练习题含答案(1)一、镁及其化合物1.某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
【答案】MgCl2·6H2O MgCl2·6H2O MgO+2HC1↑+5H2O↑2K2FeO4+16HC1=4KCl+ 2FeCl3+ 3Cl2↑+8H2O【解析】【分析】据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。
结合正盐X灼烧得到混合气体甲和固体乙可推知X含有H、O、Cl和一种金属元素。
依题意经计算可知混合气体甲中:n(HCl)=0.02mol,n(H2O)=mol=0.05mol。
又因盐X为正盐,并且所含元素均为短周期元素,可知其阴离子为氯离子,阳离子可能为Na+、Mg2+或Al3+。
若是钠离子,则X灼烧时无法产生HCl气体,不符合题意,而氯化镁晶体和氯化铝晶体灼烧后得到的分别是氧化酶和氧化铝,根据固体乙的质量计算可知阳离子为Mg2+,固体乙为MgO,n(MgO)-0.01mol,故X为MgCl2·6H2O,据此解答。
【详解】据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。
化学 镁及其化合物的专项 培优易错试卷练习题及答案

化学镁及其化合物的专项培优易错试卷练习题及答案一、镁及其化合物1.下图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:(1)A的化学式_____________B的电子式_______________。
(2)写出下列反应的化学方程式:D+G→ H_____________________________。
B+镁→ E + F______________________________。
(3)写出A + NaOH →D的离子方程式_________________________________。
【答案】(1) NH4HCO3(2) 4NH3+5O24NO + 6H2O CO2+ 2Mg ="==" 2MgO+C(3) NH4++ HCO3-+2OH-= NH3+CO32-+2H2O【解析】【分析】已知A与碱反应生成气体化合物,则A含有铵根离子;A加热分解生成等物质的量的2种气体和1种液体,液体与过氧化钠反应则为水,可确定A为碳酸氢铵,D为氨气,C为水,B为二氧化碳;二氧化碳与镁反应生成氧化镁和碳;【详解】(1)分析可知,A为碳酸氢铵,化学式为:NH4HCO3;B为二氧化碳,其电子式为:;(2)D与G分别为氨气、氧气,在一定条件下反应生成一氧化氮和水,方程式为:4NH3+5O24NO+6H2O;镁与二氧化碳反应生成氧化镁和碳,方程式为:CO2+2Mg 点燃2MgO+C;(3)碳酸氢钠与NaOH反应生成氨气、水和碳酸钠,其反应的离子方程式为:NH4+ + HCO3-+2OH-= NH3 +CO32-+2H2O;2.A、B、C、D、E、F的原子序数依次增大,它们都具有相同的核外电子层数。
已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
备战高考化学 镁及其化合物 培优易错试卷练习(含答案)含答案(1)

备战高考化学镁及其化合物培优易错试卷练习(含答案)含答案(1)一、镁及其化合物1.A、B、C、X均为中学化学常见物质,它们之间有如下转化关系(副产物已略去)。
(1)X是空气中存在的强氧化性无色气体单质,则A不是_____(填序号)。
a.C b.Na c.Al d.S若C是红棕色气体,则A可能是___________或____________。
(2)若X是一种温室气体,单质A被誉为国防金属,则反应①的化学方程式为___________________________________________________。
(3)若X为苛性碱,A是具有臭鸡蛋性气味的气体,则反应②的离子方程式为___________________________________________________。
【答案】c N2 NH3 2Mg+CO22MgO+C HS-+OH-=S2-+H2O【解析】【分析】当X为氧气时,符合此转化关系的变化有:C(CH4)→CO→CO2、N2(NH3)→NO→NO2、S(H2S)→SO2→SO3、Na→Na2O→Na2O2等;当X为二氧化碳、A为Mg时,则有如下转化关系:Mg→C→CO;当X为NaOH、A为H2S 气体时,有如下转化:H2S→HS-→S2-,据此分析解答。
【详解】(1)X是空气中存在的强氧化性无色气体单质,则X为O2,a.当A为C时,可发生如下转化:C→CO→CO2;b.当A为Na时,可发生如下转化:Na→Na2O→Na2O2;c.当A为铝时,不能实现上述转化关系;d.当A为S时,可发生如下转化:S→SO2→SO3;若C是红棕色气体,则C为NO2,转化关系可以是:NH3→NO→NO2或N2→NO→NO2,综上所述,答案为:c;N2或NH3;(2)X是一种温室气体,则X为二氧化碳;单质A被誉为国防金属,则A为金属Mg,反应①为镁在二氧化碳中燃烧的反应,反应方程式为:2Mg+CO22MgO+C,故答案为2Mg+CO22MgO+C;(3)X为苛性碱,则X为NaOH;A是具有臭鸡蛋性气味的气体,则A为H2S,所以转化关系为:H2S→NaHS→Na2S,反应②的离子方程式为HS-+OH-=S2-+H2O,故答案为HS-+OH-=S2-+H2O。
备战高考化学 镁及其化合物 培优易错试卷练习(含答案)含答案解析

备战高考化学镁及其化合物培优易错试卷练习(含答案)含答案解析一、镁及其化合物1.A、B、C、D、E、X 都是短周期元素组成的常见无机物根据上框图关系,完成下列问题:(1)A可作漂白剂,X是含有某种阳离子(此阳离子具有净水作用)的溶液,且M(A)=M(D),则A与H2O反应的化学方程式为___________,C转化成D的离子方程式为___________(2)A的某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为________________,C转化成D的化学方程式为______________(3)A是单质,X是Na2CO3溶液,E可用消毒剂,则A与H2O反应的离子方程式为_______________,(4)A是单质,X是单质(它的同素异形体是原子晶体),则E与SiO2反应的化学方程式为________________(5)A是化合物,X是O2,C转化成D还需要催化剂,E具有两性,则A与H2O反应的化学方程式为_____________(6)A是化合物(Mr(A)=100),X是O2,B转化成C还需要催化剂,E是中强碱,则A与H2O反应的化学方程式为___________【答案】2Na2O2+ 2H2O =4NaOH + O2↑ 3AlO2-+ Al3+ + 6H2O = 4Al(OH)3↓ 2Na + 2H2O =2Na++ 2OH-+H2↑ Na2CO3 + CO2 + H2O = 2NaHCO3 Cl2 + H2O =H++Cl-+ HCl SiO2 +4HF=SiF4↑+ 2H2O Al2S3 + 6H2O = 2Al(OH)3+ 3H2S↑ Mg3N2 + 6H2O = 3Mg(OH)2+ 2NH3↑【解析】【分析】A和水反应生成两种物质,B和X反应生成C,C再与X反应生成D,可推测可能是连续两次氧化,或者与量有关的反应。
【详解】(1)A可以做漂白剂,在短周期中有Na2O2、NaClO,SO2等,但是能够与水反应生成两种物质的有Na2O2,X含有的某种阳离子具有净水作用,在短周期中为Al3+。
【化学】化学镁及其化合物的专项培优 易错 难题练习题含详细答案

【化学】化学镁及其化合物的专项培优易错难题练习题含详细答案一、镁及其化合物1.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。
从硼镁泥中提取MgSO4·7H2O的流程如下:根据题意回答下列问题:(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:温度(℃)40506070MgSO430.933.435.636.9CaSO40.2100.2070.2010.193“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
【答案】烧杯、100mL的容量瓶、胶头滴管 SiO2 Mn2++ ClO-+ H2O → MnO2↓ + 2H++ Cl-2Fe2++ ClO-+ 2H+→ 2Fe3++ Cl-+ H2O 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
蒸发浓缩趁热过滤80%【解析】【详解】(1)配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,(2)由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
【化学】化学镁及其化合物的专项培优 易错 难题练习题含答案

试剂甲_____,试剂乙________
(2)写出上述③④⑤步反应的离子方程式:_____________;___________;___________
【答案】MgSO4Mg(OH++2H2OAg++Cl−=AgCl↓Ba2++SO42−=BaSO4↓
【答案】FeOCO2+2Mg C+2MgOO2Fe3O4等于不变不一定达到0.0263
【解析】
【分析】
由G为黑色非金属单质,可判断反应(3)为Mg在点燃的条件下与CO2的反应,因此D、G分别为CO2和单质碳。E与单质碳反应生成CO2,则E为氧气,由F具有磁性知F为Fe3O4,进而推知B为Fe,结合(1)中信息知A为FeO,(4)中C若为一种气体,应为CO,根据上述推断可以知道反应A(s)+C(g)⇌B(s)+D(g) ΔH=akJ·mol-1(a>0)就是FeO(s)+CO(g)⇌Fe(s)+CO2(g) ΔH=akJ·mol-1(a>0),A为固体FeO,加入该物质对平衡的移动没有影响,不会提高CO的转化率;上述反应是一个反应前后气体分子数不变的反应,因此容器内压强自始至终是一个恒量,故压强不变不能作为达到化学平衡状态的判断标准;若c(CO)=0.100 mol·L-1,根据c(CO2)=K×c(CO)计算c(CO2)。
若c(CO)=0.100mol/L,因为c(CO2)=K×c(CO),故c(CO2)=0.263×0.1mol/L=0.0263mol/L,
因此,本题正确答案是;等于;不变;不一定达到;0.0263。
6.
将3.9g的镁铝合金粉末放于过量的盐酸中,产生的气体体积在标况下是4.48L。请计算:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学镁及其化合物的专项培优易错试卷练习题含答案(1)一、镁及其化合物1.探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:请回答:(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
【答案】Mg2SiO4或 2MgO·SiO2 SiO2+2OH-=SiO32-+H2O 优良的阻燃剂等【解析】【详解】无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状物沉淀和无色溶液,白色胶状沉淀为硅酸,白色沉淀充分灼烧得到白色粉末1.80g为SiO2,物质的量=1.8g÷60g/mol=0.03mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐中含硅酸根离子或原硅酸根离子,物质的量为0.03mol,若为硅酸根离子其质量=0.03mol×76g/mol=2.28g,金属质量=4.20g-2.28g=1.92g,无色溶液中加入过量氢氧化钠溶液生成白色沉淀则判断为Mg(OH)2,金属离子物质的量=0.06mol,质量为0.06mol×24g/mol=1.44g,不符合,则为原硅酸根,物质的量为0.03mol,质量=0.03mol×92g/mol=2.76g,金属质量4.20g-2.76g=1.44g,物质的量=1.44g÷24g/mol =0.06mol,得到X为Mg2SiO4。
(1)X的化学式为,Mg2SiO4;(2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO2+2OH-=SiO32-+H2O;(3)氢氧化镁是优良的阻燃剂。
2.下图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白:(1)A的化学式____________;(2)写出反应①②的化学方程式:①_____________,②___________;(3)写出反应③的离子方程式:_______________________;(4)在反应④中,当生成标准状况下2.24 L G时,转移电子数为________ mol。
【答案】NH4HCO3 2Mg+CO22MgO+C; 4NH3+5O24NO+6H2O NH4++HCO3-+2OH-NH3↑+C O2 ↑+2H2O 0.2【解析】【分析】A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,据此分析解答。
【详解】(1)通过以上分析知,A是NH4HCO3,故答案为NH4HCO3;(2)反应①为镁在二氧化碳中燃烧生成氧化镁和碳,反应方程式为:2Mg+CO22MgO+C;反应②在催化剂、加热条件下,氨气被氧化生成一氧化氮和水,反应方程式为:4NH3+5O24NO+6H2O,故答案为2Mg+CO22MgO+C;4NH3+5O2 4NO+6H2O;(3)反应③为在加热条件下,碳酸氢铵和氢氧化钠反应生成氨气、二氧化碳和水,离子方程式为:NH4++HCO3-+2OH-NH3↑+CO2 ↑+2H2O,故答案为NH4++HCO3-+2OH-NH3↑+CO2 ↑+2H2O;(4)反应④为水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下2.24L 氧气时转移电子的物质的量=2.24L22.4L/mol×2×(1−0)=0.2mol,故答案为0.2。
3.已知A、B、C、D组成的元素都属于短周期,它们之间的简单转化关系如图所示。
请按要求写出有关反应的化学方程式:(1)若其中A、D为单质且同主族,B、C为氧化物: (该反应在工业上有重要用途) 。
(2)若A、D为常态下的气体单质且不同主族,B、C为化合物且B为水:。
(3)若A、B、C均为化合物且C为水,单质D常态下为固体:。
(4) 若A、D为固体单质且不同主族,B、C为氧化物:。
【答案】(共8分)(1) 2C+SiO2Si+2CO↑(2)2F2+2H2O===4HF+O2(3)SO2+2H2S===3S+2H2O(4) 2Mg+CO22MgO+C。
【解析】【分析】(1)A、D为单质且同主族,B、C为氧化物,A为C,B为SiO2,符合转化关系,D为Si,C为CO;(2)A、D为常态下的气体单质且不同主族,B、C为化合物且B为水,A为F2,C为HF,D 为O2,符合转化关系;(3)A、B、C均为化合物且C为水,单质D常态下为固体,H2S与SO2反应符合转化关系,D为硫;(4)A、D为固体单质且不同主族,B、C为氧化物,Mg与CO2反应符合转化关系,A为Mg,B为CO2,C为MgO,D为C单质。
【详解】(1)A、D为单质且同主族,B、C为氧化物,A为C,B为SiO2,符合转化关系,反应方程式为:2C+SiO2Si+2CO↑;综上所述,本题正确答案:2C+SiO2Si+2CO↑;(2)A、D为常态下的气体单质且不同主族,B、C为化合物且B为水,A为F2,C为HF,D 为O2,符合转化关系,反应方程式为:2F2+2H2O═4HF+O2;综上所述,本题正确答案:2F2+2H2O═4HF+O2;(3)A、B、C均为化合物且C为水,单质D常态下为固体,H2S与SO2反应符合转化关系,反应方程式为:SO2+2H2S═3S+2H2O;综上所述,本题正确答案:SO2+2H2S═3S+2H2O;(4)A、D为固体单质且不同主族,B、C为氧化物,Mg与CO2反应符合转化关系,反应方程式为:2Mg+CO22MgO+C;综上所述,本题正确答案: 2Mg+CO22MgO+C。
4.X、Y、Z三种物质有如下转化关系:(1)根据上述转化关系,写出下列物质的化学式:X_____、Y_____、Z___试剂甲_____,试剂乙________(2)写出上述③④⑤步反应的离子方程式:_____________;___________;___________【答案】MgSO4Mg(OH)MgCl2BaCl2AgNO3Mg(OH)2+2H+=Mg2++2H2O Ag++Cl−=AgCl↓Ba2++SO42−=BaSO4↓【解析】【分析】【详解】(1)X和硝酸钡反应生成硝酸镁,则X应为MgSO4,加入NaOH反应生成Mg(OH)2,与盐酸反应生成MgCl2,则Y为Mg(OH)2,Z为MgCl2,MgSO4可与BaCl2反应生成MgCl2,则甲为BaCl2,MgCl2与AgNO3反应生成硝酸镁,则乙为AgNO3,故答案为MgSO4;Mg(OH)2;MgCl2;BaCl2;AgNO3;(2)③为Mg(OH)2和盐酸的反应,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,④为MgCl2和AgNO3的反应,反应的离子方程式为Ag++Cl−=AgCl↓,⑤为MgSO4和BaCl2的反应,反应的离子方程式为Ba2++SO42−=BaSO4↓,故答案为③Mg(OH)2+2H+=Mg2++2H2O、④Ag++Cl−=AgCl↓、⑤Ba2++SO42−=BaSO4↓。
5.在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下C.铁单质与水蒸气反应的化学方程式为2Fe+3H2O(g)=Fe2O3+3H2(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:①A点的沉淀物的化学式为________;B点的沉淀物的化学式为________________________;写出A→B 段发生反应的离子方程式_____________________________。
②原混合物中MgCl 2的质量是________g ,AlCl 3的质量是________g ,NaOH 的质量是________g 。
③Q 点HCl 溶液加入量是________mL 。
【答案】A Mg(OH)2 Mg(OH)2和Al(OH)3 AlO 2-+H ++H 2O=Al(OH)3↓ 1.90 2.67 5.20 130【解析】【分析】把NaOH 、MgCl 2、AlCl 3三种固体组成的混合物溶于足量水后有1.16 g 白色沉淀,在所得的浊液中逐滴加入1 mol·L -1 HCl 溶液,前10毫升盐酸反应时沉淀量不变,说明盐酸和氢氧化钠反应,则白色沉淀为氢氧化镁沉淀,再加入盐酸产生沉淀,是偏铝酸钠和盐酸反应生成氢氧化铝沉淀,再加入盐酸,氢氧化镁和氢氧化铝沉淀全部溶解。
据此解答。
【详解】(1) A.金属钠非常活泼,容易和水或氧气反应,在实验室中保存在石蜡油或煤油中,故正确;B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,外面有氧化铝薄膜包着,不会滴下,故错误;C.铁单质与水蒸气反应的化学方程式为2Fe+4H 2O(g)Fe 3O 4+4H 2,故错误。
故选A ;(2) ①先加入的盐酸和氢氧化钠反应,说明白色沉淀为 Mg(OH)2,再加入盐酸,又产生了氢氧化铝沉淀,所以B 点为 Mg(OH)2和Al(OH)3 ;A 到B 的离子方程式为:AlO 2-+H ++H 2O=Al(OH)3↓;②氢氧化镁沉淀的质量为1.16克,即0.02mol 氢氧化镁,则对应的氯化镁的物质的量为0.02mol ,质量为0.02mol×95g/mol= 1.90g , 根据AlO 2-+H ++H 2O=Al(OH)3↓分析,反应消耗的盐酸的物质的量为1mol/L ×(30-10)×10-3L=0.02mol ,则氯化铝的物质的量为0.002mol 质量为0.02mol ×133.5g/mol= 2.67g ,氢氧化钠的物质的量为0.02×2+0.02×4+1×0.01=0.13mol ,则质量为0.13 mol ×40 g/mol = 5.20g ;③Q 点HCl 溶液可以看成就是将原来的氢氧化钠反应生成氯化钠,故根据0.13mol 氢氧化钠计算,盐酸的物质的量为0.13mol ,体积为0.13mol0.131.0/L mol L =130mL 。
