贵州专版九年级化学下册第九单元溶液专题训练三溶解和溶质的质量分数习题课件新版新人教版
合集下载
九年级化学下册 第九单元课题3溶质的质量分数第二课时课件 人教新课标版 (共12张PPT)

胶头滴管、烧杯、玻璃棒
练习:下面是一位同学配制一定溶质质量分数 的氯化钠溶液时的流程图,请找出其中的错误, 并说明理由。
1、 2、 3、 4、
课题3 溶质的质量分数
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、计算公式:
溶质质量
溶质的质量分数
100%
溶液质量
溶质质量
溶质质量+溶剂质量 t℃时,某物质的溶解度为Sg,则t℃,该物质饱和溶液中
方法一:向原溶液中增加溶质
定律:
增加溶质前溶剂的质量=增加溶质后溶剂的质量
方法二:将原溶液蒸发掉部分溶剂
定律:
蒸发溶剂前溶质的质量=蒸发溶剂后溶质的质量
有40g溶质质量分数为5%的氯化钠溶液,若 将其溶质的质量分数增大到10%,可以采取 的方法是?
解:方法一 增加溶质
设应加入氯化钠固体的质量为x
40gX(1—5%)= (40g+x)X(1—10%) 解得 X=2.22g
方法二 蒸发水分
设应蒸发掉水的质量为y 40gX5%= (40g—y)X10%
解得 y=20g
答:加入2.22g氯化钠,或蒸发掉20g水。
三.溶质质量分数在化学方程式中应
1用、50g盐酸5与锌完全反应,得 0.2g氢气,求盐酸的溶质的质 量分数?
2、某盐酸溶液100g,与13g含杂 质5%的锌完全反应,这种盐 酸的溶质质量分数是多少?
配置步骤1、计算 2、称量 3、溶解4、装
例瓶1: (溶质为固体)配制150g16%的食盐水
计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g
称量:用天平称量 24 g食盐 用量筒量取126mL水
练习:下面是一位同学配制一定溶质质量分数 的氯化钠溶液时的流程图,请找出其中的错误, 并说明理由。
1、 2、 3、 4、
课题3 溶质的质量分数
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、计算公式:
溶质质量
溶质的质量分数
100%
溶液质量
溶质质量
溶质质量+溶剂质量 t℃时,某物质的溶解度为Sg,则t℃,该物质饱和溶液中
方法一:向原溶液中增加溶质
定律:
增加溶质前溶剂的质量=增加溶质后溶剂的质量
方法二:将原溶液蒸发掉部分溶剂
定律:
蒸发溶剂前溶质的质量=蒸发溶剂后溶质的质量
有40g溶质质量分数为5%的氯化钠溶液,若 将其溶质的质量分数增大到10%,可以采取 的方法是?
解:方法一 增加溶质
设应加入氯化钠固体的质量为x
40gX(1—5%)= (40g+x)X(1—10%) 解得 X=2.22g
方法二 蒸发水分
设应蒸发掉水的质量为y 40gX5%= (40g—y)X10%
解得 y=20g
答:加入2.22g氯化钠,或蒸发掉20g水。
三.溶质质量分数在化学方程式中应
1用、50g盐酸5与锌完全反应,得 0.2g氢气,求盐酸的溶质的质 量分数?
2、某盐酸溶液100g,与13g含杂 质5%的锌完全反应,这种盐 酸的溶质质量分数是多少?
配置步骤1、计算 2、称量 3、溶解4、装
例瓶1: (溶质为固体)配制150g16%的食盐水
计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g
称量:用天平称量 24 g食盐 用量筒量取126mL水
九年级化学(人教)下册:第9单元 课题3 溶质的质量分数(共24张PPT)

分析:溶解度即为“溶解的限度”,50克水 若溶不下20克NaCl,则溶液中NaCl的质量分数 即为饱和溶液的浓度 36 /(g = 36g x
x = 18g < 20g
则:溶质在溶液中的质量分数为:
18g 36g 或 50g+18g 100g+36g
×100% ≈ 26.5%
10% 20%
例1在农业生产中,常需要用质量分数为16% 的氯化钠溶液来选种。现要配制150Kg这种溶 液,需要氯化钠和水的质量各是多少?
解: 溶质的质量分数
溶质质量
溶剂质量
溶质质量 100% 溶液质量 溶液质量 溶质的质量分数 150Kg 16% 24Kg 溶液质量 溶质质量 150Kg 24Kg 126Kg
浓溶液和稀溶液
判断依据: 一定量溶液里,所含溶质的多少
思考:溶液的浓稀 和 溶液的饱和与否的关系
区分依据不同
☆同一温度时,同一 溶质的饱和溶液肯定 比不饱和溶液浓
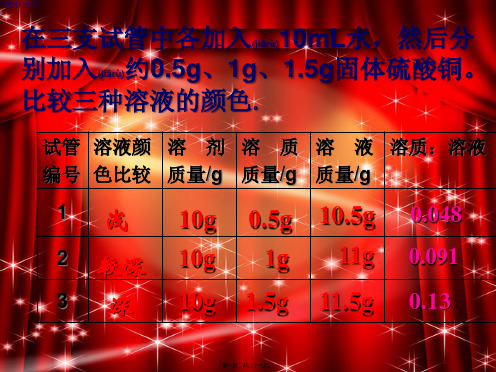
实验9-5
药品:水10mL 硫酸铜 仪器:试管 滴管
学.科.网zxxk.组卷网
颜色:
淡蓝
蓝色
深蓝
在三支试管中各加入10mL水,然后分 别加入约0.5g、1g、1.5g固体硫酸铜。 比较三种溶液的颜色。
实验步骤: 实验仪器: ⑴计算 ⑵称量 ⑶溶解 ⑷装瓶 药匙 天平 烧杯 量筒 滴管 玻璃棒
练习 配制500mL质量分数为10%的 氢氧化钠溶液(密度为1.1g/cm3),需 要氢氧化钠和水各多少克?
讨论: 在温度不变的条件 下,如何使原有溶液的溶 质质量分数增大或减小?
例1、把50g质量分数为98%的浓硫酸 稀释成质量分数为20%的稀硫酸,需 要加水多少克?
解:设加水的质量为x。 50g×98% =(50g + x)×20% x = 195g
九年级化学下册 第九单元《溶质的质量分数》课件
[例题3]: 32.5克锌与280克稀硫酸恰好完全反应(fǎnyìng), 求: (1) 生成氢气多少克? (2) 所用硫酸溶液中溶质质量分数是多少? *(3) 生成物溶液中溶质质量分数是多少?
用“挖水法”和“整体(zhěngtǐ)法”求生成物溶液 的质量
第二十五页,共三十六页。
62021/12/3
用量筒量取所需的水的体积,倒入盛有NaCl 的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
第十页,共三十六页。
2021/12/3
用固体配制一定(yīdìng)溶质质量分数的溶液
主要(zhǔyào)仪器托:盘(tuōpán)天平、烧杯、量筒、玻璃棒
解:设需要98%硫酸(liú suān)的体积为V
V1.84g/mL 98% = 98g 10%
98g10%
V=
5.4mL
1.84g/mL98%
答:需98%硫酸(liú suān)5.4mL
第十九页,共三十六页。
02021/12/3
小试牛刀 : (xiǎo shì niú dāo)
1、配制100mL密度(mìdù)为1.1g/mL的20%的NaCl溶液 需要多少克NaCl和多少mL水?
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?
解:所需氯化钠的质量(zhìliàng)为:
150kg 16% = 24kg
需要(xūyào)水的质量为:150kg - 24kg = 126kg
答:配150kg质量分数为16%的氯化钠溶液 需24kg 氯化钠和126kg水
用“挖水法”和“整体(zhěngtǐ)法”求生成物溶液 的质量
第二十五页,共三十六页。
62021/12/3
用量筒量取所需的水的体积,倒入盛有NaCl 的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
第十页,共三十六页。
2021/12/3
用固体配制一定(yīdìng)溶质质量分数的溶液
主要(zhǔyào)仪器托:盘(tuōpán)天平、烧杯、量筒、玻璃棒
解:设需要98%硫酸(liú suān)的体积为V
V1.84g/mL 98% = 98g 10%
98g10%
V=
5.4mL
1.84g/mL98%
答:需98%硫酸(liú suān)5.4mL
第十九页,共三十六页。
02021/12/3
小试牛刀 : (xiǎo shì niú dāo)
1、配制100mL密度(mìdù)为1.1g/mL的20%的NaCl溶液 需要多少克NaCl和多少mL水?
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?
解:所需氯化钠的质量(zhìliàng)为:
150kg 16% = 24kg
需要(xūyào)水的质量为:150kg - 24kg = 126kg
答:配150kg质量分数为16%的氯化钠溶液 需24kg 氯化钠和126kg水
九年级化学下册 第9单元 课题3 溶质的质量分数课件1

溶质(róngzhì)的质量分数复习
12/11/2021
第一页,共二十七页。
小明看中考说明
溶质的质量 分数 (zhìliàng)
1)说明溶液中溶质质量(zhìliàng)分数的意义 b
2)应用公式:溶质的质量分数=(溶质质量/溶液质
c 量)×100%进行简单(jiǎndān)计算
3)按要示配制一定溶质质量分数的溶液,说明有
答错了,再来一次
答对(dáduì)了,你真棒,点此做下一题
A. ①②③④
B. ⑤②④①
C. ①③⑤②④①
12/11/2021
第十六页,共二十七页。
D. ①③⑥⑤②④①
粗心(cūxīn)的小明
练习(liànxí):下面是小明配制一定溶质质量分数的氯 化钠溶液时的流程图,请找出其中的错误,并说明 理由。
关配制方案、一般步骤和方法 c
12/11/2021
第二页,共二十七页。
小明在思考
材料一、小明在喝茶时,发现茶冲了几次之后, 发现茶水(cháshuǐ)的颜色变淡了,他猜测可能是茶中某
种物质是不是少了……
材料二、于是小明就通过硫酸铜溶液浓度与颜色 的比较的实验,得出是否会是一样(yīyàng)的结论呢?
3、配制溶质质量分数(fēnshù)一定的溶液
100%
实验步骤: ⑴计算 ⑵称量(chēnɡ liànɡ) ⑶溶解
实验仪器: 药匙 天平 烧杯(shāobēi) 量筒 滴管 玻璃棒
12/11/2021
第十九页,共二十七页。
小明(xiǎo mínɡ)在努力
12/11/2021
第二十页,共二十七页。
·人教版
12/11/2021
请看实验 视频 (shíyàn)
12/11/2021
第一页,共二十七页。
小明看中考说明
溶质的质量 分数 (zhìliàng)
1)说明溶液中溶质质量(zhìliàng)分数的意义 b
2)应用公式:溶质的质量分数=(溶质质量/溶液质
c 量)×100%进行简单(jiǎndān)计算
3)按要示配制一定溶质质量分数的溶液,说明有
答错了,再来一次
答对(dáduì)了,你真棒,点此做下一题
A. ①②③④
B. ⑤②④①
C. ①③⑤②④①
12/11/2021
第十六页,共二十七页。
D. ①③⑥⑤②④①
粗心(cūxīn)的小明
练习(liànxí):下面是小明配制一定溶质质量分数的氯 化钠溶液时的流程图,请找出其中的错误,并说明 理由。
关配制方案、一般步骤和方法 c
12/11/2021
第二页,共二十七页。
小明在思考
材料一、小明在喝茶时,发现茶冲了几次之后, 发现茶水(cháshuǐ)的颜色变淡了,他猜测可能是茶中某
种物质是不是少了……
材料二、于是小明就通过硫酸铜溶液浓度与颜色 的比较的实验,得出是否会是一样(yīyàng)的结论呢?
3、配制溶质质量分数(fēnshù)一定的溶液
100%
实验步骤: ⑴计算 ⑵称量(chēnɡ liànɡ) ⑶溶解
实验仪器: 药匙 天平 烧杯(shāobēi) 量筒 滴管 玻璃棒
12/11/2021
第十九页,共二十七页。
小明(xiǎo mínɡ)在努力
12/11/2021
第二十页,共二十七页。
·人教版
12/11/2021
请看实验 视频 (shíyàn)
九年级化学下册 第九单元 溶液 课题3 溶质的质量分数课件

表示方法 溶解度曲线 表示意义:①同一种物质在不同温度时的 溶解度;②不同物质在同一温度时的溶 解度; ③物质的溶解度受温度的影响;④两种物 质溶解度曲线相交表示对应温度下的溶 解度相等。
12/11/2021
第二页,共十五页。
气体物质的溶解度 在压强为101Kpa和一定温度
时。气体溶解在1体积水 里达到饱和状态时的气体 体积。 ①指明压强;②指明温度; ③指明饱和状态;④无单位 ① 温度:随温度升高而降低 ② 压强:随压强增大而增大
H2SO4多少毫升?(P20%H2SO4=1.14g/ml; P98%H2SO4=1.84g/ml)
12/11/2021
第七页,共十五页。
【练习】加水:①在225g 20%的KNO3溶液中加入225g 水后,求溶液中溶质的质量(zhìliàng)分数?
12/11/2021
第八页,共十五页。
【练习】蒸发水:②把200g 20%的KNO3溶液蒸发掉100g水后,溶
12/11/2021
第四页,共十五页。
2.溶液稀释及浓缩的计算:
计算依据:稀释前后(qiánhòu)溶质质量保持不变。
如:m1:稀释前溶液质量
A1%稀释前溶质质量分数
m2:稀释后溶液的质量
A2%稀释后溶质质量分数
则: m1 × A1% = m2 ×A2% m1 × A1% = m m ( 1+ H2O) ×A2%
液中溶质(róngzhì)质量分数?(假设KNO3晶体不析出)
12/11/2021
第九页,共十五页。
【练习】加溶质:③在225g 20%的KNO3溶液中加入75g
KNO3固体完全(wánquán)溶解,求溶液中溶质的质量分数?
12/11/2021
