M7(R1)评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险_中文翻译公开征求意见稿
M7(R1): 评估和控制药物中 DNA 反应性(致突变)杂质以限制潜在的致癌风险(中文版:征求意见稿)

上述准许不适用于由第三方提供的内容。因此,对于版权归属第三方的文件,必须征得版权所有人 的翻印许可。
行业指南 评估和控制药物中 DNA 反应性( 致突变)杂质以限制潜在的致癌风险
人用药品注册技术要求国际协调会议 (ICH) ICH 协调指南
M7 评估和控制药物中 DNA 反应性(致突变)杂质以限制潜在的致癌风险 (中文版:征求意见稿)
当前版本为第 4 步版本 日期 2017 年 3 月 31 日
根据 ICH 进程,本指南由人用药物注册技术要求国际协调会(ICH)的专家组制定,并已提交给各 监管当局征询意见。在 ICH 进程的第 4 阶段,最后的草案被推荐给 ICH 辖区的监管机构采纳。
日期 2013 年 2 月 6 日 2014 年 6 月 5 日
2014 年 6 月 23 日
2015 年 6 月 11 日
M7(R1) 附录
获得 ICH 大会监管成员采纳并推荐 ICH 监管机构 采纳。
2017 年 5 月 31 日
法律通告:该文件受到版权保护,可以持公共许可证使用、翻印、合并至其他著作中、改编、修正、 翻译或传播,前提是文件中的 ICH 版权在任何时候均被承认。如果对文件进行改编、修正或翻译, 必须采取合理措施来明确标明、区分或确认所作的变更或所依据的原始文件。应避免留下“原始文 件更改、修正或翻译已经获得 ICH 背书或资助”的印象。
编码 M7 M7
M7
M7(R1) 附录
M7(R1)
文件历史
历史 在第 2 步中获得执行委员会批准,并且发布供公众参考。 在第 4 步中获得执行委员会批准,并且发布供公众参考,并且
ICH M7step4基因毒性杂质评估和控制◆中英

请联系网站删除只供学习与交流资料收集于网络,如有侵权IMPURITIESCONTROL OF DNA REACTIVE(MUTAGENIC) ASSESSMENT ANDPOTENTIAL RISKCARCINOGENIC IN PHARMACEUTICALS TOLIMITDNA为限制潜在致癌风险而对药物中活性(诱变性)杂质进行的评估和控制 M7Step 4 version Currentdated 23 June 2014This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union, Japan and USA.只供学习与交流.资料收集于网络,如有侵权请联系网站删除只供学习与交流M7Document History 文件历史阶段Current Step 4 version 现行版本第4reproduced, be used, copyright is protected by and may document Notice: Legal This incorporated into other works, adapted, modified, translated or distributed under a public license provided that ICH's copyright in the document is acknowledged at all times. In case of any adaption, modification or translation of the document, reasonable steps must be taken to clearly label, demarcate or otherwise identify that changes were made to or based on the original document. Any impression thatthe adaption, modification or translation of the original document is endorsed or sponsored by the ICH must be avoided.只供学习与交流.请联系网站删除只供学习与交流资料收集于网络,如有侵权The document is provided as is without warranty of any kind. In no event shallthe ICH or the authors of the original document be liable for any claim, damagesor other liability arising from the use of the document.parties. third content supplied by apply above-mentioned The permissions do not to for party, permission third in copyright where for Therefore, documents the vests a reproduction must be obtained from this copyright holder.只供学习与交流.请联系网站删除只供学习与交流资料收集于网络,如有侵权IMPURITIES(MUTAGENIC) OF DNA REACTIVE ASSESSMENT AND CONTROLRISKLIMIT IN PHARMACEUTICALS TO POTENTIALCARCINOGENIC活性(诱变性)杂质进行的评估和控制为限制潜在致癌风险而对药物中DNA ICH Harmonised Tripartite Guideline 三方协调指南ICH Step 4 of the ICH Process at the ICH Steering Committee meeting Having reachedregulatory three on 5 June 2014, this Guideline is recommended for adoption to the parties to ICH资料收集于网络,如有侵权请联系网站删除只供学习与交流只供学习与交流.资料收集于网络,如有侵权请联系网站删除只供学习与交流IMPURITIESDNA REACTIVE (MUTAGENIC) ASSESSMENT AND CONTROL OFRISKPHARMACEUTICALS TO LIMIT POTENTIALCARCINOGENIC IN活性(诱变性)杂质进行的评估和控制为限制潜在致癌风险而对药物中DNA概述1. INTRODUCTIONreagents, chemicals, of reactive drug substances involves the use of The synthesis solvents, catalysts, and other processing aids. As a result of chemical synthesis associated and drug substances degradation, impurities reside in all or subsequent drug products. While ICH Q3A(R2): Impurities in New Drug Substances and Q3B(R2): and for qualification guidance (Ref. 1, 2) provides Impurities in New Drug Products those provided for impurities, limited guidance is control for the majority of the impurities that are DNA reactive. The purpose of this guideline is to provide a categorization, the identification, is applicable to practical framework that potential limit mutagenic these impurities to qualification, and control of carcinogenic risk. This guideline is intended to complement ICH Q3A(R2), Q3B(R2) (Note 1), and ICH M3(R2): Nonclinical Safety Studies for the Conduct of HumanClinical Trials and Marketing Authorizations for Pharmaceuticals (Ref. 3).导致在所有原催化剂和其它工艺助剂,原料药合成牵涉到使用活性化学物质、试剂、溶剂、新原料药中的杂质Q3A(R2)料药及其制剂中会残留有化学合成或其降解产物、杂质。
29个ICH三级指导原则转化实施建议
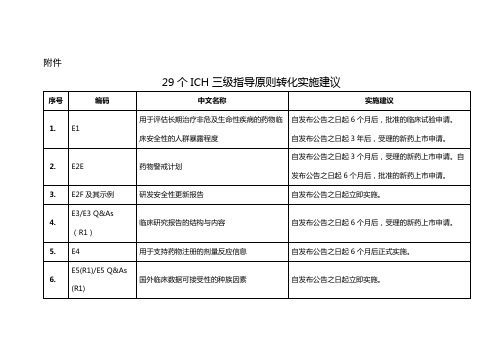
E2F及其示例
研发安全性更新报告
自发布公告之日起立即实施。
4.
E3/E3 Q&As(R1)
临床研究报告的结构与内容
自发布公告之日起6个月后,受理的新药上市申请。
5.
E4
用于支持药物注册的剂量反应信息
自发布公告之日起6个月后正式实施。
6.
E5(R1)/E5 Q&As (R1)
国外临床数据可接受性的种族因素
自发布公告之日起6个月后正式实施。
14.
E16
与药物或生物制品研发相关的生物标志物:资质提交材料的背景、结构以及格式
自发布公告之日起6个月后正式实施。
15.
E17
多区域临床试验计划与设计的总体原则
自发布公告之日起立即实施。
16.
S1A
药物致癌性试验必要性指导原则
申请人需在现行技术要求基础上尽早按照ICH指导原则开展研究;自发布公告之日起,6个月后开始的非临床研究按照ICH指导原则执行。
附件
29个ICH三级指导原则转化实施建议
序号
编码
中文名称
实施建议
1.
E1
用于评估长期治疗非危及生命性疾病的药物临床安全性的人群暴露程度
自发布公告之日起6个月后,批准的临床试验申请。
自发布公告之日起3年后,受理的新药上市申请。
2.
E2E
药物警戒计划
自发布公告之日起3个月后,受理的新药上市申请。自发布公告之日起6个月后,批准的新药上市申请。
S10
药物光安全评价
29.
M7(R1)
评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险
申请人需在现行技术要求基础上尽早按照ICH指导原则开展研究;自发布公告之日起,6个月后开始的研究,以试验记录时间点为准,按照ICH指导原则执行。
20200110 化学药物中亚硝胺类杂质研究技术指导原则(征求意见稿)

附件化学药物中亚硝胺类杂质研究技术指导原则(征求意见稿)一、概述自2018年7月在缬沙坦原料药中检出N-亚硝基二甲胺(NDMA)起,陆续在其它沙坦类原料药中检出了各类亚硝胺杂质,如NDMA、N-亚硝基二乙胺(NDEA)等。
进一步的调查发现,在个别供应商的非沙坦类的药物中(如雷尼替丁),亦有亚硝胺类杂质的检出。
亚硝胺类杂质属于ICH M7(R1)(《评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》)指南【1】中提及的“关注队列”物质;其中根据世界卫生组织公布的致癌物清单【2】,NDMA和NDEA均属于2A类致癌物质;根据CPDB(Carcinogenicity Potency Database)数据库,已有部分亚硝胺类杂质有公开的致癌性数据,如NDMA、NDEA、N-亚硝基-N-甲基-4-氨基丁酸(NMBA)、N-亚硝基二丁胺(NDBA)等。
为了保证药品的安全和质量可控,实现有效的风险控制,特制定本技术指导原则,旨在为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供指导。
申请人应切实履行药品质量管理的主体责任,对药品的安全和质量进行全生命周期管理,尽可能的避免亚硝胺类杂质的引入,若确不能完全避免的,应充分评估药品中亚硝胺类杂质的风险,并将亚硝胺类杂质控制在安全限度以下。
二、亚硝胺类杂质产生的原因根据目前所知,亚硝胺类杂质有多种产生原因【3】,如工艺产生、降解途径和污染引入等。
具体来讲,亚硝胺类杂质可能通过以下途径引入【4】:(一)由工艺引入亚硝胺类杂质的风险目前所知,NDMA、NDEA杂质可能通过亚硝化机理生成。
即在一定条件下,胺类化合物尤其是仲胺,与亚硝酸钠(NaNO2)或其它亚硝化试剂反应产生亚硝胺类杂质。
在同一工艺步骤中使用了能引入仲胺和亚硝酸盐类的物料(包括起始物料、溶剂、试剂、催化剂、中间体等),有较高的风险引入亚硝胺类杂质;即使在不同的工艺步骤中分别使用能引入仲胺和亚硝酸盐类的物料,也可能会产生亚硝胺类杂质。
化学药物中亚硝胺类杂质研究技术指导原则(试行)2020版

化学药物中亚硝胺类杂质研究技术指导原则(试行)一、概述自2018年7月在缬沙坦原料药中检出N-亚硝基二甲胺(NDMA)以来,陆续在其他沙坦类原料药中检出了各类亚硝胺杂质,如NDMA、N-亚硝基二乙胺(NDEA)等。
进一步的调查发现,在个别供应商的非沙坦类的药物中(如雷尼替丁),亦有亚硝胺类杂质的检出。
亚硝胺类杂质属于ICH M7(R1)(《评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》)指南【1】中提及的“关注队列”物质。
根据世界卫生组织公布的致癌物清单【2】,NDMA和NDEA 均属于2A类致癌物质;根据国际认可数据库,已有部分亚硝胺类杂质有公开的致癌性数据,如NDMA、NDEA、N-亚硝基-N-甲基-4-氨基丁酸(NMBA)、N-亚硝基二丁胺(NDBA)等。
为了保证药品的安全和质量可控,实现有效的风险控制,特制定本技术指导原则,旨在为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供指导。
药品上市许可持有人/药品生产企业应切实履行药品质量管理的主体责任,对药品的安全和质量进行全生命周期管理,尽可能的避免亚硝胺类杂质的引入,若确不能完全避免的,应充分评估药品中亚硝胺类杂质的风险,并将亚硝胺类杂质水平控制在安全限度以下。
二、亚硝胺类杂质产生的原因根据目前所知,亚硝胺类杂质有多种产生原因【3】,如工艺产生、降解途径和污染引入等。
具体来讲,亚硝胺类杂质可能通过以下途径引入【4】:(一)由工艺引入亚硝胺类杂质的风险目前所知,NDMA、NDEA杂质可能通过亚硝化机理生成。
即在一定条件下,胺类化合物尤其是仲胺,与亚硝酸钠(NaNO2)或其他亚硝化试剂反应产生亚硝胺类杂质。
在同一工艺步骤中使用了能引入仲胺和亚硝化试剂的物料(包括起始物料、溶剂、试剂、催化剂、中间体等),有较高的风险引入亚硝胺类杂质;即使在不同的工艺步骤中分别使用能引入仲胺和亚硝化试剂的物料,也可能会产生亚硝胺类杂质。
化学药物中亚硝胺类杂质研究技术指导原则(试行)

化学药物中亚硝胺类杂质研究技术指导原则(试行)一、概述自2018年7月在缬沙坦原料药中检出N-亚硝基二甲胺(NDMA)以来,陆续在其他沙坦类原料药中检出了各类亚硝胺杂质,如NDMA、N-亚硝基二乙胺(NDEA)等。
进一步的调查发现,在个别供应商的非沙坦类的药物中(如雷尼替丁),亦有亚硝胺类杂质的检出。
亚硝胺类杂质属于ICH M7(R1)(《评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》)指南【1】中提及的“关注队列”物质。
根据世界卫生组织公布的致癌物清单【2】,NDMA和NDEA均属于2A类致癌物质;根据国际认可数据库,已有部分亚硝胺类杂质有公开的致癌性数据,如NDMA、NDEA、N-亚硝基-N-甲基-4-氨基丁酸(NMBA)、N-亚硝基二丁胺(NDBA)等。
为了保证药品的安全和质量可控,实现有效的风险控制,特制定本技术指导原则,旨在为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供指导。
药品上市许可持有人/药品生产企业应切实履行药品质量管理的主体责任,对药品的安全和质量进行全生命周期管理,尽可能的避免亚硝胺类杂质的引入,若确不能完全避免的,应充分评估药品中亚硝胺类杂质的风险,并将亚硝胺类杂质水平控制在安全限度以下。
二、亚硝胺类杂质产生的原因根据目前所知,亚硝胺类杂质有多种产生原因【3】,如工艺产生、降解途径和污染引入等。
具体来讲,亚硝胺类杂质可能通过以下途径引入【4】:(一)由工艺引入亚硝胺类杂质的风险目前所知,NDMA、NDEA杂质可能通过亚硝化机理生成。
即在一定条件下,胺类化合物尤其是仲胺,与亚硝酸钠(NaNO2)或其他亚硝化试剂反应产生亚硝胺类杂质。
在同一工艺步骤中使用了能引入仲胺和亚硝化试剂的物料(包括起始物料、溶剂、试剂、催化剂、中间体等),有较高的风险引入亚硝胺类杂质;即使在不同的工艺步骤中分别使用能引入仲胺和亚硝化试剂的物料,也可能会产生亚硝胺类杂质。
基因杂质的评估和控制 ICH M7

(细菌诱变呈阳性*,无啮齿动物 TTC)
rodents》。或进入 The Carcinogenic Potency
致癌数据
Database (CPDB),里面有 1547 种致癌物质的列
3
警示结构,与原料药结构无关,无 控制不高于可接受限度(适当的
诱变数据
TTC)或检测细菌诱变含量:
表,结构式,CAS 号,作用部位,TTC 值等一系
基因杂质的评估和控制 ICH M7
1 概述
1 概述
ICH Q3A(R2) 新原料药中的杂质 ICH Q3B(R2) 新制剂中的杂质
关于主要杂质定性和控制的指南
ICH M3(R2) 药物人用临床试验和上市许可中的非临床安全性研究
EMA《遗传毒性杂质限度指导原则》
ICH M7 为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制 目的:提供使用框架,以应用于这些诱变杂质的鉴别、分类、定性和控制,对潜在致癌风险进行了控制。 强调:在建立诱变性杂质水平时考虑安全性和质量风险管理两方面 人用条件下,给出对原料药或制剂中残留或可能残留的诱变性杂质评估和控制的建议
➢ 如果有足够后续试验,可由单独的体外试验结果,可以对它的体内关联性进行评估。
➢ 若缺乏这些信息时,体外基因毒性物质经常被考虑为假定的体内诱变剂和致癌剂。
----摘自EMA《毒性杂质限度
指南》
✓ 为何重点研究基因毒性杂质? 基毒杂质特点:很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤发生。
补充
1 概述
✓ 何为基因毒性杂质、诱变杂质(Genotoxic Impurities,Mutagenic Impurities)?
基因毒性杂质(或遗传毒性杂质,Genotoxic Impurity ,GTI)是指化合物本身直接或间接损伤细胞DNA,产生基因突变或体内
ich指导原则m7

ich指导原则m7
ICH M7全称为“Assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk”,其关注的对象是在较低水平时也有可能直接引起DNA损伤,导致DNA突变,可能引发癌症的DNA反应性物质,即致突变杂质。
该指导原则为基毒杂质的鉴别、分类、界定和控制提供了实用框架。
在ICH M7正式发布以前,不同的地区和国家(如欧盟EMA及美国FDA)已先后发布了相关的指导原则或草案,为统一各成员国之间要求上的差异,ICH发起并组织了M7的制定工作。
该指导原则针对DNA活性杂质提出了较明确的评价及控制策略,M7(R1)于2017年5月31日发布,现已处于第四阶段,推荐到各成员国采纳使用。
我国药监部门已于2017年6月加入ICH,新药研发过程中对此类杂质的控制也要按此执行。
4种残留限度计算方法

四种制药清洁限度算法详解在《药品共线生产质量管理指南(征求意见稿)》出台之前,制药企业常用的清洁限度的算法有最低日治疗剂量的1/1000、10ppm、半数致死量LD50,2021年11月,中国CFDI 出台了《药品共线生产质量管理指南(征求意见稿)》,提供了更具有科学性和优势的方法,即基于健康的暴露限度(ADE/PDE)。
本文就这四种清洁限度作一下论述1、最低日治疗剂量的1/1000定义:下批产品的最高日服用剂量中含有上批产品的量不超过上批产品的最低日治疗量的1/1000,以此标准来制定残留限度。
公式:MDDbUbBb MTDa L ⨯⨯=10001000/1解释:MTDa:清洁前产品(目标化合物)最小每日给药剂量中的活性成分含量(mg);Bb:清洁后产品的批量(支/瓶)Ub:清洁后产品的每支含量(mg)MDDb:清洁后产品(目标化合物)最大每日给药剂量中的活性成分含量(mg)解析:①a 品种专用MTDa 对特定品种a 是固定值,根据生产线所有品种,选择MDDbUbBb ⨯最小值,即为a 品种专用限度。
②全品种可用MDDUB MTD L ⨯⨯=10001000/1根据生产线所有品种,选择MTD 最小值,选择MDDUB ⨯最小值,即为该生产线全品种皆可用限度。
历史:[1/1000来源:对于一个产品,出现在另一种产品的最大每日剂量中量,不应超过其剂量的0.001(1/10x 1/10x 1/10)。
其中,第一个1/10系数:认为药物在剂量的1/10下是非活性的;第二个1/10系数:以确保清洁程序是稳健的;最后一个1/10系数:作为安全系数。
]2、残留物浓度10ppm来源:《药品生产验证指南》指出除高活性,高致敏性药品外,10ppm 是足够安全的,衍生出了以10ppm 为限度计算残留物浓度,即,将10ppm 简化为最终淋洗水中样品残留物浓度限值为10ppm。
公式:FppmBb L ppm 1010⨯=解释:Bb:清洁后产品的批量(kg);10ppm:10×10-6,即10mg/kg;F:为安全因子系数,根据风险评估,一般取2-10;根据生产线所有品种,选择最小批量进行计算,即为该生产线全品种皆可用限度。
ich m7规则

ich m7规则
ICH M7规则是关于评估和控制药物中DNA反应性(致突变)杂质以限制潜在的致癌风险的指南。
该指南旨在提供一个可用于遗传毒性杂质的鉴别、分类、限定和控制的可行性框架,以限制潜在的致癌风险。
根据ICH M7指南,遗传毒性杂质鉴别可采用两种方法:通过数据库和文献检索致癌性和遗传毒性数据(致突变性)(CPDB,IRIS,NTP,ECHA 等);使用(定量)结构活性关系(QSAR)进行计算。
采用QSAR方法预测细菌突变试验(AMES)的结果来进行毒性评估。
并采用两种QSAR预测方法:一个方法基于专家规则(expert rule-based),另一个方法基于统计学(statistical-based)。
根据文献数据库或者QSAR计算所得出的危害评估的结果,可将杂质分为5个类别。
此外,ICH M7还规定了遗传毒性杂质的限定和控制策略,包括使用计算毒理学关注阈值(TTC)方法计算遗传毒性杂质可接受摄入量、特异性限度、短于生命周期(LTL)和关注队列(CoC)等。
在实施ICH M7时,需要遵循一些指导原则,例如建立全面的IT服务管理体系,以确保高质量、高效率的服务水平,并帮助组织在信息技术服务领域进行持续改进。
以上信息仅供参考,如有需要,建议您咨询专业律师。
ichm7基因毒性杂质评估和控制◆中英

ASSESSMENT AND CONTROL OF DNA REACTIVE(MUTAGENIC) IMPURITIES IN PHARMACEUTICALS TOLIMIT POTENTIAL CARCINOGENIC RISK为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制M7Current Step 4 versiondated 23 June 2014This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union, Japan and USA.M7Document History 文件历史Current Step 4 version 现行版本第4阶段Legal Notice: This document is protected by copyright and may be used, reproduced, incorporated into other works, adapted, modified, translated or distributed under a public license provided that ICH's copyright in the document is acknowledged at all times. In case of any adaption, modification or translation of the document, reasonable steps must be taken to clearly label, demarcate or otherwise identify that changes were made to or based on the original document. Any impression that the adaption, modification or translation of the original document is endorsed or sponsored by the ICH must be avoided.The document is provided "as is" without warranty of any kind. In no event shall the ICH or the authors of the original document be liable for any claim, damages or other liability arising from the use of the document.The above-mentioned permissions do not apply to content supplied by third parties. Therefore, for documents where the copyright vests in a third party, permission for reproduction must be obtained from this copyright holder.ASSESSMENT AND CONTROL OF DNA REACTIVE (MUTAGENIC) IMPURITIES IN PHARMACEUTICALS TO LIMIT POTENTIALCARCINOGENIC RISK为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制ICH Harmonised Tripartite GuidelineICH三方协调指南Having reached Step 4 of the ICH Process at the ICH Steering Committee meeting on 5 June 2014, this Guideline is recommended for adoption to the three regulatory parties to ICHASSESSMENT AND CONTROL OF DNA REACTIVE (MUTAGENIC) IMPURITIES IN PHARMACEUTICALS TO LIMIT POTENTIALCARCINOGENIC RISK为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制1. INTRODUCTION概述The synthesis of drug substances involves the use of reactive chemicals, reagents, solvents, catalysts, and other processing aids. As a result of chemical synthesis or subsequent degradation, impurities reside in all drug substances and associated drug products. While ICH Q3A(R2): Impurities in New Drug Substances and Q3B(R2): Impurities in New Drug Products (Ref. 1, 2) provides guidance for qualification and control for the majority of the impurities, limited guidance is provided for those impurities that are DNA reactive. The purpose of this guideline is to provide a practical framework that is applicable to the identification, categorization, qualification, and control of these mutagenic impurities to limit potential carcinogenic risk. This guideline is intended to complement ICH Q3A(R2), Q3B(R2) (Note 1), and ICH M3(R2): Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorizations for Pharmaceuticals (Ref. 3).原料药合成牵涉到使用活性化学物质、试剂、溶剂、催化剂和其它工艺助剂,导致在所有原料药及其制剂中会残留有化学合成或其降解产物、杂质。
基因杂质的评估和控制 ICH M7

癌性
*或其他相关阳性诱变数据,说明与诱导基因编写的DNA反应活性(例如,体内基因诱 变研究显示阳性)
精品课件
传毒性, 而确认有遗传毒性的物质也不一定会 产生致癌作用。 ✓杂质的理化性质和其他结构特点(如相对分子 质量、亲水性、分子对称性 / 空间位阻、反应 活性以及生物代谢速率等)会对其毒性产生抑制 或调节作用。
4.4 已上市药物的其它需考虑问题 两种情况,需要考虑对杂质进行评估: 1、新杂质的相关危害性数据所采用的研究方法 具有高质量科学性,且与相关法规测试指南一 致,其数据记录或报告易于获得 2、新的杂质被确知属于第1类或第2类诱变性 此时,申报人需要实施本指南所要求的评估
精品课件
5
原料药和制剂杂质评估
首次用于药物中的、化学合成的辅料中的杂质
生物/生物技术制品、肽类、寡核苷酸、放射药物、发酵产品、草药制 品和动 物/植物来源的粗品 ICH S9中所定义的晚期癌症指征用原料药和制剂 已上市药物中使用的辅料、调味剂、着色剂和香料 药物包材中的可浸出杂质
精品课件
3
通用原则
在EMA《遗传毒性杂质限度指导原则》中引入了可接受风险 的摄入量,即毒性物质限量,或毒理学关注门槛(TTC, Threshold of Toxicological Concern)这个概念。设置 了限度值 TTC(1.5 μg/day),即相当于每天摄入1.5 μg 的基因毒性杂质,被认为对于大多数药品来说是可以接受 的风险(一生中致癌的风险小于十万分之一)。按照这个 阈值,可以根据预期的每日摄入量计算出活性药物中可接 受的杂质水平。 TTC是一个风险管理工具,采用的是概率的方法。 TTC不能被理解为绝对无风险的保障。
8.3 定期检测要考虑的问题 定期检测—方法1 - 不需要对每批均进行放行例行检测。 - 当检测结果显示,诱变性杂质的水平无法符合
化药注射剂致突变杂质研究

NDMA在小鼠与大鼠的TD50值分别为0.189mg/kg/天和 0.0959mg/kg/天。按照更为保守的大鼠TD50值 0.0959mg/kg/天,人体重50kg,肿瘤发生风险为十万分 之一来计算: 每日人最大摄入量=0.0959mg/kg/天×50kg/50000 =0.0000959mg/天≈0.1μg/天 缬沙坦原料按照每日用药320mg计算: 0.1μg /320mg =0.00003%=0.3PPM。
16
致突变杂质的控制
特殊情况:
• 如果有其他来源的致突变杂质暴露量更大,如食 品或体内代谢物,更高的限度可能是合理的。
• 对于严重疾病、预期寿命缩短、迟发的慢性疾病 或治疗选择有限的适应症,可根据具体情况按个 案处理。
17
致突变杂质的控制要素
• 起始原料、溶剂、中间体、内包材的控制 • 生产环境和设备运行条件的控制(GMP) • 通过合理工艺设计进行控制 • 生产过程控制和工艺参数控制 • 原料药/制剂的终点控制
• AI:TD50外推得到,没有阈值,适用于 LTL限度。
AI与PDE含义不同,不能互相替代。
31
31
关于毒理学量效关系的阈值(threshold)
• 遗传毒性致癌物在极低浓度时即可造成机体遗传物质的 损伤,通常认为是没有阈值的毒性物质。
基因毒性杂质 ppt课件

CAS
74-87-3 75-00-3 75-29-6 79-11-8 50-00-0 75-07-0 542-78-9 556-52-5 106-89-8 96-24-2 96-23-1
PDE(ug/day)
1361 1810 55500 3000 1.35 or 10000 153 122
4 2.96 PMTDI :4ug/kg/day 10
0.05%
>10mg ~2g
0.2%或2mg (取最小值)
>100mg~2g
0.2%或3mg (取最小值)
>2g 0.10% >2g 0.15%
其他
➢ 限度=PDE/日最大剂量 ➢ PDE=TD50*体重/50000 ➢ PDE=NOEL*体重/(F1*F2*F3*F4*F5)
➢ 限度=TTC/日最大剂量 ➢ 由ppm推算NOEL (ICH Q3C) ➢ 由LD50推算NOEL
关于PDE法与TTC法
TTC法
无阈值效应的遗传毒性杂质;引入了毒理学关注的阈值 (Threshold of Toxicological Concern)。TTC是在接受患者终生 用药的癌症发生概率不超过10万分之一的基础上,从高浓度 下进行的致癌性实验数据线性外推倒极低浓度得到的一个理 论值。
对于无阈值效应的遗传毒性杂质,如果每日摄入量低于1.5ug, 那么患者因服药导致癌症发生的额外风险可以忽略不记。
③
限度制定
①
杂质引入方式
➢ 起始物料及其杂质 ➢ 溶剂及其杂质 ➢ 中间体 ➢ 反应副产物 ➢ 辅料杂质 ➢ 降解杂质 ➢ 生产设备引入 ➢ 包装材料引入 ➢ 环境污染引入
②
杂质毒性分类判定 致癌、致突变
ICH M7(step4):诱变性杂质评估和控制-2016模板

20140623 ICH M7(step4):诱变性杂质评估和控制(中英文1/3)A SSESSMENT AND C ONTROL OF DNA R EACTIVE (M UTAGENIC)I MPURITIES IN P HARMACEUTICALSTO L IMIT P OTENTIAL C ARCINOGENIC R ISK为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制M7Current Step 4 versiondated 23 June 2014This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union, Japan and USA.A SSESSMENT AND C ONTROL OF DNA R EACTIVE (M UTAGENIC) I MPURITIESIN P HARMACEUTICALS TO L IMIT P OTENTIAL C ARCINOGENIC R ISK为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制1. I NTRODUCTION概述The synthesis of drug substances involves the use of reactive chemicals, reagents, solvents, catalysts, and other processing aids. As a result of chemical synthesis or subsequent degradation, impurities reside in all drug substances and associated drug products. While ICH Q3A(R2): Impurities in New Drug Substances and Q3B(R2): Impurities in New Drug Products (Ref. 1, 2) provides guidance for qualification and control for the majority of the impurities, limited guidance is provided for those impurities that are DNA reactive. The purpose of this guideline is to provide a practical framework that is applicable to the identification, categorization, qualification, and control of these mutagenic impurities to limit potential carcinogenic risk. This guideline is intended to complement ICH Q3A(R2), Q3B(R2) (Note 1), and ICH M3(R2): Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorizations for Pharmaceuticals (Ref. 3).原料药合成牵涉到使用活性化学物质、试剂、溶剂、催化剂和其它工艺助剂,导致在所有原料药及其制剂中会残留有化学合成或其降解产物、杂质。
M7评估和控制药物中DNA反应性(致突变)杂质以限制潜

M7 评估和控制药物中DNA反应性(致突变)杂质以限制潜在的致癌风险行业指南美国卫生及公共服务部食品药品监督管理局药品评价与研究中心(CDER)生物制品评价与研究中心(CBER)2015.05ICHM7 评估和控制药物中DNA反应性(致突变)杂质以限制潜在的致癌风险行业指南如需更多副本,请联系:食品药品监督管理局药品评价与研究中心药物信息司交流办公室10001 New Hampshire Ave., Hillandale Bldg., 4th Floor Silver Spring, MD20993-0002电话:855 - 543 - 3784或301 - 796-3400; 传真:301- 431-6353邮箱:druginfo@/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/de fault.htm或食品药品监督管理局传播生物制品评价与研究中心外联与发展司交流办公室10903 New Hampshire Ave., Bldg. 71, Room 3128 Silver Spring, MD20993-0002电话:800 - 835 - 4709或240 -402 -7800邮箱:ocod@/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidance/default.htm美国卫生及公共服务部食品药品监督管理局药品评价与研究中心(CDER)生物制品评价与研究中心(CBER)2015.05ICH目录I.介绍(1) (5)II.指南的范围(2) (6)III.总则(3) (7)IV.已上市药品的注意事项 (8)A.原料药化学、生产和控制的批准后变更(4.1) (8)B.制剂化学、生产和控制的批准后变更(4.2) (9)C.已上市药品的临床用途变更(4.3) (9)D.已上市药品的其他注意事项(4.4) (9)V.原料药和制剂杂质评估(5) (9)A.合成杂质(5.1) (10)B.降解产物(5.2) (10)C.临床研发的注意事项(5.3) (11)VI.危害评估要素(6) (11)VII.风险表征(7) (13)A.基于TTC的可接受摄入量(7.1) (13)B.基于化合物特异性风险评估的可接受摄入量(7.2) (14)C.与短于终生(LTL)暴露相关的可接受摄入量(7.3) (14)D.多个致突变杂质的可接受摄入量(7.4) (16)E.特例和方法灵活性(7.5) (16)VIII.控制 (17)A.工艺相关杂质的控制(8.1) (17)B.控制方法的注意事项(8.2) (19)C.定期检测的注意事项(8.3) (19)D.降解产物的控制(8.4) (20)E.生命周期管理(8.5) (20)F.临床研发的注意事项(8.6) (21)IX.文件 (22)A.临床试验申请(9.1) (22)B.通用技术文件(上市申请)(9.2) (22)注解 (23)术语 (29)参考文献 (31)附件 (33)M7 评估和控制药物中DNA反应性(致突变)杂质以限制潜在的致癌风险行业指南1指南代表了食品药品监督管理局(FDA或机构)目前对于这个问题的看法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人用药品注册技术要求国际协调会(ICH)ICH协调指导原则评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险M7(R1)现行第四阶段版本2017年3月31日本指导原则由相应的ICH专家工作组制订,并根据ICH进程已提交给管理当局征询意见,在ICH进程的第四阶段,最后的草案被推荐给ICH监管机构采纳。
M7(R1)文件历史法律声明:本文件受版权保护,在无条件承认ICH版权的前提下,可使用、翻印、在其他著作中引用、改编、修正、翻译或传播本文件。
如对文件进行改编、修正或翻译,必须采取合理措施来明确标明、界定或确认变更依据本原始文件进行。
ICH不支持或赞助任何对原始文件的更改、修正或翻译。
本文件根据现有内容提供,不附带任何担保。
ICH或本文作者在任何情况下均不对使用本文件产生的索赔、损失或其他问题负责。
上述许可不适用于由第三方提供的内容。
因此,翻印版权属于第三方的文件需获得版权所有人的许可。
ICH 协调指导原则评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险M7(R1)ICH协调指导原则已于2017年5月31日在ICH会议上进入ICH进程第四阶段,并建议ICH的监管机构采纳本指导原则。
目录1.引言 (5)2.指导原则的适用范围 (5)3.总则 (6)4.已上市药品的注意事项 (7)4.1原料药CMC部分的上市后变更 (7)4.2制剂CMC部分的上市后变更 (8)4.3已上市药品的临床用途变更 (8)4.4已上市药品的其他注意事项 (8)5.原料药和制剂杂质评估 (8)5.1合成杂质 (9)5.2降解产物 (9)5.3临床研发的注意事项 (10)6.危害性评估 (10)7.风险表征 (11)7.1基于TTC的可接受摄入量 (11)7.2基于特定化合物的风险评估数据制订可接受摄入量 (12)7.2.1具有阳性致癌性数据的致突变杂质(表1中的1类) (12)7.2.2有实际阈值证据的致突变杂质 (12)7.3与LTL暴露相关的可接受摄入量 (12)7.3.1临床研发阶段 (13)7.3.2已上市药品 (13)7.4多个致突变杂质的可接受摄入量 (13)7.5特例和方法灵活性 (14)8.控制 (14)8.1工艺相关杂质的控制 (15)8.2控制方法的注意事项 (16)8.3定期检测的注意事项 (17)8.4降解产物的控制 (17)8.5生命周期管理 (18)8.6临床研发的注意事项 (18)9.文件 (19)9.1临床试验申请 (19)9.2通用技术文件(上市申请) (19)注释 (20)术语 (25)附录 (27)附录1:ICH M7 指导原则应用范围 (27)附录2:举例说明可以采用潜在的控制方法 (28)附录3:ICH M7 附录 (30)评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险M7(R1)1. 引言原料药的合成涉及反应物、试剂、溶剂、催化剂和其它加工助剂的使用。
因化学反应和终产物降解,原料药及制剂中会存在杂质。
ICH Q3A(R2)《新原料药中的杂质》和Q3B(R2)《新药制剂中的杂质》(参考文献1、2)为大多数杂质的定性和控制提供了指导,但其对DNA反应性杂质的指导很有限。
本指导原则旨在提供一个用于致突变杂质的鉴别、分类、定性和控制的可行性框架方案,用于控制杂质潜在的致癌风险。
本指导原则意在补充ICH Q3A(R2)、Q3B(R2)(注释1)和ICH M3(R2)《支持药物进行临床试验和上市的非临床安全性研究指导原则》(参考文献3)。
本指导原则强调,为把致癌风险控制在可忽略的程度,制订致突变杂质的限度时,兼顾安全性和质量风险管理两方面。
本指导原则对原料药或制剂中残留或可能残留的致突变杂质进行评估和控制,且考虑用药人群的具体情况提出了建议。
2. 指导原则的适用范围本指导原则预期在新原料药和新制剂临床研究和后续上市申报阶段提供指导。
它也适用于部分情形的已上市药品的上市后申请,以及在已上市制剂中使用的原料药用于新制剂时的上市申请,包括:•变更了原料药合成工艺,导致产生了新杂质或提高了已有杂质限度;•变更了处方、组分或生产工艺,导致产生了新降解产物或提高了已有降解产物限度;•变更了适应症或给药方案,显著影响了可接受的致癌风险水平。
本指导原则所述对杂质潜在致突变性的评估不适用于以下类型的原料药和制剂:生物/生物技术制品、肽类、寡核苷酸、放射性药物、发酵产品、草药、动物或植物来源的粗制品。
本指导原则不适用于ICH S9(参考文献4)所定义的拟用于晚期癌症适应症的原料药和制剂。
另外,某些情况下拟用于其它适应症的原料药本身在治疗浓度下就存在遗传毒性,且预测可能会增加致癌风险。
在这些情况下,暴露于致突变杂质不会显著增加原料药的致癌风险。
因此,杂质可以按非致突变性杂质进行控制。
本指导原则所述对杂质潜在致突变性的评估不适用于矫味剂、着色剂和香料,以及已上市药物中使用的辅料。
本指导原则不适用于药物包材相关的可浸出物,但如有必要,可使用本指导原则中描述的限制潜在致癌风险的安全风险评估原则。
如有必要,药品中首次使用的化学合成辅料中的杂质可使用本指导原则的安全风险评估原则。
3. 总则本指导原则关注焦点为较低水平即可直接造成DNA损伤,进而导致DNA 突变,因此可能引发癌症的DNA反应性物质。
这类致突变性致癌物通常由细菌回复突变(致突变性)试验检测确定。
其它类型的非致突变性遗传毒性物质通常有阈值机制,以一般杂质水平存在时通常不会对人造成致癌风险。
因此,为限制人暴露于潜在致突变杂质相关的患癌风险,使用细菌致突变试验来评估杂质致突变的可能性及控制的必要性。
根据已有知识,基于结构的评估有助于预测细菌致突变试验结果。
这种评估有多种方法,包括综述已有文献和/或计算机毒理学评估。
本文采用了毒理学关注阈值(TTC)的概念。
TTC定义了未经研究的化学物质在致癌或其他毒性作用风险可忽略时的可接受摄入量。
确定TTC的方法总体上可认为是非常保守的,它是将50%肿瘤发生率(TD50)的剂量简单线性外推到百万分之一发生率而得,且采用的TD50数据取自最敏感物种和对诱导最敏感的肿瘤发生部位产生的数据。
在使用TTC评估原料药和制剂中致突变杂质的可接受限度时,宜采用1.5μg/天的杂质限度,它对应理论上额外增加10-5的患癌风险。
已确定有些结构基团具有较高的致癌性,即使摄入量低于TTC水平,理论上仍会具有高致癌风险。
这类高效致突变致癌物,被称为―关注队列‖,包括黄曲霉毒素类、N-亚硝基化合物,以及烷基-氧化偶氮基化合物。
早期临床研究阶段由于整体研发经验有限,控制策略和控制方法可能不完善。
本指导原则基于已建立的风险评估策略制订致突变杂质的可接受摄入量。
在早期研发阶段,将可接受风险设定为理论计算患癌风险增加约为百万分之一。
在研发后期及上市后,将可接受风险设定为理论计算患癌风险增加约为十万分之一。
与人终生罹患各类癌症的概率(大于三分之一)相比,上述风险控制水平相当于仅造成理论上患癌风险的微小增加。
需注意的是,现确立的癌症风险评估是基于终生暴露的情形建立的。
在研发和上市期间短于终生(LTL)的暴露时杂质可以有更高的可接受限度,并仍保持相同的风险水平。
使用量化的患癌风险值(十万分之一),并将其转化为基于风险的剂量(TTC),是一种高度假设性的方法,不应作为实际风险的真实数值。
尽管如此,TTC的概念为致突变性化合物提供了一个安全暴露量的估值。
但是,考虑到推导TTC值时采用了保守的假设,超出TTC 值并不一定会增加患癌风险。
实际增加的癌症发生率远低于十万分之一。
此外,如果致突变化合物在啮齿动物生物测定中显示为非致癌物,则预计致癌风险不会增加。
基于上述这些原因,患者已暴露于某杂质,该杂质后来被鉴定为致突变的杂质时,患者的患癌风险不一定因此增加。
应进行风险评估来决定是否需要采取进一步措施。
如果确定某杂质具有潜在风险,则需根据对工艺的理解开发适当的控制策略,和/或根据开发分析控制方法,保证致突变杂质水平在可接受限度下,无致癌风险。
某些情况下,某杂质同时也是原料药的代谢产物。
此时对代谢产物的致突变风险评估可作为该杂质限度制订的依据。
4. 已上市药品的注意事项本指导原则初衷不是用于回顾性分析(即本指导原则采纳前已上市的药品)。
但是,一些上市后变更需重新评估致突变杂质相关的安全性。
本节内容适用于在本指导原则采纳之前或之后药品的上市后变更。
第8.5节(生命周期管理)包含了本指导原则采纳后的上市药品的其它建议。
4.1 原料药CMC部分的上市后变更原料药涉及CMC的上市后变更,对起始物料之后的部分如合成路线、试剂、溶剂或工艺条件的变更可能对致突变杂质的潜在风险产生影响,申报资料中应对这些影响进行评估。
特别应评估变更是否会产生任何新的致突变杂质或提高已知致突变杂质的可接受限度。
对不受变更影响的杂质建议不再重新评估。
例如,如果只变更部分生产工艺,则致突变杂质的风险评估应局限于该变更是否会产生新的致突变杂质,在受影响的步骤中致突变杂质是否升高,以及来自上游步骤中的已知致突变杂质的水平是否升高。
与这些变更相关的申报参照第9.2节内容。
变更原料药、中间体或起始物料的生产场地,或变更原材料供应商,不需要重新评估致突变杂质风险。
如拟提交一个新的原料药供应商,如有充分证据证明该供应商生产该原料药采用了与审评区域内已上市药品中所用的原料药相同的合成路线,则可以说明关于致突变杂质的风险/获益是可以接受的,不需要根据本指导原则进行评估。
如果不是这种情况,则需要根据本指导原则进行评估。
4.2 制剂CMC部分的上市后变更制剂的上市后变更(例如组分、生产工艺、剂型的变更),应包括对新致突变降解产物或提高已知致突变降解产物的可接受限度相关的潜在风险进行评估。
必要时,申报资料应包括更新后的控制策略。
如果制剂所用的原料药没有变化,则不建议也不要求对该原料药重新进行评估。
制剂生产场地变更不需要重新评估致突变杂质风险。
4.3 已上市药品的临床用途变更变更已上市药品的临床用途时,需重新评估致突变杂质限度的情形包括临床使用剂量的显著增加、服药时间的增加(特别是先前适应症将致突变杂质限度设定为高于终生使用时的可接受摄入量,但该摄入量可能已不再适合于更长给药周期的新适应症),或者适应症由病情较严重或危及生命的疾病改为不太严重的疾病,之前杂质可接受摄入量(第7.5节)较高,可能已不再适合新适应症。
与新给药途径或扩大患者人群(包括孕妇和/或儿童)相关的已上市药品临床用途的变更,如日剂量或服药时间没有增加,则不需要重新评估致突变杂质风险。
4.4 已上市药品的其他注意事项如有特殊担忧,本指导原则也可用于已上市的药品。
除非杂质有―关注队列‖(第3节)中的结构,否则仅凭杂质存在警示结构不足以启动后续措施。
