人教版必修第1册第一章物质及其变化 第二节 离子反应第一课时 电解质的电离46ppt
人教版(2019)高一化学必修第一册第一章1.2.1离子反应-电解质的电离(23张PPT)

述装置不能测出
灯泡变亮, (有电流产生)
NaCl溶都液能、导KN电O3溶液
【氯化钠在水溶液里导电】
金属导电:有自由移动的电子。 类 比
氯化钠溶液导电:有自由移动的离子。 【氯化钠的熔融状态也可以导电】
电解质与非电解质 为什么NaCl、KNO3的固体不导电,水溶液或熔 融状态导电?
练习:书写H2SO4 、NaOH、(NH4)2C3、HNO3、Ba(OH)2、 Al2(SO4)3的电离方程式
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3酸
电离时生成的阳离子 全部是是H+的化合物
NaOH = Na+ + OH-
Ba(OH)2 = Ba2+ + 2OH碱
电离时生成的阴离子 全部是OH-的化合物
自由移动离子的浓度 ⑦硫酸溶液的导电性一定比盐酸溶液的导电性强 溶液导电性
离子所带电荷的多少
A.①④
B.⑤⑦
C.③⑥
D.②⑦
小结
混合物 物 质
单质
既不是电解质 也不是非电解质
纯净物
化合物
能导电
溶于水或 熔融状态
均不导电
电解质 电离 非电解质
电离方程式
1.下列说法正确的是( AC)
A.电离时生成的阳离子全部是氢离子的化合物叫做酸 B.只有酸电离时,阳离子才是氢离子 C.电离时生成的阴离子全部是氢氧根离子的化合物叫做碱 D.所有的盐电离时都生成金属离子和酸根离子
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质 NH3·H2O是电解质 ③氯化氢溶于水能导电,但液态氯化氢不能导电
④KNO3溶液能导电,所以KNO3溶液是电解质 KNO3是电解质 ⑤溶于水后能电离出H+的化合物都是酸 NaHSO4 = Na+ + H+ + SO42⑥电解质未必能导电,能导电的未必是电解质
高中化学第一章物质及其变化第二节离子反应第1课时电解质的电离课件新人教版必修第一册

学业基础
学考评价
核心素养
核心微网络
素养新要求
1. 了解电解质的概念。
2.学会书写电解质的电离方程式。
3.理解酸、碱、盐在水溶液中的电离及导电性。
学业基础
一、电解质
1.研究氯化钠的导电性
实验
操作
实验
现象
实验
结论
电灯泡不发光
电灯泡发光
电灯泡发光
固态氯化钠不能导电
熔融状态的氯化钠能
导电,但在水溶液里能导电,所以HCl属于电解质。
(3)导电的物质不一定是电解质
①Fe、Cu等金属在熔融状态下也能够导电,但它们都是单质,不是
电解质;
②稀盐酸能导电,但不能说稀盐酸是电解质,应该说HCl是电解质,
因为稀盐酸是混合物。
(4)难溶性的物质不一定不是电解质
BaSO4、CaCO3 等难溶于水的盐,其水溶液的导电能力也很弱,但熔
4
B.KClO===K++Cl-+O2-
C.FeCl3===Fe3++3Cl-
D. KNO3 ===K + + NO−
3
答案:B
解析:原子团是在化学反应中作为整体参加反应的微粒,不能继续拆成离子形
-
式,如SO2−
4 、ClO 等。
6.[2022·合肥高一检测]物质M在水溶液中发生电离:M===X2+ +
够导电
氯化钠的水溶液能够
导电
2.电解质与非电解质
项目
定义
相同点
不同点
本质区别
所含物质
类型
电解质
非电解质
水溶液
水溶液
在__________中或__________下能
化学新教材人教版高中化学必修第一册第2节 离子反应 第1课时

再见
蔗糖 酒精 NH3
二、电解质和非电解质
例1 下列说法正确的是 A.铜、石墨均能导电,所以它们都是电解质 B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质 C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
√D.蔗糖、酒精在水溶液里和熔融状态下都不能导电,所以它们都是非电解质
解析 判断物质是否为电解质,一看物质类别必须是化合物(酸、碱、盐、水等), 选项A不正确; 二看溶于水或熔融状态下能否导电,选项C不正确,选项D正确; 三看溶于水时若与水反应,其溶液导电可能是非电解质,选项B不正确。
三、电解质的电离
例3 下列电离方程式错误的是
√A.NaHCO3===Na++H++CO23-
B.NaHSO4===Na++H++SO24- C.MgCl2===Mg2++2Cl- D.Ba(OH)2===Ba2++2OH- 解析 选项 A 中 HCO- 3 为弱酸根离子,在溶液中只有很少一部分发生电离,不能拆成 H+与 CO23-,其电离方程式为 NaHCO3===Na++HCO- 3 ;
第一章 物质及其变化 第二节 离子反应
第1课时 电解质的电离
一、导入新课
《用电安全规范》中要求:不要用湿手去接触电源开关、插座或其他电器 设备。这是为什么呢?
人的手上常会沾有NaCl(汗 液的成分之一),有时也会沾有 其他电解质,当遇到水时,形成 电解质溶液。电解质溶液能够导 电,因此,湿手直接接触电源时 容易发生触电事故。
二、电解质和非电解质
【归纳总结】
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。 (2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨等是非电解质)。 (3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。 (4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如 酒精等)。
新人教高中化学必修1讲义04 第一章第二节第1讲 电解质的电离
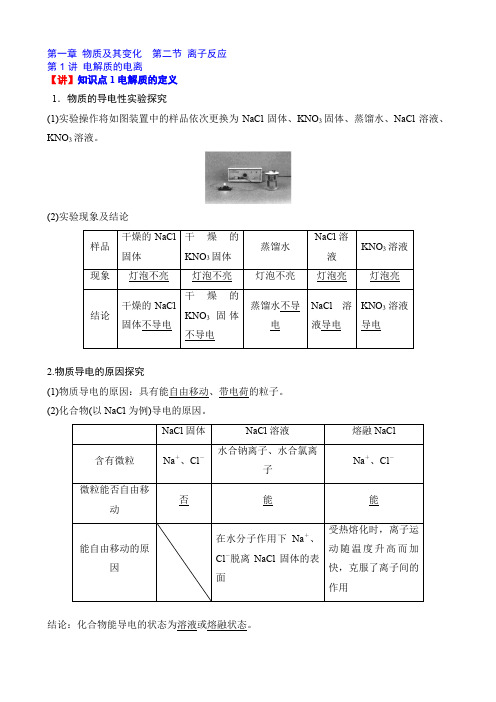
第一章 物质及其变化 第二节 离子反应 第1讲 电解质的电离【讲】知识点1电解质的定义 1.物质的导电性实验探究(1)实验操作将如图装置中的样品依次更换为NaCl 固体、KNO 3固体、蒸馏水、NaCl 溶液、KNO 3溶液。
(2)实验现象及结论2.物质导电的原因探究(1)物质导电的原因:具有能自由移动、带电荷的粒子。
(2)化合物(以NaCl 为例)导电的原因。
结论:化合物能导电的状态为溶液或熔融状态。
3.电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物叫做电解质。
如:氯化钠、硝酸钾、氢氧化钠等(2)非电解质:在水溶液里和熔融状态下均不能导电的化合物叫做非电解质。
如:蔗糖、酒精等【注意】①共同点:电解质、非电解质均指化合物(判断的前提),属于纯净物,不同之处是在水溶液中或融化状态下能否导电【思考】NaOH溶液、盐酸、铜均能导电,它们是不是电解质,是不是非电解质?①单质、混合物既不是电解质也不是非电解质①电解质的导电是有条件的(必须发生电离),电解质必须在水溶液中或熔化状态下才能导电,而且是本身电离而导电的化合物。
如:SO2、SO3、CO2、NH3的水溶液里能导电,但导电原因是与水作用后的生成物(H2SO3、H2SO4、H2CO3、NH3 ·H2O)电离所致,并非本身电离出自由离子而导电,所以SO2、SO3、CO2、NH3等为非电解质,而H2SO3、H2SO4、H2CO3、NH3 ·H2O则是电解质①AgCl、BaSO4等某些难溶盐在水中的溶解度极小,不能导电,但因这些物质在水中可溶的部分能完全电离,故属于电解质①金属氧化物(CuO)等物质在水中不溶,但因其在熔融状态下能够导电,故这类金属氧化物也属于电解质⑥能导电的物质不一定是电解质Fe、Cu等金属在熔融状态下也能导电,但它们是单质,既不属于电解质,也不属于非电解质稀盐酸能导电,但稀盐酸不是电解质,因为稀盐酸是混合物⑦电解质溶于水能导电,但熔融状态下不一定能导电(如:氯化氢等)【练】1下列叙述正确的是()A.铜丝能导电,所以铜是电解质B.氯化钠晶体不导电,所以氯化钠不是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.SO3溶于水能导电,所以SO3是电解质答案C解析A项,电解质属于化合物,故铜不是电解质,错误;B项,NaCl固体不导电,但其水溶液或熔融状态均可以导电,故NaCl是电解质,错误;D项,SO3水溶液可以导电,并不是SO3本身电离出的离子,而是其与水的反应产物H2SO4电离产生的,SO3是非电解质。
人教版高中化学必修第一册第一章物质及其变化第二节离子反应第1课时电解质的电离

第一章第二节第1课时对点训练题组一电解质及其导电性1.目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。
下列物质可用作该饮料中的电解质的是( C )A.Fe B.葡萄糖C.KCl D.CO2解析:Fe为单质,不属于电解质,A项错误;葡萄糖为非电解质,B项错误;KCl溶于水或熔融状态下都能导电,所以是电解质,C项正确;CO2为非电解质,D项错误。
2.体操运动员比赛前为了防滑,常在手掌上涂抹白色的粉末——碳酸镁,以下有关碳酸镁的说法中正确的是( A )①含有3种元素②所含元素均处于游离态③属于氧化物④属于盐⑤属于电解质⑥属于非电解质A.①④⑤B.②④⑥C.①③⑤D.②③⑥3.下表是常见的几种酸、碱、盐在水溶液中解离出离子的情况,根据表中信息分析正确的是( B )酸盐碱溶质HCl H2SO4NaCl NaHSO4NH4Cl NaOH NH3·H2O解离出的离子H+、Cl-H+、SO2-4Na+、Cl-Na+、H+、SO2-4NH+4、Cl-Na+、OH-NH+4、OH-B.在水溶液中解离出金属阳离子和酸根离子的物质一定是盐C.盐溶液解离出的阳离子一定是金属阳离子D.碱溶液解离出的离子一定是金属阳离子和OH-解析:NaHSO4在水溶液中解离出的离子有H+,但它属于盐,不属于酸,A 错误;盐由金属阳离子(或铵根离子)和酸根离子构成,则在水溶液中解离出金属阳离子和酸根离子的物质一定是盐,B正确;NH4Cl属于盐,在水溶液中解离出的阳离子为NH+4,而不是金属阳离子,C错误;NH3·H2O属于碱,在水溶液中解离出NH+4和OH-,D错误。
4.电解质在人体中具有重要作用。
水、电解质代谢紊乱可使全身各器官系统,特别是心血管系统、神经系统的生理功能和机体的物质代谢发生相应的障碍,严重时常可导致死亡。
下列关于电解质溶液的叙述正确的是( B )A.阳离子和阴离子总数一定相等B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等C.除阴、阳离子外,溶液中不再含有其他粒子D.NaCl溶液的导电性一定与KCl溶液的导电性相同解析:电解质溶液中的离子可以带一个电荷,也可以带两个电荷或三个电荷,根据电解质溶液呈电中性,则阳离子和阴离子总数不一定相等,故A错误;电解质溶液呈电中性,存在电荷守恒,阳离子带的正电荷总数一定和阴离子带的负电荷总数相等,故B正确;电解质在溶液中,微粒有阴阳离子和水分子等,故C 错误;电解质溶液导电性强弱取决于溶液中离子的浓度和离子所带电荷数,NaCl 溶液和KCl 溶液的浓度不一定相等,二者的导电性不一定相同,故D错误。
最新人教版高中化学必修第一册第一章物质及其变化第二节 离子反应 第1课时 电解质的电离

答案:①
解析:KNO3溶液属于混合物,Cu属于单质,它们能导电,但不
是电解质。CH4、MgCl2晶体和H2SO4都不导电,并且CH4也
不是电解质。熔融的NaOH是化合物且能导电,属于电解质。
CO2溶于水后,其水溶液能导电,但CO2不是电解质。
?
有些化合物,如CO2、SO3、NH3等,其水溶液能导电,但它们
根据不同的碱的电离方程式可知,它们在水溶液中都能电离
出OH-,因此碱溶液具有相似的化学性质。从电离角度看,碱
的本质就是电离时生成的阴离子全部是OH-的化合物。
?
典型例题
【例题3】 下列电离方程式中,正确的是(
A.Ca(OH)2
C.Al2(SO4)3
Ca2++2(OH)2Al3++3S
B.FeCl2
因。
NaCl固体中含有带电荷的Na+和Cl-,但它们不能自由移动,
所以干燥的NaCl固体不能导电。当NaCl固体溶于水或受热
熔化时,能够产生自由移动的Na+和Cl-,因而NaCl溶液或熔融
的NaCl能导电。
?
2.电解质的电离。
(1)电解质溶于水或受热熔化时形成自由移动的离子的过程
叫电离。电解质溶液能够导电,是由于电解质在溶液中发生
(1)KNO3固体不导电,所以KNO3不是电解质。( × )
(2)铜丝、石墨都能导电,所以它们都是电解质。( × )
(3)NaCl溶于水,在通电条件下发生了电离。( × )
(4)熔融的MgCl2能导电,所以MgCl2是电解质。( √ )
(5)BaSO4难溶于水,所以BaSO4不是电解质。( × )
?
高中化学第一章物质及其变化第二节离子反应第1课时电解质的电离课件新人教版必修1

基础落实·必备知识全过关
一、电解质及其导电性
1.试验物质的导电性[实验
(1)实验装置
(2)实验现象及结论
烧杯中物质
实验现象
结论
灯泡不亮
______________________________________
蒸馏水
灯泡不亮
导电能力非常弱,上述装置不能测出
灯泡发光
应用体验
1.图a~c分别为氯化钠在不同状态下的导电实验( 、 均表示石墨电极, 与电源正极相连, 与电源负极相连)微观示意图。下列说法错误的是( )
D
A.图示中 代表氯离子
B.图a中氯化钠固体不能导电C.图b表示熔融的 能导电D.图c表示带负电荷的水合氯离子向与电源负极相连的电极移动
方法突破
1.电离模型的建立——认知模型
2.电离方程式的书写方法
(1)强酸、强碱、大部分盐书写时用“ ”连接,例如: 、 、 。弱酸、弱碱的电离方程式暂不讨论,后续学习。
(2)注意事项
①符合质量守恒和电荷守恒规律;
②原子团不能拆开书写,如 、 、 等;
③构成物质的原子或原子团的个数在书写电离方程式时变成离子的化学计量数。
【变式设问】 结合上题图示分析,通电后 固体才发生电离吗?为什么?
提示: 不是; 固体受热熔化或溶于水发生电离,通电后离子发生定向移动。
2.[2023山东济宁高一期中]宏观与微观相结合是化学特有的认识物质的方法。 溶于水的过程如图所示,下列说法不正确的是( )
A
A.水合 离子为水合A钠离子B.水合离子的形成是电性作用的结果C.水合离子的定向运动,是水溶液导电的原因D. 溶于水发生电离:
2.判断电解质的思维流程
应用体验
2021-2022学年高中化学人教版必修第一册课件第1章 第2节 第1课时 电解质的电离

第五章 三角函数
知识点
电解质及其导电性
问题探究: 1.上图所示装置为试验物质导电 性装置,在干燥的烧杯中依次分别加入 下表中物质,观察灯泡是否变亮?加入 烧杯中的物质是否是电解质?
数学(必修·第一册 RJA)
返回导航
• 2.通过以上实验,讨论:电解质本身是否一定导电?电解质 导电的环境一般是什么环境?
3.酒精不属于电解质,而是一种非电解质。
• 知识归纳总结:
• 1.电解质和非电解质的比较:
电解质
非电 解质
定义 在水溶液里或熔 融状态下能够导 电的化合物 在水溶液里和熔 融状态下都不导 电的化合物
相同点
都是 化合物
不同点
代表物
一定条件下能 NaCl, 电离产生离子 H2SO4,
NaOH
不能电离,不
新知预习
• 一、电解质 • 1.定义 • 在水_溶__液___里____或熔融状态下能够导电的_____化__合__物_。如:HCl、 H__2S_O__4_____、NaOH、_C_a_(_O_H__)2___、NaCl、___K_N_O__3 ___等。 • 注意:(1)在水溶液里和熔融状态下都不能导电的化合物,叫非电解 质。如:蔗糖、酒精、部分非金属氧化物、氨气等。 • (2)单质和混合物既不是电解质也不是非电解质。
• 2.电解质溶液或熔融电解质导电的原因(以NaCl为例)
• (1)电解质导电必须具备的条件:有自___由__移__动___的离子。
• (2)NaCl属于电解质,固体中含有带电微粒Na+、Cl-,但这些离子 _不__能_______自由移动,故氯化钠固体____不______导电。
• (3)NaCl固体溶于水时,在__水__分__子____的作用下,Na+、Cl-进入水中, 形成了能够____自__由__移__动的带电粒子,故NaCl溶液_________可_导电。 • (4)氯化钠固体受热熔化时,离子的运动随__温__度__升__高__而加快,克服 了离子间的相互作用,产生了能够自由移动的__________和_N_a_+_______, 故C熔l-融NaCl也能导电。
高中化学第1章物质及其变化第2节离子反应第1课时电解质的电离课件新人教版必修第一册

一、电解质及其导电性
1.物质的导电性实验探究 (1)实验操作:将如图装置中的样品依次更换为NaCl固体、KNO3固 体、蒸馏水、NaCl溶液、KNO3溶液。
(2)实验现象及结论
烧杯中物质 NaCl固体 KNO3固体
蒸馏水 NaCl溶液 KNO3溶液
现象 灯泡不亮
灯泡亮
结论 NaCl固体、KNO3固体都__不__导__电___ 导电能力非常弱,上述实验装置不能测出
2.写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_B__a_(O__H_)_2_=_=_=_B_a_2_+_+___2_O_H__-____________。 (2)KHSO4:_K__H_S__O_4_=_=_=_K__+_+__H_+_+__S__O_24_-______。 (3)HNO3:_H__N_O__3_=_=_=_H_+_+___N_O__- 3 ________。 (4)Na2CO3:_N__a_2_C_O__3=_=_=_2_N__a_+_+__C__O_23_-__________。
(1)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有 __C__a_O_+__H__2O__=_=_=_C__a_(_O_H__)2_,__C__a_(O__H_)_2_+__N_a_2_C_O__3=__=_=_C_a_C__O_3_↓_+__2_N_a_O__H____ (不考虑黏土中的物质可能参加的反应)。
熔融状态下电离的方程式_______M__n_(O__H__)2_=_熔=_=_融=_=_M__n_2_+_+__2_O_H__-____。
解析:(1)发生的反应有 CaO+H2O===Ca(OH)2,Ca(OH)2+Na2CO3 ===CaCO3↓+2NaOH。
高中化学第一章物质及其变化第二节第一课时电解质的电离课件新人教版必修第一册

(2)电解质不一定同时具备以下两个条件 ①在水溶液里能导电; ②在熔融状态下能导电。 化合物只要具备其中一个条件即为电解质。如 HCl 在熔融状态时不导电,但在水 溶液里能导电,所以 HCl 属于电解质。 (3)导电的物质不一定是电解质 ①Fe、Cu 等金属在熔融状态下也能够导电,但它们都是单质,不是电解质; ②稀盐酸能导电,但不能说稀盐酸是电解质,应该说 HCl 是电解质,因为稀盐酸 是混合物。 (4)难溶性的物质不一定不是电解质 BaSO4、CaCO3 等难溶于水的盐,其水溶液的导电能力也很弱,但熔融状态下导 电,因而它们属于电解质。
蔗糖溶液 灯泡不亮
乙醇溶液 灯泡不亮
1.导电原因分析 (1)金属铜导电的原因是 铜内有自由移动的电子。 (2)NaCl 固体、KNO3 固体不导电的原因是固体中尽管有阴、阳离子,但这些离子 不能 自由移动。 (3)NaCl 溶液、KNO3 溶液、稀盐酸导电的原因是 溶液中有自由移动的离子。 (4)蔗糖溶液、乙醇溶液不导电的原因是蔗糖、乙醇都是由分子构成的,在水中不 能形成自由移动的带电荷的粒子。 2.电解质、非电解质的概念 (1)电解质:在水溶液里或熔融状态下能够导电的 化合物 ,如酸、碱、盐等。 (2)非电解质:在水溶液里和熔融状态下都不导电的化合物,如乙醇、蔗糖、葡萄 糖等。
1.电离方程式的书写方法 (1)强酸、强碱、大部分盐书写时用“===”连接,如 HCl===H++Cl-、NaCl===Na+ +Cl-。 (2)酸式盐的电离方程式 ①强酸的酸式盐在水溶液中完全电离,如在水溶液中 NaHSO4 的电离方程式为 NaHSO4===Na++H++SO24-,熔融状态下 NaHSO4 的电离方程式为 NaHSO4===Na+ +HSO- 4 。 ②弱酸的酸式盐在水溶液中电离生成酸式酸根阴离子和阳离子,如 NaHCO3===Na++HCO- 3 。
第一章物质及其变化第二节第1课时 电解质的电离课件高一上学期人教版2019高中化学必修一

活动1:物质的导电性实验:
(1)烧杯中放入干燥的NaCl固体,烧杯中放入干燥的KNO3固体 (2)烧杯中放入的NaCl溶液,烧杯中放入KNO3溶液 (3)烧杯中放蒸馏水
思考1:盐酸能导电,盐酸是电解质吗? 盐酸是混合物,既不是电解质,也不 是非电解质。
思考2:纯醋酸在熔融状态下不导电,纯醋酸 是非电解质吗?
思考2:
(1)金属和电解质溶液都能导电,原因相同吗?
不同。金属导电依靠的是自由移动的电子,电解质溶液导电依靠的是 自由移动的阴阳离子。
(2)溶液的导电性强弱取决于哪些因素?
溶液的导电能力取决于离子浓度(主要)和离子所带电荷数(次要)。
(3)能够导电却不属于电解质的物质有哪些?
能够导电的物质中含有自由移动的电子或离子,但其不属于电解质,因此 不能为化合物,该物质可为金属单质、非金属单质(石墨)、电解质溶液等。
属于电解质,则为化合物;能导电,则有自由移动的离子,因此为熔融态的 离子化合物,如熔融态的氯化钠、硫酸铜、氢D )。
A.硫酸钡不溶于水,所以硫酸钡是非电解质 B.二氧化碳溶于水可以导电,所以二氧化碳是电解质 C.硫酸是电解质,所以硫酸在熔融态或溶于水时都能导电 D.液态氯化氢不导电,但氯化氢是电解质
常见溶液导电能力的比较
丈古夫之清 立万大里事,者谁,能不扫惟一有室超。世之材,亦必有坚忍不拨之志。 男不儿要不 志展气同高云大志,,倒空要负俯天就生卑八微尺的躯人。不要自以为聪明。 器男大儿者 不声展必同闳云,志志,高空者负意天必生远八。尺躯。 不桐要山志 万气里高丹大山,路倒,要雄俯风就清卑于微老的风人声。不要自以为聪明。 有雄志心登 壮山志顶是,茫无茫志黑站夜山中脚的。北斗星。 胸无无钱大 之志人,脚枉杆活硬一,世有。钱之人骨头酥。 鸟贫贵困有 能翼造,就人男贵子有气志概。 丈有夫志四 登海山志顶,万无里志犹站比山邻脚。 沧自海信可 是填成山功可的移第,一男秘儿诀志气当如斯。 人石若看有 纹志理,山万看事脉可,为人。看志气树看材。
人教版高中化学必修第一册精品课件 第一章 物质及其变化 第二节 第1课时 电解质的电离

学以致用•随堂检测全达标
1.(2021浙江1月等级考,3题改编)下列物质属于非电解质的是( C )
A.KOH
B.H3PO4
C.SO3
D.K2SO4
解析 KOH是碱,H3PO4是酸,K2SO4是盐,都属于电解质;SO3是非金属氧化物,
不能电解,属于非电解质。
2.(2021山东6月合格考)下列物质属于电解质的是( D )
阴离子是 酸根 离子的化合物
Na2CO3 等
教材阅读想一想阅读教材“一、电解质的电离”中的“思考与讨论”。 请写出NaOH、Ca(OH)2、Ba(OH)2的电离方程式。 提示 NaOH ══ Na++OH-、Ca(OH)2 ══ Ca2++2OH-、Ba(OH)2 ══ Ba2++2OH-
易错辨析判一判
②大多有机化合物(蔗糖、乙醇等)、部分非金属氧化物(CO2、SO2等) 、 部分非金属氢化物( 如NH3等)都是非电解质。
2.电解质的电离 (1)物质的导电性 ①氯化钠导电的原因分析
变化
导电原因及分析
NaCl固体 在 水分子 作用下,Na+和Cl-从NaCl固体的表面进入水中,形
溶于水 成能够自由移动的 水合钠离子 和 水合氯离子
解析 图示中 形成水合离子时,水分子中 H 原子朝向 ,而 H 带正电荷, 根据正、负电荷相互吸引的规律, 代表氯离子,A 正确;图 a 中干燥氯 化钠固体中 Na+、Cl-不能自由移动,故不能导电,B 正确;图 b 中熔融 NaCl 中 Na+、Cl-能自由移动,故能导电,C 正确;X 与电源正极相连,图 c 中带负电荷的水合氯离子向与电源正极相连的电极移动,D 错误。
新教材高中化学第1章物质及其变化第2节离子反应第1课时电解质的电离pptx课件新人教版必修第一册

(2)下列说法是否正确?请说明理由。
①电解质溶液导电是因为在通电条件下产生了离子。
②电解质只有在水中才能发生电离。
提示:(1)人的手上常沾有NaCl,有时也会沾有其他电解质,当
遇到水时,形成电解质溶液,即潮湿的手上含有的电解质溶液
中有自由移动的离子,可以导电,会引起触电事故。溶液导电
二 电离方程式的书写
重难归纳
1.电离方程式的书写要求。
(1)书写电离方程式必须以事实为依据,不能主观臆造,也不
能随意书写离子符号,离子所带电荷数必须等于该元素或原
解质
B.CO2的水溶液能导电,所以CO2是电解质
C.蔗糖、酒精在水溶液里和熔融状态下均不导电,所以它们
不是电解质
D.铜、石墨均导电,所以它们是电解质
答案:C
解析:CO2的水溶液能导电,并不是它自身电离的结果,而是
它与水反应的产物H2CO3电离的结果。电解质一定是化合物,
铜、石墨均不是电解质。
误区警示 (1)电解质不一定导电。电解质导电是有条件的,
( × )
课堂•重难突破
一 电解质
重难归纳
1.理解电解质的概念的“三个要点”。
三个要点 要点
化合物
正确理解
如铁丝、铜、石墨是单质,虽能导
电解质是化合
电,但不是电解质;
物,不是单质,
盐酸、氯化钠溶液虽能导电,但是
也不是混合物
混合物,不是电解质
三个要点
导电条件
导电本质
常见物质
要点
正确理解
液态HCl不导电,但溶于水可
Cl- 。
微思考Fe、Cu能导电,故Fe、Cu为电解质,这种说法对吗?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化合物
无机化合物 有机化合物
氧化物
酸
碱 盐
…...
甲烷
乙醇 乙酸
大多数有 机物
活泼金属 氧化物
电解质
非金属氧 化物 某些氢 化物
非电解质
一、电解质的电离
1、电解质与非电解质 例题
1、下列物质中,不属于电解质的是( A)
A.NH3 C.H2SO4
B.KOH D.Na2CO3
一、电解质的电离
1、电解质与非电解质 例题
NaOH、MgCl2、CH3COOH 、CO2、Na2O 石墨、Ag、NaOH溶液、KNO3固体、NH3、AgCl、硫
书写离子方程式注意: 1、符合客观事实; 2、符合两个守恒
练习:书写下列物质的电离方程式
H2SO4 HCl HBr HNO3 MgCl2 NaSO4
一、电解质的电离
2、电解质的电离 (3)从电离的角度认识酸、碱、盐
a、酸:
。
电离时生成的阳离子全部是氢 离子(H+)的化合物叫做酸
一、电解质的电离
第一章 物质及其变化
第二节 离子反应
(第一课时 电解质的电离)
gxq
2020年9月3日星期四
学习目标
1认识酸、碱、盐等电解质在水溶液中或熔融状态下 能发生电离
2能利用电离概念对常见的物质及变化进行分类 3、能用电离方程式表示某些酸、碱、盐的电离
知识回顾
1、酸的通性 2、碱的通性 3、盐的通性
2、电解质的电离
(3)从电离的角度认识酸、碱、盐
b、碱:
。
c、盐:
。
【思考与讨论】(1)请写出NaOH、Ca(OH)2、Ba(OH)2的 电离方程式。
(2)请结合以上电离方程式,并参考酸的本质 ,尝试从 电离的角度概括出碱的本质
一、电解质的电离
2、电解质的电离 (3)从电离的角度认识酸、碱、盐
一、电解质的电离
物质
现象 物质 现象
干燥氧化钠 固体
灯泡不亮 氧化钠溶液
灯泡亮
硝酸钾固体
灯泡不亮 硝酸钾溶液
灯泡亮
蒸馏水 灯泡不亮
1、电解质与非电解质的概念 (1)电解质:在水溶液里或熔融状态下能够导电
的化合物 。
(2)非电解质:在水溶液里和熔融状态下均不能 导电的化合物
一、电解质的电离
1、电解质与非电解质 【问题探究】
c、盐: 电离时能生成的金属离子和酸 根离子的化合物叫做碱
一、电解质的电离
问题探究 1、对于酸、碱、盐、活泼金属氧化几种电解质分别在
什么条件下发生电离?
酸碱盐溶入水都能电离;酸在熔融状态下不电离;碱、盐在熔融状态 下要根据其性质来判断;活泼金属氧化物只有在熔融状态下才能电离;
2、NaHSO4在水溶液和熔融状态电离有何区别?用电离方 程式表达
2、电解质的电离 例题
2、下列物质的电离方程式书写错误#43; OHB、CuCl2= Cu2+ + 2ClC、Fe2(SO4)3= Fe22+ + (SO4)32D、Ba(NO3)2 =Ba2+ + 2NO3-
作业
1、课本18页T1、T2
2、书面作业 1判断下列物质是电解质还是非电解质
NaHSO4=Na+ + H+ + SO42- NaHSO4=Na+ + HSO4-
3、纯H2SO4、液态HCl都是电解质,插入电极,接通电源 就能导电吗?电解质溶液的导电能力与什么有关?
不能导电;与溶液中离子的浓度及离子所带电荷多 少有关,离子浓度越大,离子所带电荷越多,溶液 导电能力越强
一、电解质的电离
一、电解质的电离
【实验1-2】 在三个烧杯中分别加入干燥的
NaCl固体、KNO3固体和蒸馏水, 如图1-9所示连接装置,将石墨电
极依次放入三个烧杯中,分别接通电源,观察并记 录现象。
取上述烧杯中的NaCl固体、KNO3固体各少许,分别 加入另外两个盛有蒸馏水的烧杯中,用玻璃搅拌, 使固体完全溶解形成溶液。如图1-9所示,将石墨电 极依次放入NaCl溶液、KNO3溶液中,分别接通电源, 观察并记录现象
B.Na D.SO2
一、电解质的电离
2、电解质的电离
为什么NaCl、 KNO3等电解质, 在干燥时不导 电,而溶于水 或熔化后却能
导电呢?
一、电解质的电离
2、电解质的电离 (1)电离的概念 电解质溶入水或受热熔化时,形成自由移动离子的过程
叫做电离 (2)电离方程式 用化学式和离子符号表示电解质电离过程的式子
3、CO2、NH3的水溶液能导电,那么CO2、NH3是电 解质吗?为什么?
4、盐酸能导电,液态金属铜也能导电,盐酸、金 属铜是电解质吗?
溶于水发生化学反应的化合物不一定是电解 质
电解质与非电解质都是化合物,单质混合物 既不是电解质也不是非电解质
一、电解质的电离
2、化合物的类别与电解质、非电解质的关系
NaOH === Na+ + OHCa(OH)2== Ca2+ + 2OHBa(OH)2 == Ba2+ + 2OH-
阴离子全部是OH-
一、电解质的电离
2、电解质的电离 (3)从电离的角度认识酸、碱、盐
a、酸: 电离时生成的阳离子。全部是氢 离子(H+)的化合物叫做酸
b、碱: 电离时生成的阴离子全部是氢 离子(OH-)的化合物叫做碱
2、电解质的电离 例题
1、下列关于电解质与导电关系的叙述正确的是(C)
A、NaCl溶液在电流作用下电离成Na+与Cl-
B、NaCl是电解质,故NaCl晶体能导电
C、氯化氢溶于水能导电,但液态氯化氢不能导电
D、导电性强的溶液里自由移动离子浓度一定比导电性 弱的溶液里自由移动离子浓度大
一、电解质的电离
1、BaSO4、AgCl的水溶液几乎不导电,故BaSO4、 AgCl为非电解质,对吗?为什么?
2、NaCl晶体、液态HCl不导电,它们是否都是非电解 质?电解质导电的条件是什么?
电解质在溶于水或熔融状态之一能导电就是电 解质;只有两种条件都不导电才是非电解质
一、电解质的电离
1、电解质与非电解质 【问题探究】
2.下列叙述正确的是( A)
A.氯化氢水溶液能导电,所以氯化氢是电解质 B.固体氯化钠不导电,所以氯化钠是非电解质 C.SO3溶液于水能导电,所以SO3是电解质 D.铜丝能导电,所以铜是电解质
一、电解质的电离
1、电解质与非电解质 例题
3.下列物质的水溶液能导电,但属于非电解质的是
( D)
A.CH3COOH C.NH4HCO3
