诺氟沙星壳聚糖微球的制备及表征
Fe3O4/壳聚糖纳米微球的制备与表征

包覆 , 产物 显示 出了非 常好 的 荧光性 能 , 并且 在外 加磁 场下 具有 明显 的磁 响应 行 为。
关键词 : 壳聚糖 ;e 原位 聚合 ; F ; 0 荧光性 能 ; 磁性 能
P e a ain a d C a a trz t n o e c i s n Na o p e e r p r t n h r ce iai f s h t a n s h r s o o F OJ o
中图分 类号 :B 3 T 3
文献 标识码 : A
文章编 号 :82 11 (0 00 —0 9言
壳 聚糖 (htsn是 甲壳 素 脱 乙 酰 化 反 应 生 ci a ) o 成 的一 种线 性聚 合 物 ,也 是生 物 界存 在 的唯 一 的
ZHANG e — n, W ANG e , ZHANG i u W n we W i Zh -k n
( ig a n es yo c n ea dT cn lg , Qn do 2 6 4 , C ia Q n doU i r t f i c n eh ooy ig a 6 0 2 hn ) v i S e
u e xe irma nei il . nd re tro g t fe d c Ke ywor s ht s n; 3 ;n i oy e iain;l o e c n o e te ; g e i r pe is d :c io a Fe04 i—st p lm rz t u o fu r s e tpr p ris ma n tc p o r e t
COS l kn e cin n eO c i s nn n s h rss o b t x eln u rse tpo ete n g ei ep ne RS—i igra t ,a d F s d ht a a op ee h w oh e c l t oec n rp r sa dma n t rs o s n o o e f l i c
一种壳聚糖微球的制备方法与流程

一种壳聚糖微球的制备方法与流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!壳聚糖微球的制备方法与流程。
一、材料。
壳聚糖粉末。
乙酸溶液 (2%, v/v)。
壳聚糖微球 制备

壳聚糖微球制备
壳聚糖微球的制备方法有多种,以下是其中一种常用的方法:
1. 首先将壳聚糖溶解在酸性溶液中,调节pH值至2-4之间。
2. 然后加入一定量的乳化剂(如十二烷基硫酸钠),并充分搅拌使乳化剂均匀分布在溶液中。
3. 接着将油相(如大豆油)缓慢滴加到水相中,同时不断搅拌,形成微小的油滴。
4. 将上述混合物加热至70-90°C,保持一段时间,使油滴内部的水分蒸发出来,形成空心结构。
5. 最后通过过滤、洗涤等步骤去除未反应的物质和杂质,得到纯净的壳聚糖微球。
需要注意的是,在制备过程中需要控制好各种参数,如pH值、乳化剂用量、温度等,以确保微球的大小、形状和分布均匀性符合要求。
壳聚糖球形多孔微载体的制备和表征

壳聚糖球形多孔微载体的制备和表征张瑞1,韩宝三2,彭承宏2(1.内蒙古医学院附属医院肿瘤外科,内蒙古呼和浩特010050;2.上海交通大学医学院附属瑞金医院器官移植中心)摘要:目的:制备和研究一种新的体外三维环境下肝细胞黏附培养的微载体支架-壳聚糖球形多孔微载体。
方法:利用壳聚糖为基本材料,以2%乙酸为溶剂,采用液氮冷冻干燥技术制备壳聚糖球形多孔微载体,采用光学显微镜、扫描电子显微镜等仪器和方法对其形态结构及理化性质进行表征。
结果:本研究成功地制备出壳聚糖球形多孔微载体,成球率>90%,内外多孔且相互连通,孔径在20 80μm之间,具有一定的密度、弹性、溶胀性、亲和性和形态结构,并具有良好的机械强度、稳定性和较大的比表面积。
结论:本研究制备的壳聚糖球形多孔微载体为以其作为支架来进行肝细胞体外三维环境下的培养提供了一定的理论和实验依据。
关键词:微载体;多孔;壳聚糖;细胞培养中图分类号:R730.43文献标识码:A文章编号:1004-2113(2011)01-0018-07PREPARATION AND CHARACTERIZATION OF SPHERICAL POROUS CHITOSAN MICROCARRIERZHANG Rui,HAN Bao-san,PENG Cheng-hong(Department of Tumor Surgery,Affiliated Hospital,Inner Mongolia Medical College,Hohhot010050China)Abstract:Objective:To prepare and study a new microcarrier support named spherical porous ch-itosan microcarrier,for hepatocyte adhesion culture in three-dimensional environment in vitro.Meth-ods:The microcarrier with chitosan as the material and2%peracetic acid as solvent was prepared by the liquid nitrogen freeze-drying technology.The optical microscope,scanning electron microscopy and other methods were used to characterize its morphous,physical and chemical properties.Results:The spherical porous chitosan microcarrier was successfully prepared in the project.Further more,the ball-rate was more than90%.The porosity was occupied inside and outside of the microcarrier and interconnected.The pore size ranged from20μm to80μm..The microcarrier not only has a certain degree of density,elasticity,swelling,and affinity and morphology structure.but also has good me-chanical strength,stability,and larger specific surface area.Conclusion:Spherical porous chitosan收稿日期:2010-10-10;修回日期:2010-12-08基金项目:国家高新技术研究发展计划-“863”研究项目(2007AA02Z487);国家自然科学基金项目3项(20074031,30672043和30772105)作者简介:张瑞(1972-),男,内蒙古医学院附属医院肿瘤外科副主任医师。
壳聚糖微球的制备研究

实施。
在由靛红经靛红232肟最终热解制备邻氨基苯甲腈的两步反应中不难看出,两步反应的前后变化主要是溶剂的有无和反应温度的差异,从理论上说,该制备可以用一锅法加以实施。
显而易见,第一步缩合时的溶剂水是不利于第二步热分解反应的进行的,为此中间产物靛红232肟的除水和干燥就显得尤为重要。
至于稍过量的盐酸羟胺将随溶剂的除去而充分除去,微量残留并不影响靛红232肟的热分解反应的进行。
靛红与盐酸羟胺缩合时采用的溶剂为水,缩合完成后易于除去,留下的固体可在温热和真空条件下充分干燥。
靛红232肟不经处理,直接用于下步反应,研究表明,这样的做法是可行的。
为了实施前述两个目的,本文选用同时添加催化剂和高沸点有机溶剂的方法,达到了相当理想的结果。
本文选用甲醇钠为催化剂,添加甲醇钠后可使热分解温度由原来的224°C降低到165~180°C。
在选用高沸点有机溶剂时研究发现:卤代苯、硝基甲苯、煤油、聚乙烯醇等均存在不足,且可行的产物收率很低,实用价值不高。
本文选用水溶性好,易于除去且对人体危害不大的环丁砜作为热分解溶剂,充分满足了设计要求。
催化剂的添加量为靛红的0.005~0.05倍,溶剂为0.05~5倍。
考虑到成本及后处理的难易,最终选定为靛红∶甲醇钠∶环丁砜为1∶0.01∶0.5 (摩尔比),由此制得的邻氨基苯甲腈的收率可维持在80%以上。
热解温度达到靛红232肟的起始分解温度(165°C)时必须暂时撤去热源,避免反应过分剧烈,不易控制。
热分解完成后可以用减压蒸镏,收集成品,但产物易于在镏出通路凝固,造成堵塞,故本文选用化学处理。
热分解完成后的混合液经水和丙酮处理,可使催化剂,溶剂和热分解残渣充分除去,最终得到相对较纯的产品。
参考文献1 L itvishkov Y M,et al.Ger O ffen,1979:2810 8562 L itvishkev Y M.U SSR1980:7874063 A ro ra,P K,Sayre L M.T etrahedron L ett, 1991;32(8):10074 Bakke J M,H eikm ann H K Ger O ffen1971:2 1251325 Bakke J M.Ger O ffen1972:20956845 Bedfo rd G R,Partridge M W.J Chem Soc, 1959:1633修稿日期:1998.9.28壳聚糖微球的制备研究3丁 明 施建军 皇甫立霞 高建锋(合肥联合大学化工系 合肥230022)摘 要 利用液体石蜡作有机分散介质,甲醛、戊二醛作交联剂,通过反相悬液交联法制备了微米级窄分布壳聚糖微球,对合成最佳条件进行了实验选择,并对产物的形态、红外光谱特性及吸附行为进行了初步表征。
壳聚糖微球的制备及研究开题报告doc

壳聚糖微球的制备及研究-开题报告.doc壳聚糖微球是一种具有广泛应用潜力的功能性材料,其制备和研究引起了广泛的关注。
本开题报告将介绍壳聚糖微球的制备方法以及其在不同领域中的应用研究。
一、壳聚糖微球的制备方法目前,壳聚糖微球的制备方法主要包括溶液滴定、水相乳液聚合、胶体颗粒模板法等。
其中,溶液滴定法是最常用的一种方法。
该方法的步骤如下:首先,将壳聚糖溶液加入到碱性溶液中,并通过机械搅拌使溶液均匀混合;然后,利用滴定装置将酸性溶液滴入碱性溶液中,形成壳聚糖微球;最后,将得到的壳聚糖微球进行洗涤和干燥处理。
二、壳聚糖微球的应用研究壳聚糖微球在药物传递、生物传感、环境修复等领域具有广泛的应用价值。
1. 药物传递:壳聚糖微球可以作为药物的载体,通过调控微球的粒径和表面性质,将药物包埋或吸附在微球表面,实现药物的缓释和靶向释放,提高药物的疗效和减少副作用。
2. 生物传感:壳聚糖微球可以通过改变微球的形貌和结构,实现对生物分子的选择性识别和检测。
例如,将特定的生物分子固定在壳聚糖微球表面,可以用于生物传感器的构建,用于检测生物分子的浓度和活性。
3. 环境修复:壳聚糖微球可以作为吸附剂,吸附和去除水中的有机污染物和重金属离子。
此外,壳聚糖微球还可以作为载体,封装微生物和酶,实现对有机污染物的降解和去除。
三、研究目标和意义目前,壳聚糖微球的制备方法和应用研究还存在一些问题和挑战。
首先,现有的制备方法中,微球的尺寸和形貌控制不够精确;其次,壳聚糖微球的稳定性和生物相容性有待提高;此外,壳聚糖微球的应用研究还存在一些技术难题,如如何实现药物的靶向释放和环境修复效果的提高等。
因此,本研究的目标是改进壳聚糖微球的制备方法,实现对微球的粒径和形貌的精确控制;同时,研究壳聚糖微球的稳定性和生物相容性,并探索其在药物传递和环境修复等领域中的应用潜力。
通过实验研究和理论分析,探索壳聚糖微球的制备和应用的新方法和新途径,为其在生物医学、环境科学等领域的应用提供理论和实验基础。
壳聚糖微球的制备及表征

与 知识创新
壳聚糖微球的制备及表征
□
(汉中职业技术学院 摘
纪建华
陕西・汉中 723000)
要: 用来源丰富且廉价, 并具有许多优良生物特性的壳聚糖为原料,把它配成质量分数为 10%的溶液通过
乳液法与戊二醛交联合成壳聚糖微球。 用光学显微镜、 红外光光谱仪对合成的高分子微球进行形貌观察和结构 表征。 关键词:壳聚糖 中图分类号:Q53 微球 制备 表征 文章编号:1007-3973(2011)008-102-02 文献标识码:A
乙酸乙酯溶液 5ml , 反应 3h 后, 加入无水乙醇 200ml 陈化 4h, 超速离心分离,沉淀用无水乙醇洗涤 3 次后,得壳聚糖微球(cm), 将微球分散于无水乙醇中备用。壳聚糖微球的表征应用扫描 电镜观察所制备的微球的表面形貌,所制备的壳聚糖微球的 球形良好,加入交联剂的壳聚糖微球表面有明显的沟壑。应 用扫描电镜测量所制备微球的直径,所得微球的平均直径为 (108±56) m, 微球的范围控制在 50 ~ 180 m。 4 结果与讨论影响壳聚糖成球质量因素 (1) 壳聚糖溶液的浓度的影响壳聚糖溶液浓度过高, 则溶 液粘度较大, 不宜分散, 制得的球较大、 不均匀且机械强度差; 壳聚糖溶液浓度过低, 也不能形成很好的球, 且球的机械强度 差。 通过实验对比发现: 使用 1.6%的壳聚糖溶液, 能形成很好 的球, 粒度均匀, 机械强度高。 (2) O/W 比率影响壳聚糖溶液的分散效果, 对粒径有较大 影响。O/W 比率越高则分散效果越好, 液滴的粒径较小, 且粒 径分布较窄; O/W 比率太低则分散效果差, 粒径较大, 且粒径 分布较宽。实验表明: O/W 比率为 1/1 时, 制得的液滴粒径及 分布最好, 但分离难度较大。 (3) 醛基与氨基的比例在反应的聚合过程中, 加入的戊二 醛试剂实际只有一部分参与反应能进入壳聚糖珠体内;由于 当其分子中的一个醛基与壳聚糖分子中的氨基反应后,壳聚 糖大分子的运动与缠绕,会造成某些氨基由于空间位置的原 因无法与戊二醛的另一个醛基反应, 形成“悬挂醛基” 。这样 形成的树脂结构相对松散,有较大的溶胀度和含水量。经对 比实验得出, 聚合时醛基与氨基的比例为 4/1, 可得到理想的 树脂。 (4) 戊二醛浓度的影响戊二醛是一种常用的交联剂, 两个 醛剂很活泼, 与壳聚糖中的氨基反应生成 Schiff 碱。若一 6% 的戊二醛作交联剂, 由于浓度低, 交联度低, 机械强度差, 不能 得到十分规整的球; 50%的戊二醛作交联剂, 以 浓度过高, 在 树脂表面生成致密结构, 阻碍戊二醛向树脂内部渗透, 使交联 结够不均匀, 机械强度不好。而且。随着交联剂浓度的增大, 交联度随之增大,树脂颜色也随之加深。这是因为交联度越 大, 树脂的结构越紧密。 实验表明: 25%的戊二醛作交联剂, 可 得到较好表面结构较好得树脂。 (5) 搅拌速度对成球性能的影响, 在制备过程中, 液滴与 分散介质间的界面张力和搅拌机的剪切力对成球的作用影响 相反。在一定的界面张力和搅拌强度下,液滴会通过分散和 合并的一系列过程, 达到一定的动态平衡, 最后达到一个平均 粒度, 但液滴大小仍存在一定得分布, 因为在制备过程中液滴 受到的搅拌强度是不均匀的。当搅拌速度提高时,所得的平 均粒经减小, 粒经分布变窄, 但成球率有所提高。这表明搅拌 速度的提高导致分散在介质中的壳聚糖小液滴粒经变小,比 表面积增大, 液滴数目增多。 (6)脱乙酰度对成球质量的影响 脱乙酰度太高,粘度太 大, 致使分散效果极差, 成球情况也不理想。经过对比实验可 知: 脱乙酰度在 80—85%最为理想。
(09综合实验)壳聚糖微球的制备

壳聚糖微球固定木瓜蛋白酶的研究1 壳聚糖微球的制备壳聚糖属多糖类物质,是一种生物相容性好、无毒、廉价易得的天然高分子生物材料。
壳聚糖易于进行化学改性,引入新的功能团,尤其是壳聚糖分子中含有游离的氨基,通过化学交联剂(戊二醛)很容易与酶发生间接共价结合,使酶牢固地固定在壳聚糖分子上。
因此,壳聚糖是一类性能优良的酶固定化载体。
壳聚糖在酸性条件下溶解、碱性条件下沉淀,在较低浓度的NaOH溶液中,壳聚糖微球在还未完全沉淀成球以前就己经塌陷,壳聚糖分子堆砌在一起,导致所成微球形态不好、强度较差、表面厚度不均一、凸凹不平、不能形成良好的结构。
随着NaOH浓度的增加,壳聚糖微球迅速成形,容易形成厚度均一、形态较好、韧性好的微球,此时微球表面被撑起,呈现出壳聚糖自身的疏松多孔结构。
不过当其浓度达到20%,又不能成球,因为浓度太高来不及成球就己经粘连在一起,形成一片絮状物。
所以适宜的NaOH浓度范围为7.5-15%。
在NaOH溶液中加入乙醇后形成的壳聚糖微球更加圆润,而且随着溶液中乙醇含量的增加,壳聚糖微球的机械强度得到了加强,韧性越来越好,但当乙醇浓度达到50%时,球表面产生了很多气泡,微球悬浮在溶液中,不利于操作。
故选取2.0%壳聚糖滴入10%NaOH:乙醇=4:1的溶液中为较好的成球条件。
壳聚糖2.0g 溶于100mL、1.0%乙酸溶液中((20℃条件下)充分溶解,将壳聚糖溶液逐滴滴入250mL混合液(10.0% NaOH与95%乙醇,体积比为4:1),得粒度均匀、形状规整的壳聚糖微球,过滤收集壳聚糖微球,再用蒸馏水洗涤至中性,湿态保存。
2 壳聚糖微球的交联:将1.0g壳聚糖微球置于100mL蒸馏水中,加入一定体积(0.6、1.0、1.4mL)的25%戊二醛,30℃下恒温振荡 2.0 hr,用大量水反复洗涤,以去除残留的戊二醛溶液,即得壳聚糖微球载体。
3 木瓜蛋白酶的固定化称取上述壳聚糖微球载体,加入10mL的0.lmol/L磷酸缓冲溶液(pH = 6.0、7.0、8.0)和10mL木瓜蛋白酶溶液(浓度为:0.5、1.0、1.5mg.mL-1),30℃下恒温振荡一定时间(3.0、4.0、5.0 hr)。
壳聚糖药物微球的制备及应用进展

壳聚糖药物微球的制备及应用进展摘要】壳聚糖由于具有良好的理化性质,在微球的制备中被广泛应用。
本文综述了近两年来壳聚糖药物微球的制备及应用进展,并探讨了影响微球质量的因素。
【关键词】壳聚糖制备应用【中图分类号】R931.4 【文献标识码】A 【文章编号】2095-1752(2011)24-0076-02壳聚糖(chitosan)是一种天然高分子多聚糖,在体内溶胀成水凝胶后可被很好的生物降解,由于其具有良好的成膜性和黏附性,无毒,无抗原性,能溶于酸或酸性水溶液,被广泛应用于微球的制备。
壳聚糖药物微球的制备方法一般有乳化-化学交联法,喷雾干燥法,离子交联法,沉淀/凝聚法等多种方法。
1 壳聚糖微球的制备1.1乳化-化学交联法是将药物、乳化剂和壳聚糖混合搅拌乳化制成乳状液,在复乳体系中,通过引入制孔剂,制备壳聚糖多孔微球,以此提高壳聚糖微球的比表面积和吸附性能,并逐步滴加入交联剂,减压过滤后用不同溶剂洗涤,冷冻干燥后得壳聚糖多孔微球的一种方法。
易兵鸿[1]等制备5-氟脲嘧啶壳聚糖缓释微球,采用戊二醛作为交联剂,结果药物则固定于微球骨架或结合于表面,通过体外累计释药率的比较表明,所制微球具有缓释性和药物突释效应。
方志文[2]等以壳聚糖为分散介质, 选用戊二醛为交联固化剂,采用乳化交联法制备盐酸丙米嗪壳聚糖微球,所制微球外观均匀圆整,分散性良好,粒径分布均匀。
1.2 喷雾干燥法是将药物溶于壳聚糖制成溶液,经喷嘴喷入干燥室内,其雾滴中的水分被送入干燥室的热空气快速蒸发而干燥制备微球的一种方法。
该法具有操作简便、条件温和、微粒体形成速度快等特点,便大量生产,目前是微粒体制备工业化最有希望的方法之一。
在制备过程中需要注意的是混合液的粘度、均匀性、喷雾速率及干燥速率等。
为了减少微球间的粘连常可加入抗粘剂,如滑石粉、硬脂酸镁及二氧化硅等。
赵国巍等[3]以壳聚糖、丙烯酸树脂为载体材料, 采用喷雾干燥法制备三七皂苷缓释微球,所制三七皂苷缓释微球的外观圆整, 平均粒径为11.80μm,包封率70.4%,载药量9.1%,在磷酸缓冲液中三七皂苷12h释放缓慢、平稳,具有很好的缓释效果。
壳聚糖微球的制备研究

5 使 壳 聚 糖 和 高分 于微 球 的 功 能性 相 复 合 可使 其 在 生物 医 学 领 域得 到 更大 的 应 用 〔
, ,
7
]。
目前
对 壳 聚 糖微 球的 制备 及 性 能 研 究 不 多 易琼 等 人 制 备 了 壳 聚 糖 吸 附剂 但 成 球 及 单 分 散 性 不
佳阁
。
张 所信 制备 了毫 米 级 实心 及 中 空 壳 聚糖球 粒 并 用 于
, 。
pH
为 9
,
0 升温 至 8
℃
。
进一 步 反 应 h l 最后 于
过 滤 用 煤 油 充分洗 涤 再 用 无 水 乙 醇 于
索 氏 提 取 器 中抽 提 除去 残 留 有 机 物
2
.
8 0 ℃ 烘箱
中干燥 将 产 物 轻研 成 均 匀 粉 末
。
,
3
பைடு நூலகம்性 能测 定
H
一
用 日本 5 7
。
0 型 扫 描 电镜观 察 微 球 粒子 大 小 和 外 观 形 貌 8 的表 面 化学 结 构
2 2
.
;
CP
级
;煤
油及 3 0
透 平 油 工 业 级 聚 乙 烯醇
AR
级
。
实验 方法
3 % 乙 酸 溶 液置 于 s o m l
,
取适 量 一 定 浓 度 的 壳 聚 糖
、 、
三
口
烧瓶 中 然 后 分 别 加 入 油 相 分 散
,
介质 致 孔 剂 乙 酸 乙 醋 乳 化 剂 及 高 分 子表 面 改 性 剂 在 5 0 ℃ 下 充 分 搅拌 使 反 应 体 系 呈 乳 液
诺氟沙星-壳聚糖微球的制备及释药性能

诺氟沙星-壳聚糖微球的制备及释药性能薛昌刚;童春义;肖苏尧;王贝;俞丹密;唐冬英;刘选明【期刊名称】《中南大学学报(自然科学版)》【年(卷),期】2008(039)003【摘要】利用乳液-化学交联法,用水溶性壳聚糖(CS)与诺氟沙星(NFX)制备诺氟沙星-壳聚糖微球(NFX-CSM).根据正交实验设计,考察投料比、交联剂用量、转速和反应温度对质量指标的影响,选出最佳制备工艺条件;利用扫描电镜,红外光谱和Zeta电位仪对载药微球进行表征;用药物溶出度仪检测NFX-CSM在不同pH值环境下的释药速率,并考察不同交联剂用量和投料比((m(CS):m(NFX))所制备的载药微球对释药速率的影响;将大肠杆菌与NFX-CSM共培养,检测载药微球的抗菌效果.研究结果表明:在最佳制备工艺条件下,制得载药微球的平均粒径约为4 μm,球形圆整,分散性好,载药量和包封率分别为4.9%和42.3%;载药微球在不同pH值环境下均对药物有良好的缓释效果,其释药速率随交联剂用量的增加和投料比的增大而变小;NFX在CSM的协同抗菌作用下,抗菌效果明显增强.【总页数】6页(P480-485)【作者】薛昌刚;童春义;肖苏尧;王贝;俞丹密;唐冬英;刘选明【作者单位】湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082;湖南大学,生命科学与技术研究院,化学生物传感与计量学国家重点实验室,湖南,长沙,410082【正文语种】中文【中图分类】O636.1;R978.1【相关文献】1.载三氧化二砷壳聚糖微球的制备、表征及释药性能 [J], 张亮;王靖;刘昌胜;黄晓春;陈统一2.Fe3 O4/羧甲基壳聚糖磁性载药微球的制备及释药性能 [J], 韩利华;赵由春;高扬;陈春江;王家喜;尚宏周3.盐酸海地芬-壳聚糖微球的制备及其释药性能 [J], 蒋林斌;易志远;宁春园;杨华;张淑琼4.拉米夫定-海藻酸钠/壳聚糖核壳结构微球的制备及释药性能 [J], 谢博媛;李国明;刘聪;严冠彦;黄克钧5.金雀异黄素/壳聚糖微球的制备及其释药性能 [J], 冯淑莹;李国明;侯琼;石光因版权原因,仅展示原文概要,查看原文内容请购买。
壳聚糖载药微球的制备和体外释放研究

壳聚糖载药微球的制备和体外释放研究罗华丽;臧剑甬;张秀娟【摘要】以壳聚糖(CS)和盐酸左氧氟沙星(LVFX)为原料,通过乳化交联法制备CS 载药微球,应用显微镜、扫描电镜考察载药微球微观形态,建立恒温恒速流动药物溶出系统检测微球中药物体外释放特性和影响因素.结果发现:微球理化特性受壳聚糖脱乙酰度、壳聚糖醋酸溶液浓度、交联剂用量等工艺条件影响,微球载药量与壳聚糖降解程度、CS与LVDX配比等因素有关,所制得载药微球体外药物缓释性能良好.%Using Chitosan and Levofloxacin,Chitosan microsphere is prepared by crosslinking emulsification process, and the physical and chemic property of Chitosan microsphere is examined through such equipments as microscopy and SEM, and the drug releasing system with constant temperature and velocity has been established in order to test drug-releasing property and factors. The results have been discovered that the physical and chemic property of microsphere depends on such factors as acetic acid concentration, the degree of deacetylation of Chitosan, Chitoan concentration,crosslink reagent dosage and so on and the drug-loaded content is influenced by such factors as Chitosan degradable degree and the ratio of CS/LVFX, and the drug-releasing property in vito is good.【期刊名称】《河南科学》【年(卷),期】2011(029)001【总页数】5页(P20-24)【关键词】壳聚糖;盐酸左氧氟沙星;微球;缓释【作者】罗华丽;臧剑甬;张秀娟【作者单位】烟台职业学院,食品与生化工程系,山东,烟台,264670;烟台职业学院,食品与生化工程系,山东,烟台,264670;烟台职业学院,食品与生化工程系,山东,烟台,264670【正文语种】中文【中图分类】O621壳聚糖(Chitosan,简称CS)又称可溶性甲壳质、甲壳胺或几丁聚糖,是自然界唯一碱性多糖,无毒且具有体内生物降解性和生物相容性[1],化学名为(1,4)-2-氨基-2-脱氧-β-D-葡萄糖,结构类似纤维素,如下图所示:盐酸左氧氟沙星(Levofloxacin,简称LVFX)是第三代氟诺酮类广谱抗菌药,作用于细菌DNA旋转酶,对大多数革兰氏阴性菌均有较强的抗菌活性,适用于上下呼吸道感染症、上下尿路感染症、肠道感染症、皮肤软组织感染症及外科和五官科等领域的感染均有效,且不良反应低.目前,LVFX只开发出片剂和针剂,由于盐酸左氧氟沙星生物半衰期小于6小时,体内血药浓度变化幅度较大,体内生物利用率度较低[2-3].壳聚糖缓释盐酸左氧氟沙星微球在维持血药浓度水平,减少给药次数,降低药物毒性,提高药物疗效等方面具有重要作用,为临床治疗提供了一种新剂型.本文采用乳化交联法合成壳聚糖载药盐酸左氧氟沙星微球,考察原材料、合成工艺等对微球制备工艺,并对微球载药性能进行了评价.1.1 实验材料及仪器CS(济南海得贝海洋生物工程有限公司,脱乙酰度85%、90%和95%,水溶性壳聚糖,壳寡糖);盐酸左氧氟沙星(原药,浙江京新药业股份有限公司);液体石蜡、异丙醇、石油醚(分析纯,天津天大化工实验厂);戊二醛(glutaraldehyde,简称GL,50%溶液,天津科密欧化学试剂开发中心);Span80(国药集团化学试剂有限公司);电磁搅拌器(85-2,巩义市英峪予华仪器厂);恒温电磁搅拌器(DF-101S,巩义市英峪予华仪器厂);热式偏光显微镜(Olympus BX51,自然光路下观察);扫描电镜(SEM,S2250,英国剑桥);紫外分光光度计(UV-4100,优尼柯上海有限公司);药物溶出仪(黄海仪器厂)等.1.2 未载药微球的制备将适量的液体石蜡与Span80搅匀,按一定比例加入CS醋酸溶液,在室温下经电磁搅拌成为稳定的乳化体系,随后添加一定量的戊二醛交联固化,反应完全后分别用异丙醇和石油醚洗涤,离心分离后用微孔过滤器过滤,即得浅黄色微球.1.3 载药微球的制备将LVFX按一定比例加入到CS醋酸溶液中搅匀后,用注射器滴加到液体石蜡与Span80混合体系中,经搅拌成为稳定的乳化体系,随后加入一定量的戊二醛交联固化,反应完全后用异丙醇和石油醚洗涤,离心分离后用微孔过滤器过滤,即得颜色较深的载药微球.1.4 微球载药量的测定称取一定量的载药微球,加入到100 mL 0.1 mol/L盐酸中,水浴60℃,剧烈搅拌6 h以上.经微孔过滤器过滤得续滤液,取续滤液5 mL定容至50 mL容量瓶中,使用紫外分光光度计在293 nm处测定吸光度.根据LVFX的标准曲线,计算LVFX 的浓度及含量.1.5 显微镜观察取一定乳液中的微球和干燥后的微球,分别用热式偏光显微镜在自然光路下观察微球的形态,并根据标尺量取粒径及统计出粒径分布.热式偏光显微镜,自然光路不加热时观察,利用显微镜自带标尺对微球直径进行测量,微球粒径计算样本至少200个,参照下述公式(Di单个微球粒径,n微球个数)计算平均粒径D,DP表示分散度[4].1.6 扫描电镜(SEM)测定将样品均匀撒在样品平台上,用导电胶固定后溅金,置于样品平台上进行观察.1.7 体外释放用转篮法[5]测定载药微球药物溶出曲线.具体操作:称取一定量载药微球于转篮内,水浴37±0.5℃,转速50 r·min-1. 溶出介质在 2 h 内是人工胃液,在 2~12 h为人工肠液. 在 1,2,4,6,8,10,12 小时分别取样1 mL,并同时补加同体积的同种溶出介质,定容至50 mL,于293 nm处测定其紫外吸光度A,由标准曲线计算累计溶出百分率.2.1 CS载药微球制备工艺优化2.1.1 壳聚糖脱乙酰度优化采用脱乙酰度85%,90%和95%壳聚糖制备未载药微球,由表1可见,随着脱乙酰度增大,壳聚糖分子链上氨基增多,在醋酸溶液中形成的聚电解质分子主链上带正电荷的铵离子较多,使壳聚糖分子内和分子间氢键解离更多,易溶于水.聚电解质分子链上亲水离子越多,乳液液滴和连续介质之间界面张力越小,同等分散条件下所得乳液液滴粒径越小.如表1所示,95%脱乙酰度壳聚糖微球平均粒径50.1 μm且分散度0.40,相对85%和90%壳聚糖所制得微球,平均粒径较小且更均匀.考虑到95%和90%脱乙酰度壳聚糖所制备微球平均粒径和分散度相差不大,从节约成本角度考虑,本研究选择90%脱乙酰度壳聚糖作为载药基材.2.1.2 壳聚糖醋酸浓度优化分别配制质量浓度为0.1、0.2、0.3 和0.4 g·L-1壳聚糖醋酸溶液,由图 1 可见质量浓度0.3 g·L-1壳聚糖醋酸溶液制得微球圆整,大小适中,粒径分布较均匀.由表2可知,鉴于反应速度、产量、粒径大小和分散度等因素,为得到粒径适当、分布均匀且产量较多的壳聚糖微球,确定壳聚糖醋酸溶液质量浓度0.3 g·L-1.2.1.3 Span80乳化剂用量优化液体石蜡体积20 mL,乳化剂用量分别按照液体石蜡体积4%、6%和8%制备壳聚糖微球.由表3可见,随着Span80用量增加,微球粒径逐渐减小且粒径分布较窄.这是因为Span80可降低体系表面张力,在一定外力分散作功下,表面张力越小所形成微球数越多,且微球粒径越小.所以,优选Span80为油相体积的8%.2.1.4 油水相体积比优化油相(O)与水相(W)体积比(简油水比)及油相粘度,是影响乳液稳定性的重要因素.分别采用油/水比为1、2/1和3/1,液体石蜡为油相,0.3 g·L-1壳聚糖醋酸溶液为水相,制备CS微球.如表4所示,油水比3/1时制备微球为佳,平均粒径为(123.1±4.0)μm,分散度0.50.2.1.5 交联时间优化保持其他条件不变,调节交联反应时间为 0.5、1.0、2.0 和3.0 hr,分别制备未载药微球.由表5可见,交联时间短时微球成球性变差,时间过长则粒径分布变大.这是由于壳聚糖氨基与戊二醛醛基交联需一定时间,交联反应发生完毕后再延长时间,会有粒子间交联聚并使得微球粒径分散度变大,优选交联时间1.0 hr.2.1.6 LVFX/CS质量比优化由SEM图片(图2)观察载药微球,可以看到载药微球表面有许多微孔,随着LVFX/CS质量比的加大,微球表面也被药物所覆盖且载药量大大提高(图3).可见改变LVFX/CS质量比是有效提高载药量的方式之一.分别按LVFX/CS质量比为1/1.5,1/1,1.5/1,2/1,3/1来制备微球进行载药量的测定.LVFX/CS质量比为3/1时载药量最大为17%,是LVFX/CS质量比为1/1.5时载药量2.7%的6.3倍,优选LVFX/CS质量比为3/1.综上,CS载药微球工艺主要参数为:90%脱乙酰度壳聚糖、壳聚糖醋酸质量浓度0.3 g·L-1,Span80为油相体积的8%,油水相体积比3/1,交联时间1 hr,LVFX/CS质量比为3/1.2.2 改性壳聚糖载药微球水解、氧化降解时间优化使用20%体积比浓度的醋酸溶液配置3%的壳聚糖醋酸溶液,放入60℃水浴中水解3 h、6 h和12 h,制备壳聚糖载药微球,结果发现其载药量依次为8.6%,16.0%,6.9%,即载药量在水解6 h时达到最大,而水解时间越长反而载药量降低.配制100 mL含有1 mL浓盐酸,2.5 mL 3%H2O2的CS醋酸溶液,放置数小时进行氧化降解.分别用氧化降解3 h、6 h、12 h和24 h的CS醋酸溶液,LVFX/CS比为3/1制备壳聚糖载药微球.进行紫外吸光度测定并根据标准曲线计算其载药量依次为5.6%、8.8%、12.1%和9.9%,即氧化降解12 h时载药量达到最大,同样氧降时间增长反而载药量降低.最终确定制备改性壳聚糖载药微球,优选水解时间为6 h或者氧化降解时间为12h.2.3 载药微球的体外释放曲线采用LVFX/CS比为1.7/1来制备水解改性壳聚糖载药微球,其药物释放曲线(图5)与置于透析袋中LVFX纯品的胃液溶出曲线(图4)对比:载药微球在人工胃液中1 h时药物累计释放率达到35%,在1 h至2 h,仅释放了总药量的2%;在人工肠液中2 h至4 h内释放了总药量的15%左右,药物的释放速度有所减慢,到12 h体外溶出累计释放度仅达52%,适于作缓释给药;在人工胃液中释放曲线斜率高于在人工肠液中释放曲线斜率,说明LVFX在胃液中释放速度快于在肠液中释放速率.3.1 CS载药微球缓释机制[6]CS微球对LVFX缓释作用首先是因为延缓模型药物的溶解,微球的溶胀是一个从外到内的过程,因而药物的溶解和释放也是从外到内的进行.其次,CS微球同时会抑制药物在微球中扩散,由于LVFX与CS缓释基材间存在的电荷作用、范德华力、氢键等相互作用,使得LVFX在微球中的扩散速度减慢.3.2 水解、氧化降解改性壳聚糖载药微球探究经水解6 h或氧化降解12 h的壳聚糖载药微球的载药量远高于水解或氧化降解时间更短或更长的壳聚糖载药微球的载药量.这是由于更短时间的水解或氧化降解改性壳聚糖的空间结构紧密,不利于LVFX在微球中的扩散、包载药物不充分从而载药量不大;而过长时间的水解、降解作用,又使得壳聚糖分子链被打断得过于严重,微球结构过于疏松而无法负载大量的药物,使得载药量下降,同时表现出药物释放速度加快,缓释作用相对降低.综上所述,CS载药微球的制备工艺参数宜为:水解时间6 h或氧化降解时间12 h 的脱乙酰度90%壳聚糖、壳聚糖醋酸质量浓度0.3 g·L-1,乳化剂占液体石蜡体积的8%,油水体积比3/1,LVFX/CS质量比3/1,在室温25℃条件下,经中速搅拌,交联反应1 h,可制备粒径分布较窄的CS载药微球,其载药量达17%,药物缓释曲线较好.【相关文献】[1]徐榕青,郑梅,王诤毓,等.壳聚糖的初步稳定性研究[J].海峡药学,2000,12(4):10-11.[2]邵强,张玉海,陈永和,等.左氧氟沙星治疗泌尿道感染的临床研究[J].中国新药杂志,1999,8(1):35-36.[3]徐志豪,刘富光,王选锭,等.盐酸左氧氟沙星治疗呼吸、泌尿系统感染多中心随机对照临床研究[J].中国新药杂志,2000,10(9):702-704.[4]刘利萍,李苹,吴泽志,等.5-Fu壳聚糖/丝素复合磁微球的制备及体外性质研究[J].中国药学杂志,2003,38(10):774-776.[5]国家药典委员会.中国药典(二部)[M].北京:化学工业出版社,2000:447. [6]朱盛山.药物新剂型[M].2版.北京:人民卫生出版社,1998:522-526.。
实验一 壳聚糖载药微球的制备

实验一 壳聚糖载药微球的制备一、目的要求1. 掌握离子交联法制备壳聚糖载药微球的机理及基本操作。
2. 学会使用紫外分光光度计测量微球的载药量。
二、实验原理壳聚糖是一种多糖,自然界中第二大糖类,由甲壳素经脱乙酰反应得到的,而甲壳素是虾或螃蟹的外骨骼以及真菌的细胞壁的主要组成部分。
壳聚糖的结构与纤维素相似但是与纤维素不同的是在其糖苷链上连接着2-氨基-2-脱氧-β-D-葡聚糖,正是因为壳聚糖有了这个氨基使其广泛的应用于药物制备与研发当中。
同时壳聚糖还是无毒的,具有生物可降解性和生物相容性并且不会引发免疫排斥反应的材料。
更重要的是壳聚糖还具有粘膜吸附性,这可以是其在体内停留更长的时间,正是因为以上特点壳聚糖成为了药物载体的理想原材料。
焦磷酸钠分子式Na 4P 2O 7·10H 2O,为无色或白色结晶性粉末,相对密度1.82.易溶于水,不溶于乙醇,对热极稳定。
是一种常见的食品添加剂。
壳聚糖与焦磷酸钠反应的原理:壳聚糖在酸性条件下产生NH 3+(如图2-1)。
3图2-1 壳聚糖在酸性条件下产生自由氨基自由氨基带有正电荷,而三聚磷酸钠在水溶液中产生阴离子(如图2-2)。
OP P O -Na ++Na -OO -Na ++Na -O O O图2-2 三聚磷酸钠在水溶液中产生阴离子壳聚糖的自由氨基阳离子与三聚磷酸钠上的阴离子发生静电吸附反应,紧紧的吸附在一起。
OP P O -Na +-OO -+Na -O OO 3OH+HO图2-3 壳聚糖与焦磷酸钠的静电吸附反应三、实验方法(一)载药微球的制备先称取0.5 g 的壳聚糖并溶于50 ml (2% v/v )醋酸溶液中,制得1 % (w/v)的壳聚糖醋酸溶液,然后用循环水式真空泵抽滤除去壳聚糖中的杂质。
在室温下,向壳聚糖醋酸溶液中滴加NaOH 溶液(0.1 mol/L ),调节pH=4.5值在一定范围。
加入0.2 g 的布洛芬,搅拌30 min 使其成为均一、稳定的悬浊液。
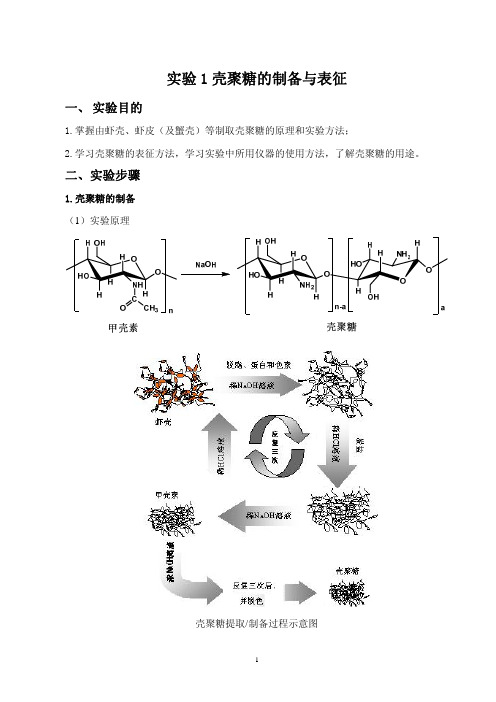
实验1.壳聚糖的制备与表征
一、 实验目的
1.掌握由虾壳、虾皮(及蟹壳)等制取壳聚糖的原理和实验方法; 2.学习壳聚糖的表征方法,学习实验中所用仪器的使用方法,了解壳聚糖的用途。
二、实验步骤
1.壳聚糖的制备 (1)实验原理
壳聚糖提取/制备过程示意图
1
甲壳素(Chintin)是无毒、生物可降解的天然多糖,由 2-乙酰氨基-2-脱氧-β-D-葡萄糖 组成,广泛分布于海洋及陆地上的低等节肢动物、昆虫外壳和少数真菌中,又称甲壳质、 几丁质。甲壳素外观为白色半透明固体, 不溶于水、稀酸、稀碱及普通有机溶剂,溶于 浓盐酸、硫酸, 但同时降解。甲壳素自然资源十分丰富,天然来源数量仅次于纤维素。 壳聚糖(Chitosan)是甲壳素水解其酰胺 N-脱乙酰基以后所得到的产物。 一般而言, 酰 胺 N-乙酰基脱去 55%以上的甲壳素就可称之为壳聚糖,因此,壳聚糖实际上由 2-乙酰氨 基-2-脱氧-β-D-葡萄糖和 2-氨基-2-脱氧-β-D-葡萄糖两类单糖组成。 壳聚糖在酸性溶液中游 离的伯胺基显示出碱性,可与氢质子定量发生反应。壳聚糖无毒,具有良好的生物可降 解性和生物相容性而被用作药物载体;其良好成膜性被广泛用作功能食品、食品添加剂 和果蔬保鲜膜等,应用越来越广泛。 (壳聚糖应用方面的研究请课后自行查阅文献了解。 ) (2)仪器设备及试剂(此处仅为壳聚糖制备用,不包括壳聚糖表征用的) 。 真空干燥箱,电动搅拌器,控温加热器,三口烧瓶,索氏提取器;NaOH(C.P.) , HCl(C.P.) ,丙酮(C.P.) ; 虾壳,由购自市场冻虾去肉而得; 虾皮,购自自由市场。 (3)实验步骤 甲壳素制备 ① 原料采集及预处理。 冻虾解冻以后,剥下虾壳(包括虾头) ,并认真剔除虾壳上残留的虾肉,充分清洗后, 室温下晾干,80 ℃下真空干燥过夜。 虾皮(视具体情况决定是否需要处理) ,经充分清洗后晾干,80 ℃下真空干燥过夜。 ② 脱脂脱蛋白脱钙。 称取一定量的预处理后的虾壳/虾皮, 置于 80 ℃下 2% NaOH 水溶液中处理 1 小时后, 用蒸馏水洗至中性,以除去油脂和蛋白;再用 1 mol/L HCl 于 30 ℃下浸泡 30 分钟后,用 蒸馏水洗至中性,以脱去钙质及盐分。重复上述操作三次。 ③ 脱色及产物收集。 将脱脂脱钙脱蛋白后的虾壳/虾皮置于索氏提取器中,用丙酮作溶剂进行脱色,可得 到白色片状的甲壳素。收集所得产物,并在 80 ℃下真空干燥 3 小时后,称取质量,计算 所得甲壳素的产率,比较不同原料中甲壳素产率的差异。 壳聚糖制备 ① 甲壳素脱乙酰化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Scientific Journal of Frontier Chemical DevelopmentJune 2015, Volume 5, Issue 1, PP.8-12 Preparation and Characterization of Norfloxacin Chitosan MicrospheresRong Pan 1,2, Ziru Lian 2†, Jiangtao Wang 1†1. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao,266100, China2. Marine College, Shandong University, Weihai, 264209, China†Email: yoyo-lzr@ (Z. Lian); jtwang@ (J. Wang)AbstractNorfloxacin (NFX)/ Chitosan (CS) microspheres were prepared by using inverse emulsion polymerization and cross-linking method. Glutaraldehyde was used as cross linker. Orthogonal design based on 4 factors: core-shell ratio, chitosan concentration, dosage of cross linker, agitation speed. Based on the entrapment efficiency and drug loading content of microspheres by orthogonal array analysis, the optimum condition for microspheres preparation was: core-shell ratio = 1:10, chitosan concentration (w/v) = 4%, dosage of cross linker (v/ v) = 1%, agitation speed = 800 rpm. The microspheres were characterized by Fourier transform infrared spectroscopy (FTIR) and scanning electron microscopy (SEM). Cumulative release profile of NFX from the microspheres in seawater was measured in 48 h. The drug released slower as chitosan increases.Keywords: Norfloxacin; Chitosan; Microspheres; Seawater; Controlled Release诺氟沙星壳聚糖微球的制备及表征潘容1, 2,连子如2,王江涛11. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛 2661002. 山东大学(威海),海洋学院,山东威海 264209摘要:利用反相乳液聚合-化学交联法,以戊二醛作为交联剂制备诺氟沙星-壳聚糖微球。
根据正交实验设计,考察核壳比、壳聚糖用量(w/v)、交联剂用量(v/v)和转速4个因素对微球制备的影响。
基于微球的载药量和包封率综合,得到最佳制备条件:(1)核壳比1:10,(2)壳聚糖用量(w/v) 4%,(3)交联剂用量(v/v)1%,(4)转速800 rpm。
利用扫描电镜、红外光谱对最佳制备条件下得到的微球进行表征。
测定壳聚糖微球在天然海水环境中48 h内的释药速率,壳聚糖用量越大,药物释放越缓慢。
关键词:诺氟沙星;壳聚糖;微球;海水;缓释引言壳聚糖是由甲壳素脱乙酰基所得到的产物,是迄今为止自然界中唯一存在的具有天然碱性的多糖[1]。
它具有良好的生物相容性和生物可降解性,亲水性强,无毒性、对环境友好,是一种常用的天然药物、基因载体材料[2]。
壳聚糖潜在的良好性能使其具有广阔的前景,其作为高分子缓释载体材料的应用价值得到了越来越广泛的关注。
通过控制壳聚糖的分子量、用量、载药量、交联度等可实现对药物的控制释放[3-5]。
诺氟沙星是一种氟喹诺酮类抗菌药,具有广谱抗菌作用,几乎不溶于水、脂溶性较差,药物穿透能力不强,生物利用度低[6]。
可以将诺氟沙星和壳聚糖结合在一起,使诺氟沙星通过扩散等方式在一定时间内以一定的速度释放到环境中。
通过药物缓释技术,用药后能在较长时间内持续释放药物,以达到长效作用,提高药物利用率[7-8]。
南美白对虾养殖业中时常有病害发生,其中由弧菌引起的红腿病发病率极高,达到80~90%,对对虾的养成期危害较大,一般在养殖初期将诺氟沙星与饲料混合投喂防治[9]。
将诺氟沙星制成缓释微球应用于对虾养殖中的相关研究报道较少,本研究中使用了两种不同分子量的壳聚糖混合制备诺氟沙星-壳聚糖微球,并对制备条件进行优化,同时对微球进行了表征并测定其在天然海水中的释药率。
以期提高虾对诺氟沙星药物利用率,增大药在水体中作用时间,减少投药次数和使用量,同时减少诺氟沙星对近岸水体环境和其他生物污染,进而保护近岸水体环境。
1实验1.1试剂与仪器试剂为:壳聚糖(CS1,平均相对分子量为120000,青岛海汇生物工程有限公司);壳聚糖(CS2,平均相对分子量为1500,肇庆长龙生物科技有限公司赠送);诺氟沙星(Norfloxacin, NFX)和戊二醛(50%)购自上海阿拉丁试剂公司;其他药品和试剂均为分析纯。
仪器为:S-4800冷场发射扫描电子显微镜(日本日立公司);Tensork-27型傅立叶红外光谱仪(德国Bruker公司);Hitachi L-2000高效液相色谱仪(日本日立公司);UV-2550紫外分光光度计(日本岛津公司);AnKe TDL-40B飞鸽离心机(上海安亭科学仪器厂);超纯水系统(美国Millipore公司制造)。
1.2微球的制备称取一定量的CS1和CS2混合溶于8 mL 1%醋酸溶液中,搅拌并超声至完全溶解。
称取一定量的NFX 溶于2 mL的0.1 mol/L的盐酸溶液中,待完全溶解后,将诺氟沙星溶液加入到壳聚糖溶液中,搅拌使其混合均匀。
混合物缓慢滴加到盛有100 mL石蜡油的三颈烧瓶中,以2%的Span80作为乳化剂,高速搅拌乳化1 h,形成稳定的微乳液,然后将一定量的戊二醛缓慢的逐滴滴入三颈烧瓶中交联固化,搅拌反应3 h。
冷却,用丙酮破乳、4000 rpm离心15 min、然后用石油醚和异丙醇交替洗涤沉淀并离心,沉淀在60℃真空干燥,得橙黄色粉末,即诺氟沙星-壳聚糖微球(NFX-CSM)。
采用同样方法,不加NFX,得到空白壳聚糖微球(CSM)。
本实验综合考察了诺氟沙星-壳聚糖微球制备过程中的核壳比、壳聚糖用量、交联剂用量、转速4个因素,分3个水平,设计了L9(34)正交实验。
1.3表征和性能检测1.3.1NFX-CSM的形貌表征用S-4800冷场发射扫描电子显微镜对NFX-CSM样品形貌进行观察。
1.3.2NFX-CSM的结构表征采用傅立叶外光谱仪分别对壳聚糖、壳聚糖微球和诺氟沙星样品进行红外光谱测试。
样品采用KBr压片法,扫描范围从400到4000 cm-1,分辨率为4 cm-1。
1.3.3NFX-CSM的载药率和包封率的测定精确称取一定量壳聚糖微球,放入100 mL圆底烧瓶,并加入一定量0.1 mol/L的盐酸溶液,水浴加热回流反应2 h至微球中药物充分溶解释放。
过滤,冷却,滤液定容于100 mL容量瓶中,用紫外分光光度计测其吸光度(波长278 nm),与标准曲线比较求出其浓度,壳聚糖微球载药率和包封率的计算公式分别为:载药率(%)=W n/W m×100% (1)包封率(%)=W n/W s×100% (2)式中,Wm为壳聚糖微球总质量(g),Wn为诺氟沙星被包裹入微球的质量(g),Ws为初始加入的诺氟沙星质量(g)。
1.3.4天然海水中的缓释实验准确称取一定量壳聚糖微球,加入到100 mL的天然海水中,定时取样5 mL,用高效液相色谱分析其中诺氟沙星的浓度。
根据标准曲线方程计算其浓度,绘制累积释药率-时间曲线。
色谱条件:Hitachi L-2000高效液相色谱仪(日本日立公司),L-2455二极管阵列检测器(日本日立公司);色谱柱C18(上海Agela公司,250 mm×4.6 mm,5 μm);流动相0.025 mol/L磷酸溶液(用三乙胺将pH调至3.00)-乙腈=87:13;检测波长278 nm;流速1 mL/min;柱温为室温;进样量20 μL。
2结果与讨论2.1正交实验优化实验条件在预实验的基础上,选定两种壳聚糖配比为CS1:CS2为1:3制备壳聚糖微球,NFX-CSM制备优化过程中采用正交矩阵分析。
实验结果如表1所示:表1 正交实验结果序号核壳比壳聚糖用量(w/v)/%交联剂用量(v/v)/%转速/rpm包封率/% 载药量/%载药率+包封率/%1 1:52 1 500 29.3 5.4 34.72 1:53 2 800 34.5 5.1 39.63 1:54 3 1100 35.8 5.3 41.64 1:10 2 2 1100 33.5 4.7 38.25 1:10 3 3 500 32.8 4.4 37.26 1:10 4 1 800 40.5 5.0 45.57 1:15 2 3 800 32.0 3.1 35.18 1:15 3 1 1100 30.5 3.3 33.89 1:15 4 2 500 31.6 3.5 35.1K138.6 36.0 38.0 35.6K240.3 36.9 37.6 40.1K334.6 40.7 37.9 37.9由载药量和包封率综合考察了诺氟沙星-壳聚糖微球制备过程中的核壳比、壳聚糖用量(w/v)、交联剂用量(v/v)、转速4个因素,分3个水平,设计了L9 (34)正交实验。
对不同因素和个水平列出9种分析,根据表1结果,我们可以得到,微球制备的最佳条件为:核壳比为1:10、壳聚糖用量(w/v)为4%、交联剂用量(v/v)为1%、转速为800 rpm。
且制备过程中各因素的重要次序依次为:核壳比>壳聚糖用量(w/v)>转速>交联剂用量(v/v)。
