《氨+硝酸+硫酸》课件1
合集下载
氨硝酸硫酸-高中化学必修一优秀课件PPT

2.喷泉实验: 实验装置
操作及现象
结论
(1)打开止水夹,并挤压滴管的胶头
(2)烧杯中的溶液由玻璃管进入烧 氨__极__易____溶于水,
瓶,形成__喷___泉___,瓶内液体呈
水溶液呈__碱____性
__红____色
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
点拨:用氨气做喷泉实验成功的关键点: (1)装置气密性要好。 (2)烧瓶要干燥。 (3)气体要纯,收集满。
+
4
+OH-,
H2O
H++OH-。上述反应和电离均是可逆的,所以六种粒子
都存在。
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
2.下列叙述中与氮的固定无关的是 A.工业合成氨
(B)
B.工业上将氨转化成硝酸和其他氮的氧化物
D.所有铵盐中,氮元素化合价都是-3价
解析:铵盐都是晶体,都易溶于水;有的铵盐受热分解不一定生成NH3, 如NH4NO3受热分解生成N2;铵盐都能与碱反应生成NH3,但有些铵盐也能与酸 反应,如NH4HCO3;铵盐中,氮元素化合价不一定都是-3价,如NH4NO3中 NO的氮元素是+5价。
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
3.化学性质:
NH3+H2O NH3·H2O
NH3+HCl===NH4Cl
有白烟产生
4NH3+5O2催==化 △==剂= 4NO+6H2O
还原性
氨 硝 酸 硫 酸 课件( 最新) 高中化 学必修 一(荐) 【精品 课件】
氨硝酸硫酸(01)ppt课件

1、氨的性质
入烧瓶内形成喷泉;
b.烧瓶内溶液呈红色。 形成喷泉的原因:当滴管中的水挤 入到烧瓶中时,烧瓶内的氨溶解, 使瓶内压强迅速降低,瓶外的空气 将烧杯内的溶液很快压入到烧瓶, 形成喷泉。
实验结论: a.氨极易溶于水。
b.氨水显碱性。
思考: ①喷泉停止后,为什么烧瓶不能被水完全充满 ? 由于氨气是用向下排空气法收集的,一定含有
←浓氨水
(如CaO、NaOH、碱石灰等)上,消耗 浓氨水中的水,同时反应放热,促进 NH3· H2O分解产生NH3
←固体碱性物质
固液不加热装置还可以制哪些气体?
①CaCO3+2HCl=CaCl2+CO2↑+H2O ②Zn+H2SO4=ZnSO4+H2↑ ③2Na2O2+2H2O=4NaOH+O2↑
氨的催化氧化——工业制硝酸的基本反应
4 NH3 + 5 O2
还原剂 氧化剂
2NO + O2 = 2NO2
催化剂
△
4 NO + 6 H2O
3NO2 +H2O = 2HNO3 +NO
2、铵盐
(1)定义:
(农业上常用的化肥)
+ 由铵根离子(NH4 )与酸根离子构成的 化合物叫铵盐.
(2)物理性质:易溶于水、白色晶体 (3)铵盐的化学性质 ①溶于水的气体: 还有哪些气体能做喷泉实验? NH3、HCl、SO2、NO2
与碱液反应的气体:HCl、SO2、NO2、CO2 与盐酸反应的气体:NH3
(2)氨的化学性质:
①氨与水反应:
a、氨水显弱碱性。能使酚酞溶液变红或使红色石蕊试纸变蓝。 + NH4 + OH
人教版化学必修一第四章第四节氨 硝酸 硫酸(一)品质课件PPT

一、氨气(NH3)
②与酸 • NH3+HCl==NH4Cl 迅速生成大量白烟 • 2NH3+H2SO4==(NH4)2SO4 • NH3+HNO3==NH4NO3 迅速生成大量白烟 ③与O2(催化氧化) ▲ 4NH3+5O2催==化△=剂=4NO+6H20
一、氨气(NH3)
(3)用途
二、铵盐
1、物理性质
§4.4.1 氨 硝酸 硫酸
氨
一、氨气(NH3)
1、N的固定
N2-闪--电→NO--O-2→NO2 --H2-O→HNO3→M(NO3)x
合成氨:
N2+3H2
≒ 高温、高压 催化剂
2NH3
一、氨气(NH3)
2、NH3 (1)物理性质
• 无色气体,刺激性气味,ρ<ρ空气,极易 溶于水(1:700),易液化
【实验4-8】喷泉实验
现象
烧杯中溶液由玻璃管进入烧瓶, 形成喷泉,瓶内液体呈现红色
结论 NH3极易溶于水,水溶液呈碱性
一、氨气(NH3)
(2)化学性质
①与H2O
• NH3+H20 ≒ NH3·H2O
一水合氨、氨水
氨水
NH3·H2O 的性质
①弱碱性:NH3·H2O ≒ NH4++OH②不稳定性:NH3·H2O =△= NH3↑+H2O
原装理置::2固N+H4固Cl-△+-C→a(气OH)2=△=CaCl2+2NH3↑+2H2O 干燥:碱石灰/生石灰 收集:向下排空气法 验满:
①湿润红色石蕊试纸 ②浓HCl
三、NH3的实验室制法
尾气处理:水/稀硫酸(防倒吸)
人教版高中化学必修一4.4《氨 硝酸 硫酸》课件ppt

属反应,通常生成SO2
练习:下列现象反映了硫酸的哪些主要性质 (1)浓硫酸滴在木条上,过一会儿,木条变黑。 (2)敞口放置浓硫酸时,质量增加。 (3)锌粒投入稀硫酸中,有气泡产生。 (4)把铜片放入浓硫酸里加热,有气体产生。 (5)利用浓硫酸和食盐固体反应可制HCl气体。 (6)浓硫酸不能用来干燥硫化氢气体。 (7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
2、浓实硫验酸室能常够用吸浓收空盐气酸中跟的浓水硫蒸酸气混。因合此来,快在速实验 室简中易常制用浓取硫HC酸l气来 体干,燥请不简与述它原起因反。应的气体。
浓硫酸具有吸水性且浓硫酸溶于水时放出 大量的热
浓硫酸与木屑、棉花、纸屑反应
2)、脱水性
浓硫酸与蔗糖反应
浓硫酸能按水的组成比脱去有机物中的氢和氧元素 浓硫酸的吸水性与脱水性有何区别?
第四节 氨 硝酸 硫酸
(第三课时)
二、硫酸和硝酸的特性
硫酸与硝酸都具有酸的通性。 硫酸、硝酸都是一种酸,HNO3 = H+ + NO3-
H2SO4=2H++SO42-
使指示剂变色: 稀硫酸与硝酸使紫色石蕊试液变红
与碱发生中和反应: H+ + OH - = H2O 与碱性氧化物反应: 2 H+ + CuO = Cu2+ + H2O 与盐反应:2 H+ + CO3 2- = H2O + CO2
注意:硫酸分子中的硫元素的化合价为 +6 价,处于硫元素所有化合价中的最高 价 态,在氧化还原反应中化合价只能 降低 , 表现 氧化性 , 浓硫酸被还原一般得到的产物为 SO2 。
试写出浓硫酸与铁在加热条件下的反应方程式, 并标出电子转移的方向和数目,指出氧化剂和 还原剂:
练习:下列现象反映了硫酸的哪些主要性质 (1)浓硫酸滴在木条上,过一会儿,木条变黑。 (2)敞口放置浓硫酸时,质量增加。 (3)锌粒投入稀硫酸中,有气泡产生。 (4)把铜片放入浓硫酸里加热,有气体产生。 (5)利用浓硫酸和食盐固体反应可制HCl气体。 (6)浓硫酸不能用来干燥硫化氢气体。 (7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
2、浓实硫验酸室能常够用吸浓收空盐气酸中跟的浓水硫蒸酸气混。因合此来,快在速实验 室简中易常制用浓取硫HC酸l气来 体干,燥请不简与述它原起因反。应的气体。
浓硫酸具有吸水性且浓硫酸溶于水时放出 大量的热
浓硫酸与木屑、棉花、纸屑反应
2)、脱水性
浓硫酸与蔗糖反应
浓硫酸能按水的组成比脱去有机物中的氢和氧元素 浓硫酸的吸水性与脱水性有何区别?
第四节 氨 硝酸 硫酸
(第三课时)
二、硫酸和硝酸的特性
硫酸与硝酸都具有酸的通性。 硫酸、硝酸都是一种酸,HNO3 = H+ + NO3-
H2SO4=2H++SO42-
使指示剂变色: 稀硫酸与硝酸使紫色石蕊试液变红
与碱发生中和反应: H+ + OH - = H2O 与碱性氧化物反应: 2 H+ + CuO = Cu2+ + H2O 与盐反应:2 H+ + CO3 2- = H2O + CO2
注意:硫酸分子中的硫元素的化合价为 +6 价,处于硫元素所有化合价中的最高 价 态,在氧化还原反应中化合价只能 降低 , 表现 氧化性 , 浓硫酸被还原一般得到的产物为 SO2 。
试写出浓硫酸与铁在加热条件下的反应方程式, 并标出电子转移的方向和数目,指出氧化剂和 还原剂:
氨、硝酸、硫酸PPT课件
【知识延伸】: 挥发性酸(HCl、HNO3等)遇氨 气均有白烟生成; 难挥发性酸H2SO4无此现象。
NH3+HCl==NH4Cl; NH3+HNO3== NH4NO3;
2NH3+ H2SO4== (NH4)2SO4;
不能用浓硫酸干燥.
⑶氨与氧气反应:
⑶氨与氧气反应:
催化剂 4NH3+5O2==== 4NO+6H O 2 △
NH3· H2O不稳定,受热时容易分解为NH3和 H2O。不加热不分解.
NH3· H2O=== NH3↑+H2O
【探究实验】:
取两支玻璃棒,分别蘸取浓 氨水和浓盐酸后,再将两支 玻璃棒靠近,观察现象。
现象:产生大量的白烟。
⑵氨与酸反应:
NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
稍后,德国化学家耐斯特通过理 论计算,认为合成氨是不可能的。因 此人工合成氨的研究又一次止步。后 来才发现,是能斯特计算时误用了一 个热力学数据,以至得到错误结论。
在合成氨研究屡屡受挫的情况下,德 国另一位化学家哈伯知难而进,对合成 氨进行了全面系统地研究和实验,终于 在1908年7月在实验室里用N2和H2在600℃、 200个大气压下合成氨,产率虽只有2%, 但却是科学上的一项重大突破。
⑺干燥装置
棉花的作用: 防止空气对流
浓氨水
浓氨水
CaO或NaOH 方法二:加热浓氨水制氨气 NH3· H来自O=== NH3↑+H2O
实验:
一支干燥的充满NH3的圆 底烧瓶,用带有玻璃管和 滴管(滴管预先吸入水)的 塞子塞紧瓶口。 倒置烧瓶,使玻璃管插入 盛有水的烧杯里(水中滴有 酚酞溶液)。
NH3+HCl==NH4Cl; NH3+HNO3== NH4NO3;
2NH3+ H2SO4== (NH4)2SO4;
不能用浓硫酸干燥.
⑶氨与氧气反应:
⑶氨与氧气反应:
催化剂 4NH3+5O2==== 4NO+6H O 2 △
NH3· H2O不稳定,受热时容易分解为NH3和 H2O。不加热不分解.
NH3· H2O=== NH3↑+H2O
【探究实验】:
取两支玻璃棒,分别蘸取浓 氨水和浓盐酸后,再将两支 玻璃棒靠近,观察现象。
现象:产生大量的白烟。
⑵氨与酸反应:
NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
稍后,德国化学家耐斯特通过理 论计算,认为合成氨是不可能的。因 此人工合成氨的研究又一次止步。后 来才发现,是能斯特计算时误用了一 个热力学数据,以至得到错误结论。
在合成氨研究屡屡受挫的情况下,德 国另一位化学家哈伯知难而进,对合成 氨进行了全面系统地研究和实验,终于 在1908年7月在实验室里用N2和H2在600℃、 200个大气压下合成氨,产率虽只有2%, 但却是科学上的一项重大突破。
⑺干燥装置
棉花的作用: 防止空气对流
浓氨水
浓氨水
CaO或NaOH 方法二:加热浓氨水制氨气 NH3· H来自O=== NH3↑+H2O
实验:
一支干燥的充满NH3的圆 底烧瓶,用带有玻璃管和 滴管(滴管预先吸入水)的 塞子塞紧瓶口。 倒置烧瓶,使玻璃管插入 盛有水的烧杯里(水中滴有 酚酞溶液)。
氨 硝酸 硫酸 第1课时 课件化学课件PPT

第四章 第四节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
4.铵盐都____易____溶于水,受热易___分__解___,与碱反应 加热时放出__氨__气____。
写出氯化铵、碳酸氢铵受热分解的化学方程式: ____N_H__4_C_l_=_=△_=_=_=_N_H__3_↑__+__H_C__l↑_______________、 __N_H__4_H_C__O_3_=_=_△=_=_=_N__H_3_↑__+__H_2_O__↑__+__C_O__2↑_____。 5.实验室中,常用加热固体氯化铵和氢氧化钙的混合物 制取氨:__2_N_H__4C__l+__C__a_(O__H_)_2_=_=△_=_=_=_C__a_C_l_2+__2_H__2_O_+__2_N_H__3_↑__。
第四章 第四节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
●新知预习 1.在自然界中,氨是动物体特别是蛋白质腐败的产物。 工业制取氨的反应为____N_2_+__3_H_2__高__催温__化、__剂高__压____2_N__H_3___。 它是没有颜色、有_刺__激__性___气味的气体。氨的密度比空 气___小_____。氨__极__易____溶解于水。在常温下,1体积水大约 可溶解__7_0_0____体积氨气。氨的水溶液叫做__氨__水____。
第四章 第四节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物 质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液 C.CaCO3与稀H2SO4 D.NH4HCO3与稀盐酸
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
4.铵盐都____易____溶于水,受热易___分__解___,与碱反应 加热时放出__氨__气____。
写出氯化铵、碳酸氢铵受热分解的化学方程式: ____N_H__4_C_l_=_=△_=_=_=_N_H__3_↑__+__H_C__l↑_______________、 __N_H__4_H_C__O_3_=_=_△=_=_=_N__H_3_↑__+__H_2_O__↑__+__C_O__2↑_____。 5.实验室中,常用加热固体氯化铵和氢氧化钙的混合物 制取氨:__2_N_H__4C__l+__C__a_(O__H_)_2_=_=△_=_=_=_C__a_C_l_2+__2_H__2_O_+__2_N_H__3_↑__。
第四章 第四节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
●新知预习 1.在自然界中,氨是动物体特别是蛋白质腐败的产物。 工业制取氨的反应为____N_2_+__3_H_2__高__催温__化、__剂高__压____2_N__H_3___。 它是没有颜色、有_刺__激__性___气味的气体。氨的密度比空 气___小_____。氨__极__易____溶解于水。在常温下,1体积水大约 可溶解__7_0_0____体积氨气。氨的水溶液叫做__氨__水____。
第四章 第四节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物 质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液 C.CaCO3与稀H2SO4 D.NH4HCO3与稀盐酸
【高中化学】氨、硫酸、硝酸ppt1

塑料
硝酸盐
1、不要做刺猬,能不与人结仇就不与人结仇,谁也不跟谁一辈子,有些事情没必要记在心上。 2、相遇总是猝不及防,而离别多是蓄谋已久,总有一些人会慢慢淡出你的生活,你要学会接受而不是怀念。 3、其实每个人都很清楚自己想要什么,但并不是谁都有勇气表达出来。渐渐才知道,心口如一,是一种何等的强大! 4、有些路看起来很近,可是走下去却很远的,缺少耐心的人永远走不到头。人生,一半是现实,一半是梦想。 5、你心里最崇拜谁,不必变成那个人,而是用那个人的精神和方法,去变成你自己。 6、过去的事情就让它过去,一定要放下。学会狠心,学会独立,学会微笑,学会丢弃不值得的感情。 7、成功不是让周围的人都羡慕你,称赞你,而是让周围的人都需要你,离不开你。 8、生活本来很不易,不必事事渴求别人的理解和认同,静静的过自己的生活。心若不动,风又奈何。你若不伤,岁月无恙。 9、命运要你成长的时候,总会安排一些让你不顺心的人或事刺激你。 10、你迷茫的原因往往只有一个,那就是在本该拼命去努力的年纪,想得太多,做得太少。 11、有一些人的出现,就是来给我们开眼的。所以,你一定要禁得起假话,受得住敷衍,忍得住欺骗,忘得了承诺,放得下一切。 12、不要像个落难者,告诉别人你的不幸。逢人只说三分话,不可全抛一片心。 13、人生的路,靠的是自己一步步去走,真正能保护你的,是你自己的选择。而真正能伤害你的,也是一样,自己的选择。 14、不要那么敏感,也不要那么心软,太敏感和太心软的人,肯定过得不快乐,别人随便的一句话,你都要胡思乱想一整天。 15、不要轻易去依赖一个人,它会成为你的习惯,当分别来临,你失去的不是某个人,而是你精神的支柱;无论何时何地,都要学会独立行走 ,它会让你走得更坦然些。 16、在不违背原则的情况下,对别人要宽容,能帮就帮,千万不要把人逼绝了,给人留条后路,懂得从内心欣赏别人,虽然这很多时候很难 。 17、做不了决定的时候,让时间帮你决定。如果还是无法决定,做了再说。宁愿犯错,不留遗憾! 18、不要太高估自己在集体中的力量,因为当你选择离开时,就会发现即使没有你,太阳照常升起。 19、时间不仅让你看透别人,也让你认清自己。很多时候,就是在跌跌拌拌中,我们学会了生活。 20、与其等着别人来爱你,不如自己努力爱自己,对自己好点,因为一辈子不长,对身边的人好点,因为下辈子不一定能够遇见。
人教版化学必修一《氨 硝酸 硫酸》课件PPT

有的水(或水蒸气)及结晶水
用途:
气体干燥剂
想一想浓硫酸 可以干燥哪些 类型气体?
(干燥不与它起 反应的气体。)
(非还原性的中性和酸性气体)
思考:
1、能否用浓硫酸干燥湿润的NH3?
答:不能。因为NH3为碱性气体,能与 硫酸发生反应。
2、把一瓶浓硫酸打开瓶盖露置在空气中一 段时间之后,会有什么变化?
答:质量变大了。因为浓硫酸有吸水性, 吸收空气中的水分后使质量增加。
1.1molCu 和2molH2SO4(浓)共热能 否得到1molSO2?
2.浓硫酸的作用? 强氧化性和酸性
反应物之比
n(Cu) :n( H2SO4) =1:2
还原剂:氧化剂 n(Cu ) :n( H2SO4)=1:1
③与某些还原性化合物反应:
H2S + H2SO4 = S + SO2 + 2H2O 浓硫酸能干燥:
常温下:即冷的浓硫酸
Al Fe 发生钝化
能用铝槽车 盛放、运输 浓硫酸
表面生成致密的氧化物薄膜
若加热,仍反应:
2Fe + 6H2SO4 (浓) = Fe2(SO4)3+ 3SO2 +6H2O
现象:
①固:红→黑 ②液:无→棕黑→蓝色
③气:无色有刺激性气味;使品红溶液褪色。
Cu + 2H2SO4(浓) ∆ CuSO4+ SO2 ↑ +2H2O
♣ (一)物理性质:
颜 色:无 色 状 态 : 油状液体
密 度 : 1.84g/cm3 沸 点 : 高沸点(338˚C) 挥发性: 难挥发 溶解度: 易溶与水
思考:稀释浓硫酸时应该如何操作?
l
正确操作: 将浓硫酸缓慢地沿玻璃
用途:
气体干燥剂
想一想浓硫酸 可以干燥哪些 类型气体?
(干燥不与它起 反应的气体。)
(非还原性的中性和酸性气体)
思考:
1、能否用浓硫酸干燥湿润的NH3?
答:不能。因为NH3为碱性气体,能与 硫酸发生反应。
2、把一瓶浓硫酸打开瓶盖露置在空气中一 段时间之后,会有什么变化?
答:质量变大了。因为浓硫酸有吸水性, 吸收空气中的水分后使质量增加。
1.1molCu 和2molH2SO4(浓)共热能 否得到1molSO2?
2.浓硫酸的作用? 强氧化性和酸性
反应物之比
n(Cu) :n( H2SO4) =1:2
还原剂:氧化剂 n(Cu ) :n( H2SO4)=1:1
③与某些还原性化合物反应:
H2S + H2SO4 = S + SO2 + 2H2O 浓硫酸能干燥:
常温下:即冷的浓硫酸
Al Fe 发生钝化
能用铝槽车 盛放、运输 浓硫酸
表面生成致密的氧化物薄膜
若加热,仍反应:
2Fe + 6H2SO4 (浓) = Fe2(SO4)3+ 3SO2 +6H2O
现象:
①固:红→黑 ②液:无→棕黑→蓝色
③气:无色有刺激性气味;使品红溶液褪色。
Cu + 2H2SO4(浓) ∆ CuSO4+ SO2 ↑ +2H2O
♣ (一)物理性质:
颜 色:无 色 状 态 : 油状液体
密 度 : 1.84g/cm3 沸 点 : 高沸点(338˚C) 挥发性: 难挥发 溶解度: 易溶与水
思考:稀释浓硫酸时应该如何操作?
l
正确操作: 将浓硫酸缓慢地沿玻璃
高一化学必修1教材4.4《氨-硝酸-硫酸》课件ppt

注意:这是工业制取硝酸的第一步反应
(4)与某些盐溶液反应
Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+
三、铵盐
特性:
1、都是易溶于水的晶体 2、受热均易分解 (铵盐→氨+酸或酸性氧化物)
△ NH4Cl == NH3 ↑ + HCl ↑ NH4HCO3△=△= NH3↑ + CO2↑+ H2O↑ NH4HCO3=△= NH3↑+ CO2↑+ H2O (NH4)2CO3 == 2NH3↑+ CO2↑+ H2O
其他方法:用浓氨水制氨气
浓氨水
NH3·H2O == NH3↑+H2O
NaOH
NH3·H2O或=C=a=O NH3↑+H2O
浓氨水
CaO或NaOH
硫酸(H2SO4)
(一)稀硫酸具有酸的通性 H2SO4=2H++SO42-
①与指示剂反应; ②与活泼金属反应; ③与金属氧化物反应生成盐和水; ④与盐的反应生成新盐和新酸; ⑤与碱的反应,生成盐和水。
用途:可以作干燥剂
可用来干燥与它不起反应的气体,如 H2、O2、Cl2、 CO2、CO、CH4、SO2、N2、NO2、NO、HCl。 不能干燥NH3、H2S、HBr、HI
CuSO4·5H2O + H2SO4 = CuSO4 + H2SO4·5H2O ⑵ 脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1
②与某些非金属反应
2H2SO4(浓)+C===CO2↑+ 2H2O + 2SO2↑
氧化剂 还原剂
2H2SO4(浓)+H2S=== S↓ + 2H2O + SO2↑
(4)与某些盐溶液反应
Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+
三、铵盐
特性:
1、都是易溶于水的晶体 2、受热均易分解 (铵盐→氨+酸或酸性氧化物)
△ NH4Cl == NH3 ↑ + HCl ↑ NH4HCO3△=△= NH3↑ + CO2↑+ H2O↑ NH4HCO3=△= NH3↑+ CO2↑+ H2O (NH4)2CO3 == 2NH3↑+ CO2↑+ H2O
其他方法:用浓氨水制氨气
浓氨水
NH3·H2O == NH3↑+H2O
NaOH
NH3·H2O或=C=a=O NH3↑+H2O
浓氨水
CaO或NaOH
硫酸(H2SO4)
(一)稀硫酸具有酸的通性 H2SO4=2H++SO42-
①与指示剂反应; ②与活泼金属反应; ③与金属氧化物反应生成盐和水; ④与盐的反应生成新盐和新酸; ⑤与碱的反应,生成盐和水。
用途:可以作干燥剂
可用来干燥与它不起反应的气体,如 H2、O2、Cl2、 CO2、CO、CH4、SO2、N2、NO2、NO、HCl。 不能干燥NH3、H2S、HBr、HI
CuSO4·5H2O + H2SO4 = CuSO4 + H2SO4·5H2O ⑵ 脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1
②与某些非金属反应
2H2SO4(浓)+C===CO2↑+ 2H2O + 2SO2↑
氧化剂 还原剂
2H2SO4(浓)+H2S=== S↓ + 2H2O + SO2↑
氨 硝酸 硫酸(第1课时)

b:遇浓盐酸产生大量的白烟 (6)尾气处理:用水吸收NH3
要得到干燥的氨气,常用试剂有哪些? ①CaO、碱石灰等碱性干燥剂 ②无水CaCl2不能用来干燥NH3(形成CaCl2•8NH3)
2020/11/3
23
除了利用上述方法之外,实验室有无其他简 单可行的方法来制得氨气?
方法二:加热浓氨水制氨气
2020/11/3
2020/11/3
27
3.某学生在氨气的喷泉实验基础上 积极思考产生喷泉的其他方法,并 设计如图所示的装置。在锥形瓶中, 分别加入足量的下列物质,反应后
可能产生喷泉的是:( )D
A. Cu与稀盐酸
B. NaHCO3与NaOH
C. CaCO3与稀硫酸
D. NH4HCO3与稀盐酸
2020/11/3
28
4-N3 H3+5O2=催加=化热剂=4+N2 O+6H2O
这个反应叫做氨的催化氧化, 它是工业上制硝酸的基础.
2020/11/3
14
思考与交流
O2
O2 H2O
N2 NH3 NO NO2 HNO3
2020/11/3
15
制尿素
氨的用途
制硝酸
制纯碱
2020/11/3
做致冷剂
16
铵盐
2020/11/3
浓氨水
NH3·H2O == NH3↑+ H2O
24
方法三
思考:有什么现象?
←浓氨水 为什么有此现象?
←固体CaO
1、吸收水分,减少溶剂。 2、增加OH-的浓度。 3、放出热量,升高温度。
2020/11/3
25
如何用实验方法证明某白色固体是铵盐? 铵盐(NH4+)的检验:
要得到干燥的氨气,常用试剂有哪些? ①CaO、碱石灰等碱性干燥剂 ②无水CaCl2不能用来干燥NH3(形成CaCl2•8NH3)
2020/11/3
23
除了利用上述方法之外,实验室有无其他简 单可行的方法来制得氨气?
方法二:加热浓氨水制氨气
2020/11/3
2020/11/3
27
3.某学生在氨气的喷泉实验基础上 积极思考产生喷泉的其他方法,并 设计如图所示的装置。在锥形瓶中, 分别加入足量的下列物质,反应后
可能产生喷泉的是:( )D
A. Cu与稀盐酸
B. NaHCO3与NaOH
C. CaCO3与稀硫酸
D. NH4HCO3与稀盐酸
2020/11/3
28
4-N3 H3+5O2=催加=化热剂=4+N2 O+6H2O
这个反应叫做氨的催化氧化, 它是工业上制硝酸的基础.
2020/11/3
14
思考与交流
O2
O2 H2O
N2 NH3 NO NO2 HNO3
2020/11/3
15
制尿素
氨的用途
制硝酸
制纯碱
2020/11/3
做致冷剂
16
铵盐
2020/11/3
浓氨水
NH3·H2O == NH3↑+ H2O
24
方法三
思考:有什么现象?
←浓氨水 为什么有此现象?
←固体CaO
1、吸收水分,减少溶剂。 2、增加OH-的浓度。 3、放出热量,升高温度。
2020/11/3
25
如何用实验方法证明某白色固体是铵盐? 铵盐(NH4+)的检验:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课堂练习
2、工业上拟用铜和硝酸来制备Cu(NO3)2· 3H2O,
下面有三位同学提出了不同的生产方案:
甲方案:Cu+浓HNO3→ 蒸发结晶 乙方案: Cu+稀HNO3→ 蒸发结晶 丙方案:Cu CuO 蒸发结晶 丙 你认为______方案最好,理由 消耗硝酸少,不污染环境 _______________________________
这两种气体把棉布与空气隔绝起来,棉 布在没有氧气的条件下当然就不能燃烧了。 当这两种气体保护棉布不被火烧的同时,它 们又在空气中相遇,重新化合而成氯化铵小 晶体,这些小晶体分布在空气中,就象白烟 一样。实际上,氯化铵这种化学物质是很好 的防火能手,戏院里的舞台布景、舰艇上的 木料等,都经常用氯化铵处理,以求达到防 火的目的。
按正确的顺序连接下列仪器,并说明你 的理由。
仪器连接如下
说明:应首先用无水硫酸铜验证水,然后用品 红验证二氧化硫,再用高锰酸钾氧化多余的二 氧化硫,接着再次验证二氧化硫是否全部被氧 化,最后才验证二氧化碳。
2、硝酸的氧化性 浓稀硝酸都能与铜发生反应 4HNO3(浓)+Cu==Cu(NO3)2+2NO2 +2H2O 8HNO3(稀)+3Cu==3Cu(NO3)2+2NO +4H2O 浓硝酸也能与木炭发生反应
一、氨
1、物理性质
无色、有刺激性气味气体, 密度比空气小,易液化,极易溶 于水(1∶700)。
实 验----氨气的喷泉实验
探究
(1)氨为什么会形成喷泉?
氨气极易溶于水,使烧瓶内压强减小, 瓶内外形成较大的压差;大气压将水压 入烧瓶
思 考
1、形成喷泉的原理?
烧瓶内外形成压强差 2、喷泉实验成功的关键? a.装置的气密性好;b.气体的纯度高; c.烧瓶必须干燥。
△ —— NH4Cl —— HCl ↑ +NH3↑
NH4Cl加热 —— NH4Cl) (HCl +NH3 —— NH4HCO3加热
② 不稳定性酸的铵盐
△ —— NH4HCO3 —— H2O +CO2 ↑ +NH3↑
③ 强氧化性酸的铵盐
NH4NO3加热
△ —— 2NH4NO3 —— 4H2O + 2N2 ↑ + O2↑ (炸药) △ —— 3(NH4)2SO4 ——4NH3 + N2 ↑ + 3SO2↑+ 6H2O
空气加热
HNO3
用什么方法鉴别浓硫酸和稀硫酸? 1、利用浓硫酸的脱水性 2、利用浓硫酸的氧化性 3、利用浓硫酸的钝化作用 4、利用浓硫酸溶于水放热 5、你还能想到用其他的方法鉴别它们吗?
如果是在距离水面比较近的地方,就尽量跑到 水边,因为氨气溶于水。
四、铵盐及其性质 思考 加热试管中的氯化铵晶体,
没有熔化就直接变成气体,气体在试 管上方又变成氯化铵晶体,这个变化 是升华过程吗?
(1)铵根离子(NH4+)和酸根离 子组成的化合物,易溶于水。 (2)化学性质:
(A) 受热易分解
① 稳定、挥发性酸的铵盐
收集到的氨气中混有空气 4、若不考虑水柱的压力,实验完毕后,所 得溶液中溶质的物质的量浓度是否仍为 1/22.4 mol/L 仍为1/22.4 mol/L
探究
(4)滴有酚酞的溶液变为红 色说明什么?
氨气溶于水
,溶液显碱性。
2、化学性质
(1)氨跟水的反应
NH3· H2O== NH3↑+ H2O
氨水的成份: 分子 :NH3· H2O 离子: NH4+ NH3 OHH2O H+(极少量)
C
D
(1)硫酸、硝酸、盐酸都是酸,它们在组 成上有什么特点? (2)这种特点与酸的通性有什么关系?用 电离方程式表示。
(3)实验室里用金属与酸反应制取氢气, 往往用稀硫酸或盐酸,而不用浓硫酸或硝 酸,这是为什么?
硫酸与硝酸都具有酸的通性。
硫酸、硝酸都是一种酸,HNO3 = H+ + NO3-
H2SO4=2H++SO42-
3、浓硫酸与浓硝酸的钝化作用
铜
Fe
课堂练习
1、 下列现象体现了硫酸的哪些性质? (1) 把浓硫酸滴入放在蒸发皿里的蔗糖上, 蔗糖就会炭化变黑 脱水性 (2) 把浓硫酸露置在空气里, 质量会增加。 吸水性 (3) 把锌粒放入稀硫酸里,会产生氢气。
酸性
(4) 把铜片放入浓硫酸里并加热, 会产生SO2。 强氧化性 (5) 利用浓硫酸和食盐固体反应, 制HCl气体。 难挥发性
思考与交流
2、有哪些生物能直接吸收含氮的化合物?
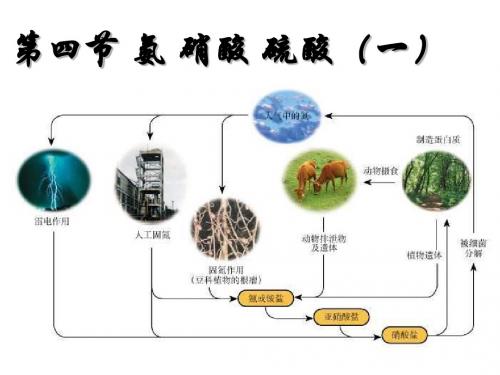
豆类植物的根瘤菌能 把氮气变成氮的化合 物。多数植物能吸收 含氮化合物。
思考与交流
3、人体里蛋白质中的氮是从哪儿来的? 硝酸盐
硝化细菌↑硝化作用→植物蛋白→动物蛋白
铵 盐
思考与交流
4、自然界中有哪些固氮途径?
氮的固定:将空气中游离态 的氮转变为化合态的方法。
第四章 非金属及其化合物
第四节 氨 硝酸 硫酸
1918年,德国化学家哈伯因为在合成氨 方面的巨大贡献而获诺贝尔化学奖。 1931年,诺贝尔化学奖再次垂青于与合 成氨有关的研究。
哈尔滨氨气泄漏数百人紧急疏散 从这则新闻可知氨气
有哪些物理性质? 2007年9月17日10时40分许,在南 岗区学府路287号附近,一冷冻厂内的 供液管出现漏点,致使部分氨气泄漏, 厂内工人及附近群众数百人被疏散, 11时许,记者赶到事故发生现场,进 入厂区后,一股浓烈的气味扑鼻而来, 让人感到呼吸困难,记者的双眼被熏 得泪流不止。
浓硫酸与蔗糖反应
(2)与铜反应 2H2SO4+Cu==CuSO4+2H2O+SO2
(3)、与木炭的反应
在加热时浓硫酸不仅能和活泼性不强 的铜发生反应,还能与炭反应。
2H2SO4+C == CO2 +2H2O+2SO2
我们在做浓硫酸使蔗糖脱水的实验中会闻到 一股刺激性的气味,那么它是否真的是二氧化硫 呢?我们用下列实验来验证浓硫酸与炭反应是否 生成了二氧化碳、水和二氧化硫。
探究
(2)含水的胶头滴管在实验 中作用?
引发水上喷
试一试
若实验室只有单孔塞,能否用上述装置 进行喷泉实验?如能,应如何引发喷泉?
探究
(3)若 VL烧瓶充满标况下的氨气,喷泉 实验后溶液充满整个烧瓶,所得溶液物质 的量浓度
1 mol/L 22.4 _______
思 考
3、从上述实验来看,溶液都不能完全充满 烧瓶,为什么?
在氨水溶质的质量分数、物质的量浓度计 算时,以NH3为溶质 氨水的密度: ρ小于1g/cm3 ,ω越大,ρ越小。
氨水与液氨
名 形 称 成 氨 水 液 氨
氨气溶于水 混合物
H2O、NH3 、NH3·H2O NH4+ OHH+
氨气降温加压液化
物质分类 微粒种类
纯净物(非电解质) NH3
思考
氨能否与酸反应?
三、氨的用途
铵盐
硝酸
纯碱
用稀氨水治疗 蚊虫叮咬
NH3
有机合成工业原料
消除 二氧化氮 的污染
吸收硫酸 生产中的 二氧化硫
致冷剂
动动脑?
通过今天的学习,若当你遇到氨气泄漏事 故,你将如何应对? 在遇到氨气泄漏时,应该马上疏散到室外,最 好到开阔地带,并站在上风头。 在撤离时,最好准备一块湿毛巾捂住嘴巴。
思考与交流
5、简单描述氮在自然界的循环过程?
自然界中氮的循环Байду номын сангаас程
大气中的氮
氮的固定(生物固氮、 高能固氮、人工固氮)
细菌分解
土壤中的氮 (铵盐→硝酸盐)
植 物 吸 收
硝酸盐
动物排泄 物及遗体 动物摄取
植物中有机氮
动物中有机氮
练习 下面是实验室制取氨气的装置和选用 的试剂,其中错误的是( )
A
B
2、反应装置 ①发生 ②收集
固+固须加热(同O2)
向下排空气法
c、注意事项: ①验满 湿润红色石蕊试纸
沾浓盐酸的玻璃棒
②干燥剂 碱石灰(NaOH+CaO), 不可用浓H2SO4、P2O5和CaCl2 ③简单方法制氨气: 浓氨水
碱石灰 或△
氨气
思考与交流
1、氮在自然界中主要以哪些形式存在?
游离态:氮气; 化合态:无机物和有机物中,是构 成蛋白质和核酸不可缺的成分。
使指示剂变色:
稀硫酸与硝酸使紫色石蕊试液变红
与碱发生中和反应:
与盐反应:
H+ + OH - = H2O
与碱性氧化物反应: 2 H+ + CuO = Cu2+ + H2O
2 H+ + CO3 2- = H2O + CO2
一、硫酸和硝酸的氧化性
1、硫酸的氧化性 浓硫酸与木屑、棉花、纸屑反应
(1)脱水性
②鉴别: NH4+ 样品
强碱 △
湿润 气体 红色石蕊 蓝色
③铵态氮肥不可与草木灰混用;应储存在阴凉处。
4、氨气的实验室制法
1、 反应原理 Ca(OH)2 (强碱) △ —— ②反应 2NH4Cl + Ca(OH)2 —— CaCl2 +2NH3↑+2H2O
①药品
NH4Cl(铵盐)
③特点
复分解反应 (强碱制弱碱)
△ 催化剂
思考:把烧红了的铂丝插入盛浓氨水 的锥形瓶中(不接触溶液)观察到悬 在液面上的铂丝更加红亮,同时有红 棕色气体生成,并有白色烟雾产生, 试解释原因。
4NH3+5O2 ==== 4NO+6H2O
△
催化剂
