第22课 电解质溶液
医用化学课本习题答案

习 题 解 答第一章 溶 液1. 温度、压力如何影响气体在水中的溶解度?2. 何谓亨利定律?何谓气体吸收系数?3. 亨利定律适应的范围是什么?4. 20℃,10.00mL 饱和NaCl 溶液的质量为12.003g ,将其蒸干后,得到NaCl3.173g 。
求:(1)质量摩尔浓度;(2)物质的量浓度。
解:NaCl 的相对分子量为:58.5NaCl 的物质的量为:mol M m n B 05424.05.58173.3===(1) NaCl 的溶解度:)100/gNaCl (93.35100173.3003.12173.3水g =⨯-(2) 质量摩尔浓度:).(143.61000/)173.3003.12(5.58/173.31-=-==kg mol W n m B B (3) 物质的量浓度:).(424.51000/105.58/173.31-==L mol V n c B B 5. 将8.4g NaHCO 3溶于水配成1000mL 溶液,计算该物质的量浓度。
解:NaHCO 3相对分子量为:84 NaHCO 3的物质的量为:mol M m n B 1.0844.8===NaHCO 3的物质的量浓度:).(1.01000/10001.01-===L mol V n c B B 6. 欲配制10.5mol ·L -1 H 2SO 4 500mL ,需质量分数为0.98的H 2SO 4(密度为1.84)多少毫升?解:H 2SO 4的相对分子量为:98所需的H 2SO 4的物质的量为:mol V c n B B 25.51000/5005.10=⨯=⨯=设所需的0.98的H 2SO 4V (ml ),则H 2SO 4溶液的质量为V ×1.84(g ),所以含有的纯H 2SO 4为V ×1.84×0.98(g )。
25.59898.084.1=⨯⨯==V M m n B V =285.3ml7. 某病人需要补充钠(Na +)5g ,应补给生理盐水(0.154mol ·L -1)多少毫升? 解:设需要生理盐水Vml ,则含有NaCl 的物质的量为:V ×0.154/1000(mol ),所以含有的Na +的物质的量为:V ×0.154/1000(mol )。
新教材高中化学课时作业5电解质溶液苏教版必修1

电解质溶液一、选择题:每小题只有一个选项符合题意。
1.下列说法正确的是( )A.难溶于水的化合物是非电解质B.某化合物的水溶液可以导电,所以该化合物是电解质C.硫酸是电解质,所以硫酸在熔化时或溶于水时都能导电D.液态氯化氢不能导电,但氯化氢是电解质2.下列物质分类正确的组合是( )3.下列物质中,含有自由移动的Cl-的是( )A.KClO3溶液B.CaCl2溶液C.KCl晶体D.液态氯化氢4.下列各组物质,前者属于电解质,后者属于非电解质的是( )A.NaCl晶体、BaSO4B.铝、二氧化硫C.液态的醋酸、酒精D.熔融的KNO3、硫酸溶液5.下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )A.Na+、OH-、SO2-4 B.H+、Cl-、SO2-4C.Na+、K+、OH-D.Na+、K+、NO-36.下列叙述正确的是( )A.固体氯化钠不导电,所以氯化钠是非电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.五氧化二磷溶于水能导电,所以五氧化二磷是电解质7.下列物质中不能导电,又不是电解质和非电解质的是( )A.食盐溶液B.石墨晶体C.液态氧气D.铜8.下列水溶液中的电离方程式错误的是( )A.Na2CO3===2Na++CO2-3B.NaHSO4===Na++H++SO2-4C.MgCl2===Mg2++Cl-2D.Ba(OH)2===Ba2++2OH-二、选择题:每小题有一个或两个选项符合题意。
9.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,则表中X离子的种类及其个数b为( )A.NH+4、4a B.SO2-4、2aC.OH-、4a D.NO-3、2a10.NaHSO4在水溶液中能够电离出H+、Na+和SO2-4。
下列对NaHSO4的分类中不正确的是( )A.NaHSO4是正盐B.NaHSO4是酸式盐C.NaHSO4是钠盐D.NaHSO4是酸11.在电解质溶液中,下列叙述正确的是( )A.阳离子和阴离子数目不一定相等B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等C.除阴、阳离子外,溶液中不会再有其他粒子D.电解质溶液的导电性一定很强12.下列四项都能导电,其中一项与其他三项导电原理不同的是( )A.氯化钠熔融导电B.液态汞导电C.H2SO4溶液导电D.熔融状态的KOH导电三、非选择题13.在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
高中化学电解池知识点归纳

⾼中化学电解池知识点归纳 ⾼中的化学课本内容⾯⼴量⼤,知识点多,学⽣⾯临着⼤量的知识点,经常会遗漏⼀些重要知识,你还记得电解池的知识点吗?下⾯是店铺为⼤家整理的⾼中化学重要的知识点,希望对⼤家有⽤! ⾼中化学电解池知识点归纳 1 ⾼中化学电解池知识点 ⼀、电解的原理 1.电解定义 在电流作⽤下,电解质在两个电极上分别发⽣氧化反应和还原反应的过程。
2.能量转化形式 电能转化为化学能。
3.电解池 (1)构成条件 ①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
4.分析电解过程的思维程序 (1)⾸先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质⽔溶液的组成,找全离⼦并分阴、阳两组(不要忘记⽔溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序 阴极:阳离⼦放电顺序: Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(⽔)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极: 活泼电极>S2->I->Br->Cl->OH->含氧酸根离⼦。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原⼦守恒和电荷守恒。
(5)最后写出电解反应的总化学⽅程式或离⼦⽅程式。
⼆、电解原理的应⽤ 1.电解饱和⾷盐⽔ (1)电极反应 阳极反应式:2Cl--2e-=Cl2↑(氧化反应) 阴极反应式:2H++2e-=H2↑(还原反应) (2)总反应⽅程式 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 离⼦反应⽅程式:2Cl-+2H2O 2OH-+H2↑+Cl2↑ (3)应⽤:氯碱⼯业制烧碱、氯⽓和氢⽓。
2.电镀 以⾦属表⾯镀银为例, (1)镀件作阴极,镀层⾦属银作阳极。
(2)电解质溶液是AgNO3溶液等含镀层⾦属阳离⼦的盐溶液。
(3)电极反应: 阳极:Ag-e-=Ag+; 阴极:Ag++e-=Ag。
第二讲:电解质溶液

第二讲:电解质溶液【测试要求】(1)知道酸、碱、盐在溶液中能发生电离。
(2)能正确书写强酸、强碱和大部分可溶性盐的电离方程式。
(3)通过实验事实认识离子反应及其发生的条件,能正确书写常见的离子方程式。
【知识梳理】一、酸、碱、盐在水溶液中的电离酸、碱、盐在水溶液中能导电,是因为它们在溶液中发生了,产生了。
思考:什么是电离?物质发生电离需要什么条件?是不是所有物质都能够电离?1.电解质:在水溶液熔融状态下能够导电的称作电解质练习1:下列物质哪些属于电解质?哪些不属于电解质?①金属铜②固态NaCl ③SO3④H2SO4⑤碳棒⑥酒精水溶液⑦KOH溶液⑧蔗糖⑨KOH ⑩MgO属于电解质的是:,不属于电解质的是:。
2.铜片、石墨能导电,它们是电解质吗?SO3的水溶液能导电,SO3是电解质吗?归纳总结:①化合物分为电解质、非电解质两类。
单质和混合物既不是电解质,也不是非电解质;②电解质导电是有条件的,即电解质必须在或才能导电;③能导电的物质不一定是电解质,如;④酸、碱、大部分盐和活泼金属氧化物是电解质;⑤非金属氧化物、大部分有机物为非电解质。
3.电离方程式的书写:练习2:用电离方程式表示下列物质的电离。
HCl—H2SO4—NaOH —Ba(OH)2—MgCl2 —NH4Cl—归纳:4.酸、碱、盐定义:电离时生成的阳离子的化合物叫做酸;电离时的化合物叫做碱;电离时能生成和的化合物叫做盐。
思考:NaHSO4溶液能电离出H+和Na+,NaHSO4属于酸吗?电解质溶于水形成的溶液与其它溶液有什么本质的区别呢?归纳:5.电解质溶液的特点⑴导电性(存在)⑵电中性(电荷守恒)练习3:在下列物质中:①H2SO4②HCl ③NaOH ④Cu(OH)2⑤AgCl ⑥Na2CO3⑦C2H5OH ⑧H2O ⑨SO2⑩Fe属于电解质的是_ ;不属于电解质的是__ _ ;在溶液中主要以离子形式存在的是_ 。
思考:(1)CuSO4溶液能与BaCl2溶液反应而与NaCl溶液却不能反应,试分析原因。
2020高一化学全一册课时作业22电解原理(含答案)
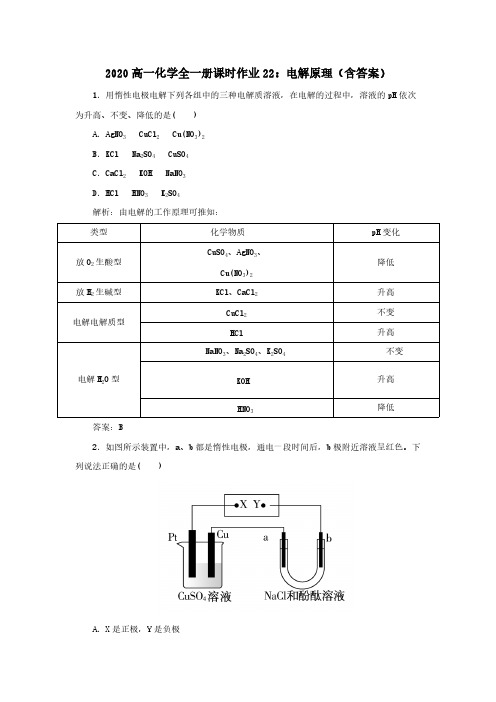
2020高一化学全一册课时作业22:电解原理(含答案)1.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )A.AgNO3 CuCl2 Cu(NO3)2B.KCl Na2SO4 CuSO4C.CaCl2 KOH NaNO3D.HCl HNO3 K2SO4解析:由电解的工作原理可推知:类型化学物质pH变化CuSO4、AgNO3、降低放O2生酸型Cu(NO3)2放H2生碱型KCl、CaCl2升高CuCl2不变电解电解质型HCl升高NaNO3、Na2SO4、K2SO4不变电解H2O型KOH升高HNO3降低答案:B2.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。
下列说法正确的是( )A.X是正极,Y是负极B .X 是负极,Y 是正极C .CuSO 4溶液的pH 值逐渐减小D .CuSO 4溶液的pH 值不变解析:通电电解氯化钠溶液时,b 极附近溶液呈红色,说明b 连接的Y 为电源的负极,则X 为正极,故A 正确,B 错误;通电电解硫酸铜时,总反应为:2CuSO 4+2H 2O 2Cu +2H 2SO 4+O 2↑,溶液的pH 减小,故C 正确,D 错误。
=====通电答案:AC3.在原电池和电解池的电极上所发生反应的类型相同的是( )A .原电池的正极和电解池阳极B .电解池阳极和电解池阴极C .原电池负极和电解池阳极D .原电池的正极和原电池负极解析:原电池正极和电解池阴极上得电子而发生还原反应,原电池负极和电解池阳极上失电子发生氧化反应,所以原电池负极和电解池阳极上反应类型相同、原电池正极和电解池阴极上反应类型相同,故选C 。
答案:C4.用惰性电极电解下列溶液一段时间后,再加入一定量的某种纯净物(括号内物质),不能使溶液恢复到原来的成分和浓度的是( )A .KCl(HCl)B .H 2SO 4(H 2O)C .AgNO 3(HNO 3)D .CuSO 4(CuCO 3)解析:电解液复原时要分析电池反应式,看是什么物质脱离了原来的溶液体系(如析出沉淀、气体),少了什么就补什么;电解AgNO 3溶液有Ag 和O 2生成,应补Ag 2O ,每生成4 mol Ag 生成1 mol O 2,要恢复原来浓度应加2 mol Ag 2O ,C 项不符合题意。
化学课件——水的电离和溶液pH值

水的电离和溶液pH值水的电离和溶液的pH值是电解质溶液的重点和难点,同时也是高考化学试题的热点。
分析多年的高考化学试题,我们不难发现:水的电离和溶液pH值这一知识点试题每年考并且常考常新。
因此,有必要认真加以训练。
相关知识点1、电解质溶液的酸碱性跟水的电离密切相关。
实验证明,水是一极弱电解质,能微弱电离:H2O+H2OH3O++OH-可简写为:H2OH++OH-。
此电离平衡易受外界条件(温度、电解质等)影响,但遵循平衡移动原理。
实验还证明,在溶液中,在一定温度下,[H+]与[OH-]的乘积是一常数,即[H+]·[OH-]=Kw。
Kw简称为水的离子积。
它是一温度函数,随温度升高而增大。
25℃时,Kw=1×10-14,100℃,Kw=1×10-12。
2、电解质溶液的酸碱性取决于[H+]与[OH-]的相对大小。
在常温下,中性溶液[H+]=[OH-]=1×10-7mol/L,酸性溶液[H+]>[OH-];[H+]>1×10-7mol/L;碱性溶液[H+]<[OH-],[H+]<1×10-7mol/L。
3、电解质稀溶液的酸碱性可用pH值大小来统一量度,其定义式:pH=-1g[H+],同样可定义:pH=-1g[OH-],在常温下,pH+pOH=14。
4、电解质溶液pH值的测定:(1)酸碱指示剂是测定溶液的pH值范围。
常用指示剂有:甲基橙、石蕊、酚酞,并熟记它们的变色范围。
(2)pH试纸是粗确测定溶液的pH 值,应掌握其操作步骤。
(3)测定溶液pH值最精确的方法是用pH计。
解题指导1、解答水电离的相关试题时应注意:(1)运用平衡移动原理来分析水的电离平衡移动—定性判断;(2)运用溶液中[H+]·[OH-]=Kw和水电离出的[H+]=[OH-]掌握相关运算—定量计算。
(3)正确处理矛盾的主要方面与次要方面的关系,比如,在处理溶液的稀释、电离与水解等关系时,一定要抓住主要矛盾。
电解质溶液ppt课件

第三节 弱电解质溶液的电离平衡
一、一元弱酸(碱)的电离平衡 HAc H+ + Ac-
①电离度:达电离平衡时,已电离的分子数和分子 总数之比。单位为1,一般用百分率表示
已电离分子数 α 100 % 分子总数
通常0.1 mol· kg-1溶液中: 强电解质α>30%; 弱电解质α≤5%;
第20页
7 1 c c 1 . 0 10 mol L H OH
酸性溶液:
碱性溶液:
c c H OH
c c H OH
第 8页
第 9页
pH值的测定
pH试纸
pH计(酸度计)
滴定方法
第10页
几种常用酸碱指示剂及其在各种pH值下的颜色
甲基红
溴百里酚蓝
酚酞
第11页
如:计算0.2mol· kg-1的NaCl溶液的凝固点降低值 。 假设NaCl不电离,则i =1:
0 . 2 1 . 86 1 T iK f fb B
0 . 72 K
如果NaCl百分之百电离,则i =2:
T f 0 . 774 K 0 . 2 1 . 86 2
第23页
一些酸在水溶液中的KaΘ和pKaΘ值(25℃)
酸 性 增 强
碱 性 增 强
第24页
③电离平衡常数与电离度的关系
而实验测得的ΔTf却是0.694K
第14页
二、离子氛与离子强度 中心离子周围的那些异号离子群叫做离子氛。
+ -
+
+ +
+
+
第15页
(一)离子氛
强电解质理论: 1. 强电解质在水中完全电离 2. 离子间通过静电力相互作用,在中心离子周围形
高三一轮复习公开课:原电池及其应用-PPT

问题讨论5: 如何理解铅蓄电池的正负极反应和总反应?
铅蓄电池(电瓶)——二次电池
Pb‖H2SO4(aq)‖PbO2
PbSO4不溶于水
负极:Pb — 2e- → Pb2+ + SO42-
√负极反应:Pb — 2e- + SO42- === PbSO4 正极:PbO2 + 2e- → Pb2+ + SO42-
分组讨论并展示负极反应式:
第一组:H2酸性
H2-2e-==2H+
第二组:H2碱性
H2-2e-+2OH-==2H2O
第三组:CH3OH酸性 CH3OH-6e-+H2O==CO2+6H+
第四组:CH3OH碱性 CH3OH-6e-+8OH-==CO32-+6H2O
第五组:CH3OCH3酸性 CH3OCH3-12e-+ 3H2O ==2CO2+12H+
电解质溶液:H2SO4(aq)、KOH(aq)
正极
酸性:O2 + 4e- + 4H+ == 2H2O
碱性:O2 + 4e- + 2H2O == 4OH-
-4
燃料:H2、CH4、CH3OH、CH3OCH3、C2H5OH
酸性:CH4 — 8e- + 2H2O ==
→ 负极
CO2 +8H+
负极
总结: 碱性:CH4 — 8e- + 10OH- == CO32- + 7H2O
第六组:CH3OCH3碱性 CH3OCH3-12e-+16OH-==2CO32-+11H2O
电解质说课稿

电解质说课稿尊敬的各位评委老师:大家好!今天我说课的内容是“电解质”。
一、教材分析“电解质”是高中化学中的重要概念,它不仅是对初中化学知识的深化和拓展,也为后续学习化学平衡、电离平衡等知识奠定基础。
本节课主要包括电解质和非电解质的概念、电解质的电离等内容。
教材首先通过实验引入电解质的概念,让学生观察在溶液中导电和不导电的物质,引发学生的思考和探究欲望。
接着,详细阐述了电解质和非电解质的定义,并通过实例帮助学生理解。
在电解质的电离部分,教材用简单易懂的方式介绍了电离的过程和表示方法,使学生能够初步认识物质在溶液中的存在形式。
二、学情分析学生在初中已经学习了一些溶液的导电性知识,但对于电解质的概念还比较模糊。
他们具备一定的观察能力和实验操作能力,但抽象思维能力和分析问题的能力还有待提高。
在教学中,要充分利用实验和多媒体等手段,引导学生观察、思考和分析,帮助他们逐步建立起电解质的概念。
三、教学目标1、知识与技能目标(1)理解电解质和非电解质的概念,能正确判断常见的电解质和非电解质。
(2)了解电解质的电离过程,会书写常见电解质的电离方程式。
(3)通过实验探究,提高学生的观察能力和实验操作能力。
2、过程与方法目标(1)通过实验观察、分析和归纳,培养学生的科学探究能力和思维方法。
(2)引导学生运用对比、归纳等方法,加深对概念的理解和应用。
3、情感态度与价值观目标(1)激发学生学习化学的兴趣,培养学生严谨求实的科学态度。
(2)让学生体会化学知识与生活实际的密切联系,增强学生学以致用的意识。
四、教学重难点1、教学重点(1)电解质和非电解质的概念。
(2)电解质的电离及电离方程式的书写。
2、教学难点(1)理解电解质的电离过程。
(2)正确判断电解质和非电解质。
五、教学方法为了实现教学目标,突破教学重难点,我将采用以下教学方法:1、实验探究法通过实验让学生直观地感受物质的导电性,引导学生分析实验现象,得出结论。
2、讲授法对于一些抽象的概念和理论知识,如电解质的电离过程,采用讲授法进行讲解,使学生能够更好地理解。
物理化学电解质溶液-课件

( 1 ) Q z F 1 9 6 5 0 0 C m o l 1 0 . 0 1 8 3 m o l = 1 7 6 6 C
(2 )tQ I0 .1 0 7 2 6 56 C C s 17 .0 6 1 0 4s
1 (3)m (O 2)0.0183m ol4M (O 2)
电极上的反应次序由离子的活泼性决定
在电解池中,都用铜作电极
阳极上发生氧化作用
-
- 电源 +
e-
+
e-
Cu
Cu
C u (s ,电 极 ) C u 2 a q 2 e
阴极上发生还原作用
C u2aq2e C u(s)
电极有时也可发生反应
CuSO4
电解池
总反应△rGT,p>0
结论
由以上可归纳出两点结论:
1900年,吉尔伯特(S. W. Gilbert )发 现摩擦静电,人们开始认识电现象。
1799年,伏打(A. Volta)设计伏要电池, 给用直流电进行研究提供了可能。
1807年,戴维(H. Davy)用电解法制备 出金属钠和钾,标志电化学产生。
1833年,法拉第(M. Faraday)提出法拉 第定律,为电化学定量研究和电解工业奠定 了理论基础。
(2)原电池:能够实现化学能转化为电 能的电化学装置。
注意:电解池和原电池可能是一套装置, 如充电电池。
电化学装置的电极命名
电化学装置不论是电解池还是原电池, 电极的命名通常有如下形式:
(1)正极、负极。
(2)阴极、阳极。
注意:习惯上,电解池用阴极、阳极命 名;原电池用正极、负极命名。
正极、负极
高三化学二轮复习:电解质溶液图像类题目分析课件

NaHA Na2A H2A
4.沉淀溶解平衡曲线 (1)“曲线”溶解平衡图像的分析
BaSO4(s) Ba2+(aq)+SO42-(aq)
基本图像
AgCl(s)
Ag+(aq)+Cl-(aq)
Ksp(AgCl) = c(Ag+)×c(Cl-)
→
线上的任意点为平衡点,Ksp不变
对数直线图
MgCO3(s)
K2 HR K3 R-。向一定浓度的 H3RCl2 溶液中滴加 NaOH 溶液,溶液中 H3R2 + 、 H2R + 、 HR 和 R - 的 分 布 系 数 δ(X) 随 pH 变 化 如 图 所 示 。 已 知 δ(X) =
cH3R2++cH2cR+X+cHR+cR-,下列表述正确的是 A.KK21>KK32 B.M 点,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)
SO24-(aq)的平衡常数 K=KKssppSSrrCSOO43 B.a=-6.5 C.曲线④代表含SrCO3(s)的1.0 mol·L-1
Na2CO3溶液的变化曲线
√D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH
≥7.7时才发生沉淀转化
2.(2022·湖南,10)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL 浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lg c(Ag+)与 V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离 子浓度小于1.0×10-5 mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)= 1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。下列说法正确 的是 A.a点:有白色沉淀生成 B.原溶液中I-的浓度为0.100 mol·L-1
高二化学弱电解质电离

③同离子效应
加入与弱电解质电离所产生的离子相同 离子,电离平衡向逆方向移动
CH3COOH
CH3COO-+H+
17
2024年10月13日11时39分
④化学反应
加入能与弱电解质电离产生的离子反应的 物质时,使电离平衡向正移动
CH3COOH
CH3COO-+H+
18
2024年10月13日11时39分
小结:影响电离平衡的因素
Fe3++3OH-
33
2024年10月13日11时39分
问题探讨
试写出NaHSO4、NaHCO3的在水溶液中及熔融状 态下的电离方程式?
在水溶液中:NaHSO4=Na+ + H+ + SO42-
NaHCO3=Na+ + HCO3-
HCO3-
H+ + CO32-
熔融状态:NaHSO4=Na+ + HSO4-
强电解质:在水溶液能够全部电离的电解 质。 弱电解质:在水溶液里只有部分电离的 电解质。
本质区别:是否完全电离!
6
2024年10月13日11时39分
“强电解质溶液的导电能力一定比弱电解质溶液强”对吗?
溶液导电性强弱是由溶液中自由移动离子浓度
和离子电荷数决定。 7
2024年10月13日11时39分
3、影响电离平衡的因素 ①温度 电离过程是吸热过程,升高温度,
平衡向电离方向移动
CH3COOH
CH3COO-+H+
15
2024年10月13日11时39分
②浓度
加水稀释向电离的方向移动,电离程 度增大 增加弱电解质浓度,向电离的方向移 动,但电离程度减小
202化学复习22弱电解质的电离平衡含解析

课时作业22 弱电解质的电离平衡时间:45分钟一、单项选择题(每小题只有一个选项符合题意)1.(2020·河北石家庄辛集中学模拟)液态化合物AB会发生微弱的自身电离,电离方程式为AB A++B-,在不同温度下其平衡常数K(25 ℃)=1。
0×10-14,K(35 ℃)=2。
1×10-14。
则下列叙述正确的是(D)A.c(A+)随温度的升高而降低B.35 ℃时,c(A+)〉c(B-)C.AB的电离程度:α(25 ℃)>α(35 ℃)D.AB的电离是吸热过程解析:升高温度,K增大,说明AB的电离程度增大,所以c(A+)随着温度的升高而增大,A项错误;根据题给信息,无法推出35 ℃时,c(A+)>c(B-),B项错误;升高温度,K增大,AB 的电离程度增大,所以AB的电离程度:α(25 ℃)〈α(35 ℃),C 项错误;升高温度,平衡向吸热反应方向移动,则AB的电离是吸热过程,D项正确。
2.下列事实中,能说明MOH是弱碱的有(B)①0.1 mol·L-1 MOH溶液可以使酚酞试液变红②0.1 mol·L-1 MCl溶液呈酸性③0。
1 mol·L-1MOH溶液的导电能力比0.1 mol·L-1 NaCl溶液弱④等体积的0。
1 mol·L-1 MOH溶液与0。
1 mol·L-1 HCl溶液恰好完全反应A.①②③B.②③C.②④D.③④解析:①0。
1 mol·L-1 MOH溶液可以使酚酞试液变红,说明MOH能电离出氢氧根离子,而不能说明MOH的电离程度,所以不能证明MOH是弱碱;②0.1 mol·L-1MCl溶液呈酸性,说明MCl 为强酸弱碱盐,则MOH为弱碱;③溶液的导电能力与离子浓度和离子所带的电荷数有关,0.1 mol·L-1 MOH溶液的导电能力比0.1 mol·L-1NaCl溶液的弱,说明MOH溶液中离子浓度比NaCl 溶液中离子浓度小,MOH部分电离,为弱碱;④等体积的0。
初中化学电解溶液教案

初中化学电解溶液教案
一、教学目标:
1. 了解电解的基本概念和原理;
2. 掌握电解质和非电解质的区别;
3. 理解电解质溶液的导电性;
4. 掌握电解质溶液的电解过程及相关实验操作。
二、教学重点:
1. 电解质和非电解质的区别;
2. 电解质溶液的导电性;
3. 电解质溶液的电解过程及相关实验操作。
三、教学难点:
1. 电解质溶液的导电性的表达方法;
2. 电解质溶液的电解过程的理解。
四、教学过程:
1. 导入:通过展示一些常见的电解质和非电解质溶液的实例,引发学生对电解的兴趣,让学生思考为什么电解质溶液能导电,而非电解质溶液不能导电。
2. 导学:介绍电解的定义、原理和分类,引导学生探讨电解质和非电解质的区别,并通过实验观察电解质溶液的导电性。
3. 实验操作:学生分组进行电解质溶液的实验,观察电解过程,并记录实验现象和结果。
4. 总结:引导学生归纳电解质溶液的导电性规律和电解过程中的变化,让学生理解电解的实质。
5. 提高:通过举一反三的方式,让学生应用所学知识解决相关问题,并拓展关于电解的学习内容,拓宽学生的思维。
五、课堂实践:
1. 学生根据所学知识,设计一个实验,验证不同浓度的电解质溶液对导电性的影响;
2. 学生进行小组讨论,总结电解质溶液的应用领域,并阐述其重要性;
3. 学生通过展示电解质溶液的实验操作过程和实验结果,展示所学知识。
六、教学反思:
本节课主要通过实验操作的方式,让学生亲身体验电解质溶液的导电性和电解过程,培养学生的动手能力和实验观察能力。
教师应注重引导学生提出问题、解决问题和归纳总结,提高学生的创新思维和综合能力。
冶金电化学第二章..

电解质水溶液的动态性质
2018/10/9
1
上次课的主要内容
1、什么是活度和和活度系数?
活度:即“有效浓度”
活度系数:活度与浓度的比值,反映了粒子间相 互作用所引起的真实溶液与理想溶液的偏差。 2、标准状态是如何规定的? 规定:活度等于1的状态为标准态。对于固态、 液态物质和溶剂,这一标准态就是它们的纯物 质状态,即规定纯物质的活度等于1。这种假想 状态同时具备无限稀释溶液的性质(γ=1)和活 度为1的两个特性。
(2-8)
18
三、离子独立移动定律及离子摩尔电导率
在无限稀释时,所有电解质都全部电离,而且离 子间一切相互作用均可忽略,因此离子在一定电 场作用下的迁移速度只取决于该种离子的本性而 与共存的其它离子的性质无关。
正离子的极限 摩尔电导率
m
m,
m,
(2-9)(离子独立移动定律)
2018/10/9
(2-13)
28
(2-13)式中Ex为x方向的电位梯度,U+和U-均为 比例系数,则U+和U-称为离子淌度,也称离子迁 移率,离子淌度的定义:单位电位梯度或单位电 场强度下离子的迁移速度。单位为
m s V
2
1
1
(米2.秒-1.伏特-1)。
各种离子中的H+的淌度最大,在25℃时无限稀溶 液中淌度为36.30×10-8m2.s-1.V-1;其次是OH-, 淌度为20.52×10-8m2.s-1.V-1;一般离子淌度为 10×10-8m2.s-1.V-1以下。
m ,
m
m , m
(2-16)
t U /( U U )
电解质溶液的电导测定【最新精选】

电解质溶液的电导一、实验目的1.掌握电导率法测定弱酸标准电离平衡常数的原理和方法;2.学会电导率仪的使用方法。
3.巩固电解质溶液电导的基本概念。
二、实验原理电解质溶液的电导的测定,通常采用电导池,若电极的面积为A,两电极的间的距离为l,则溶液的电导L 为L = KA / l 式中K 称为电导率或比电导,为l=1m,A=1m2 时溶液的电导,K 的单位是S/m.电解质溶液的电导率与温度、溶液的浓度及离子的价数有关.为了比较不同电解质溶液的导电能力.通常采用涉及物质的量的摩尔电导率Λm 来衡量电解质溶液的导电能力.Λm=K/C 式中Λm 为摩尔电导率(Sm2 /mol) 注意,当浓度C 的单位是mol/L 表示时,则要换算成mol/m3,后再计算.因此,只要测定了溶液在浓度C 时的电导率K 之后,即可求得摩尔电导率Λm 。
摩尔电导率随溶液的浓度而变,但其变化规律对强、弱电解质是不同的.对于强电解质的稀溶液有:式中A 常数, 0,m Λ也是常数,是电解质溶液 无限稀释时的摩尔电导,称为无限稀释摩尔电导。
因此以Λm..和根号C 的关系作图得一直线,将直线外推至与纵轴相交,所得截距即 为无限稀释C A m m -Λ=Λ0,时的摩尔电导0,m Λ.对于弱电解质,其0,m Λ值不能用外推法求得.但可用离子独立运动定律求得:0,m Λ=I0,++I0,-式中I0,+ 和I0,-分别是无限稀释时正、负离子的摩尔电导,其值可通过查表求得。
根据电离学说,可以认为,弱电解质的电离度α等于在浓度时的摩尔电导Λ与溶液在无限稀释时的电导0,m Λ之比,即另外还可以求得AB 型弱电解质的Ka 的值,所以,通过实验测得α即可得a K 值。
三、实验仪器与试剂仪器:电导仪,恒温槽 ,移液管,容量瓶;药品:0.1mol KCl 溶液,电导水。
四、实验步骤(1) 配制溶液。
用0.10 mol·L-1的kcl 溶液分别配制0.05 mol·L-1、0.01 mol·L-1、0.005 mol·L-1、0.001 mol·L-1的kcl 溶液各100mL 。
常用电解质

常用电解质1. 说起常用电解质,那可真是我们生活中的"小能手"啊!化学老师总爱说:"这些物质就像是体内的小邮递员,负责传递各种重要信息。
"2. 氯化钠可是常用电解质中的"老大哥"。
小明笑着说:"这不就是咱们天天吃的盐嘛!"可不是嘛,它在人体里可重要了,帮助维持细胞的正常功能。
3. 氯化钾也是个"热心肠",它在维持心脏节律方面可是个好帮手。
张老师打了个有趣的比方:"它就像是心脏的小指挥家,帮助心脏保持稳定的节奏。
"4. 碳酸氢钠,也就是我们常说的小苏打,可是个多面手。
李阿姨总说:"这东西不光能做蛋糕,还能调节体内酸碱平衡,简直是居家必备!"5. 磷酸盐在运动饮料中经常露面,它就像是运动员的能量补充站。
小红做完体育课后感叹:"喝了运动饮料,感觉整个人都活过来了!"6. 硫酸镁,也就是泻盐,在医疗上可有大用处。
王医生说:"它就像是身体的清道夫,帮助清理肠道。
"不过可不能随便吃,得听医生的建议。
7. 葡萄糖电解质溶液在医院可常见了,它就像是"生命之水"。
护士小张说:"病人输液时用的就是它,补充水分和电解质的好搭档。
"8. 乳酸钠在食品工业中可活跃了,它是个调味高手。
食品厂的老李说:"这玩意儿能让火腿肠更有嚼劲,还能延长保质期,简直是食品界的万能小助手!"9. 醋酸钠也是个有趣的家伙,它在实验室里可是个"暖宝宝"。
化学课上,老师演示了它的结晶放热现象,把同学们都看呆了。
10. 柠檬酸盐在饮料中经常出现,它是个"调味大师"。
小华尝了一口柠檬汽水说:"这酸爽的感觉,太解暑了!"11. 碳酸钙虽然不太溶于水,但它可是骨骼和牙齿的"守护神"。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 2 页第22课-电解质溶液1.(2011江苏高考14)下列有关电解质溶液中微粒的物质的量浓度关系正确的是A.在0.1 mol ·L -1NaHCO 3溶液中:c(Na +)>c(HCO 3-)>c(CO 32-)>c(H 2CO 3)B.在0.1 mol ·L -1Na 2CO 3溶液中:c(OH -)-c(H +)=c(HCO 3-)+2c(H 2CO 3-)C.向0.2 mol ·L -1NaHCO 3溶液中加入等体积0.1 mol ·L-1NaOH 溶液:c(CO 32-)> c(HCO 3-)> c(OH -)>c(H +)D.常温下,CH 3COONa 和CH 3COOH 混合溶液[pH =7,c(Na +)=0.1 mol ·L -1]:c(Na +)=c(CH 3COO -)>c(CH 3COOH)>c(H +)=c(OH -) 2.(2011安徽高考12)室温下,将1.000mol ·L -1盐酸滴入20.00mL 1.000mol ·L -1氨水中,溶液pH 和温度随加入盐酸体积变化曲线如下图所示。
下列有关说法正确的是A. a 点由水电离出的c(H +)=1.0×10-14mol/LB. b 点:c(NH 4+)+c(NH 3·H 2O)=c(Cl -)C.c 点:c(Cl -)= c(NH 4+)D.d 点后,溶液温度略下降的主要原因是NH 3·H 2O 电离吸热3.(2011浙江高考13)海水中含有丰富的镁资源。
某同学设计了从模拟海水中制备MgO 的实验方案:1.0 L 模拟海(25℃,pH M gO模拟海水中的离 子浓度(mol /L)Na+Mg 2+Ca2+Cl ―3H C O -0.4390.0500.0110.5600.001注:溶液中某种离子的浓度小于1.0×10-5 mol/L ,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:K sp (CaCO 3)=4.96×10-9;K sp (MgCO 3)=6.82×10-6; K sp [Ca(OH)2]=4.68×10-6;K sp [Mg(OH)2]=5.61×10-12。
下列说法正确的是 A .沉淀物X 为CaCO 3B .滤液M 中存在Mg 2+,不存在Ca 2+C .滤液N 中存在Mg 2+、Ca 2+D .步骤②中若改为加入4.2 g NaOH 固体,沉淀物Y 为Ca(OH)2和Mg(OH)2的混合物4.(2011福建高考10)常温下0.1mol·L -1醋酸溶液的pH=a ,下列能使溶液pH=(a +1)的措施是A .将溶液稀释到原体积的10倍B .加入适量的醋酸钠固体C .加入等体积0.2 mol·L -1盐酸D .提高溶液的温度5.(2011广东非公开11)对于0.1mol •L -1 Na 2SO 3溶液,正确的是A 、升高温度,溶液的pH 降低B 、c (Na +)=2c (SO 32―)+ c (HSO 3―)+ c (H 2SO 3)C 、c (Na +)+c (H +)=2 c (SO 32―)+ 2c (HSO 3―)+ c (OH ―)D 、加入少量NaOH固体,c (SO 32―)与c (Na +)均增大6.(2011山东高考14)室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是A.溶液中导电粒子的数目减少B.溶液中)()()(33--∙OHc COOH CH c COOCH c 不变C.醋酸的电离程度增大,c(H +)亦增大D.再加入10mlpH=11的NaOH 溶液,混合液pH=7 7.(2011天津)25℃时,向10ml0.01mol/LKOH 溶液中滴加0.01mol/L 苯酚溶液,混合溶液中粒子浓度关系正确的 A.pH >7时,c(C 6H 5O -)>c(K +)>c(H +)>c(OH -) B.pH <7时,c(K +)>c(C 6H 5O -)>c(H +)>c(OH -)C.V[C 6H 5OH(aq)]=10ml 时,c(K +)=c(C 6H 5O -)>c(OH -)=c(H +)D.V[C 6H 5OH(aq)]=20ml 时,c(C 6H 5O-)+c(C 6H 5OH )=2c(K +)8.(2011天津)下列说法正确的是 A.25℃时NH 4Cl 溶液的K W 大于100℃时NH 4Cl 溶液的K WB.SO 2通入碘水中,反应的离子方程式为SO 2+I 2+2H 2O=SO 32-+2I -C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba 2+、AlO 2-、NO 3-D.100℃时,将pH =2的盐酸与pH =12的NaOH 溶液等体积混合,溶液显中性9.(2011重庆) 对滴有酚酞试液的下列溶液,操作后颜色变深的是A.明矾溶液加热B.CH 3COONa 溶液加热C.氨水中加入少量NH 4Cl 固体D.小苏打溶液中加入少量NaCl 固体10.(2011新课标全国)将浓度为0.1mol ·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是 A. c (H +)B. )(HF K a C.)()(+-H c F c D.)()(HF c H c +11.(2011海南)用0.1026mol ·L -1的盐酸滴定25.00mL 未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为A. 22.30mLB. 22.35mLC. 23.65mLD. 23.70Ml12.(2011全国II 卷6)等浓度的系列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的PH 由小到大排列的正确是 A .④②③① B .③①②④C .①②③④D .①③②④13.(2011全国II 卷9)温室时,将浓度和体积分别为c 1、v 1的NaOH 溶液和c 2、v 2的CH 3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是 A .若PH>7时,则一定是c 1v 1=c 2v 2B .在任何情况下都是c (Na +)+c (H +)=c (CH 3COO-)+c (OH -)C .当pH=7时,若V 1=V 2,则一定是c 2>c 1D .若V 1=V 2,C 1=C 2,则c (CH 3COO -)+C(CH 3COOH)=C(Na +)14.(2011四川)25℃时,在等体积的 ① pH=0的H 2SO 4溶液、②0.05mol/L 的Ba (OH )2溶液,③pH=10的Na 2S 溶液,④pH=5的NH 4NO 3溶液中,发生电离的水的物质的量之比是 A.1:10:1010:109 B.1:5:5×109:5×108C.1:20:1010:109D.1:10:104:10915.(2011上海19)常温下用pH 为3的某酸溶液分别与pH 都为11的氨水、氢氧化钠溶液等体积混合得到a 、b 两种溶液,关于这两种溶液酸碱性的描述正确的是 A .b 不可能显碱性B . a 可能显酸性或碱性C .a 不可能显酸性D .b 可能显碱性或酸性 16.(2011天津,14分)工业废水中常含有一定量的Cr 2O 72—和CrO 42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。
常用的处理方法有两种。
方法1:还原沉淀法该法的工艺流程为其中第①步存在平衡:2CrO 42—(黄色)+2H +Cr 2O 72—(橙色)+H 2O(1)若平衡体系的pH=2,则溶液显 色. (2)能说明第①步反应达平衡状态的是 。
a .Cr 2O 72—和CrO 42—的浓度相同b .2v (Cr 2O 72—) =v (CrO 42—)c .溶液的颜色不变(3)第②步中,还原1mol Cr 2O 72—离子,需要________mol 的FeSO 4·7H 2O 。
(4)第③步生成的C r (O H)3在溶液中存在以下沉淀溶解平衡:C r (O H )3(s)Cr 3+(aq)+3OH —(aq)常温下,C r (O H )3的溶度积Ksp =c(Cr 3+)·c 3(OH —)=10-32,要使c(Cr 3+)降至10-5mol/L ,溶液的pH 应调至 。
方法2:电解法该法用Fe 做电极电解含Cr 2O 72—的酸性废水,随着电解进行,在阴极附近溶液pH 升高,产生C r (O H )3沉淀。
(5)用Fe 做电极的原因为。
(6)在阴极附近溶液pH 升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
1.(09年安徽理综·10)在溶液中能大量共存的一组离子或分子是A .NH 4+、H +、NO 3-、HCO 3-B .K + 、Al 3+、SO 42- 、NH 3·H 2OC .Na +、K +、SO 32-、Cl 2D .Na + 、CH 3COO -、CO 32-、OH -2.(09年安徽理综·13)向体积为0.05mol·L -1CH 3COOH溶液中加入体积为V b 的0.05mol·L -1KOH 溶液,下列关系错.误.的是 A .V a >V b 时:c (CH 3COOH) +c (CH 3COO -)>c (K +) B .V a =V b 时:c (CH 3COOH) +c (H +)>c (OH -) C .V a <V b 时:c (CH 3COO -)>c (K +)> c (OH -)> c (H ) D .V a 与V b 任意比时:c (K +)+ c (H +) =c (OH -)+ c(CH 3COO -)3.(09年北京理综·5)化学与人类生活密切相关。
下列说法正确的是A .苯酚有一定毒性,不能作消毒剂和防腐剂B .白磷着火点高且无毒,可用于制造安全火柴C .油脂皂化生成的高级脂肪酸钠是肥皂的有效成分D .用食醋去除水壶中的水垢时所发生的是水解反应 4.(09年北京理综·8)下列叙述正确的是A .将CO 2通入BaCl 2溶液中至饱和,无沉淀产生;再通人SO 2,产生沉淀B .在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO 3)2固体,铜粉仍不溶解C .向AlCl 3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO 4溶液,沉淀消失D .纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO 4固体,速率不改变5.(09年北京理综·11)有4种混合溶液,分别由等体积0.1 mol /L 的2种溶液混合而成:①CH 3COONa 与HCl ;②CH 3COONa 与NaOH ;③CH 3COONa 与NaCl ;④CH 3COONa 与NaHCO 3 下列各项排序正确的是A .pH :②>③>④>①B .c (CH 3COO 一):②>④>③>①C .溶液中c (H +):①>③>②>④D .c (CH 3COOH):①>④>③>②6.(09年广东化学·9)下列浓度关系正确的是A .氯水中:c (Cl 2)=2c (ClO -)+c (Cl -)+C(HCl)}第 2 页 共 2 页B .氯水中:c (Cl -)>c (H +)>c (OH -)>c (ClO -)C .等体积等浓度的氢氧化钠与醋酸混合:c (Na +)=c (CH 3COO -) D .Na 2CO 3溶液中:c (Na +)>c (CO 32-)>c (OH -)>c (HCO 3-)>c (H +)7.(09年广东化学·12)下列离子方程式正确的是A .向盐酸中滴加氨水:H ++OH -=H 2OB .Fe(OH)3溶于氢碘酸:Fe(OH)3+3H +=Fe 3++3H 2OC .铜溶于稀硝酸:3Cu+8H ++2NO 3-=3Cu 2++2NO↑+4H 2OD .Na 2S 2O 3溶液中通入足量氯气:S 2O 32-+2Cl 2+3H 2O=2SO 32-+4Cl -+6H +8.(09年广东化学·16)磷钨酸H 3PW 12O 40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。
