各种化学元素溶解方法
高考化学溶解度知识点

高考化学溶解度知识点化学是高考中难度较大的科目之一,而其中的溶解度知识点更是难倒了许多学生。
溶解度是指在一定温度下,单位溶剂中溶质在饱和条件下溶解的质量或体积。
溶解度的大小与各种因素相关,包括溶质本身的性质、溶剂的性质、温度和压力等。
接下来,我们将从不同角度探讨高考化学中的溶解度知识点。
一、概念与计算溶解度通常用溶质在一定量溶剂中的质量或体积来表示。
常见的单位包括摩尔溶解度(mol/L)、质量溶解度(g/L)等。
在计算溶解度时,需要提前了解溶质和溶剂的摩尔质量或分子式,并根据方程式中的系数之比进行计算。
此外,还需要关注温度对溶解度的影响,因为溶解度通常随温度的升高而增加。
二、溶解度曲线和饱和度对于溶解度的研究,我们通常会绘制溶解度曲线以便更直观地了解其变化规律。
溶解度曲线是指在不同温度下,溶质在溶剂中的质量或体积随溶剂量的变化关系。
通过观察溶解度曲线,我们可以得出溶解度与浓度的关系,从而了解饱和度的概念。
饱和度是指在给定的条件下,溶液中溶质的溶解量达到最大,无法再溶解更多溶质的状态。
同时,饱和度还与温度相关,温度升高会使溶质更易溶解。
三、溶解度与溶剂的极性溶解度的大小与溶质和溶剂之间相互作用力的性质有关。
一个常见的规律是“相似溶解相似”,即极性溶质溶解于极性溶剂中,而非极性溶质溶解于非极性溶剂中。
这是因为极性分子和极性溶剂分子之间可以发生氢键或离子-极化作用,有利于溶解。
而非极性分子由于缺乏这样的相互作用力,通常溶解度较小。
四、共价键和离子键物质的溶解度在溶解度的讨论中,共价键物质和离子键物质是两大重要的类别。
共价键物质通常是由非金属元素组成,具有共价键的特征。
这类物质在溶解时,通常需要打破一些共价键才能进行溶解。
而离子键物质则由金属和非金属元素通过离子键连接而成。
离子键物质在溶解时会形成离子,从而与溶剂形成新的作用力,这有利于其溶解。
因此,共价键物质溶解度较小,而离子键物质溶解度较大。
五、影响溶解度的因素除了溶质和溶剂的性质外,溶解度还受到温度、压力和浓度的影响。
溶解性口诀总汇(附溶解性表)

溶 解 性硝酸盐,Fra bibliotekO₃~都易溶。
亚硝酸盐,NO₂ˉ
除AgNO₂难溶外都易溶。
醋酸盐,C₂H₃O₂ˉ
除Ag⁺,Hg₂²⁺,Bi³⁺⁵等盐难溶外都易溶。
氯化物,Cl⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺⁶等盐难溶外都易溶。
溴化物,Br⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Pt²⁺÷等盐难溶外都易溶。
碘化物,I⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺,Bi³⁺⁶等盐难溶外都易溶。
硫酸盐,so₄²⁻
除Pb²⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都易溶。
亚硫酸盐,so₃²⁻
除Na⁺,K⁺,NH₄⁺³等盐难溶外都易溶。
硫代硫酸盐,S₂O₃²⁻
除Ba²⁺,Pb²⁺,Ag⁺≤等盐难溶外都易溶。
硫化物,s²⁻
砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
草酸盐,C₂O₄²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
硫代氰酸盐,SCN⁻
除Pb²⁺,Cu²⁺Ag⁺,Hg₂²⁺,Cd²⁺等盐难溶外都易溶。
氧化物,o²⁻
除Na⁺,K⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都难溶。
氢氧化物, OH⁻
除Na⁺,K⁺,Ba²⁺,等的氢氧化物外都难溶, Sr²⁺,Ca²⁺的氢氧化物微溶。
除Na⁺,K⁺,NH₄⁺,Ca²⁺,sr²⁺,Ba²⁺⁵等盐难溶外都难溶。
磷酸盐,PO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
亚砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺¹等盐难溶外都难溶。
碳酸盐,CO₃²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
各种元素溶解度

346
硫代硫酸铵 (NH4)2S2O3
2.15
钒酸铵
NH4VO3
0.48 0.84 1.32
2.42
钯、钡、铋、铂、钚
物质
化学式
氢氧化钯 (II)
Pd(OH)2
0°C 10°C 20°C 30°C
4.106×10-
10
40°C
50° 60° 70° 80° 90° 100° CCCCC C
氢氧化钯 (IV)
4.642×10
-2
硝酸 铬
Cr(NO3)3
108
124 130
152
高氯 酸铬
Cr(ClO4)3
104
123 130
硫酸 铬
叠氮 化亚 汞
Cr2(SO4)3 ·18H2O Hg2(N3)2
220
2.727×10
-2
溴化 亚汞
Hg2Br2
1.352×10
-6
碳酸 亚汞
Hg2CO3
4.351×10
-7
4
2.868×10-
7
7.761×10-
4
1.096×10-
10
1.561×10-
20
3.109×10-
11
1.352×10-
7
3.144×10-
4
3.622×10-
4
7.998×10-
2
27.7
49.9 67.3 60.3
物质
化学式
一氧化氮 NO
一氧化二 氮
N2O
铬酸镝(III)
Dy2(CrO4) 3·10H2O
97.2
硫酸氢铵 NH4HSO4
100
酒石酸氢铵 NH4HC4H4O6
初中化学溶解度表及口诀

初中化学溶解度表及口诀
初中化学溶解度表及口诀如下:
口诀:
钾钠铵盐硝酸盐,完全溶解不困难,氯化亚汞氯化银,硫酸钡和硫酸铅,生成沉淀记心间,氢硫酸盐和碱类,碳酸磷酸硝酸盐,可溶只有钾钠铵。
钾钠铵硝皆可溶,盐酸不溶银亚汞;硫酸不溶钡和铅,碳磷酸盐多不溶;多数酸溶碱少溶,只有钾钠铵钡钙。
钾钠铵盐硝酸盐,溶入水中都不见;硫酸盐类不溶钡,氯化物中不溶银;碳酸盐类多不溶,只有钾钠铵盐溶。
溶解度表:
钾盐、钠盐、铵盐、硝酸盐都溶于水。
硫酸盐除了硫酸钡、硫酸铅不溶,硫酸钙、硫酸银微溶外,其他都溶。
盐酸盐除了氯化银不溶外,其他都溶。
碳酸盐除了碳酸钾、碳酸钠、碳酸铵溶外,其他都不溶。
需要注意的是,口诀和表格只是帮助记忆的工具,具体物质的溶解度还需要参考实验数据和资料。
此外,溶解度不仅受物质本身性质的影响,还与温度、压强等条件有关。
因此,在理解和应用溶解度概念时,需要综合考虑各种因素。
纤维素溶解常见方法

纤维素溶解常见⽅法2018年04⽉纤维素溶解常见⽅法黄锋1朱达2(1南京林业⼤学理学院⾼分⼦材料与⼯程专业,江苏南京210037;2南京林业⼤学理学院材料化学,江苏南京210037)摘要:纤维素作为储量丰富的天然⾼分⼦材料,越来越多的被⼈类使⽤,本⽂总结了纤维素常见的溶解⽅法,并探讨了各种溶解⽅法的优缺点。
关键词:纤维素;溶解1纤维素简介在整个地球上的可再⽣资源中,最为丰富的⼀种资源就是纤维素,纤维素属于⼀种可再⽣的⾼分⼦材料,它主要是通过葡萄糖的聚合⽣成的,⾃然界中的这种纤维素⼴泛存在。
随着不可再⽣资源的不断消耗,⼈们对天然⾼分⼦也表现出了极⼤的兴趣。
它也是当前的⼀种⾮常重要的化⼯原料。
2纤维素结构纤维素中含有的基本元素是碳氢氧这三种,基本的结构单元是C 6H 10O 5。
属于⼀种线性的⾼分⼦材料,β-D -是其中的⼀个基本构成单元,⽽各个葡萄糖之间的连接主要是依靠的化学键是1-4-。
纤维素分⼦的羟基上的氢原⼦具有很强的极性,会与氧原⼦上的孤对电⼦相互吸引,通过取向的氢键,纤维素形成了多种类型的超分⼦半晶态结构,从⽽导致化学试剂很难进⼊纤维素分⼦中,并与其发⽣相互反应。
3纤维素的传统溶解⽅法3.1铜氨法在⼀百多年前,S ch weiz 等⼈将氨⽔与氢氧化铜放在⼀起进⾏反应,就能⽣成⼀种蓝⾊的溶液,⽽这种溶液能够具有很强的溶解纤维素的能⼒,⼈们称之为铜氨法溶解机理,普遍认为,是纤维素与铜氨溶液反应⽣成了⼀种配位的化合物,⽽该化合物⼜能在⽔中进⾏溶解。
3.2黏胶法配制时选⽤的原料为棉短绒与⽊材等纤维素,以此来配制成⼀种浆泊,然后将该溶液与浓度维持在18%左右,温度控制在18到25摄⽒度之间的NaOH 溶液混合在⼀起,接着就对浆泊的质量进⾏压榨,使之产⽣⼀种碱性的纤维素。
⽽降解后⽣成的纤维素同CS 2进⾏反应就能⽣成⼀种纤维素黄原酸酯,能够在强碱中被溶解掉,⽣成相应的黏胶液。
对其进⾏⼀系列的熟成,脱泡,以及过滤后,再在纺丝机上的喷丝头中压⼊⼀定量的硫酸与硫酸钠,通过浸浴,将其凝固拉伸,最终制成丝。
化学溶解度表和化学价的口诀

化学溶解度表和化学价的口诀溶解性口诀一:1钾钠铵盐溶水快,2硫酸盐除去钡铅钙。
3氯化物不溶氯化银4硝酸盐溶液都透明。
4口诀中未有皆下沉。
溶解性口诀二:钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀三:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵化学价合价一:一价氟氯溴碘氢,还有金属钾钠银。
二价氧钡钙镁锌,铝三硅四都固定。
氯氮变价要注意,一二铜汞一三金。
二四碳铅二三铁,二四六硫三五磷。
常见元素的主要化合价二:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀三:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;全铜以二价最常见。
常见根价口诀:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
钢铁中金属元素的溶解方法和作用

主要以固溶体存在,硅化物有MnSi或FeMnSi;少量以硅酸盐及游离SiO2形式成为非金属夹杂;在高碳钢有少量SiC。
单质硅与HF作用,与其他酸不起作用,能溶解强碱;硅化物能溶解于酸,难溶硅化物需用HNO3-HF或H2SO4-H3PO4溶解。
硅含量高时,溶解过程产生硅酸沉淀,为消除硅酸影响,一是加HF成SiF4其他逸出,二是脱水产生SiO2沉淀滤去。
Fe3P是硬而脆的物质,磷含量高形成Fe3P,增加钢的冷脆敏感性,产生焊接裂纹。钢中磷高于0.1%会发生以上危害。
S
主要以硫化物存在钢中,有大量锰存在时形成MnS和FeS。在钢中分布有偏析。
硫化物一般易溶于酸中,在非氧化性酸中生成硫化氢逸出,在氧化性酸中生成硫酸盐。
硫在化学分析中,通常表现在气体容量法定碳时,必须要考虑良好的脱硫剂,否则会使碳含量结果偏高。
浓硝酸对铁有钝化作用,所以在溶解镍钢时,镍含量低用硝酸(1+3)或盐酸(1+1);含镍高的用硝酸(1+3)。
主要是离子有色对比色有影响。镍的隐蔽剂除氰化物外,很少有与之络合能减少镍离子的颜色隐蔽剂。因此需考虑试样空白或通过分离镍而消除其影响。
使钢具有韧性、防腐抗酸性、高导磁性,使晶粒细化提高淬透性、增加硬度。
钨高时极易水解产生混浊,将其分离较困难,用钨酸形式分离还会有吸附,消除此影响方法有:一是加磷酸、酒石酸或柠檬酸掩蔽,二是冒硫酸或高氯酸烟时钨酸脱水后过滤,三是强碱使钨酸转变为可溶性的钨酸钠。
增加钢的回火稳定性、红硬性、热强性,增加耐磨性。
Al
主要以金属固溶体存在,可以形成AlN, Al2O3,(FeMn)O·Al2O3,CaO·Al2O3和·AlOxNy夹杂物。
N
主要以氮化物如Fe4N,Mn3N2,AlN,BN,TiN,VN,CrN等,只有极少数成为固溶体。
不锈钢各元素的化学分析方法

硅的分析一、方法概要试样以稀酸溶解,在适宜酸度下,硅酸与钼酸铵作用,生成硅钼离子,在草酸的存在下,以硫酸亚铁铵还原呈硅钼兰,比色测得其含量。
二、分析试剂1、稀王水于735毫升水中加浓盐酸200毫升,加浓硝酸65毫升,摇匀。
2、钼酸铵5% 水溶液(在60℃以下温热溶解)。
3、草酸1%4、硫酸亚铁铵6%(每100毫升溶液中加1:1硫酸1毫升)摇匀。
三、分析操作称样0.1克于150毫升三角瓶中,加稀王水25毫升低温溶样,溶毕试样后,取下加水约30毫升冷至室温,用水稀释至100毫升容量瓶中至刻度摇匀,分取此试液10毫升于150毫升三角瓶中,加5%钼酸铵5毫升,在热水浴中加热30秒后取下,冷至室温,加草酸(1%)50毫升使钼酸铁沉淀溶解,立即加6%硫酸亚铁铵5毫升摇匀,比色,以水为空白。
721、722型比色计波长680nm 3公分比色皿曲线常数计算常数K=标样含量差/标样消光差Si%=K×(试样的消光—标样的消光)+标样的含量注:1、溶解试样是关键,低温溶样过程中视溶样情况可适当少加些蒸馏水,继续溶样,使试样完全溶解。
2、如遇碳高或溶液浑浊时,需过滤后再吸取母液。
3、各种试剂必须加准确。
4、含量:<0.40%时,称样200毫克在0.40%—1.5%时,称样100毫克>1.5%时,称样50毫克锰的分析一、方法概要试样经酸溶解后,以硝酸银作催化剂,用过硫酸铵氧化锰呈高锰酸,比色,测得其含量。
二、分析试剂1、红水盐酸:硝酸1:12、硫磷混酸硫酸:磷酸2:13、硝硫混酸硝酸:硫酸2:1(碳高时用此溶液)4、磷酸浓(高碳钢用)5、硝酸银0.5%水溶液6、过硫酸铵10%水溶液三、分析操作1、低碳不锈钢Mn的分析操作称样100毫克于150毫升三角瓶中,加红水5毫升低温溶毕试样后,加硫磷混酸(2:1)7毫升,继续加热蒸发至冒硫酸烟,取下稍停,加水25毫升,加硝酸银25毫升,加过硫酸铵25毫升,低温加热使溶液呈稳定红色后,再上大火煮沸30秒,氧化锰呈高锰酸,取下冷却至室温,比色,以水为空白。
各种元素在水中的溶解度列表

2.42
化学式
0 °C
10 °C
20 °C 4.106×10 5.247×10
-10 -14
30 °C
40 °C
50 °C
60 °C
70 °C
80 °C
90 °C
100 °C
氢氧化钯(II) 氢氧化钯(IV) 乙酸钡 砷酸钡 叠氮化钡 溴酸钡 溴化钡 碳酸钡 氯酸钡 氯化钡 氯酸钡 铬酸钡 氰化钡 亚铁氰化钡
7.14 0.265 0.244 0.234 0.205
钨酸钙 氟化锆 硫酸锆 砷酸镉 苯甲酸镉 溴酸镉 溴化镉 碳酸镉 氯酸镉 氯化镉 氰化镉 亚铁氰化镉 氟化镉 甲酸镉 氢氧化镉 碘酸镉 碘化镉 硝酸镉 草酸镉
CaWO4 ZrF4 Zr(SO4)2·4H2O Cd3(AsO4)2 Cd(C7H5O2)2 Cd(BrO3)2 CdBr2 CdCO3 Cd(ClO3)2 CdCl2 Cd(CN)2 Cd2Fe(CN)6 CdF2 Cd(HCO2)2 Cd(OH)2 Cd(IO3)2 CdI2 Cd(NO3)2 CdC2O4.3H2O
126
166
2.32 100 33.8 128 33.2 137 32.7 147 33.5 154 31.1 159 29.7
3.02
3.42 17.1
4.71 17.5
6.87 17.9
8.55
8.7 18.4
213
278
295
312
氯酸钙 铬酸钙 磷酸二氢钙 氟化钙 氟硅酸钙 甲酸钙 磷酸氢钙 氢氧化钙 碘酸钙 碘化钙 钼酸钙 硝酸钙 亚硝酸钙 草酸钙 高氯酸钙 高锰酸钙 磷酸钙 硒酸钙 硫酸钙
7.298×10 2.868×10 7.761×10 1.096×10 1.561×10 3.109×10
高中化学常见物质分离提纯的10种方法

高中化学常见物质分离提纯的10种方法1.结晶和重结晶:利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3。
2.蒸馏冷却法:在沸点上差值大。
乙醇中(水):加入新制的CaO吸收大部分水再蒸馏。
3.过滤法:溶与不溶。
4.升华法:SiO2(I2)。
5.萃取法:如用CCl4来萃取I2水中的I2。
6.溶解法:Fe粉(A1粉):溶解在过量的NaOH溶液里过滤分离。
7.增加法:把杂质转化成所需要的物质:CO2(CO):通过热的CuO;CO2(SO2):通过NaHCO3溶液。
8.吸收法:用做除去混合气体中的气体杂质,气体杂质必须被药品吸收:N2(O2):将混合气体通过铜网吸收O2。
9.转化法:两种物质难以直接分离,加药品变得容易分离,然后再还原回去:Al(OH)3,Fe(OH)3:先加NaOH溶液把Al(OH)3溶解,过滤,除去Fe(OH)3,再加酸让NaAlO2转化成A1(OH)3。
10.纸上层析2.学习胜在学习规律,思维模式,内在联系,解题模式整理,而不是每天报着书一页页看,当然这前面四点的形成基于对基础知识的精准积累,这就靠每天自己的听课效率和课后同步训练。
会找规律会自己联系知识点之间的相关永远都是提高学习效率,形成知识网络的必经之路!一、构建网络,夯实双基化学学科的特点是碎、散、多、杂,难记易忘。
复习时,要注意指导学生总结归纳,构建网络,找出规律,力求做到"记住-理解-会用"。
高三化学复习内容可分为一般知识和重点知识,复习中必须根据大纲和考纲,对基础知识、基本技能进行准确定位,以提高复习的针对性和实效性,既要全面复习,不留死角,更要突出重点。
指导学生归纳结总时,对不同的内容可采取不同的方式:1、课堂引导归纳对于中学化学的主干知识和重点内容,如氧化还原反应、离子反应、电化学、物质结构、化学反应速率及化学平衡、电解质溶液、有机化学、化学实验等,课堂上教师应引导和启发学生共同讨论,寻找规律,帮助学生构建知识体系,通过网络的建立,揭示概念之间的关系,找到相关概念之间的区别与联系,有重点有针对性地复习,加强对知识的理解,让学生真正得到感悟、并学会迁移,最终达到灵活运用。
纤维素溶解常见方法

2018年04月纤维素溶解常见方法黄锋1朱达2(1南京林业大学理学院高分子材料与工程专业,江苏南京210037;2南京林业大学理学院材料化学,江苏南京210037)摘要:纤维素作为储量丰富的天然高分子材料,越来越多的被人类使用,本文总结了纤维素常见的溶解方法,并探讨了各种溶解方法的优缺点。
关键词:纤维素;溶解1纤维素简介在整个地球上的可再生资源中,最为丰富的一种资源就是纤维素,纤维素属于一种可再生的高分子材料,它主要是通过葡萄糖的聚合生成的,自然界中的这种纤维素广泛存在。
随着不可再生资源的不断消耗,人们对天然高分子也表现出了极大的兴趣。
它也是当前的一种非常重要的化工原料。
2纤维素结构纤维素中含有的基本元素是碳氢氧这三种,基本的结构单元是C 6H 10O 5。
属于一种线性的高分子材料,β-D -是其中的一个基本构成单元,而各个葡萄糖之间的连接主要是依靠的化学键是1-4-。
纤维素分子的羟基上的氢原子具有很强的极性,会与氧原子上的孤对电子相互吸引,通过取向的氢键,纤维素形成了多种类型的超分子半晶态结构,从而导致化学试剂很难进入纤维素分子中,并与其发生相互反应。
3纤维素的传统溶解方法3.1铜氨法在一百多年前,S ch weiz 等人将氨水与氢氧化铜放在一起进行反应,就能生成一种蓝色的溶液,而这种溶液能够具有很强的溶解纤维素的能力,人们称之为铜氨法溶解机理,普遍认为,是纤维素与铜氨溶液反应生成了一种配位的化合物,而该化合物又能在水中进行溶解。
3.2黏胶法配制时选用的原料为棉短绒与木材等纤维素,以此来配制成一种浆泊,然后将该溶液与浓度维持在18%左右,温度控制在18到25摄氏度之间的NaOH 溶液混合在一起,接着就对浆泊的质量进行压榨,使之产生一种碱性的纤维素。
而降解后生成的纤维素同CS 2进行反应就能生成一种纤维素黄原酸酯,能够在强碱中被溶解掉,生成相应的黏胶液。
对其进行一系列的熟成,脱泡,以及过滤后,再在纺丝机上的喷丝头中压入一定量的硫酸与硫酸钠,通过浸浴,将其凝固拉伸,最终制成丝。
各种化学元素溶解方法

Al 和它的合金:易溶于盐酸,在浓硝酸和稀硝酸及稀硫酸中溶解缓慢。
易溶于浓苛性碱溶液(20-40%)。
Al2O3将试样与过量4-6倍的无水碳酸钠和碳酸钾(1:1)在镍或铁坩埚中熔融,冷却后,将熔块溶于水中,而不溶碳盐可用碳酸溶解,也可以用硫酸铵熔融,熔块用水浸取。
B:溶于氧化性酸,浓硫酸和浓硝酸中,甚至于加热至冒烟的高氯酸中,与苛性碱熔融生成偏硼酸盐。
V:溶于硝酸及硝酸和盐酸的混合酸中,加热溶于浓硫酸中,不溶于稀硫酸和盐酸。
与碱一起熔融形成矾酸盐。
W:溶于氢氟酸和硝酸混合酸中,溶于含有碳酸的酸混合物中,在过氧化氢存在下溶于饱和草酸溶液中,粉状钨易溶于过氧化氢溶解中,在氧化剂存在下(例如KClO3),用碱或碳酸钠熔融形成钨酸盐。
F:易溶于稀硫、盐酸和硝酸中。
Fe2O3:溶于硫酸、盐酸和硝酸,用6倍KHSO4熔融并浸出熔块于稀硫酸中。
Y:溶于硫酸、硝酸和盐酸溶液中。
Co:溶于稀硝酸、稀盐酸、稀硫酸中,浓硝酸和浓硫酸使钴“钝化”。
La和其它稀土:易溶于盐酸、硝酸和硫酸溶液中。
Mg:溶于稀硫酸、盐酸和硝酸中,在浓硫酸中也溶解。
Cu:溶于硝酸中,加热至冒烟时浓硫酸溶解铜。
在氧化剂(加Fe(Ⅲ)、H2O2、HNO3 等)共存时盐酸也能溶解铜。
Mo:易溶于硝酸、硝酸和盐酸混合酸中,在强烈加热时浓硫酸也溶解钼,粉末的钼溶于过氧化氢溶解中。
As:溶于硝酸,盐酸和硝酸的混合酸中,用强热浓硫酸也能溶解砷。
Ni:溶于稀硝酸中及盐酸和硝酸混合酸溶解中。
Nb:溶于硝酸和氢氟酸中,溶于浓硫酸与硫酸铵或硫酸钾的混合物(加热至冒烟)中。
Sn:溶于盐酸、盐酸和硝酸的混合酸中,也溶于热的浓硫酸中。
铂属元素或贵金属:钯是铂金属最活泼的一个元素,它溶于浓硝酸及热硫酸中,溶于王水中,铂溶于王水中,钌、铑、铱、锇不溶于一般无机酸和王水中,铂族金属在有氧化剂存在时与碱一起熔融,均可转变为可溶化合物。
Re:溶于硝酸而形成铼酸溶液,粉状铼易溶于过氧化氢溶液。
高中化学盐溶解性表及元素周期表
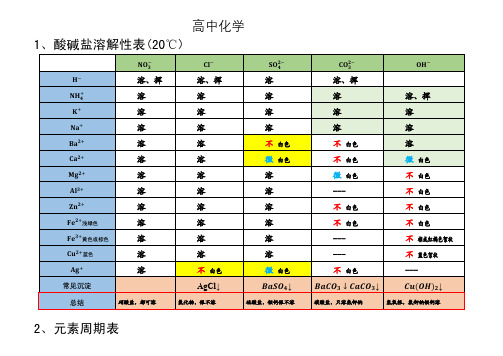
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
分析六大元素化学方法

分析六大元素化学方法母液制备(测定锰磷硅)钢样称取0.2g钢样,入100ml两用瓶,加20%过硫酸铵溶液10ml后,再加(1+4)硝酸20ml,于电炉上加热溶解后,煮沸至大气泡。
再加(1+9)过氧化氢2 ~ 3滴。
继续煮沸1 ~ 2分钟,取下,流水冷却至室温,以水定容100ml。
锰:硝酸银—过硫酸铵光度法吸取母液20ml加入100m烧杯中,加硝酸银5ml,加过硫酸铵5ml,放在煮沸的烧杯里加热2分钟左右,温度达到80℃,冷却至室温。
比色皿3 cm 波长530 nm 以水作空白1.硝酸银溶液:2%,10g硝酸银加10ml浓硝酸及490ml水,溶清混匀,贮于棕色瓶中。
2.过硫酸铵溶液:20%(40g过硫酸铵溶于150ml水后,以水稀释至200ml,当天配制)磷:抗坏血酸—铋盐光度法吸取20ml母液,加入100m烧杯中,加磷掩蔽剂10ml,放在煮沸的烧杯里加热,1分钟左右温度达到50℃,再加入磷显色剂显色,摇匀形成稳定的磷钼蓝。
比色皿 3 cm 波长680nm、700nm 以水作空白1.磷掩蔽剂:8g抗坏血酸溶于400ml水后,分次加无水碳酸钠1.5g,调整PH在6 ~ 6.5之间,然后加2.5g硫代硫酸钠溶解后,再加100ml无水乙醇混匀。
2.磷显色剂:45ml浓硫酸缓慢加至250ml水中,再加2.5g硝酸铋及6g钼酸铵,溶解后,以水稀释至500ml。
硅:草酸—硫酸亚铁铵光度法吸取母液5ml,加入100m烧杯中,加钼酸铵15ml,放在煮沸的烧杯水里加热1分钟左右温度达到65℃,再加入硅显色剂30ml,摇匀。
比色皿3cm 波长680nm、700nm 以水作空白1.钼酸铵溶液:1.6% ,8g钼酸铵溶500ml水中。
2.草酸溶液:3%,15g草酸溶于500ml水中。
3.硫酸亚铁铵溶液:2%,10g硫酸亚铁铵溶于100ml水中,边搅边拌边加25ml浓硫酸,溶解澄明后,以水稀释至500ml。
4.硅显色剂:3%草酸溶液与2%硫酸亚铁铵溶液等体积混合(当天配制)。
n元素在奥氏体钢中的溶解_概述及解释说明

n元素在奥氏体钢中的溶解概述及解释说明1. 引言1.1 概述奥氏体钢是一种重要的金属材料,具有优异的力学性能和耐腐蚀性,在工业领域得到广泛应用。
然而,其中包含的n元素(指代某种特定元素)对奥氏体钢的性能起着至关重要的作用。
本文旨在全面概述并解释n元素在奥氏体钢中的溶解机制及其重要性,以期为相关研究提供参考和启发。
1.2 文章结构本文主要分为五个部分:引言、正文、实验方法和结果分析、解释和应用展望以及结论与总结。
引言部分将介绍文章的背景和目的,并简要概述下文内容;正文部分将详细介绍奥氏体钢及其特性以及n元素在其中的重要性;实验方法和结果分析部分将介绍研究所采用的实验方法,并对n元素溶解实验结果进行详细分析;解释和应用展望部分将探讨n元素溶解对奥氏体钢性能影响的机理,并展望其应用前景;最后,结论与总结部分将对研究结果进行总结回顾,并提出后续工作建议与发展方向指引。
1.3 目的本文旨在深入探讨n元素在奥氏体钢中的溶解机制及其对材料性能的影响,以期为相关领域的研究提供理论依据和应用指导。
通过对n元素在奥氏体钢中的溶解机制进行解释,可以增进我们对这类材料结构与性能之间关系的理解,并为优化材料设计和合金开发提供参考。
此外,本文还将展望相关研究领域的联系和探索空间,为未来研究提供思路和方向。
2. 正文2.1 奥氏体钢及其特性奥氏体钢是一种具有良好机械性能的金属材料,其主要特点是具有高强度、耐磨损和耐腐蚀等优点。
奥氏体钢由铁和碳组成,并加入了其他合金元素来改善其特性。
这些合金元素可以分为n元素和非n元素。
2.2 n元素在奥氏体钢中的重要性n元素在奥氏体钢中起到关键作用,对提高钢材的使用性能至关重要。
n元素可以改变奥氏体钢的晶格结构,增加晶界强度和塑性,使得奥氏体钢更加稳定和可靠。
此外,n元素还可以提高硬度、强度和韧性等力学性能,并增加抗疲劳裂纹扩展的能力。
2.3 n元素在奥氏体钢中的溶解机制在奥氏体钢中,n元素以固溶形式存在。
化工流程 沉淀溶解

化工流程沉淀溶解
沉淀溶解是指在难溶电解质溶液中,当溶液中某物质的离子积大于其溶度积常数时,就会有沉淀生成;反之,当离子积小于其溶度积常数时,沉淀就会溶解。
沉淀溶解的常用方法有酸碱溶解法、配位溶解法、氧化还原溶解法和沉淀转化溶解法。
例如,在碳酸钙中加入盐酸,可通过消耗碳酸根离子使沉淀溶解;在氯化银沉淀中滴加氨水,可形成银氨溶液,从而使沉淀溶解。
在化工流程中,沉淀溶解的过程对于优化反应条件、提高产品质量和产率具有重要意义。
在实际生产中,需要根据具体情况选择合适的沉淀溶解方法,以达到最佳的生产效果。
磁石溶解方法

磁石溶解方法全文共四篇示例,供读者参考第一篇示例:磁石溶解方法是一种将磁石完全或部分溶解并提取其中的成分的技术方法。
磁石通常由铁、镍、钴等金属元素构成,其中包含的磁性物质能够被外界磁场所吸引或排斥。
磁石溶解方法在矿产资源利用、新材料研究、环境污染治理等领域有着重要应用价值。
本文将介绍磁石溶解方法的原理、过程和应用,以及未来的发展方向。
一、磁石溶解方法的原理磁石溶解方法的基本原理是利用溶剂对磁石内部结构的破坏,将其中的金属元素溶解在溶液中,然后通过化学分离等方法提取目标物质。
通常情况下,磁石的主要成分铁、镍、钴等金属元素在特定条件下可以被一些强酸、强碱等溶剂所溶解。
在溶解过程中,磁石结构的破坏会导致原子之间的键断裂,金属元素释放出来,溶液中的离子形式存在。
1.选择合适的溶剂:根据磁石的成分和性质,选择适合其溶解的溶剂。
一般常用的溶剂有氢氧化钠、盐酸、硫酸等。
2.磁石的预处理:通过磨碎、粉碎等方法将磁石加工成适合溶解的形态,提高溶解速度和效率。
3.溶解磁石:将经过预处理的磁石与选定的溶剂置于反应容器中,加热或搅拌等操作加速溶解过程。
4.分离提取:通过沉淀、过滤、离心等方法将溶液中的金属离子与残渣进行分离,获得目标物质。
5.精细提纯:通过再结晶、沉淀、电解等方法进一步提纯目标物质,消除杂质。
6.回收利用:将溶解后的残渣经过处理,实现磁石资源的循环利用。
1.矿产资源开发:利用磁石溶解方法可以有效提取稀有金属、贵金属等有价值的矿物成分,实现矿产资源的可持续开发利用。
2.新材料研究:磁石溶解方法可以提供各种金属元素的纯净原料,为新材料的研发和制备提供基础条件。
3.环境污染治理:在处理含有重金属污染的废水、废渣等环境污染物时,可以利用磁石溶解方法将有害物质分离提取,实现资源化利用和环境污染治理的双重效果。
4.医药健康:一些医药材料、药物中也含有特定的金属元素,通过磁石溶解方法可以实现对这些金属成分的提取和分离,为医药制备提供原料保障。
铜的溶解名词解释

铜的溶解名词解释铜是一种常见的金属元素,具有良好的导电和导热性能,因此在许多行业中广泛应用。
铜的溶解是指将固态的铜转化为溶解于液体或溶液中的离子形式。
铜的溶解具有重要的科学和工业意义,在冶金、化学工程以及环境保护等领域都有广泛的应用。
一、铜的溶解过程铜的溶解过程可以分为两个关键步骤:离子化和溶解。
离子化是指将固态铜脱离晶体结构转化为离子形式,溶解是指离子在溶剂中的扩散和稳定存在。
在溶解过程中,铜原子自身并不发生化学变化,只是从固态中解离出来,在溶液中以离子的形式存在。
铜的溶解涉及各种因素,包括温度、表面积、溶剂性质和溶液中其他化学物质的存在等。
温度是最主要的影响因素之一,通常情况下,随着温度的升高,铜的溶解度也会增加。
而表面积越大,铜的溶解速率也会相应增加。
此外,溶剂的性质也会影响铜的溶解性,不同溶剂中铜的溶解度可能存在差异。
二、铜的溶解在工业和科学领域的应用1. 冶金工业在冶金工业中,铜的溶解是一项重要的步骤。
通过将铜矿石经过冶炼和提纯的过程,得到精炼的铜金属。
这个过程通常包括铜的溶解、分离和电解等步骤。
铜的溶解是从矿石中将有用的金属离子分离出来的关键步骤之一。
2. 化学工程在化学工程中,铜的溶解是许多反应和合成过程的关键步骤。
铜离子可以用作催化剂,在化学反应中起着重要的作用。
铜的溶解还可以用来制备各种铜化合物,如铜盐和有机铜化合物等,这些化合物在有机合成和催化反应中常被使用。
3. 环境保护铜的溶解在环境保护领域也具有重要的意义。
在废水处理中,铜离子可以通过溶解的方式从废水中去除。
这是因为铜的溶解度较高,可以很好地与废水中的有机物或其他金属形成络合物,从而实现其去除。
此外,铜的溶解还广泛应用于金属腐蚀、化学分析和材料科学等领域。
铜的溶解性及其变化规律的研究对于理解金属在各种环境和条件下的行为具有重要意义,并为相关的工业和科学研究提供了基础。
总结铜的溶解是将固态的铜转化为溶解于液体或溶液中的离子形式的过程。
sb元素的固溶度-概述说明以及解释

sb元素的固溶度-概述说明以及解释1.引言1.1 概述概述部分的内容:在材料科学领域中,固溶度是一个重要的概念。
固溶度是指溶质元素在溶剂晶格中的溶解度,即在原子尺度上的固体溶解。
本文将重点研究sb 元素的固溶度,通过分析和研究sb元素在不同溶剂中的溶解情况,探讨其固溶度的变化规律和影响因素。
sb元素是周期表中的元素,其具有一定的特殊性。
在材料中加入适量的sb元素可以改变材料的性质和结构,并且对材料的导电性、磁性等性能有着显著影响。
因此,了解sb元素的固溶度对于材料的设计和制备具有重要意义。
本文将首先介绍sb元素的基本性质和特点,包括其原子结构、晶体结构以及化学性质等。
其次,将探讨sb元素在不同溶剂中的溶解度变化情况,并分析其固溶度的影响因素,如温度、压力、溶质浓度等。
此外,本文还将对sb元素固溶度的研究方法和技术进行介绍,包括实验方法、计算模拟等。
通过深入研究sb元素的固溶度,我们可以更好地理解其在材料中的行为和作用机制,为材料设计和合金开发提供理论依据和实验指导。
同时,对于工业生产中的材料优化和性能改善也具有指导意义。
本文将尽可能全面地介绍和总结关于sb元素固溶度的最新研究成果,以期为相关领域的研究人员提供参考和借鉴。
1.2 文章结构文章结构部分的内容可以写作如下:本文主要以研究和探讨sb元素的固溶度为主题。
为了系统全面地介绍固溶度的相关内容,本文将按照以下结构展开论述。
首先,文章引言部分将对固溶度的概念进行概述,明确固溶度的定义和重要性。
固溶度是指在一定温度下,溶质在溶剂中所能溶解的最大量或溶解度的度量。
在材料科学和物理化学领域,固溶度研究是一项重要的研究内容,对于合金材料的制备和性能提升具有重要意义。
接下来,文章将介绍整体的文章结构安排。
本文分为引言、正文和结论三个部分。
引言部分将对固溶度的概述进行详细介绍,阐明固溶度的研究意义。
正文部分分为两个要点,分别讨论sb元素的固溶度要点1和要点2。
高一化学元素溶解性知识点

高一化学元素溶解性知识点化学元素溶解性是指化学元素在不同溶剂中的溶解情况。
了解元素的溶解性对于理解化学反应、溶液的性质以及实际应用具有重要意义。
本文将介绍几个常见元素的溶解性及其相关知识点。
1. 钾(K)钾是一种活泼的金属元素,具有良好的溶解性。
在水中,钾离子(K+)可以迅速溶解,形成无色透明的溶液。
此外,钾离子也能够溶解于许多有机溶剂中,如醇类和醚类溶剂。
2. 氯(Cl)氯是一种具有较好溶解性的气体元素。
在水中,氯气可以通过氯化反应与水发生反应,生成盐酸(HCl)。
由于盐酸是强酸,其分子易离解,形成氢离子(H+)和氯离子(Cl-)。
这也说明了氯气易溶于水的原因。
3. 溴(Br)溴是一种非常有溶解性的非金属元素。
在水中,溴能够与水发生反应,形成溴化氢(HBr)。
由于溴化氢是一种强酸,因此会产生氢离子和溴离子。
溴在许多有机溶剂中也具有较好的溶解性。
4. 碘(I)碘是一种不易溶解的非金属元素,其溶解度较低。
在水中,碘虽然可以产生少量的碘化氢(HI),但溶解度相对较小。
由于碘的溶解度较低,因此在进行化学实验时常常使用有机溶剂如氯仿来溶解碘。
5. 银(Ag)银是一种具有较好溶解性的金属元素。
在水中,银可以形成溶解度较小的溶液。
然而,在含有硝酸根离子(NO3-)或氨根离子(NH3)的溶液中,银会与这些离子反应生成溶解度较大的络合物,如硝酸银(AgNO3)和银氨根络合物(Ag(NH3)2+),使其具有更好的溶解性。
通过了解元素的溶解性,我们可以更好地理解化学反应的过程,预测物质在不同溶液中的行为,以及应用化学知识解决实际问题。
因此,高一化学学习中,掌握元素溶解性的知识点是至关重要的。
在化学实验中,我们可以通过溶液的透明度、颜色的变化、气体的释放等来判断元素的溶解性。
此外,我们还可以利用溶解度规律,了解不同离子的溶解度与溶液中温度、浓度等因素的关系。
这有助于我们预测溶液中物质的溶解程度,甚至可以进行定量计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al 和它的合金:易溶于盐酸,在浓硝酸和稀硝酸及稀硫酸中溶解缓慢。
易溶于浓苛性碱溶液(20-40%)。
Al2O3将试样与过量4-6倍的无水碳酸钠和碳酸钾(1:1)在镍或铁坩埚中熔融,冷却后,将熔块溶于水中,而不溶碳盐可用碳酸溶解,也可以用硫酸铵熔融,熔块用水浸取。
B:溶于氧化性酸,浓硫酸和浓硝酸中,甚至于加热至冒烟的高氯酸中,与苛性碱熔融生成偏硼酸盐。
V:溶于硝酸及硝酸和盐酸的混合酸中,加热溶于浓硫酸中,不溶于稀硫酸和盐酸。
与碱一起熔融形成矾酸盐。
W:溶于氢氟酸和硝酸混合酸中,溶于含有碳酸的酸混合物中,在过氧化氢存在下溶于饱和草酸溶液中,粉状钨易溶于过氧化氢溶解中,在氧化剂存在下(例如KClO3),用碱或碳酸钠熔融形成钨酸盐。
F:易溶于稀硫、盐酸和硝酸中。
Fe2O3:溶于硫酸、盐酸和硝酸,用6倍KHSO4熔融并浸出熔块于稀硫酸中。
Y:溶于硫酸、硝酸和盐酸溶液中。
Co:溶于稀硝酸、稀盐酸、稀硫酸中,浓硝酸和浓硫酸使钴“钝化”。
La和其它稀土:易溶于盐酸、硝酸和硫酸溶液中。
Mg:溶于稀硫酸、盐酸和硝酸中,在浓硫酸中也溶解。
Cu:溶于硝酸中,加热至冒烟时浓硫酸溶解铜。
在氧化剂(加Fe(Ⅲ)、H2O2、HNO3 等)共存时盐酸也能溶解铜。
Mo:易溶于硝酸、硝酸和盐酸混合酸中,在强烈加热时浓硫酸也溶解钼,粉末的钼溶于过氧化氢溶解中。
As:溶于硝酸,盐酸和硝酸的混合酸中,用强热浓硫酸也能溶解砷。
Ni:溶于稀硝酸中及盐酸和硝酸混合酸溶解中。
Nb:溶于硝酸和氢氟酸中,溶于浓硫酸与硫酸铵或硫酸钾的混合物(加热至冒烟)中。
Sn:溶于盐酸、盐酸和硝酸的混合酸中,也溶于热的浓硫酸中。
铂属元素或贵金属:钯是铂金属最活泼的一个元素,它溶于浓硝酸及热硫酸中,溶于王水中,铂溶于王水中,钌、铑、铱、锇不溶于一般无机酸和王水中,铂族金属在有氧化剂存在时与碱一起熔融,均可转变为可溶化合物。
Re:溶于硝酸而形成铼酸溶液,粉状铼易溶于过氧化氢溶液。
Pb:易溶于稀硝酸中,加热时溶于浓盐酸和浓硫酸中。
Ag:易溶于硝酸,加热可溶于浓硫酸中。
Ta:溶于氢氟酸和硝酸中,与碱熔融生成钽酸盐,在加热浓硫酸时钽才能作用。
Ta2O3:(a)可用碳酸钠和碳酸钾混合物熔融;
(b)可用苛性碱共熔。
Ti:溶于1:1稀盐酸和1:1稀硫酸,易溶于稀氢氟酸和它与硝酸混合酸中,硝酸“钝化”钛。
TiO2:a、在加热时溶于酸中。
b、在加热至沸时溶于硫酸和硫酸钠混合物中。
Th和ThO2:易溶于浓盐酸心脏盐酸和硝酸混合酸中。
Cr:溶于盐酸、高氯酸和稀硫酸中。
Ce:易溶于酸形成Ce(Ⅲ)盐。
Zn:易溶于酸及浓碱溶液中。
ZrO2:溶于盐酸和硝酸混梧酸及氢氟酸中,也可溶于氢氟酸和硝酸的混合酸中。
加热溶于硫酸与硫酸钾混合物或与硫酸氢钾熔融。
