4.1化学反应方向(详细)
物理化学第四章-化学平衡

平衡 正向自发
ii (产物) ii (反应物) 逆向自发
自发变化的方向:反应总是从化学势较高的一边流向化 学势较低的一边。
1. 化学反应的限度
所有的化学反应既可以正向进行亦可以逆向进行, 且反应正向进行和逆向进行均有一定的程度,反应 物不会完全转化为产物。
典型例子:
H2(g)+I2(g)↔2HI C2H5OH(l)+CH3COOH(l)↔CH3COOC2H5+H2O
任意化学反应: rGm rGm RT ln Qa
rGm ii (产物) jj (反应物)
(化学反应的吉布斯自由能改变量)
rGm
i
i
(产物)
jj (反应物)
(化学反应的标准吉布斯自由能改变量)
1.rGm 是任意反应系统的吉布斯自由能变化
rGm 是任意反应系统的标准摩尔吉布斯自由能变化
rGm 指产物和反应物都处于标准态时,产物的吉布
斯函数与反应物的吉布斯函数总和之差,称为化学
反应的“标准摩尔Gibbs 自由能变化值”,只是温
度的函数。
平衡时Leabharlann gGhHa
A
b
B
r Gm
若上述反应在定温定压下进行,其中各分压是任意的而 不是平衡时的分压,此时反应的吉布斯函数变化为:
非平衡时
rGm gG hH (aA bB )
B
B
RT
ln( PB
/
P )
g[G
RT
ln(
pG
/
p
)]
h[
H
RT
ln(
pH
/
p
)]
a[
A
RT
ln(
4.1生物体内的化学反应

ATP ATP水解酶
ADP+P i+能量 ——各项需
能的生命活动
(三)、ATP的合成途径
动物和人等
绿色植物
ADP +Pi+
能量 ATP合成酶 ATPA来自P合成ATP时所需能量的主要来源
人和动物:呼吸作用 绿色植物:呼吸作用+光合作用
▼ ATP和ADP相互转化的反应式:
ATP水解酶
ATP ATP合成酶 ADP + Pi +能量
生化反应 特点
相比一般的化学反应,生物体内的化学反 应有何特点? ① 常温、常压下,快速、有序地进行。
② 绝大多数需酶催化
③ ATP提供能量
实验:探究酶的高效性
过氧化氢(H2O2),俗称双 氧水,强氧化剂,分解产生 水和氧气
2H202
过氧化氢酶 (生物催化剂)
Fe3 +
(无机催化剂)
2H20 + O2
从外界摄取食物, 转变为自身物质 生物体 分解大分子物质
为生命活动供能
新陈代谢是生命活动的最基本特征
新陈代谢
• 新陈代谢由同化作用和异化作用组成。 同化作用:生物体不断从外界摄取营养物 (合成代谢质),将它们转化成自身的物质,
并储存能量的过程。 异化作用:生物体不断将自身物质分解以 (分解代谢释)放能量,并将代谢终产物排
果胶酶能分解果 肉细胞壁中的果 胶,提高果汁产 量,使果汁变得 清亮。
你消化不良 时可以服用
含酶牙 膏可以 分解细 菌,使 我们牙 齿亮洁、 口气清 新。
加酶洗衣粉 比普通洗衣 粉有更强的 去污能力。
用小刀将数十只萤火虫的发光器割下, 干燥后研成粉末,取两等份分别装入 A、B两支试管,各加入少量水使之混 合,置于暗处,可见试管内有淡黄色 荧光出现,约过15分钟荧光消失。 然后:
化学平衡的移动,化学反应进行的方向

【重点内容】化学平衡的移动,化学反应进行的方向。
2【内容讲解】一、化学平衡的移动1、含义:可逆反应达到平衡状态后,反应条件(如浓度、压强、温度)改变,使正和逆不再相等,原平衡被破坏;一段时间后,在新的条件下,正、逆反应速率又重新相等,即V 正'=V逆',此时达到了新的平衡状态,称为化学平衡的移动。
应注意:v正'≠v正,v逆'≠v逆。
2、影响因素:(1)浓度:其它条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
在下列反应速率(v)对时间(t)的关系图象中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:①增大反应物浓度;②减小生成物浓度;③增大生成物浓度;④减小反应物浓度注:①由于纯固体或纯液体的浓度为常数,所以改变纯固体或纯液体的量,不影响化学反应速率,因此平衡不发生移动。
②增大(或减小)一种反应物A的浓度,可以使另一种反应物B的转化率增大(或减小),而反应物A的转化率减小(或增大)。
(2)压强:其它条件不变时,对于有气体参加的可逆反应,且反应前后气体分子数即气体体积数不相等,则当缩小体积以增大平衡混合物的压强时,平衡向气体体积数减小的方向移动;反之当增大体积来减小平衡混合物的压强时,平衡向气体体积数增大的方向移动;若反应前后气体分子数即气体体积数相等的可逆反应,达到平衡后改变压强,则平衡不移动。
对于反应mA(g)+nB(g) pC(g)+qD(g),在下列v-t图中,在t1时刻发生下述相应条件的变化,则正、逆反应速率的改变情况如图所示:① m +n > p +q,增大压强;② m +n > p +q,减小压强;③ m +n < p +q,增大压强;④ m +n < p +q,减小压强;⑤ m +n = p +q,增大压强;⑥ m +n = p +q,减小压强。
(3)温度:其它条件不变时,升高温度,平衡向吸热反应(△H>0)方向移动;降低温度,平衡向放热反应(△H<0)方向移动。
化学平衡与反应方向

化学平衡与反应方向化学平衡是指在化学反应中,反应物与生成物的摩尔浓度达到稳定的状态。
它是一个动态的平衡过程,反应物会与生成物相互转化,但它们的摩尔浓度保持不变。
反应方向是指在化学平衡下,化学反应的主要方向。
1. 定义化学平衡化学平衡是指在封闭的反应容器中,反应物和生成物之间的摩尔浓度达到一种稳定的状态,不随时间而发生变化。
在平衡态下,反应速率的正向和逆向的反应速率相等。
2. 平衡常数与反应方向平衡常数(Kc)是用来表示平衡时反应物与生成物浓度的比例的常数。
对于一个化学反应aA + bB ⇌ cC + dD,其平衡常数的表达式为Kc = [C]c [D]d / [A]a [B]b。
平衡常数是一个无量纲的值,它的大小决定了反应的方向。
当Kc > 1时,生成物浓度较高,反应向右(生成物方向)进行;当Kc < 1时,反应物浓度较高,反应向左(反应物方向)进行;当Kc = 1时,反应物和生成物的浓度相等,反应处于平衡状态。
3. 影响反应方向的因素反应方向受到以下因素的影响:3.1 温度:根据吉布斯自由能变化定律,ΔG = ΔH - TΔS,其中ΔG为自由能变化,ΔH为焓变化,ΔS为熵变化,T为温度。
当ΔG < 0时,反应向生成物方向进行;当ΔG > 0时,反应向反应物方向进行。
温度的增加会增加反应的速率,并且可以改变平衡常数的大小。
3.2 压力(或浓度):对于气体反应来说,压力的增加会使反应方向向摩尔数较少的一方进行。
对于溶液反应来说,浓度的增加也会导致反应方向的改变。
3.3 反应物与生成物的活性:有些反应物和生成物具有不同的活性,活性较高的物质通常倾向于转化为活性较低的物质。
4. Le Chatelier原理Le Chatelier原理是用来解释反应方向变化的一个重要原理。
它说的是,当外部条件发生变化时,系统会倾向于抵消这种变化,以维持平衡。
4.1 温度的变化:温度的增加会使反应向吸热方向进行,温度的降低会使反应向放热方向进行。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
4.1化学反应工程基础(2)

rR
k1C
C a1 b1`
AB
rs
k2C
C a2 b2
AB
对比速率
rR
/ rS
k1CAa1CBb1 k2 CAa 2CBb 2
1.优化的温度和浓度效应
T、C效应 S rR /(rR rS ) /(1 )
a1 b1
k C C k 1 A B
..1
k
N
C A0
N
1 k i
当各釜的容积VI相等时,则: 1= 2=....... N i1
所以:
C
=
AN
C A0
1 k N
N
或:
x AN=1
1
1
k
N
N
理想流动和理想反应器的设计
2.图解法 四种计算情况:
C
n Af
CA0 xAf
C
n Af
(无积分形式)
CSTR不同反应级数的结果
n=0 n=1 n=2
k m CA0 CAf CA0xAf
k m
CA0 CAf CAf
xAf 1 xAf
k m
CA0 C
C
2 Af
Af
C
A0
xAf (1
xAf
)2
CAf CA0 k m
k C C k 2 A B
0 E1 E2
1
RT
a1 a2
b1 b2
0
A
B
2
T效应: E1>E2,T↑,α ↑,活化能高的反应好
E1<E2,T↓,α ↑,活化能低的反应好
江洲区第七中学九年级化学全册第4章认识化学变化4.1常见的化学反应_燃烧第1课时燃烧的条件完全燃烧与

P18-19 第4、5、6、7、8题
第7题〔2〕
结束语
同学们,你们要相信梦想是价值的源泉,相信成 功的信念比成功本身更重要,相信人生有挫折没 有失败,相信生命的质量来自决不妥协的信念,
考试加油!奥利给~
第4章 认识化学变
第3节 化学方程式的书写与
第4章 认识化学变化
第2课时 依据化学方程 计算
舍 勒 ( 瑞 典 )
〔普 英利 国斯 〕特
里
空气成分的发现 P14-15 拉瓦锡〔法国〕
测定空气里氧气的含量 :
已知红磷固体能够与氧气发生反映 ,
生成五氧化二磷固体。
1、实验原理 : 利用在密闭的容器 里红磷和空气中氧气反映〔生成固 体小颗粒〕 , 让容器内压强减小 , 使水进入容器 , 测定进入水的体 积 , 可得出空气中氧气的体积。
第3节 化学方程式的书写与应用
[问题探究]
你能帮他解答吗?
[思考交流]
第3节 化学方程式的书写与应用
[归纳提升]
根据化学方程式的意义之一能表示各物质间的质 析题意找出已知量、未知量,然后按照依据化学方程 式要求去完成答题任务。依据化学方程式的计算均依 式的含义进行,此题中发生的反应为高锰酸钾受热分 注意解题步骤:设、写、找、列和答五步。
第3节 化学方程式的书写与应用
知识点二 依据化学方程式的计算
1.计算依据:化学反应不但符合质量守恒定律,而且 生成物之间都有固定的质量比。
第3节 化学方程式的书写与应用
2.计算步骤
例题:3 g镁在氧气中充分燃烧,计算生成氧化镁的质
解:设生成氧化镁的质量为x。 ①设_未__知__数___
2Mg+O2 =点==燃==2MgO ②写出反应的_化_学__方_程__式___
九年级化学上册 第4章 认识化学变化 4.1 常见的化学反应—燃烧(1)课件

烧
铁丝(tiě sī)在氧气中燃 火星四射、放热、生成黑色固体
烧
共同点
发光、放热、化学变化
阅读:P92燃烧的定义
第三页,共十八页。
白磷、红磷(hónɡ 燃烧 lín)
第四页,共十八页。
P93 物质有可燃性(可燃物)
燃烧的条件
(tiáojiàn)
(一般情况)
与空气(或氧气(yǎngqì))接触
可燃物达到燃烧所需的最低温
度 (也叫着火点)
钠在氯气中燃烧(ránshāo);
镁在二氧化碳中燃烧
第五页,共十八页。
通常状况下一些常见(chánɡ jiàn)物质的着火点
物质
白磷
红磷
木材
着火点/℃ 物质
40 木炭
240 乙醇(酒精)
250-330 无烟煤
着火点/℃ 320-370
558
700-750
注意:着火点是物质固有(gùyǒu)的一种性质。
第六页,共十八页。
第七页,共十八页。
如何(rúhé)使燃料燃烧更旺(剧烈)?
第八页,共十八页。
影响燃烧现象 的因素 (xiànxiàng)
1、铁丝在氧气中能燃烧(ránshāo),在空气中不能 。
2、木头推成刨花后更易燃烧 3、潮湿的木材不易燃着
1、氧气(yǎngqì)的浓度
2、可燃物与氧气的接 触面积(状态) 3、可燃物干燥程度
第4章 认识 化学变化 (rèn shi)
—燃烧 1节 常见的化学反应 第
(huàxué fǎnyìng)
(1)
燃烧的条件
防火与灭火
第一页,共十八页。
第二页,共十八页。
P92 表4-1
事例
化学平衡

质的△fGm为零。
于是,任意一化学反应的△rGm就可采用下式计算:
rGm
i f Gm .i 产
i f Gm .i 反
2. 由△rGm,根据式△rGm=-RTlnK求标准平衡
常数K
例:反应
CO(g) + Cl2(g)
a
bgh
∴dnA=-ad dnB=-bd dnG=gd
dnH=hd
n
dGT .P idni
i
dGT.P gG hH aA bB d ii d
i—计量系数 对产物i为正
对反应物i为负
而
GT .P
G
热力学要解决化学的根本问题 和限度,即反应 能否发生?发生
了多少的问题?
把热力学基本原理和规律应用于化学反应就可以从 原则上确定反应进行的方向,平衡的条件,反应所能达到 的最高限度,以及导出平衡时物质的数量关系,并用平衡 常数来表示。
本章将应用热力学第二定律的一些结论来处理化学
平衡问题:
判椐 S G
COCl2(g)
298K △fGm -137.3 0
-210.5 (KJ.mol-1)
因此 △rGm=-210.5-(-137.3)=-73.2 KJ.mol-1
K
exp
r Gm RT
exp
73.2 103 8.314 298
6.78
1012
Sm 197.56 130.59 239.7 J.K-1mol-1
求出△rHm= -201.16-(-110.54)=-90.62 KJ·mol-1<0 放热
物理化学简明教程印永嘉化学平衡ppt课件

第四章 化学平衡
返回目录
退出
18
1. 化学反应的rGm和rGm
任意化学反应的等温方程可表示为
rGm rGm RT ln Qa
(1) rGm =BB :
T,p一定时,μ 一定,
rGm 是一常数,与实际压力无关
rGm =B B :
T,p一定时, rGm不是常数,与Qa有关
(2) (rGm)T,p (W’=0时)可指示反应能够进行的方向; rGm 即K 可指示反应的限度,一般情况下不能指示反应
g
pH / p
a
pB / p
h b
pB p
B eq
=常数=K
K表示标准平衡常数。 由上式可见,标准平衡常数K是无量纲的,仅是温度的函 数。
第四章 化学平衡
返回目录
退出
9
令
gG hH aA bB rGm
即上式可表示为
r Gm
RTlnK RT ln
pB /
p
B eq
rGm:是指产物和反应物均处于标准态时,产物的吉布 斯函数和反应物的吉布斯函数总和之差,故称为反应的
返回目录
退出
12
范特霍夫(Van’t Hoff )等温方程
rGm RT ln K RT ln Qa
Van’t Hoff
Qa
a B B
B
在不同的场合,可以赋于aB不同的含义:
理想气体
aB ------- pB /p
实际气体
aB ------- fB /p
理想液态混合物
aB ------- xB
pH2 2O p
p2 H2
pO2
p2 H2O
1.55 107
(1.00 10 4 Pa )3
4.1化学反应工程基础(3)
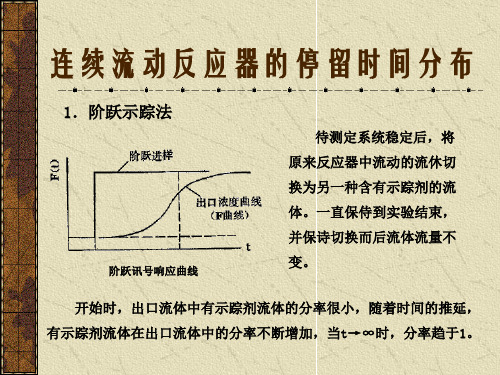
对dt时间内示踪物作物料衡算:
C0v0dt=Cv0dt+Vd C
理想混合流示众试验示意图
C C 整理后成为: v0 1 C dt Vd C 0 0
C 积分之得: C 0
t = 1 - e
流动模型
C F t C 0
Peclet准数:
Pe
uL EZ
方差
返混程度较小时,数学期望θ=1
t2 2 2 / Pe tm
2
对一级不可逆反应,转化率可表示为:
xA 1
4 Pe Pe 2 1 2 exp ( 1 ) ( 1 ) exp ( 1 ) 2 2
CN F (t ) C 0
s 1
Nt
2 3 N 1 Nt Nt 1 Nt 1 Nt 1 1 2! 3! N 1!
tE t t E t t
若取样为等时间间隔,则上式成为:
E t t 一般不能正好等于1。
一般情况下:
tE t E t
V v0
但对工业反应器来说,由于过程的复杂性不易精确地确定V。
连续流动反应器的停留时间分布
2.方差
描述停留时间分布的离散程度。 方差的定义为:
对t 微分可得:
dFt Et dt
N t N 1!
N
N 1
Nt
流动模型
若以对比时间θ 表示:
CN F ( ) C 0 1 2 1 3 1 N 1 N 1 1 N N N N 2 ! 3 ! N 1 !
沪教版化学九年级上册 4.1 常见的化学反应—燃烧 课件 (共37张PPT)

我是魔法师
刘谦
魔术1: 烧不坏的手帕
手帕是可燃物,容易着火而燃烧, 可酒精烧完了,手帕却安然无恙,你 能给出合理的解释吗?
魔术2 水中生火
水可以灭火,那水中为什么可 以生火哪?你能作出合理的解 释吗?
火是光明的使者, 火是热量的源泉, 火花是跳动的美, 火星是流动的美, 火给我们带来了
温暖和食物。
常见的化学反应——燃烧
镁在空气中燃烧 木炭在氧气中燃烧
铁丝在氧气中燃烧
燃烧事例
燃烧现象
镁带在空气中燃烧 耀眼白光、放热、生成白色固体 木炭在氧气中燃烧 发出白光、放热、生成无色气体
铁丝在氧气中燃烧 火星四射、放热、生成黑色固体
先拨119, 地址要讲清;
湿巾掩口鼻, 弃物先逃生;
天啊!太高了, 还是拿绳子吧!
浓烟匍匐行, 溜边出险境;
楼高莫下跳, 破窗先坠绳。
友情提醒:下列标志可助你化险为夷
疏 散 通 道 方 向 灭火设备或报警装置的方向
击碎板面
常见几种消防安全标记
禁止烟火 禁止吸烟 禁止放鞭炮 禁止带火种 当心爆炸 当心火灾
赤壁之战中,周瑜的军队点燃战船, 熊熊燃烧的战船借助东风直冲曹军的 木船,使曹军的木船燃起大火。曹军 的木船是_可__燃__物__,木船燃烧的条件是 __与__氧__气__接__触_______________、 __温__度__达__到__着__火__点_____________.
火从天使变成恶魔, 就会露出狰狞的面目,
扑灭森林大火时设置隔离带,你知 道这是什么原因吗? 撤离可燃物
化学反应的方向和限度(教案)

化学反应的方向和限度(教案)第一章:化学反应的基本概念1.1 化学反应的定义解释化学反应的实质:原子的重新组合过程强调化学反应的特征:产生新物质1.2 化学反应的类型描述氧化还原反应、置换反应、复分解反应等基本反应类型分析各类反应的特点和实例第二章:化学平衡的概念2.1 化学平衡的定义解释化学平衡的实质:正反应速率和逆反应速率相等,反应体系中各物质的浓度不再发生变化强调化学平衡的重要性:反应物与物之间的动态平衡2.2 化学平衡的表示方法介绍化学平衡常数的概念和表达式解释平衡移动原理:勒夏特列原理第三章:化学反应的限度3.1 可逆反应的限度阐述可逆反应的特点:反应可以正向进行,也可以逆向进行介绍可逆反应的限度:反应达到最大限度时,反应物和物的浓度保持不变3.2 化学反应的平衡常数解释平衡常数的含义:反应物和物浓度的比值的乘积强调平衡常数与反应限度之间的关系:平衡常数越大,反应限度越大第四章:化学反应的方向4.1 熵的概念解释熵的定义:系统的混乱度或无序度强调熵增原理:自然界中的过程总是朝着熵增加的方向进行4.2 吉布斯自由能介绍吉布斯自由能的定义和表达式解释吉布斯自由能与化学反应方向的关系:吉布斯自由能减少,反应自发进行第五章:化学反应条件的控制5.1 温度对化学反应的影响解释温度对反应速率和平衡的影响阐述如何通过控制温度来促进或抑制化学反应5.2 压强对化学反应的影响解释压强对气体反应的影响阐述如何通过控制压强来促进或抑制化学反应第六章:化学反应速率与限度的关系6.1 化学反应速率的概念解释化学反应速率的定义:单位时间内反应物浓度的减少或物浓度的增加强调反应速率与反应物浓度的关系6.2 反应速率与反应限度的关系阐述反应速率与反应限度的相互影响:反应速率越大,反应限度越大;反应速率越小,反应限度越小第七章:化学平衡的计算7.1 化学平衡常数的计算介绍如何根据实验数据计算化学平衡常数强调平衡常数的意义:判断反应进行的方向和限度7.2 平衡常数与反应物浓度的关系解释平衡常数与反应物浓度之间的关系:平衡常数越大,反应物浓度越大;平衡常数越小,反应物浓度越小第八章:化学反应的实际应用8.1 工业生产中的应用阐述化学反应在工业生产中的应用实例:合成氨、制碱等强调化学反应在提高产量和降低成本方面的重要性8.2 环境保护中的应用解释化学反应在环境保护中的作用:去除污染物、回收资源等强调化学反应在解决环境问题方面的潜力第九章:化学反应的实验操作9.1 实验操作的基本技能介绍化学实验中常用的操作技能:称量、溶解、过滤、蒸馏等强调实验操作的准确性和安全性9.2 化学反应实验的设计与评价阐述如何设计化学反应实验:选择合适的实验材料、仪器和操作方法强调实验评价的重要性:分析实验结果,得出合理结论第十章:化学反应的综合分析与应用10.1 化学反应在科学研究中的应用阐述化学反应在揭示物质结构和性质方面的重要性介绍化学反应在研究生物大分子、材料科学等领域中的应用10.2 化学反应在生活中的应用解释化学反应在日常生活中的作用:食物的腐败、药物的制备等强调化学反应对人类生活的重要性重点和难点解析1. 化学反应的基本概念:理解化学反应的实质和特征,区分不同类型的化学反应。
4化学平衡1省名师优质课赛课获奖课件市赛课一等奖课件

DrGm (T2 ) T2
-
DrGm (T1) T1
D
r
H
m
(T
)(
1 T2
-
1 T1
)
3. 电动势法:DrGm (T ) -ZFE
4. 光谱法:
DrGm (T ) T
B
B{Gm
(T
)
-
H
m
T
(298.15K )}B
+
Dr
H
(298.15K
m
)
5. 由物质旳微观数据,利用统计热力学提供旳有关 配分函数旳知识计算
∴ DrGmө = DrGmө (1)+ DrGm(2)+ DrGm(3)+ DrGm(4) = DrGmө (1)+ DrGm(2)+ 0+0
其中 DrGm(2)=RTln(p/pө) = –8.584 kJmol-1 DrGmө (1)= – 228.6 kJmol-1
度到达极限值—eq(反应旳程度)。 2.宏观上看反应停止了,实际上到达动态平衡。
rate(forward)= rate(backward) 3.平衡不受催化剂旳影响 4.反应条件不但能影响平衡,还能变化反应方向。如:
加压能使石墨金刚石
反应系统旳Gibbs 自由能
任意化学反应:( )T, p , W’=0时, 反应方向 和程度旳判据为:
对峙反应:正向反应和逆相反应都有一定程度旳进行
混合物旳构成不随时间而变化 — 化学反应旳程度
化学平衡是动态平衡,即,正向反应进行和逆相进行旳 速率相等
2
(1) 化学反应旳平衡状态
反应: Reactants
forward backward
4.1化学反应发生的条件第1课时课件--九年级化学沪教版(全国)(2024)上册

新 [应用] 我国研发团队研制出可以在水下燃烧的火炬,在2022
知
梳 年北京冬奥会上首次实现机器人水下火炬接力传递,让奥运
理
圣火呈现出水下燃烧的胜景。
(3)影响可燃物燃烧剧烈程度的因素
①内因:可燃物本身的性质。
②外因:a.氧气的浓度;b.可燃物与氧气的接触面积。
新 3.防火与灭火
知
梳 灭火的原理与方法
理
灭火的原理
实例
灭火的方法
(1) 将可燃物撤离燃烧
设置隔离带,使树木与
区,与火源隔离
扑灭森林火灾 燃烧区隔离
(2) 将燃烧着的可燃物
与空气隔离
熄灭酒精灯 用灯帽盖灭
新
知
灭火的原理
实例
灭火的方法
梳 理
(3) 使用大量的冷却剂
使燃烧物冷却,让燃烧
物的温度降低到着火 扑灭住宅着火 用高压水枪喷水灭火
点以下
实验内容
实验二
实验三
木条 燃烧, 实验现象 玻璃棒 没有
燃烧
杯中的蜡烛逐 渐 熄灭
木条 先燃 烧, 煤块 后
燃烧
新 知
序号
实验一
实验二
实验三
梳 理
木条具有 可燃 性, 蜡烛燃烧
木条和煤块都有 可燃 性,与 氧气
实验 与氧气接触,温度达
消耗了杯 接触,但木条的着火
分析 到着火点;玻璃棒不 具有 可燃 性
例 均正确的是(错误的请在原处更正)
( D)
选项 实例
灭火方法
灭火原理
A 油锅着火
用水浇灭
使温度降到可燃物的 着火点以下
B 液化气起火 关闭阀门 隔绝空气
C 住宅失火 用高压水枪灭火 降低可燃物的着火点
4.1化学反应发生的条件(第1课时)课件九年级化学(全国)(2024)上册

第4章 认识化学反应
第1节 化学反应发生的条件 第1课时 燃烧的条件
1星题 夯实基础
知识点1 化学反应需要一定的条件 1. 下列有关化学反应的说法中,错误的是( C )
A. 化学反应能否发生,与反应物本身的性质和反应的条件 直接相关
B. 化学反应有快有慢,通过改变条件可以调控反应的快慢 C. 实验室制氧气,一定需要催化剂 D. 影响化学反应的条件有反应物的浓度、温度、催化剂等
1星题 夯实基础
3. [2024潍坊期中]生活中一个小小的烟头可能引起一场火 灾,烟头在火灾中所起的负面作用是( A ) A. 使温度达到可燃物的着火点 B. 提供可燃物 C. 提供氧气 D. 降低可燃物的着火点
返回
1 2 3 4 5 6 7 8 9 10
1星题 夯实基础
4. [实验创新]在“燃烧的条件”教学中,老师改进了教材中 的实验,如图所示(已知白磷的着火点为40 ℃,红磷的着 火点为240 ℃)。请回答下列问题:
能发生爆炸,D符合题意。
【答案】D
返回
1 2 3 4 5 6 7 8 9 10
2星题 提升能力
7. [情境题2024盐城模拟]我国古代常用“火折子”保存火 种,《天工开物》中有关“火折子”的记载:“以白薯蔓
浸水泡浓,捶之,晒干,辅以硝五钱、硫黄二两、松香四 钱……装入竹筒,吹气复燃。”以下相关说法错误的是
1 2 3 4 5 6 7 8 9 10
返回
2星题 提升能力
(1)在上述实验中,面粉爆炸是 化学 (填“物理”或
“化学”)变化。
(2)鼓入空气的作用是 让面粉与空气充分接触 。
(3)下列情况下,不会发生爆炸的是 ①② (填序号)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
典例剖析∶
1.下列说法不正确的是 C A. 焓变是一个与反应能否自发进行有关的因素, 多数的能自发进行的反应都是放热反应。 B. 在同一条件下不同物质有不同的熵值,其体系 的混乱程度越大,熵值越大。 C. 一个反应能否自发进行取决于该反应放热还是 吸热
D. 一个反应能否自发进行,与焓变和熵变的共同 影响有关
很多情况下,简单地只用其中一个判据判断同一 个反应,可能会出现相反的判断结果,所以应两 个判据兼顾。由焓判据和熵判据组合成的复合判 据将更适合于所有的过程。
自发过程的变化趋势
1、能量趋于降低
2、混乱度趋于增加
解释:室温时冰融化
-10℃时水结冰
自主学习:P38科学视野
复合判据(自由能变化)
△ G=△H—T △S
(A)钠与水反应:
D
)
2Na(s) + 2H2O (l) = 2NaOH + H2 (g) △H=-368 kJ/mol
(B)铁生锈: 3Fe(s)+3/2O2(g)=Fe2O3(s)
△H=-824 kJ/mol
(C)氢气和氧气反应: 2H2(g)+O2(g)=2H2O(l ) △H=-571.6kJ/mol
练习1:
已知金刚石和石墨在氧气中完全燃烧的热化 学方程式为: ① C(金刚石、s)+O2(g) =CO2(g) △H1=-395.41kJ/mol ② C(石墨、s)+O2(g) = CO2(g) △H2=-393.51kJ/mol 关于金刚石与石墨的转化,下列说法正确的 是( AC )
A.金刚石转化成石墨是自发进行的过程 B.石墨转化成金刚石是自发进行的过程 C.石墨比金刚石能量低 D.金刚石比石墨能量低
练习2:
知道了某过程有自发性之后,则 A.可判断出过程的方向 B.可确定过程是否一定会发生 C.可预测过程发生完成的快慢 D.可判断过程的热效应
A
?
自发反应一定要△H < O ?
自发进行的吸热反应
N2O5分解: 2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol 碳铵的分解: (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
5、以下自发反应可用能量判据来解释的是( D ) A、硝酸铵自发地溶于水 B、2N2O5(g)===4NO2(g)+O2(g); △H=+56.7kJ/mol C、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g); △H=+74.9 kJ/mol D、2H2(g)+O2(g)=2H2O(l); △H=-571.6 kJ/mol
6、下列反应中,熵减小的是( D ) A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) B. 2N2O5(g)=4NO2(g)+O2(g) C. MgCO3(s)=MgO(s)+CO2(g) D. 2CO(g)=2C(s)+O2(g)
练习4 下列反应中,在高温下不能自发进行的是 D A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) B. 2N2O5(g)=4NO2(g)+O2(g) 熵增
熵增
C. MgCO3(s)=MgO(s)+CO2(g) 熵增
D. CO(g)=C(s)+1/2O2 熵减
一、自发过程的变化趋势
3、下列说法正确的是∶( D ) A、放热反应一定是自发进行的反应; B、吸热反应一定是非自发进行的; C、自发进行的反应一定容易发生; D、有些吸热反应也能自发进行。 4、250C和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g); △H=+56.76kJ/mol,自发进行的原因是∶ D A、是吸热反应;B、是放热反应; C、是熵减少的反应; D、熵增大效应大于能量效应。
当△ G<0时,反应自发进行 当△ G>0时,反应不自发进行 当△ G=0时,平衡状态
三、化学反应自发进行的方向
△ G=△H—T △S
H
<0
>0 >0 <0
S
>0
<0 >0 <0
G
<0 >0
反应在该状况下 能否自发进行 自发进行 不自发进行
低温时>0,高温时<0 低温不自发,高温自发 低温时<0,高温时>0 低温自发,高温不自发
1、能量趋于降低 2、混乱度趋于增加 注意:过程的自发性只用于判断过程的方向,不 能确定是否一定会发生和过程发生的速率。
二、化学反应自发进行的方向
1、物质具有的能量趋于降低
——H(焓变)<0 焓(H)判据 熵(S)判据
放热反应
熵增原理
2、物质的混乱度趋于增加
——S(熵变)>0
化学反应的方向
共同影响
2.下列反应中,熵减小的是 D A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) B. 2N2O5(g)=4NO2(g)+O2(g)
C. MgCO3(s)=MgO(s)+CO2(g)
D. 2CO(g)=2C(s)+O2(g)
练习与探究 1、下列说法正确的是∶( C )
混乱度
混乱度与熵
熵: 热力学上用来表示混乱度的状态函数,符 号为S ——体系的无序性越高,即混乱度越高, 熵值就越大
归纳:
同一物质,气态时熵最大, 液态时次之,固态时最小。
熵变△S:化学反应中要发生物质的
变化或物质状态的变化,因此存在着 熵变。 △S=S产物-S反应物
熵增:在密闭条件下,体系有由有序 自发地转变为无序的倾向
温度对反自发性的情况
类 型
△H
△S
△H— T△S
反应的自发性
1 2
—
+
永远是—
在任何温度都是自发反 应
+
—
永远是+
在任何温度下都是非自发 反应 在低温是自发反应 在高温是非自发反应 在低温是非自发反应 在高温是自发反应
3
4
—
—
在高温+ 在低温— 在高温— 在低温+
+
+
练习3
碳铵[(NH4)2CO3]在室温下就能自发地分解产 生氨气,对其说法中正确的是 A A、碳铵分解是因为生成了易挥发的气 体,使体系的熵增大。 B、碳铵分解是因为外界给予了能量 C、碳铵分解是吸热反应,根据能量判据 不能自发分解 D、碳酸盐都不稳定,都能自发分解。
盐酸滴加到石灰石上
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
二氧化碳气体通入氯化钙溶液中
自发过程:在一定条件下,不需要外力作 用就能自动进行的过程; 非自发过程:在一定条件下,需持续借助人 为作用才能进行的过程。
【讨论】请尽可能多地列举你熟 知的自发过程。
知识巩固:下列哪个过程非自发过程(
A、凡是放热反应都是自发的,由于吸热反应都是 非自发的; B、自发反应一定是熵增大,非自发反应一定是熵 减少或不变; C、自发反应在恰当条件下才能实现; D、自发反应在任何条件下都能实现。
2、自发进行的反应一定是∶( A、吸热反应;B、放热反应; C、熵增加反应;D、熵增加或者放热反应。
D)
△G=△H-T△S
反应熵变 △S
影响因素: 反应焓变 △H
吸热
放热
熵增
熵减
焓减小有利于反应自发,熵增大有利于反应自发
规律方法总结
自发反应中的焓变和熵变的关系
1、在温度、压力一定的条件下,放热的熵增加的反应 一定能自发进行 2、在温度、压力一定的条件下,吸热的熵减少的反应 一定不能自发进行 3、当焓变和熵变的作用相反时,如果二者大小相差悬 殊,可能某一因素占主导地位 4、当焓变和熵变的作用相反且二者相差不大,温度可 能对反应的方向起决定性作用 5、无热效应的自发过程是熵增加的过程,如两种理想 气体的混合等。
(D)水由低处往高处流
自发过程共同点——放热反应
△H<0
一、自发过程的能量判据
能量判据:自发过程的体系取向于从高能状 态转变为低能状态(这时体系会对外部做功 或释放热量),这一经验规律就是能量判据。
高能态→低能态+能量
(释放热量或对外做功)
能量判据又称焓判据,即△H<0的反应有自 发进行的倾向,焓判据是判断化学反应进行 方向的判据之一。
(1)既不吸热也不放热的自发过程
两种理想气体的混合可顺利自发进行
H2
O2
O2
H2
(2)吸热的自发过程 室温下冰块的融化; 硝酸盐类的溶解;
常温常压下N2O5的分解: 2N2O5(g) =4NO2(g)+O2(g); △H=+56.7kJ/mol
碳铵的分解:
(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g); △H=+74.9 kJ/mol
二、自发过程的熵判据
熵判据:
在与外界隔离的体系中,自发过程将 导致体系的熵增大,这一经验规律叫 做熵增原理,是判断化学反应方向的 另一判据——熵判据。
小结:自发过程的变化趋势
1、能量趋于降低: 高能态→低能态+能量
(释放热量或对外做功)
2、混乱度趋于增加
有虽与能量高低有关, 但用焓判据却无法解释清楚,例如:
学习要求: 1、理解能量判据、熵的概念
2、利用能量判据判断反应进行的 方向
3、利用熵变判断反应进行的方向
思考与交流
1、高山流水是一个自动进行的自然过程。 高处水一定会流到低处吗? 2、低处水可以流至高处么? 可采取什么措施?
3、在“低水高流”的过程中一旦外界停止做 功,该过程还能继续进行下去吗?
