2020高考化学大一轮复习第五章物质结构元素周期律第2节考点3元素周期表和元素周期律的应用课件
届高三化学一轮复习五物质结构元素周期律二节元素周期律PPT课件

=主族序数=最 外层电子数 (O、F 除外)
应 元素原子失 用 电子能力
逐渐减弱
逐渐增强
基础自知主识梳理 典例解析方法 考点能力突破
元素原子得 电子能力 元素的金属性 和非金属性
离子的氧化性 和还原性
最高价含氧酸酸性 最高价碱的碱性 气态氢化物稳定性 气态氢化物还原性 单质置换氢气 的难易程度
逐渐增强
。
基础自知主识梳理 典例解析方法 考点能力突破
二、元素周期律
1.定义 元素的性质随着原子序数的递增而呈周期性变化的规律。 2.实质 元素原子核外电子排布的周期性变化。
基础自知主识梳理 典例解析方法 考点能力突破
3.元素周期表中主族元素性质的递变规律
同周期(左→右) 同主族(上→下)
结
电子层数 相同
CH3OH、CH3F、H2N—NH2 等 ②阴离子:S2-、HS-、Cl-、O22③阳离子:K+、Ca2+
①Na+、NH4+、H3O+ ②F-、OH-、NH2③同位素如 11H、12H、13H
3.寻找10电子微粒和18电子微粒的思维方法 (1)10电子微粒:
(2)18电子微粒:
基础知识梳理 典考例点解研析析方突法破 考点能力突破
考点一原子核外电子排布的特殊规律及电子数相等的粒 子
1.核外电子排布的特殊规律(短周期元素) (1)最外层有 1 个电子的元素:H、Li、Na。 (2)最外层有 2 个电子的元素:He、Be、Mg。 (3)最外层电子数等于次外层电子数的元素:Be、Ar。 (4)最外层电子数是次外层电子数 2 倍的元素:C;是次外层 3 倍的元 素:O;是次外层 4 倍的元素:Ne。 (5)电子层数与最外层电子数相等的元素:H、Be、Al。 (6)电子总数为最外层电子数 2 倍的元素:Be。 (7)次外层电子数是最外层电子数的 2 倍的元素:Li、Si。 (8)内层电子总数是最外层电子数 2 倍的元素:Li、P。
2020高考化学复习专题之物质结构和元素周期律

物质结构、元素周期律(一)原子结构1.原子(A Z X)中有质子(带正电):Z个,中子(不显电性):(A—Z)个,电子(带负电):Z个。
2.原子中各微粒间的关系:①A=N+Z(A:质量数,N:中子数,Z:质量数)②Z=核电荷数=核外电子数=原子序数③M Z ≈ M N≈1836 M eˉ(质量关系)3.原子中各微粒的作用(1)原子核几乎集中源自的全部质量,但其体积却占整个体积的千亿分之一。
其中质子、中子通过强烈的相互作用集合在一起,使原子核十分“坚固”,在化学反应时不会发生变化。
另外原子核中蕴含着巨大的能量——原子能(即核能)。
(2)质子带一个单位正电荷。
质量为1.6726×10-27kg,相对质量1.007。
质子数决定元素的种类。
(3)中子不带电荷。
质量为1.6748×10-27kg,相对质量1.008。
中子数决定同位素的种类。
(4)电子带1个单位负电荷。
质量很小,约为11836×1.6726×10-27kg。
与原子的化学性质密切相关,特别是最外层电数数及排布决定了原子的化学性质。
4.原子核外电子排布规律(1)能量最低原理:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即依次:K→L→M→N→O→P→Q顺序排列。
(2)各电子层最多容纳电子数为2n2个,即K层2个,L层8个,M层18个,N层32个等。
(3)最外层电子数不超过8个,次外层不超过18个,倒数第三层不超过32个【注意】以上三条规律是相互联系的,不能孤立理解其中某条。
如M层不是最外层时,其电子数最多为18个,当其是最外层时,其中的电子数最多为8个。
(二)元素周期律、元素周期表1.原子序数:人们按电荷数由小到大给元素编号,这种编号叫原子序数。
(原子序数=质子数=核电荷数)2.元素周期律:元素的性质随着原子序数的递增而呈周期性变化,这一规律叫做元素周期律。
具体内容如下:随着原子序数的递增,①原子核外电子层排布的周期性变化:最外层电子数从1→8个的周期性变化。
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
高考化学一轮复习专题5物质结构元素周期律课件

态的M,则M为S、Y为O;X元素的最高价氧化物对应的水化物与其气态氢
化物相遇会有白烟生成,则X为N;根据图像可知,生成的沉淀为Al(OH)3,则Z
为Al。滴加NaOH溶液,沉淀量不变时说明N H
与OH-反应,则Q中一定含有
4
Al3+和N H
,结合Al3+、N
4
H
消4 耗NaOH溶液的体积可推知Q应该为NH4Al
金属性逐渐增强 非金属性逐渐减弱
离子的氧化性、还原 性
阳离子氧化性逐渐增 强 阴离子还原性逐渐减 弱
阳离子氧化性逐渐减 弱 阴离子还原性逐渐增 强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的 水化物的酸碱性
碱性逐渐减弱 酸性逐渐增强
碱性逐渐增强 酸性逐渐减弱
知能拓展
对比观 元素的性质对比
元素的非金属性与金属性、原子或离子半径大小、元素主要化合价 等具有周期性的变化规律,运用元素周期表和元素周期律,对比分析元素的 性质,注意物质性质的相似性、递变性和特殊性。
12/12/2021
(3)对角线规则
对角线元素(右图中的A与D)存在着相似性,如Li与Mg、Be与Al等,但只适
用于第二、三周期。这是由A、D的原子半径相近引起的。
二、元素周期律
项目
同周期(左→右)
同主族(上→下)
原子 结构
核电荷数 电子层数
逐渐增大 相同
逐渐增大 逐渐增多
原子半径
逐渐减小(稀有气体元 逐渐增大 素除外)
(SO4)2。H2O在常温下为液体,NH3在常温下为气体,故简单氢化物的沸点:H
2O>NH3,A项正确;S2-有3个电子层,O2-、Al3+均有2个电子层,电子层结构相
2020年高考化学一轮复习:物质结构、元素周期律
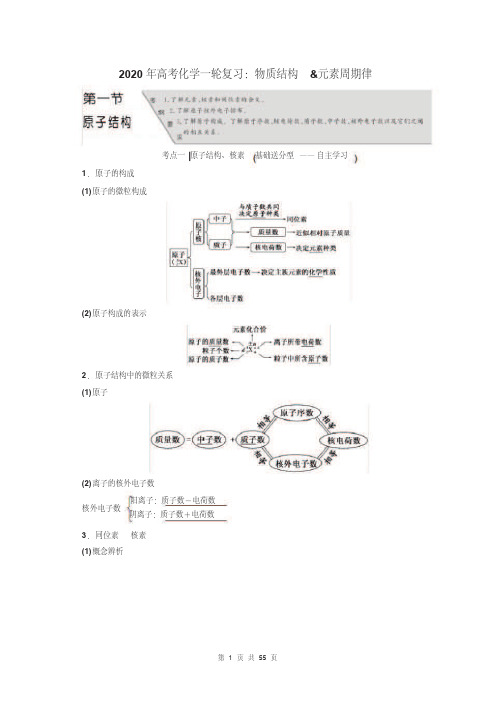
1. 原子的构成 (1) 原子的微粒构成
考点一 |原子结构、核素 基础送分型 —— 自主学习
(2) 原子构成的表示
2. 原子结构中的微粒关系 (1) 原子
(2) 离子的核外电子数 阳离子:质子数-电荷数
核外电子数 阴离子:质子数+电荷数
3. 同位素 核素 (1) 概念辨析
O
的相对分子质量相同
解析: 选 C 同种元素形成的不同单质称为同素异形体。
[探规寻律 ]
“同位素 ” 的特点
(1)在元素周期表中处于同一位置一般使用同一元素符号。但如氕、氘、氚在周期表中都处于
同一位置,氢的同位素一般可用不同的符号来表示,如
11H
、
D(
2 1
解析: 选 D A.元素符号左下角表示的是原子核内的质子数,原子核内的质子数等于该元素
的原子序数,所以该元素的原子序数是
116,正确。 B.在原子符号的左上角表示的是该元素原子的
质量数,质量数就是质子数与中子数的和,所以该原子的中子数是
293- 116= 177,正确。 C. 对于
元素的原子来说,原子核内的质子数等于原子核外的电子数,等于元素的原子序数,所以该原子的
A. 23984Pu
与
238 92
U
的质子数不同,不能互为同位素,错误;
B.23984 Pu
与
239 94
Pu
均是核
第 3 页 共 55 页
素,不是单质,不能互为同素异形体,错误;
C.
238
94Pu
与
238
92 U
的质子数不同,属于不同的元素,不可
能具有完全相同的化学性质,错误;
高考化学(鲁科版)一轮总复习(课件):第5章_物质结构_元素周期律_第2节_元素周期律和元素周期表

2.(1)16号元素属于________周期________族。 (2)属于第4周期ⅡA族的元素符号为________,原子序数为________。 [提示] (1)第3 ⅥA (2)Ca 20 (3)第6 ⅦA
[考点多维探究] 角度1 元素周期表结构的分析判断 1.下列各表分别是元素周期表的一部分(表中为原子序数),其中符合实际情 况的是( )
“0族”法确定元素位置 (1)熟记0族元素的相应周期数和原子序数
元素符号 He Ne Ar Kr Xe Rn 原子序数 2 10 18 36 54 86 周期数 1 2 3 4 5 6
(2)确定主族元素在周期表中位置的方法:原子序数-最邻近的稀有气体元素 的原子序数=ΔZ。
若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ| 若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ
角度2 元素在周期表中位置的确定 4.根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( )
【导学号:99682167】 A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数 相等 D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子 数相等
高考化学一轮复习 第五章 物质结构 元素周期律 第2讲 元素周期律和元素周期表课件 新人教

2.电负性 (1)含义:元素的原子在化合物中 吸引键 合电子 能力的标度。元素的电负性越大,表示其原 子在化合物中 吸引键合电子 的能力越 强 。 (2) 标准 :以最 活泼 的非金 属氟的 电负 性为 4.0 和锂的电负性为 1.0 作为相对标准,计算得出 其他元素的电负性(稀有气体未计)。
(3)变化规律 ①金属元素的电负性一般 小于1.8 ,非金
3.启发人们在一定区域内寻找新物质 (1)半导体元素在分区线附近,如:Si、Ge、Ga 等。
(2)农药中常用元素在右上方,如:F、Cl、S、 P、As 等。
(3)催化剂和耐高温、耐腐蚀合金材料主要在过 渡元素中找。如:Fe、Ni、Rh、Pt、Pd 等。
考点精讲
考点一 元素周期表的结构
问题 1:如何根据原子序数确定元素在周期表中的 位置?
有气体元素所在周期的下一周期。 (3)求差值,定族数。若某元素原子序数比相应稀有气
体元素多 1 或 2,则该元素处于该稀有气体元素所在周期的 下一周期的ⅠA 族或ⅡA 族;若比相应稀有气体元素少 1~ 5,则该元素处于稀有气体元素所在周期的ⅢA~ⅦA 族。 对于过渡元素族序数的确定另行考虑。
问题 2:同周期ⅡA 族与ⅢA 族元素原子序数差的关 系如何?
第Ⅷ 族
第 8、9、10 共 3 列
0族
第18 列
(4)分区
①分界线:沿着元素周期表中 铝、锗、锑、 钋 与 硼、硅、砷、碲、砹 的交界处画一条斜线,
即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左下方 金属元素区,分界线 右上方为非金属元素区 。
③分界线附近元素的性质:既表现 金属 元素 的性质,又表现 非金属元素 的性质。
(5)重要关系 ①周期序数=元素原子的电子层数。
2020年高考化学一轮复习第5章第2节元素周期表元素周期律课件

②各区位置:分界线左下方为_金__属_元__素__区___,分界线 右上方为_非__金__属__元__素__区__。
③分界线附近元素的性质:既表现_金__属__元__素__的性质, 又表现_非__金__属__元__素__的性质。
(2)过渡元素:元素周期表中部从__Ⅲ__B_族到__Ⅱ_B__族 10 个纵行共六十多种元素,这些元素都是金属元素。
(3)镧系:元素周期表第_六___周期中,57 号元素镧到 71 号元素镥共 15 种元素。
(4)锕系:元素周期表第_七__周期中,89 号元素锕到 103 号元素铹共 15 种元素。
辨析拓展 1.正误判断(正确的打“√”,错误的打“×”)。 (1)元素周期表是按元素的相对原子质量由小到大排 列而形成的。( ) (2)三、四周期同主族元素的原子序数相差 8。( ) (3)同周期第ⅡA 族和第ⅢA 族的原子序数相差 1。 () (4)元素周期表中位于金属与非金属分界线附近的元 素属于过渡元素。( )
族,就不会有 B;A 若为氦元素,则其位于最右边一族, 那么不会有 C。既然 A 不是氢元素或氦元素,则 A、E 原子序数之差不可能为 2,A 错误;由表中位置关系可知 D、E 原子序数之差可能是 8、18 或 32,B 正确;又知 B、 D 原子序数之差应大于 8,D 正确;B、C 之间仅隔有 E 一种元素,故原子序数之差一定为 2,C 正确。
利用稀有气体元素确定主族元素在周期表中的位置 原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
若ΔZ <0,则与稀有气体元素同周期,族序数为8-|ΔZ| 若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ
例如:(1)35 号元素(相邻近的是 36Kr),则 35-36=-1, 故周期数为 4,族序数为 8-|-1|=7,即第四周期第ⅦA 族, 即溴元素;
高考化学一轮复习学案课件(人教版)第5章物质结构元素周期律第2节元素周期律(1)

答案:
一、1. K L M N O P Q 由近到远 由低到高 2.(1)能量低 (2)2n2 (3)8 2 (4)18 2 32 二、1. 性质 原子序数 周期性 2. 核外电子排布 3. 减小 增大 相同 逐渐增多 逐渐增多 相同 减弱 增强 增强 减弱 减弱 增强
增强 减弱 主族序数 主族序数 增强 减弱 减弱 容易 增强 难 减弱
其他
分子 Ar F2、HCl
离子
K+、Ca2+、Cl-、 S2-
O22-、HS-
H2S
PH3、H2O2
SiH4、CH3F
N2H4、CH3OH
C2H6、CH3NH2等
【温馨提示】上表中有些18电子粒子符合“9+9”规律,如 C2H6、H2O2、N2H4、F2、CH3F、CH3OH等(-CH3、-OH、 -NH2、-F为9电子基团)。
三、2. (1)金属与非金属的分界线 (2)过渡元素 (3)右上角
原子核外电子的排布
【自主解答】
C 解析:K层电子数为奇数的元素只有H,A正确;L层或M层电 子数为奇数时,此层为最外层,族序数等于最外层电子数,B、D 均正确;第二周期以后元素的L层中电子数均为8个,但族序数与L 层电子数无关,C错误。
非金属元素气态氢化物 的形成与稳定性
最高正价=______最 低负价=主族序数-8
酸性逐渐________碱 性逐渐________
气态氢化物的形成越来 越______,其稳定性 逐渐______
最高正价数= ________(O、F除外)
酸性逐渐________碱 性逐渐________
气态氢化物的形成越来 越______,其稳定性 逐渐______
②最高价氧化物性也就越强。
2022高考化学一轮复习 第五单元 物质结构 元素周期律 第2节 元素周期表 元素周期律课件 新人

答案 C 解析 表中数字代表元素的相对原子质量,故A错误;表中元素的排列依据是 相对原子质量的大小,故B错误;根据题给元素周期表的一部分推测表中 “?=70”和C、Si在同一横排,应属于同主族,所以该元素的最高化合价为+4 价,故C正确;每一横行都对应现在常用的元素周期表中的同一族,故D错误。
考向2 元素在周期表中位置的推断 【典例2】 (2020四川眉山中学二诊)下表是元素周期表的一部分,W、X、 Y、Z为短周期主族元素。Z的最高价氧化物对应的水化物为M,室温 下,0.01 mol·L-1M溶液pH<2。下列说法中错误的是( )
对点演练2为纪念门捷列夫发表第一张元素周期表(部分如下)150周年,联 合国宣布2019年为“国际化学元素周期表年”。关于下表的说法正确的是 ()
A.表中数字代表元素的原子序数 B.表中元素的排列依据是元素的原子结构 C.推测表中“?=70”指代的元素的最高化合价为+4价 D.每一列(纵行)都对应现在常用的元素周期表中的一族
自我诊断 1.最外层电子数是2的元素一定是第ⅡA族的元素吗?
提示 不一定。最外层电子数为2的元素也可以是0族元素He和部分过渡元 素。
自我诊断 1.最外层电子数是2的元素一定是第ⅡA族的元素吗? 2.判断正误,正确的打“√”,错误的打“×”。 (1)元素所在的主族序数与最外层电子数相等的元素都是金属元素。( ) (2)第ⅠA族全部是金属元素。( ) (3)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。
2.元素周期表的编排原则
3.元素周期表 (1)元素周期表的结构。
(2)周期(7个横行,7个周期)。
周期序数 元素种数 0族元素原子序数
1234567 2 8 8 18 18 32 32 2 10 18 36 54 86 118
2020高考化学大一轮复习第五章物质结构元素周期律第2节考点3元素周期表和元素周期律的应用课件

2
考点突破
元素位、构、性的综合应用★★★★★
1.(2019·广东揭阳模拟)四种短周期主族元素W、X、Y、Z的原子序数依次增 大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中 最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
第五章
物质结构 元素周期律
第二节 元素周期表 元素周期律
考点3 元素周期表和元素周期律的应用
栏目导航
01
夯实考点
02
考点突破
03 真题体验·直击高考
04
配套训练
1
夯实考点
【知识梳理】
1.元素周期表中元素的分区 ①分界线:沿着元素周期表中___铝_、 锗、锑、钋与硼、___硅_、砷、碲、砹的交 界处画一条斜线,即为金属元素区和非金
(3)结构与性质的互推。 ①若元素的最外层电子数小于4,则该元素容易__失__电__子__;若该元素的最外层电 子数大于4,则该元素容易__得__电__子__。 ②若某元素容易得电子,则可推知该元素的最外层电子数___大__于__4_;若某元素 容易失电子,则可推知该元素的最外层电子数__小__于___4_。
() A.简单离子半径:W<X<Z B.W与X形成的化合物溶于水后溶液呈碱性 C.气态氢化物的热稳定性:W<Y D.最高价氧化物的水化物的酸元素原子中最大的,为钠元素,Z与X形成 的化合物水溶液呈中性,说明XZ为氯化钠,Z为氯元素,则Y为硫元素或磷元素,W 为氧元素或氮元素。简单离子半径:Z>W>X,A项错误;W和钠形成的化合物为 氮化钠、氧化钠或过氧化钠,其水溶液溶质都有氢氧化钠,显碱性,B项正确;气态 氢化物稳定性:W>Y,C项错误;最高价氧化物对应的水化物中高氯酸酸性最强, D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
考点突破
元素位、构、性的综合应用★★★★★
1.(2019·广东揭阳模拟)四种短周期主族元素W、X、Y、Z的原子序数依次增 大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中 最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
() A.简单离子半径:W<X<Z B.W与X形成的化合物溶于水后溶液呈碱性 C.气态氢化物的热稳定性:W<Y D.最高价氧化物的水化物的酸性:Y>Z 【答案】B
【解析】X的原子半径是短周期主族元素原子中最大的,为钠元素,Z与X形成 的化合物水溶液呈中性,说明XZ为氯化钠,Z为氯元素,则Y为硫元素或磷元素,W 为氧元素或氮元素。简单离子半径:Z>W>X,A项错误;W和钠形成的化合物为 氮化钠、氧化钠或过氧化钠,其水溶液溶质都有氢氧化钠,显碱性,B项正确;气态 氢化物稳定性:W>Y,C项错误;最高价氧化物对应的水化物中高氯酸酸性最强, D项错误。
【解析】根据题中的化合价可知,d为O,g为S,则x为H,f为Al,e为Na,h为 Cl,y为C,z为N。x元素在周期表中位置是第一周期ⅠA,A错误;离子半径大小: S2->Cl->O2->Na+>Al3+,B项正确;非金属性:N>C,最高价氧化物对应水化物 酸 性 HNO3>H2CO3 , C 项 错 误 ; 非 金 属 性 : Cl>S , 气 态 氢 化 物 的 热 稳 定 性 HCl>H2S,D项错误。
【解析】氨可作制冷剂,所以W是氮元素;钠是短周期主族元素中原子半径最
大的,所以Y是钠元素;Na2S2O3与稀盐酸反应生成黄色沉淀硫单质和有刺激性气味 的气体SO2,所以X、Z分别是氧元素、硫元素。氧元素非金属性强于氮元素,所以 热稳定性:H2O>NH3,A项正确;Na、O的简单离子都具有与氖原子相同的电子层 结构,B项正确;硫化钠水溶液呈碱性,该溶液可使石蕊试纸变蓝,C项错误;S、O
(1)结构与位置互推。 ①电子层数=__周__期__序__数__;质子数=_原__子__序__数___; 最外层电子数=__主__族__序__数__。 ②熟练掌握周期表中的一些特殊规律:各周期所能容纳元素种数;稀有气体的 原子序数及在周期表中的位置;同族上下相邻元素原子序数的关系。
(2)性质与位置的互推。
(3)结构与性质的互推。 ①若元素的最外层电子数小于4,则该元素容易__失__电__子__;若该元素的最外层电 子数大于4,则该元素容易__得__电__子__。 ②若某元素容易得电子,则可推知该元素的最外层电子数___大__于__4_;若某元素 容易失电子,则可推知该元素的最外层电子数__小__于___4_。
【思维深化】
判断正误(正确的画“√”,错误的画“×”)。 (1)在周期表中的金属与非金属的分界线附近可以探索研制农药的材料( ) (2)硒是第ⅥA族元素,推测可知其氢化物的稳定性弱于HCl的稳定性( ) (3)原子序数为29的元素位于元素周期表的第四周期第ⅠB族( ) (4)俄罗斯专家合成了核素X,则该元素位于元素周期表中第七周期第ⅥA族
同为第ⅥA族元素,S、Na同为第三周期元素,D项正确。
2.(2018·云南昆明模拟)随原子序数递增,八种短周期元素(用字母x,y,z…表 示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法正确的是
()
A.x元素在周期表中的位置是第二周期ⅠA族 B.离子半径:g2->h->d2->e+>f3+ C.最高价氧化物对应水化物的酸性:y>z D.气态氢化物的热稳定性:g>h 【答案】B
属元素区的分界线(氢元素除外)。 ②各区位置:分界线左面为__金__属__元
素区,分界线右面为__非__金__属__元素区。 ③分界线附近元素的性质:既表现
_金__属___元__素__ 的 性 质 , 又 表 现 __非__金__属__元__素__ 的性质。
2.元素周期表的应用
3.元素“位—构—性”之间的关系及应用
①根据元素的性质可以推知元素在周期表中的位置。如同周期元素A、B、C的 金属性逐渐增强,则可知A、B、C在同周期中按__C_、__B__、__A_的顺序从左向右排列。
②根据元素在周期表中的位置关系可以推断元素的性质。如A、B、C三种元素 在 同 一 主 族 中 由 上 而 下 排 列 , 则 A 、 B 、 C 的 单 质 氧 化 性 依 次 ___减__弱_ 或 还 原 性 依 次 _增__强___。
第五章
物质结构 元素周期律
第二节 元素周期表 元素周期律
考点3 元素周期表和元素周期律的应用
栏目导航
01
夯实考点
02
考点突破
Байду номын сангаас
03 真题体验·直击高考
04
配套训练
1
夯实考点
【知识梳理】
1.元素周期表中元素的分区 ①分界线:沿着元素周期表中___铝_、 锗、锑、钋与硼、___硅_、砷、碲、砹的交 界处画一条斜线,即为金属元素区和非金
3.(2017·全国卷Ⅰ,12)短周期主族元素W、X、Y、Z的原子序数依次增大, W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由 X、Y和Z三种元素形成的一种盐溶于水,加入稀盐酸,有黄色沉淀析出,同时有刺 激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W的强 B.Y的简单离子与X的简单离子具有相同的电子层结构 C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红 D.Z与X属于同一主族,与Y属于同一周期 【答案】C
