第十一讲 等效平衡和平衡的应用拓展(一)
等效平衡的含义及应用

等效平衡的含义及应用等效平衡是指一种在特定条件下,不同的物体或现象在某种方面具有相同的效果或相互抵消的状态。
等效平衡的应用极为广泛,既出现在数学、物理等自然科学中,也广泛应用于经济、政治、社会等人文科学领域。
下面我将详细介绍等效平衡的含义及应用。
等效平衡在自然科学领域的应用:在物理学中,等效平衡是指在特定条件下,不同的力或物体在某种方面具有相同的效果或相互抵消的状态。
例如,在力学中,当两个力大小相等、方向完全相反时,它们产生的效果相互抵消,物体处于力的等效平衡状态。
这种平衡状态在人们生活中的应用非常广泛,例如在建筑工程中,设计师需要考虑建筑结构的平衡,以确保建筑物的稳定和安全。
此外,在电路中,等效平衡由于电阻、电容、电感等元件来建立,从而使电流和电压达到平衡,以确保电路的正常工作。
在经济学中,等效平衡是指在一定条件下,不同的经济变量或影响因素在某种方面达到平衡状态。
例如,在需求和供应的关系中,当某个商品的需求量等于供应量时,市场达到供需平衡,商品的价格也会趋于稳定。
在宏观经济学中,经济平衡则是指国民经济总量的需求与供给的平衡状态,通常表现为国内生产总值与总消费、总投资等的平衡关系。
这种等效平衡的概念在宏观经济政策制定和货币政策执行中起着重要的作用,有助于维持经济的稳定和可持续发展。
在政治学和国际关系学中,等效平衡被用来描述国际关系中的力量对称和相互制衡的状态。
国际关系理论认为,只有在大国之间保持相对平衡的力量,才能防止某个国家的霸权行为。
在欧洲的历史上,等效平衡原则曾经起到了重要的作用,例如在拿破仑战争之后,各个国家之间建立起的复杂的联盟体系,以保持力量相对平衡,维护和平。
此外,在现代国际政治中,国际组织的成立和多边协议的签署,也是为了维持国际社会的等效平衡,促进各国的合作与共赢。
在社会学中,等效平衡被应用于社会关系和社会结构的研究。
社会关系中的等效平衡通常指的是人际关系的互惠性和平衡,即人与人之间的互相给予和接受应该是相对平衡的。
等效平衡知识点总结

等效平衡知识点总结等效平衡是指在特定条件下,两个或多个物体或系统的状态达到平衡,其效果相同。
等效平衡是物理学中一个重要的概念,它在多个领域都有着广泛的应用,例如力学、热力学、电磁学等。
在本文中,我们将对等效平衡的知识点进行总结,包括概念、原理、应用等方面。
1. 概念等效平衡是指在某些条件下,两个或多个物体或系统的状态达到平衡,而它们的效果是相同的。
也就是说,虽然系统的组成部分、结构或者形状不同,但是它们达到平衡的效果却是一样的。
这种情况下,我们可以认为这些系统是等效平衡的。
2. 原理等效平衡的原理可以总结为以下几点:(1)平衡条件:等效平衡的系统必须满足平衡条件,即各个部分的作用力和反作用力平衡,或者各个部分的力矩和反力矩平衡。
只有在这种条件下,系统才能达到平衡状态。
(2)效果相同:虽然系统的组成部分、结构和形状可能有所不同,但是它们达到平衡的效果是相同的。
这意味着我们可以从效果上来看,将这些系统视为等效平衡的。
(3)等效性:等效平衡的系统之间具有等效性,即它们在某些特定条件下可以互相替代,而不会改变系统的平衡状态。
这种等效性是等效平衡的重要特征。
3. 应用等效平衡在物理学中有着广泛的应用,包括但不限于以下方面:(1)力学:在力学中,我们常常会遇到复杂的物体或系统,如梁、桥、支架等。
通过等效平衡的原理,我们可以将这些复杂的系统简化为等效的力学模型,从而更容易地进行分析和计算。
(2)热力学:在热力学中,等效平衡的概念可以用来分析热量的传递和平衡。
例如,当两个系统之间存在热传导时,我们可以将它们视为等效平衡的系统,从而更好地理解热传导的规律。
(3)电磁学:在电磁学中,等效平衡的概念可以用来分析电路的平衡和稳定性。
例如,我们可以将复杂的电路简化为等效的电路模型,从而更方便地进行电路设计和分析。
4. 注意事项在使用等效平衡的原理时,需要注意以下几点:(1)条件限制:等效平衡的原理只在特定条件下成立。
因此,在使用等效平衡的原理时,需要确保系统满足平衡条件,才能将其视为等效平衡的。
例析等效平衡原理及其应用讲课教案

例析等效平衡原理及其应用例析等效平衡原理及其应用一、等效平衡的概念在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,无论是从正反应开始,还是从逆反应开始,或者从正、逆反应同时开始,在达到化学平衡状态时,反应混合物中任何相同组分的百分含量(物质的量分数、体积分数或质量分数)均相同,这样的化学平衡互称等效平衡(包括“相同的平衡状态”)。
对概念的几点说明:⑴外界条件相同:通常可以是①恒温恒容②恒温恒压;⑵“等效平衡”与“完全相同的平衡状态”不同:“等效平衡”只要求平衡混合物中各组分的百分含量(物质的量分数、体积分数或质量分数等)对应相同即可,而对于物质的量、浓度、压强、反应速率等可以不相同;⑶平衡状态只与始态有关,而与途径无关,只要物料相当,就能达到相同的平衡状态。
二、等效平衡建立的条件及类型1.恒温恒容的等效平衡⑴在恒温恒容条件下,对于反应前后气体体积改变的反应(即△V≠0的体系):若改变起始加入情况,只要通过可逆反应的化学计量数比换算成方程式左右两边同一边物质的物质的量与原平衡相等,则两平衡等效;⑵在恒温恒容条件下,对于反应前后气体体积不变的反应(即△V=0的体系):只要反应物(或生成物)的物质的量的比与原平衡相同,则两平衡等效;2.恒温恒压的等效平衡在恒温恒压条件下,若改变起始加入情况,只要通过可逆反应的化学计量数比换算成方程式左右两边同一边物质的物质的量之比与原平衡相同,则两平衡等效。
三、等效平衡在解化学平衡试题中的应用1.求不同起始状态的各物质的物质的量例1、在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O22SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。
现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量。
如果a、b、c取不同的数值,它们必须满足一定的关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同,请填写下列空白:⑴若a=0,b=0,则c= 。
等效平衡原理、规律及应用完美版

等效平衡原理、规律及应用〖目标与要求〗运用对比的方法掌握等效平衡的基本原理规律和计算方法〖内容与要点〗等效平衡原理、规律、例题和习题一、等效平衡原理在一定条件下(定温定容或定温定压),对于同一可逆反应,不管从正反应开始,还是从逆反应开始,只是起始时加入物质的情况不同,而达到平衡时,任何相同组分的含量均相同,这样的化学平衡互称为等效平衡。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
如,常温常压下,可逆反应:2SO2 + O22SO2①2mol 1mol 0mol②0mol 0mol 2mol③①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡。
二、等效平衡规律①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比值与原平衡相同,则两平衡等效。
③在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
反之,等效平衡时,物质的量之比与原建立平衡时相同。
三、等效平衡投料方案的设计(1)“站点法”设计恒温恒容下的等效平衡3H2 + N2 2NH3原始站 A 4 1 0中途站 B: a b c平衡站P [] [] []中途站 C: a’b’c’终极站 D 0 2显然,从初始到平衡态的过程中,反应要经历中间的许多站点B、C... 若以此站点值为起始投料方案,都能建立等效平衡.A和D 是达到平衡站点(P)两个极端.A 站点要经正向右移而达到平衡点P; D 站点要经逆向左移而达到平衡点P. 该例中,H2的取值在4mol-1mol之间.从一个站点到另一个站点各物质的变化量之比等于化学方程式计量数之比.如有:(4-a):(1-b): (0+c)=3:1:2 (1+a’): (0+b’):2-c’)=3:1:2 等等.(2) “扩缩法”设计恒温恒压下的等效平衡恒温恒压下,将各物质的量增扩(或减缩)同样倍数都能建立相同的平衡态.因恒压,气体总体积要随之扩大(或缩小)相应的倍数,致使气体浓度没变,平衡没发生移动,所以这样建立的都是等效平衡。
等效平衡专题(较好的资料)
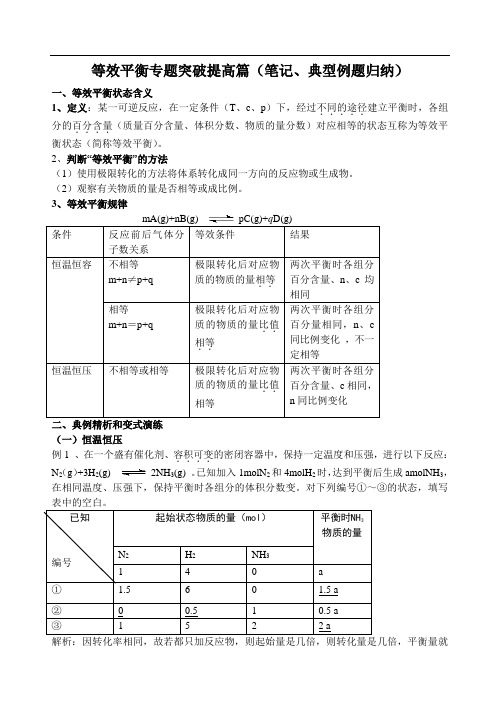
等效平衡专题突破提高篇(笔记、典型例题归纳)一、等效平衡状态含义1、定义:某一可逆反应,在一定条件(T 、c 、p )下,经过不同的途径.....建立平衡时,各组分的百分含量....(质量百分含量、体积分数、物质的量分数)对应相等的状态互称为等效平衡状态(简称等效平衡)。
2、判断“等效平衡”的方法(1)使用极限转化的方法将体系转化成同一方向的反应物或生成物。
(2)观察有关物质的量是否相等或成比例。
3、等效平衡规律二、典例精析和变式演练(一)恒温恒压例1 、在一个盛有催化剂、容积可变....的密闭容器中,保持一定温度和压强,进行以下反应: N 2(g )+3H 2(g) 2NH 3(g) 。
已知加入1molN 2和4molH 2时,达到平衡后生成amolNH 3,在相同温度、压强下,保持平衡时各组分的体积分数变。
对下列编号①~③的状态,填写表中的空白。
解析:因转化率相同,故若都只加反应物,则起始量是几倍,则转化量是几倍,平衡量就是几倍,又因等压条件下物质的量之比等于体积之比,故起始量之比等于平衡量之比。
①和题干量之比是1.5,平衡之比就是1.5。
②的平衡量是题干平衡量的一半,则若没有NH3,只有N2、H2,则其物质的量应分别为0.5和2mol,又因1 mol NH3完全转化生成N20.5 mol,H21.5mol,故原来的N2、H2分别为0 mol 和0.5mol。
③可同理推得。
例2、恒温、恒压..下,在一个可变容积的容器中发生如下发应:A(g)+B(g)C(g)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol 和3a mol,则x=mol,y=mol。
平衡时,B的物质的量(选填一个编号)(甲)大于2 mol (乙)等于2 mol(丙)小于2 mol (丁)可能大于、等于或小于2mol作出此判断的理由是。
等效平衡规律的理解和应用

等效平衡规律的理解和应用《化学平衡》一章常会考:⑴同一化学反应在不同条件某物质百分含量的大小、转化率等。
⑵化学平衡的相关计算等等。
而要解决此类问题,则常运用等效平衡规律。
为此,在复习中必须理解等效平衡规律,从而正确地运用该规律解决化学平衡中的很多问题,最终达到真正掌握知识的目的。
一等效平衡定义:化学平衡状态与条件相关,而与建立平衡的途径无关。
对于同一可逆反应,在同一条件下以不同投料方式(即从正反应,逆反应或从中间状态开始)进行反应,只要达到平衡时相同组分在混合物中的百分数相同,这样的平衡称为等效平衡。
二等效平衡规律的理解规律之一:恒温恒容条件下体积可变的反应⑴规律:如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡状态等效。
例如:2SO 2(g)+O2(g)2SO3(g)①2moL 1moL 0②0 0 2moL③amoL bmoL cmoL 如果此时满足a+c=2 b+1/2 c=1则①②③建立的化学平衡状态等效⑵理解:化学平衡的建立与途径无关,起始加反应物或起始加生成物,只要加入的物质极值转化后物质的量相等,又由于恒温恒容,此时的平衡不仅是等效的,而且是同一平衡。
平衡时相同组分的物质的量,浓度,转化率及混合气体的密度,相对分子质量都相等。
规律之二:恒温恒容条件下体积不变的反应⑴规律:如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡状态等效。
例如:2A(g)+3B(g)5C(g)①2moL 3moL 0②0 0 10moL③amoL bmoL cmoL 如果此时满足(a +2/5c)/(b+3/5c)=2/3则①②③建立的化学平衡状态等效⑵理解:以上述反应为例,在等温时分别在1L的容器Ⅰ和2L的容器Ⅱ中加入2moL A 、3mo B 和4moLA 、6mo B。
容器Ⅱ中间有可抽动的隔板(隔板的体积忽略),此时容器Ⅱ左右两边的反应与容器Ⅰ完全相同,则达平衡时容器Ⅱ左右两边的反应与容器Ⅰ相同组分的物质的量,浓度,转化率及混合气体的密度,相对分子质量都相等。
高二化学等效平衡的应用

富婆群 https:///
夏日如火,似水流年。青春像时钟上的指针,一去不复返,带走了我们的幻想与美好 。落寞的身影消散了,只剩下哀伤而又华丽的碎片从眼前斜斜飞过。折翼天使带走了梦想的翅膀,那一刻便瞬间僵硬,找不到一丝生气。回旋﹑辗转﹑缠绕逐渐勒紧直到缺氧 ,脑中却是一片空白。压 抑的氛围席卷了一切。天空黑的史无前例,没月华,没星光 。记忆像是香樟树的年轮,随着时间的增长,被青苔包裹着暗中滋长,与日俱增。寂寥的眼神透入心底,映射着说不出的空洞孤寂。雾雨朦 朦胧胧的飘落着扬扬洒洒,带着 不尽
高中化学等效平衡知识点及典例(K12教育文档)

高中化学等效平衡知识点及典例(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学等效平衡知识点及典例(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学等效平衡知识点及典例(word版可编辑修改)的全部内容。
化学等效平衡知识点一、概念:在一定条件下,同一可逆反应的两个不同的起始状态(一般是各组分起始加入量不同)分别达到平衡时,同种组分的含量都相同,这样的两个平衡叫等效平衡。
二、规律:①对于一般的可逆反应,在定温定容的条件下,只改变起始时加入物质的物质的量,若通过可逆反应的化学计量数比例换算成同一半边的物质的物质的量(终态假设)与原平衡相同,这样的平衡就是等效平衡。
②在定温定容的条件上,对于反应前后气体分子数不变的可逆反应,只要反应物(生成物)的物质的量的比例与原平衡相同,两平衡即是等效平衡。
③在同温同压条件下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
三、等效相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,达到平衡时,任何相同物质的含量(体积分数、质量分数或物质的量分数)都相同的化学平衡互称等效平衡。
可分为“全等效”平衡和“相似等效"平衡.判断等效平衡的方法:使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的数量是否相当。
在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,起始时加入物质的物质的量不同,达平衡时的状态规律如下表:一、恒温恒容(定T、V)的等效平衡1.在定T、V条件下,对于反应前后气体体积改变的反应:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
剖析等效平衡及其应用举例

剖析等效平衡及其应⽤举例剖析等效平衡及其应⽤举例化学平衡是中学化学中重要理论内容,⽽等效平衡是化学平衡的难点部分,学⽣往往在理论学习中,很容易接受等效平衡,但在解决相关问题时,困难重重,有时甚⾄⽆从下⼿,下⽂将从各⽅⾯对等效平衡总结归纳,并列举出相关的例题,希望能给⼤家带来帮助。
⼀、建⽴等效平衡的依据——⼀定条件下化学平衡的建⽴,与途径⽆关,只与条件和起始物质的量有关。
⼆、等效率平衡的定义——在⼀定条件(同温同容或同温同压)下,同⼀可逆反应,不管起始物是全部反应物还是全部⽣成物,或部分⽣成物和全部反应物或部分反应物和全部⽣成物,只要达到平衡时,各组分的量(包括体积,物质的量,或质量等)或含量(包括,体积分数,物质的量分数,或质量分数等)或浓度保持不变的状态,均互为等效平衡。
三、⼏种规律⼀、同温同容下1、反应前后⽓体系数有变化的可逆反应,如222SO O32SO 改变起始量,若平衡时各组分的量或含量对应相等,也能互为等效平衡。
解题⽅法——按化学⽅程式计算,完全换算到同⼀⽅向各组分的量对应相等。
例2006年汕头⼀模,在⼀定温度下,把2mol 2SO 和21molO 通⼊⼀个⼀定容积的密闭容器⾥,发⽣如下反应. 22322SO O SO + 当此反应进⾏到⼀定程度时,反应混合物就处于化学平衡状态,现在该容器中维持温度不变,令分别代表初始加⼊的2SO 、2O 和3SO的物质的量a 、b 、c mol ,如a 、b 、c 取不同的数值,它们必须满⾜⼀定的相互关系,都能保证达到平衡时,反应混合物中三种⽓体的体积分数仍跟上述平衡时的完全相同。
请填写下列空⽩。
(1)若a=0,b=0则c= 。
(2)若a=0.5,b= 和c=(3)a 、b 、c 必须满⾜的⼀般条件是(请⽤两个⽅程式表⽰,其中⼀个只含a 和c ,另⼀个只含b 和c 。
)答案:(1)2 (2)0.25、1.5 (3)a+c=2, b+2c =1 2、反应前后⽓体系数不变的可逆反应,如改变起始量,达到等效平衡有两种可能。
等效平衡原理及规律总结

等效平衡原理及规律总结哎呀,今天咱们聊聊等效平衡原理及规律总结这个话题,咋听起来有点高大上呢?其实啊,这里面涉及到的东西还是挺有趣的。
就跟我们日常生活中做菜一样,讲究的是火候、调料和比例,只有把这三点把握好了,才能做出美味可口的佳肴。
同样地,等效平衡原理及规律总结也是这样一门学问,它告诉我们如何在化学反应中保持平衡,从而让我们更好地理解这个世界。
咱们来聊聊什么是等效平衡。
简单来说,就是在一个封闭的系统里,各种物质之间的相互作用达到了一种稳定的状态。
这种状态就像我们生活中的平衡木一样,虽然摇摇晃晃,但总能保持在一条直线上。
那么,如何才能让这些物质保持平衡呢?这就需要用到等效平衡原理了。
等效平衡原理告诉我们,在化学反应中,只要各个物质的浓度不变,那么整个系统就会保持平衡。
这就像是我们在玩捉迷藏时,只要大家不被发现,游戏就能继续进行下去。
这并不是说只要浓度不变就万事大吉了。
我们还需要关注反应物和生成物之间的转化率,以及反应速率等因素。
只有这些因素都考虑到了,我们才能真正掌握等效平衡原理。
接下来,咱们来聊聊等效平衡规律。
在化学反应中,有些物质的浓度变化比较快,而有些物质的变化速度相对较慢。
这就像是我们生活中的“急性子”和“慢性子”一样,有些人做事雷厉风行,有些人则拖拖拉拉。
在等效平衡中,我们需要关注的是如何调整各个物质的浓度,以便让整个系统尽快达到平衡。
这个过程就像是我们在做饭时,需要不断地加入调料、翻炒和加水。
只有这样,才能让菜肴的味道更加丰富多彩。
同样地,在等效平衡中,我们需要不断地调整反应物和生成物的浓度,以及反应条件,以便让整个化学反应尽快达到平衡。
那么,如何才能更好地掌握等效平衡原理及规律呢?这就需要我们多做实验、多观察、多思考。
就像是我们在学习一门新技能时,需要不断地练习、摸索和总结经验一样。
只有这样,我们才能真正掌握这门学问,成为化学界的大咖。
当然啦,等效平衡原理及规律总结不仅仅是一门科学知识,它还可以应用到我们的日常生活中。
高三《等效平衡》知识点讲解和练习

高三《等效平衡》讲解和练习一、等效平衡1.等效平衡分类:等效平衡分为全同平衡和倍数平衡。
(1) 全同平衡①定义:指相同条件下同一可逆反应从不同途径达到平衡时,各组分的物质的量(或质量)分别相等。
②建立的条件:恒温恒容下气体分子数不等的可逆反应,只能建立全同平衡。
(2) 倍数平衡①定义:指相同条件下同一可逆反应从不同途径达到平衡时,各组分的质量分数、体积分数(气体)或物质的量分数分别相等。
②建立条件:恒温、恒压、反应前后气体分子数不等的可逆反应和恒温下任何反应前后气体分子数相等的可逆反应。
2.等效平衡题的判断方法:“一边法”3.等效平衡题的具体判断方法(1)在一定的温度下,一体积不变的密闭容器中,反应N2+3H2⇌2NH3按下列各途径分别加入各物质,达到平衡时,NH3的物质的浓度与A平衡时NH3的物质的浓度相等的是_______。
N2 + 3H2 ⇌2NH3A 1mol 3mol 0 ——从正反应开始B 0mol 0mol ?mol ——从逆反应开始C 0.5mol 1.5mol 1mol ——从中间态开始D ? mol 2mol ? molE 0.5mol 1.2mol 2.4mol ……——其他中间态(2)在一定的温度下,一体积可变的密闭容器中,反应N2+3H2⇌2NH3按下列各途径分别加入各物质,达到平衡时,NH3的物质的浓度与A平衡时NH3的物质的浓度相等的是_____。
N2 + 3H2 ⇌2NH3A 1mol 3 mol 0mol ——从正反应开始B 2mol 6mol 0mol ——从正反应开始C 0mol 0mol 2mol ——从逆反应开始D 0mol 0mol 4mol ——从逆反应开始E 0.5mol 1.5mol 1mol ——从中间态开始F 2mol 6mol 3mol ——从中间态开始……(3) 特殊情况:对于反应前后气体分子数不变的可逆反应,在恒T恒V(或T恒P)下,只要各物质的量一定,就能建立起全同平衡或倍数平衡。
等效平衡原理、规律及应用完美版

〖目标与要求〗运用对比的方法掌握等效平衡的基本原理规律和计算方法〖内容与要点〗等效平衡原理、规律、例题和习题一、等效平衡原理在一定条件下(定温定容或定温定压),对于同一可逆反应,不管从正反应开始,还是从逆反应开始,只是起始时加入物质的情况不同,而达到平衡时,任何相同组分的含量均相同,这样的化学平衡互称为等效平衡。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
如,常温常压下,可逆反应:2SO2 + O2 2SO2①2mol 1mol 0mol②0mol 0mol 2mol③①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡。
二、等效平衡规律①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比值与原平衡相同,则两平衡等效。
③在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
反之,等效平衡时,物质的量之比与原建立平衡时相同。
三、等效平衡投料方案的设计(1)“站点法”设计恒温恒容下的等效平衡3H2 + N2 2NH3A 4 1 0中途站 B: a b c平衡站 P [] [] []中途站 C: a’ b’ c’终极站 D 0 2显然,从初始到平衡态的过程中,反应要经历中间的许多站点 B、C... 若以此站点值为起始投料方案,都能建立等效平衡.A和D 是达到平衡站点(P)两个极端.A 站点要经正向右移而达到平衡点P; D 站点要经逆向左移而达到平衡点P. 该例中,H2的取值在4mol-1mol之间.从一个站点到另一个站点各物质的变化量之比等于化学方程式计量数之比.如有:(4-a):(1-b): (0+c)=3:1:2 (1+a’): (0+b’):2-c’)=3:1:2 等等.(2) “扩缩法”设计恒温恒压下的等效平衡恒温恒压下,将各物质的量增扩(或减缩)同样倍数都能建立相同的平衡态.因恒压,气体总体积要随之扩大(或缩小)相应的倍数,致使气体浓度没变,平衡没发生移动,所以这样建立的都是等效平衡。
等效平衡教案

等效平衡教案什么是等效平衡?等效平衡是指在一个系统中,各种力量或因素相互作用,最终达到一种平衡状态,使得系统中各个部分的作用力或因素相互抵消,从而保持系统的稳定状态。
在物理学、化学、生物学等领域中,等效平衡都是非常重要的概念。
等效平衡在教学中的应用在教学中,等效平衡也是一种非常重要的教学方法。
通过等效平衡教学,可以使学生在学习过程中更加深入地理解知识点,从而提高学习效果。
等效平衡教学的基本原理等效平衡教学的基本原理是通过将学生的注意力集中在一个或多个关键点上,从而达到平衡的效果。
这些关键点可以是某个概念、某个公式、某个实验结果等等。
通过将学生的注意力集中在这些关键点上,可以使学生更加深入地理解这些知识点,从而提高学习效果。
等效平衡教学的具体实施方法等效平衡教学的具体实施方法包括以下几个方面:1. 突出重点在教学过程中,教师应该突出重点,将学生的注意力集中在重点上。
这些重点可以是某个概念、某个公式、某个实验结果等等。
通过将学生的注意力集中在这些重点上,可以使学生更加深入地理解这些知识点,从而提高学习效果。
2. 强化联系在教学过程中,教师应该强化知识点之间的联系,使学生更加深入地理解知识点之间的关系。
这些联系可以是某个概念与另一个概念之间的联系,也可以是某个公式与实验结果之间的联系等等。
通过强化知识点之间的联系,可以使学生更加深入地理解知识点,从而提高学习效果。
3. 适当重复在教学过程中,教师应该适当重复某些知识点,以加深学生的理解。
这些知识点可以是某个概念、某个公式、某个实验结果等等。
通过适当重复某些知识点,可以使学生更加深入地理解这些知识点,从而提高学习效果。
4. 激发兴趣在教学过程中,教师应该激发学生的兴趣,使学生更加主动地参与到学习中来。
这可以通过讲解生动有趣的例子、引导学生自己发现问题等方式来实现。
通过激发学生的兴趣,可以使学生更加深入地理解知识点,从而提高学习效果。
等效平衡教学的优点等效平衡教学有以下几个优点:1. 提高学习效果等效平衡教学可以使学生更加深入地理解知识点,从而提高学习效果。
等效平衡专题讲座最新版最新版
例题分析
在一定温度下,把2 mol SO2和1 mol O2通入一个一定容积的密 闭容器里,发生如下反应: 2SO2+O2 2SO3 当此反应进行到 一定程度时,反应混合物就处于化学平衡状态。现在该容器中, 维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3 的物质的量(mol)。如果a、b、c取不同的数值,它们必须满 足一定的相互关系,才能保证达到平衡时反应混合物中三种气 体的百分含量仍跟上述平衡时的完全相同。请填写下列空白: (1)若a=0,b=0,则c=___________。 (2)若a=0.5,则b=________2_,c= _________。 (3)a、b、c取值必须满0.足25的一般条件1是.5(用两个方程式表示, 其中一个只含a和c,另一个只含b和c):______,_____。
探究二
等温等容条件下等效平衡的条件 相同物质的起始物质的量之比相等 物质的起始物质的量等于所加物质的物 质的量与反应物或生成物等效的该物质 的物质的量之和。
例题分析
在一定温度下保持压强相等的密闭容器中,充入 1molA、2molB发生A+B 2C+D,达到平衡时 A的含量为w,下列物质组合充入该容器中,A的 含量仍为w的是( BD ) A. 2molC+1molD B. 1molB+2molC+1molD C. 1molA+1molB D. 1molA+4molB+4molC+2molD
总结
等效平衡的条件(xA+yB pC+qD) A、x+y≠ p+q 等温等容:相同起始物质的物质的量相等 等温等压:相同起始物质的物质的量之比相等 B、x+y = p+q 相同起始物质的物质的量之比相等
等效平衡说课稿

等效平衡说课稿一、教学目标本节课的教学目标是使学生能够理解和运用等效平衡的概念,掌握等效平衡的计算方法,并能够应用等效平衡解决实际问题。
二、教学重点和难点本节课的教学重点是让学生掌握等效平衡的概念和计算方法,教学难点是如何运用等效平衡解决实际问题。
三、教学过程1. 导入(5分钟)通过一个生活中的例子引入等效平衡的概念,如一个人站在两个杠杆上,如何调整杠杆的长度使得能够保持平衡。
2. 概念讲解(10分钟)解释等效平衡的概念,即通过调整物体的位置或质量分布,使得物体在重力作用下保持平衡的状态。
引入等效平衡的计算公式:力矩=力的大小 ×力臂。
3. 计算方法讲解(15分钟)详细讲解等效平衡的计算方法,包括力的大小和力臂的计算。
通过多个实例演示如何计算等效平衡,如一个悬挂在杆上的物体,如何调整杆的位置使得物体保持平衡。
4. 实例练习(20分钟)给学生提供一些实例练习,让他们运用所学的等效平衡的计算方法解决问题。
例如,一个悬挂在绳子上的物体,如何调整绳子的角度使得物体保持平衡。
5. 拓展应用(15分钟)引导学生思考等效平衡的应用领域,如建筑物的平衡设计、机械装置的平衡调整等。
通过展示一些实际案例,让学生理解等效平衡在工程领域的重要性。
6. 归纳总结(10分钟)总结等效平衡的概念、计算方法和应用领域。
强调学生在实际生活中要注意平衡的原理和方法。
四、教学手段和教学资源教学手段主要包括讲解、示范、实例演示和讨论等。
教学资源包括教科书、黑板、投影仪等。
五、教学评价通过学生的课堂表现、小组讨论和实例练习的答题情况来评价学生的学习情况。
同时,教师还可以设计一些开放性问题,考察学生对等效平衡的理解和应用能力。
六、教学延伸可以引导学生进行更复杂的等效平衡计算和实际应用的探究,如建筑物的平衡设计原理和方法的研究。
七、教学反思本节课通过生动的例子和实例练习,使学生能够深入理解等效平衡的概念和计算方法。
同时,通过拓展应用的环节,让学生了解等效平衡在实际工程中的重要性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十一讲等效平衡和平衡的应用拓展(一)一.平衡移动原理1.平衡移动原理,又叫原理。
如果改变的一个条件,平衡就朝能够方向移动。
2.减弱不是抵消。
如某容器中盛有NO2和N2O4的混合气体,若容器体积突然增大为原来的两倍,混合气体的颜色变化情况:气体颜色突然变(深,浅),然后慢慢(深,浅),但比原来(深,浅),NO2浓度(大,小,等)于原来的一半。
若容器体积突然缩小为原来的一半,混合气体的颜色变化情况:气体颜色突然变(深,浅),然后慢慢(深,浅),但比原来(深,浅),NO2浓度(大,小,等)原来的两倍。
3.判断下列情况平衡的移动方向2SO 2(g)+O2(g)2SO3(g); △H=-196.6 kJ/ mol在一定条件下达到平衡A.若在定容积下,充入稀有气体,平衡移动。
若定压强下,充入稀有气体,平衡移动。
B.若在定容积下,将平衡时各组分的浓度减半,平衡移动。
若在定压条件下,将平衡时各组分的物质的量减半,平衡移动。
C.若将容器体积压缩到原来的1/2,平衡向移动,C(SO2)比原来的2倍(大,小,等)。
二.转化率①.平衡移动,转化率(一定,不一定)变,反应物的转化率变,平衡(一定,不一定)移动。
②.反应物的总量保持不变,若平衡正向移动,每种反应物的转化率。
(增大,减少,不变)③.恒温恒容条件下的平衡,增加反应物的量。
A.mA(g)pC(g)+qD(g),增加A的物质的量,平衡移动。
(增大,减少,不变)若m=p+q,a(A)(增大,减少,不变)若m>p+q,a(A)(增大,减少,不变)若m<p+q,a(A)B.mA(g)+nB(g) pC(g)+qD(g)a.增加n(A),平衡向移动,a(A)(增大,减少,不变)a(B. (增大,减少,不变)b.按平衡时各组分的物质的量同倍数的增加,平衡移动。
若m=p+q,a(增大,减少,不变)(A)(增大,减少,不变)若m>p+q,a(A)(增大,减少,不变)若m<p+q,a(A)c.若按反应物的起始量,同倍数的增加,平衡移动。
(增大,减少,不变)若m=p+q,a(A)若m>p+q,a(增大,减少,不变)(A)(增大,减少,不变)若m<p+q,a(A)跟踪练习:(一)可逆反应: 3A (g )3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势, 则下列判断正确的是( ) A .B 和C 可能都是固体 B .B 和C 一定都是气体C .若C 为固体,则B 一定是气体D .B 和C 可能都是气体(二):在密闭容器中发生如下反应:a X(g)+b Y(g) c Z(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的21,当再次达平衡时,W 的浓度为原平衡时的1.8倍.下列叙述中不正确...的是 A .平衡向逆反应方向移动 B .a +b <c +d C .z 的体积分数增加 D .X 的转化率下降(三):有2 mol SO 2和1mol O 2在一定条件下发生反应:2SO 2+O 22SO 3并达到达到平衡状态,平衡时, n(SO 2)= 1mol, n(O 2)=0.5mol, n(SO 3)= 1mol.比较下列情况的转化率. ①.增加n(SO 2), a(SO 2) . a(O 2) ②.加压或降温, a(O 2)演译变换I:若该反应在恒温恒容条件下进行①.增加n(SO 3),平衡向 移动,a(SO 2) .②.若平衡体系中再加2 mol SO 2和1mol O 2,平衡向 移动, a(SO 2) . a(O 2) ③.若平衡体系中再加n(SO 2)= 1mol, n(O 2)=0.5mol, n(SO 3)= 1mol. a(SO 2) . a(O 2) ④.若在平衡体系中移走n(SO 2)= 0.5mol, n(O 2)=0.25mol, n(SO 3)= 0.5mol. a(SO 2) . a(O 2) 演译变换II:若该反应在恒温恒压条件下进行①.若平衡体系中再加2 mol SO 2和1mol O 2, a(SO 2) . a(O 2)②.若在平衡体系中移走n(SO 2)= 0.5mol, n(O 2)=0.25mol, n(SO 3)= 0.5mol. a(SO 2) . a(O 2)③.若平衡体系中再加n(SO 2)= 1mol, n(O 2)=0.5mol, n(SO 3)= 1mol. a(SO 2) . a(O 2) ④. 增加n(SO 3),a(SO 2) .演译变换III:①.若2 mol SO 2和1mol O 2在恒温恒容条件下进行, a(SO 2)= m ,在恒温恒压条件下进行a(SO 2)= n,比较m n②.若2 mol SO 2和1mol O 2在恒温恒容条件下进行, 达到平衡时,a(SO 2)= m, 若2 mol SO 3在恒温恒容条件下进行, 达到平衡时,a(SO 3)= n,则m 和n 的关系为 (四):某温度下在密闭容器中发生如下反应:)()(2g N g M 2E (g ), 若开始时只充入2mol E (g ),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M 和1mol N 的混合气体达平衡时M 的转化率为( )A .20%B .40%C .60%D .80%第十一讲 等效平衡和平衡的应用拓展(二)三. 等效平衡1. 等效平衡原理在相同条件下,同一可逆反应体系,无论是从正反应开始,还是从逆反应开始,只要按化学反应方程式中的化学计量数之比投入反应物或生成物,建立的平衡都是相同的(各组分浓度相同或各组分物质的量分数相同) 2. 等效平衡规律例题(一):在一定温度下,把2mol SO 2和1mol O 2通入一个一定容积的密闭容器里,发生如下反应:2SO2 +O 22 SO 3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a 、b 、c 分别代表初始加入的SO 2、O 2和SO 3的物质的量(mol )。
如a 、b 、c 取不同的数值,它们必须满足一定的相互关系,才能保持达到平衡时,反应混合物中三种气体的体积分数仍和上述平衡时的完全相同。
请填写下列空白: ⑴若a=0,b=0,则c= _____________。
⑵若a=0.5,则b= _________ 和c= __________。
⑶a 、b 、c 必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c ,另一个只含b 和c ): __________________________________________________。
(4)若将题目中的定容变为定压,(1)(2)(3)的答案如何变化?例题(二):在一个固定容积的密闭容器中,保持一定的温度进行以下反应:)g (Br )g (H 2 )g (HBr 2。
已知加入1mol H 2和2mol Br 2时,达到平衡后生成a mol HBr(见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写下表中的空白。
跟综训练:在一个盛有催化剂容积可变的密闭容器中,保持一定温度和压强,进行以下反应:N 2+3H 22NH 3。
已知加入1mol N 2和4mol H 2时,达到平衡后生成a mol NH 3(见下表已知项)。
在相同温度、压强下,保持平衡时各组分的体积分数不变。
对下列编号①~③的状态,填写表中空白。
例题(三):在一个固定容积的密闭容器中,加入2molA 和1molB ,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时C 的浓度为cmol/L ,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时C 的浓度仍为cmol/L 的是( ),大于cmol/L 的是( ),小于cmol/L 的是( ).A. 4molA+2molBB.1molA+0.5molB+1.5molC+1molDC. 2molC+1molD+1molBD.3molC+1molDE. 3molC+1molD+1molBF. 1molA+0.5molB 思考:已知:mA(g)+nB(g)PC(g)+qD(g)达到平衡状态时, n(A):n(B):n(C):n(D)= x:y:k:w. ①.若为定容定温条件,再按x:y:k:w 加入等量的A,B,C,D,则A,B,C,D 的浓度如何变化?A,B 的转化率如何变化?②.若将原容器体积缩小一半,则A,B,C,D 的浓度如何变化?A,B 的转化率如何变化? ③.若将原容器体积变为原来的2倍,则A,B,C,D 的浓度如何变化?A,B 的转化率如何变化? 热身练习:在一密闭容器中,a A(g)b B(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B 的浓度是原来的60%,则( ) A .平衡向逆反应方向移动了 B .物质A 的转化率减小了 C .物质B 的质量分数增大了 D .a >b已知编号起始状态物质的量 n /mol 平衡时NH 3的物质的量 n /molN 2H 2NH 314 0 a ① 1.56 0 ② 1 0.5a ③mg (g ≥4m )第十一讲等效平衡和平衡的应用拓展(三)四.化学平衡有关图象方法与思路:一看清横坐标和纵坐标,二看线的走向、变化的趋势,三看线是否通过原点,两条线的交点及线的拐点,四看要不要作辅助线等温线、等压线,五看定量图象中有关量的多少。
先拐先平,定一议二是常用的两种方法。
(一)外界条件对反应速率的影响及其图象平衡正向移动的图象有,逆向移动的图象有,不移动的图象有. 可能是由什么原因引起的平衡移动?(二)对于反应mA(g)+nB(g)pC(g)+qD(g) △H各种情况下的图象1.转化率-时间关系图:P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q T一定时,m+n p+q2.含量-时间关系图:P一定时,△H 0 P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q3.转化率-温度-压强关系图:m+n >p+q 时,△H 0 m+n <p+q 时,△H 04.含量-温度-压强关系图:m+n >p+q 时,△H 0 m+n <p+q 时,△H 0m+n >p+q 时,△H 0 m+n >p+q 时,△H 0 跟踪练习(一):条件一定时,反应2NO(g)+O2(g)2NO 2(g) △H <0中NO 的百分含量NO%与T 变化关系曲线图,图中有a 、b 、c 、d 四个点,其中表示未达到平衡状态,且v正<v逆的点是( )A. aB. bC. cD. d 跟踪练习(二):mA(s)+nB(g)qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B 的体积分数(B%)与压强(p )的关系如图6所示,有关叙述正确的是( )。
