有机化学第二版第十章醛和酮
有机化学复习-醛和酮

• Meerwein-Ponndorf 还原
(i-PrO)3Al / i-PrOH
• 金属还原:Na, Li, Mg, Zn
2.1 催化氢化还原
OO R'(H) RR CC R'(H) Pt Pt H2 H(0.3MPa) 2 (0.3MPa) OH OH RR CH CH R'(H) R'(H)
醛和酮
一. 醛酮的命名 系统命名:主链,含羰基最长碳链;编号,靠近羰基一端
二、醛酮的物理性质和光谱性质
一、物理性质
沸点:比分子量相近的烃和醚高,比相应的醇低。(极性) 水溶性:低级的醛、酮能和水混溶。 (分子间氢键) 相对密度:脂肪族醛酮小于1,芳香族醛酮大于1。
二、 光谱性质
红外光谱: C=O 1750~1680cm-1 强吸收;当羰基与双键共轭,吸收向低频方向位
2, 4-二硝基苯肼
2, 4-二硝基苯腙(黄色固体)
总结: C=O + H2N-Y → C=N-Y + H2O
醛酮的鉴别或鉴定
1.7 Wittig反应
(1) 磷 Ylide —— Wittig试剂
Ph3P
+ R2CH
X
SN2
Ph3P
CR2X H
-HB
Ph3P
CR2
Ph3P
CR2
(2) Wittig 反应 R' R' R' R'
OO O CC C
MgX MgX MgX MgX O O O MgX MgX
C C C R RR R R R
OMgX OMgX OMgX OMgX OMgX OMgX
CC C CC
C C R RR
有机化学 第十章 酮和醛 名词解释

第十章酮和醛1.醛:羰基分别与一个烃基和一个氢相连的化合物。
2.酮:羰基与两个烃基直接相连的化合物。
3.酰基:4.单箭头表示均裂,双箭头表示异裂。
5.脂肪族醛、酮亲核加成反应活性次序:6.增长碳链的反应:酮和醛:与氢氰酸加成、与格式试剂反应、与炔金属化合物反应。
7.羟醛缩合:两分子含有α-氢的醛在酸或碱的催化下(最常用的是稀碱),相互结合形成β-羟基醛的反应。
(反应可逆)8.克莱森-施密特反应:芳香醛与含有α-氢的脂肪醛/酮进行交叉羟醛缩合反应生成α,β-不饱和醛/酮的反应。
9.卤代反应:醛/酮在酸或碱催化下,与卤素反应α-氢被卤代(溶剂:四氯化碳、水、醋酸、酸酐、醇)。
10.制备少一个碳的羧酸:卤仿反应。
11.曼尼希反应:含有α-活泼氢的酮与甲醛及胺反应,可以在酮的α为引入一个氨甲基,这个反应也称为氨甲基化反应。
12.制备α、β-不饱和酮:曼尼希反应、克莱森-施密特反应、羟醛缩合。
13.过氧酸氧化反应:酮在酸催化下与过氧酸作用生成酯的反应。
(过氧酸:过氧乙酸、过氧三氟乙酸、过氧苯甲酸、过氧间氯苯甲酸等)14.康尼扎罗反应:无α-H的醛在浓碱作用下可在两分子间发生反应,一分子醛被还原成醇,另一分子醛被氧化成酸。
(也称歧化反应)15.维悌希反应:醛、酮与磷叶立德反应生成烯烃。
(磷叶立德试剂也称为维悌希试剂)。
16.安息香缩合反应:芳醛在氰基负离子催化下,生成α-羟基酮的反应。
(最简单的芳香α-羟基酮称为安息香)。
17.盖特曼-可赫反应:在催化剂(无水三氯化铝和氯化亚铜)存在下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。
18.在乙醛分子的羰基与甲基这几间插入一个或者多个乙烯基,原来的甲基和醛基间的相互影响依旧存在。
19.迈克尔加成:α,β-不饱和醛/酮和碳负离子发生1,4-共轭加成反应。
20.狄尔斯-阿尔德反应:共轭双烯与含有烯键或炔键的化合物反应生成六元环状化合物的反应。
21.制备乙酰乙酸乙酯:烯酮与乙醇反应。
有机化学第二版-高占先著-第十章课后答案
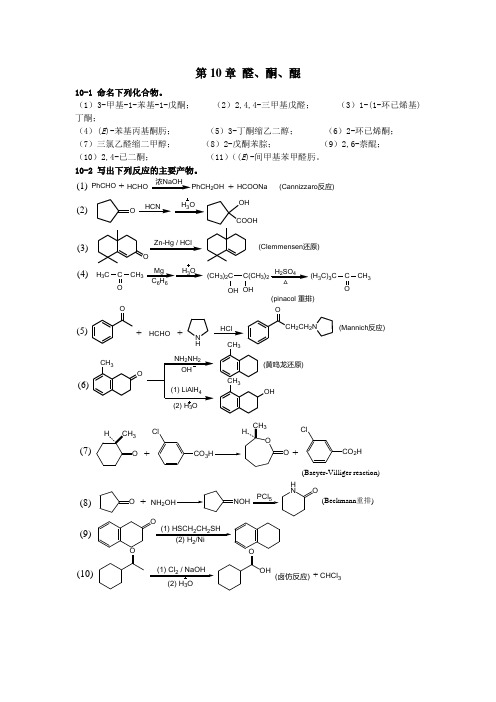
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮;(4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg 66H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O(1) Cl 2 / NaOH 3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr +Ph 3(1) CuCl 3(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 22CH 3CH 3CH 23OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
有机化学第十章醛和酮详解演示文稿

H(R)
2. H2O
ONa R C SO3H
H(R)
NaHSO3
HCN / NaOH OH
R C CN H(R)
第二十三页,共74页。
1. 醛酮羰基上的亲核加成反应(2)
分析:分子型亲核试剂的特点及与醛酮的加成
•特点分析
H Nu
水、醇、胺
•预测:直接与羰基加成
H OH H OR H NHR H NR2
▪ 醛酮与胺类化合物的加成——生成亚胺和烯胺
▪
第二十二页,共74页。
一. 醛酮的性质(II)
复习:醛酮与负离子型亲核试剂的加成
OH
R C CCR
OH RC R
H(R)
(R)H 1. M C C R
OH
1. RMgX 2. H2O
2. H2O
RC H
1. LiAlH4
H(R)
O
or NaBH4
C
R
第六页,共74页。
CrO3 Pyridine
Sarrett 试剂
RCH O
CrO3 Pyridine
Sarrett 试剂
CrO3 / H2SO4 Jones 试剂 O
Al[OC(CH3)3]3 / CH3CCH3
Oppenauer 氧化
O R C R'
• 氧化烯烃
R1
C R2
R3 C
H
(1) O3 (2) Zn / H2O
R''
1o醇 2o醇 3o醇
2.2 醛酮与炔化物的加成
O
M C C R(H)
H2O
C
M = Na, K, MgX等
OH C C C R(H)
有机化学--醛和酮

羰基等吸电子基团活化-氢的能力有以下次序: CHO COPh COR CN COX CO2R CO2H
问题:薄荷酮、孟烷酮和异孟烷酮是三个具有光学活性的天然化合物:
O
O
O
(-)-薄荷酮
孟烷酮
异孟烷酮
试对以下现象提出合理的解释:
(1)在乙醇钠的乙醇溶液中放置一段时间,光学纯的 薄荷酮([]D = -32o)会变成消旋的薄荷酮([]D = 0)。
(2)用90%的硫酸处理,孟烷酮转变为孟烷酮和异孟 烷酮的混合物。
2、-卤化反应
O
X2
R CH3
O R CH2X
(X = Cl, Br或I)
酸催化过程:
O
H+
C R CH3
O+H
-H-
C
R CH2
H
+
OH
XX
OH X-
C
C
R CH2
R CH2 X
O
C
+ HX
R CH2 X
O
Br2 AcOH, H2O, 70oC
醛和酮
➢ 醛酮的命名,结构、物理性质 ➢ 醛酮的制备 ➢ 醛酮的反应
O C RH
醛
O C R R'
酮
O C R OH
羧酸
O C R OR'
酯
O C R NH2
酰胺
羰基 Carbonyl group 醛 Aldehydes 酮 Ketones
O C RX
酰卤
亲核加成 氢化还原
R (H)R'
C O
4-氧代戊醛
O
(R)-Carvone (R)-香芹酮
薄荷味
有机化学-第十章

10.2 醛酮的化学性质
如果利用NaHSO3与羰基化合物加成的可逆性,将 NaCN 与 α-羟基磺酸钠作用,使生成的 HCN 与分解出的羰基化合 物加成生成α-羟基腈,这样也可避免 HCN 的直接使用。 例如:
10.2 醛酮的化学性质
醛、酮与碳负离子的加成
Grignard 试剂,炔钠,Wittig试剂等,都含有碳负离子, 它们与羰基化合物的反应活性很高,有机合成上有广泛的 应用。
10.2 醛酮的化学性质
一、与氨、伯胺的反应
脂肪族醛、酮与氨、伯胺的反应可生成亚胺,也称为席夫 碱(Schiff base):
10.2 醛酮的化学性质
脂肪族醛、酮生成的亚胺中含的C=N双键在反应条件下不 是很稳定的,它易于发生进一步的聚合反应。芳香族的醛、 酮与伯胺反应生成的亚胺则比较稳定。
10.1 醛酮的结构及分类
在醛、酮分子中,羰基碳原子是以sp2 杂化状态与其它三 个原子构成键的,羰基碳原子的P轨道与氧原子上的P轨道 以相互平行的方式侧面重叠形成π键,即羰基是一个平面 构型的; 与羰基碳原子直接相连的其它三个原子处于同一平面内, 相互间的键角约为120度,而π键是垂直于这个平面的。
> > >
>
>
>
>
10.2 醛酮的化学性质
一、与水的加成
甲醛、乙醛、丙酮等小分子羰基化合物在水中的溶解性非 常好,这不仅是它们与水分子之间可以形成氢键,还在于 它们可以与水分子发生加成反应,生成了水合物; 这种水合物只有在水溶液中在一定浓度范围、一定的温度 下才是比较稳定的,游离的羰基水合物(同碳二元醇)是 极不稳定的,它将迅速脱水成为羰基化合物。
有机化学中的醛与酮的还原反应

有机化学中的醛与酮的还原反应有机化学是研究碳元素及其化合物的学科,其中醛与酮是有机化合物中常见的官能团。
在有机合成中,还原反应是一种重要的反应类型,可以将醛与酮还原为对应的醇。
本文将重点介绍有机化学中的醛与酮的还原反应以及对应的反应机理。
I. 醛的还原反应醛是含有羰基(C=O)官能团的有机化合物,常用通式为RCHO。
醛的还原反应是指将醛转化为相应的醇化合物。
常见的还原剂有氢气(H2)、金属还原剂(如铝铵)、氢化钠(NaBH4)和氢化铝锂(LiAlH4)等。
1. 氢气还原氢气还原是醛与氢气在催化剂存在下进行的一种化学反应。
常用的催化剂有镍(Ni)和铂(Pt)等贵金属催化剂。
醛在加氢条件下形成醇的过程如下所示:RCHO + H2 → RCH2OH此反应通常在高压和高温条件下进行,并且需要催化剂的存在。
氢气还原适用于对烯醛和环状醛的还原反应。
2. 氢化钠还原氢化钠(NaBH4)是一种常用的选择性还原试剂,适用于将醛还原为醇。
氢化钠在水或醇溶液中存在时,会产生邻硼酸盐(NaB(OH)4)及其还原活性的官能团BH4-,可以与醛发生反应。
醛的氢化钠还原反应如下所示:RCHO + NaBH4 → RCH2OH + NaB(OH)4氢化钠还原通常在室温下进行,并且具有选择性,不会影响其他官能团的存在。
3. 氢化铝锂还原氢化铝锂(LiAlH4)是一种强还原剂,适用于对各类酮和醛进行还原反应。
氢化铝锂可以将醛与酮直接还原为相应的醇化合物。
醛的氢化铝锂还原反应如下所示:RCHO + LiAlH4 → RCH2OH + LiAlO2氢化铝锂还原反应要求在无水环境下进行,因为它非常易于与水反应,产生剧烈的放热。
II. 酮的还原反应酮是官能团为C=O的有机化合物,通式为R1COR2。
酮的还原反应是指将酮转化为相应的醇化合物。
与醛的还原反应类似,常用的还原剂包括氢气、金属还原剂和氢化钠等。
1. 氢气还原酮的氢气还原与醛类似,在催化剂(如Ni和Pt)存在下,酮可以与氢气反应生成相应的醇。
有机化学第十章习题醛酮课后习题答案
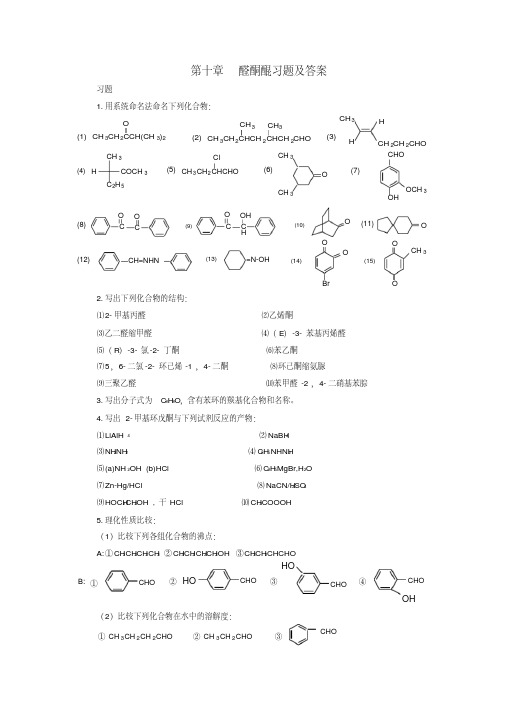
第十章醛酮醌习题及答案习题1.用系统命名法命名下列化合物:CH 3CH 2CCH(CH 3)2O(1)(2)(3)CH 3CH 2CHCH 2CHCH 2CHOCH 3CH 3CH 3HHCH 2CH 2CHO(4)(5)CH 3C 2H 5COCH 3HCH 3CH 2CHCHOCl(6)OCH 3CH 3(7)CHOOHOCH 3(11)(8)(9)(10)CO CO COC HOH OO (12)(13)(14)(15)CH=NHN=N-OHOOBr OOCH 32.写出下列化合物的结构:⑴2-甲基丙醛⑵乙烯酮⑶乙二醛缩甲醛⑷(E )-3-苯基丙烯醛⑸(R )-3-氯-2-丁酮⑹苯乙酮⑺5,6-二氯-2-环己烯-1,4-二酮⑻环己酮缩氨脲⑼三聚乙醛⑽苯甲醛-2,4-二硝基苯腙3.写出分子式为C 8H 8O ,含有苯环的羰基化合物和名称。
4.写出2-甲基环戊酮与下列试剂反应的产物:⑴LiAlH4⑵NaBH 4⑶NH2NH 2⑷C6H 5NHNH 2⑸(a)NH 2OH (b)HCl ⑹C 2H 5MgBr,H 2O ⑺Zn-Hg/HCl ⑻NaCN/H 2SO 4⑼HOCH 2CH 2OH ,干HCl ⑽CH 3COOOH5.理化性质比较:(1)比较下列各组化合物的沸点:A:①CH 3CH 2CH 2CH 3 ②CH 3CH 2CH 2CH 2OH ③CH 3CH 2CHCHOOH③①CHO②CHOHOCHOHOCHO④B:(2)比较下列化合物在水中的溶解度:① CH 3CH 2CH 2CHO ② CH 3CH 2CHOCHO③(3)比较下列化合物与HCN 加成反应的活性:③①②④CH 3CHOC 6H 5COCH3CH 3COCH3C 6H 5CC 6H 5O(4)比较下列化合物与NaHSO 3加成反应的活性:HOOO③①②(5)比较下列化合物的稳定性:③①②④OHOOO(6)比较下列负离子的稳定性:③①②OOOOOCH 3(7)比较下列化合物pka 的大小:③①②④CH 3CHO C 6H 5COCH3CH 3COCH3C 6H 5CC 6H 5O6.完成下列反应:⑴HCN OH -CH 3CH 2COCH 3?稀H 2SO 4?⑵OH -NaHSO 3CH 3COCH 3H 2O⑶CH 3-C-CH 2CH 3OCH 3MgBr H 2O,⑷CH 3CHO Br 2 / FeH 2O / H+Mg 无水乙醚?⑸O+CHCNaH 3O +⑹NH 2OHHCl?C 6H 5CCH 3OOCH 3(C 6H 5)3P=CHCH3⑺+⑻H 2O,HAcO(1mol) Br 2C CH 3CH 3C-CH 3I 2NaOH⑼CH 3OH 3O +CH 3O⑽NaBH 4COONaOH,H 2OCH 3-C-CH 3⑾?+CH 3OCOHO ⑿(CH 3)2NHHCl?O+HCHO +⒀NaCN / EtOH / H2OOCHO ClCH 2COOC 2H 5NaOC(CH 3)3⒁+OMe 2CuLi?+O⒂⒃AlCl 3-CuC 2l 2CH 3++COHCl浓NaOH+?⒄CH 3ICH 3COOOHH 3O +?N⒅CH 3-C-CH 2CH 2BrOOHOH干 HClH 2O / H +Mg 干醚O?⒆+(CH 3CH 2-C)2OOOCHOCH 3CH 2-C-OKO⒇COCH 3AlCl3+O-C-CH 3O OH7.下列化合物:(1)CH 3CHO (2)CH 3CH 2COCH 2CH 3(3)(CH 3)2CHOH (4)O(5) (CH 3)2CHCHO (6) C 6H 5CHO (7) C 6H 5COCH 3(8)CHO能够发生碘仿反应的有?能与亚硫酸氢钠反应的有?能与甲醛发生交叉Cannizzaro 反应的有?能够与Tollens 试剂反应的有?能够与Fehling 试剂反应的有?8.鉴别下列各组化合物:(1)CH 3COCH 2CH 3A.CH 3CH 2CH 2CHOB. C.CH 3CHCH 2CH 3OHD.CH 3CH 2CH 2CH 2OH(2)A.CHOCOCH 3B.C.CH=CH 2 D.C CH(3)A.正戊醛 B.苯甲醛戊酮戊酮戊醇戊醇(4) A.B.OHOHC.CHOD.O9.解释下列反应的机理:(1):H-C-CH 2CH 2CH 2-CH-C-HOOCH 3稀 OH -CH 3CHO(2):OHORRH 3O +RR(3):二苯基乙二酮在NaOH 的作用下发生重排,生成二苯基羟乙酸钠,酸化后得到二苯基羟乙酸,如果用CH 3ONa代替NaOH ,则可以得到二苯基羟乙酸甲酯。
有机化学第10章 醛和酮

Witting反应是在醛酮基碳所在处形成碳碳双键的一个重要方法,产物中 没有双键位置不同的异构体。反应条件温和,产率也较好,但产物双键 的构型较难控制。 Witting也因该工作而与Brown H C共享了1979年的诺 贝尔化学奖。 另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
补充: 醛、酮与炔化钠的加成
R-CC-Na+ NaNH2 (-NH3) R-CCH +
C=O
NH3(液) 或乙醚
C C ONa CR H O 2
• 醛和脂肪族甲基酮(或七元环以下的环酮)与之反应,生成
• -羟基磺酸钠
白色
过量
在酸碱下可逆反应,分离提纯
-羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可被氰基取代, 生成 -羟基腈,避免用有毒的氰化氢,产率也比较高。
3、与醇的加成
*1 反应情况介绍 ① 与醛反应 CH3CH=O + CH3CH2OH
(hydrazine)
C 6H 5 H C O + H2NNH O2 N NO2
(hydrazone)
C 6H 5 H C NNH O 2N NO2 + H 2O
2,4–二硝基苯肼
O O + H2NNHCNH2
2,4–二硝基苯腙
O NNHCNH2 + H2O
氨基脲
(semicarbazine)
缩氨基脲 (半卡巴腙)
有机化学第二版第十章习题答案
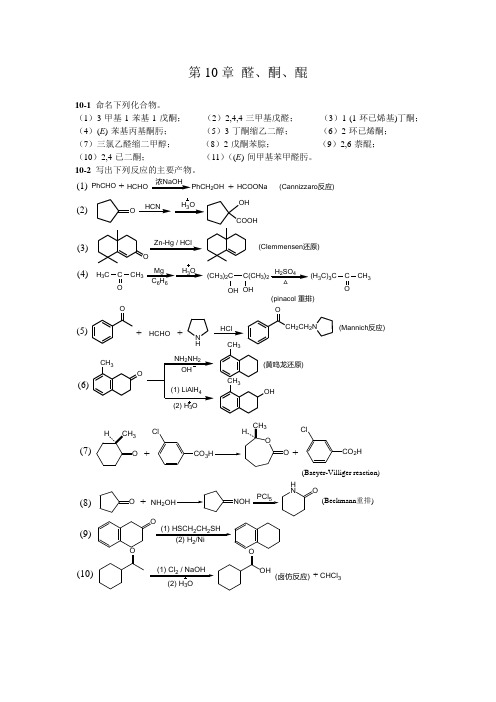
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮; (4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg C 6H 6H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr+Ph 33(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCOO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)COCH 3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 2CCH 2CH 3CH 3CH 2CHCH 3OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
有机化学:第十章 醛 酮(1)
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
《有机化学》第十章 醛酮的结构与性质

第十章醛酮的结构与性质引言醛酮分之中都会含有羰基( ),羰基中碳原子是sp2杂化的,三个杂化轨道形成三个δ键,其中一个是和氯形成的δ键。
这三个键在同一平面上,彼此间理论键角为120°,但由于三个键所连基团不同,相互作用有差别,因此键角和理论值略有出入。
碳原子和剩下的一个轨道和氧原子的轨道重叠形成Л键,因此羰基是由一个δ键和一个Л键所组成的碳氧双键,如图:图10.1羰基的结构及其电子云示意图羰基中碳氧双键与烯烃中碳碳双键不同,是极性的双键(由于氯原子的电负性比碳大),成键电子云密度在氧原子处较高,氧原子带部分负电荷(δ-),而碳原子处电子云分布较低,因而带部分正电荷(δ+)。
极性碳氧双键易受到带负电荷或孤对电子的试剂(即亲核试剂)的进攻,发生亲核加成反应,这是羰酮经典的反应之一。
羰基是极性基团具有较强的吸电子诱导反应,因而羰基的α-H具有一定的“酸性”,在碱性条件下离去后形成碳负离子,作为亲核试剂与另一分子的醛(或酮)发生醇醛缩合(或醇酮缩合)反应。
另外醇酮的羰基易发生氧化还原反应。
10.1 亲核加成反应醛酮的亲核加成反应是其经典的反应之一,可用下列通式表示:在反应过程中,首先是试剂的亲核部分(Nu-)向羰基碳进攻,形成负氧离子,再与带正电荷的亲电部分(A+)结合。
影响亲核加成速度主要是电子效应和空间效应。
羰基碳原子的正电性的高低决定反应速度的快慢,吸电子取代基加快反应进程,供电子取代基减慢反应进程。
由于在决定反应速度的步骤中碳原子由于sp2杂化转变为sp3杂化,键角变小,基团的排斥作用增强,因此羰基所连的基团的大小也对反应速度产生影响。
基团越大,空间位阻越大,反应速度越慢。
下列醛酮的亲核加成反应活性由强到弱的顺序为:(1)(2)10.1.1含氧亲核试剂的加成反应1.与水的加成反应水和醇都是含氧的亲核试剂。
在一定的条件下水可与醛酮的羰基加成形成水合物,但是水合物极不稳定,很易失水:(平衡主要偏向反应物方向)只有活性较强的醛的水合物较稳定,如甲醛在水溶液中几乎全部以水合物形式存在,但不能分裂,而三氯乙醛的水合物其吸收光谱图表明不含羰基:水合氯醛2.与醇的加成反应:在干燥的HCl作用下,醛与等摩尔的醇亲核加成生成半缩醛,半缩醛可与另一摩尔的醇发生反应,生成缩醛:半缩醛缩醛缩醛对碱和氧化剂都很稳定,在有机合成中常用此反应来保护醛酮。
有机化学中的醛与酮

有机化学中的醛与酮有机化学是研究碳及其化合物的科学,而醛与酮是有机化学中的两种重要官能团。
它们在生物体内和化工生产中扮演着不可或缺的角色。
本文将从醛和酮的结构、性质以及应用等方面进行探讨。
1. 醛的结构与性质醛是一类碳链中含有C=O(碳氧双键)官能团的有机化合物。
其通用结构可以表示为RCHO,其中R代表烃基或芳香基。
醛分子中的碳氧双键赋予了其一些独特的性质。
(1)氧化还原性:醛能够与氧化剂反应形成相应的羧酸,同时也能够被还原为醇类。
(2)亲核加成反应性:醛的碳氧双键上的部分电子云较为富集,因此醛具有与亲核试剂(如胺、酚等)发生加成反应的能力。
(3)醛反应的选择性:由于醛的邻位没有可以供电子给碳氧双键的基团,醛的反应往往具有较高的选择性。
2. 酮的结构与性质酮也是一类具有C=O官能团的有机化合物,其通用结构可以表示为R₂CO,其中R代表烃基或芳香基。
与醛相比,酮分子中的碳氧双键位于碳链的内部。
(1)稳定性:由于酮分子中的碳氧双键位于碳链的内部,其比醛的碳氧双键不容易发生亲核加成反应,因此酮相对来说比较稳定。
(2)亲核取代反应性:酮的碳氧双键上的电子云较为分散,因而酮分子具有一定的亲核取代反应活性。
3. 醛与酮的应用由于醛与酮具有较为特殊的结构与性质,它们在很多领域有重要的应用。
(1)生物化学中的应用:醛与酮是生物体内代谢产物的重要组成部分,在葡萄糖新陈代谢和脂肪酸合成等生化过程中发挥着关键作用。
(2)有机合成中的应用:醛和酮是合成其他有机分子的重要中间体。
它们通过与其他试剂反应,可以得到醇、醚、酸等不同类型的有机化合物。
(3)药物和香料工业中的应用:许多药物和香料化合物中都含有醛或酮官能团,因此对醛和酮的研究和合成对于药物和香料工业有重要的意义。
总结:醛与酮是有机化学中研究的重要内容之一。
从它们的结构、性质到应用领域,都展示了它们在化学和生物学中的重要地位。
随着有机化学的不断发展,对醛与酮的研究将会越来越深入,为我们理解有机物质的特性与功能提供更多的支持与指导。
有机化学第10章醛、酮及亲核加成反应

CH3
CH3 OC2H5
C
+
CH3 OC2H5
O HCOC2H5
O MeC
HOCH2CH2OH
CO2H
H+,
O O
Me
O O
Me
CH2OH
H2O HCl
O MeC
CO2H
1. LiAlH4 2. H2O
CH2OH
二、与亚硫酸氢钠的加成
醛或活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮) 在室温下与过量的饱和亚硫酸氢钠(40%水溶液)溶液一 起振荡,不需加任何催化剂反应即可生成-羟基磺酸钠 盐.
第一节 醛、酮的结构与物理性质
醛、酮的分子中都含有羰基(>C=O)
O R
H
醛
-CHO 醛基
O
R
R'
酮
>C=O 酮基
分子中的烃基(R)可以相同也可以不相同。醛、酮分子 中的烃基可以是直链的或是环状的,脂肪的或芳香的。
一、羰基的结构
CO
CO
碳原子SP2杂化轨道与另外三个原子以键结合的,所以这 三个键都处于同一个平面上,键角约为120°。
=O + HNO 3 V2O5 HOOC(CH 2)4COOH
二、坎尼扎罗反应
不含-H的醛在浓碱作用下,一分子醛被氧化成酸, 而另一分子醛则被还原为醇,这是自氧化还原反应,也 叫歧化反应或康尼查罗(Cannizzaro)反应。
Cl
R
C=O
R
> Ph CH3
C=O
> Ph Ph
C=O
一、与醇的加成
醛在干燥氯化氢气体的存在下,可与醇发生加成反 应,生成半缩醛,半缩醛不稳定,会分解为原来的 醛,若有另一分子醇存在,半缩醛将与之失水生成
有机化学 醛和酮
二、同分异构
1.醛的同分异构:碳链的异构引起的。 2.酮的同分异构:碳链的异构引起的和酮羰基的位置不同引 起的异构。 3.相同碳数的饱和一元醛、酮互为同分异构体。
三、醛酮命名 醛的命名
1. 脂肪醛的系统命名:含醛基的最长碳链为主 链,从醛基开始编号,称某醛。
HCHO
甲醛 Organic Chemistry
磷叶立德 又称维蒂希试剂
机理:
R1 Ph3P- CHR + R2 CO R1 R2 C O CHR PPh3 R1 R2 C O CHR PPh3
教材没有反应机理过程指示(箭头)
R1 R
2
C CHR + Ph3P=O
Wittig反应条件温和,产率高,生成的双键位置 确定,没有重排。反应活性:醛>酮>酯
无水HCl OC2H5 OC2H5
+
CH =CH CH =CHCH 22 OC OC H 2H 2 55
OC H OC 2 55 2H [O ]
H ,H2O CH2 OH
CHCHO OH
3、与含氮亲核试剂的加成 1.4 与氨的衍生物加成缩合:氨及其衍生物是含氮的 亲核试剂,可与羰基加成,再分子内失去一分子水形 成碳氮双键
CH3CHCH2CHO OH
β-羟基丁醛
4.含有芳香环的醛,则将芳香环当作取代基。
CHO
CH CHCHO
CHO OH
苯甲醛
β-苯基丙烯醛
邻羟基苯甲醛
(苦杏仁油)
(肉桂醛)
(水杨醛)
Organic Chemistry HUAIHUA UNIVERSITY
酮的命名
1. 脂肪酮的系统命名:与醇的命名相同,连有羰 基的最长碳链为主链:
醛与酮的合成与反应

醛与酮的合成与反应醛和酮是有机化合物中常见的一类功能团,它们在化学反应和有机合成中具有重要作用。
本文将介绍醛和酮的合成和反应,包括常见的合成方法和典型的反应类型。
一、醛和酮的合成方法1. 氧化还原反应合成醛氧化还原反应是常用的合成醛的方法之一。
例如,通过加热醛或醇与强氧化剂如酸性高锰酸钾(KMnO4)、氢氧化钾(KOH)等反应,可将醛及醇氧化为醛,生成相应的酮。
2. 羧酸的还原合成醛羧酸的还原是另一种制备醛的方法。
一般使用还原剂如亚磷酸酯(如三氯化铝)、氯化铝等来催化羧酸的还原,生成相应的醛。
3. 烷基化合成醛烷基化反应是一种常见的合成醛的方法。
通过将卤代烷和金属盐如亚铁盐(如亚铁(II)氯化铵)反应,在适当的条件下,可生成相应的醛。
4. 卡宴转化合成酮卡宴转化(Wolff-Kishner反应)是制备酮的经典方法之一。
该反应以卡宴(Hydrazine)为还原剂,将醛还原得到相应的酮。
二、醛和酮的典型反应类型1. 氧化反应醛和酮都是易于氧化的官能团,容易被氧化剂氧化,生成酮和酸。
例如,醛在氧气或过氧化氢(H2O2)的存在下,可发生氧化反应,生成相应的酸。
2. 加成反应醛和酮常参与加成反应,与亲电试剂如胺类、羰基化合物、硫酸盐等反应,生成相应的加合物。
3. 缩合反应酮与酮发生缩合反应后,产生烯酮类化合物。
醛和酮通过催化剂如氢氰酸钠(NaCN)等催化,也可发生缩合反应,生成相应的糖类化合物。
4. 氧化邻位反应邻位氧化反应是醛和酮经典的反应类型之一。
将醛或酮与碱性过氧化物如过氧化乙酰、过氧化苯甲酮等反应,可发生邻位氧化反应,生成相应的酮或醛。
总结:通过氧化还原反应、羧酸的还原、烷基化合成和卡宴转化等方法,可以有效地合成醛和酮。
而醛和酮在化学反应中则常见于氧化、加成、缩合和氧化邻位等各种典型反应中。
熟悉醛和酮的合成方法和反应特点,对于有机合成和发展新颖化合物具有重要意义。
有机化学中的醛与酮的合成

有机化学中的醛与酮的合成在有机化学领域,醛和酮是两类重要的有机化合物。
它们在合成有机物以及药物研发等方面起着至关重要的作用。
本文将重点讨论醛和酮的合成方法及其应用。
一、醛的合成方法1. 氧化反应法醛可以通过氧化反应法合成,其中最常见的方法是利用氧化剂将醇氧化为醛。
常用的氧化剂有酸性高锰酸钾(KMnO4)、酸性过硫酸盐(H2SO5)以及乳酸等。
例如,1-丙醇可通过酸性高锰酸钾氧化得到丙醛。
2. 烷基化反应法醛还可以通过烷基化反应法合成,这个方法利用卤代烷与金属有机化合物反应生成醛。
以Fischer酯化反应为例,醛可由卤代烷与铜锌合金反应合成。
3. 催化还原法醛可以通过催化还原法得到,这种方法常用的还原剂有氢气、氢化硼和锂铝氢化物等。
其中催化氢化反应是一种常见的方法,例如,丁酮可通过催化氢化反应得到丁醇。
二、酮的合成方法1. 酮的羰基化反应酮的合成可以通过酮的羰基化反应来实现。
此反应是将羧酸转化为酐,再与亲核试剂反应生成酮。
该方法的优点在于通过酮的羰基化反应可以实现无需使用有毒或昂贵试剂的合成。
例如,乙酸酐可以通过与格氏试剂(Grignard试剂)反应生成丙酮。
2. 同时氧化和还原反应酮的合成还可以通过同时氧化和还原的反应进行。
常用的方法有Wolff-Kishner还原反应和Clemmensen还原反应。
例如,甲酮可通过Wolff-Kishner还原反应得到甲基胺。
3. 羰基化合成法酮还可以通过羰基化合成法合成,利用芳香羰基化合成法可以实现酮的有效合成。
该方法通过碱性条件下的羰基化反应将醛与亲核试剂反应生成酮。
例如,苯甲醛与溴乙酸反应可以合成苯乙酮。
三、醛与酮的应用1. 有机合成醛和酮作为含有羰基的化合物,在有机合成中具有广泛的应用。
它们可以作为重要的中间体,在化学合成中起到重要的作用。
例如,在合成药物和天然产物中,醛和酮的存在可以提供合成路径上所需的反应活性。
2. 药物研发醛和酮也在药物研发领域中发挥着重要作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章 醛酮含有羰基的化合物:O H O CH3CCH3 O C CH3醛和酮:CH 3C羧酸 羧酸:CH3CO OHCOOH COOH COOHOH CH3CHCOOHO羧酸衍生物:CH3COCl (CH3CO) ( )2OCOOC 2H 5NHOβ-二羰基化合物:CH3CCH2COOC 2H5CH2COOC2H5 COOC2H5210 醛和酮教学大纲(醛和酮)醛和酮的结构与物理性质 醛和酮的结构与物理性质; 醛和酮的化学性质:1.与氢氰酸加成; 2.与亚硫酸氢钠加成; 3.与醇亲核加成; 4.与氨的衍生物反应; 5.与Grignard试剂加成; 试剂加成 6.醇醛缩合反应; 7 卤化和卤仿反应; 7. 卤化和卤仿反应 还 原 反 应 —— 催 化 加 氢 、 金 属 氢 化 物 还 原 、 Clemmenson 还 原 、 WolffKishner黄鸣龙还原、Cannizzaro反应;氧化反应)。
羰基 carbonylOR C H R O C R'醛(aldehyde)O R C O R C R' Ar H Ar O C O C R H酮(Ketone K t )Oβ αC H(R)CC脂肪族醛、酮芳香族醛、酮α,β-不饱和醛、酮4命名:O CH3CCH2CH2CHOO O CH3CCHCCH3 CH2CH=CH24-氧代戊醛3-烯丙基-2,4-戊二酮OO CHO环己酮CHO2'-氧代环己基甲醛CHO OH O CHO苯甲醛2-羟基苯甲醛 (水杨醛)呋喃甲醛 (糠醛)5z醛和酮的结构2spCσOδ C+δO键角接近 120 °1 C=O双键是由一个σ键和一个π键组成的。
2 羰基碳原子为 sp2杂化轨道与氧原子的 p 轨道和其它两个原子 形成三个 形成 个σ键 键,一个 个 p轨 轨道与氧原子的 与氧 子 p轨 轨道侧面交盖成 侧面交 成π键 键, 氧原子上另有两对孤对电子处于氧的s轨道和p轨道中。
2 C=O C O是一个极性基团,具有偶极矩,碳原子带部分正电,氧 是一个极性基团 具有偶极矩 碳原子带部分正电 氧 原子带部分负电。
6z醛和酮的物理性质¾ 由于羰基为一极性基团,故醛、酮的 b.p p比相对分子质量 相近的烃和醚高。
但因其分子间不能形成氢键,其 b.p又 比相同碳原子数的醇要低。
¾ 醛、酮的羰基能与水中的氢原子形成氢键,故低级醛、 酮可溶于水;但芳香族醛 酮则微溶或不溶于水 酮可溶于水;但芳香族醛、酮则微溶或不溶于水。
¾ 羰基的红外光谱在1750-1680 cm-1之间有一个非常强的伸 缩振动吸收峰 -CHO中的C-H键在2720 cm-1区域有一个 缩振动吸收峰。
区域有 个 非常特征的伸缩振动吸收峰。
当羰基与双键共轭,吸收 向低波数位移。
向低波数位移7z醛和酮的化学性质性质分析 羰基氧有弱碱性 可与酸结合δ−R R21Oδ+碳与氧相连 氢易被氧化H(R)C HαCα碳有吸电子基 α氢有弱酸性羰基碳有亲电性 可与亲核试剂结合8亲核加成(★★)醛 和 酮 的 化 学 性 质醛的氧化 氢化还原与含碳亲核试剂的加成 与含氮亲核试剂的加成 与含氧亲核试剂的加成 与含硫亲核试剂的加成α-活泼H的反应(★★)烯醇化 α-卤代(卤仿反应) 醇醛缩合反应9亲核加成 ★ ★1. 反应机理碱催化的反应机理C=O NuC Nu O-H+CNu OH酸催化的反应机理C=O + H+[+ C=OH C OH+ C-OH ]Nu-CNu OH102 醛、酮的反应活性 2. 醛 酮的反应活性醛、酮亲核进程的难易既取决于亲核试剂的亲核性强弱, 也取决于羰基碳原子亲电性的强弱以及羰基周围的空间效应。
综合考虑电子效应和空间效应的影响,规律如下:R HC=O>R R'C=O>Ar R'C=O113**. 与含碳亲核试剂的加成能与醛、酮发生亲核合成的含碳亲核试剂有氢氰酸、格氏 试剂、有机锂试剂、末端炔化物等。
反应在接近中性的弱碱性 条件下进行,按碱催化机理进行。
主要用于有机合成。
与HCN 的加成O C OH HCN / NaOH(微量) 或 NaCN / H2SO4(滴入) C CNα-羟基腈¾ 反应必须在弱碱性条件下进行 ¾ 反应具可逆性 ¾ 适用于醛、脂肪族甲基酮和八个碳以下的环内酮12剧毒O C OH HCN / NaOH(微量) 或 NaCN / H2SO4(滴入) C CN氰化钠口服致死量为150~250mg,(若成人口服苦杏仁 40~60g即能引起中毒或死亡)。
对氰化物中毒,可用亚硝酸盐硫代硫酸钠疗法:先用亚 硝酸钠、亚硝酸异戊酯从而迅速生成高铁血红蛋白把细胞色 素氧化酶从氰化细胞色素氧化酶中置换出来,从而恢复活性。
残余的CN-用硫代硫酸钠清扫,生成无毒的硫氰酸盐排出体外。
另外,大剂量亚甲兰也可用于氰化物中毒的急救。
131903 年, Lapworth p 在研究丙 酮与氰化氢的反应时,发现反应 H3C 速率因加碱而加快,因加酸而变 慢,提出了第一个有机反应机理。
O C CH3 + HCNOH-HOCNHCN + OHCN+H2OO C CN慢 决速步骤O CH CNCN快OH C CN + CNα-羟基氰14应用 应用H2O H+ H C O C NaOH 95% H2SO4 C C COOH HCN H C OH C CN H C OH C COOHα-羟基羧酸α,β-不饱和羧酸15与格氏试剂 的加成O C MgX R OMgX C H2O OH C R决速步骤RC 2O CHRMgX gH2OR CH2 OH OH R' R CH OH R' C R'' R R1o醇 2o醇 3o醇R'CHO O C R' R''RMgXH2ORMgXH2O¾ 由于碳负离子具强亲核性, 反应不可逆。
¾ 与羰基相连的烃基空阻太大,格氏试剂烃基也太大时,用烷 与羰基相连的烃基空阻太大 格氏试剂烃基也太大时 用烷 基锂代替可发生正常的加成反应。
164. 与含氮亲核试剂的加成能与醛、酮发生亲核加成的含氮亲核试剂有氨和氨的 各种衍生物 反应在弱酸条件下进行 反应是可逆的 主 各种衍生物。
反应在弱酸条件下进行,反应是可逆的。
主 要用于有机合成、羰基的保护、醛(酮)的提纯和鉴定。
17与氨基化合物的加成亲核加成HOHCH3CH=O + NH3 氨CH3CH-NH-H2OCH3CH=NH 亚胺 不稳定 易分解CH3CH=O CH O + RNH2 伯胺亲核加成HO H CH3CH-NR CH NR-H2OCH3CH=NR 席夫碱 (Schiff’s base) CH2=CHNR2 烯胺H 仲胺α 位有氢OHCH3CH=O + R2NH 亲核加成 CH2CH-NR2-H2O18¾ 反应在酸性条件下进行,为可逆反应。
¾ 脂肪族醛所生成的Schiff碱容易进一步聚合,而芳醛所 生成的Schiff碱性质稳定,且产率较高。
¾ 酮与NH3、RNH2的反应趋势较小。
19与伯胺 伯胺缩合成 缩合成亚胺 亚胺的机理 的机理H C O C OH H2NR -H C OH NHR H酸催化 使羰 酸催化,使羰 基亲电性增强COHNH2R- H2O C NHR OH2-H C NHR C NR20例:醛较活泼, 易反应苯 CHO + CH3NH2 CH N CH3 + H2O除去方法 除去方法: 共沸或用 干燥剂O H3C C CH3 + CH3CH2CH2NH2HClH3C C NCH2CH2CH3 + H2O H3CHO CHO + H2NH CH=N + H2OCH-N21与氨衍生物的缩合H2NOH H C N OH + H2O羟胺O H2NHN C NH2 C O + H肟 (oxime)O C N NH C NH2 + H2O氨基脲H2NNHR" H缩氨脲(用于分析)C N NHR + H2O取代肼H2NHN O2N NO2 H腙类CN NH O2NNO2 + H2O2, 4-二硝基苯肼2, 4-二硝基苯腙 (黄色固体 用于分析) (黄色固体、用于分析22应用¾ 产物均为固体结晶,又可用于醛、酮的定性鉴别。
常用试剂为 2 4-二硝基苯肼。
2,4¾ 产物易于从反应体系中分离出来,又因这些产物在酸性水溶液 中加热易于分解成原来的醛酮 故用于分离 提纯 中加热易于分解成原来的醛酮,故用于分离、提纯。
¾ 制备各种胺类化合物。
通过加成制备胺类化合物NR C or RMgX RLi H2O NHR C R1o or 2o 胺类似羰基23通过还原制备胺类化合物RNH2 H2 / Ni C N R CH NH R2o 胺H2 / Ni C N OH 或 LiAH4 CH NH2 H2 / Ni C N NH2H2N OH C OH2N NH21o 胺还原时被取代通过烯胺还原制备胺类化合物O C CH2R R' R HNR'2 H+ N C R' R H2 CHR Pd / C R' N C H24R'烯胺CH2R3o 胺——Beckmann Beckmann重排 肟在酸性条件下的重排——1. 肟的构型 在肟分子中,若双键碳原子连有两个不同的基团,则 存在顺反异构体 并可用Z/E法标记其构型(腙类化合 存在顺反异构体,并可用 物也存在类似的情况)。
NH2OH•HCl Na2CO3CHOH C =NOHZ-苯甲醛肟 mp 35oC通常以E构 型为主。
NH2OH•HCl 苯 hνH C =N OHE-苯甲醛肟 p 132oC mp252. 贝克曼(Beckmann)重排芳香族酮肟用H2SO4或PCl5处理,则发生分子内重排,其 结果是肟羟基与其处于反式的烃基换位,生成烯醇式中间体, 然后再转化为 N- 取代酰胺。
这种酮肟的反式重排成为贝克曼 (Beckmann)重排。
C =NHROHRC =NC6H5R C=C6H5:+HO:ONH C6H5(1)重排反应是在酸催化下完成的; 特特 点点 (2)只有处于羟基反位的烃基才能迁移; (3)基团的迁移和羟基离去是同步的; (4)迁移基团在迁移过程中构型保持不变。
26Beckmann 重排的立体化学• 反式协同迁移 式协 移—消除R C R' R C R' N OH O H R' C NH R N OH H R O C NH R'• 迁移基团的构型保持不变t-Bu H H Et H3C C N OH H3C构型不变O C NH t-BuEtH27Beckmann 重排的机理R C R' N R' OH O H R C NδOH2 R C N R'烷基向缺电子的N迁移H2O R C N R' R OH2 C N R'OH R C N H R' ROH C NH R'O H R C NH R'285. 与含氧亲核试剂的加成能与醛、酮发生亲核加成的含氧亲核试剂有水和醇,醛、酮的 能与醛 酮发生亲核加成的含氧亲核试剂有水和醇 醛 酮的 水合物是不稳定的。
