武汉理工大学2013-2014(2)物理化学C(A)卷
武汉理工大学-历年真题清单

武汉理工大学研招办经济学院西方经济学(含微观、宏观经济学)2007——2009经济学(含微观、宏观经济学)1997——2000,2002——2006(2002——2004,2006有答案)宏观经济学2004——2006(2004有答案)货币银行学2004——2007(2004有答案)国际贸易概论1998——2000,2002——2009(2002——2004有答案)国际金融学2002,2004——2009(2002,2004有答案)国际市场营销2002财政学2007产业经济学2002,2006——2009(2002有答案)电子商务概论2008——2009运输经济学2002——2009区域经济学2007人力资源管理2007管理学概论2004——2007(2004有答案)管理学原理1997——2000,2002——2009(2002——2004有答案)微机原理及应用1997——2000,2002——2007概率论与数理统计2001——2009复试科目:国际贸易学2003加试科目:国际金融学2003;国际市场营销学2003复试科目:产业经济学2003复试科目:数量经济学专业复试2003文法学院伦理学基础综合2007——2009伦理学原理2007——2009伦理学2002——2005民法学2007民商法学2008——2009民商法学综合2007——2009经济法学2002,2004——2009经济法综合2007——2009法学综合2002——2006知识产权2007知识产权法2002——2005法理学与知识产权法2004——2005社会心理学2002心理学2002思想政治教育学原理与方法2002——2009中国化的马克思主义2007——2009马克思主义基本原理及其发展2007——2009马克思主义基本原理2007马克思主义哲学原理2002——2009新闻传播专业综合考试(含广告学、编辑出版学)2004——2005出版发行综合2006——2009广告学综合2006——2009传播学原理2004——2009专业综合(教育学、运动训练学)2007体育教育综合(运动生理学、运动训练学)2008——2009运动生理学2007复试科目:综合复试2003;复试(科技法方向)2003加试科目:专业加试2003;加试(科技法方向)2003高等教育研究所教育学2002——2006,2008——2009教育管理学2002——2006,2008——2009复试科目:综合复试2003加试科目:教育学2003;教育心理学2003外国语学院二外日语2002——2009二外法语2002——2009二外德语2002——2009二外俄语2003——2009基础英语2001——2009(注:其中2002,2003,2005年的试卷名称为“综合英语”)英语语言学2001——2003,2006——2009(2001有答案)语言学及英美文学2004——2005英美文学2007——2009英语写作2002复试科目:外国语言学及应用语言学专业复试2003艺术与设计学院设计艺术学专业综合(含设计艺术史论、工业设计及其理论、环境艺术设计及其理论、视觉传播艺术设计、动画艺术设计及其理论、数字艺术设计及其理论)2008——2009美术学专业综合2008——2009艺术学专业综合2008——2009设计艺术学专业史论2003——2006,2008——2009 美术学专业史论2008——2009艺术学专业史论2008——2009音乐艺术研究专业综合(报考艺术管理方向)2009 视觉传播艺术设计基础2007速写与焦墨山水画2005速写与花卉白描2005——2006速写与人物写生画2005——2006速写与色彩人物写生2005,2007速写与泥塑人物写生2007速写与素描人物写生2005速写与水彩或水粉画创作2005速写与装饰画创作2005——2006中外美术史2002,2005,2007中国美术史专题2006中国画创作基础2007艺术美术专业基础2007美术史论2005——2007美术理论2004艺术学概论2007艺术设计史基础2004——2005,2007艺术史论基础2007艺术设计史论基础2003,2006艺术设计理论2002艺术设计史2002专业史论2007艺术设计学“专业设计基础”2002专业设计2002信息设计基础2004——2005动画创作基础2004——2006艺术管理专业基础2004——2005,2007艺术教育专业基础2007民艺专业基础2004 ——2005民间美术2007民间艺术设计及其原理2006设计基础理论与设计基础表达2002环境艺术设计基础2006——2007环境艺术设计与公共艺术创作专业基础2002动画与数字化设计艺术基础2007动画设计与数码设计基础2002系统设计及传播艺术基础2002系统设计及传播艺术理论2002工业设计理论2002工业设计基础2004——2007数码设计理论2002数码艺术设计基础2003中外建筑史2002动画创作理论2002动画创作基础2003环境艺术设计2002环境艺术设计基础2004——2005公共艺术创作与设计2002公共艺术设计基础2006卡通画创作2002专业设计(计算机艺术设计)2002专业设计(系统设计及传播艺术设计)2002环境艺术设计专业方向(环境艺术设计基础)2003设计艺术学专业工业设计方向设计基础2003平面设计基础2003——2005平面艺术设计基础2006现代美术与公共艺术设计基础2003设计管理2006设计基础(展示设计及理论方向)2006信息设计基础2006影视艺术设计基础2006音乐艺术研究2007复试科目:艺术与设计学院复试2003加试科目:艺术与设计学院加试2003理工学院材料力学1997——2000,2002——2009弹性力学2002——2004,2007理论力学2002——2009工程力学2004微机原理及应用1997——2000,2002——2007微机原理(即:微型计算机原理)1997——2000,2002——2004 岩石力学1997——2000,2002岩体力学2003——2007(注:2003年有两种)结构力学2002——2009量子力学2004——2009物理光学2002,2004——2009电磁场与电磁波2004电磁场理论2005——2009概率论与数理统计2001——2009数值分析2002,2004——2007高等代数2001——2009数学分析2002——2009常微分方程2002——2007线性代数2002普通物理2002——2009运筹学2002——2008(注:2002年试卷有两种)物理化学2002——2009有机化学2002——2007无机化学2002——2009化学原理2008——2009基础无机化学2007物理化学原理2007高等数学2007,2009高等数学(工)2002——2006,2008高等数学(二)2004高等数学(文)2003——2005复试科目:应用化学专业复试2003复试科目:应用数学专业复试2003复试科目:固体力学专业复试2003资源与环境工程学院物理化学2002——2009材料力学1997——2000,2002——2009岩石力学1997——2000,2002岩体力学2003——2007(注:2003年有两种)岩石力学与工程2004——2009矿山岩石力学2002无机化学2002——2009浮选2002固体废物处理工程2002水污染控制工程2002大气污染控制工程2002化工基础2002——2007化工原理2002——2009(注:2002年称“环境化工原理”)采矿学2002安全工程学2007——2009爆破工程2002——2009(注:2003年称“凿岩爆破”)流体力学2002——2004胶体化学2003——2009结晶矿物学2003——2006环境学概论2004——2009环境化学2004——2007环境流体力学2002,2005——2007环境工程微生物学2005——2006环境生物学2005——2007矿物加工工程专业复试科目:综合复试2003采矿工程专业复试科目:专业复试2003环境工程专业复试科目:环境工程专业复试2003;加试科目:环境工程专业加试2003材料科学与工程学院材料科学基础2002——2009普通物理2002——2009材料力学1997——2000,2002——2009医学综合一(含生物化学、无机化学)2008——2009医学综合二(含生物化学、高分子化学)2008医学综合三(含生物化学、组织学)2008——2009医学综合2002,2004细胞生物学2002——2007组织学2002——2007物理光学2002,2004——2009计算机在材料科学中的应用2007计算机在材料中的应用2004——2005工程材料2002——2007生物化学2002——2007物理化学2002——2009有机化学2002——2007无机化学2002——2009陶瓷工艺原理2002玻璃工艺原理2002复合材料工艺2002铸造合金及其熔炼2002塑性成型原理2002材料成型原理2003——2009焊接冶金2002金属热处理2002金属材料学2007固体物理2002——2009聚合物加工原理与工艺2002胶凝材料学2002无机非金属材料工学2002,2004——2009金属学及热处理2002硅酸盐物理化学2002高分子化学及物理2002高分子化学2003——2009金属学原理2002——2007材料物理与化学专业复试科目:综合复试2003;加试科目:物理化学2003;材料学院同等学历加试2003材料学专业复试科目:综合复试2003;加试科目:物理化学2003;材料学院同等学历加试2003材料加工工程专业复试科目:综合复试2003;加试科目:物理化学2003;材料学院同等学历加试2003生物医学工程专业复试科目:生物医学工程专业复试2003;加试科目:生物化学2003;组织学2003机电工程学院材料力学1997——2000,2002——2009机械原理1997——2000,2002——2009机械设计1997——2000,2002——2009控制工程基础2002——2009统计质量管理2005——2009传感器原理2003——2009传感检测技术2002——2003传感技术1997——2000传感与检测技术2002电子技术基础2002——2009微机原理及应用1997——2000,2002——2007人机工程学2002——2006机电工程学院2003年同等学历考研加试题(测试技术)机电工程学院2003年同等学历考研加试题(机械原理)机电工程学院2003年同等学力考研加试题(机械设计)机电工程学院2003级硕士研究生复试试题汽车工程学院材料力学1997——2000,2002——2009理论力学2002——2009汽车理论基础2002——2009发动机原理2002——2009摩托车理论与结构设计2002汽车运用工程2002——2009汽车运输工程2002——2003工程热力学2002——2008汽车运输学2003——2005,2007交通运输学2006汽车营销与策划2009汽车市场学2004——2008动力机械及工程专业复试科目:动力机械及工程复试2003;加试科目:发动机构造2003;发动机原理2003车辆工程专业复试科目:综合复试2003;加试科目:汽车构造2003;汽车理论2003载运工具运用工程专业复试科目:综合复试2003自动化学院电路1997——2000,2002——2009电工技术基础2002电工原理2003——2006控制理论基础2002自动控制原理1997——2000,2002——2009信号处理技术2002——2005(注:2002——2003年称“信号分析与处理”)传感技术1997——2000传感与检测技术2002传感检测技术2002——2003传感器原理2003——2009电机及拖动基础2001电力电子技术(一)2007电力电子技术2002——2006,2008——2009微机原理及接口技术2002——2009数字电路2003——2009逻辑设计2004——2006电力电子与电力传动专业复试科目:电力电子与电力传动专业复试2003检测技术与自动化装置专业复试科目:检测技术与自动化装置专业复试2003 控制理论与控制工程专业复试科目:控制理论与控制工程专业复试2003;加试科目:自动控制原理2003;微机原理及接口技术2003计算机科学与技术学院数据结构1997——2000,2002——2008操作系统1998——2000,2002——2008计算机组成原理2002——2007微机原理及应用1997——2000,2002——2007C语言2007微机原理(即:微型计算机原理)1997——2000,2002——2004离散数学2002——2006计算机网络1999——2000,2002软件工程2002——2006数据库原理2002编译原理2002计算机原理2002计算方法2003——2005复试科目:计算机应用技术、计算机软件与理论专业2003加试科目:微机原理及应用2003;数据库应用2003信息工程学院数据结构1997——2000,2002——2008信号与系统1999——2000,2002——2009信号与线性系统2002——2006物理光学2002,2004——2008光纤光学2007现代光学2006高频电路2002微机原理及应用1997——2000,2002——2007微机原理(即:微型计算机原理)1997——2000,2002——2004 脉冲与数字电路1999——2000,2002电子技术基础2002——2009高频电子线路1999——2000,2002微机原理及其通信接口2003——2009信号分析与处理2002——2008传感技术1997——2000电路1997——2000,2002——2009数字信号处理1999——2000,2002,2009土木工程与建筑学院材料力学1997——2000,2002——2009传热学2002——2007中外建筑史2002——2009建筑历史2004——2007建筑设计2002——2004,2008——2009建筑设计(1)2005——2007建筑设计(2)2005——2007规划设计2007——2008城市规划原理2003——2009建筑结构抗震设计2007抗震结构设计2004结构力学2002——2009工程项目管理2008——2009建筑施工与工程项目管理2003——2007建筑施工技术2002建筑工程经济与企业管理2002工程热力学2002——2009土质学与土力学2002——2007水分析化学2002——2005水分析与物理化学2006——2007水力学与水泵2002——2007水力学与水分析化学2008——2009土力学2002——2009建筑构造2002岩石力学1997——2000,2002岩体力学2003——2007(注:其中2003年有两种)钢筋混凝土结构2002,2006——2009混凝土结构原理2003钢筋砼结构2005土力学与基础工程2002结构动力学2002结构设计原理2002(第1种),2002(第2种),2005——2007桥梁工程2002给水工程2002排水工程2002路基路面工程2002,2005——2007工程地质学2004——2006美学2004建筑设计及其理论专业复试科目:建筑设计2003;建筑设计知识2003;加试科目:中外建筑史2003结构工程专业复试科目:结构工程2003;综合复试(建筑工程施工技术、建设工程项目管理方向)2003;加试科目:施工组织学2003;建筑经济与企业管理2003;结构力学2003;混凝土结构2003桥梁与隧道工程专业复试科目:桥梁与隧道工程专业复试2003;加试科目:桥梁与隧道工程专业加试Ⅰ2003;桥梁与隧道工程专业加试Ⅱ2003岩土工程专业复试科目:综合复试2003市政工程专业复试科目:专业复试2003交通学院高等数学2007,2009高等数学(工)2002——2006,2008高等数学(二)2004交通运输装备2005——2007桥梁设计与施工2005,2007第三方物流理论与实践2007现代物流与运输2005——2006物流学2006现代物流学2002,2007——2009运输经济学2002——2009路基路面工程2002,2005——2007工程热力学2002——2009结构分析2008——2009理论力学2002——2009土质学与土力学2002——2006材料力学1997——2000,2002——2009施工组织及概预算2004土工原理与计算2008——2009公路工程施工组织及概预算2003信号与系统1999——2000,2002——2009微机原理及应用1997——2000,2002——2007运筹学2002——2009(注:2002年试卷有两种)船舶结构力学2002,2004——2009船舶原理2002——2009船舶设计原理2002——2009流体力学2002——2004,2006——2008环境学导论2002国际航运经济与政策2002——2004计算机辅助船体建造2002船舶技术经济学2002传热学2002——2007国际集装箱运输与多式联运2002——2004港口管理(运输企业管理学)2002——2005港口企业管理学2007运输企业管理学2006道路勘测设计2002船舶强度与结构设计2002——2007环境质量评价2002交通环境工程地质与应用2002声学基础2002,2006航运管理2002——2006(注:2002年有两种)结构设计原理2002(第1种),2002(第2种),2005——2007计算机辅助船舶设计2002船舶营运管理2007船舶建造工艺学2003——2007船机制造工艺学2002结构力学计算2008——2009结构力学与结构电算2003——2007运动生物力学2004划船运动概论2004船体振动学2006液压原理与控制2002机械制造工艺学2002流体力学专业复试科目:流体力学2003;加试科目:流体力学2003,工程热力学和传热学、水力学2003工程力学专业复试科目:理论力学2003道路与铁道工程专业复试科目:道路与铁道工程2003,桥梁工程2003;加试科目:土力学2003交通运输规划与管理专业复试科目:综合复试2003;加试科目:交通运输设备概论2003船舶与海洋结构物设计制造专业复试科目:综合复试2003;加试科目:船舶与海洋工程学2003结构工程专业复试科目:结构综合2003;加试科目:钢结构2003航运学院船舶管理2002——2009航运管理2002——2006(注:2002年有两种)航海学2002船舶操纵与避碰2002——2006航海气象学与海洋学2004,2006——2007(注:2007年试卷共3页,缺第2页)物理海洋数字计算2008信号与系统1999——2000,2002——2009能源与动力学院电力电子技术2008——2009电力电子技术(二)2006——2007测试技术2007A卷,2007B卷工程热力学与传热学2006——2009机械振动学2006热能与动力机械制造工艺学2006——2007轮机自动化2007——2009智能运输系统概论2006——2009专业综合(含工程热力学、传热学、内燃机原理)2005专业综合(含工程热力学、传热学、机械设计)2005专业综合(含自动控制理论、测试技术、计算机技术)2005专业综合(含自动控制理论、电工电子技术、计算机控制技术)2005专业综合(含机械设计、测试技术、自动控制理论)2005工程热力学2002——2009机械设计1997——2000,2002——2009船舶柴油机2009内燃机原理2007A卷,2007B卷内燃机原理2002——2004,2006传热学2002——2007自动控制理论2003——2004,2006——2007自动控制原理1997——2000,2002——2009动力机械制造与维修2009船舶动力装置原理与设计2002船舶建造工艺学2003——2007船机制造工艺学2002船舶机械制造与修理2003——2004船舶管理2002——2009机械制造工艺学2002轮机工程专业复试科目:轮机工程2003;加试科目:内燃机学2003;轮机概论2003;工程热力学和传热学2003载运工具运用工程专业复试科目:载运工具运用工程2003管理学院管理学原理1997——2000,2002——2009(2002——2004有答案)管理经济学基础2005——2007管理信息系统2002——2007(2002——2004部分有答案)概率论与数理统计2001——2009线性代数2002线性代数与概率统计2003——2009会计学原理1997——2000,2002——2009(2002——2004有答案)(注:1998年共3页,缺P3)技术经济学2002——2009(2002——2004部分有答案)运筹学2002——2009(注:2002年试卷有两种)现代工业管理2003——2004(2003——2004部分有答案)公司理财原理2002——2009(2002——2004有答案)(注:2002年称“财务管理学”,2003——2004称“公司财务管理”)项目管理2005——2007企业管理学2002(2002有答案)生产管理学2002(2002部分有答案)市场营销学2001(2001有答案)技术创新管理2003(2003部分有答案)工商管理硕士(MBA)专业复试科目:MBA专业综合课2003;加试科目:市场学2003;投资学2003会计学专业复试科目:财务会计与管理会计2003;加试科目:财务管理2003;会计学2003管理科学与工程专业复试科目:企业管理概论2003;加试科目:管理经济学2003;企业管理学2003技术经济及管理专业复试科目:投资分析2003;加试科目:产业经济学2003;投资学2003企业管理专业复试科目:市场营销与生产管理2003;加试科目:市场学2003;管理学原理2003系统工程专业复试科目:系统工程概论与线性规划2003;加试科目:概率统计2003;线性代数2003政治与行政学院邓小平理论和“三个代表”重要思想2007——2009邓小平理论2002——2006马克思主义哲学原理2002——2009政治学原理2007——2009西方哲学史2007——2009西方政治思想史2008——2009中外政治思想2007高等数学(文)2003——2004思想政治教育理论与方法2002——2005,2007科学技术史2002——2007中共党史2002——2009自然辩证法2002——2009中国近代史2002科学技术哲学专业复试科目:综合复试2003;加试科目:马克思主义哲学原理2003;现代科技导论2003中共党史专业复试科目:综合复试2003;加试科目:政治学原理2003;中国近代史2003物流工程学院机械设计基础2005——2009机械工程基础2004机械CAD基础2006起重运输机械2005——2009起重机械2002物流信息技术2005——2009物流学2006现代物流学2002,2007管理学基础2005——2009画法几何2002——2003,2005——2007材料力学1997——2000,2002——2009理论力学2002——2009机械原理1997——2000,2002——2009机械设计1997——2000,2002——2009电子技术基础2002——2009微机原理及应用1997——2000,2002——2007工程材料2002——2007工程力学2004运筹学2002——2009(注:2002年试卷有两种)运筹学与系统工程2004计算机应用基础与计算机技术基础2004仓储技术与设备2006——2007自动识别技术2007CAD/CAM技术2002液压原理与控制2002机械制造工艺学2002机电一体化技术2002液压技术2002机械制造及自动化专业复试科目:机械制造及自动化专业复试2003;面试科目:机械制造专业2003机械电子工程专业复试科目:机械电子工程专业复试2003;面试科目:机械一体化技术(机电专业)2003机械设计及理论专业复试科目:机械设计及理论专业复试2003化学工程学院制药化学2005——2009化工原理2005——2009药物分析2005——2007物理化学2006——2007。
武汉理工大学考试试题纸(A卷)

武汉理⼯⼤学考试试题纸(A卷)武汉理⼯⼤学考试试题纸(A卷)课程名称⽆机化学(下)专业班级⼀.选择题(15分)1. 下列硝酸盐热分解为⾦属的是()(A)NaNO3(B)Pb(NO3) 2(C)AgNO3(D)Cu(NO3) 22. 下列各组硫化物,其中均难溶于稀酸, 但能溶于浓盐酸的是()(A)Bi2S3和CdS (B) ZnS和PbS (C) CuS 和Sb2S3 (D) As2S3和HgS3. 下列氢氧化物中,哪⼀种既能溶于过量的NaOH,⼜能溶于过量的氨⽔()(A)Ni(OH)2 (B)Fe(OH) 3(C)Zn(OH)2(D)Al(OH)34. 与浓盐酸反应不能⽣成黄绿⾊⽓体的物质是()(A)PbO2(B)Fe2O3(C) Co2O3(D) MnO25. 配制SnCl2溶液,常在溶液中放⼊少量固体Sn粒,其理由是()(A)防⽌Sn2+被氧化;(B)防⽌Sn2+⽔解;(C)防⽌SnCl2溶液产⽣沉淀;(D)防⽌SnCl2溶液挥发6. 下列物质中酸性最强的是()(A) H2S (B) H2SO3(C) H2SO4(D) H2S2O77. 在FeCl3和KNCS 的混合溶液中,加⼊⾜够的NaF,其现象是()(A)变成⽆⾊(B) 颜⾊加深(C) 产⽣沉淀(D) 颜⾊变浅8. 下列离⼦与过量KI溶液反应只能得到澄清的⽆⾊溶液的是()(A)Cu2+(B) Fe3+(C) Hg2+(D) Hg22+9.在NaH2PO4溶液中加⼊AgNO3溶液后主要产物是()(A) Ag2O (B) AgH2PO4 (C) Ag3PO4(D) Ag2HPO410. 下列叙述中正确的是()(A) H2O2 的分⼦构型为直线形;(B)H2O2既有氧化性⼜有还原性,主要⽤作氧化剂(C)H2O2是中强酸,分⼦间有氢键;(D)H2O2与K2Cr2O7 的酸性溶液反应⽣成稳定的蓝⾊CrO5,此反应可⽤来鉴定H2O2⼆、按性质递变规律排序(⽤>,<表⽰)(7分)1. 氧化性HClO4H5IO6HBrO42. 熔点SnCl2SnCl43. 熔点BeCl2MgCl2 SrCl24. 热稳定性碳酸碳酸氢盐碳酸盐5. 碱性Sn(OH)2 Sn(OH)46. 还原性Cl-Br-I-7. 酸性HClO HBrO HIO三、完成并配平下列⽅程式(20分)1.在消防队员的背包中,超氧化钾既是空⽓净化剂,⼜是供氧剂2. H3BO3+HOCH2CH2OH→3. Na2S2 + SnS →4. SbCl3(aq) 溶液稀释时变浑5. PCl5+H2O→6. Mn2++ NaBiO3 + H+→7. 常温下,液溴与碳酸钠溶液→8. Ag++Cr2O72-→9. Hg22++I-(过量)→10. HF腐蚀玻璃四、填空题( 28分)1. 氯⽓能使湿润的KI-淀粉试纸变蓝,有关的反应式为();但试纸长久与氯⽓接触后,蓝⾊会消失,这是因为(),反应式为()。
武汉理工大学2013-2014(2)物理化学C(A)卷
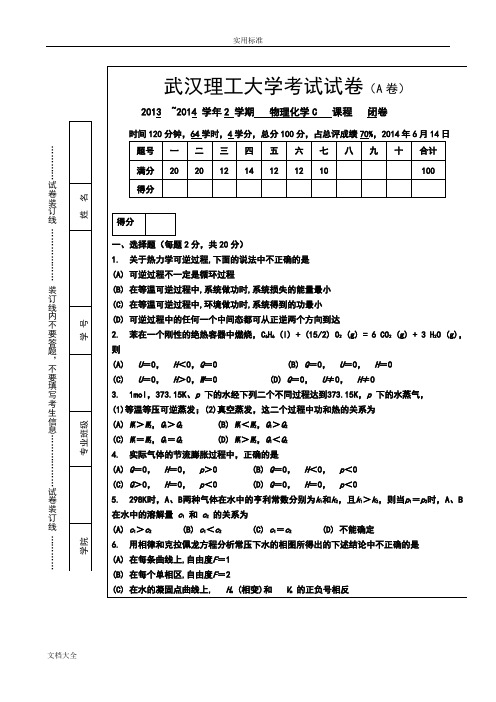
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………武汉理工大学考试试卷(A卷)2013 ~2014 学年2 学期物理化学C 课程闭卷时间120分钟,64学时,4学分,总分100分,占总评成绩70%,2014年6月14日题号一二三四五六七八九十合计满分20 20 12 14 12 12 10 100得分得分一、选择题(每题2分,共20分)1. 关于热力学可逆过程,下面的说法中不正确的是(A) 可逆过程不一定是循环过程(B) 在等温可逆过程中,系统做功时,系统损失的能量最小(C) 在等温可逆过程中,环境做功时,系统得到的功最小(D) 可逆过程中的任何一个中间态都可从正逆两个方向到达2. 苯在一个刚性的绝热容器中燃烧,C6H6 (l) + (15/2) O2 (g) = 6 CO2 (g) + 3 H2O (g),则(A) U=0,H<0,Q=0 (B) Q=0,U=0,H=0(C) U=0,H>0,W=0 (D) Q=0,U≠0,H≠03. 1mol,373.15K、p下的水经下列二个不同过程达到373.15K,p下的水蒸气,(1)等温等压可逆蒸发;(2)真空蒸发,这二个过程中功和热的关系为(A) W1>W2,Q1>Q2 (B) W1<W2,Q1>Q2(C) W1=W2,Q1=Q2(D) W1>W2,Q1<Q24. 实际气体的节流膨胀过程中,正确的是(A) Q=0,H=0,p>0 (B) Q=0,H<0,p<0(C) Q>0,H=0,p<0 (D) Q=0,H=0,p<05. 298K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当p1=p2时,A、B 在水中的溶解量c1和c2的关系为(A) c1>c2(B) c1<c2(C) c1=c2(D) 不能确定6. 用相律和克拉佩龙方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上,自由度F=1(B) 在每个单相区,自由度F=2(C) 在水的凝固点曲线上, H m (相变)和V m的正负号相反7. 为求AgCl 的活度积,应设计电池为: (A) Ag , AgCl | HCl (aq) | Cl 2 (p ) | Pt (B) Pt | Cl 2 (p ) | HCl (aq) ¦¦ AgNO 3 (aq) | Ag(C) Ag | AgNO 3 (aq) ¦¦ HCl (aq) | AgCl , Ag(D) Ag , AgCl | HCl (aq) |AgCl , Ag8. 一根毛细管插入水中,液面上升的高度为 h ,当在水中加入少量的 NaCl ,这时毛细管中液面的高度为: (A) 等于h (B) 大于h (C) 小于h (D) 无法确定 9. 某反应的反应物消耗掉3/4的时间是其半衰期的2倍,则该反应的级数为 (A) 零级(B) 一级(C) 二级(D) 三级10. 对ζ 电势的阐述,正确的是:(A) ζ 电势与溶剂化层中离子浓度有关 (B) ζ 电势在无外电场作用下也可表示出来 (C) | ζ |电势越大,溶胶越不稳定 (D) | ζ |电势越大,扩散层中反号离子越少答案:题号 1 2 3 4 5 6 7 8 9 10 答案得分二、填空题(每空2分,共20分) 1. 已知H 2 (g)在298K 时的标准摩尔燃烧焓 cH m =-285.8 kJ/mol , 则反应2 H 2 (g) + O 2 (g) → 2 H 2O (l) 在298K 时恒容反应热 Q V =( )kJ/mol 。
2013武汉二月理综化学试题及答案1 Word 文档

武汉市2013届高中毕业生二月调研测试理科综合试题(化学部分及答案)7、根据生活经验,下列物质按酸碱性的一定顺序依次排列,正确的是A、厕所清洁剂厨房清洁剂醋肥皂B、醋厕所清洁剂洗衣液厨房清洁剂C、厕所清洁剂醋肥皂厨房清洁剂D、厨房清洁剂醋肥皂厕所清洁剂8、下列有关铝或其化合物的说法中,不正确...的是A、制备A1C13不能采用将溶液直接蒸干的方法B、工业上采用电解A1C13方法冶炼金属铝C、实验室常用氨水和硫酸铝溶液制备Al(OH)3D、存在于污水中的胶体物质,常用投加明矶等电解质的方法进行处理9.下列物质的除杂方法中,合理的是①C2H4中混有的C2 H4,可以将混合气体先通过溴水,然后用碱石灰干燥②K2CO3中混有的少量NaHCO3,可以用加热的方法除去③乙烯中混有的SO2气体可以通过酸性高锰酸钾溶液除去④金属铜中含有的少量银和锌可以通过电解精炼的方法除去H2S中混有的水蒸气用浓硫酸干燥即可A.、①④B、②③C、①⑤D、④5⑤10.反兴奋剂是每届体育赛事关注的热点。
利尿酸是一种常见的兴奋剂,其分子结构如下: 关于利尿酸的说法中,正确的是A、它是芳香烃B、它不能使酸性高锰酸钾溶液褪色C、它不能与饱和碳酸钠溶液反应放出CO2D、它能发生取代反应、加成反应和酯化反应I1、下列离子方程式正确的是A、大理石溶于醋酸: CaCO3+2H+-=Ca2++CO2↑+H2OB、FeBr2溶液中通人少量的CI2: CI2 +2Fe2+=2Fe3++2C1-C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H+ +SO42-+Ba2++20H -=BaSO4↓+2H2OD、酸性氢氧燃料电池的正极反应:H2一2e- =2H+12、在VmL 0.1 mol/L Na2S溶液中逐滴加人V mL 0. 1 mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是13. A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质。
武汉理工大学考试试卷 A
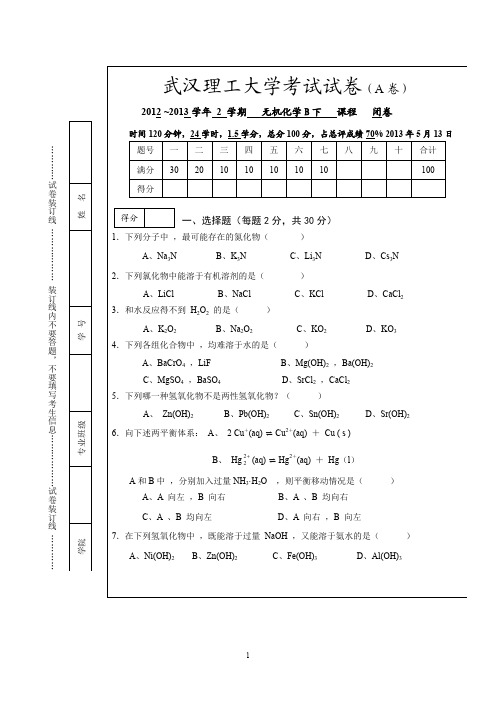
2012 ~2013 学年 2 学期 无机化学 B 下 课程 闭卷
时间 120 分钟,24 学时,1.5 学分,总分 100 分,占总评成绩 70% 2013 年 5 月 13 日
… … … … 试 卷 装 订 线 … … … … … … 装 订 线 内 不 要 答 题 , 不 要 填 写 考 生 信 息 … … … … … … 试 卷 装 订 线 … … … …
)
7.在下列氢氧化物中 ,既能溶于过量 NaOH ,又能溶于氨水的是( A、Ni(OH)2 B、Zn(OH)2 C、Fe(OH)3 D、Al(OH)3
)
1
8.已知:
Cu2
+
+
0.15 v
+
Cu 小
+
0. 52 v
Cu 则在水溶液中 Cu2 、Cu 的稳定性大小为 (
+ +
)
A、Cu2 大 ,Cu
B、Cu2 小,Cu 大
得分
三、根据描述写出下列反应式并配平(每小题 2 分,共 10 分)
21.在氯化银溶于氨水的溶液中,加入甲醛并加热
22.NO3-的鉴定反应 23.将 Cr2S3 投入水中
24.向 PbS 中加入过量 H2O2
25.用碘溶液滴定硫代硫酸钠溶液
得分
3+
四、是非题(正确划√,错误划×。每小题 1 分,共 10 分)
37. 使难溶沉淀溶解主要有如下几种方法 : ⑴ ⑵ ⑶ 加酸溶解 :常用于难溶弱酸盐沉淀 。如 : CaCO3 + 2 HCl = CaCl2 + CO2(g)+ H2O 加氧化剂或还原剂溶解 : 3 CuS + 8 HNO3 (稀) = 3 Cu (NO3)2 + 3 S(s) + 2 NO(g) + 4 H2O 加入配位剂溶解 : AgCl + 2 NH3 = [Ag (NH3)2] + Cl
武汉理工大学物理化学下-期末考试试卷(1)

武汉理工大学考试试题纸( A 卷)课程名称:物理化学A4(下) 专业班级:题号 一 二 三 四 五 六 七 八 九 十 总分 题分 342012141010100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一、填空题(每空2分,共34分)1.已知298K 时,∞m λ(HCl)= 0.042615S •m 2•mol -1,∞m λ(NaAc) = 0.009101 S •m 2•mol -1,∞m λ(NaCl)= 0.012645 S •m 2•mol -1,则∞m λ(HAc) = S •m 2•mol -1;在此温度测得50mol •m -3的HAc 的电导率为3.68×10-2 S •m -1,则该溶液的摩尔电导率m λ= S •m 2•mol -1,解离度α= 。
2.已知CO 分子的转动惯量I = 1.449×10-46kg •m 2,振动频率ν= 65.05×1012s -1,普朗克常数h = 6.626×10-34 J •s ,玻尔兹曼常数k = 1.38×10-23 J •K -1,则CO 分子的转动特征温度r Θ= K ,振动特征温度v Θ= K 。
3.在体积为V 的立方容器中有极大数目的三维平动子,其平动能级的能量与三个平动量子数的关系为kT n n n z y x )(1.0222t ++=ε,则该系统在平衡时,17)(222=++z y x n n n 时平动能级的简并度为 ,该能级上粒子的分布数与基态能级上粒子的分布数之比0/n n 为 。
4.物理吸附的吸附力是 ,吸附分子层是 层。
5.溶液的表面张力随溶质的浓度增加而增加,则溶液的表面吸附使得溶质的在表面层的浓度c B (表面)与溶质的在本体的浓度c B (本体)的关系为c B (表面) c B (本体)。
(选填 “>”,“<”,“=”)6.恒温下,微小晶体的溶解度 普通晶体的溶解度。
武汉理工大学物理化学下 期末考试试卷

武汉理工大学考试试题纸( A 卷)课程名称 物理化学( 下) 专业班级题号 一 二三 四 五 六 七 八 九 十 总分 题分12 4012121212100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一.选择题(12分,每题2分)1. 如图:, 在毛细管中装入水,如果在左端加热, 毛细管中的水将( )A. 保持不变B. 向左移动C. 来回移动D. 向右移动2. 将2 滴 K 2[Fe(CN)4]水溶液滴入过量的CuCl 2水溶液中形成亚铁氰化铜正溶液,下列三种电解质聚沉值最大的是A. KBrB. K 2SO 4C. K 4[Fe(CN)6] D . Na 3PO 43. 298K 时,电池反应H 2(g) +21O 2(g) ===H 2O(l) 所对应的电池标准电动势E 1,反应 2 H 2O(l) === 2 H 2(g) + O 2(g) 所对应的电池标准电动势E 2,E 1和E 2的关系为 A. E 2= -2 E 1 B. E 2=2 E 1 C. E 2= - E 1 D. E 2= E 14. 在统计热力学中,若按组成子能否被分辨来对系统分类,那么A. 气体与晶体均属定域子系统B. 气体与晶体均属离域子系统C. 气体属定域子系统,而晶体属离域子系统D.气体属离域子系统,而晶体属定域子系统5. 一定量纯理想气体等温变压时,在分子运动的各配分函数中与压力有关的是: A. 电子运动的配分函数 B. 平动配分函数 C. 转动配分函数 D. 振动配分函数6. 对于任意给定的化学反应A +B −→−2Y ,则在动力学研究中:( )A. 表明它为二级反应B. 表明了它是双分子反应C. 表明了反应物与产物分子间的计量关系D. 表明它为基元反应二.填空题(40分,每空2分)1. 含有0.3 mol ·kg -1KNO 3及0.2 mol ·kg-1的K 2SO 4水溶液的离子强度I =⎽⎽⎽⎽⎽⎽⎽⎽。
2013年湖北卷理综化学高考试卷(原卷 答案)

绝密★启用前2013年普通高等学校招生全国统一考试(湖北卷)理综化学本试卷共13题,共100分。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题1.(6分)化学无处不在,与化学有关的说法不正确的是()A.侯氏制碱法的工艺过程中应用了物质溶解度的差异B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物D.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成2.(6分)香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是()A.香叶醇的分子式为C10H18OB.不能使溴的四氯化碳溶液褪色C.不能使酸性高锰酸钾溶液褪色D.能发生加成反应不能发生取代反应3.(6分)短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是()A.W2﹣、X+B.X+、Y3+C.Y3+、Z2﹣D.X+、Z2﹣4.(6分)银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl5.(6分)已知K sp(AgCl)=1.56×10﹣10,K sp(AgBr)=7.7×10﹣13,K sp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol•L﹣1,向该溶液中逐滴加入0.010mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A.Cl﹣、Br﹣、CrO42﹣B.CrO42﹣、Br﹣、Cl﹣C.Br﹣、Cl﹣、CrO42﹣D.Br﹣、CrO42﹣、Cl﹣6.(6分)分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有()A.15种B.28种C.32种D.40种三、非选择题(包括必考题和选考题两部分.第22题~第32题为必考题,每个试题考生都必须作答.第33题~第40题为选考题,考生根据要求作答)8.(13分)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.回答下列问题:(1)装置b的名称是.(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).A.立即补加B.冷却后补加C.不需补加D.重新配料(3)本实验中最容易产生的副产物的结构简式为.(4)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).(5)分离提纯过程中加入无水氯化钙的目的是.(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有(填正确答案标号).A.蒸馏烧瓶B.温度计C.吸滤瓶D.球形冷凝管E.接收器(7)本实验所得到的环己烯产率是(填正确答案标号).A.41%B.50%C.61%D.70%9.(15分)锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等.充电时,该锂离子电池阴极发生的反应为6C+xLi++xe﹣═Li x C6.现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).回答下列问题:(1)LiCoO2中,Co元素的化合价为.(2)写出“正极碱浸”中发生反应的离子方程式.(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式;可用盐酸代替H2SO4和H2O2的混合液,但缺点是.(4)写出“沉钴”过程中发生反应的化学方程式.(5)充放电过程中,发生LiCoO2与Li1﹣x CoO2之间的转化,写出放电时电池反应方程式.(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是.在整个回收工艺中,可回收到的金属化合物有(填化学式).10.(15分)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:(Ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ•mol﹣1(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49.0kJ•mol﹣1水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2(g)△H3=﹣41.1kJ•mol﹣1二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=﹣24.5kJ•mol﹣1回答下列问题:(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一.工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示).(2)分析二甲醚合成反应(Ⅳ)对于CO转化率的影响.(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响.(4)有研究者在催化剂(含Cu﹣Zn﹣Al﹣O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是.(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW•h•kg﹣1).若电解质为酸性,二甲醚直接燃料电池的负极反应为,一个二甲醚分子经过电化学氧化,可以产生个电子的能量;该电池的理论输出电压为1.20V,能量密度E=(列式计算.能量密度=电池输出电能/燃料质量,1kW•h=3.6×106J).11.(15分)[化学﹣选修2:化学与技术]草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸(含2个结晶水)的工艺流程如下:回答下列问题:(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、.(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和,滤渣是.(3)工艺过程中③和④的目的是.(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸.该方案的缺点是产品不纯,其中含有的杂质主要是.(5)结晶水合草酸成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水中,用0.0500mol•L﹣1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为;列式计算该成品的纯度.12.(15分)[化学﹣选修3:物质结构与性质]硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:(1)基态Si原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为、电子数为.(2)硅主要以硅酸盐、等化合物的形式存在于地壳中.(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子.(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为.(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是.②SiH4的稳定性小于CH4,更易生成氧化物,原因是.(6)在硅酸盐中,SiO四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为,Si与O的原子数之比为,化学式为.13.(15分)[化学﹣选修5:有机化学基础]査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:已知以下信息:①芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水.②C不能发生银镜反应.③D能发生银镜反应、可溶于饱和Na2CO3溶液、核磁共振氢谱显示有4种氢.④⑤RCOCH3+RˊCHO RCOCH=CHRˊ回答下列问题:(1)A的化学名称为.(2)由B生成C的化学方程式为.(3)E的分子式为,由E生成F的反应类型为.(4)G的结构简式为.(5)D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为.(6)F的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为(写结构简式).2013年普通高等学校招生全国统一考试(湖北卷)理综化学(参考答案)一、选择题1.【分析】A.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出;B.浓盐酸易挥发,与NH3结合生成NH4Cl固体;C.补碘常在食盐中加入KIO3固体而不是高碘酸;D.硫磺、硝石、木炭三种物质比例为1:2:3.【解答】解:A.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,发生以下反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,故A正确;B.浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟,故B正确;C.碘是人体必需元素,补碘常在食盐中加入KIO3固体而不是高碘酸,高碘酸为强酸性,具有强烈刺激性和腐蚀性,故C错误;D.制备黑火药的原料为S、KNO3、C,三者比例为1:2:3,故D正确.故选C.2.【分析】由结构可知分子式,分子中含碳碳双键、﹣OH,结合烯烃、醇的性质来解答.【解答】解:A.由结构可知香叶醇的分子式为C10H18O,故A正确;B.含碳碳双键,能使溴的四氯化碳溶液褪色,故B错误;C.含碳碳双键、﹣OH,均能使酸性高锰酸钾溶液褪色,故C错误;D.含碳碳双键可发生加成反应,含﹣OH可发生取代反应,故D错误;故选A.3.【分析】根据答案选项可知W、X、Y、Z形成的简单离子分别为W2﹣、X+、Y3+、Z2﹣,又知W、X、Y、Z均为短周期元素,且原子序数依次增大,故可推出W为O,X为Na,Y为Al,Z为S.【解答】解:根据短周期元素W、X、Y、Z的原子序数依次增大及各选项可以推出,W为O2﹣、X为Na+、Y为Al3+、Z为S2﹣,Al3+和S2﹣均能发生水解,水解打破了水的电离平衡;O2﹣不能在水溶液存在,而Na+不水解,故正确的是C;故选C.4.【分析】铝、银和电解质溶液构成原电池,铝作负极,银作正极,负极上铝失电子发生氧化反应,正极上银离子得电子发生还原反应,据此分析解答.【解答】解:A.银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银,所以银器质量减小,故A错误;B.银作正极,正极上Ag2S得电子作氧化剂,在反应中被还原生成单质银,故B正确;C.Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3,Al2S3+6H2O=2Al(OH)3↓+3H2S↑故C错误;D.黑色褪去是Ag2S转化为Ag而不是AgCl,故D错误;故选B.5.【分析】析出沉淀时,AgCl溶液中c(Ag+)==mol/L,AgBr溶液中c(Ag+)==mol/L,Ag2CrO4溶液中c(Ag+)==mol/L,c(Ag+)越小,则越先生成沉淀.【解答】解:析出沉淀时,AgCl溶液中c(Ag+)==mol/L=1.56×10﹣8mol/L,AgBr溶液中c(Ag+)==mol/L=7.7×10﹣11mol/L,Ag2CrO4溶液中c(Ag+)==mol/L=3×10﹣5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br﹣、Cl﹣、CrO42﹣,故选C.6.【分析】分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,判断形成该酯的羧酸与醇的同分异构体种数,根据羧酸与醇组合,计算同分异构体数目.【解答】解:分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,属于饱和一元酯,若为甲酸和丁醇酯化,丁醇有4种;若为乙酸和丙醇酯化,丙醇有2种;若为丙酸和乙醇酯化,丙酸有1种;若为丁酸和甲醇酯化,丁酸有2种;故羧酸共有5种,醇共有8种,酸和醇重新组合可形成的酯共有5×8=40种,故选D.7.【分析】A.乙醇和水混溶,不能用作萃取剂;B.乙酸乙酯和乙醇混溶,不能用分液的方法分离;C.应利用二者溶解度随温度的变化不同分离;D.丁醇和乙醚的沸点不同,可用蒸馏的方法分离.【解答】解:A.乙醇和水混溶,不能用作萃取剂,应用四氯化碳或苯萃取,故A错误;B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,应用蒸馏的方法分离,故B错误;C.根据二者在水中随温度升高而溶解度不同,利用重结晶法.NaCl随温度升高溶解度变化不大,KNO3随温度升高溶解度变化大,经冷却过滤,故C错误;D.丁醇和乙醚混溶,但二者的沸点不同,且相差较大,可用蒸馏的方法分离,故D正确.故选D.三、非选择题(包括必考题和选考题两部分.第22题~第32题为必考题,每个试题考生都必须作答.第33题~第40题为选考题,考生根据要求作答)8.【分析】(1)装置b是冷凝器;(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;(5)无水氯化钙用于吸收产物中少量的水;(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=×100%=61%.【解答】解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置,故答案为:直形冷凝器;(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故答案为:防止暴沸;B;(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚,;故答案为:(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,故答案为:检漏;上口倒出;(5)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,故答案为:干燥;(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,故答案为:CD;(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=×100%=61%,故答案为:61%.9.【分析】(1)根据化合物中,化合价的代数和为0判断;(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;(5)放电时,Li1﹣x CoO2和Li x C6发生氧化还原反应生成LiCoO2和C;(6)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动,在整个回收工艺中,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4.【解答】解:(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价,故答案为:+3;(2)正极中含有铝,铝易溶于强碱溶液生成AlO2﹣,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,且引入氯离子杂质,在后续步骤中难以分离,故答案为:2LiCoO2+H2O2+3H2SO4Li2SO4+2CoSO4+O2↑+4H2O;有氯气生成,污染较大,引入氯离子杂质,在后续步骤中难以分离;(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;(5)充放电过程中,Li1﹣x CoO2和Li x C6发生氧化还原反应生成LiCoO2和C,反应方程式为:Li1﹣x CoO2+Li x C6=LiCoO2+6C,故答案为:Li1﹣x CoO2+Li x C6=LiCoO2+6C;(6)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4,故答案为:Li+从负极中脱出,经由电解质向正极移动并进入正极材料中;Al(OH)3、CoCO3、Li2SO4.10.【分析】(1)铝土矿制备较高纯度Al2O3的主要工艺流程是利用氧化铝是两性氧化物溶于碱生成四羟基合铝酸钠,溶液中通入过量二氧化碳生成氢氧化铝沉淀,加热分解得到氧化铝;(2)二甲醚合成反应(Ⅳ)对于CO转化率的影响,结合甲醇合成反应,水煤气变换反应和化学平衡移动原理分析判断;(3)依据热化学方程式和盖斯定律计算得到,依据计算得到的反应结合化学平衡移动原理分析判断增大压强的影响;(4)依据化学平衡特征和平衡移动原理分析;(5)燃料电池中燃料在负极上失电子发生氧化反应,书写电极反应,计算电子转移;依据能量密度=电池输出电能/燃料质量列式计算.【解答】解:(1)铝土矿制备较高纯度Al2O3的主要工艺流程,利用氧化铝是两性氧化物溶于碱生成四羟基合铝酸钠,溶液中通入过量二氧化碳生成氢氧化铝沉淀,加热分解得到氧化铝;反应娥化学方程式为:Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4;NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3;2Al(OH)3Al2O3+3H2O,故答案为:Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4;NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3;2Al(OH)3Al2O3+3H2O;(2)二甲醚合成反应(Ⅳ)对于CO转化率的影响,消耗甲醇,促进甲醇合成反应(Ⅰ)CO(g)+2H2(g)═CH3OH (g)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2(g)消耗部分CO,故答案为:消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO;(3)Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ•mol﹣1Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=﹣24.5kJ•mol﹣1依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=﹣204.7kJ•mol﹣1该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加,故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=﹣204.7kJ•mol﹣1;该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大;(4)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡左移;(5)若电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O﹣12e﹣=2CO2+12H+;一个二甲醚分子经过电化学氧化失去12个电子,能量密度=电池输出电能/燃料质量,该电池的理论输出电压为1.20V,能量密度E==8.39KW•h•kg﹣1,故答案为:CH3OCH3+3H2O﹣12e﹣=2CO2+12H+;12;=8.39KW•h•kg﹣1.11.【分析】(1)根据反应物、生成物和反应条件写出反应方程式;(2)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物;(3)循环利用的物质能降低成本,减少污染;(4)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质;(5)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度.【解答】解:(1)根据流程图知,200℃、2MPa条件下,一氧化碳和氢氧化钠反应生成甲酸钠,反应方程式为:CO+NaOHHCOONa,加热条件下,甲酸钠脱氢生成草酸钠和氢气,反应方程式为:2HCOONa Na2C2O4+H2↑,故答案为:CO+NaOH HCOONa,2HCOONa Na2C2O4+H2↑;(2)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,所以过滤操作①的滤液是氢氧化钠溶液,滤渣是CaC2O4,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物,该操作过程中,稀硫酸过量,所以过滤操作②的滤液是H2C2O4溶液、H2SO4溶液,滤渣是CaSO4,故答案为:NaOH溶液,CaC2O4 ,H2C2O4溶液、H2SO4溶液,CaSO4;(3)氢氧化钠和硫酸都具有腐蚀性,能污染环境,分别循环利用氢氧化钠和硫酸能降低成本,减小污染,故答案为:分别循环利用氢氧化钠和硫酸能降低成本,减小污染;(4)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质,存在于溶液中,所以含有的杂质主要是Na2SO4,故答案为:Na2SO4;(5)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4﹣+6H+=10CO2↑+2Mn2++8H2O,设草酸的物质的量为xmol,则:5H2C2O4+6H++2MnO4﹣=10CO2↑+2Mn2++8H2O5mol 2molx 0.0500mol•L﹣1×0.015L所以,5mol:2mol=x:0.0500mol•L﹣1×0.015L解得x=0.001875mol,故其纯度=×100%=94.5%,故答案为:94.5%.12.【分析】(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2);(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在;(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合;利用均摊法计算;(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2;(5)①烷烃中的C﹣C键和C﹣H键大于硅烷中的Si﹣Si键和Si﹣H键的键能;②键能越大、物质就越稳定,C﹣H键的键能大于C﹣O键,故C﹣H键比C﹣O键稳定,而Si﹣H键的键能远小于Si ﹣O键,所以Si﹣H键不稳定而倾向与形成稳定性更强的Si﹣O键;(6)硅酸盐中的硅酸根(SiO)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32﹣;【解答】解:(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d 能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2);故答案为:M;9;4;(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在,故答案为:二氧化硅(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合.硅晶胞中每个顶点上有1个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数=6×=3,故答案为:共价键;3;(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2,故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;(5)①烷烃中的C﹣C键和C﹣H键大于硅烷中的Si﹣Si键和Si﹣H键的键能,所以硅烷中Si﹣Si键和Si﹣H键的键能易断裂,导致长链硅烷难以生成,故答案为:C﹣C键和C﹣H键较强,所形成的烷烃稳定,而硅烷中Si﹣Si键和Si﹣H键的键能较低,易断裂,导致长链硅烷难以生成;②键能越大、物质就越稳定,C﹣H键的键能大于C﹣O键,故C﹣H键比C﹣O键稳定,而Si﹣H键的键能远小于Si ﹣O键,所以Si﹣H键不稳定而倾向与形成稳定性更强的Si﹣O键;故答案:C﹣H键的键能大于C﹣O键,C﹣H键比C﹣O键稳定.而Si﹣H键的键能却远小于Si﹣O键,所以Si﹣H 键不稳定而倾向于形成稳定性更强的Si﹣O键;(6)硅酸盐中的硅酸根(SiO)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;故答案为:sp3根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32﹣;故答案为:1:3;SiO32﹣;13.【分析】芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水,72g水的物质的量=,所以1个A分子中含有8个氢原子,A能和水发生加成反应,则A中含有碳碳双键,B中含有羟基,B被氧化后生成C,C不能发生银镜反应,则C中不含醛基,则C中含有羰基,结合A的相对分子质量知,A是苯乙烯,B的结构简式为:,C的结构简式为:;D能发生银镜反应说明D中含有醛基,可溶于饱和Na2CO3溶液说明D中含有羧基或酚羟基,核磁共振氢谱显示有4种氢,说明D含有四种类型的氢原子,结合D的分子式知,D是对羟基苯甲醛,D和氢氧化钠溶液反应生成E,E的结构简式为:,和碘烷反应生成F,F的结构简式为:,C和F反应生成G,结合题给信息知,G的结构简式为:.【解答】解:芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水,72g水的物质的量=,所以1个A分子中含有8个氢原子,A能和水发生加成反应,则A中含有碳碳双键,B中含有羟基,B被氧化后生成C,C不能发生银镜反应,则C中不含醛基,则C中含有羰基,结合A的相对分子质量知,A是苯乙烯,B的结构简式为:,C的结构简式为:;D能发生银镜反应说明D中含有醛基,可溶于饱和Na2CO3溶液说明D中含有羧基或酚羟基,核磁共振氢谱显示有4种氢,说明D含有四种类型的氢原子,结合D的分子式知,D是对羟基苯甲醛,D和氢氧化钠溶液反应生成E,E的结构简式为:,和碘烷反应生成F,F的结构简式为:,C和F反应生成G,结合题给信息知,G的结构简式为:.(1)通过以上分析知,A是苯乙烯,故答案为:苯乙烯;(2)在加热、铜作催化剂条件下,B被氧气氧化生成C,反应方程式为:,故答案为:;(3)通过以上分析知,E的分子式为:C7H5O2Na,E发生取代反应生成F,故答案为:C7H5O2Na;取代反应;。
武汉理工大学 12大学物理A下试卷A
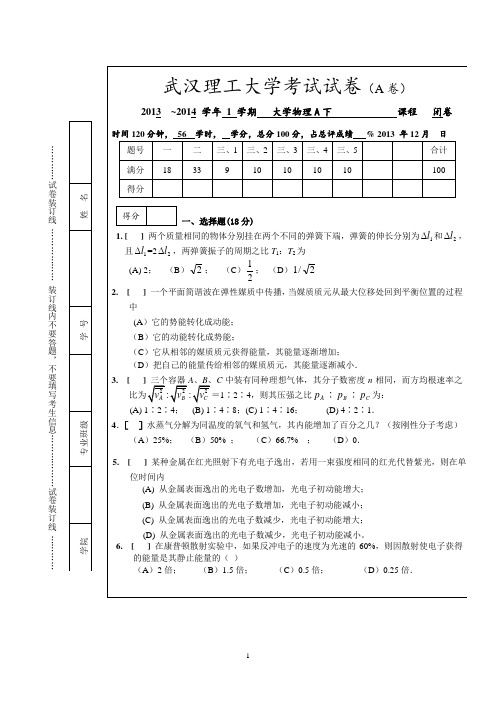
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………=1A10的不J s)一物体质量为时假设样品均匀伸长而石英容器基本不变形,涉条纹在视场中平移过…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线……………………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………(n≥0, x a武汉理工大学教务处试题标准答案及评分标准用纸课程名称 大学物理(A 下) ( A 卷)一、选择题(每题3分,共18分)(B) (C) (C) (A) (B) (D)二、填空题(每题3分,共33分) 1.242s; 113π. (答对一个给2分,答对二个给3分) 2. 00cos m; cos m x x x x A t A t u u ωϕωϕ⎡-⎤⎡-⎤⎛⎫⎛⎫-+++ ⎪ ⎪⎢⎥⎢⎥⎝⎭⎝⎭⎣⎦⎣⎦(对一个给2分,对二个给3分) 3. (1)100()d ∞⎰Nf v v ; (2)100100()d ()d ∞∞⎰⎰vf v v f v v; (3)100()d ∞⎰f v v4. 氧气; 1T (对一个给2分,对二个给3分)5. 3J6. 变为暗条纹7. 38.9410⨯ 8. 2;14 9.hcλ;h λ; h cλ 10.11. 250cm三、计算题1. 解:(1) 221kA E E E p K =+= 2/1]/)(2[k E E A p K +== 0.08 m 3分(2)222121v m kx = )(sin 22222φωωω+=t A m x m)(sin 222φω+=t A x 2222)](cos 1[x A t A -=+-=φω222A x =,0.06x A =±=± m 3分 (3) 过平衡点时,x = 0,此时动能等于总能量221v m E E E p K =+= 1/2v [2()/]0.8K p E E m =±+=± m/s 3分2. 解:取S 1、S 2连线及延长线为x 轴,向右为正,以S 1为坐标原点.令l S S =21.(1) 先考虑x < 0的各点干涉情况.取P 点如图.从S 1、S 2分别传播来的两波在P 点的相位差为|)]|(2[||2201021x l x +π--π-=-λφλφφφl λφφπ+-=22010l uνφφπ+-=22010= 6 π ∴ x < 0各点干涉加强.(2) 再考虑x > l 各点的干涉情况.取Q 点如图.则从S 1、S 2分别传播的两波在Q 点的相位差为 )](2[2201021l x x -π--π-=-λφλφφφl λφφπ--=22010l uνφφπ--=22010= 5 π ∴ x > l 各点为干涉静止点. 3分(3) 最后考虑0≤x ≤11 m 范围内各点的干涉情况.取P ′点如图.从S 1、S 2分别传播来的两波在P ′点的相位差为)](2[2201021x l x -π--π-=-λφλφφφl x λλφφπ+π--=242010l x u νλνφφπ+π--=2220102112π+π-π=x 3分 由干涉静止的条件可得π+=π+π-π)12(2112k x ( k = 0,±1,±2,…) 2分 ∴ x = 5-2k ( -3≤k ≤2 )即 x = 1,3,5,7,9,11 m 为干涉静止点. 2分3. 解:(1) 向左移动; 2分 (2) 为k N -级明条纹; 2分 (3) 升温前,k 级明纹处22e k λδλ=+=升温后,原k 级明纹处()()22e L k N λδλ'=-∆+=-两式相减得 2L N λ∆= 4分(4) 线胀系数()0002L N L t L t t λβ∆==∆- 2分 4. 解:(1) a +b = (1 / 300) mm = 3.33 μm 1分(2) (a + b ) sin ψ =k λk λ= (a + b ) sin24.46°= 1.38 μm∵λR =0.63~.76 μm ;λB =0.43~0.49 μm∴ 对于红光,取k =2 , 则 λR =0.69 μm 2分对于蓝光,取k =3, 则 λB =0.46 μm 1分(3) 红光最大级次k max = (a + b ) / λR =4.81分蓝光最大级次 k max = (a + b ) / λB =7.2 1分(4) 取k max =4则红光的第4级与蓝光的第6级还会重合.设重合处的衍射角为ψ' , 则()828.0/4sin =+='b a R λψψ'=55.9° 2分(5) 红光的第二、四级与蓝光重合,且最多只能看到四级,所以纯红光谱的第一、三级将出现.()207.0/sin 1=+=b a R λψ ψ1 = 11.9° 1分()621.0/3sin 3=+=b a R λψ ψ3 = 38.4° 1分5. 解:(1) 根据波函数的归一化条件,有()22d sin d 1an n x x x A x aπψ∞-∞==⎰⎰由此得A = 3分 归一化波函数为:0() 0 0, n n x x a x ax x a ψ=≤≥⎩π1分 (2) ()222s i n x p x a a ψ2π==()d 30, 0,,,,d 424p x a a ax a x == 2分 其中 3,44a ax = 为极大值处 2分(3) ()222d d s i n d x P x x x a aψ2π== 粒子位于0 – a /4内的概率为:/4202sin d a x P x a a 2π=⎰/4202sin d()a a x xa a a2π2π=2π⎰/411214[sin ]24a x xa a πππ=-10.254== 2分。
武汉理工大学有机化学参考答案

环境科学专业本科培养计划Undergraduate Program for Specialty in EnvironmentalScience一、业务培养目标ⅠEducational Objectives本专业培养具备环境科学的基本理论、基本知识和基本技能,具有较强的适应能力、实干精神和创新意识,能在科研机构、高等学校、企事业单位及行政部门等从事环境方面的科研、教学、管理等工作的高级专门人才。
The program in environmental science is designed to provide students an integrated education, which helps students to develop the basic knowledge and capabilities, and prepares them to be advanced environmental science personnel with high adaptability and creative consciousness. Students will be well-prepared for careers in academic institutions, educational institutions, and private and government agencies.二、业务培养要求ⅡEducational Requirement本专业学生主要学习环境科学方面的基本理论、基础知识和基本技能,受到基础研究和应用基础研究方面的科学思维和科学实验的训练,培养较好的科学素养,有较强的自学能力和分析解决环境问题的能力,具备一定的教学、研究、开发和管理能力。
毕业生应获得以下几方面的知识和能力:1. 掌握数学、物理、化学和微生物等方面的基本理论和基本知识;2. 掌握环境科学与管理的基本理论、基本知识和基本技能;3. 熟悉国家环境保护、自然资源合理利用、可持续发展、知识产权等有关政策和法规;4. 具有一定的实验设计能力,以及分析整理实验结果的能力;5. 具有撰写科技报告的能力;6. 掌握资料查询、文献检索及运用现代信息技术获取相关信息的基本方法。
201X大学物理C试题(A卷,含答案)

…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………A B A B6、对已知动能的电子,其德布罗意波长可以计算出来;按非相对论情形计算获得的德布罗意波,比起按相对论情形考虑的计算结果会 [ ] (A )大; (B )小; (C )相同; (D )不能确定。
7、将波函数在空间各点的振幅同时增大C 倍,则微观粒子在空间的分布的概率密度将 [ ] (A )增大C 倍; (B )增大2C 倍; (C )增大2C 倍; (D )不变。
二、填空题(每小题3分,小计21分)1、在单位矢量为(,,)x y z e e e r r r的直角坐标系下,质量为 1 kg m =的质点在某外力的作用下运动,运动方程为()2()2x y r t t e te =+rrr(采用SI 单位制),则 1 s t =时该质点的角动量(对原点)为L =r____________2-1(kg m s )⋅⋅,第2秒内该外力对质点所做的功为_______________。
2、两个静质量都为0m 的粒子分别以速率45c 和 35c (c 为真空中光速)沿同一直线对撞后合成为一个粒子,则该合成粒子的动量大小为____________,质量M 为_____________。
3、半径为1R 的金属球1带电1Q ,半径为2R 的金属球2带电2Q ,相距很远。
现在用导线将两球连接,则达到静电平衡时两球所带的电量分别为1Q '=_____________,2Q '=____________。
4、通有电流I 的长直导线附近放一处在同一平面的单匝线圈,其边 长分别为a 和b ,平行于导线的一边到导线的距离为d (如图), 则到导线垂直距离为r 处的磁感应强度大小为_______________, 通过矩形线圈的磁通量为______________________。
5、不考一个平行板电容器的两极板都是半径为r 的圆形导体,两极板通过导线与交流电源连接;如果极板间电场强度大小的变化率为dE dt ,忽略边缘效应,则两极板间的位移电流强度为_________________,此时流经导线的传导电流是_________________(真空静电常数为0ε)。
2014大学物理B试题(A卷,含答案)

(1)
SOBCO =
3 2 π dB 3 3 + π 2 R , SOA′BO = R 2 , ε ABC = −ε = R 4 12 dt 12
方向从 A 指向 C,C 端电势高 (2) 下移时,杆上电动势减小。
8
[ ]
一 21
二 21
三、1 10
三、2 9
三、3 9
三、4 10
三、5 10
三、6 10
合计 100
…………试卷装订线 ……………… 装订线内不要答题,不要填写考生信息………………试卷装订线 …………
1、一个质点在做匀速率圆周运动时
(A)切向加速度改变,法向加速度也改变. (B)切向加速度不变,法向加速度改变. (C)切向加速度不变,法向加速度也不变. (D)切向加速度改变,法向加速度不变. 2、 一质量为 M 的均质细杆自然垂挂于 O 点,可绕过 O 点的水平轴转动。现有质量为 m 的子弹 水平射入杆的下端并留在杆中,则在射入过程中,由子弹与杆组成的系统 学 号 (A)动量守恒 (B)机械能守恒 (D)动量、机械能和角动量都守恒 [ ]
2 a) , 对应的能量本征值为 En = ( nπ = a ) 2m , 则基态下在 x = ______
− v v0
,则该气体分子的最可
处发现粒子的概率最大,第一激发态下该粒子出现在 [ a
4 ,3a 4] 区间的概率为________。
2
三、计算题(共 6 题,小计 58 分) 计算题 得分 1、 (10 分)质量为 m 的质点受到力 F = − kvx (其中 k 为常数)的作用沿
平衡状态下的平均动能,则其德布罗意波长为________________(普朗克常数为 h )。 6、质量为 m 的某种气体分子,其速率 v 的分布密度函数正比于 ve 几速率为_______,平均平动动能为___________。 7、质量为 m 微观粒子被约束在 0 < x < a 的一维无限深势阱中,处于量子数为 n 的定态波函 数正比于 sin(nπ x
武汉理工大学物理化学期末考试试卷

β µA
α B. µ A <
β µA
α C. µ A =
β µA
D.
α β µA = µB
3.理想气体等温自由膨胀过程的 . A.Q > 0 B.∆U < 0 C.W < 0 D.∆H = 0 4.对于只作膨胀功的封闭系统(∂A/∂T)V 的值是 . A.大于零 B.小于零 C.等于零 D.不能确定 * * 5.在温度为 T 时,纯液体组分 A 和 B 的饱和蒸气压分别为 pA 和 pB ,且 pB*=3 pA*,若组分 A 和 B . 形成理想液态混合物,当气液两相平衡时,气相中组分 A 和 B 的物质的量相等。则组分 A 和 B 在液相中的摩尔分数各应是 A.xA=0.5 B.xA=3/4 C.xA=1/4 D.不能确定
1.314.5 kJ . 2.(K1 / K2 )2 . 3.2,2 . 4.dS≥ .
δQ
T环
,不可逆
5. − .
∂V nR ,− p ∂T P
6.712.1,35.8 . 7.降低,升高,或降低或升高 .
二、选择填空题(30 分,每题 2 分) 选择填空题(
1.D . 11.B . 2.A . 12.B . 3.D . 13.D . 4.B . 14.C . 5.B . 15.D . 6.B . 7.D . 8.C . 9。C 。 10。B 。
(7 分) (1 分) (1 分)
∆U = ∆H = 0 ∆S = nRln(p1/p2) = 13.4J/K ∆A = ∆G =-T∆S =-4014.3J
∂∆ G (10 分)(1)∵ r m 五、 ( ∂T = −∆ r S m p
(1 分) (1 分) (1 分)
武汉理工大学物理化学下 期末考试试卷

课程名称:物理化学A4(下)题号一二三四五六七八九十总分题分342012*********(HAc) = S?m= S?m=。
= K时平动能级的简并度为,为。
.物理吸附的吸附力是,吸附分子层是层。
) c.恒温下,微小晶体的溶解度普通晶体的溶解度。
效应是光的引起的,其强度与入射光的波长的。
溶胶的胶团结构式为,胶粒在电场中向极移动。
)为。
1.要使浓差电池 Pb(Hg)(a 1)|Pb(NO 3)2水溶液| Pb(Hg)(a 2)的电动势大于零,则铅汞齐中铅的活度a 1 a 2 A) > B) = C) < D) (A 、B 、C )都可能2.在有电流流过电极时,原电池正极的电极电势随电流密度的增加而 ,电解池阳极的电极电势随电流密度的增加而 。
A) 上升、上升 B) 上升、下降 C) 下降、上升 D) 下降、下降 3.下列说法正确的是 。
A) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式不同;B) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式相同; C) 系统的熵与能量零点的选择无关,且定域子与离域子的计算公式相同; D) 系统的熵与能量零点的选择有关,且定域子与离域子的计算公式不同。
4.用?dm -3的KBr 和?dm -3的AgNO 3溶液以等体积混合制成的水溶胶,聚沉能力最强的电解质为 。
A) KCl B) K 2SO 4 C) MgSO 4 D) FeCl 35.在带有活塞的玻璃U 形管两端端口形成了一大一小的两个肥皂泡,如图所示,当打开U 形管的活塞时,则发生A) 大肥皂泡变小,小肥皂泡变大,直到两泡体积相等; B) 大肥皂泡变大,小肥皂泡变小,直到小泡消失; C) 大肥皂泡变大,小肥皂泡变小,直到两泡曲率半径相等; D) 大肥皂泡不变,小肥皂泡变大,直到与大泡体积相等。
6.一反应的半衰期与反应物的初始浓度成反比,则下列关系正确的是 。
A) 反应物的浓度c 与时间t 成线性关系;B) 反应物的浓度的对数ln c 与时间t 成线性关系; C) 反应物的浓度的倒数1/c 与时间t 成线性关系;D) 反应物的浓度的倒数的平方1/c 2与时间t 成线性关系。
2014.07武汉理工大学物理B试卷A卷及答案1

…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………(共6页第1页)(共6页第2页);t时间内通过矩形线圈导线任一截面的电量.2(共6页第4页)(共6页第5页)得分7.(10分)观测者甲乙分别静止于两个惯性参考系S和S'中,甲测得在同一地点发生的两事件的时间间隔为 4s,而乙测得这两个事件的时间间隔为 5s.求:(1) S'相对于S的运动速度.(2)乙测得这两个事件发生的地点间的距离.(共6页第6页)(共6页 第7页)参考答案 一 CCDDD 二 1.22.0ln 2b d ad μπ+ 3.0ln 2I x a a xμπ+ 4.cos BS t ω,sin BS tRωω-5.5882.4 三1. 解:(1)由()2ˆˆ2192r tit j =+-得2x t = ,2192y t=-消去t 得轨道方程:21192y x =-(2)1ˆˆ217r i j =+ ,2ˆˆ411r i j =+ 2121ˆˆ26ˆˆ261r r i j v i j t t --===-- m/s(3)由()2ˆˆ2192r tit j =+-得ˆˆ24v i tj=- ,ˆ4a j =- 则16v t =+3.58dv a dtτ===≈ m/s 2 1.79n a =≈ m/s 22. 解:(1)由图知,波向左传播,则有x 0=0,v 0>0,所以,02πϕ=-。
由24Ts >知,8T>s ,而原点处质点,在0秒时振幅为0,2A ,则2秒内转过的角度为4πϕ∆=,所以=8πω,则O 点的振动方程为cos()82y A t ππ=-m(2)由24Ts >知,8T >s ,则2秒内波传播了20m ,所以 u=10ms -1,则波动方程为 cos 8102x y A t ππ⎡⎤⎛⎫=+- ⎪⎢⎥⎝⎭⎣⎦m(共6页 第8页)3. 解:过场点建立半径为r 的球形高斯面,场强在高斯面上的通量为24e SE dS E r πΦ=⋅=⋅⎰(1)r<R 时,先求高斯面包围的电量。
大学物理C试题A卷含答案

…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………()22x 2sin()n x a π2()2n E n a mπ=x =[3,23]a a…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线……………………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………武汉理工大学考试试题答案要点(A 卷)2013 ~2014 学年 2 学期 大学物理C 课程一、选择题(每题3分,小计21分) A B A A C A D二、填空题(每小题3分,小计21分)1、 0.5 z e -, 1.5 (J)2、0712m c , 03512m3、12112()Q Q R R R ++, 12212()Q Q R R R ++ 4、02I rμπ, 0ln 2Ia d b d μπ+⎛⎫⎪⎝⎭ 5、 20dE r dt επ, 20dE r dt επ 6、02C λλ+ , 00112)C hc λλλ⎛⎫- ⎪+⎝⎭ 7、 2a , 1 三、计算题1、(10分)根据牛顿第二定律 2dv m v x dtα=-, 注意到对一维情形 dv dv dx dv v dt dx dt dx == 带入前式并分离变量,得 mdv v xdx α=-00v x v dv xdx v m α=-⎰⎰ 故 220x m v v e α-=2、(9分)222m g T m a -=,11T m a =,21T R T R J β-=,a R β=,23J m R =212322()m g a m m m =++,12112322()m m gT m m m =++,1322123(2)2()m m m g T m m m +=++【注】如果[按文字]1m 与2m 颠倒,则1T 与2T 标称也对调,此时动力学式子中下标1与2对调,131222()g a m m m m =++,21112322()m m gm m m T =++,2123123(2)2()m g m m T m m m +=++3、(9分) 飞船系,0L t c'∆=。
大物A-武汉理工2013-2考试卷A 答案

E
3 0
(rA
rO
)
3 0
a
5、(10 分)(1)在导线内 r R
B
Ir 2 R2
在导线外 r R B I 2 r
(2) F
dF
l
RdL 0 I1I2 dx 0 I1I2 ln R d L
Rd 2x
2x
Rd
方向平行于 I1 (向上)
6、(10
分)(1)当 r
R
时,
Er
r 2
E
qr 4 0 r 3
2、 q0q 6 0 R
…
装 订
3、 B dS 0 , 磁场是无源场。
4、 I0et , (I0 0S)et
线
S
… … …
5、 0Q , 2 R
R2Q 4
6、 3 c ,
3c
2
2
…
…
三、计算题
…
装 订
1、(9 分)根据牛顿第二定律
m
dv dt
kv2 x
,
线 内 不
注意到对一维情形
… … … … … …
装
订
线
内
不
要
得分
2、(10 分)一飞船的固有长度为 L0 ,相对于地面作匀速直线运动的速度
答 题
,
大小为 u ,飞船上一人从飞船的后端向飞船前端的靶子发射一颗相对飞船速度为 v 的子弹, 不
求:(1)在飞船上测得子弹从射出到击中靶的时间间隔 t ;
要 填
(2)在地面上测得子弹从射出到击中靶的时间间隔 t 。
[]
(A)为 0 (B) 与 a 成正比 (C) 与 a 成反比 (D) 与 a2 成反比.
2015.06武汉理工大学普通化学试卷A

2014 ~2015 学年 2 学期 普通化学 课程 闭卷 时间 120 分钟,30 学时,2 学分,总分 100 分,占总评成绩 70% 2015 年 06 月 19 日 题号 满分 得分 名 得分 一 20 二 20 三 10 四 10 五 40 六 七 八 九 十 合计 100 …………
试 卷 装 订 线
………………
姓
一、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号
内。本大题共 20 分,共计 10 小题,每小题 2 分) 1.相同温度时,下列各种物质的溶液浓度均为 0.01 mol· L1,按照它们的渗透压递减的顺序 排列正确的是 (A)HAc - NaCl -C6H12O6 - CaCl2 (C)C6H12O6 - HAc - NaCl - CaCl2 2. 已知反应 NO(g) + CO(g) 学 号 (A)低温低压 3 .从 2 H I( g ) (B)CaCl2- NaCl - HAc - C6H12O6 (D)HAc - NaCl - CaCl2 - C6H12O6 ( (D)高温低压 ( ) ) ( )
+ 2
22. 原电池两极上进行氧化和还原反应。 因此, 总的原电池反应肯定是氧化还原反应。 (
25. 氢 键 只 存 在 于 NH3、 H2O、 HF 的 分 子 之 间 , 其它分子间不存在氢键。 (
得分
四、问答题(本大题共 10 分,共计 2 小题,每小题 5 分) (慢) 总反应 2H2O2 = 2H2O + O2
………………
…………
试 卷 装 订 线
………………
试 卷 装 订 线
…………
5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线………
…
…………试卷装
订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………姓
名
学
号
专
业
班
级
学
院
得分
五、计算题(12分)
某二元凝聚系统相图,如图所示,请回答:
(1)填出各相区存在的稳定相;
(2)用式子分别表示出QP及MN线上所进行的结晶过程;
(3)作熔体X的冷却曲线。
(4)从熔体X要想得到纯固体D,必须如何控制冷却温度?
相区ⅠⅡⅢⅣⅤⅥⅦ
稳定相
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线………
…
…………装订线………………装订线内不要答题,不要填写信息………………装订线…………
武汉理工大学考试试题答案(A卷)
2013 ~2014 学年2 学期物理化学C课程
一、选择题(20分)
1.B
2.C
3.B
4.D
5.B
6.D
7.C
8.B
9.B 10.A
二、填空题(20分)
答案:
三、计算题(12分)
解:2mol
n=,单原子理想气体的
,m
1.5
V
C R
=,
,m
2.5
p
C R
=
在此过程中因0
Q=,所以U W
∆=(2分)22211,21
(//)()
V m
p nRT p nRT p nC T T
--=-
所以
211
(1.50.2)/(1 1.5)204
T T T K
=++=(2分)
即:
,21
()2 1.58.314(204300) 2.39kJ
V m
U nC T T
∆=-=⨯⨯⨯-=-(2分)
2.39kJ
W U
=∆=-(2分)
,21
()2 2.58.314(204300) 3.99kJ
p m
H nC T T
∆=-=⨯⨯⨯-=-(2分)
22
,
11
-1
-1
ln ln
2040.2
(2 2.58.314ln28.314ln)J K
3001
10.73J K
p m
T p
S nC nR
T p
∆=-
=⨯⨯⨯-⨯⨯⋅
=⋅
(2分)
四、计算题(14分)
(1分)
1121,1K J 81.2K J )15
.26315
.273ln 184.40.1800.1(ln )l (--⋅=⋅⨯⨯⨯==∆T T nC S m p (1分)
()11
fus 2K J 1.2215
.273K J 7.3340.18--⋅-=⋅-⨯=∆=∆T H S m
(1分) 1112,3K J 41.1K J )15
.27315
.263ln 092.20.1800.1(ln )(--⋅-=⋅⨯⨯⨯==∆T T s nC S m p
(1分) 11321sys K J 20.7K J 1.41)22.1 2.81 ( --⋅=⋅=∆+∆+∆=∆---S S S S
(1分) ⎰=-⨯⨯⨯==∆1
2 1753J J )]263273(18.40.1800.1[d )1(T T p T C H
(1分) J 106.03J )]7.334(0.1800.1[3fus 2⨯-=-⨯⨯=∆=∆m H n H
(1分) ⎰-=-⨯⨯⨯==∆2
1
3377J J )]273263(092.20.1800.1[d )(T T p T s C H
(1分) J 105.65J )3771003.6753(33321⨯-=-⨯-=∆+∆+∆∆H H H H =
(1分) 113
amb amb amb amb amb K J 5.21K J 15
.2631065.5--⋅=⋅⨯=∆-=-==∆T H T Q T Q S p
(2分)
0K 0.8J K J )5.217.20(11amb sys iso >--⋅=⋅+-=∆+∆=∆S S S
(2分) 可以自发进行
(1分)
五、计算题(12分) (1)每个相区0.5分
(3.5分)
(2)QP 线上:()()s l D s A →+
(2分) MN 线上:()α+→s l D (2分) (3)省略:每个转折点0.5分
(2.5分)
(4)要想从熔体X 得到纯固体D ,必须控制冷却温度在两条三相线之间 (2分)
六、计算题(12分)
(1)()()()()()1H 1B r s Ag s AgB r KPa 100,H H Br
221==+-
+
++→+αα
g (2分) (2)m ol /KJ 88.6m r -=∆zFE G =-
(2分) ()Kmol /J 24.48m r -=∂∂∆p T E zF S =
(2分)
()KJ/mol 26.21m r =-=-p T E zF zFE H ∂∂+∆
(2分)
(3)()
-+=Br H ln /ααzF RT E E -
()2
2
Br H / b b ±±±-
+
γαααα===
4099.0=±γ
(2分) ()672.0/2
== b b ±±γα
(2分)
七、计算题(10分)
(1)因半衰期与乙醛的初始压力成反比,故为二级反应 (2分) (2) 34CH CHO(g)CH (g)+CO(g)→
t =0时 A,0p 0 0
t =t 时 A p A 0A p p -, A 0A p p -, A,0A 2p p p =-总
A A,02p p p =-总
A,0A 26.664kPa,30.531kPa,22.797kPa p p p ===总
1A A,01A A,0
511
11111()
111() 6.3610kPa s 100s 22.797kPa 26.664kPa
k t p p k t p p ---=+=-=
-=⨯⋅ (4分)
(3)这是阿累尼乌斯公式的应用,因21/2k k =,所以
2
211
11
31211ln 18.314J mol K ln 2791.15K 190400J 1.23710K 810.6K
a k R T T E k T ----=-⋅⋅=-⨯=⨯= (4分)。
