武汉理工大学物理化学下期末考试试卷
大学物理化学下_期末考试试卷

武汉理工大学考试试题纸( A 卷)课程名称 物理化学( 下) 专业班级题号 一 二三 四 五 六 七 八 九 十 总分 题分12 4012121212100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一.选择题(12分,每题2分)1. 如图:, 在毛细管中装入水,如果在左端加热, 毛细管中的水将( )A. 保持不变B. 向左移动C. 来回移动D. 向右移动2. 将2 滴 K 2[Fe(CN)4]水溶液滴入过量的CuCl 2水溶液中形成亚铁氰化铜正溶液,下列三种电解质聚沉值最大的是A. KBrB. K 2SO 4C. K 4[Fe(CN)6] D . Na 3PO 43. 298K 时,电池反应H 2(g) +21O 2(g) ===H 2O(l) 所对应的电池标准电动势E 1,反应 2 H 2O(l) === 2 H 2(g) + O 2(g) 所对应的电池标准电动势E 2,E 1和E 2的关系为 A. E 2= -2 E 1 B. E 2=2 E 1 C. E 2= - E 1 D. E 2= E 14. 在统计热力学中,若按组成子能否被分辨来对系统分类,那么A. 气体与晶体均属定域子系统B. 气体与晶体均属离域子系统C. 气体属定域子系统,而晶体属离域子系统D.气体属离域子系统,而晶体属定域子系统5. 一定量纯理想气体等温变压时,在分子运动的各配分函数中与压力有关的是: A. 电子运动的配分函数 B. 平动配分函数 C. 转动配分函数 D. 振动配分函数6. 对于任意给定的化学反应A +B −→−2Y ,则在动力学研究中:( )A. 表明它为二级反应B. 表明了它是双分子反应C. 表明了反应物与产物分子间的计量关系D. 表明它为基元反应二.填空题(40分,每空2分)1. 含有0.3 mol ·kg -1KNO 3及0.2 mol ·kg-1的K 2SO 4水溶液的离子强度I =⎽⎽⎽⎽⎽⎽⎽⎽。
物化试卷(B)

武汉理工大学考试试题纸(B 卷)备注:学生不得在试题纸上答题(含填空题、选择题等客观题一、单项选择题(1.5分×12题)1.某气体要其液化,则温度、压力必须满足:A.T >T c p >p c B.T >T c p <p c C.T <T c p >p c D.T <T c p <p c2.苯在一个刚性的绝热容器中燃烧,C 6H 6(l)+(15/2)O 2(g)=6CO 2(g)+3H 2O (g),则A.∆U =0,∆H <0,Q =0B.Q =0,∆U =0,∆H =0C.∆U =0,∆H >0,W =0D.Q =0,∆U ≠0,∆H ≠03.对于1mol 理想气体其等于()TVS∂∂A.R B.R /V C.0 D.-R /p4.液态水在25℃,p =23.76mmHg (25℃时水的饱和蒸气压)下蒸发为水蒸气(假定为理想气体)则A.ΔU =0 B.ΔH =0 C.ΔG =0 D.ΔS =05.B 物质在α相中浓度大于在β相中的浓度,当两相接触时:A.B 由α相向β相扩散 B.B 由β相向α相扩散 C.B 在两相中处于扩散平衡 D.无法确定6.放热反应2NO(g)+O 2(g)=2NO 2(g)达平衡后,若分别采取措施,能使平衡向产物方向移动的是:①增加压力;②减少NO 2的分压;③增加O 2分压;④升高温度;⑤加入催化剂A.①②③ B.②③④ C.③④⑤ D.①②⑤7.在下列体系中自由度F =2的体系是:A.298K 时,H 2O(l)、H 2O(g)共存 B.C 2H 5OH(l)与H 2O(l)的混合物C.S(s)、S(l)、S(g)共存 D.PCl 5(g)分解平衡时:PCl 5(g)=PCl 3(g)+Cl 2(g)8.下列电解质溶液的浓度都为0.01mol kg -1。
离子平均活度系数最小的是:A.ZnSO 4 B.CaCl 2 C.KCl D.H 2SO 49.电池Hg |Zn(a 1)|ZnSO 4(a 2)|Zn(a 3)|Hg 的电动势A.仅与a 1,a 3有关,与a 2无关 B.仅与a 1,a 2有关,与a 3无关C.仅与a 2,a 3有关,与a 1无关 D.与a 1,a 2,a 3均无关10.如图在毛细管中有一段液体柱,当毛细管左端加热时,管内液体A.向左移动 B.向右移动 C.不动 D.来回振荡11.今有反应CaCO 3(s)=CaO(s)+CO 2(g)在一定温度下达到平衡,现在不改变温度和CO 2的分压力,也不改变CaO(s)颗粒的大小,只降低CaCO 3(s)颗粒的直径,增加分散度,则平衡将A.向左移动 B.向右移动 C.不发生移动 D.无法判断12.某反应的等容反应的摩尔热力学能变∆U m =100kJ ·mol -1,则该反应的活化能A.必定等于或小于100kJ ·mol -1 B.必定等于或大于100kJ ·mol -1C.可以大于或小于100kJ ·mol -1 D.只能小于100kJ •mol -1课程名称物理化学专业班级题号一二三四五六七八九十总分题分183016131211100二、填空题(2分×15空)1.已知反应2H 2(g)+O 2(g)→2H 2O (l)在298K 时恒容反应热Q V =-564kJ/mol ,则H 2(g)在298K 时的标准摩尔燃烧焓∆c H m =()kJ/mol 。
《物理化学》下册期末考试试卷

《物理化学》下册期末考试试卷a 化学专业《物理化学》下册期末考试试卷(1)⼀、单项选择题(每⼩题2分,共30分)1、0.001 mol ·kg -1K 3[Fe(CN) 6] ⽔溶液的离⼦强度为:() (A) 6.0×10-3mol ·kg -1(B) 5.0×10-3mol ·kg -1(C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg-12、电导测定应⽤⼴泛,但下列问题中哪个是不能⽤电导测定来解决的()(A)求难溶盐的溶解度 (B)求弱电解质的解离度(C)求平均活度系数 (D)测电解质溶液的浓度3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1的 NaAc 溶液的离⼦平均活度系数分别为γ ±,1和γ ±,2,则有 ( )(A) γ ±,1= γ ±,2 (B) γ ±,1>γ ±,2 (C) γ ±,1<γ ±,2 (D) γ ±,1≥ γ ±,24、⾦属与溶液间电势差的⼤⼩和符号主要取决于: ( ) (A) ⾦属的表⾯性质 (B) 溶液中⾦属离⼦的浓度(C)⾦属与溶液的接触⾯积 (D)⾦属的本性和溶液中原有的⾦属离⼦浓度5、⾦属活性排在H 2之前的⾦属离⼦,如Na + 能优先H +在汞阴极上析出,这是由于:()(A) φθ(Na +/ Na) < φθ(H +/ H 2)(B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很⼤的超电势, 以⾄于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ()K O H m291,2∞=4.89×10-2-12mol m S ??,此时(291K)纯⽔中的m (H +) =m (OH -) =7.8×10-8mol ·kg -1,则该温度下纯⽔的电导率为() (A)3.81×10-9S ·m -1(B )3.81×10-6S ·m -1(C)7.63×10-9S ·m -1(D )7.63×10-6S ·m -17、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ;(C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。
物理化学(全一册)期末试卷(A)

)
) ) )
4. 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。 ( 5. 理想稀溶液中的溶剂遵从亨利定律,而溶质遵从拉乌尔定律。 ( 6. 等温等压条件下,电池反应的 r H m 不等于其反应热 QP。 ( 7. 反应速率常数 k 与反应物的浓度有关。 ( ) 8. 温度升高,液体的表面张力增大。 ( ) 9. 电解质溶液浓度越大,其摩尔电导率越小。 ( 10.克拉珀龙方程适用纯物质的任何两相平衡。 ( 二、选择题(10 分) 1.理想气体定温自由膨胀过程为( ) )
3
B T (K )
)
的 HAc 溶液的 Λ m 为 5 .2 0 1 1 0 S m m o l ,求 HAc 在该浓度下
2
4
1
的电离度 及电离平衡常数 K 。已知 H 离子和 A c 离子的 m 分别为 3 4 9 .8 2 1 0 S m m o l 和
2
-1
3.已知某一级反应 A=B+C, A 的初始浓度减少一半时,须花 120s,则该反应的速率常数为( ) 。 4.空气中漂浮一肥皂泡,其内外压之差等于( ) 。 5.某一液体不能润湿玻璃,当用一玻璃毛细管插入该液体时,毛细管中液体呈( )面。 四.计算题(40 分) 3 3 3 1.3mol 单原子理想气体从始态 100kPa,75dm 先恒温可逆压缩使体积缩小至 50dm ,再恒压加热至 100dm , 求整个过程的 Q,W,△U,△H 和△S。 分) (10 2.已知水在 77℃时的饱和蒸气压为 41.891kPa,水在 101.325kPa 下的正常沸点为 100℃,求 (1)表示水的蒸气压与温度关系的方程式中 A 和 B 的值。 ln ( p / P a )= A ( (2)水的摩尔蒸发焓。 (假定在一定温度范围为一常数) (10 分) 3.25℃时测得浓度为 0 .1 0 0 0 m o l d m
武汉理工大学物理化学下-期末考试试卷(1)

武汉理工大学考试试题纸( A 卷)课程名称:物理化学A4(下) 专业班级:题号 一 二 三 四 五 六 七 八 九 十 总分 题分 342012141010100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一、填空题(每空2分,共34分)1.已知298K 时,∞m λ(HCl)= 0.042615S •m 2•mol -1,∞m λ(NaAc) = 0.009101 S •m 2•mol -1,∞m λ(NaCl)= 0.012645 S •m 2•mol -1,则∞m λ(HAc) = S •m 2•mol -1;在此温度测得50mol •m -3的HAc 的电导率为3.68×10-2 S •m -1,则该溶液的摩尔电导率m λ= S •m 2•mol -1,解离度α= 。
2.已知CO 分子的转动惯量I = 1.449×10-46kg •m 2,振动频率ν= 65.05×1012s -1,普朗克常数h = 6.626×10-34 J •s ,玻尔兹曼常数k = 1.38×10-23 J •K -1,则CO 分子的转动特征温度r Θ= K ,振动特征温度v Θ= K 。
3.在体积为V 的立方容器中有极大数目的三维平动子,其平动能级的能量与三个平动量子数的关系为kT n n n z y x )(1.0222t ++=ε,则该系统在平衡时,17)(222=++z y x n n n 时平动能级的简并度为 ,该能级上粒子的分布数与基态能级上粒子的分布数之比0/n n 为 。
4.物理吸附的吸附力是 ,吸附分子层是 层。
5.溶液的表面张力随溶质的浓度增加而增加,则溶液的表面吸附使得溶质的在表面层的浓度c B (表面)与溶质的在本体的浓度c B (本体)的关系为c B (表面) c B (本体)。
(选填 “>”,“<”,“=”)6.恒温下,微小晶体的溶解度 普通晶体的溶解度。
武汉理工大学《大学物理》期末试题及参考答案
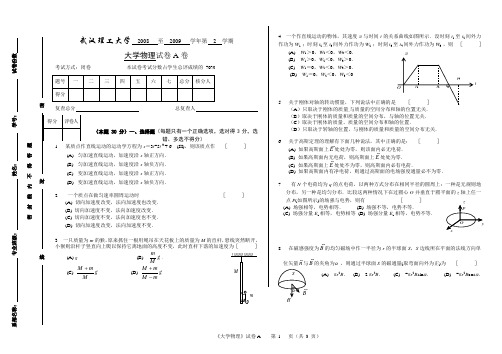
武汉理工大学2008 至2009 学年第 2 学期大学物理试卷A卷考试方式:闭卷本试卷考试分数占学生总评成绩的70%总复查人(每题只有一个正确选项,选对得3分,选错、多选不得分)x=3t-5t 3 + 6 (SI),则该质点作[]轴正方向.轴负方向.轴正方向.(D)变加速直线运动,加速度沿x轴负方向.2 一个质点在做匀速率圆周运动时[](A) 切向加速度改变,法向加速度也改变.(B) 切向加速度不变,法向加速度改变.(C) 切向加速度不变,法向加速度也不变.(D) 切向加速度改变,法向加速度不变.3一只质量为m的猴,原来抓住一根用绳吊在天花板上的质量为M的直杆,悬线突然断开,小猴则沿杆子竖直向上爬以保持它离地面的高度不变,此时直杆下落的加速度为[](A) g.(B) gMm.(C) gMmM+. (D) gmMmM-+.4一个作直线运动的物体,其速度v与时间t的关系曲线如图所示.设时刻t1至t2间外力作功为W1 ;时刻t2至t3间外力作功为W2 ;时刻t3至t4间外力作功为W3 ,则[](A) W1>0,W2<0,W3<0.(B) W1>0,W2<0,W3>0.(C) W1=0,W2<0,W3>0.(D) W1=0,W2<0,W3<05关于刚体对轴的转动惯量,下列说法中正确的是(A)只取决于刚体的质量,与质量的空间分布和轴的位置无关.(B)取决于刚体的质量和质量的空间分布,与轴的位置无关.(C)取决于刚体的质量、质量的空间分布和轴的位置.(D)只取决于转轴的位置,与刚体的质量和质量的空间分布无关.6 关于高斯定理的理解有下面几种说法,其中正确的是:[](A) 如果高斯面上E处处为零,则该面内必无电荷.(B) 如果高斯面内无电荷,则高斯面上E处处为零.(C) 如果高斯面上E处处不为零,则高斯面内必有电荷.(D) 如果高斯面内有净电荷,则通过高斯面的电场强度通量必不为零.7 有N个电荷均为q的点电荷,以两种方式分布在相同半径的圆周上:一种是无规则地分布,另一种是均匀分布.比较这两种情况下在过圆心O并垂直于圆平面的z轴上任一点P(如图所示)的场强与电势,则有[](A) 场强相等,电势相等.(B) 场强不等,电势不等.(C) 场强分量E z相等,电势相等(D) 场强分量E z相等,电势不等.8 在磁感强度为B的均匀磁场中作一半径为r的半球面S,S边线所在平面的法线方向单位矢量n与B的夹角为α,则通过半球面S的磁通量(取弯面向外为正)为[](A) πr2B.(B) 2 πr2B.(C) -πr2B sinα.(D) -πr2B cosα.系部名称:专业班级:姓名:学号:试卷份数密封线内不得答题线封密t9 如图,无限长直载流导线与正三角形载流线圈在同一平面内,若长直导线固定不动,则载流三角形线圈将[](A) 向着长直导线平移.(B) 离开长直导线平移.(C) 转动.(D) 不动.I110 自感为0.25 H的线圈中,当电流在(1/16) s内由2 A均匀减小到零时,线圈中自感电动势的大小为:[](A) 7.8 ×10-3 V.(B) 3.1 ×10-2 V.(C) 8.0 V.(D) 12.0 V.(本题 20 分)二、填空题(每空2分)1 质点沿半径为R的圆周运动,运动学方程为223t+=θ(SI) ,则t时刻质点的法向加速度大小为;角加速度α= .2 一物体质量为10 kg,受到方向不变的力F=30+40t(SI)作用,在开始的两秒内,此力冲量的大小等于________________;若物体的初速度大小为10 m/s,方向与力F的方向相同,则在2s末物体速度的大小等于___________________.3 保守力的特点是__________________________________________.4 如图,A点与B点间距离为2l,OCD是以B为中心,以l为半径的半圆路径. A、B两处各放有一点电荷,电荷分别为+q和-q .把另一电荷为Q(Q<0 )的点电荷从D点沿路径DCO移到O点,则电场力所做的功为___________________5 在一个不带电的导体球壳内,先放进一电荷为+q的点电荷,点电荷不与球壳内壁接触.然后使该球壳与地接触一下,再将点电荷+q取走.此时,球壳的电荷为__________,电场分布的范围是_______________________.6 有一同轴电缆,其尺寸如图所示,它的内外两导体中的电流均为I,且在横截面上均匀分布,但二者电流的流向正相反,则(1)在r < R1处磁感强度大小为________________T.(2) 在r > R3处磁感强度大小为________________T.(本题10 分)三、质量为m的子弹以速度v 0水平射入沙土中,设子弹所受阻力与速度反向,大小与速度成正比,比例系数为K,忽略子弹的重力,求:(1) 子弹射入沙土后,速度随时间变化的函数式;(2) 子弹进入沙土的最大深度.(本题 10 分)附加1、如图所示,两条平行长直导线和一个矩形导线框共面.且导线框的一个边与长直导线平行,他到两长直导线的距离分别为r1、r2.已知两导线中电流都为tIIωsin=,其中I0和ω为常数,t为时间.导线框长为a宽为b,求导线框中的感应电动势.IIO xr1r2ab+线封密(本题 10分)四、 如图所示,一个质量为m 的物体与绕在定滑轮上的绳子相联,绳子质量可以忽略,它与定滑轮之间无滑动.假设定滑轮质量为M 、半径为R ,其转动惯量为221MR ,滑轮轴光滑.试求该物体由静止开始下落的过程中,下落速度与时间的关系.(本题 10 分)五、一带电细线弯成半径为 R 的半圆环,均匀带电,电量为Q 。
物理化学期末试题及答案

物理化学期末试题及答案一、选择题(每题2分,共20分)1. 下列哪种物质的摩尔质量不是以克/摩尔为单位?A. 氧气B. 二氧化碳C. 氢气D. 氮气答案:C2. 在理想气体状态方程中,PV=nRT中,P代表的是:A. 压力B. 体积C. 温度D. 摩尔数答案:A3. 根据热力学第一定律,下列哪项描述是正确的?A. 能量守恒B. 能量可以被创造或消失C. 能量可以被转化为质量D. 能量可以在不同形式间转换答案:D4. 以下哪个选项是正确的?A. 温度是热力学系统的宏观量B. 温度是热力学系统的微观量C. 温度是热力学系统的微观量和宏观量D. 温度不是热力学系统的量答案:A5. 根据热力学第二定律,下列哪项描述是错误的?A. 热量不能自发地从低温物体传递到高温物体B. 所有自然过程都会导致熵增加C. 熵是状态函数D. 熵是过程函数答案:D6. 在电化学中,哪个术语用于描述电子的流动?A. 电流B. 电压C. 电阻D. 电势答案:A7. 什么是电解质?A. 一种不导电的物质B. 一种在溶液中不产生离子的物质C. 一种在溶液中产生离子的物质D. 一种在熔融状态下产生离子的物质答案:C8. 根据阿伏伽德罗定律,1摩尔任何气体在标准状态下的体积是多少?A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A9. 什么是布朗运动?A. 原子的无规则运动B. 分子的无规则运动C. 电子的无规则运动D. 离子的无规则运动答案:B10. 在理想气体的范德瓦尔斯方程中,b代表什么?A. 气体分子的体积B. 气体分子间的相互作用力C. 气体分子的动能D. 气体分子的势能答案:A二、填空题(每题2分,共20分)1. 摩尔质量的单位是______。
答案:克/摩尔2. 理想气体状态方程的公式是______。
答案:PV=nRT3. 热力学第一定律表明能量______。
答案:守恒4. 温度的单位是______。
武汉理工大学物理化学期末考试试卷

β µA
α B. µ A <
β µA
α C. µ A =
β µA
D.
α β µA = µB
3.理想气体等温自由膨胀过程的 . A.Q > 0 B.∆U < 0 C.W < 0 D.∆H = 0 4.对于只作膨胀功的封闭系统(∂A/∂T)V 的值是 . A.大于零 B.小于零 C.等于零 D.不能确定 * * 5.在温度为 T 时,纯液体组分 A 和 B 的饱和蒸气压分别为 pA 和 pB ,且 pB*=3 pA*,若组分 A 和 B . 形成理想液态混合物,当气液两相平衡时,气相中组分 A 和 B 的物质的量相等。则组分 A 和 B 在液相中的摩尔分数各应是 A.xA=0.5 B.xA=3/4 C.xA=1/4 D.不能确定
1.314.5 kJ . 2.(K1 / K2 )2 . 3.2,2 . 4.dS≥ .
δQ
T环
,不可逆
5. − .
∂V nR ,− p ∂T P
6.712.1,35.8 . 7.降低,升高,或降低或升高 .
二、选择填空题(30 分,每题 2 分) 选择填空题(
1.D . 11.B . 2.A . 12.B . 3.D . 13.D . 4.B . 14.C . 5.B . 15.D . 6.B . 7.D . 8.C . 9。C 。 10。B 。
(7 分) (1 分) (1 分)
∆U = ∆H = 0 ∆S = nRln(p1/p2) = 13.4J/K ∆A = ∆G =-T∆S =-4014.3J
∂∆ G (10 分)(1)∵ r m 五、 ( ∂T = −∆ r S m p
(1 分) (1 分) (1 分)
武汉理工大学物理化学下 期末考试试卷

课程名称:物理化学A4(下)题号一二三四五六七八九十总分题分342012*********(HAc) = S?m= S?m=。
= K时平动能级的简并度为,为。
.物理吸附的吸附力是,吸附分子层是层。
) c.恒温下,微小晶体的溶解度普通晶体的溶解度。
效应是光的引起的,其强度与入射光的波长的。
溶胶的胶团结构式为,胶粒在电场中向极移动。
)为。
1.要使浓差电池 Pb(Hg)(a 1)|Pb(NO 3)2水溶液| Pb(Hg)(a 2)的电动势大于零,则铅汞齐中铅的活度a 1 a 2 A) > B) = C) < D) (A 、B 、C )都可能2.在有电流流过电极时,原电池正极的电极电势随电流密度的增加而 ,电解池阳极的电极电势随电流密度的增加而 。
A) 上升、上升 B) 上升、下降 C) 下降、上升 D) 下降、下降 3.下列说法正确的是 。
A) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式不同;B) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式相同; C) 系统的熵与能量零点的选择无关,且定域子与离域子的计算公式相同; D) 系统的熵与能量零点的选择有关,且定域子与离域子的计算公式不同。
4.用?dm -3的KBr 和?dm -3的AgNO 3溶液以等体积混合制成的水溶胶,聚沉能力最强的电解质为 。
A) KCl B) K 2SO 4 C) MgSO 4 D) FeCl 35.在带有活塞的玻璃U 形管两端端口形成了一大一小的两个肥皂泡,如图所示,当打开U 形管的活塞时,则发生A) 大肥皂泡变小,小肥皂泡变大,直到两泡体积相等; B) 大肥皂泡变大,小肥皂泡变小,直到小泡消失; C) 大肥皂泡变大,小肥皂泡变小,直到两泡曲率半径相等; D) 大肥皂泡不变,小肥皂泡变大,直到与大泡体积相等。
6.一反应的半衰期与反应物的初始浓度成反比,则下列关系正确的是 。
A) 反应物的浓度c 与时间t 成线性关系;B) 反应物的浓度的对数ln c 与时间t 成线性关系; C) 反应物的浓度的倒数1/c 与时间t 成线性关系;D) 反应物的浓度的倒数的平方1/c 2与时间t 成线性关系。
大学化学专业《大学物理(下册)》期末考试试题A卷 附答案

10、质量为m的物体和一个轻弹簧组成弹簧振子,其固有振动周期为T.当它作振幅为A的自由简谐振动时,其振动能量E=__________。
5、一个绕有500匝导线的平均周长50cm的细螺绕环,铁芯的相对磁导率为600,载有0.3A电流时, 铁芯中的磁感应强度B的大小为___________;铁芯中的磁场强度H的大小为___________ 。
6、设在某一过程P中,系统由状态A变为状态B,如果________________________________________,则过程P为可逆过程;如果_________________________________________则过程P为不可逆过程。
二、名词解释(共6小题,每题2分,共12分)
1、刚体:
2、定压摩尔热容:
3、布郎运动:
4、介质的极化:
5、光的吸收:
6、循环过程:
三、选择题(共10小题,每题2分,共20分)
1、下述说法中,正确的是( )。
A.本征半导体是电子与空穴两种载流子同时参予导电,而杂质半导体(n型或p型)只有一种载流子(电子或空穴)参予导电,所以本征半导体导电性能比杂质半导体好
大学化学专业《大学物理(下册)》期末考试试题A卷 附答案
姓名:______ 班级:______学号:______
考试须知:
1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)
大学化学专业《大学物理(下册)》期末考试试题C卷 附解析

大学化学专业《大学物理(下册)》期末考试试题C卷附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、质量分别为m和2m的两物体(都可视为质点),用一长为l的轻质刚性细杆相连,系统绕通过杆且与杆垂直的竖直固定轴O转动,已知O轴离质量为2m的质点的距离为l,质量为m的质点的线速度为v且与杆垂直,则该系统对转轴的角动量(动量矩)大小为________。
2、长为、质量为的均质杆可绕通过杆一端的水平光滑固定轴转动,转动惯量为,开始时杆竖直下垂,如图所示。
现有一质量为的子弹以水平速度射入杆上点,并嵌在杆中. ,则子弹射入后瞬间杆的角速度___________。
3、质量为的物体,初速极小,在外力作用下从原点起沿轴正向运动,所受外力方向沿轴正向,大小为。
物体从原点运动到坐标为点的过程中所受外力冲量的大小为_________。
4、某人站在匀速旋转的圆台中央,两手各握一个哑铃,双臂向两侧平伸与平台一起旋转。
当他把哑铃收到胸前时,人、哑铃和平台组成的系统转动的角速度_____。
5、二质点的质量分别为、. 当它们之间的距离由a缩短到b时,万有引力所做的功为____________。
6、已知质点的运动方程为,式中r的单位为m,t的单位为s。
则质点的运动轨迹方程,由t=0到t=2s内质点的位移矢量______m。
7、两列简谐波发生干涉的条件是_______________,_______________,_______________。
8、质点p在一直线上运动,其坐标x与时间t有如下关系:(A为常数) (1) 任意时刻t,质点的加速度a =_______; (2) 质点速度为零的时刻t =__________.9、在主量子数n=2,自旋磁量子数的量子态中,能够填充的最大电子数是______________。
大学化学专业《大学物理(下册)》期末考试试卷C卷 附答案

1、在一任意形状的空腔导体内放一任意形状的带电体,总电荷为q,如图所示.试证明,在静电平衡时,整个空腔内表面上的感生电荷总是等于-q。
2、一束具有动量 的电子,垂直地射入宽度为a的狭缝,若在狭缝后远处与狭缝相距为R的地方放置一块荧光屏,试证明屏幕上衍射图样中央最大强度的宽度 ,式中h为普朗克常量。
大学化学专业《大学物理(下册)》期末考试试卷C卷 附答案
姓名:______ 班级:______学号:______
考试须知:
1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)
1、如图,在双缝干涉实验中,若把一厚度为e、折射率为n的薄云母片覆盖在 缝上,中央明条纹将向__________移动;覆盖云母片后,两束相干光至原中央明纹O处的光程差为_________________。
B. 媒质质元的振动动能和弹性势能都作周期性变化,但二者的相位不相同
C. 媒质质元的振动动能和弹性势能的相位在任一时刻都相同,但二者的数值不相等
D.媒质质元在其平衡位置处弹性势能最大
7、对位移电流,有下述四种说法,请指出哪一种说法正确( )。
A.位移电流是由变化的电场产生的
B.位移电流是由线性变化的磁场产生的
1、电位梯度:
2、自由度:
3、质点的角动量(对点):
4、定压摩尔热容:
5、基态:
6、光的吸收:
三、选择题(共10小题,每题2分,共20分)
1、一质点在x轴上运动,其坐标与时间的变化关系为x =4t-2 ,式中x、t分别以m、s为单位,则4秒末质点的速度和加速度为( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.物理吸附的吸附力是,吸附分子层是层。
5.溶液的表面张力随溶质的浓度增加而增加,则溶液的表面吸附使得溶质的在表面层的浓度c B(表面)与溶质的在本体的浓度c B(本体)的关系为c B(表面) c B(本体)。
(选填“>”,“<”,“=”)6.恒温下,微小晶体的溶解度普通晶体的溶解度。
(选填“>”,“<”,“=”)7.胶体的丁铎尔(Tyndall)效应是光的引起的,其强度与入射光的波长的。
8.以FeCl3为稳定剂的Fe (OH)3溶胶的胶团结构式为,胶粒在电场中向极移动。
9.已知293K时,某固体表面对气体的朗缪尔吸附系数b= 则气体的分压为时吸附量与饱和吸附量之比(V a/V a∞)为。
10.对于平行一级反应来说,反应1和反应2的指前因子(参量)相同,活化能分别为100kJ·mol-1和70 kJ·mol-1,当反应在1000 K进行时,且反应开始时只有A,则在反应的任一时刻,物质B与物质C的浓度之比c B/c C 为。
二、单项选择填空题(每题2分,共20分)1.要使浓差电池 Pb(Hg)(a1)|Pb(NO3)2水溶液| Pb(Hg)(a2)的电动势大于零,则铅汞齐中铅的活度a1a2A) > B) = C) < D) (A、B、C)都可能2.在有电流流过电极时,原电池正极的电极电势随电流密度的增加而,电解池阳极的电极电势随电流密度的增加而。
A) 上升、上升B) 上升、下降C) 下降、上升D) 下降、下降3.下列说法正确的是。
A) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式不同;B) 系统的热力学能与能量零点的选择有关,且定域子与离域子的计算公式相同;C) 系统的熵与能量零点的选择无关,且定域子与离域子的计算公式相同;D) 系统的熵与能量零点的选择有关,且定域子与离域子的计算公式不同。
4.用•dm -3的KBr和•dm -3的AgNO3溶液以等体积混合制成的水溶胶,聚沉能力最强的电解质为。
A) KCl B) K2SO4 C) MgSO4 D) FeCl3 5.在带有活塞的玻璃U形管两端端口形成了一大一小的两个肥皂泡,如图所示,当打开U形管的活塞时,则发生A) 大肥皂泡变小,小肥皂泡变大,直到两泡体积相等;B) 大肥皂泡变大,小肥皂泡变小,直到小泡消失;C) 大肥皂泡变大,小肥皂泡变小,直到两泡曲率半径相等;D) 大肥皂泡不变,小肥皂泡变大,直到与大泡体积相等。
6.一反应的半衰期与反应物的初始浓度成反比,则下列关系正确的是。
A) 反应物的浓度c与时间t成线性关系;B) 反应物的浓度的对数ln c与时间t成线性关系;C) 反应物的浓度的倒数1/c与时间t成线性关系;D) 反应物的浓度的倒数的平方1/c 2与时间t 成线性关系。
7.对行反应A B ,当温度一定时由纯A 开始,下列说法中错误的是 。
A) 开始时A 的反应消耗速率最快;B) 反应的净速率是正逆二向反应速率之差; C) k 1/ k -1的值是恒定的;D) 达到平衡时正逆二向的反应速率系(常)数相等。
8.某反应的速率常数为×10-2 min -1,反应物的初始浓度为 mol •dm -3,则反应的半衰期为:A) B) 15min C) 216minD) 1082min9.对基元反应 A + 2B → C ,若将其反应速率方程写成下列形式:2BA A A d d c c k t c =-;A) 增加B) 下降C) 不变D) 或增加或下降三、乙酸乙脂的皂化反应是典型的二级反应。
其反应式为CH3COOC2H5 + NaOH == CH3COONa + C2H5OH(A) (B) (X) (Y)已知该反应的活化能为60kJ mol-1,反应开始时,A和B的浓度皆为mol dm-3。
在21℃时反应经历25 min后,测得B的浓度为 mol dm-3。
计算:(1)反应在21℃时的速率常数;(2)在21℃时,反应物的转化率达90%时,需要的时间;(3)反应在30℃时的速率常数;(4)反应在30℃,A和B的初始浓度为 mol dm-3时的半衰期。
四、25℃时,电池Cd(s)|CdCl2·(饱和溶液)|AgCl(s)|Ag(s)的电动势为,电动势的温度系数为×10- 4V K-1,法拉第常数F= 96500C mol-1。
试写出z= 2时的电池反应式,并计算在此温度时电池反应的r G m,r S m,r H m及可逆热效应Q r值。
五、已知在25℃时,电池Pt(s)|H 2(200kPa)|HCl(b = mol kg -1, ±γ=|AgCl(s)|Ag(s)的电动势为,,且E (H +/H 2)= 0V ,E (Ag +/Ag)= ,试计算:(1) 该电池中HCl 溶液的离子平均浓度±b ,离子平均活度±a 及HCl 溶液的活度HCl a ;(2) 银——氯化银电极的标准电极电势E (Cl -/AgCl/Ag);(3) 氯化银的活度积K sp (AgCl)六、已知反应2 N 2O 5 → 4 NO 2 + O 2的机理如下:(1) N 2O 5NO 2 + NO 3(2) NO 2 + NO 3 NO + O 2 + NO 2 (3) NO + NO 32 NO 2试通过稳态近似处理方法证明5252O N 2121O N 22d d c k k k k tc +=--。
武汉理工大学教务处试题标准答案及评分标准用纸课程名称:物理化学(A卷)一、填空题:(每空2分、共34分)1.,×10-4,2.,31233.3,4.分子间力、多(多或单)5.<6.>7.散射、四次方成反比8.{[Fe(OH)3]m•n Fe3+•3(n-x)Cl-}3x+•3x Cl-,负9.10.二、单项选择填空题:(每题2分、共20分)1. A2. C3. B4. D5. C 6 .C 7. D 10. B三、(12分)(1) ∵t k c c 110A,A =- ∴ A0,A A 0,A 1c c c c t k -==00529.002.000529.002.0251⨯-⨯= mol -1dm 3min -1 (3分)(2) ∵t k c c 110A,A =- ∴ min 9.80)02.01)9.01(02.01(56.51)11(1A,0A =--=-=c c k t (3分)(3) ∵)11(R )()(ln12a 12T T E T k T k --= ∴7284.0)15.294115.3031(8.31410006056.5)(ln 2=-⨯-=T k 52.11)K 15.303(=k mol -1dm 3min -1 (3分)(4) ∵0,A 211kc t =∴ min 68.801.052.11110,A 21=⨯==kc t(3分) 四、(14分)解 Cd + 2AgCl + === CdCl 2• + 2Ag (2分)1m r m ol kJ 33.1306753.0965002-•-=⨯⨯-=-=∆zFE G(3分)114m r K mol J 45.125)105.6(965002)(---••-=⨯-⨯⨯=∂∂=∆p TEzF S (3分)1m r m r m r m ol kJ 73.167)45.125(29815.033.130-•-=-+-=∆+∆=∆S T G H(3分)1m r m r,mol kJ 40.37)45.125(29815.0-•-=-=∆=S T Q(3分)五、(10分)解:1/2H 2(g) + AgCl(s) ===Ag(s) + HCl(a)(1)-11kg m ol 1.0)(•==-+-+±b b ννννν (1分)0796.0/==±±± b b a γ(1分)32HCl 10336.6-±⨯==a a(1分)(2)21H HCl )(lg 105916.02 p p a E E -= 21H HCl )(lg 105916.02p p a E E +=∴ V 2221.0kPa)100kPa 200(10336.6lg 05916.03610.0213=⨯+=-E V 2221.0)Ag |AgCl |Cl ()H |H ()Ag |AgCl |Cl (2==-=-=-+--+E E E E E E(3分)(3)设计电池 Ag|Ag +||Cl -|AgCl|Ag 则该电反应为AgCl ==== Ag + + Cl -∴K sp (AgCl) = K而05916.0lgzE K = 5773.07994.02221.0-=-= E7583.9ln -= K K sp (AgCl) = ×10-10(4分) 六、(10分)证:由稳态近似得:0d d 33232523NO NO 3NO NO 2NO NO 1O N 1NO =---=-c c k c c k c c k c k tc(1) (2分)0d d 332NO NO 3NO NO 2NO=-=c c k c c k tc(2) (2分)由(2)得 2NO 32NO c k k c =代入到(1)中,得 ()2523NO21O N 1NO 2c k k c k c +=- (2分)325252NO NO 1O N 1O N d d c c k c k tc --=-(2分)=()252252211112NOO N NOO N c k k c k c k c k +---=⎪⎪⎭⎫ ⎝⎛+---21112152k k k c k O N=⎪⎪⎭⎫⎝⎛+-21212252k k k c k O N =52212122O N c k k k k +-(2分)。
