厦门大学无机化学习题16 过渡元素(二)
无机化学试题【附答案】@厦大

厦门大学“无机化学(一) ”课程试卷
化学化工学院化学系、材料系 2004 年级 化学、化学生物、化学教育、高分子专业
主考教师:郑兰荪、朱亚先、黄荣斌、林丽榕 试卷类型: (闭卷)
向 0.10 mol·dm-3草酸溶液中滴加NaOH溶液使pH = 7.00,溶液中(H 2 C 2 O 4 , HC 2 O 4 ,
C2O2 4 ) ______________浓度最大 。
(H 2 C 2 O 4 的 K a1 = 5.9 10-2,K a2 = 6.4 10-5) 21. 2 分 同离子效应使难溶电解质的溶解度_________________________; 盐效应使难溶电解质的溶解度_____________________________; 后一种效应较前一种效应_____________________________得多。 21. 2 分 下列过程的熵变的正负号分别是 :
)
4.
2 分 4 mol Br 2 和 5 mol HBr 2HBr(g) 的 K c = 1.86。 反应 H 2 (g) + Br 2 (g) 若将 3 mol H 2 , 3 放在 10 dm 烧瓶中,则…………………………………………………………………… ( ) (A) 反应将向生成更多的 HBr 方向进行 (B) 反应向消耗H 2 的方向进行 (C) 反应已经达到平衡 (D) 反应向生成更多Br 2 的方向进行 2 分 试由下列表中数据,确定压力为 101 kPa时BCl 3 的沸点为…………………… ( BCl 3 (g) BCl 3 (l) -1 f H m / kJ·mol -427.2 -403.76
厦门大学无机化学试卷

班级 姓名 分数一、选择题 ( 共18题 35分 ) 1. 2 分InCl 2为逆磁性化合物,其中In 的化合价为…………………………………………( ) (A) +1 (B) +2 (C) +3 (D) +1和+32. 2 分下列氢化物中,在室温下与水反应不产生氢气的是…………………………………( ) (A) LiAlH 4 (B) CaH 2 (C) SiH 4 (D) NH 33. 2 分和水反应得不到H 2O 2的是……………………………………………………………( ) (A) K 2O 2 (B) Na 2O 2 (C) KO 2 (D) KO 34. 2 分下列物质的水解产物中既有酸又有碱的是………………………………………… ( ) (A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 35. 2 分有关H 3PO 4、H 3PO 3、H 3PO 2不正确的论述是…………………………………( ) (A) 氧化态分别是+5,+3,+1 (B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸6. 2 分下列各组化合物中,都有颜色的一组化合物是…………………………………… ( ) (A) SiCl 4,SnCl 4,PbO (B) CCl 4,NO 2,HgI 2 (C) SiC ,B 2H 6,N 2O 4 (D) PbO 2,PbI 2,SnS7. 2 分下列化合物中最稳定的是…………………………………………………………… ( ) (A) Li 2O 2 (B) Na 2O 2 (C) K 2O 2 (D) Rb 2O 28. 2 分1 mol 下列各物质溶于1 dm 3水中,生成的溶液 中H + 浓度最高的是……………( ) (A) SO 3 (B) P 4O 10 (C) HF (D) MgH2 厦门大学“无机化学(二)”课程试卷化学化工学院化学、材料系2004年级化学各专业试卷类型:(A 卷)对于H 2O 2和N 2H 4,下列叙述正确的是………………………………………………( ) (A) 都是二元弱酸 (B) 都是二元弱碱 (C) 都具有氧化性和还原性 (D) 都可与氧气作用10. 2 分下列分子式中错误的是……………………………………………………………… ( ) (A) SF 2 (B) SF 3 (C) SF 4 (D) SOF 411. 2 分O 22-可作为…………………………………………………………………………… ( )(A) 配体 (B) 氧化剂 (C) 还原剂 (D) 三者皆可12. 2 分下列含氧酸根中,属于环状结构的是……………………………………………… ( )(A) S O 462-(B) S O 3102-(C) P O 393-(D) P O 3105-13. 2 分BF 3通入过量的Na 2CO 3溶液,得到的产物是………………………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 314. 2 分下列含氧酸中酸性最弱的是………………………………………………………… ( ) (A) HClO 3 (B) HBrO 3 (C) H 2SeO 4 (D) H 6TeO 615. 2 分下列各组物质氧化性变化次序不正确的是………………………………………… ( ) (A) HNO 3 > H 3PO 4 > H 3AsO 4 (B) HBrO 3 > HClO 3 > HIO 3 (C) H 2SeO 4 > H 6TeO 6> H 2SO 4 (D) HClO 4 > H 2SO 4 > H 3PO 416. 2 分锌粉与酸式亚硫酸钠反应生成……………………………………………………… ( ) (A) Na 2S 2O 4 (B) Na 2S 2O 3 (C) Na 2SO 3 (D) Na 2SO 417. 2 分用于制备K 2S 2O 8的方法是……………………………………………………………( ) (A) 在过量的硫酸存在下,用高锰酸钾使K 2SO 4氧化 (B) 在K + 离子存在下,往发烟硫酸中通入空气(C) 在K + 离子存在下,电解使硫酸发生阳极氧化作用 (D) 用氯气氧化硫代硫酸钾K 2S 2O 3鉴别Sn4+和Sn2+离子,应加的试剂为…………………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)二、填空题( 共8题25分)19. 5 分比较下列各物质的性质:(1) BeCl2和CaCl2的沸点,前者______________后者;(2) NH3和PH3的碱性,前者______________后者;(3) NaOCl和NaClO3的氧化性,前者______________后者;(4) BaCrO4和CaCrO4在水中的溶解度,前者______________后者;(5) TlCl和TlCl3的水解度,前者______________后者。
过渡元素化学(二)

过渡元素化学(二)过渡元素是周期表中的一组元素,其电子排布在第3到第12组之间。
这个区域由于有半满或近半满的d轨道和未填满的f轨道,使得这些元素具有特殊的性质,可以表现出很多不同的化学行为。
本文将深入探讨过渡元素的化学性质以及它们在化学反应中所扮演的角色。
1. 过渡元素的物理特征过渡元素具有许多独特的物理特征。
首先,它们具有高密度,高熔点和沸点,因为它们拥有许多未填满的d轨道,这些轨道的电子之间相互作用会导致较强的金属-金属键。
其次,它们通常是良好的导体,因为它们的未填满的d轨道使它们具有离子化趋势,容易失去电子形成正离子或者吸收电子形成负离子。
2. 过渡元素离子的颜色许多过渡元素的离子具有强烈的颜色,这是由于它们的d轨道未填满。
当电子从一个未填满的d轨道移到另一个未填满的d轨道时,会吸收光,而吸收波长的颜色就是离子呈现的颜色。
例如,二价铜在水溶液中呈现蓝色,因为它的四对未填满的d电子在s和p电子之间能吸收波长为580 nm左右的光线,这些电子从第一对d电子到第三对d电子转移。
过渡元素可以呈现多种不同的氧化态,这使得它们在许多有机和无机化学反应中都有不同的用途。
例如,铁可以以氧化态+2形式存在,也可以存在于+3的氧化态下。
由于不同的氧化态会影响到元素的化学性质,因此过渡元素在反应中所扮演的角色也会因其氧化态的不同而有所不同。
4. 过渡元素在催化反应中的作用过渡元素在催化反应中发挥着重要的作用,常见的过渡金属催化反应包括原料的直接活化、分子间的加成、还原等。
许多过渡金属催化剂的成功应用可以归功于它们容易形成中间态,也可以通过自旋、电荷、配体效应等变化调节反应活性。
与此同时,过渡元素也可以得到良好的选择性,这是由于它们的每一种氧化态具有不同的反应性能,所以它们可作为特异性催化剂。
总之,过渡元素是化学反应中非常重要的一类元素,它们具有独特的性质和特征,使得它们在许多不同的化学反应中都有不同的贡献和应用。
厦门大学2016年无机化学考研真题

厦门大学2016年招收攻读硕士学位研究生入学考试试题科目代码:617科目名称:基础化学招生专业:化学化工学院、材料科学与工程系、公共卫生学院、药学院各相关专业考生须知:答题必须使用黑(蓝)色墨水(圆珠)笔:不得直接在试题(草稿)纸上作答;凡未按规定作答均不予评阅、判分;责任考生自负。
一、单项选择题(共35题,每题2分,共70分)1.下列关于O22-和O2-的性质的说法中,不正确的是()(A)两种离子都比O2分子稳定性小(B)O22-的键长比O2-键长短(C)O22-是反磁性的,而O2-是顺磁性的(D)O2-的键能比O22-键能大2.多电子原子的能量E由()决定的(A)主量子数n (B)n,l (C)n,m,l (D)l3.在容积可变的密闭容器中通入体积比为2:3的气体A和气体B,在一定条件下发生如下反应:A+3B⇌2C(A、B、C均为气体)当反应达到平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是()A.5:6 B.5:4 C.5:3 D.5:24.0.01mol氯化铬(CrCl3.6H2O)在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为()(A){Cr(H2O)6}Cl3 (B){Cr(H2O)5Cl}Cl2.H2O(C){Cr(H2O)4Cl2}Cl.2H2O (D){Cr(H2O)3Cl3}.3H2O5.根据酸碱的溶剂理论,在液态 SO2体系中的碱是…………………………………()(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl36.在某温度下反应 A + B = C + D Δ H < 0 ,达到平衡后再升高温度,平衡将逆向移动的原因是()A、υ (正) 减小,υ (逆) 增大B、k (正) 减小,k (逆) 增大C、υ (正) 和υ (逆) 都减小D、υ (正) 增加的倍数小于υ (逆) 增加的倍数7.已知 298 K 时反应 H 2O ( l ) →H 2 (g )+21O 2 (g) 的平衡常数 K Θ=2.86×10-42 , 在此温度下H 2O ( l ) 的饱和蒸气压为3.17 kPa ,则反应H 2O (g) HH 2 (g )+21O 2 (g) 在相同温度下的平衡常数 K Θ与下列数据最接近的是 ( )A 、7.0×10-44B 、9.1×10-41C 、4.5×10-42D 、6.8×10-438. 为了防止海轮船体的腐蚀,可在船壳水线以下位置嵌上一定数量的 ( )(A)铜块 (B)铅块 (C)锌块 (D)钠块9.{Ca (EDTA)}2-配离子中,Ca 2+的配位数是 ( )(A)1 (B)2 (C)4 (D)610.在下列碱金属电对M +/ M 中,ϕΘ最小的是 ( )A 、Li +/ LiB 、Na +/ NaC 、K +/ KD 、Rb +/ Rb11..若空气中水蒸气压高于同温度下某种盐浓溶液的蒸气压,则该盐会 ( )A 、风化B 、潮解C 、升华D 、溶解12.CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为 3.0mol.L -1的溶液中Ca 2+可能的最高浓度是A,1.8x10-9mol.L -1CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为3.0mol.L -1的溶液中Ca 2+可能的最高浓度是 ( )A,1.8x10-9mol.L -1 , B,1.8x10-10mol.L -1C,5.9x10-10mol.L -1 D,5.9x10-9mol.L -113. 298 K 下,H 2(g) +21O 2(g) =H 2O(g) m f H ∆= -242 kJ ·mol -1,当温度升高了100 K ,则反应的 m r S ∆值应为…………………………………………………………………… ( )(A) 比升温前大 (B) 比升温前小(C) 和升温前近似 (D) 不变14.叠氮酸的结构是 N 1—N 2—N 3,1、2、3号氮原子采用的杂化类型分别为( )。
高等无机过渡元素化学习题
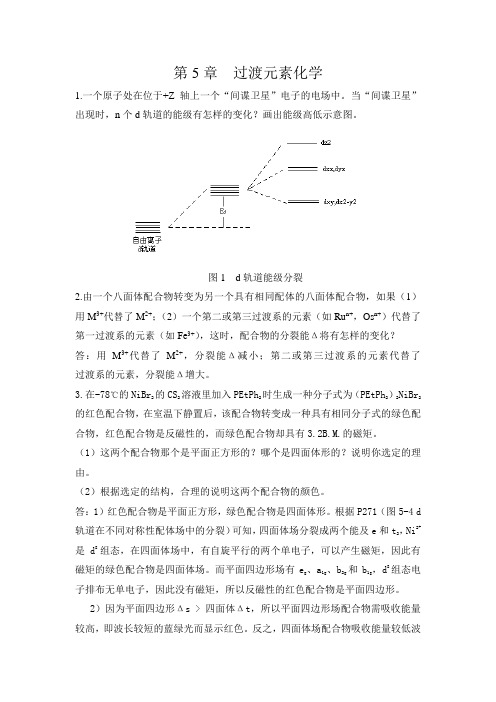
因为μ= n(n 2),分裂能Δ值 I4- < Cl4-,与 Cl 相比,I 是弱场,高自旋,
单电子数多,所以磁矩大。
14.根据下列化合物的有效磁矩,描述它们的电子结构和几何构型: (1)K2[NiF6],0.0B.M.; (2)[Mn(NCS)6]4-,6.06B.M.; (3)[PtCl4]2-,0.0B.M.; (4)CoCl42-,4.3~4.7B.M. (Et-乙基,Ph-苯基)
答:1)[Fe(H2O)6]3+:Δ < P,高自旋;[PtCl6]2-:Δ > P,低自旋。 2)Nb、Ta 的半径比 Ti 的大,外层电子多,所以能够容纳较多的配体。 3)Mo、W 的含氧酸是高酸,能结合质子,水的配位数增加,且 M-OH 键较弱,
易失水聚合,所以 Mo 和 W 比 Cr 易形成聚合度高的多酸。 4)Re 原子的电子组态为[Xe]5d56s2,在 Re2Cl82-中 Re 的氧化态为+3,价电子
答:不同。Fe(Ⅵ)的磁矩:μ= n(n 2)=2.83B.M.
Pr(Ⅲ)的磁矩:μ=g
J(J
1),根据表
5-17
得
Pr(Ⅲ)的基态光谱支项为H34,可知 S=1,L=5,J=4;g=1+ J(J 1) S(S 1) L(L 1) = 4 ;所以μ=3.58B.M.
2J (J 1)
5
18.解释下列问题: (1)[Fe(H2O)6]3+为高自旋,而[PtCl6]2-为低自旋; (2)Ti 形成 TiF62-离子,而 Nb,Ta 则形成 MF82-或 MF83-离子(其中 M=Nb,Ta) (3)Mo 和 W 比 Cr 易形成聚合度高的多酸; (4)Re 可形成含有四重 Re-Re 键的 Re2Cl82-离子,而 Mn 未见报道。
过渡元素(课后基础习题)

过渡元素1、钛的主要矿物是什么?简述从钛铁矿制取钛白得反应原理。
2、完成并配平下列反应方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→3、完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;得水溶液加入过量得氨;(3)向含有TiCl-26(4)向VCl3的水溶液加入过量的氨;(5)将VCl2的固体加到HgCl2水溶液中。
4、根据下列实验写出有关的反应方程式:将一瓶TiCl4打开瓶塞时立即冒白烟。
向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
5、完成并配平下列反应方程式−(1)V2O5 + NaOH−→−(2)V2O5 + HCl−→−(3)VO43- + H+(过量) −→−(4)VO2+ + Fe2+ + H+−→−(5)VO2+ + H2C2O4 + H+−→6、新生成的氢氧化物沉淀为什么会发生下列变化(1)Mn(OH)2几乎是白色的,在空气中变为暗褐色?(2)白色的Hg(OH)2立即变为黄色?(3)蓝色的Cu(OH)2,加热时为什么变黑?7、根据下述各实验现象,写出相应的化学反应方程式(1)往Cr2(SO4)3溶液中滴加NaOH溶液,先析出葱绿色絮状沉淀,后又溶解,此时加入溴水,溶液就由绿色变为黄色。
用H2O2代替溴水,也得到同样结果。
(2)当黄色BaCrO4沉淀溶解在浓HCl溶液中时得到一种绿色溶液。
(3)在酸性介质中,用锌还原Cr2O-2时,溶液颜色由橙色经绿色而变成蓝色。
放置时又变回绿色。
7(4)把H2S通入已用H2SO4酸化的K2Cr2O7溶液中时,溶液颜色由橙变绿,同时析出乳白色沉淀。
过渡金属元素习题及答案

本部分内容集中出现在选修三物质的结构与性质,主要考察的知识点有:一、原子或离子的电子排布式;二、分子的结构(特别是配合物结构的考察);三、中心离子的配位数;四、含有过渡元素晶体的密度和化学式的考察。
1.[物质结构与性质]K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态外围电子排布式为。
(2)(CN)2分子中碳原子杂化轨道类型为;1molK4[Fe(CN)6]分子中含有σ键的数目为。
(3)O+22与CN-互为等电子体,则O+22的电子式为。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为。
2.芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中,(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有种。
(3)H2S和H2Se的参数对比见下表。
化学式键长/nm键角沸点/℃H2S 1.34 92.3º -60.75H2Se 1.47 91.0º -41.50①H2Se的晶体类型为,含有的共价键类型为。
②H2S的键角大于H2Se的原因可能为。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示编号I5/KJ·mol-1I6/KJ·mol-1I7/KJ·mol-1I8/KJ·mol-1A 6990 9220 11500 18770B 6702 8745 15455 17820C 5257 6641 12125 13860A是(填元素符号),B的价电子排布式为。
3.由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
厦门大学839无机化学(海洋化学)2013年考研专业课真题答案解析

(1)[FeF6]3-(µ=5.9 B.M.);(2)[Mn(CN)6]4-(µ=1.8 B.M.); 【考查重点】: 这是配位化合物的内容,考查配位化合物的理论、中心价层轨道的杂化、配位化合物的 磁性。 【答案解析】:
物质的磁矩 与物质轨道中单电子数 n 之间满足:
n(n 2) B ,
其中, B 为磁矩单位,称为玻尔磁子。
厦门大学 2013 年招收攻读硕士学位研究生入学考试试题答案解析
科目代码:839 科目名称:无机化学 招生专业:海洋化学
考生须知:答案必须使用墨(蓝)色墨水(圆珠)笔;不得在试卷(草稿)纸上作答; 凡未按规定作答均不予评阅、判分
一、(18 分)判断下列说法是否正确?说明理由。
(1)过渡元素的原子填充电子时是先填 4s 然后填 3d,失去电子时是先失去 3d 再失去 4s;
决化学反应的方向和限度问题,并不涉及反应速率,因为热力学中的方程是在静态或准静态 条件下推导而来,而静态或准静态要求过程无限缓慢,并不考虑时间。氧化还原反应的电极 电势(能斯特方程)正是热力学的产物,因此,它不考虑反应速率问题。
《厦门大学 839 无机化学历年考研真题及答案解析》
有机化学习题与答案厦门大学

有机化学习题与答案厦门大学有机化学习题与答案(厦门大学)第一章绪论习题一、根据下列电负性数据:判断下列键中哪个极性最强?为什么?答案 <请点击>二、(a) F2、HF、BrCl、CH4、CHCl3、CH3OH诸分子中哪些具有极性键?(b) 哪些是极性分子?答案 <请点击>三、下列各化合物有无偶极矩?指出其方向。
答案 <请点击>四、根据O和S的电负性差别,H2O和H2S相比,哪个的偶极-偶极吸引力较强,哪个的氢键较强?答案 <请点击>五、写出下列化合物的路易斯电子式。
答案 <请点击>六、把下列化合物由键线式改写成结构简式。
七、下面记录了化合物的元素定量分析和相对分子质量测定的结果,请计算它们的化学式。
(1) C:65.35%,H:5.60%,相对分子质量 110(2) C:70.40%,H:4.21%,相对分子质量 188(3) C:62.60%,H:11.30%,N:12.17%,相对分子质量 230(4) C:54.96%,H:9.93%,N:10.68%,相对分子质量 131(5) C:56.05%,H:3.89%,Cl:27.44%,相对分子质量 128.5(6) C:45.06%,H:8.47%,N:13.16%,Cl:33.35%,相对分子质量 106.5答案 <请点击>八、写出下列化学式的所有的构造异构式。
答案 <请点击>第一章绪论习题(1)1、什么是烃、饱和烃和不饱和烃?点击这里看结果2、什么是烷基?写出常见的烷基及相应的名称。
点击这里看结果3、给下列直链烷烃用系统命名法命名点击这里看结果4、什么是伯、仲、叔、季碳原子,什么是伯、仲、叔氢原子?点击这里看结果5、写出己烷的所有异构体,并用系统命名法命名。
点击这里看结果6、写出符合下列条件的烷烃构造式,并用系统命名法命名:1.只含有伯氢原子的戊烷2.含有一个叔氢原子的戊烷3.只含有伯氢和仲氢原子的已烷4.含有一个叔碳原子的已烷5.含有一个季碳原子的已烷6.只含有一种一氯取代的戊烷7.只有三种一氯取代的戊烷8.有四种一氯取代的戊烷9.只有二种二氯取代的戊烷点击这里看结果7、写出2-甲基丁烷和2,2,4-三甲基戊烷的可能一氯取代物的结构式,并用系统命名法命名。
无机化学练习题(含答案)第18章 过渡元素(一)

第18章过渡元素(一)18-1:试以原子结构理论说明:(1)第四周期过渡金属元素再性质上的基本共同点;(2)讨论第一过渡系元素的金属性﹑氧化态﹑氧化还原稳定性以及酸碱稳定性变化规律;(3)阐述第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因。
(1)答:第四周期元素电子结构的特点是具有未充满的3d轨道,最外层电子为1-2个,其特征电子构型为(n-1)d1-10ns1-2,它们的电力能和电负性都很小,容易失去电子呈金属性,而且标准电极电势值几乎都是负值,表明具有较强的还原性,能从非氧化性的酸中置换出氢。
(2)答:第一过渡系元素从左到右,金属的还原能力逐渐减弱,它们的原子半径随着原子序数的增加而减小,开始减小是很明显的,到VIB族以后就变得平缓,到IB时原子半径又开始上升。
第一过渡系金属从左到右,熔点从钪的1541℃升到钒的1890℃达到高峰,然后下降到锰的1244℃,随后又上升再下降,这种变化的趋势是因为随原子序数的增加,用于形成金属键的未成对的d电子成对而减少,熔点下降,边界元素Mn和Zn的3d能级为半充满和全充满的稳定构型而使熔点较低。
随着原子序数的增加,氧化态先是逐渐升高,达到其族数对应的最高氧化态,这种变化的趋势与成键d电子数有关。
由于d1-d5电子构型的过渡元素的电子都是未成对的,都能参与成键,当失去所有s和d电子时就出现最高氧化态。
但在超过3d5构型的元素后,一方面由于电子的配对,再失去电子就要消耗能量去克服电子成对能,另一方面随着原子序数的增加,原子半径逐渐减小,失去电子更加困难,以致失去所有的价电子在能量上是禁阻的,所以到Ⅷ族元素中大多数元素都不呈现与族对应的最高氧化态。
第一过渡系金属元素+∏价氧化态的标准电极电势从左到右由负值增加到正值,金属的还原性依次减弱,它们的最高价氧化态含氧酸的标准电极电势从左到右随原子序数的增大而增大,即氧化性逐渐增强,中间氧化态化合物在一定条件下不稳定,可发生氧化还原反应。
《无机化学习题》(张祖德)简介
绪 论 Introduction我的宗旨:To our students, whose enthusiasm and curiosity have often inspired us, and whose questions and suggestions have sometimes taught us.一、Chemistry ── the Central ScienceChemistry has often been called the central science, because a basic knowledge of chemistry is essential for the study of biology, physics, geology, ecology and many other subjects.1.二十世纪,特别是二十世纪后期,化学有了突飞猛进的发展。
(1) 冠醚(crown ether )的发现(The discovery of crown ether ):第一个冠醚的发现纯属偶然。
工业化学家(杜邦公司)C. J. Pedersen 要从一种单基保 护邻苯二酚(1)与二氯二乙醚(2)制备双苯酚(3): OHO O Cl O Cl OHHO O O O +(1)(2)(3)(邻羟基苯氧基 -乙基醚)当用了稍微不纯的化合物(1)(含有一些未经保护的酚),还得到了非常少的(0.4%)六醚(4)O OO O OO(4)KMnO 4可溶于其中,呈紫红色,他又合成了(12C4)Li +O O O O O (15C5)Na +OO O OO O OO O O O O O OO (21C7)Cs +(24C8)能放入的离子:它们可以用来识别碱金属离子,从而开创了超分子化学(super molecular chemistry )的先河。
Pedersen 获得了1989年的Nobel chemistry prize.(2) N 5+阳离子的首次露面(the discovery of the pentanitrogen ion ): 在无水HF 中, 78℃下,由N 2F 2与AsF 5反应:N 2F 2 + AsF 5 [N 2F +][AsF 6-],将[N 2F +][AsF 6-]与HN 3(叠氮酸)反应:[N 2F +][AsF 6-] + HN 3 [N 5+][AsF 6-] + HF 。
大学无机化学d区元素介绍

失去结晶水
水溶液中铬的各种离子
颜色
Cr2O
27
橙红
CrO
24
黄
Cr3+(aq) 紫
Cr(OH)
4
亮绿
Cr2+(aq) 蓝
Cr2+(aq)
存在的pH
<2
>6
酸性
强碱 酸性
Cr3+(aq)
1. (1)Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
(2) Cr(Ⅵ) 的难溶盐 铬酸盐比相应的重铬酸盐溶解度小。 Ksp(Ag2CrO4) =1.1×10-12 Ksp(Ag2Cr2O7 )=2.0×10-7
4Ag Cr2O72- H2O 2Ag2CrO4 (s,砖红) 2H 2Ba2 Cr2O72- H2O 2BaCrO4 (s,柠檬黄)2H 2Pb2 Cr2O72- H2O 2PbCrO4 (s,黄) 2H
如:VH18,TaH0.76,LaNiH5.7 。 4. 与硼、碳、氮形成间充式化合物。
5.多种氧化态 红色为常见的氧化态
§12.2 钛 钒
12.2.1.(1)金属钛的物理性质
银白色光泽,熔点较高,密度比钢小,机 械强度大,抗腐蚀性很强。 航天、航海、军械兵器等部门不可缺少的 材料。
12.2.1 (2)钛的 化合物
18
•V2O5与强酸反应(pH < 1) 得到的不是五价钒离子,而是含五价钒的钒氧离子:
V2O5 + 2H+ = 2VO2+ + H2O
•五氧化二钒具有氧化性,可以氧化盐酸:
V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O
无机化学练习题过渡金属元素的化学性质

无机化学练习题过渡金属元素的化学性质无机化学练习题:过渡金属元素的化学性质过渡金属元素是周期表中位于主族元素与内过渡元素之间的一组元素。
它们具有独特的化学性质,广泛应用于无机化学、有机化学、生物化学等领域。
本文将围绕过渡金属元素的化学性质展开探讨,并试图回答以下问题:过渡金属元素为什么具有多种氧化态?其复合物的特征及反应行为如何?过渡金属元素在催化反应中的应用有哪些?一、多种氧化态的原因过渡金属元素具有多种氧化态的主要原因在于其d轨道的电子结构。
与主族元素不同,过渡金属元素的d轨道不稳定,容易发生电子转移。
这种电子转移使得d轨道的能级发生变化,从而出现不同的氧化态。
以铁为例,其原子结构为[Ar] 3d^6 4s^2。
当铁失去两个电子,即形成Fe^2+离子时,电子结构变为[Ar] 3d^6。
当铁失去三个电子,形成Fe^3+离子时,其电子结构变为[Ar] 3d^5。
由于过渡金属元素具有不同的氧化态,因此可以展现出多样的化学性质和反应行为。
二、过渡金属元素的复合物1. 特征过渡金属元素与配体形成的复合物具有一系列独特的特点。
首先,复合物通常呈现出比单质金属更高的稳定性。
其次,复合物的形成导致了配体与金属中心之间的电荷转移,从而改变了金属的电子结构。
此外,复合物还表现出各种颜色,这是由于d轨道的电子跃迁所引起的。
2. 反应行为过渡金属元素复合物在溶液中具有广泛的反应行为。
典型的反应包括配位还原反应、配位置换反应和配位加成反应。
在配位还原反应中,配体能够接受或释放电子,从而改变金属离子的氧化态。
在配位置换反应中,配体与金属离子之间发生交换,形成新的配合物。
在配位加成反应中,新的配体与金属离子形成更稳定的络合物。
三、过渡金属元素在催化反应中的应用过渡金属元素由于其多种氧化态和复合物的特点,在催化反应中具有重要应用价值。
过渡金属可以提供活性位点,促进催化反应发生。
此外,金属的氧化态也可以调节催化反应的速率和选择性。
厦门大学无机化学习题15 过渡元素(一)

过渡元素(一)钛1.指出TiO2分别与下列物质反应的产物是什么?Ca、H2SO4、Al、C+Cl2、NaOH、HF、C、BaCO32.给出合理的解释(1)TiCl4可用于制造烟幕?(2)Ti3+离子具有还原性?(3)Ti易溶于HF,难溶于HNO3中?(4)金属钛在低温下没有反应性?(5)Ca与Ti是同一周期的邻近元素,Ti的密度、熔点比Ca高?(6)Ca2+为无色,而Ti2+为有色离子?(7)Ca与Ti原子外层都是4s2,Ti有+2、+3、+4多种氧化数,而Ca只有+2价态?3.金属钛有何宝贵的特性?基于这些特性的主要作用有哪些?4.以TiO2为原料制取TiCl4的两种方法。
写出有关反应方程式。
5.完成并配平下列反应方程式:(1)Ti+HF →(2)TiO2+H2SO4→(3)TiCl4+H2O →(4)FeTiO3+H2SO4→(5)TiO2+BaCO3→(6)TiO2+C+Cl2→(7)Ti+HCl →6.在敞开的容器中,被盐酸酸化了的三氯化钛紫色溶液会逐渐褪色?为什么?7.根据下列实验写出有关反应方程式;将一瓶TiCl4打开瓶塞时立即冒白烟,向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
8.利用标准电极电势数据判断H2S,SO2,SnCl2和金属铝能否把TiO2+离子还原成Ti3+?9.试说明Ti(H2O)62+、Ti(H2O)63+和Ti(H2O)64+离子中哪些离子不能在水溶液中存在?为什么?10.怎样鉴别TiO 2+离子和Ti 3+离子?11.(1)Ti(H 2O)63+配离子在约490nm 处显示一个较强吸收,预测Ti(NH 3)63+将吸收较长波长还是较短波长的光,为什么?(2)已知TiCl 63-在784nm 处有一宽峰,这是由什么跃迁引起的,该配离子的△o 值为多少? 钒1.给出合理的解释:(1)VF 5是已知的,而VCl 5不稳定;(2)某些钒(V )的化合物,其离子虽为d 0结构,但却是有色的;(3)钒是过渡元素,而磷是非金属,然而这二个元素有相似之处,请给予说明。
无机化学第16章 过渡元素2题解

Ag Cl(D白色) +2NH3 =[Ag(NH3)2 ]Cl(溶液)
9.有一黑色固体A,不溶于水和氢氧化钠,但易溶于热 浓盐酸,并生成绿色溶液B。B与铜粉一起煮沸,逐渐 变为土黄色溶液C。C用大量水稀释出现白色沉淀D。 白色沉淀D溶于氨水成无色溶液E。E在空气中转变成 蓝色溶液F。向F中加入KCN,蓝色消失,生成溶液G。 向G中撒入锌粉,生成红色沉淀H。H溶于热硝酸中生 成蓝色溶液I。用碱处理I,生成浅蓝色沉淀J。将J滤出 后强热,又变成A。试确定A,B,C,D,E,F,G,F,G,H,I,J所 代表的物质,并写出反应方程式。
第十六章 过渡元素(二)
作业
第275页:2., 6.,8.,9.
2.写出下列反应方程式:
1. Cu+2H2SO4 (浓) CuSO4 +SO2 +2H2O
2. 2Cu+4NaCN+2H2O 2Na[Cu(CN)2 ]+2NaOH+H2
3. 4CuO 加热1000℃O2 +2Cu2O
4. Cu2O+H2SO4 CuSO4 +Cu +H2O 5. 2CuSO4 +4NaI 2CuI +I2 +2Na2SO4 6. 2Cu2+ + 6CN- (过量) 2[(Cu(CN)2 )]- +(CN)2 7. Cu2+ +4NH3 (过量) [Cu(NH3)4 ]2+
I
浅蓝J
将J滤出后强热,又变成A。
10. Cu(OH)2 强热 CuO+H2O
【最新资料】2016年厦门大学无机元素化学期末考试试卷

班级 姓名 分数一、选择题 ( 共 9题 17分 ) 1. 1 分在下列化合物中,属杂多酸盐的是……………………………………………………( ) (A) Na 3[P(W 12O 40)] (B) KCr(SO 4)2·12H 2O (C) Na 4Mo 7O 23 (D) Fe 2(CO)92. 2 分欲将K 2MnO 4转变为KMnO 4,下列方法中可得到产率高、质量好的是………………( ) (A) CO 2通入碱性K 2MnO 4溶液 (B) 用Cl 2氧化K 2MnO 4溶液 (C) 电解氧化K 2MnO 4溶液 (D) 用HAc 酸化K 2MnO 43. 2 分下列物质不能大量在溶液中共存的是…………………………………………………( )(A)-36Fe(CN)和OH -(B)-36Fe(CN)和I -(C)-46Fe(CN)和I 2(D) Fe 3+ 和Br -4. 2 分下列离子中氧化性最强的是……………………………………………………………( )(A) CoF -36 (B) Co(NH 3)+33(C) Co(CN)-36(D) Co 3+5. 2 分某金属离子在八面体弱场中的磁矩是4.90 B.M.,而在八面体强场中的磁矩为0,该中心金属离子可能是……………………………………………………………………………( ) (A) Cr(III) (B) Mn(II) (C) Mn(III) (D) Fe(II)6. 2 分弱场中,八面体和四面体配合物的 CFSE 相等的是…………………………………( )(A) Fe 2+ (B) Ni 2+ (C) Mn 2+ (D) Cu 2+7. 2 分在[Co(en)(C 2O 4)2]配离子中,中心离子的配位数为…………………………………( ) (A) 3 (B) 4 (C) 5 (D) 68. 2 分[Fe(H 2O)6]2+的晶体场稳定化能(CFSE)是……………………………………………( ) (A) -4 Dq (B) -12 Dq (C) -6 Dq (D) -8 Dq厦门大学“无机化学(二)”课程试卷化学化工学院化学系、材料系2004年级化学各专业 试卷类型:(闭卷、A 卷) 考试时间:1小时9. 2 分根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是…………………………………………………………………………………… ( ) (A) d 2 (B) d 3 (C) d 4 (D) d 8二、填空题 ( 共 4题 13分 )10. 4 分K 2Cr 207溶液分别与BaCl 2、KOH 、浓HCl(加热)和H 2O 2(乙醚)作用,将分别转变为_______________,______________,_____________,_____________ 。
无机化学习题(2)---文本资料

6-6 用四个量子数n,l,m和ms对原子核外n=3的所有电子分 别进行描述。 解:n=3,则l=0,1,2。 l=0 m=0 l=1 m=-1,0,+1 l=2 m=-2,-1,0,+1,+2 轨道数目: 1+3+5=9 (n2) 电子数: 2×9=18 (2n2)
这18个电子的运动状态可以用量子数分别描述如下:
2
计算结果是E4s>E3d,说明Cu离子失去4s轨道中的电子
6-10已知离子M2+3d轨道中有5个电子,试退出 (1)M原子的核外电子排布 (2)M元素的名称和符号 (3)M元素在周期表中的位置
• 解:先列出具有3d5~7的元素及其电子构型:
25号 锰 Mn[Ar]3d54s2 26号 铁 Fe[Ar]3d64s2 27号 钴 Co[Ar]3d74s2 根据科顿原子轨道能级图,他们的E4s>E3d,所以形成M2+时, 失去的是2个4s电子。由此可得出结论(1)M原子的核外 电子排布为[Ar]3d54s2,结论(2)M元素是锰,Mn。 [Ar]3d54s2中最高能级属于第4能级组,故M为第四周期元素。 d电子未充满,属于d去区副族元素,其族数等于最高能级 组中的电子总数,即(5+2)为7.因此可推出结论(3)M 元素在周期表中位于d区,第四周期,ⅦB族。
4
5 6 7 8
3
3 3 3 3
1
1 1 1 1
-1
0 0 1 1
-1/2
1/2 -1/2 1/2 -1/2
9
3
2
-2
1/2
• 6-8 Cu原子形成+1价离子时失去的是4电子还是 3d电子?用Slater规则的计算结果加以说明。
高考化学 必备例题 (易错指典型例题评析) 过渡元素

冠夺市安全阳光实验学校2013高考化学必备经典例题(易错指津+典型例题评析)过渡元素【知识网络】【易错指津】1.NO3-与Fe2+在酸性条件下,不能共存。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。
但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。
如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。
反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
【典型例题评析】例1久置于空气中的下列物质,因被氧化而呈黄色的是A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银思路分析:本题考查的是常见的“黄色体系”有四种固体:溴化银、硫、过氧化钠、三硝基甲苯;外加几种黄色溶液:浓HNO3(因溶液中有NO2气体)、工业盐酸(含Fe3+离子)、不纯的硝基苯(因溶有NO2)、亚铁盐溶液(因含Fe3+离子)等。
对于该题除考查物质的物理性质颜色之外,还附加了一个条件:“因被氧化”,因此,只能考虑B选项。
答案:B方法要领:本题是“氧化”概念与化合物的物理、化学性质的结合。
该题看似简单,但很容易选错,关键注意答题时要看清题目的限制条件,并把握全面。
抓住“氧化”这一特征便可。
例2某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH 溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是A.NH4+B.Mg2+C.Fe2+D.Al3+思路分析:各离子在加入NaOH溶液和HCl的变化过程中,离子变化为:NH4+→NH3;Mg2+→Mg(OH)2→Mg2+;Fe2+→Fe(OH)2→Fe(OH)3→Fe3+;Al3+→AlO2-→Al3+。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过渡元素(二)
1.试回答和解释下列事实:
(1)PdCl 2·2PF 3比PdCl 2·2NH 3稳定?而BF 3·NH 3却比BF 3·PF 3稳定得多?这是为什么? (2)相应的化学式为PtCl 2(NH 3)2的固体有两种异构体(顺、反),它们的颜色不同,一种
是棕黄色,另一种是淡黄色;它们在水中的溶解度也有差别,其中溶解度较大的应是哪一种?为什么?
(3)钌和锇的四氧化物都是低熔点的固体(RuO 4为298K 、OsO 4为314K ),试加以解释。
(4)ZrO 2的碱性比TiO 2强,为什么? (5)Nb 和Ta 的原子半径几乎相同,为什么?
2.Pt(NH 3)2(NO 3)2有α和β两种构形。
α形与草酸反应生成Pt(NH 3)2C 2O 4,但β形与草酸反应得到的反应产物却是Pt(NH 3)2(C 2O 4H)2。
为什么会出现不同的反应产物?用什么物理方法来区分α形和β形。
请画出这两种配合物的结构式。
3.完成下列方程式 (1)Pt +HNO 3+HCl → (2)PdCl 2+CO +H 2O → (3)K 2PtCl 6+K 2C 2O 4 → (4)MoO 42-+Zn 2++H + → (5)Mo 3+
+NCS -
→ (6)(NH 4)2PtCl 6 →
(7)K 2PtCl 6+N 2H 2·2HCl → (8)ZrCl 4+H 2O → (9)PtF 6+Xe → (10)Ru +KClO 3+KOH → (11)MoO 3+NaOH → (12)WO 3+NaOH → (13)WO 3·nH 2O → (14)(NH 4)2ZrF 6 →
4.Zr 和Hf 有何宝贵的特征?基于这些特性有哪些主要用途?
5.锌汞齐能将钒酸盐中的钒(V )还原至钒(II ),将铌酸盐中的铌(V )还原至铌(IV ),但
△ △
△ △
不能使钽酸盐还原,此实验结果说明了什么规律性?
6.R
3Cl
9
溶于含Pph
3
的溶剂中形成化合物为R
3
Cl
9
(Pph
3
)
3
,试画出其结构式。
7.举例说明什么是多酸(同多酸和杂多酸)?它们的主要用途。
8.试指出铂制器皿中能否进行下述各试剂参与的化学反应。
(1)HF (2)王水(3)NaOH+Na
2O
2
(4)Na
2
CO
2。
