无机化学 p区元素习题
大连理工大学无机化学教研室《无机化学》(第5版)(课后习题详解 p区元素(二))

H2S 和调节 pH 的方法来鉴别它们?
解:分别取少量四种溶液于试管中,然后通入 H2S 至饱和,出现黑色沉淀的是
P(b N)O3 2 ,然后在不出现沉淀的三支试管中加入 NH3 gH 2O ,出现黑色沉淀的是 FeSO4 ,出
现肉色沉淀的是 MnSO4 ,不出现沉淀的是 K2SO4 。PbS 的
,不溶于稀酸,
离心分离,即考研考证电子书、题库视频学习平 台
6..某金属氧化物 A 的晶体放入水中生成白色沉淀 B;再加入盐酸,沉淀 B 消失,又
得到 A 的溶液。此溶液与过量的稀 NaOH 溶液反应生成白色沉淀 C;C 与 NaClO-NaOH
2
2
2.完成并配平下列反应方程式: 解:各反应方程式如下:
3.完成并配平下列反应方程式:
1/7
圣才电子书
十万种考研考证电子书、题库视频学习平 台
解:各反应方程式如下:
4..写出下列反应方程式: (1)三氧化二砷溶于氢氧化钠溶液;(2)三硫化二锑溶于硫化铵溶液; (3)硝酸铋溶液稀释时变混浊; (4)硫代亚锑酸钠与盐酸作用; (5)铋酸钠与浓盐酸反应。 解:各反应方程式如下:
12..将 SO2(g)通入纯碱溶液中,有无色无味气体(A)逸出,所得溶液经烧碱中 和,再加入硫化钠溶液除去杂质,过滤后得溶液(B)。将某非金属单质(C)加入溶液 (B)中加热,反应后再经过滤、除杂等过程后,得溶液(D)。取 3mL,溶液(D)加入 HCl 溶液,其反应产物之一为沉淀(C)。另取 3mL 溶液(D),加入少许 AgBr(s),则其 溶解,生成配离子(E)。再取第 3 份 3mL 溶液(D),在其中加入几滴溴水,溴水颜色消 失,再加入 BaCl2 溶液,得到不溶于稀盐酸的白色沉淀(F)。试确定 A,B,C,D,E,F 的化学式,并写出各步反应方程式。
武汉大学版无机化学课后习题答案(第三版)第15章p区元素

P区元素(1)1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
(1)O2+(二氧基阳离子)(2)O2(3)O2-(超氧离子)(4)O22-(过氧离子)解:见下表物种分子轨道键键级磁性相对稳定性O2+KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)11( П2pz*)0一个σ键一个二电子П键,一个三电子П键2.5 顺依次减小O2KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键二个三电子П键2 顺O2-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键一个三电子П键1.5 顺O22-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)2一个σ键 1 逆2. 重水和重氧水有何差别?写出它们的分子式。
它们有何用途?如何制备?答:重水:D2O;重氧水: ;重水是核能工业常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
3. 解释为什么O2分子具有顺磁性,O3具有反磁性?答:根据O2分子的分子轨道式KK(σ2s)2(σ2s*)2(σ2p)2(П2p) 4(П2py*)1( П2pz*)1分子中两个П2p反键轨道各有一单电子,因此它具有顺磁性。
在O3分子中,每个氧原子各用一个P轨道组成一个成键П轨道,一个反键П轨道,一个非键П轨道,其中4各P电子,两个进入成键П轨道,两个进入非键П轨道,П键键级为一,分子没有成单电子,所以分子具有反磁性。
4.在实验室怎样制备O3?它有什么重要性?5.答:在实验室里制备臭氧主要靠紫外光(<185nm)照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,含臭氧可达10%。
臭氧发生器的示意图见图13-10。
它是两根玻璃套管所组成的,中间玻璃管内壁镶有锡锚,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),02就部分转变成了036.7.油画放置久后为什么会发暗、发黑?为什么可用H2O2来处理?写出反应方程式。
无机化学习题(2)

n
10 3
l
2
m
-2
ms
-1/2
1
2 3
3
3 3
0
0 1
0
0 -1
1/2
-1/2 1/2
11
12 13 14 15 16 17 18
3
3 3 3 3 3 3 3
2
2 2 2 2 2 2 2
-1
-1 0 0 1 1 2 2
1/2
-1/2 1/2 -1/2 1/2 -1/2 1/2 -1/2
无机化学习题
第 6章
6-7 量子数n,l,m,ms各有什么意义?举例说明如何用四个量 子数描述电子的运动状态。
解: 主量子数n决定氢原子和类氢离子中电子的能量E;描述原子中电子出 现概率最大区域离核的远近。(n=1,2,3,...,正整数) 角量子数l决定电子绕核运动的角动量的绝对值;多电子原子中电子的 能量由n和l共同决定;决定了原子轨道的形状。(取值0,1,2,...,(n-1)) 磁量子数m决定角动量M在z轴上的分量Mz;决定原子轨道在核外空间 中的取向。(取值0,±1,±2,...,±l,共(2l+1)个取值)
自旋量子数ms决定电子自旋角动量沿外磁场方向的分量Ms的大小。 (ms=±1/2)
6-4 若核外电子的动能为13.6eV,求该电子德布罗意波长。
解:先将13.6eV转换成以J为单位的能量 E= 13.6eV×1.602×10-19J· eV-1 1 由E= 2 mv2得 2E
v=
将电子质量m=9.11×10-31kg和E值代入其中,得
分子或离子的空 间构型
7-8 中心原子的价电子总数是中心原子的价电子数和配位原子提供的电子数之和。
第15章 p区元素(3)

第15章P区元素(三)一是非题1. 所有卤素都有可变的氧化数()2. 实验室中用MnO2 和任何浓度HCl 作用都可以制取氯气()3. 卤素单质的聚集状态熔点沸点都随原子序数增加而呈有规律变化这是因为各卤素单质的分子间力有规律地增加的缘故()4. 卤素中F2 的氧化能力最强故它的电子亲合能最大()5. 溴能从含碘离溶液中取代碘因此碘就不能从溴酸钾溶液中取代出溴()6. 卤素单质性质相似因此分别将F2 和Cl2 通入水中都能将水氧化()7. HX 是强极性分子其极性按HF>HCl>HBr>HI 顺序变化因此HX 的分子间力也按此顺序降低()8. 氢卤酸盐大多是离子晶体,氢卤酸为分子晶体,所以氢卤酸盐的熔点总比氢卤酸高()9. 浓HCl 具有还原性它的盐也必具还原性()10. HX 中卤素处在低氧化数状态时所有HX 都有可能被其他物质所氧化()11. HF 能腐蚀玻璃实验室中必须用塑料瓶盛放()12. 含氧酸的热稳定性随卤素氧化数增加而提高这是因为卤素氧化数增加结合氧原子数增加增加了含氧酸根的对称性()13. 含氧酸中非羟氧原子数越多,酸性越强。
在HF 酸中因为无非羟氧原子,故是弱酸()14. 相同氧化数的不同卤素形成的含氧酸其酸性随元素电负性增加而增强()15. SF4, N2O, XeF2, IF3 价层均有5 对价电子对,但这些分子的空间构性却不同。
这些分子的空间构型分别为变形四面体,直线型,直线型,T 型。
()16. 稀有气体得名于它们在地球上的含量最少。
()二选择题1. 下列物质在常温下呈液态的是()1 HF2 Br23 I24 MgCl22. 下列微粒中不具氧化性的是()1 F2 2 Cl-3 BrO-(4) I23. 根据标准电极电位,判断卤素离子X-能被O2 氧化发生4X-+O2+2H2O=2X2+4OH-反应的是()1 F-2 Cl-(3)Br-(4)都不能4. 在任何温度下,X2 与碱性溶液作用能得到XO3-和X-的卤素是()1 F2 2 Cl23 Br2 (4) I25. 由于HF 分子间形成氢键而产生的现象是()1 HF 的熔点高于HCl2 HF 是弱酸3 除F-化物外还有HF2 等化合物4 三种现象都是6. HX 及卤化物中的X- 具有最大还原性的是()1 F-2 I-3 Cl-4 Br-7. 盐酸是重要的工业酸,它的产量标志国家的化学工业水平,其主要性质是()1 浓HCl 有络合性2 具有还原性3 具有强酸性4 三者都是8. 下列各组溶液按pH 值增大顺序排列的是()1 HI<HBr<HCl<HF2 HClO4<HClO3<HClO3 HClO<HBrO<HIO4 三者都是9. 下列各组物质,按热稳定性顺序增加排列的是()1 HI<HBr<HCl<HF (2) HClO<NaClO3 HClO<HClO3<HClO4(4) 三者都是10. 下列各组物质其水解程度按顺序增加排列的是()1 KClO3, KClO2, KClO (2) KClO, KbrO, KIO3 KCl, KClO, NH4ClO (4)三者都是11. 氯元素会全部被氧化的反应是()1 Cl2+H2O=HCl+HClO (2) 2NaCl+F2=2NaF+Cl23 4HCl+MnO2=MnCl2+Cl2+2H2O4 2NaCl+3H2SO4+MnO2=MnSO4+2NaHSO4+2H2O+Cl212. 制备F2 实际所采用的方法是()1 电解HF2 电解CaF23 电解KHF24 电解NH4F13. 实验室制备Cl2 气体的最常用的方法是()1 KMnO4 与浓盐酸共热2 MnO2 与稀盐酸反应3 MnO2 与浓盐酸共热4 KMnO4 与稀盐酸反应14. 实验室制得的氯气含有HCl 和水蒸气欲通过二个洗气瓶净化下列洗气瓶中试剂选择及顺序正确的是()1 NaOH 浓H2SO42 CaCl2 浓H2SO43 H2O 浓H2SO4 4 浓H2SO4 H2O15. 下列各试剂混合后能产生氯气的是()1 NaCl 与浓H2SO42 NaCl 和MnO23 NaCl 与浓HNO34 KMnO4 与浓HCl16. 实验室中制取少量HBr 所采用的方法是()1 红磷与Br2 混合后滴加H2O; 2 KBr 固体与浓H2SO4 作用3 红磷与H2O 混合后滴加Br2;4 Br2 在水中歧化反应17. 欲由KBr 固体制备HBr 气体应选择的酸是()1 H2SO42 HAc3 HNO34 H3PO418. 氢氟酸最好储存在()1 塑料瓶中2 无色玻璃瓶中3 金属容器中4 棕色玻璃瓶中19. 卤素单质中与水不发生水解反应的是1 F2 2 Cl23 Br24 I220. 下列含氧酸中酸性最弱的是()1 HClO2 HIO3 HIO34 HBrO21. 下列含氧酸中酸性最强的是()1 HClO32 HClO3 HIO34 HIO22. 下列有关卤素的论述不正确的是()1 溴可由氯作氧化剂制得2 卤素单质都可由电解熔融卤化物得到3 I2 是最强的还原剂4 F2 是最强的氧化剂23. 下列含氧酸的氧化性递变不正确的是()1 HClO4>H2SO4>H3PO42 HBrO4>HClO4>H5IO63 HClO>HClO3>HClO4 4 HBrO3>HClO3>HIO324. 下列物质中关于热稳定性判断正确的是()1 HF<HCl<HBr<HI2 HF>HCl>HBr>HI3 HClO>HClO2>HClO3>HClO4 4 HCl>HClO4>HBrO4>HIO4三填空题1 . F Cl Br 三元素中电子亲合能最大的是单质的解离能最小的是2. 键能F2 Cl2活泼性F2Cl23. 卤素单质的颜色为F2 Cl2, Br2, I24. 下列物质的颜色为I2 I2溶于CCl4中I2溶于乙醇中少量I2溶于KI 溶液中A 紫色 B. 紫黑色 C. 红棕色 D. 黄色5. I2溶于KI 溶液中的颜邓可能为或原因是6. 将Cl2(g)通入热的Ca(OH)2 溶液中反应产物是低温下Br2与Na2CO3溶液反应的产物是常温I2与NaOH 溶液反应的产物是7. 用NaCl 固体和浓硫酸制HCl 时是充分考虑了HCl 的性性和性8. 反应KX s +H2SO4(浓)====KHSO4+HX 卤化物KX 是指和9. 导致氢氟酸的酸性与其他氢卤酸明显不同的因素主要是小而特别大10. 比较下列各对物质的热稳定性1 ClO2I2O52 HClO2HClO43 IF7 BrF74 NaICl4CsICl45 IBr2- I2Br-11. 不存在FCl3的原因是12. HOX 的酸性按卤素原子半径的增大而13. 含氧酸的酸性常随非羟基氧或酰氧原子数的增多而14. 氧化性HClO3 HClO酸性HClO3HClO15 Cl2O 是的酸酐I2O5是的酸酐16. HClO4的酸酐是它具有强性受热易发生17 高碘酸是元酸,其酸根离子的空间构型为其中碘原子的杂化方式为高碘酸具有强性四完成并配平下列反应方程式1. 向KBr 固体加浓硫酸2. I2与过量双氧水反应3. 硫代硫酸钠溶液加入氯水中4. 溴水中通入少量H2S5. 向Na2S2溶液中滴加盐酸6. 向HI 溶液中通入O37. 将氟通入溴酸钠碱性溶液中8. 氯酸钾受热分解9. 次氯酸钠溶液与硫酸锰反应10. 氯气通入碳酸钠热溶液中11. 浓硫酸与溴化钾反应12. 浓硫酸与碘化钾反应13. 向碘化亚铁溶液中滴加过量氯水14. 向碘化铬溶液中加入次氯酸钠溶液15. 用氢碘酸溶液处理氧化铜16. 将氯气通入碘酸钾的碱性溶液中五简答题1. 氟的电子亲合能比氯小但F2 却比Cl2 活泼请解释原因。
无机化学p区元素习题_2012.6.12_

p区、d区、ds区元素练习题一、选择题1.硼的氢化物称为硼烷,最简单的硼烷是(B)。
(A) BH3(B) B2H6 (C) BH4- (D) BH42.硼酸的分子式常写成H3BO3,它是(A)。
(A) 一元弱酸;(B) 二元弱酸;(C) 三元弱酸(D) 强酸3.在三氟化硼分子中,B与F的电负性差较大(>1.7),它是(C)。
(A) 离子化合物 (B) 极性分子 (C) 非极性分子 (D) 常温下为固态化合物4.在硼氢化物B2H6中,连接两个B之间的化学键(D)。
(A) 氢键(B) 配位键 (C) 共价键 (D) 氢桥5.关于硼化物的下列叙述中,错误的(C)。
(A) 硼砂是最重要的硼酸盐(B) 卤化硼在水中能发生水解(C) 所有含硼化合物都是缺电子化合物 (D) 在固态硼化物或其水溶液中,均不存在B3+离子6.[Al(OH)4]-中,Al的杂化方式为(B)。
(A) sp (B) sp3 (C) sp2(D)sp2d7.在硼的化合物中,硼原子的最高配位数不超过4,这是因为(D)。
(A) 硼的氧化值最大为3 (B) 配位原子半径小(C) 硼与配位原子电负性差小 (D) 硼原子无价层d轨道。
8.在H3BO3分子及其晶体中,存在的化学作用有(A)。
(A) 共价键,氢键,分子间力 (B) 离子键,氢键(C) 共价键,氢键(D) 离子键,氢键,分子间力9.下列试剂中,与铝盐溶液混合后无沉淀生成的(D)。
(A) Na2CO3溶液 (B) 过量的氨水 (C) Na2S溶液 (D) 过量的NaOH溶液10.下列化合物中偶极矩不为零的分子是(D)。
(A) CO2(B) CCl4 (C) CS2 (D) CO11.石墨中层与层之间的结合力是(C)。
(A) 共价键 (B) 自由电子 (C) 范德华力 (D) 大π键12.常压下饱和CO2溶液中,下列物种浓度最大的是(A )。
(A) CO2⋅H2O (B) H2CO3 (C) HCO3- (D)CO32-13.SiF4分子的空间构型(C)。
大连理工大学无机化学教研室《无机化学》(第5版)-章节题库-第13章 p区元素(一)【圣才出品】

第13章 p 区元素(一)一、选择题1.下列酸中属于一元酸的是( )。
【答案】A【解析】H 3BO 3在水中电离的方程式为:H 3BO 3 + H 2O = B (OH )4- + H +,而B (OH )4-不再电离,所以H 3BO 3为一元酸。
2.有三种氧化物,其中能与浓盐酸反应放出可以使淀粉碘化钾试纸变蓝的黄绿色气体,在硫酸介质中与溶液反应,使溶液变成紫红色,则该氧化物是( )。
【答案】D【解析】使淀粉碘化钾试纸变蓝的黄绿色气体为Cl 2;在硫酸介质中与溶液反应,使溶液变成紫红色,是因为反应生成了MnO 7-。
上述过程中,发生以下反应:PbO 2+4HCl (浓)=PbCl 2+Cl 2+2H 2O5PbO 2+2Mn 2++4H +=5Pb 2++2MnO 4-+2H 2O 3.下列氧化物酸性强弱次序中,错误的是( )。
【解析】氧化物的酸性强弱与电负性有关,电负性越大,酸性越弱。
4. ()不是CO的等电子体。
A.NOB.NO+C.N2一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
5.下列无机酸中能溶解的是()。
A.HClC.HF【答案】C【解析】SiO2能与HF酸发生反应,反应方程为SiO2+4HF→SiF4+2H2O。
6.配SnCl2溶液,常在溶液中放入少量固体Sn粒。
其理由是()。
A.防止Sn2+被氧化B.防止Sn2+水解C.防止SnCl2溶液产生沉淀D.防止Sn2+溶液挥发【解析】加入Sn 粒,溶液中即使有Sn 4+生成,也能被Sn 还原。
反应式为Sn 4++ Sn = 2Sn 2+。
7.下列化合物不属子缺电子化合物的是( )。
A .BCl 3B .HBF 4C .B 2H 6D .Al (OH )3【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。
无机化学第五版第十四章

在O3中,中心氧原子的δ=6-2-6×3畅443畅44+3畅44=1左侧端基氧原子:δ=6-4-4×12=0右侧端基氧原子:δ=6-6-2×12=-1 当然,对O3这一特例,部分电荷的计算与形式电荷的计算是一致的,这是一种巧合。
通过计算表明O3是极性分子,正电荷的中心靠近中心氧原子,负电荷中心靠近端基氧原子。
必须指出的是:这种计算虽然能说明O3的极性,但仍然很粗糙,实际上两个端基氧原子的电荷密度是相等的。
O3中有Π43键,端基O 与中心O之间并不是一个双键、一个配键。
这正是Lewis结构的不足所致。
在CO中,δ(C)=4-2-6×2.552.55+3.44=-0.554δ(O)=6-2-6×3.442.55+3.44=+0.554由此可以推断:在CO中正电荷中心靠近O,负电荷中心靠近C。
这一推断与实验事实是一致的(分子轨道理论也对CO的极性做出了解释)。
通过部分电荷的计算,讨论O3,CO的极性,以便开阔思路,可尝试推广之。
主要参考文献 [1]Bodner G M.Core Text Chemistry Structure&Dynamics.John Wiley&Sons Inc,1996. [2]Shriver D F.Inorganic Chemistry.2nd ed.Oxford University Press,1994. 中译本:高忆慈,译.无机化学.2版.北京:高等教育出版社,1997.三、习题解析 1(141)畅试写出下列物质之间的反应方程式((1),(4)略)。
(2)液氨和钠; (3)浓硝酸和汞; (5)稀硝酸和银;(6)锡和浓硝酸; (7)氯化铵溶液与亚硝酸钠溶液;(8)酸性溶液中碘化钾与亚硝酸钠。
解:(2)2N H3(l)+2Na(s)NaN H2(am)+H2(g) (3)H g(l)+4H N O3(浓)H g(N O3)2(aq)+2N O2(g)+2H2O(l) (5)3Ag(s)+4H NO3(稀)3AgN O3(aq)+NO(g)+2H2O(l) (6)Sn(s)+4H N O3(浓)β-H2SnO3(s)+4N O2(g)+H2O(l) (7)N H4Cl(aq)+NaN O2(aq)△N2(g)+NaCl(aq)+2H2O(l) (8)2I-(aq)+2N O-2(aq)+4H+(aq)I2(aq)+2N O(g)+2H2O(l) 2(142)畅完成并配平下列反应方程式((1),(2)略): (3)Cu(N O3)2△(4)H g(N O3)2△ 解:(3)2Cu(N O3)2(s)△2CuO(s)+4NO2(g)+O2(g) (4)H g(N O3)2△H g(g)+2N O2(g)+O2(g) 樉熟悉硝酸盐受热分解的规律。
无机化学第五章习题参考答案
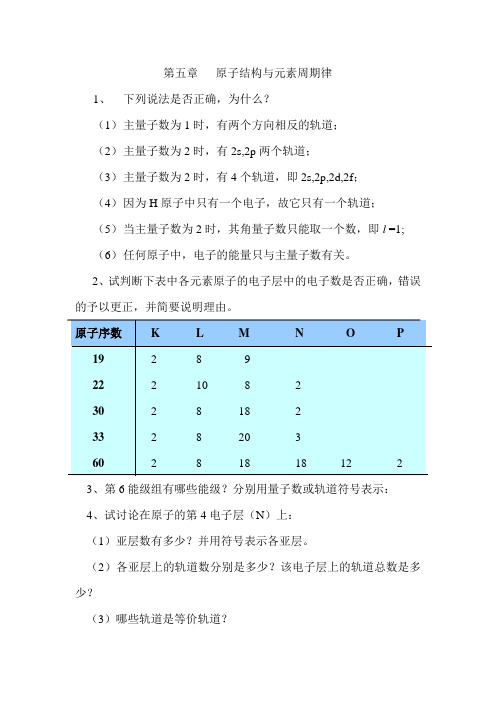
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
大连理工大学无机化学教研室《无机化学》(第5版)-章节题库-第15章 p区元素(三)【圣才出品】

第15章 p区元素(三)一、选择题1.制备HBr 可用NaBr 与下列( )酸作用。
【答案】C【解析】卤化氢具有挥发性,一般实验室制备卤化氢均采用复分解反应法,即用金属卤化物与酸发生反应制备卤化氢。
制备氟化氢、氯化氢时选用浓硫酸;溴化氢和碘化氢有较显著的还原性,能与浓硫酸进一步发生氧化还原反应而得到Br 2、I 2,故一般选用无氧化性的高沸点浓磷酸代替浓硫酸制得溴化氢和碘化氢。
NaBr +H 3PO 4NaH 2PO 4+2HBr ∆−−→2.HCl ,HBr ,HI 三种物质的沸点依次升高的主要原因是( )。
A .范德华力减小B .取向力增大C .诱导力增大D .色散力增大【答案】D【解析】在HCl ,HBr ,HI 三种物质中,色散力是分子间主要的作用力。
对液态物质,分子间力越大,汽化热就越大,沸点就越高。
3.I 2在下述溶液中溶解度最大的是( )。
A .水B .KI 水溶液C .NaCl 水溶液D .NaF 水溶液【答案】B【解析】I 2在KI 溶液中,溶解度增大,这主要是由于生成了I 3-的缘故:I2+I-I3-ƒ4.下列物质中极性最弱的是()。
A.HF B.HCl C.HBr D.HI【答案】D【解析】两种元素的电负性相差越大,它们之间键的极性就越强,卤素中氟的电负性为4.0,氯为3.0,溴为2.8,碘为2.5,而氢的电负性为2.1。
显然,在卤化氢分子中键的极性强弱的程度应为:HF>HCl>HBr>HI,故HI的极性最弱。
5.工业上生产碘的方法之一是采用碘酸根离子(IO3-)与亚硫酸氢根离子(HSO3-)溶液相互作用,亚硫酸氢根离子被氧化成硫酸根离子,而碘酸根被还原成碘。
还原1molIO3-需要亚硫酸氢根离子的物质的量是()。
A.0.4molB.1.0molC.2.0molD.2.5mol【答案】A【解析】IO-3 I2转移5e-;HSO3- SO42-转移2e-根据得失电子守恒可得5·n(IO3-)=2·n(HSO3-),则得所需n(HSO3-)=2.5mol。
北师大考研无机化学复习题第十四章

第14 章p 区元素(二)一、教学基本要求1.了解16-18族元素的特点;2.了解重点元素硫、卤素的存在、制备和用途;3. 掌握重点元素硫、卤素的单质及其化合物的性质,会用结构理论和热力学解释它们的某些化学现象;4. 了解第1个稀有气体化合物的诞生及其对化学发展的贡献。
二、要点1.薄膜法(membrane process)工业上利用离子交换电解NaCl水溶液生产Cl2的一种方法,隔开阳极室和阴极室的薄膜式一带有支链(支链上有磺酸基或羧基)的聚全氟乙烯骨架高分子离子交换膜,这种阳离子交换膜允许Na+由阳极室流向阴极室以保持电解过程中两室的电荷平衡,而不让OH-按相反方向流向阳极室。
2. 臭氧空洞(ozone hole)指的是因空气污染物质,特别是氧化氮和卤代烃等气溶胶污染物的扩散、侵蚀而造成大气臭氧层被破坏和减少的现象。
经过跟踪、监测,科学家们找到了臭氧空洞的成因:一种大量用作制冷剂、喷雾剂、发泡剂等化工制剂的氟氯烃是导致臭氧减少的"罪魁祸首"。
另外,寒冷也是臭氧层变薄的关键,这就是为什么首先在地球南北极最冷地区出现臭氧空洞的原因了。
3.恒沸溶液(azeotropic solution)恒沸溶液即恒沸混合物。
在一定条件下,当某些溶液的组成与其相平衡的蒸气组成相同时,溶液在蒸馏时期沸点保持恒定,故称恒沸溶液。
例如,在一大气压下,氯化氢和水的恒沸混合物中含氯化氢的重量百分数为20.24,其恒沸点是108.6℃。
4.制备某些重要含硫工业产品的途径:化合态硫或天然单质硫2 22SO4 2Cl23H3H 2SO4三、学生自测练习题1.是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1.1 所有卤素都有可变的氧化数。
( )1.2 实验室中用MnO2和任何浓度HCl作用,都可以制取氯气。
( )1.3 卤素单质的聚集状态、熔点、沸点都随原子序数增加而呈有规律变化,这是因为各卤素单质的分子间力有规律地增加的缘故。
无机化学习题库p_区元素

⽆机化学习题库p_区元素⼀是⾮题1. BF3 中的 B 是以sp2 杂化轨道成键的当BF3 ⽤B 的空轨道接受NH3 的成BF3·NH3 时,其中的B 也是以sp2 杂化轨道成键的,()2. B2H6 和LiH 反应能得到LiBH4,若此反应在⽔溶液中进⾏仍可制得[BH4]-离⼦()3. H3BO3 中有三个氢因此是三元弱酸()4. AlCl3 分⼦中Al 是缺电⼦原⼦因此AlCl3 中有多中⼼键()5. SiF4、SiCI4 、SiBr4 、和SiI4 都能⽔解⽔解产物都应该是硅酸H2SiO3 和相应的氢卤酸HX()6. 氧化数为⼗2 的Sn 具有还原性将锡溶于浓盐酸得到的是H2[Sn IV Cl6] ⽽不是H2[Sn II C14] ()7. 为了防⽌制备的锡盐溶液发⽣⽔解⽽产⽣沉淀可加酸使溶液呈酸性⾄于加酸的时间于沉淀的先后⽆关,可以在沉淀产⽣后⼀段时间再加酸()8. 氮与⽐它电负性⼤的元素成键才可能成为正氧化态数因此氮与氟或氧成键时氮为正氧化数()9. N3-在⽔溶液中是以NH3 存在()10. 浓和稀硝酸作为氧化剂时它们的还原产物分别为NO2 和NO 可见⼀个浓硝酸分⼦还原时的⼀个电⼦,⼀个稀硝酸分⼦却得三个电⼦,因此浓硝酸的氧化能⼒⽐稀硝酸的弱()⼆选择题1. 下列化合物属于缺电⼦化和物的是()(A) BeCl3(B) H[BF4] (C) B2O3(D) Na[Al(OH)4]2. 在硼的化合物中硼原⼦的最⾼配位数不超过4 这是因为()(A) 硼原⼦半径⼩ (B) 配位原⼦半径⼤(C) 硼与配位原⼦电负性差⼩(D) 硼原⼦⽆价层d 轨道3. 下列关于BF3 的叙述中正确的是()(A) BF3 易形成⼆聚体(B) BF3 为离⼦化合物(C) BF3 为路易斯酸(D) BF3 常温下为液体4. 下列各对物质中中⼼原⼦的轨道杂化类型不同的是()(A) CH4 与SiH4 (B) H3O+与NH3(C) CH4 与NH +(D) CF4 与SF45. 下列含氧酸根中具有环状结构的是()(A) Si3O 9 (B) P3O 10 (C) B3O 7 (D) S4O 66 有⼀淡黄⾊固体含23%硼(B )的相对原⼦质量为10.81)和77%氯,他是从三氯化硼制得的0.0516 克此试样在69 度蒸发,蒸⽓在2.96kPa 时占有体积268cm3此化合物的化学式是()(A) B4C l4(B) B8Cl8(C) B12Cl12(D)B16Cl167. 可形成下⾯⼏种类型化合物的X 元素是(NH3)2; X2O3; XCl3; XO .2 ; XF3; HF()(A) P (B) Al (C) B (D) S8. 下列⾦属单质中熔点最低的是()(A) Cu (B) Zn (C) Na (D) Ga9. 下列化合物中熔点最低的是()(A) BCl3(B) CCl4 (C) SiCl4(D) SnCl410. 下列物质在⽔中溶解度最⼩的是()(A) Na2CO3(B) NaHCO3(C) Ca(HCO3)2(D) KHCO311. 下列分⼦中偶极矩不为零的是()(A) BCl3(B) SiCl4(C) PCl5(D) SnCl212. 下列含氧酸中属于⼀元酸的是()(A) H3AsO3(B) H3BO3(C) H3PO3(D) H3CO313. 下列物质中酸性最强的是()(A) B(OH)3(B) Al(OH)3(C) Si(OH)4(D) Sn(OH)414. 下列物质中酸性最强的是()(A) H2SnO3 (B) Ge(OH)4(C) Sn(OH)2(D) Ge(OH)215. 下列各组化合物中对热稳定性判断正确的是()(A) H2CO3 > Ca(HCO3)2(B) Na2CO3 > PbCO3(C) (NH4)2CO3 > K2CO3 (D) Na2SO3 > Na2SO416. 下列化合物中不⽔解的是()(A) SiCl4(B) CCl4(C) BCl3(D) PCl517. 与Na2CO3 溶液反应⽣成碱式盐沉淀的离⼦是()(A) Al3+(B) Ba2+(C) Cu2+ (D) Hg2+18. 1mol 下列物质溶于1dm3 ⽔中⽣成的溶液中H+浓度最⼤的是()(A) B2O3(B) P4O10 (C) N2O4(D) SO319. 1mol 下列物质⽣成正酸时所需⽔的mol 数最多的是()(A) B2O3(B) P4O10(C) (SO3)3(D) N2O520. 碳化铝固体与⽔作⽤产⽣的⽓体是()(A) C2H2(B) CH3CCH (C) CO2(D) CH421. 下列物质⽔解并能放出氢⽓的是()(A) B2H6(B) N2H4(C) NH3 (D) PH322. 下列物质中还原性最强的是()(A) GeH4(B) AsH3(C) H2Se (D) HBr23. 下列⾦属中与硝酸反应得到产物价态最⾼的是(A) In (B) Tl (C) Sb (D) Bi24. 常温下不能稳定存在的是()(A) GaCl . (B) SnCl4 (C) PbCl4 (D) GeCl425. 下列氧化物中氧化性最强的是()(A) SiO2 (B) GeO2 (C) SnO2 (D) Pb2O326. 下列化合物中不能稳定存在的是()(A) SbI3(B) PI3(C) AlI3(D) TlI327. 下列化学式中代表⾦刚砂的是()(A) Al2O3(B) CaC2(C) SiO2 (D) SiC三填空题1 . 最简单的硼氢化合物是其结构式为它属于化合物 B 的杂化⽅式为B与B 之间存在⽽硼的卤化物以形式存在其原因是分⼦内形成了键,形成此键的强度( 按化合物排列) 顺序为2. ⽆机苯的化学式为其结构为与的结构相似3. 硼酸为状晶体,分⼦间以键结合,层与层之间以结合。
北师大考研无机化学复习题第十三章

北师⼤考研⽆机化学复习题第⼗三章第13 章p 区元素(⼀)⼀、教学基本要求1. 了解p区元素的特点;2. 了解p区元素的存在、制备及⽤途;3. 掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会⽤结构理论和热⼒学解释它们的某些化学现象;4. 从⼄硼烷的结构了解缺电⼦键和硼烷结构;5. 了解⼀些⽆机材料的制备和⽤途;6.了解惰性电⼦对效应概念及其应⽤。
⼆、要点1.缺电⼦化合物 (Electron-deficient compound)具有共价性的原⼦,若其价电⼦数少于价层轨道数时,这种原⼦称为缺电⼦原⼦。
缺电⼦原⼦以共价键所形成的不具有⼋隅体结构的化合物称作缺电⼦化合物。
如:B原⼦最外层电⼦排布为:2s22p1,有3个价电⼦,但它有四个价层轨道(⼀个3s,三个3p),是缺电⼦原⼦。
当它和卤素原⼦形成BX3时,在中⼼B原⼦外围只能形成三个共⽤电⼦对(6个电⼦),它不是⼋隅结构,这类化合物就是缺电⼦化合物。
2.⾜电⼦化合物 (Electron-precise compound)指所有价电⼦都与中⼼原⼦形成化学键,并满⾜了路易斯结构要求的⼀类化合物。
第14族元素形成⾜电⼦化合物,例如甲烷分⼦CH4 , 分⼦中的键电⼦对数恰好等于形成的化学键数。
3.富电⼦化合物 (Electron-rich compound)指价电⼦对的数⽬多于化学键数⽬的⼀类化合物。
第15族⾄第17族元素形成富电⼦化合物,例如氨分⼦NH3, 4个原⼦结合只⽤了3对价电⼦,多出的两个电⼦以孤对形式存在。
4.稀散元素 (Rare element)⾃然界中不能形成独⽴矿床⽽以杂质状态分散于其他矿物中的元素,如硒、碲、锗、铟、铊等。
可由冶⾦、化⼯作业的各种粉尘、残渣或中间产品中提取。
这些元素在电⼦⼯业、原⼦能⼯业、合⾦材料、电光原材料及催化剂等⽅⾯有重要的⽤途。
5.三中⼼两电⼦键 (Three center two electron bond)它是多中⼼共价键中的⼀种,指三个原⼦共⽤两个电⼦的化学键,中⼼原⼦常为缺电⼦原⼦,例如,硼烷中就存在3e-2c的氢桥键。
大连理工大学无机化学教研室《无机化学》(第6版)笔记和课后习题(含考研真题)详解(13-18章)【圣

2.p 区元素特征 (1)各族元素性质自上而下呈规律性变化 同族自上而下:原子半径↑,金属性↑,非金属性↓。 (2)多种氧化值 ns2np1~6 的价电子构型使大部分 p 区元素具有多种氧化值。 (3)电负性大 电负性:p 区元素>s 区元素。 (4)第二周期元素具有反常性 第二周期元素单键键能(N、O、F)<第三周期元素单键键能(P、S、Cl)。 (5)第四周期元素表现出异样性 d 区元素的插入,使第四周期元素的原子半径显著减小,性质展现出特殊性。
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 13 章 p 区元素(一)
13.1 复习笔记
一、p 区元素概述 1.p 区元素 p 区元素:除 H 以外的所有非金属元素和部分金属元素。 惰性电子对效应:同族元素,自上而下,氧化值低的化合物的稳定性高于氧化值高的化 合物的现象。
圣才电子书 十万种考研考证电子书、题库视频学习平台
③加合反应:B2H6+2NH3→[BH2·(NH3)2]++[BH4]- 【注意】①乙硼烷自燃和水解放热较大,可用于制作火箭燃料。②乙硼烷是剧毒物质, 空气中其最高允许含量为 0.1µg/g。 (2)硼的含氧化合物 ①三氧化二硼 B2O3 a.物理性质 颜色:白色固体;密度:2.55g·cm-3;熔点:450C。 b.化学性质 被碱金属还原:B2O3+3Mg→2B+3MgO 与水反应:
B 2 O 3 HH 22OO 2 H B O 2 HH 22OO 2 H 3 B O 3
②硼酸 H3BO3 化学性质:硼酸为一元弱酸(固体酸);与多羟基化合物发生加合反应;受热易分解。 ③硼砂 硼砂:硼酸盐的一种,水解呈碱性;溶液中,n(H3BO3)=n(B(OH)4-),具有缓冲 作用。 (3)硼的卤化物 ①三卤化硼 BX3 BX3 在湿空气中发生水解反应 BX3+3H2O→B(OH)3+3HX ②氟硼酸 H[BF4] H[BF4]的酸性比 HF 强,可利用 BF3 的水解制备,反应方程为
(完整版)无机化学试题及答案解析

第12 章S 区元素(第一套)一、单选题1. 重晶石的化学式是(A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO32. 下列碳酸盐,溶解度最小的是(A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO33. NaN03受热分解的产物是(A) Na2O,NO2,O2;(B)NaNO2,O2;(C)NaN02,N02,02;(D)Na20,N0,02。
4. 下列哪对元素的化学性质最相似(A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al5. 下列元素中第一电离能最小的是(A) Li (B) Be (C) Na (D) Mg6. 下列最稳定的氮化物是(A) Li3N (B) Na3N (C) K3N (D) Ba3N27. 下列水合离子生成时放出热量最少的是(A) Li+ (B) Na+ (C) K+ (D) Mg2+8. 下列最稳定的过氧化物是(A) Li202 (B) Na202 (C) K202 (D) Rb2029. 下列化合物中键的离子性最小的是(A) LiCl (B) NaCl (C) KCl (D) BaCl210. 下列碳酸盐中热稳定性最差的是(A) BaC03 (B) CaC03 (C) K2C03 (D) Na2C0311. 下列化合物中具有磁性的是(A) Na202 (B) Sr0 (C) K02 (D) Ba0212. 关于s 区元素的性质下列叙述中不正确的是(A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物(B) 在s 区元素中,Be、Mg 因表面形成致密的氧化物保护膜而对水较稳定(C) s 区元素的单质都有很强的还原性(D) 除Be、Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料13. 关于Mg , Ca , Sr , Ba及其化合物的性质下列叙述中不正确的是(A) 单质都可以在氮气中燃烧生成氮化物M3N2(B) 单质都易与水水蒸气反应得到氢气(C) M(HCO3)2在水中的溶解度大MC03的溶解度(D) 这些元素几乎总是生成+2 价离子二、是非题(判断下列各项叙述是否正确对的在括号中填“/ 错的填“X”)1. 因为氢可以形成H+所以可以把它划分为碱金属2. 铍和其同组元素相比离子半径小极化作用强所以形成键具有较多共价性3. 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
大连理工大学无机化学教研室《无机化学》(第5版)(名校考研真题详解 p区元素(三))

15.3 名校考研真题详解一、判断题1.因为I -的极化率大于Cl -,所以θθsp sp (AgI)(AgCl)<K K 。
( )[南京航空航天大学2012研]【答案】√【解析】因为卤素离子随着离子半径增加,变形性越来越大,而银离子属于18e 型离子,极化力强,所以当卤离子半径增加时,卤化银的化学键的共价性越来越明显。
通常认为,氟化银是离子晶体,其它三个都是共价化合物,且化学键的共价性依Cl 、Br 、I 的次序逐渐增强。
所以氟化银可溶于水,其它三个难溶于水且溶解度依次急剧下降。
2.次氯酸钠是强氧化剂,它可以在碱性介质中将[Cr (OH )4]-氧化为Cr 2O 72-。
( )[北京科技大学2011研]【答案】√【解析】次氯酸钠是强碱弱酸盐,其水溶液本身呈碱性,并且ClO -中的Cl 呈+1价,极易得电子形成-1价的稳态离子状态,所以有强氧化性(得电子,化合价降低,被还原),故存在反应()24242ClO Cr OH CrO 2Cl 2H O ----+=++⎡⎤⎣⎦,而Cr 2O 72-是2个CrO 42-之间共用1个O 结合而成的。
3.AgCl 不溶于硝酸,但在浓盐酸中有一定的溶解度。
()[北京科技大学2011研]【答案】√【解析】AgCl在浓盐酸中形成[AgCl2]-。
4.在稀有气体这种单原子分子之间不存在分子间作用力。
()[电子科技大学2010研]【答案】×二、选择题1.碘易升华的原因是()。
[北京科技大学2012研]A.分子间作用力大,蒸气压高B.分子间作用力小,蒸气压高C.分子间作用力大,蒸气压低D.分子间作用力小,蒸气压低【答案】B【解析】碘属于分子晶体,分子间靠较弱范德华力结合,故熔点和沸点较低;I2晶体三相点下的压力高于一个标准大气压,蒸气压较高,故碘容易升华。
2.下列离子中,能在酸性较强的含Fe2+溶液中大量存在的是()。
[北京科技大学2011研]A.Cl-B.NO3-C.ClO3-D.BrO3-【解析】酸性较强的溶液中,如果存在NO3-、ClO3-或BrO3-时,会形成强氧化性酸将Fe2+氧化为Fe3+。
无机化学p区元素习题

无机化学p区元素习题P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题(返回目录)1硼在自然界主要以含氧化合物的形式存在。
()2在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3硼酸是三元酸。
()4硼是非金属元素,但它的电负性比氢小。
()5由于B-O键键能大,所以硼的含氧化合物很稳定。
()6硼砂的化学式为Na2B2O7。
()7B2H6为平面形分子。
()8硼是缺电子原子,在乙硼烷中含有配位键。
()9三卤化硼熔点的高低次序为BF3BCl3>BBr3>BI3。
()11地壳中丰度最大的金属元素是铝。
()12Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13只有在强酸性溶液中才有Al(H3+2O)6存在。
()14在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15Al某3都是共价型化合物。
()16KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17在氯化氢气流中加热金属铝可制得无水AlCl3。
()19因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22硅在地壳中的含量仅次于氧。
()23分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24活性炭具有吸附作用,它是颗粒状的石墨。
()25金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27高纯度的硅和锗是良好的半导体。
()28金刚石与石墨是同素异形体,由金刚石转变为石墨的△rH>0。
()29用碳酸钠溶液沉淀溶液中的Ca2+,Mg2+,Cu2+时,均得到碳酸盐沉淀。
()30水溶液中Cu2+与CO2-3作用形成的沉淀是Cu2(OH)2CO3。
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》笔记和课后习题详解(下册)p区金属

和 Ag(Ⅰ)的电子构型(18e)相类似,因此在 T1(Ⅰ)形成共价键为主的化合物中,与
Ag(Ⅰ)相似。如 TlCl 像 AgCl 一样,为白色絮状沉淀,且暴露于日光下易分解变色;TlCl、
TlBr、TlI 同 AgCl、AgBr、AgI 一样,溶解度均很小;也能生成难溶的
三、判断题
1.
难溶于 HAc(aq)。( )
【答案】×
2.
可溶于浓硫酸。( )
【答案】√
3.制备α-锡酸应在高温下进行。( ) 【答案】×
四、简答题
1.铊(Ⅰ)的化合物和银(Ⅰ)的某些相应化合物有何相似之处?说明原因。
答:元素在化合物中所表现的性质与它的电荷-半径比及电子层结构密切相关。特别是
在共价化合物中,其电子层结构与极化能力和变形性相联系。Tl(Ⅰ)的电子构型(18+2e)
【答案】Sn(Ⅱ);差
5 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
4.填写下列反应的主要产物,并指出产物的颜色
(1)
______
______ ______。
(2)
______
______ ______。
(3)
______
______。
【答案】(1)
【答案】D
8.在 和 化合物中,Tl 的氧化数分别为( )。 A.+3、+3 B.+1、+1 C.+3、+1 D.+1、+3 【答案】C
9.下列物质不溶于 NaOH 溶液的是( )。
【答案】D
2 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
10.下列反应方程式正确的是( )。
B.除 是共价化合物外,其余都是离子化合物
无机化学实验习题答案

转无机化学实验习题答案实验习题p区非金属元素(卤素、氧、硫)1.氯能从含碘离子的溶液中取代碘,碘又能从氯酸钾溶液中取代氯,这两个反应有无矛盾?为什么?答:这两个反应无矛盾。
因为氯的氧化性强于碘,而碘的氧化性又强于氯酸钾。
2.根据实验结果比较:①S2O82-与MnO4-氧化性的强弱;②S2O32-与I-还原性的强弱。
答:因为S2O82-可以将Mn2+氧化为MnO4-,所以S2O82-的氧化性强于MnO4-,S2O32-能将I2还原为I-,S2O32-和还原性强于I-。
3.硫代硫酸钠溶液与硝酸银溶液反应时,为何有时为硫化银沉淀,有时又为[Ag(S2O3)2]3-配离子?答:这与溶液的浓度和酸碱性有关,当酸性强时,会生成硫化银沉淀,而在中性条件下就会生成[Ag(S2O3)2]3-配离子。
4.如何区别:①次氯酸钠和氯酸钠;②三种酸性气体:氯化氢、二氧化硫、硫化氢;③硫酸钠、亚硫酸钠、硫代硫酸钠、硫化钠。
答:①分别取少量两种固体,放入试管中,然后分别往试管中加入适量水,使固体全部溶解,再分别向两支试管中滴入两滴品红溶液,使品红溶液褪色的试管中放入的固体为次氯酸钠,剩下的一种为氯酸钠。
②将三种气体分别通入品红溶液中,使品红褪色的是二氧化硫,然后将剩余的两种气体分别通入盛有KMnO4溶液的试管中,产生淡蓝色沉淀的是H2S,剩下的一种气体是氯化氢。
③分别取四种溶液放入四支试管中,然后向四支试管中分别加入适量等量的H2SO4溶液,有刺激性气味气体产生的是亚硫酸钠,产生臭鸡蛋气味气体是的硫化钠,既有刺激性气味气体产生,又有黄色沉淀产生的是硫代硫酸钠,无明显现象的是硫酸钠。
5.设计一张硫的各种氧化态转化关系图。
6.在氯酸钾和次氯酸钠的制备实验中,如果没有二氧化锰,可改用哪些药品代替地二氧化锰?答:可用高锰酸钾代替二氧化锰。
7.用碘化钾淀粉试纸检验氯气时,试纸先呈蓝色,当在氯气中放置时间较长时,蓝色褪去,为什么?答:因为2KI+Cl2=2KCl+I2,I2遇淀粉变蓝,因此试纸呈蓝色,但氯气有氧化性,可生成HClO,可以将蓝色漂白,所以在氯气中放置时间较长时,蓝色褪去。
江苏师范大学《无机化学》习题库及答案第十五章 P区元素(三)

第十五章P区元素(三)一、选择题(每题3分,共30分)1、常见的卤素阴离子X- ,具有最大还原性的是()A、F-B、I-C、Cl-D、Br-2、下列酸,按照酸性降低的顺序排列的是()A、HI<HBr<HCl<HFB、HClO4<HClO3<HClOC、HClO<HBrO<HIOD、三者都是3、在0 °C和25 °C下,X2 与碱性溶液作用,得到的主要产物都是XO3-和X-是()A、F2B、Cl2C、Br2D、I24、下列各试剂混合后能产生氯气的是()A、NaCl 与浓H2SO4B、NaCl 和MnO2C、NaCl 与浓HNO3D、KMnO4 与浓HCl5、欲由KBr 固体制备HBr 气体,应选择的酸是()A、H2SO4B、HAcC、HNO3D、H3PO46、卤素单质中,在水中不发生歧化反应的是()A、F2B、Cl2C、Br2 4 I27、下列含氧酸的氧化性递变不正确的是()A、HClO4>H2SO4>H3PO4B、HBrO4>HClO4>H5IO6C、HClO>HClO3>HClO4D、HBrO3>HClO3>HIO38、下列物质中关于热稳定性判断正确的是()A、HF<HCl<HBr<HIB、HF>HCl>HBr>HIC、HClO>HClO2>HClO3>HClO4D、HCl>HClO4>HBrO4>HIO49、ClF3分子的空间构型是()A、四面体B、直线型C、T型D、变形四面体10、下列稀有气体中沸点最低的是()A、HeB、KrC、XeD、Ar二、填空题(每空1分,共25)1、F Cl Br 三元素中电子亲合能最大的是,单质的解离能最小的是。
2、键能F2 Cl2,活泼性F2Cl23、含氧酸的酸性常随非羟基氧原子数的增多而。
无机化学p区金属单元测试题及答案

无机化学p区金属单元测试题及答案一、选择题(每题2分,共20分)1. 以下哪个元素属于p区金属元素?A. 锂(Li)B. 钠(Na)C. 钙(Ca)D. 铝(Al)2. p区金属元素通常具有哪些性质?A. 低电离能B. 高电离能C. 低电负性D. 所有上述选项3. 以下哪个化合物是p区金属的氧化物?A. Na2OB. MgOC. Fe2O3D. CuO4. p区金属元素的最高氧化态通常为多少?A. +1B. +2C. +3D. +45. 以下哪个元素是p区金属中最活泼的?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)二、填空题(每空2分,共20分)6. p区金属元素通常位于元素周期表的________区。
7. 钠(Na)的原子序数是________。
8. p区金属元素的电子构型通常是________。
9. 钾(K)的离子半径比钠(Na)的离子半径________。
10. p区金属元素的化学性质通常表现为________。
三、简答题(每题10分,共20分)11. 描述p区金属元素的一般化学性质。
12. 解释为什么p区金属元素容易形成阳离子。
四、计算题(每题15分,共30分)13. 假设有1摩尔的钠(Na)与水反应,生成氢气和氢氧化钠。
写出该反应的化学方程式,并计算生成的氢气在标准状况下的体积。
14. 给定钾(K)的电离能为418 kJ/mol,计算1摩尔钾原子完全电离成钾离子所需的能量。
五、论述题(每题10分,共10分)15. 论述p区金属元素在工业和日常生活中的应用。
答案:一、选择题1. D2. D3. A4. B5. D二、填空题6. s和p7. 118. ns^1或ns^2np^x9. 大10. 还原性三、简答题11. p区金属元素的一般化学性质包括:低电离能,容易失去最外层电子形成阳离子;电负性较低,通常形成+1或+2价的化合物;具有较高的反应活性,容易与非金属元素如氧、硫等形成化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
()29 用碳酸钠溶液沉淀溶液中的Ca2+,Mg2+,Cu2+时,均得到碳酸盐沉淀。
()30 水溶液中Cu2+与CO32-作用形成的沉淀是Cu2(OH)2CO3。
()31 水玻璃可用作不烧砖的粘合剂。
()32 Na2SiO3·5H2O是高效洗衣粉的助剂,以取代Na5P3O10。
()33 四卤化硅熔点高低的次序为SiF4<SiCl4<SiBr4<SiI4。
()34 铅无毒。
()35 铅是很硬的重金属,能档住x-射线。
()36 锡有三种同素异形体:灰锡(α锡)、白锡(β锡)和脆锡。
()37 可溶性铅盐与Na2CO3溶液反应得到PbCO3沉淀。
()38 Cl2与Sn反应生成SnCl2。
()39 Pb(Ac)2是一种常见的铅盐,是强电解质。
()40 实验室中可用盐酸与金属锡反应制备SnCl2(aq)。
()41 Pb(OH)2与稀盐酸反应没有沉淀生成。
()42 PbCl2可以溶于热水和较浓的盐酸中。
()43 Pb2+、Mg2+是无色的,所有的镁盐都是无色的,而铅盐由于极化作用强,能呈一定的颜色。
()44 SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
()45 若验证Pb(OH)2在酸中的溶解性,只能将其溶解在HAc或硝酸中。
()46 PbSO4不溶于浓H2SO4和饱和NH4Ac溶液中。
()47 试剂瓶中存放的SnCl2·6H2O,长时间后,会生成不溶于水的失去还原性的物质。
()48 固体硝酸盐具有氧化性,受热时易分解。
()49 氮的最高氧化值为+5,可以推断NF5能稳定存在。
()50 硝酸盐易溶于水,所以常用作配位剂。
()51 固体铵盐受热分解产物因生成铵盐的酸的性质不同而异。
()52 所有固体铵盐的热分解产物中均有氨气。
()53 由于HNO3具有强氧化性,所有硝酸盐的水溶液也具有强氧化性。
()54 HNO3的浓度越大,其氧化性越强。
()54 铜与浓HNO3反应生成NO2,铜与稀HNO3反应生成NO,所以稀HNO3的氧化性比浓55 HNO3强。
()56 在KI水溶液中加入NaNO3,再加CCl4萃取,CCl4层显紫红色。
()57 氮族元素氢化物沸点高低的次序为NH3<PH3<AsH3<SbH3<BiH3。
()58 氮族元素氢化物的碱性强弱次序为NH3<PH3<AsH3<SbH3<BiH3。
()59 氮族元素氢化物还原性强弱的次序为NH3>PH3>AsH3>SbH3>BiH3。
()60 氮族元素氢化物的热稳定性高低次序为NH3>PH3>AsH3>SbH3>BiH3。
()61 加热NH4Cl和NaNO2的混合溶液可以生成N2。
()62 有些洗衣粉中含有三聚磷酸钠。
使用这种洗衣粉,常因磷是富营养元素,引起河流湖63 泊中的藻类迅速生长,而破坏生态平衡。
()64 在任何条件下,P4O10与水反应的产物都是H3PO4。
()65 H3PO4是具有高沸点的三元中强酸,一般情况下没有氧化性。
()66 NaH2PO4、Na2HPO4、Na3PO4三种溶液均呈碱性。
()67 H3PO3是三元弱酸,易发生歧化反应。
()68 H3PO2是三元弱酸,可以发生歧化反应。
()69 POCl3的分子构型为正四面体。
()70 三卤化磷熔点高低的次序为PF3<PCl3<PBr3<PI3。
()71 三卤化磷沸点高低的次序为PF3>PCl3>PBr3>PI3。
()72 PCl5(s)是离子晶体。
()73 三卤化磷标准摩尔生成热的大小次序为PF3<PCl3<PBr3<PI3。
()74 在Na2HPO4溶液中加入AgNO3生成Ag2HPO4沉淀。
()75 由于Sb3+易水解,稀释SbCl3溶液时,产生Sb(OH)3沉淀。
()76 锑和铋为金属,所以它们的氢氧化物皆为碱。
()77 砷分族最高氧化值为+5。
()78 砷分族包括Ge、Sb、Bi三种元素。
()79 铋酸钠为土黄色,易溶于水,有强氧化性。
()80 Bi2S5为黑色硫化物。
()81 Sb2S5、Sb2S3都是橙红色的能稳定存在的硫化物。
()82 H[Sb(OH)6]是难溶于水的弱酸。
()83 氧族元素中,只有氧在自然界可以单质状态存在。
()84 在所有含氧的化合物中,氧的氧化值都是负的。
()85 氧族元素氢化物还原性强弱的次序为H2O<H2S<H2Se<H3Te。
()86 氧族元素氢化物酸性强弱的次序为H2O<H2S<H2Se<H3Te。
()87 氧族元素氢化物的热稳定性高低的次序为H2O<H2S<H2Se<H3Te。
()88 H2O2分子间可以形成氢键。
()89 氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
()90 O3是反磁性的极性分子。
()91 硫的含氧酸及其盐都是不稳定的,极易分解。
()92 浓硫酸不能用于干燥氨气。
()93 可用浓硫酸干燥CO2气体。
()94 H2S在空气中燃烧的产物只能是SO2和H2O。
()95 可用FeS与HNO3反应制取H2S。
()96 SO2是大气的主要污染源之一,酸雨主要是由SO2形成的。
()97 浓硫酸虽有强氧化性,但仍可用铁罐运输。
()98 浓硫酸属于高沸点酸。
()99 将H2S通入MnSO4溶液中,可得到MnS沉淀。
()100 △f H(S,单斜)<△f H(S,斜方)。
()101 连二亚硫酸钠的俗名是大苏打。
()102 H2S溶液放置一段时间变混浊,是因为H2S被空气氧化生成S沉淀。
()103 液态三氧化硫的分子式可以用S3O9表示之。
()104 K2S2O8中含有-O-O-键。
()105 用Na2S溶液与含Cr3+的溶液反应,得不到Cr2S3,若想制得Cr2S3必须采用干法。
()106 用Na2S溶液与含Al3+的溶液反应,可得到Al2S3。
()107 硫代硫酸钠的俗名是大苏打。
()108 海波的化学式为Na2S2O3·5H2O。
()109 在照像行业中Na2S2O3作为定影剂使用是基于它具有还原性。
()110 H2S可以被Cl2氧化为H2SO4。
()111 在酸性溶液中,KMnO4只能将H2S氧化为单质硫。
()112 S2O32-的构型与SO42-相似。
()113 热的NaOH溶液与过量的硫粉反应可生成Na2S2O3。
()114 氢氟酸能腐蚀玻璃,故需要用塑料瓶保存。
()115 在氢卤酸中,由于氟的非金属性强,所以氢氟酸的酸性最强。
()116 所有卤素元素都有正的氧化值。
()117 在卤素与氧的化合物中,每种卤素都有多种正氧化值。
()118 卤化氢沸点高低的次序为HF<HCl<HBr<HI。
()119 卤化氢热稳定性高低的次序为HF>HCl>HBr.>HI。
()120 卤化氢还原性强弱的次序为HF<HCl<HBr<HI。
()121 卤化氢酸性强弱的次序为HCl>HBr.>HI>HF。
()122 卤素单质在水中都可以发生歧化反应。
()123 卤素单质在酸性介质中更容易发生歧化反应。
()124 除HF外,可用卤化物与浓硫酸反应制取卤化氢。
()125 卤素单质水解反应进行的程度由Cl2到I2依次减弱。
()126 HClO4是最强的无机酸。
()127 氯的含氧酸酸性强弱次序为HClO<HClO2<HClO3<HClO4。
()128 氯的含氧酸盐热稳定性强弱次序为MClO<MClO2<MClO3<MClO4。
()129 氯的含氧酸氧化性强弱的次序为HClO<HClO2<HClO3<HClO4。
()130 氯酸钾是强氧化剂,在氯酸钾的水溶液中加入KI即有I2生成。
()131 将KClO3溶液与KI溶液混合,无明显现象发生,当加入稀H2SO4后,就有I2生成。
()132 在氯的含氧酸中,随着氯的氧化值增加,其氧化性越来越强。
()133 可用溴化钠与浓磷酸反应制取溴化氢。
()134 常温下BrO-在碱性溶液中不能存在。
()135 高碘酸是三元酸。
()136 在自然界中存在着碘酸盐和碘化物。
()137 卤酸的酸性强弱次序为:HClO3>HBrO3>HIO3。
()138 高溴酸的氧化性比高氯酸的弱。
()139 碘酸与金属锌反应能生成氢气。
()140 高碘酸有强氧化性,必须在碱性条件下,氯气才能将碘酸盐氧化为高碘酸盐。
()141 次卤酸盐热稳定性高低的次序为MClO>MBrO>MIO。
