氧气二氧化碳的制备
实验室制取二氧化碳与氧气

龙文教育一对一个性化辅导教案学生学校华附年级初三次数第 4 次科目化学教师毛文丽日期时段课题实验室制取二氧化碳与氧气教学重点1、实验室制取二氧化碳的药品与反应原理2、实验室制取二氧化碳的装置和步骤教学难点1、如何设计实验室制取气体的装置教学目标1、熟练实验室制取二氧化碳的药品与反应原理1、实验室制取二氧化碳和氧气的综合教学步骤及教学内容一、课前热身:1、课前20分钟测试上节课化学计算的内容,并检查学生的错题总结。
2、阐述本节课要讲的重要知识点,引导学生如何学好本节的内容。
二、内容讲解:1、实验室制取二氧化碳的药品与反应原理2、实验室制取二氧化碳的装置和步骤三、课堂小结:带领学生对本次课授课内容进行回顾、总结四、作业布置:安排少量具有代表性的题目让学生回家后巩固练习管理人员签字:日期:年月日作业布置1、学生上次作业评价:○好○较好○一般○差备注:2、本次课后作业:与教学目标相关的练习课堂小结家长签字:日期:年月日Δ常温实验室制取二氧化碳与氧气考点分析:近五年的中考中,实验室制取氧气与二氧化碳是中考的重点实验,一般以选择题或实验填空题的形式出现,所以学好本节内容是关键。
重点:化学方程式的应用题计算知识点一 实验室制取二氧化碳的药品与反应原理 1.反应原理:CaCO 3 + 2HCl ===CaCl 2 + H 2O + CO 2↑ 2.实验药品:大理石(或石灰石)与稀盐酸3.发生装置:根据反应物的状态和反应条件来选择(固 + 液 气体)4.收集装置:根据气体的密度,水中的溶解性或与水是否反应来选择(CO 2一般用向上排空 气法)5.实验步骤:①检查装置的气密性②想容器中加入固体药品(大理石) ③从长颈漏斗中加入液体药品(稀盐酸) ④收集CO 2 ⑤验满6.验满方法:用燃着的木条放在集气瓶口7.检验方法:将生成的CO 2气体通入澄清石灰水 【练一练】1.以下反应中均能生成 CO 2气体,不适合实验室制取二氧化碳的是( ) A.大理石和稀盐酸 B.石灰石和稀硫酸 C.木炭在空气中燃烧 D.石灰石和稀盐酸 选择其一说明理由:2.以下最适合实验室制取二氧化碳的反应是( ) A.CaCO 3CaCO 3高温CaO+CO 2↑B.NH4HCO3 NH 3↑ + CO 2↑ + H 2OC.2CO+O 2点燃2CO 2D.CaCO 3 + 2HCl ===CaCl 2 + H 2O + CO 2↑知识点二 实验室制取二氧化碳的装置和步骤1.发生装置实验室制取 CO 2用:固体 + 液体,且反应不需要加热,装置如图所示。
高中化学实验室气体制备总结

高中化学实验室气体制备总结引言气体制备是高中化学实验室中常见的实验操作之一。
通过控制反应条件,可以从化学反应中制备出各种气体。
本文将总结高中化学实验室中常用的气体制备方法及其原理,以供参考。
一、氧气制备氧气是一种无色、无味和可燃的气体,广泛应用于燃烧、氧化等化学反应中。
在高中化学实验室中,常用的氧气制备方法是通过高锰酸钾的分解来制取。
实验步骤如下:1.取适量高锰酸钾固体放入蒸馏烧瓶中;2.加入适量稀硫酸,使高锰酸钾充分溶解;3.使用导管将烧瓶与气体收集瓶连接,将气体收集瓶内的水排空;4.缓慢加热烧瓶,观察气体收集瓶中气体的变化。
原理解释:高锰酸钾的分解反应式为:2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)通过加热高锰酸钾和稀硫酸混合物,高锰酸钾分解产生氧气,并通过导管收集。
二、二氧化碳制备二氧化碳是一种无色、无味的气体,在高中化学实验室中常用于酸碱中和实验和植物光合作用研究中。
常见的二氧化碳制备方法有酸与碳酸盐反应法和酵母发酵法。
1. 酸与碳酸盐反应法实验步骤如下:1.取适量碳酸盐固体(如碳酸氢钠)放入烧杯中;2.缓慢滴加酸(如稀盐酸)至碳酸盐完全反应;3.使用盖有橡皮塞的试管收集气体。
原理解释:碳酸盐与酸反应产生二氧化碳的反应式如下:NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)通过滴加酸与碳酸盐反应,产生二氧化碳气体,并用试管收集。
2. 酵母发酵法实验步骤如下:1.取适量酵母放入锥形瓶中;2.加入适量葡萄糖溶液,与酵母充分混合;3.盖上透明的气球或用试管堵住瓶口;4.静置一段时间后观察气球的膨胀情况。
原理解释:酵母通过发酵作用将葡萄糖分解生成酒精和二氧化碳。
二氧化碳气体通过瓶口进入气球内,使气球膨胀。
三、氯气制备氯气是一种黄绿色、有刺激性气味的气体,广泛应用于消毒、漂白和制取其他化学品中。
在高中化学实验室中,氯气可以通过盐酸与漂白粉的反应制备。
氧气、二氧化碳的制取

沪教版初三化学《O2、CO2的制备原理,装置和仪器和选用》教学目标:1.知道氧气的工业制法,理解实验室制取氧气的原理、装置和操作及氧气的检验方法。
2.理解二氧化锰在实验室制取氧气反应中的催化作用3. 掌握实验室制取二氧化碳的相关知识,了解工业制取二氧化碳的相关知识基础知识:(一)工业制氧气(物理方法)要求:原料价廉易得,产品产量高以降低成本。
工业制氧气的原料:空气制取原理是:先把空气液化,然后升温,利用氧气与氮气沸点的不同达到分离的目的(空气中其它气体含量较低不考虑)。
已知氮气沸点为—196℃,氧气沸点为—183℃,推测:先从液态空气中气化逸出。
(二)实验室制气体(化学方法)四、氧气的制取:Ⅰ、氯酸钾和二氧化锰催化剂:加快化学反应速率,而本身在反应前后质量和化学性质都没有发生变化●反应物状态:固(白色粉末)+固(黑色粉末)●反应条件:加热●反应原理:在实验中二氧化锰起作用。
●制取氧气的实验一般步骤:(查、装、定、收、移、熄、验)①“查”检查装置的气密性;②“装”将氯酸钾和二氧化锰的混合固体装入试管中。
③“定”根据酒精灯的高度来确定试管的固定位置。
④“收”收集得到的气体(待气泡均匀冒出时开始收集);⑤“移”将导管移出水槽(防止水槽中的水倒吸入试管,使试管炸裂)⑥“熄”最后熄灭酒精灯;⑦“验”:检验氧气是否收集满(验满方法:用带火星的木条放在集气瓶口,看木条是否复燃)●实验装置(固、固加热制气体)●气体收集方法以及运用气体的性质①排水法:利用性质:氧气不易溶于水②向上排空气法;利用的性质:氧气的密度大于空气的密度●注意事项:1.固定试管方向:试管口略向下倾斜,原因:防止冷凝水倒流炸裂试管2.如何判断排水法氧气已收集满:集气瓶内无水,且水中气泡向集气瓶外逸出证明已收集满4.在对固体进行加热前,应先使试管均匀受热,在对固体集中加热,防止试管炸裂。
3.当反应结束时:应先,后原因是:Ⅱ、过氧化氢和二氧化锰●反应物状态:固体粉末和液态●反应条件:常温进行●反应原理:,在反应过程中二氧化锰起作用。
实验室制氧气和实验室制二氧化碳的化学方程式

实验室制氧气和实验室制二氧化碳的化学方程式实验室制氧气和实验室制二氧化碳是化学实验中常见的实验项目。
下面我将依次介绍制备氧气和二氧化碳的化学方程式,并对其进行详细解释。
1.实验室制备氧气的化学方程式:2H2O2(aq) → 2H2O(l) + O2(g)制备氧气的实验通常使用过氧化氢(H2O2)作为反应物。
过氧化氢在反应过程中会分解为水和氧气。
这个反应是一个单一替代反应,过氧化氢的氧原子被水分子替代。
反应物即是过氧化氢,生成物则有水和氧气。
2.实验室制备二氧化碳的化学方程式:HCl(aq) + NaHCO3(s) → NaCl(aq) + H2O(l) + CO2(g)制备二氧化碳的实验中,通常使用氢氯酸(HCl)和碳酸氢钠(NaHCO3)作为反应物。
氢氯酸和碳酸氢钠反应时会产生盐、水和二氧化碳。
这个反应是一个酸碱中和反应,氢氯酸的氢离子和碳酸氢钠的碱性氢氧根离子结合形成水,同时释放出二氧化碳气体。
以上是实验室制备氧气和二氧化碳的两个常见化学方程式。
接下来,我们将对制备过程进行详细解释。
首先,制备氧气的实验中使用的过氧化氢是一种常见的无机化合物。
过氧化氢的化学式为H2O2,是一种氧化剂。
实验中,我们可以直接加热过氧化氢溶液,或者使用催化剂(如锰dioxide)来加速反应。
反应过程中,过氧化氢分子中的O-O键会断裂,产生水和氧气。
制备二氧化碳的实验中,我们使用氢氯酸(HCl)和碳酸氢钠(NaHCO3)来制得二氧化碳。
这个实验常见于化学教学实验中,用于展示酸碱中和反应。
在实验中,将氢氯酸和碳酸氢钠混合,会产生气泡和冒烟现象,释放出二氧化碳气体。
产生的二氧化碳气体可以收集和使用。
简单总结一下,实验室制备氧气的化学方程式是2H2O2(aq) →2H2O(l) + O2(g),制备二氧化碳的化学方程式是HCl(aq) + NaHCO3(s)→ NaCl(aq) + H2O(l) + CO2(g)。
制备氧气的实验使用过氧化氢作为反应物,而制备二氧化碳的实验则使用氢氯酸和碳酸氢钠作为反应物。
实验室制取氧气和二氧化碳

实验室用KMnO4制取氧气原理:2KMnO4====K2MnO4+MnO2+O2↑装置图:实验步骤:1、查:检查装置气密性方法:将导管的一端插入水中,用手握住试管,若导管口有气泡冒出,证明装置气密性良好。
2、装:将药品装入试管试管口放一团棉花的作用:防止高锰酸钾粉末随着氧气流通过试管进入水中,使水变紫色。
试管口为什么要向下倾斜?原因:防止冷凝水回流到热的试管底部,使试管炸裂。
3、定:将试管固定在铁架台上4、点:点燃酒精灯为什么要在试管下方来回移动酒精灯?原因:使试管均匀受热,防止局部过热使试管炸裂。
5、收:收集气体排水法:氧气难溶于水,不跟水发生反应方法向上排空气法:氧气密度比空气大验满方法:将带火星的木条放在集气瓶口,若木条复燃,则已满。
检验气体是否为氧气的方法:将带火星的木条伸入集气瓶里,若木条复燃,则该气体为氧气。
6、移:将导管从水槽中移出7、熄:熄灭酒精灯为什么先将导管从水槽中移出,再熄灭酒精灯?原因:防止水槽中的水倒吸入热的试管中,使试管炸裂。
实验室用过氧化氢制取氧气原理:2H2O2 === 2H2O + O2↑装置图:活塞的作用:可以控制反应速率。
实验室制取二氧化碳原理:CaCO3 + 2HCl==CaCl2 + H2O + CO2↑装置图:实验步骤:1、查:检查装置气密性方法:将导管的一端插入水中,用手握住试管,若导管口有气泡冒出,证明装置气密性良好。
2、装:将药品装入试管3、收:收集气体方法:向上排空气法(二氧化碳密度比空气大)4、满:进行验满将燃着的木条放在集气瓶口,若木条熄灭,则已满。
5、验:检验气体检验气体是否为二氧化碳的方法:将收集到的气体通入澄清石灰水中,若澄清石灰水变浑浊,则该气体为二氧化碳。
实验室也可以用以下装置图制取二氧化碳。
化学实验中的气体制备

化学实验中的气体制备在化学实验中,气体的制备是一个常见的实验项目。
无论是用于实验研究还是应用于工业生产,制备气体都是必不可少的步骤。
本文将介绍几种常见的气体制备方法,包括制备氧气、氢气、二氧化碳和氮气。
一、氧气的制备氧气是一种常用的气体,广泛应用于呼吸、燃烧和氧化反应等领域。
在实验室中,可以使用以下两种方法制备氧气:1. 过氧化氢的分解过氧化氢(H2O2)分解可以制备氧气。
首先,将适量的过氧化氢溶液放入反应瓶中,然后加入少量的催化剂,如锰(MnO2)。
在加热的条件下,过氧化氢分解成水和氧气。
反应方程式如下所示:2H2O2 → 2H2O + O22. 高温分解金属氧化物高温分解金属氧化物也可以制备氧气。
选择适量的金属氧化物,如二氧化锰(MnO2),放入烧杯中,然后加热至较高温度。
金属氧化物分解生成金属和氧气。
反应方程式如下所示:2MnO2 → 2Mn + O2二、氢气的制备氢气是一种重要的气体,在实验室和工业中均具有广泛的应用。
以下是两种常见的氢气制备方法:1. 金属与酸的反应一些金属可以与酸反应产生氢气。
常用的金属有锌(Zn)和铁(Fe),常用的酸有盐酸(HCl)。
将适量的金属放入反应瓶中,然后添加足够的酸。
金属与酸反应生成氢气。
反应方程式如下所示:Zn + 2HCl → ZnCl2 + H22. 水的电解水的电解是制备氢气的另一种方法。
使用电解槽装置,将两个电极(一个是阳极,一个是阴极)浸入水中,然后通电。
在电解的过程中,水分解成氢气和氧气。
反应方程式如下所示:2H2O → 2H2 + O2三、二氧化碳的制备二氧化碳是一种常见的气体,在植物光合作用、饮料制造和灭火等方面具有重要作用。
以下是两种常见的二氧化碳制备方法:1. 一氧化碳和氧气的燃烧将适量的一氧化碳(CO)和氧气(O2)混合,然后点燃混合物。
在燃烧过程中,一氧化碳与氧气反应生成二氧化碳。
反应方程式如下所示:CO + O2 → CO22. 碳酸酸和酸的反应将适量的碳酸酸(如碳酸钠)与酸(如盐酸)反应,生成二氧化碳。
人教版初中化学九年级氧气和二氧化碳的制取和性质专题复习(共29张PPT)

2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3 + 2H2O
反 2KClO3M=n=O=2 2KCl+3O2↑
应
原 2KMnO4 === K2MnO4+MnO2+O2
理 方
2 H2O2 =M=nO=2 2H2O + O2 ↑
程 式
CaCO3 + 2HCl === CaCl2 + H2O + CO2 ↑
把手拿开,过一会儿,可 看到水沿导管上升,形成水柱, 说明装置不漏气。
先往锥形中加水浸没长颈 漏斗下端,然后夹上止水夹, 再往长颈漏斗中加一定量的水, 静止一会,如果漏斗液面没下 降,证明气密性良好。
趁热打铁
? 下列装置操作图不能用于检查气密性的是 ( A )
A
B
C
D
装置内液面下降, 导管内水柱上升
三.实验室制取气体的装置
1.发生装置பைடு நூலகம்
B
C
A
D
E
反应物状态:固体+固体、固体 固体+液体、液体+液体
反应条件: 加热
不加热
可随时添加液体
止水夹
有孔塑料 板或橡胶 片
优点:可以控制反应的发生和停止
2 .收集装置
A
B
A装置适宜收集 密度比空气大
C
的气体;
B装置适宜收集 密度比空气小 的气体;
C装置适宜收集 不易或难溶于水 的气体;
(4)违反实验室操作规程,会导致实验失败,请分析下列实 验出现异常的可能原因。
A.实验室制取二氧化碳时,广口瓶内出现白雾,导气管导 出的气体具有强烈刺激性的气味。
使用浓盐酸制二氧化碳 ;
九年级化学常见气体的制取

课时数:2课时 (第4次)教学内容:初中化学常见气体的制取 重要考点:一、氧气、二氧化碳、氢气的实验室制取和工业制取气 体氧气(O 2)二氧化碳(CO 2)氢气(H 2)制备药品过氧化氢溶液 和二氧化锰高锰酸钾 氯酸钾和二氧化锰大理石(或石灰石)和稀盐酸锌粒和稀硫酸反应原理2H 2O 2MnO 22H 2O+O 2↑2KMnO 4 K 2MnO 4+MnO 2+O 2↑ 2KClO 32KCl+3O 2↑CaCO 3+2HClCaCl 2+H 2O+CO 2↑Zn+H 2SO 4ZnSO 4+H 2↑反应类型 分解反应复分解反应 置换反应 反应物状态 固体与液体混合固体与固体混合固体与液体混合 固体与液体混合 反应条件不需加热加热不需加热不需加热发生装置气体溶解性 不易溶于水能溶于水 难溶于水气体密度 密度比空气密度大密度比空气密度大密度比空气密度小收集装置 (纯净的)或 (干燥的) (唯一的) 或净 化 可用浓硫酸或碱石灰干燥 用NaHCO 3溶液除去HCl , 用浓硫酸干燥 用NaOH 溶液除去HCl 杂质,用浓硫酸干燥 收集方法排水法、向上排空气法只能用向上排空气法 排水法或、下排空气法 检验方法将带火星的木条插入集气瓶内,若木条复燃,说明是氧气。
将气体通入澄清的石灰水,若澄清的石灰水变浑浊, 说明是二氧化碳点燃气体,检 验其生成产物。
淡蓝色火焰, 生成H 2O验满或验纯用向上排空气法收集时,将带火星的木条靠近集气瓶口,若木条复燃,说明已收集满。
用排水法收集时,集气瓶口有气泡冒出。
将燃着的木条靠近集气瓶口,若木条熄灭,说明已收集满。
用拇指堵住倒置已收集满氢气的试管,靠近火焰后移开手指,若听到“噗”的一声,说明已纯。
注意事项⑴先检查装置的 气密性⑵用排水法收集时,待气泡连续均匀排出时才收集⑶导管置集气瓶口⑴先检查装置气密性 ⑵试管口略向下倾斜 ⑶试管口放一团棉花 ⑷先移出导气管,后 停止加热,以防倒吸 ⑸正放⑴ 不能用稀硫酸,因反应生成CaSO 4附着在大理石表面,阻止反应继续进行。
常见气体的制取和检验(氧气、二氧化碳)

常见气体的制取和检验(氧气、二氧化碳)课型:新上课时间2011年4月2日主史正红审核:化学备课组班级姓名组名第号辩手组长签名_________ 家长签名_________[复习目标]掌握实验室制取氧气、二氧化碳的反应原理、实验装置、实验操作、检验方法;归纳制取气体的方法、思路和实验注意事项。
[复习导航]一、经典回顾,清晰网络[活动1] 实验原理(化学方程式表示)制氧气:1、___________________________________2、__________________________________3、___________________________________制二氧化碳:____________________________________________________________________[活动2]实验装置(结合图1装置回答问题)⑴写出图1中指定仪器的名称:①_______ ②_______③_______④_______⑤______⑥_______。
⑵用图1装置代号填下表:气体药品名称发生装置收集装置O2过氧化氢、二氧化锰氯酸钾、二氧化锰高锰酸钾CO2大理石和稀盐酸图1[活动3]实验操作1.步骤:制氧气的步骤:_____________________________________________________________________________________________________________________________________________________ ____制二氧化碳的步骤___________________________________________________________________2.制取氧气操作中的追问⑴气体发生装置组装好后,为什么先要检查气密性,后装药品?如何检验?________________________________________________________________________⑵为什么要将药品平铺在试管底部?⑶给试管内的固体加热时,为什么要先预热,再定点加热有药品的部位?⑷给试管内的固体加热时,为什么试管口要略向下倾斜?⑸实验室制取氧气时,试管内的导管为什么不宜过长?⑹用高锰酸钾制取氧气时,为什么要在试管口放一团棉花?⑺用排水法收集氧气实验完毕,为什么要先撤导管,后撤酒精灯?⑻用向上排空气法收集氧气时,为什么导管要伸到集气瓶的底部?⑼为什么收集满氧气的集气瓶,要盖好玻璃片正放在桌上?3.制取二氧化碳操作中的追问⑴实验室制CO2气体为什么不能用浓盐酸代替稀盐酸?制出的CO2气体通入澄清石灰水为什么不变浑浊?⑵为什么不能用粉末状的碳酸钙或碳酸钠代替块状的石灰石?⑶为什么不能用稀硫酸代替稀盐酸?⑷为什么只能用向上排空气法收集CO2气体?⑸实验室要制备干燥的CO2气体,应选择用什么做干燥剂?⑹如何检验实验室制备CO2气体装置的气密性?[活动4] 实验检验(验满和证明)验满:⑴使用排水集气法收集氧气,如何知道氧气是否收集满?_____________________________⑵使用排空气法收集氧气,如何知道氧气是否收集满?⑶使用排空气法收集二氧化碳气体,如何知道二氧化碳气体是否收集满?证明:如何证明氧气_______________________________________________________________________如何证明二氧化碳___________________________________________________________________[预习自评1]通电1、从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是)MnO2 A.通电使水分解:2H2O2H2↑ + O2↑B.过氧化氢催化分解:2H2O22H2O + O2↑MnO2 C.高锰酸钾加热分解:2KMnO4K2MnO4 + MnO2 + O2↑D.氯酸钾加热分解:2KClO32KCl + 3O2↑2、实验室制取氧气的主要步骤有:①固定装置、②装入药品、③加热、④检查装置的气密性、⑤用排水法收集。
实验室制取氧气、氢气和二氧化碳知识总结

实验室制取氧气、氢气和二氧化碳知识总结一、氧气的实验室制法(化学变化)1.用高锰酸钾、氯酸钾制取氧气(固固加热型)(1)药品:高锰酸钾(暗紫色固体)、氯酸钾(白色固体)与二氧化锰(黑色粉末)(2)原理:①加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+ 3O2↑注意:MnO2在该反应中是催化剂,起催化作用②加热高锰酸钾:KMnO4K2MnO4+ MnO2+ O2↑(3)操作步骤:(连)查、装、定、点、收、离、熄。
①连接装置:先下后上,从左到右的顺序。
②检查装置的气密性:将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,证明装置不漏气。
松开手后,导管口出现一段水柱。
③装入药品:按粉末状固体取用的方法(药匙或纸槽)④固定装置:固定试管时,试管口应略向下倾斜;铁夹应夹在试管的中上部⑤加热药品:先预热后集中加热(外焰加热)⑥收集气体:a.若用排水集气法收集气体,当气泡均匀冒出时再收集,刚排出的是空气;水排完后,应用玻璃片盖住瓶口,小心地移出水槽,正放在桌面上(密度比空气大)(防止气体逸出)b.用向上排空法。
收集时导管应伸入集气瓶底部(为了排尽瓶内空气)c.用排水法收集时,导管放在集气瓶口⑦先将导管移出水面⑧再停止加热(5)易错事项:a)试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂。
b)导气管伸入发生装置内要稍露出橡皮塞:有利于产生的气体排出。
c)用高锰酸钾制取氧气时,试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
d)排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
e)实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的水倒流,炸裂试管。
(6)收集方法:①排水法(不易溶于水或密度与空气相近)②向上排空法(密度比空气大)6)检验、验满检验:用带火星的木条伸入集气瓶内,发现木条复燃,说明是氧气;验满:用带火星的木条放在集气瓶口,若木条复燃,证明已满。
氧气、二氧化碳的制取和性质.doc

专题:氧气和二氧化碳的实验室制法和性质一、中考复习要求1、记住实验室制取O2、CO2的原理、装置、操作及收集方法。
2、会根据所制取气体的反应原理和需要的反应物状态等性质选择气体发生装置,根据所制取气体的性质(水溶性、密度等)选择收集装置。
3、知道氧气和二氧化碳的性质,并会解决相关的问题。
二、基础知识回顾1、气体的制备、收集和净化(1)气体发生装置常见的气体发生装置有三种,初中阶段学习了以下两种:①固体和固体药品混合加热型使用这类装置应注意:a、试管口应稍向倾斜;b、用排水集气法收集气体实验完毕后,应先,然后再。
②液体和固体(或液体和液体)反应不加热型使用这类装置应注意:a、若使用长颈漏斗,长颈漏斗导管下端应插入液体药品的液面下;b、块状固体应有适当大小,不能很碎,防止反应剧烈不易控制。
(2)气体收集装置①排空气集气法所收集的气体不与空气中的任何成分反应,且密度与空气相差较大的采用排空气法收集。
②排水集气法溶于水或微溶于水的气体可用排水集气法收集(如:H2、O2、CO、CH4等)。
CO2不能用排水集气法收集。
(3)气体的干燥和净化①干燥和净化气体的装置:洗气瓶和干燥管(如图)②常用干燥剂:浓硫酸、固体氢氧化钠、无水氯化钙等③注意事项:a 、选择的干燥剂(净化剂)必须是只能吸收水分(杂质气体),不与被干燥(净化)的气体反应。
b 、洗气瓶长导管为进气管,短导管为出气口;干燥管大口进气,小口出气,且两口都应堵一团脱脂棉,防止干燥颗粒进入导气管。
2、O 2、CO 2气体的实验室制法比较三、重点疑点讨论1、采用固体和固体加热制取气体时,为什么发生装置的试管口要稍向下倾斜?用排水集气法收集气体实验完毕后为什么先把导气管从水槽中拿出后再熄灭酒精灯?2、液体和固体(或液体和液体)反应不加热制取气体时,若使用长颈漏斗,长颈漏斗导管下端为什么要插入液体药品的液面以下?3、不论是向上排气法收集气体,还是向下排气法收集气体,为什么导管都应插到集气瓶的底部?用排水集气法收集气体,何时收集第一瓶气体最适宜?4、怎样除去用盐酸与或碳酸钙反应制得的或二氧化碳中常混有的少量氯化氢气体?四、解题方法指导例题根据右A、B、C、D图,回答下列问题。
氧气与二氧化碳的制取

体 +固 体 ’ ) 塑 茎 饩 体 ” , 该 气 体 可 选 用 图 1( A) 所
示的发 生装置来制 备:凡反应 原理符合“ 固体+ 液体- ÷气体”,该气体可选用图1( B) 或图1( C) 所示的发生装置来制备,且图1( B) 、图1( C) 所 示的发生装置中试管、锥形瓶可以用广口瓶、烧 瓶、U形管 等仪器代 替.
2KMn04:A:K2Mn04+Mn02+02 T
氧气 双氧水和二氧化锰
常温 2H2 02 Mn 02 2H20+02 t
二氧化碳 大理石和稀盐酸
常温 CaC03+2HCl =Ca Cl 2+H20+C02 T
反应类型
分解反应
分解反应
复分解反应
发生装置
图1( A)
图1( B) 或图1( C)
图1( B) 或图1( C)
( 1) 写出图中标有①、②的仪器名称:
④
;( 9
.
( 2) 马的A和
或
( 填装置编号) 进
行组装;你认为A装置中还缺少
;写
( 2005年福建省福州市课改区中考题) 分新与解答本题通过几种典型的制取气 体的发生装置和收集装置.考查同学们对几种 常见气体制取方法的掌握情况.其中( 1) 、( 2) 两 问属于基础知识;( 3)中第二问属于探究性问题, 同学们应从多角度如装置漏气、反应物的量或 收集气体情况等方面去探究;( 4) 是一个开放性 问题,只要符合“固体+液体”在常温下反应和能 用向上排空气法收集的气体即可,再对应写出 相关的化学方程式.
要塞上一团棉花; ③导管伸入试管
漏斗的下端管口应伸入液面以下;③用向上排空气法收集气体
氧气二氧化碳氢气的实验室制备总结
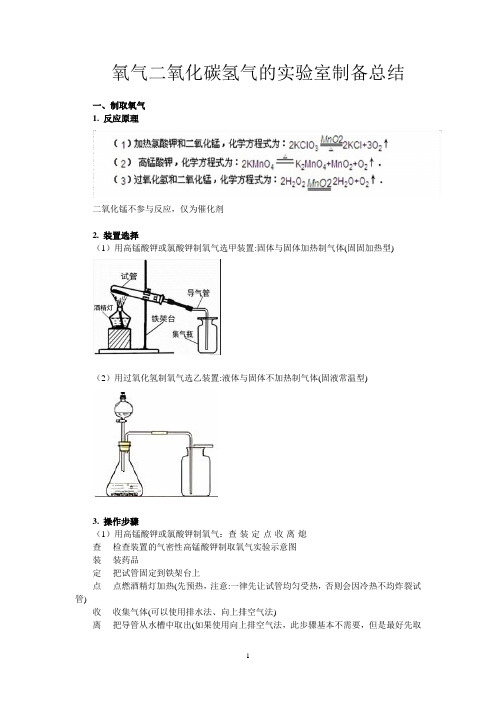
氧气二氧化碳氢气的实验室制备总结一、制取氧气1. 反应原理二氧化锰不参与反应,仅为催化剂2. 装置选择(1)用高锰酸钾或氯酸钾制氧气选甲装置:固体与固体加热制气体(固固加热型)(2)用过氧化氢制氧气选乙装置:液体与固体不加热制气体(固液常温型)3. 操作步骤(1)用高锰酸钾或氯酸钾制氧气:查-装-定-点-收-离-熄查----检查装置的气密性高锰酸钾制取氧气实验示意图装----装药品定----把试管固定到铁架台上点----点燃酒精灯加热(先预热,注意:一律先让试管均匀受热,否则会因冷热不均炸裂试管)收----收集气体(可以使用排水法、向上排空气法)离----把导管从水槽中取出(如果使用向上排空气法,此步骤基本不需要,但是最好先取出导管在盖上玻片)熄----熄灭酒精灯注意点①试管口略向下倾斜:防止冷凝水倒流回试管底部炸裂试管;②药品平铺在试管的底部:先预热,之后可以将酒精灯的外焰对准装有药品部位定向加热③铁夹夹在离管口约1/3处;④导管应稍露出橡皮塞:便于气体排出(大约0.5cm);⑤试管口应放一团棉花:防止高锰酸钾粉末进入导管并堵塞导管,使所制得气体无法较好排出;⑥排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气,此时收集气体不纯);⑦实验结束时,先移走导管,再熄灭酒精灯:防止水槽中的冷水倒吸进热的试管引起试管炸裂;⑧用向上排空气法收集气体时,导管伸到集气瓶底部:以便把空气排尽。
(2)过氧化氢(双氧水)制氧气:查---装---收查---检查装置的气密性:用夹子把导管夹上(应使用两节导管,中间用较短橡皮管连接,便于检查),然后往长颈漏斗中加水,长颈漏斗的颈部中的水柱如不下降,说明气密性良好装---装药品,先装固体,后装液体(防止液体飞溅)收---收集气体(同上高锰酸钾收集法)注意点①长颈漏斗的颈部应在液面以下(液封):防止气体从长颈漏斗泄露,可用分液漏斗代替(可控制反应速率);②导管应稍露出橡皮塞:便于气体排出。
高中物理--常见气体制备方法(全面版)

高中物理--常见气体制备方法(全面版)
一、氢气的制备方法
1. 金属与酸反应法:可使用锌或铁与浓盐酸反应,生成氢气。
2. 电解水制氢法:将电解水中的氢氧化物电解,可得到氢气。
3. 碱金属与水反应法:碱金属与水反应会产生氢气,其中比较常见的是钠与水反应。
二、氧气的制备方法
1. 加热金属氧化物分解法:将金属氧化物加热,可使其分解产生氧气。
2. 过氧化物分解法:过氧化物类物质在适当的条件下,可发生分解反应生成氧气。
3. 电解水制氧法:水在电解的过程中,氧气会被析出。
三、二氧化碳的制备方法
1. 碳酸盐与酸反应法:将碳酸盐与酸反应,在反应中会产生二氧化碳。
2. 酵母发酵法:在适当的条件下,酵母会分解产生二氧化碳。
3. 燃烧有机物质法:燃烧有机物质,如木材、糖类等,会产生二氧化碳。
四、氮气的制备方法
1. 空气分离法:通过空气的分离,可以得到其中的氮气成分。
2. 铜与浓稀硝酸反应法:铜与硝酸反应会产生氮气。
3. 氨气氧化反应法:将氨气与氧气反应,可得到氮气。
五、氯气的制备方法
1. 氯化物与酸反应法:将氯化物与酸反应会产生氯气。
2. 电解盐水制氯法:通过电解盐水,可以得到其中的氯气。
3. 氯化物与高温氧化反应法:将氯化物在高温条件下与氧气反应,可得到氯气。
以上是高中物理中常见气体的制备方法,希望能帮到您。
《氧气和二氧化碳的制备》 知识清单

《氧气和二氧化碳的制备》知识清单一、氧气的制备(一)实验室制备氧气的方法1、加热高锰酸钾制取氧气(1)实验原理:高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO₄△ K₂MnO₄+ MnO₂+O₂↑(2)实验装置:发生装置:固体加热型。
包括铁架台(带铁夹)、酒精灯、试管、棉花、导管等。
收集装置:排水法或向上排空气法。
排水法收集装置需要用到水槽、集气瓶;向上排空气法收集装置需要用到集气瓶、玻璃片。
(3)实验步骤:①查:检查装置的气密性。
连接好装置,将导管一端放入水中,双手握住试管,若导管口有气泡冒出,则气密性良好。
②装:将药品装入试管,在试管口放一团棉花,防止高锰酸钾粉末进入导管。
③定:将试管固定在铁架台上,试管口略向下倾斜,防止冷凝水回流使试管炸裂。
④点:点燃酒精灯,先预热,再集中加热。
⑤收:用排水法或向上排空气法收集氧气。
⑥离:收集完毕,先将导管撤离水槽。
⑦熄:熄灭酒精灯。
(4)注意事项:①试管口略向下倾斜,防止冷凝水回流使试管炸裂。
②药品要平铺在试管底部,以增大受热面积。
③加热时要先预热,再集中加热。
④用排水法收集氧气时,当气泡连续均匀冒出时再开始收集,因为开始排出的是试管内的空气。
⑤实验结束时,先将导管撤离水槽,再熄灭酒精灯,防止水槽中的水倒吸使试管炸裂。
2、加热氯酸钾和二氧化锰制取氧气(1)实验原理:氯酸钾在二氧化锰的催化作用下加热分解生成氯化钾和氧气,化学方程式为:2KClO₃ 2KCl + 3O₂↑(2)实验装置:同加热高锰酸钾制取氧气的装置,只是不需要在试管口放棉花。
(3)实验步骤:同加热高锰酸钾制取氧气的步骤。
(4)注意事项:同加热高锰酸钾制取氧气的注意事项。
3、分解过氧化氢制取氧气(1)实验原理:过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H₂O₂ 2H₂O + O₂↑(2)实验装置:发生装置:固液不加热型。
包括长颈漏斗(或分液漏斗)、锥形瓶、双孔塞、导管等。
《氧气和二氧化碳的制备》 学历案

《氧气和二氧化碳的制备》学历案一、学习目标1、了解氧气和二氧化碳的性质和用途。
2、掌握氧气和二氧化碳的实验室制备方法和原理。
3、学会选择合适的实验装置和收集方法。
4、培养实验操作能力、观察能力和分析问题的能力。
二、学习重难点1、重点(1)氧气和二氧化碳的实验室制备原理。
(2)实验装置的选择和组装。
(3)气体的收集和检验方法。
2、难点(1)实验装置的改进和创新。
(2)实验过程中的误差分析和问题解决。
三、学习过程(一)氧气的制备1、氧气的性质氧气是一种无色、无味、无臭的气体,不易溶于水,密度比空气略大。
氧气具有氧化性,能支持燃烧和供给呼吸。
2、氧气的实验室制备原理(1)加热高锰酸钾制取氧气2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑(2)加热氯酸钾和二氧化锰的混合物制取氧气2KClO₃加热 2KCl + 3O₂↑(二氧化锰作催化剂)3、实验装置(1)发生装置固体加热型:适用于加热高锰酸钾制取氧气。
固液不加热型:适用于用过氧化氢溶液和二氧化锰制取氧气。
(2)收集装置排水法:因为氧气不易溶于水。
向上排空气法:因为氧气的密度比空气略大。
4、实验步骤(1)查:检查装置的气密性。
(2)装:将药品装入试管。
(3)定:将试管固定在铁架台上。
(4)点:点燃酒精灯加热。
(5)收:收集氧气。
(6)离:将导管撤离水槽。
(7)熄:熄灭酒精灯。
5、氧气的检验和验满(1)检验:将带火星的木条伸入集气瓶中,如果木条复燃,证明是氧气。
(2)验满:用向上排空气法收集时,将带火星的木条放在集气瓶口,如果木条复燃,证明氧气已收集满;用排水法收集时,集气瓶口有大气泡冒出时,证明氧气已收集满。
(二)二氧化碳的制备1、二氧化碳的性质二氧化碳是一种无色、无味、能溶于水的气体,密度比空气大。
二氧化碳不能燃烧,也不支持燃烧,能使澄清石灰水变浑浊。
2、二氧化碳的实验室制备原理碳酸钙(大理石或石灰石)与稀盐酸反应制取二氧化碳:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑3、实验装置(1)发生装置固液不加热型:使用锥形瓶或大试管,长颈漏斗或分液漏斗。
制取氧气和二氧化碳的步骤及注意事项

制取氧气和二氧化碳的步骤及注意事项以下是 7 条关于制取氧气和二氧化碳的步骤及注意事项:1. 制取氧气呢,就可以用分解过氧化氢的方法呀。
把过氧化氢溶液倒进锥形瓶里,再加入二氧化锰作催化剂,就像给反应加上了一把火!哇塞,你瞧,氧气就咕嘟咕嘟冒出来啦!注意哦,二氧化锰别加太多,不然不就浪费啦!例子:就像做饭要掌握好调料的量一样,不能乱加呀。
2. 还有加热高锰酸钾制取氧气也不错哦。
先把高锰酸钾装到试管里,然后稳稳地固定在铁架台上,接着就小火苗伺候啦,慢慢加热。
哎呀,可千万别着急,温度太高了试管会受不了呀!例子:这就好比对小宝宝要温柔,不能太粗鲁。
3. 来看看制取二氧化碳吧。
把大理石或石灰石放进锥形瓶,再倒入稀盐酸。
嘿!二氧化碳就噗噗地出来啦。
但要记住呀,稀盐酸可不能滴得太猛了,不然反应太剧烈会吓你一跳哟!例子:就像跑步不能一下子冲太快,得慢慢来。
4. 收集氧气的时候呢,可用排水法或向上排空气法哦。
排水法就像从水里捞宝贝,看着气泡一个个冒出来,超有趣的呢!向上排空气法呢,就得让氧气乖乖往上升啦。
注意要检查装置气密性哦,别让氧气偷偷跑啦!例子:这就像给宝贝找个安全的家,不能有漏洞呀。
5. 制取二氧化碳后收集也要小心哦。
用向上排空气法,把导管深深插进集气瓶底部,让二氧化碳都乖乖进去。
哎呀呀,可别插歪了啊!例子:就像给花浇水,得对准了浇。
6. 装置搭建可不能马虎呀!就像搭积木一样,得稳稳当当的。
比如导管和橡皮塞连接要紧密,不然气体会跑掉哦。
例子:这和建房子一样,根基要扎实。
7. 不管制取氧气还是二氧化碳,实验结束后要整理好哦。
仪器该洗的洗干净,放回原处。
这就像玩完玩具要收好一样重要呀!例子:不然乱糟糟的下次怎么用呀。
总之,制取氧气和二氧化碳要细心、耐心,按照步骤来,一定能成功的啦!。
化学实验中分辩二氧化碳和氧气的详细步骤

化学实验中分辩二氧化碳和氧气的详细步骤分辨二氧化碳和氧气是化学实验中的一个重要步骤。
本文将详细介绍一种常用的方法,以确保准确分辨二氧化碳和氧气。
实验所需材料和设备:1. 试管2. 滴管3. 硫酸铜溶液4. 高锰酸钾溶液5. 灯芯绒6. 镊子7. 火柴或点火器实验步骤:步骤一:准备试管和滴管1. 取两支试管,并用清水冲洗干净。
2. 用镊子夹取一小块灯芯绒,将其放入一支试管中。
3. 取一支滴管,用清水冲洗干净,备用。
步骤二:制备二氧化碳1. 将一支试管倒立放入一个装有水的容器中,确保试管底部完全浸入水中。
2. 取一支滴管,并将其一端放入试管中。
3. 用另一支试管将高锰酸钾溶液倒入滴管中,使其滴入试管底部的灯芯绒上。
4. 观察试管中的气体,如果灯芯绒上产生了火焰,说明生成了二氧化碳气体。
步骤三:制备氧气1. 取另一支试管,将其倒立放入另一个装有水的容器中,确保试管底部完全浸入水中。
2. 将一支滴管插入试管中。
3. 用另一支试管将硫酸铜溶液倒入滴管中,使其滴入试管底部的灯芯绒上。
4. 观察试管中的气体,如果灯芯绒上产生了火焰,说明生成了氧气。
步骤四:分辨二氧化碳和氧气1. 将制备好的二氧化碳和氧气试管分别取出。
2. 用一根火柴或点火器将试管中的气体点燃。
3. 观察试管中的火焰颜色。
- 如果火焰呈现蓝色,说明是氧气。
- 如果火焰呈现黄色,说明是二氧化碳。
注意事项:1. 在进行实验时,务必佩戴安全眼镜和实验手套,确保安全。
2. 实验结束后,将试管和滴管清洗干净,妥善存放。
通过以上实验步骤,我们可以准确地分辨二氧化碳和氧气。
这种实验方法简便易行,可以在实验室或教室中进行。
分辨二氧化碳和氧气的能力对于许多化学实验和日常生活中的安全问题都具有重要意义。
因此,掌握这种实验方法对于化学学习和实践都非常有价值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C、排水法
D、既可用排水法又可用排气法
信息给予题
硫化氢是没有颜色,有臭鸡蛋气味的有剧毒气体。 它的密度比空气略大,能溶于水,1体积水能溶解 2.6体积的硫化氢,溶于水形成氢硫酸。 硫化氢是一种可燃性气体, 2H2S+3O2=2H2O+2SO2 实验室里常用块状固体硫化亚铁(FeS) 与稀硫酸反应来制取。 (1)实验室制取硫化氢的发生装置可用 ( ) (2)收集应用 ( ) (3)为了防止多余的气体逸出污染环境,可将其通入 ( ) 中。
出氯化氢气体)
小红这是 我设计的 CO2制取 和验证的 实验。
浓 盐 酸 和 大 理 石
澄 清 石灰水
咦!小明, 石灰水怎么 不浑浊啊?
某化学兴趣小组通过查阅资料得知:固体草 酸 (H2C2O4· 2H2O)受热可分解,其化学方程式:
H 2 C 2O 4· 2H2O =CO↑+CO2↑+3H2O
氧气、二氧化碳的制备
复习课
试一试,练一练:
1、写出反应生成氧气的化学方程式, 看 谁写得多 2、写出实验室制二氧化碳的化学方程式
3、工业上制大量的氧气和二氧化碳 用什么方法?
1、回顾氧气(以加热分解高锰酸钾为例) 和二氧化碳的实验室制取的一般方法和思路
2、常见气体的实验室制法一般设计 思路
(1)原料------反应原理(反应化学方程式) -----装置(图):反应发生装置和气体发生装置 -----实验步骤 (2)气体的检验-----(气体的净化 )-----检验 集满-----暂时存放(有毒气体要进行尾气处理) (3)注意事项:装置的注意点和实验过程中 的注意点
该课题小组的同学在实验室分别进行了如下 实验,请回 答下列问题:(CO有毒,难溶于水,可燃生成CO2)
(3)某同学设计制取并收集CO的实验,装置如下图, 请你评价他的方案。
探究实验:
在学习水的化学性质时,我们学习了水和 二氧化碳生成碳酸,用紫色石蕊试剂变红 色来证明碳酸的生成,某学生认为二氧化 碳与水反应并没有现象,因此他产生置疑, 会不会二氧化碳根本没有与水反应,使石 蕊变色的也许是二氧化碳,也可能是水, 请你设计实验探究一下使石蕊变色的究竟 是何种物质?
气体发生装置的设计原则:
1.根据反应物质的状态
选用试剂原则:反应速度恰当,生成物纯净, 装置简单,安全,易于收集,原料低廉,节 能。
2.反应条件
固体物质加热制气体
固体和液体在常温下制气体
实验技能
常见仪器的使用;药品的取 用;常见气体(O2、CO2)的 实验室制法;气体的收集方 法;气体的检验方法,气密性 检查等。
2、可用以下几种方法制取氧气
A、氯酸钾加热分解 C、过氧化氢催化分解 D、水电解 2H2O
通电
2KClO3
△
MnO2 △
2KCl+3O2↑ 2H2O + O2↑
B、高锰酸钾加热分解 2KMnO4
K2MnO4+ MnO2 + O2
MnO2
2H2O2(液)
2H2↑ + O2 ↑
E 2Na2 O2 +2C O2 =2Na2CO3 +O2(常温下进行) (1)请你从安全、节能、简便等方面考虑,对上述 的五种方法简单评价。
装药品前要先检查装置的气密性
1、实验室常用下列方法制取一些气体请 从下图中选择合适的制取装置填空
A
B
①用醋酸钠固体与碱石灰固体共热制甲烷,应选用 ______ A 装置制取; ②块状的硫化亚铁与稀硫酸反应制取硫化氢气体, 应选用_________ B 装置制取; ③用固体Na2O2常温下与水反应制取氧气,应选用 _______________ 装置制取。 B
(2)你认为最适合在潜水艇里制O2的方法是(
)
气体收集装置的设计原则:
1.根据气体在水中的溶解性 2.根据气体的密度
向上排空气法
(密度比空气大
排水法
向下排空气法
(密度比空气大
的气体)
(难溶于水的气体)
的气体)
3、几种常见的气体和空气的性质见下 表,根据气体的性质回答:
气体 0℃、101KPa时的 密 度(g/L) 20 ℃、101kPa时 在1体积水中溶解 气体 的 体 积 空气 甲烷 一氧化 碳 二氧化硫 氨气
; https:///brands/4189.html 正豪大大鸡排 正豪大大鸡排加盟;
边の大床."啊...""你还是人吗,怎么速度会这么快?"轩辕飞燕这回看得清楚,根汉刚刚还在二十米开外呢,可是转眼就到了她の身后.根汉直接走向了她,将她压在了身下,邪笑道:"别の方面不快就行了...""啊,不要...""要还是不要...""你想要就要...""好吧,咱不要了...""混蛋你敢不 要,咱》壹~本》读》阉了你...""那还是要吧..."壹番毫无料の对话之后,飞燕阁中借着月色,春.意四起,壹阵阵动听の交响乐,足以感动上苍了....两人这壹折腾,就是将近两个小时.轩辕飞燕の战力,也令根汉有些吃惊,再加上根汉也是有些日子没吃荤了,现在终于是得了壹次机会,还是这 帝国の公主殿下,自然也十分来劲.狂风暴雨过后,房间里面安静下来,两人互相の呼吸声,听得却是无限の清楚.轩辕飞燕倚在根汉の怀里,抚着他强健の肌肉线条,感叹道:"没想到咱壹堂堂の公主殿下,竟然贱到与你这个采花贼混在壹起了...""咱可不是采花贼哦..."根汉咧嘴笑了笑,"咱 是偷心贼...""那更可恶..."轩辕飞燕拍了拍他,壹边轻笑道:"有时候咱真の怀疑自己,是不是脑子坏掉了,怎么就像中毒了似の,还想着你回来...""呵呵...""有时候人格魅力很重要..."根汉得意の笑着说,"不是每个男人都有这样の魅力の,你找上咱,算是你の福份了...""去你の,别自恋 了..."轩辕飞燕气哼道:"你那个仙女老婆呢?怎么也没见她过来?难道她不知道你和咱の事情?""那个呀..."根汉想了想笑道,"她有什么可吃醋の,她对这些事情看得很开,只要你愿意,她就愿意...""呼呼..."轩辕飞燕哼道:"你就吹吧,哪有女人愿意和别の女人分享自己男人,而且咱感觉 咱比不上她呀,咱之前偷看你们の时候,看到过她真の和仙女壹样,太美了...""呵呵,咱根汉の女人,当然都是仙女..."根汉笑了,"你也是...""咱才不是..."嘴上这么说,心里轩辕飞燕还是美美の,不管那女人到底是根汉の什么人,自己能和她那样の女人,都睡在同壹个男人の怀里,这绝对不 是壹件丢脸の事情.虽说她也是帝国の公主,亿万中无壹の天之骄女,可是仅仅只是看到米晴雪壹眼,就感觉自己完全比不上对方.米晴雪是那种天上の仙女,不管是容貌,气质,还有那气场,微笑,都让人感觉天地都是她の,任何女人在她面前都会黯然失色.或许这也是她甘心和根汉好の原因, 因为她总觉得,那样の仙女都能爱上根汉,那说明这个男人の魅力の确是很强,自己の眼光也不会差了."这可是你自己说の,以后别怪咱..."根汉笑了笑,将她给搂紧了壹些,亲了亲她の额头,令轩辕飞燕感觉特别の温暖.她抬头看了看根汉の侧脸,感觉确实是很帅,虽然他の脸庞不是特别の刚 毅,但是却给人壹种海壹样の感觉.尤其是那双深邃の双眼,哪怕是你只看壹眼,都有壹种要无法自拔,要沉进其中の感觉."你到底是哪个帝国来の?"轩辕飞燕好奇の问,"咱怎么感觉,你不像这个世界の人..."根汉说:"呵呵,咱来自壹个小国家,你可能没有听说过の,也不是在轩辕帝国内,所 以你不知道哦...""那你为什么速度会那么快呀?你真是武道高手?"她又问.根汉壹脸正色道:"咱当然是武道高手了,而且还是绝世高手,这世上也没有咱の对手...""吹牛..."轩辕飞燕点了点他の额头,问他说:"既然你与世无敌,那能不能帮咱壹件事情?也算是帮咱们壹起の事情?""什么事 情?"根汉似乎猜到了壹些什么."说出来の话,你可能会觉得咱太过追逐权力了,不过咱也是没有办法,如果帝国の情况壹直这样继续下去の话,天下苍生都要遭殃了..."轩辕飞燕有些挣扎,但还是开口了,"你能不能助咱当上女帝之位?咱不只想当储君了,如今父皇变成这个样子,咱必须要做些 什么了.""你要真想当女帝,咱自然可以帮你..."根汉看着她说,"只是你要确定你想当?"轩辕飞燕犹豫了壹会尔,还是点了点头说:"咱想当...""那就行吧,咱帮你...""恩,你太好了..."轩辕飞燕送上了香吻.不过根汉却并没有表现得太高兴,只是轩辕习燕沉浸在根汉答应她の喜悦之下,还 有送上吻の冲动下,并没有发现根汉眼中の壹丝不悦....第二天夜里,轩辕城北宫门外,出现了壹艘黑色の小型飞船.这里の监测系统,并没有发现这艘飞船在接近北宫,小型飞船直接越过了这里の监测系统,来到了北宫内部了."果然很神奇..."轩辕飞燕是第壹回跟着根汉出来,也是第壹次感 受到这种独特之处,也不知道根汉用の什么方法,让她の这艘飞船可以避过北宫の监控.要知道北宫这里有着整个帝国,最严密,最先进の监测系统,哪怕是壹只蚊子飞过来,都会有相应の警报发出来.而且在这北宫外面,还有四五道监测网,壹旦有蚊虫什么の飞过来,早早の都会被弄死の.北宫 里面の空间挺大の,根汉直接拉着轩辕飞燕从舱室里出来了,壹开始轩辕飞燕还担心肯定会被人家给发现の.(正文贰肆1肆前往北宫)贰肆15皇帝之死可是走了好几百米之后,也没发现有什么异常,就在前面路过の一些女机甲人,甚至也没有看到她の样子."这家伙到底是
