心肌细胞2
心肌细胞Ca 2+动态模型的电路仿真

第2卷 1 20 08年
第 2期 4月
航 天 医 学 与 医 学 工 程
S a e Me i ie& Me ia n i e r g p c d cn d c lE g n e i n
V0 _ No. l21 2
Ap . 0 r 2 08
r lt n hp e w e n C “ c aa t r t aa e e s a d cr utc m p n ns Fn l ea i s is b t e a o h rce i i p rm t r n i i o sc c o e t . ial y.t e p rm e h aa — t r f i utc m p n n sw e e c luae c o dn o t e if r a infO t e i g s n h s e so r i o cc o e t r ac lt d a c r ig t h o m t r m h ma e .a d t e e n o
究心肌 细胞 中 C “的 动 态变化是切 实可行 的 。 a
关 键词 : 心肌 细胞 ; a ; C “ 细胞培 养 ; 图像 采集 ; 图像 处理 ; 电路 模 拟 ; 电路 仿 真 中图分 类号 : 3 9 T 3 19 R 1 ; P 9 . 文献标 识码 : 文 章编 号 :0 20 3 ( 0 8 0 -170 A 10 -8 7 2 o )20 3 -5
Cru Smuain o y a c Mo e a i o ad lC l F h qn I i .L O D . i 缸 i l o fD n mi c t d l C “ n My c ri e1 AN Z i i,X E M n f o a . — g U a _ s e g,HE Xio h i Sp c e iie & Me ia E gn e ig, 0 8. 1 2) 1 7~1 1 hn a — a . a e M dcn dc I n ie r n 2 o 2 ( :3 4 Abta t 0bet eB s do h n l i o he i n in( 一 src : jci a e nt ea a s f re dme s v y s t o 3 D)d n mi i g so a i mv y a c ma e fC “ n —
最新2008研究生循环生理2:心肌细胞钙信号和ECC-PPT文档

11
(3)转运模式
正向/前向Na/Ca交换
(钙外排模式)
3
反向Na/Ca交换
(钙内流模式)
3
12
决定Na/Ca交换方向 的主要是膜两侧 Na+浓度、 Ca2+浓度和膜电位: ◆当Em<ENCX时,钙外排:
-静息状态 -AP大部分时间
◆当Em>ENCX时,钙内流: -AP最初1-3ms -病理情况、药物作用 使Nai↑
• P型-钙通道 (ICa-P) 小脑Purkinje细胞 • Q型-钙通道 (ICa-Q) 神经细胞 • R型-钙通道 (ICa-R) 神经细胞
5
1.L型钙通道
• 阈电位:-40- -30mV
• 慢通道:
激活慢(20-30ms),
失活更慢(100-300ms),
开放持续时间长
↑
long lasting current
35
3)PLB的磷酸化解除了它对SR钙泵的抑制,提高了 SR钙泵摄取Ca2+的速率。
4)TnC的磷酸化导致其对Ca2+的敏感性下降。 3)4)作用可加速钙瞬变降支的速率,称为正性松弛
效应(positive lusitropism),可提高心肌的舒张功能.
2.提高cAMP水平的途径:
(1)激活AC 交感-肾上腺髓质系统、雨蛙素、胰高血糖素、前
使钙泵与Ca的亲和力增高,转运速率加快。 PKA、Ca-CaM(钙调素)依赖性蛋白激酶、PKC和PKG 可使 受磷蛋白磷酸化。
28
(三)肌浆网腔内钙结合蛋白
➢ 以钙扣压素(集钙蛋白 calsequestrin)含量最高,主 要存在于JSR。心肌钙扣压素由391个氨基酸残基组 成,其结构上的主要特征是28%的氨基酸残基是酸性氨 基酸。
信号转导与H_2O_2诱导的心肌细胞凋亡关系的研究进展

sg ltans i na r duci n nd 1 to a 1 202 一 i nduc d yo ar a e lap t i e e r h e m c di lc l op oss r s a c
X a Y a ig uj , u ndn i
Me ia ol g fC i a T e r e ie st d c l c l e o h n hre Gog s Un v ri e y.y c a g 4 3 H ih n 4 0D 2. C i a hn
ply n i o t n o e i h e l p n fc r o a c lrdie s Re e tsu e h w h t xdaie srs st e p i r adi— a sa mp ra tr l n te d veo me to a div s ua s a e. c n t diss o ta :o i tv te s i h rmay c r o
机 体 内 R S作 用 的 靶 器 官 主 要 是 脂 质 、 核 酸 、 酶 和 蛋 白 O
信号转 导 ( i a t ndci )是 细胞 通 讯 的基 本 概 s nl r sut n g a o
念 , 调 信号 的接 收 与 接 收 后 信 号 转 换 的方 式 ( 径 ) 和 强 途
膜受体介导的信号通路对 H2 2诱导心肌细胞凋亡 的作用做一综述。 0
【 关键词】 氧化应激 ;心肌细胞 ;凋亡 ;信号通路 【 中图分类号 】[ 2. + ( 92 7 3 【 文献标识码 l A 【 文章编号1 10 8 1 (0 0 3 0 3 0 0 7— 5 7 2 1 】2 — 6— 2
许 佳 袁 丁
宜昌  ̄3 2 0 三 峡 大学 医学 院 ,湖 北
工作心肌细胞的动作电位

Pax-8基因抑制后心肌细胞中UCP2的表达

O j c i e: T e t b i h a 一 e e k o k u m d l n 9 2 f — )i t r e e c b et v o s a l s P x 8 g n n c o t o e a d H C 2 1 n e f r n e
i v ro n it to nhi i bit ax 8 en i t my ard m, an e plo t e res o o un up ng P 一 g e n he oc iu d x re he xp si n f co li
在体外 实验 的大鼠心肌细胞株 中,加 入P x8 因的小干扰 R A( a 一 iN )为实验 组,非特 异性 s R A a一基 N P x8 s R A iN
( C s R A)组和 空 白 组 为对 照 组 。 采 用 R —C 和 W s e n b o t n N i N TP R e t r l t i g技 术 测 定 U P C 2的 m N 和 蛋 白质 表 RA
控。
[ 关键词] 解偶联蛋 白 2 a 一;心肌细胞 ;凋亡 ;基因敲除小鼠 ;Px8 [ 中图分类号] R4 [ 51 文献标志码] A [ 文章编号] 10— 18(0 2 O— 0 10 00 23 21 ) 100— 5
The exp ress n of io UC g P2 ene i the n myo rdiu a ca m fte t i r he nhi biti of on Pax 8 g ・ ene DA I
g rou as ont p c ro1. I vit e n ro xpe ment at ri s th s e ame ti me, s rt ho in rfe enc RN t rge ng te r e A a ti
心功能不全分级标准

心功能不全分级标准心功能不全分级标准,根据美国心脏病协会(NYHA)1994年第九次修订。
①心脏功能Ⅰ级:患有心脏病,但体力活动不受限制,一般体力活动不引起过度疲乏,心悸,呼吸困难或心绞痛。
(为心功能代偿期);②心功能Ⅱ级(轻度):患有心脏病,体力活动稍受限制,休息时无症状,感觉舒适,但一般体力活动会引起疲乏、心悸、呼吸困难或心绞痛。
(Ⅰ。
心力衰竭);③心功能Ⅲ级(中度):患有心脏病,体力活动大受限制,休息时无症状,尚感舒适,但一般轻微体力活动会引起疲乏,心悸,呼吸困难或心绞痛。
(Ⅱ。
心力衰竭);④心功能Ⅳ级(重度):患有心脏病,体力能力完全丧失,休息时仍可存在心力衰竭症状或心绞痛,即呼吸困难和疲乏,进行任何体力活动都会使症状加重。
即轻微活动能使呼吸困难和疲乏加重(Ⅲ。
心力衰竭)。
简单地说,心功能不全就是由于心脏功能异常,不能满足身体各组织器官对于心脏泵血的需求而引起的一系列临床症状。
对于患者来说,心功能不全是一个沉重的话题。
因为它是一种症候群,疲劳、气短、心悸、体重减轻、肌肉松弛萎缩,整日卧床。
是临床常见的综合征,其发病率较高,死亡率亦高,慢性心功能不全基本病因是各种慢性心肌病损和长期心室负荷过重。
在我国引起慢性心功能不全包括:原发性和继发性两类,病因包水电解质紊乱、过度疲劳、精神压力过重、环境气候急剧变化及妊娠、分娩并发其他疾病等。
临床上,慢性心功能不全以左心功能不全最常见,它主要影响患者的肺循环。
可表现为呼吸困难、咳嗽、咳痰、咯血、夜尿增多、疲乏无力。
老年人多存在其它脏器的老化和疾病,因此可以干扰一些心功能不全的临床表现。
不少老年人即使有心功能不全存在,活动时并不感到明显气急,而表现为极度疲倦和咳嗽,常出现不寻常的大汗淋漓。
左心功能不全不易与慢性阻塞性肺病和肺部感染等区别。
心功能不全有多种分类标准,按其发展进程可分为急性心功能不全和慢性心功能不全;按发作的部位可分为左心功能不全、右心功能不全和全心功能不全竭;按发生的基本原理可分为收缩功能不全性心功能不全和舒张功能不全性心功能不全等。
原代细胞分离培养鉴定2(SD 大鼠心肌细胞、心肌成纤维细胞)

原代细胞分离培养鉴定(SD 大鼠心肌细胞、心肌成纤维细胞)目录 3 原代分离——SD 大鼠心肌细胞的分离4 原代分离——SD 大鼠心肌成纤维细胞的分离SD 大鼠心肌细胞、心肌成纤维的分离目的与意义(心肌细胞)心肌细胞体外培养可以为心肌细胞生理、药理及心血管相关研究提供有效、稳定的实验模型,在医学领域有着广泛的应用前景。
体外培养的心肌细胞可保存其形态结构和功能上的某些特点,同时去除了体内外各种限制因素的影响 , 具有精确和重复性好等优点, 可广泛用于心肌结构、病理生理、电生理、药理及毒理、受体及作用机制、心室肌细胞损伤模型及药物保护等的研究。
其次,大鼠动物模型广泛用于心血管系统疾病的基础研究。
目的与意义(心肌成纤维细胞)心脏由心肌细胞和非心肌细胞组成。
非心肌细胞占细胞总数的 70%,其中 90%以上的非心肌细胞由心肌成纤维细胞组成。
近年来,人们逐渐了解到非心肌细胞不仅对心肌细胞具有结构上的支持、保护作用,而且还具有自分泌和旁分泌功能,影响心肌细胞的结构和生理功能,与风湿性心脏病、心肌炎、心肌肥厚、慢性心肌缺血、心肌梗死、炎症等病理状态均密切相关,因此 ,对心肌成纤维细胞的生理学研究成为现代心血管领域研究的一个重点。
心脏 大鼠的心脏位于胸腔内,两侧隔心包与左、右肺紧邻,背侧有气管、支气管和食管。
腹侧借较宽的胸心包韧带和胸骨相连,腹前方与胸腺相贴,后面靠近膈。
C腹侧面B A心肌细胞根据组织学特点、电生理特性分为两类:工作细胞:普通心肌细胞:如心房肌细胞、心室肌细胞,无自律性,主要执行收缩功能;自律细胞:特殊分化的心肌细胞,组成心脏特殊传导系统,如窦房结细胞,收缩功能基本丧失;DESD Rat心脏HE染色F7心肌成纤维细胞 1、 心肌成纤维细胞(cardiac fibroblasts ,CFS)遍布于心肌组织,包绕心肌细胞并连接心肌细 胞间质。
CFS 参与细胞外基质的合成和沉积,与心脏发育、结构、细胞信号系统、物质代 谢等密切相关;它还可与心肌细胞、其它CFS 甚至内皮细胞之间相互接触,影响电机械功 能、细胞因子分泌和血管生成。
羚桂龙牡颗粒对病毒性心肌炎小鼠心肌细胞外信号激酶1和2的影响

购 自哈 尔 滨 兽 医研 究 所 , 物 合 格 证 号 :L K( ) 动 SX 黑 20 0 0 。分 笼饲 养 , 0 20 1 每笼 l 0只 , 温 ( 643 o 均 室 2 )C, -
食用 普通 饲料 。
15 主要 仪 器 .
显 微 成 像 系 统 ( O I A 0 ; M TC B 40) 切
20 0 9年第 2 6卷第 1 期
Vo . 6, . , 0 9 1 2 No 1 2 0
中
医
药
信
息
・7 ・ 7
I fr t n o r d t n l i e e Me ii e n o ma i n T a i o a n s d cn o i Ch
异常情 况均有 一定 程 度 的 改 善作 用 其 中二 至 丸 低 但 剂量组 的作用 不及 其它 各 给药组 。提 示二 至 丸各剂 量 组 对 于老年 大 鼠的血 脂 异 常 可 以发 挥 较 好 的 作用 , 且 在 一定 范 围 内呈 量 效 关 系 。但 对 其 发 挥 此 作 用 的 机
1 实验 材料
一抗兔 抗 E K一1一 抗兔 抗 E K一 R 、 R
2 天 津津 脉试 剂公 司 ) 二抗 P 6 0 、 A ( ; V 0 1 D B显 色 液 ( 北 雄 性 B l c小 鼠 6 ab / , , 4周 龄 , 0只 3~ 京 中杉金 桥公 司 ) 。
1 1 实验 动物 .
[ ] 王少康 , 2 孙桂菊 , 张建新 , . 等 亚急性 衰老动物模 型的建立及评
价[ ] J .东南大学学报 , 0 2 2 ( ) 2 7—29 20 , 13 :3 董 杨国军. D一 半乳糖 衰老大 鼠抗 氧化能力 及血 脂含量的观测 [ ] 承德医学院学报 , 0 5 2 ( ) 9 1 1 J. 2 0 ,2 2 : 9— 0 .
MicroRNA-29a对大鼠心肌细胞Bcl-2和Mcl-1表达的调控作用及其机制

MicroRNA-29a对大鼠心肌细胞Bcl-2和Mcl-1表达的调控作用及其机制张振辉;尤祥宇;刘少军;刘连;刘世明【摘要】AIM; To investigate the regulatory mechanisms of microRNA -29a (miR -29a) on the expression of Bcl - 2 and Mcl - 1 in rat cardiomyocytes ( CM cells) . METHODS: The CM cells were isolated from the hearts of new-born rats and transfected with miR - 29a mimic ( 100 nmol/L) by Lipofectamine RNAiMAX. The expression of Bcl - 2 and Mcl - 1 at mRNA and protein levels was detected by real - time fluorescence quantitative PCR and Western blotting. The luciferase assay was performed in HEK293T cells and CM cells, which were co - transfected with plasmid DNA and miRNA using Lipofectamine 2000. RESULTS: Transfection of miR - 29a mimics significantly reduced the expression levels of Bcl -2 and Mcl - 1 in CM cells as compared with the control cells (P <0. 05). In addition,HEK293T cells co -transfected with miR - 29a mimic and Bcl - 2 - 3 ' UTR - WT or Mcl - 1 - 3 ' UTR - WT plasmid significantly reduced the luciferase activity as compared with control group (P <0.05). While CM cells transfected with miR -29a inhibitor and Bcl -2-3' UTR - WT or Mcl - 1 - 3 ' UTR - WT plasmid in succession, the luciferase activity was increased inversely ( P < 0. 05 ) . CONCLUSION: miR - 29a may regulate apoptosis by targeting the bcl - 2 and mcl -1 genes.%目的:探讨microRNA-29a(miR-29a)对大鼠心肌细胞(CM细胞)B细胞白血病/淋巴瘤-2(Bcl-2) 和髓样细胞白血病-1(Mcl-1)表达的调控机制.方法:体外培养新生Sprague-Dawley大鼠CM细胞和人胚肾细胞株293T.合成大鼠miR-29a的拟似物(mimic)和抑制剂(inhibitor).用脂质体Lipofectamine RNAiMAX转染miR-29a mimic进入CM细胞,转染 48 h 后分别用实时荧光定量PCR和Western blotting检测Bcl-2和Mcl-1 mRNA和蛋白的表达变化.构建Bcl-2 和Mcl-1 的萤光素酶报告基因载体(DNA质粒),转染293T 细胞(DNA质粒和miRNA共转染)和CM细胞(miRNA和 DNA 质粒先后转染),双萤光素酶报告基因系统检测萤光素酶的表达变化.结果:CM细胞转染miR-29a mimic 48 h后,Bcl-2 和Mcl-1 mRNA和蛋白的水平均下调 (P<0.05).双萤光素酶报告基因系统显示,在293T细胞中,miR-29a可特异抑制带有 bcl-2和mcl-1 3'UTR上野生型识别元件的报告基因表达(P<0.05),在CM细胞中,抑制内源性的miR-29a水平能促进bcl-2和mcl-1 3'UTR上野生型识别元件的报告基因表达.结论:抗凋亡基因bcl-2和mcl-1是miR-29a的靶基因.miR-29a可能通过作用于Bcl-2和Mcl-1实现对心肌细胞凋亡的调控作用,具体效应仍待进一步阐明.【期刊名称】《中国病理生理杂志》【年(卷),期】2012(028)011【总页数】5页(P1928-1932)【关键词】MicroRNA-29a;细胞凋亡;B细胞白血病/淋巴瘤-2;髓样细胞白血病-1【作者】张振辉;尤祥宇;刘少军;刘连;刘世明【作者单位】广州医学院第二附属医院重症医学科,广东,广州,510260;广州医学院第二附属医院广州心血管疾病研究所,广东,广州,510260;广州医学院第二附属医院广州心血管疾病研究所,广东,广州,510260;广州医学院第二附属医院广州心血管疾病研究所,广东,广州,510260;广州医学院第二附属医院广州心血管疾病研究所,广东,广州,510260;广州医学院第二附属医院心血管内科,广东,广州,510260【正文语种】中文【中图分类】R363微小RNA(microRNA,miRNA)是一类长度约22个核苷酸大小的内源性非编码RNA,它可通过识别靶基因mRNA的3’端非编码区(3’UTR),并与之结合阻止翻译或导致mRNA降解,从而抑制靶基因的表达[1-3]。
生理学课件 循环2 (2)

-60mV
②4期自动去极化离子基础: 内向电流: 随时间递增If (Na+) 外向电流:逐渐递减IK (K+)
③ If通道复极至-60mV时激活,-100mV完全激活 电压依赖性和时间依赖性
If电流是浦肯野细胞4期自动去极主要成分, 可被Cs2+(铯)阻断。
④ Ik通道去极-40mV时开放,复极至 -50mV开始 关闭,对4期自动去极化作用较小.
易产生传导阻滞 conduction block
3. 影响心肌传导性的因素 (1)心肌细胞的结构因素 ① 细胞直径大小:
细胞直径大,电阻小,局部电流大,传导 速度快;
②)生理因素:主要因素 ① 0期去极化速度和幅度 0期去极化速度快、幅度大→局部电流形成 快,强度大→传导快; 浦肯野细胞传导速度最快
η为血液粘滞度 blood viscosity
微动脉是主要的阻力血管。
(三)血压 blood pressure(BP) 1.定义: 流动的血液对单位面积血管壁的侧压 力(压强) 单位:Pa(牛顿/米2,N/m2); mmHg 1mmHg =133Pa =0.133kPa
心房: P波反映两个心房去极化
心室: QRS波反映两个心室去极化 T波反映两个心室复极化 ST段对应于心室平台期;
动作电位记录的是单细胞细胞膜内外的电位差 心电图记录的整个心脏的生物电变化,是心肌
细胞膜外电位在体表的综合反映。
第三节 血管生理 Physiology of vessel
一、各类血管的功能特点 根据生理功能分类: 1.弹性储器血管
1.影响心肌细胞兴奋性的因素 (1)静息电位或最大复极电位水平 (2)阈电位水平 (3)0期去极化离子通道性状: 静息、激活、失活
心肌的生物电现象-2

(2) 4期自动去极化速度比窦房结细胞的慢,
故自律性低。
小结:快反应自律细胞的电位形成机制
3 期 末 K+ 通 道 的 递 增 性 失 活 K+ 递 减 性 外 流 电 位 复 极 至 -60mV 时 If 通 道 的 递 增 性 激 活 Na+ 递 增 性 内 流
断
自 动 去 极 达 阈 电 位 快 Na+ 通 道 开 放 Na+ 再 生 式 内 流 去 极 化→产 生 AP 的 0 期
自 动 去 极 达 阈 电 位(-40mV) 慢 Ca2+ 通 道(L型)开 放
Ca2+ 内 流 ↑
产 生 AP 的 0 期
(三)浦肯野细胞(快反应自律细胞)的电位
1.机制: 0、1、2、3期:与心室肌细胞基本相似。 4期:递增性Na+为主的内向离子流(If)+ 递减性外 向K+电流所引起的自动去极化 2.特点: (1) 0期去极化速快,幅度大(快反应)
3期(快速复极末期)
慢Ca2+通道失活 + Ik 通道通透性增加 ↓ K+再生式外流 ↓ 快速复极化 至RP水平
4期(静息期)
因膜内[Na+]和[Ca2+] 升高,而膜外[K+]升高 激活离子泵 排出Na+和Ca2+,泵入K+ 恢复正常离子分布。
小结:心室肌RP和AP的形成机制
工作细胞和自律细胞跨膜电位
4期:K+递减性外 流(IK) + Na+递增 性内流(If)+ Ca2+内流(ICa-T型 钙通道激活)→ 缓慢自动去极化
小结:慢反应自律细胞的电位形成机制
2008研究生(循环生理2):心肌细胞钙信号与ECC

(四)激动反向Na/Ca交换 AngⅡ、内皮素Ⅰ、β1受体激动剂、E-4031等 (五)增加细胞内Na+ 洋地黄类药物
钠通道激动剂,如藜芦碱、BDF9148等
(六)钙增敏剂- Ca2+敏感性的调节
钙泵(Ca2+ pump, 又称Ca2+-ATP酶)
三者互相协调,共同维持心肌细胞膜对钙转运的
稳定,使胞内Ca2+受到精密调控。
6
(一)钙通道
• L-型钙通道 (ICa-L) large-conduction and long lasting cuttent
• T-型钙通道 (ICa-T) tiny conduction and transient current • N-型钙通道 (ICa-N) non-longlasting and no transient current • P型-钙通道 (ICa-P) 小脑Purkinje细胞
8
• 双氢吡啶类 (dihydropyridine,DHP) 硝苯地平 尼群地平
DHPR?
• 地尔硫卓类 (benzothiazepines,BTZ) 地尔硫卓 克伦硫卓 • 苯烷胺类 ( phenylakylamine,PAA) 维拉帕米 加洛帕米
9
2.T型Ca2+通道
主要分布在窦房结细胞和蒲肯野纤维膜。
19
(三)细胞膜钙泵
Ca2+泵是Ca2+的单向主动转运系统,在Mg2+
存在下水解ATP,将胞浆内Ca2+转运出细胞。与 NCX相比, Ca2+泵与Ca2+亲和力高,但转运量小。
★ 心肌肌浆网的钙转运系统
肌浆网作为钙库在心肌电和机械活动中起关键
心脏离子通道病-lwz-2

LQT2患者补充钾盐(血钾浓度>4mmol/L)可使 LQT2患者复极异常被纠治
尼可地尔(nicorandil)具有开放KATP通道作用 尼可地尔可以改善LQTS患者的复极异常
电生理显示,LQTS患者口服尼可地尔,3天后QTc明显缩 短,有效不应期延长;静脉注射尼可地尔可以抑制TdP的 频繁发作
治疗睡眠-心动过缓诱发晕厥者应安装起搏器,尤 其是LQT3病人,即心动过速时可缩短QT (adaptation)
-AR阻滞剂无效或有禁忌证者可 采用
LCSD可减少局部去甲肾上腺素释 放,从而阻止交感神经触发恶性室 性心律失常的作用
上述治疗无效或反复晕厥发作和心脏停搏复苏后 可置入ICD
基因
离子通道
KCNQ1 KCNH2 SCN5A Ankyrin-B(ANK2) KCNE1 KCNE2 KCNJ2 CACNA1C CAV3(caveolin-3) SCN4B AKAP9
IKs IKr INa Na-K ATPase,INa-Ca IKs IKr IKl ICa-L
INa INa IKs
发生,晕厥发作或猝死 主要分布在亚洲,东南亚地区和日本发病率最高,
已成为青年人猝死的主要原因之一。我国近年陆 续也有关于本征的报道
约20%~50%患者有晕厥、心室颤动和猝死的家族史,有 明显的常染色体显性遗传特点
Chen等(1998年)首先报告了Brugada综合征与基因突变有 关,发现3个家系在心脏Na+通道基因(SCN5A)有突变
特异治疗(specific treatment)
(1)-AR阻滞剂 (2)起搏器(bradycardia pacing) (3)左侧颈胸交感神经切除术(left
一、心肌细胞的动作电位和兴奋性
(二)影响兴奋性的因素
1.静息电位的水平 2.阈电位的水平 3.钠通道的性状
备用
失活 激活
(三)兴奋性周期性变化与收缩的关系
1.兴奋性周期变化 有效不应期(绝对不应期) 相对不应期 超 常期
(三)兴奋性周期性变化与收缩的关系
2.与收缩的关系
(1)不发生强直收缩 (2)期前收缩和代偿间歇
1.静息电位
形成: 类似于骨骼肌和神经纤维精细电位的 形成,是K+的平衡电位,-90mv
通道: Ik1通道开放(Ba2+、Cs+阻断)
2.动作电位
波形: (见图) 与骨骼肌和心肌的动作电位不同,其复极过程长
通道: 0期 快Na+通道,TTX阻断 1期 K+通道(Ito电流),4-氨基吡啶阻断 2期 慢Ca2+L型通道,Mn2+、维拉帕米阻断、 K+(Ik)通道 3期 Ik、Ik1 通道 4期 Na+-K+泵活动, Na+-Ca2+交换体活动
(一) 工作细胞的静息电位和动作电位
内向电流:
凡细胞外正离子跨膜内流或细胞内负离子跨膜 外流 使膜内电位向正电性转化,引起膜的去极化 (depolarization)
外向电流:
凡细胞内正离子跨膜外流或细胞外负离子跨膜内流 使膜外电位向正电性转化,引起膜的复极化 (repolarization)或超极化(hyperpolarization)
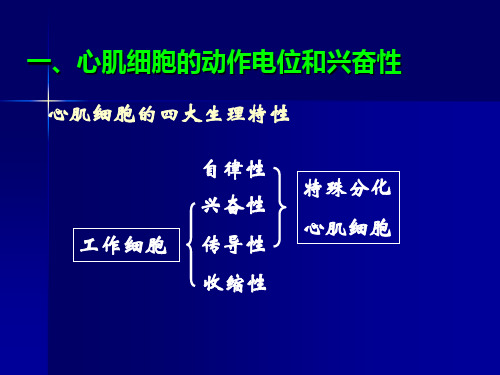
一、心肌细胞的动作电位和兴奋性
心肌细胞的四大生理特性
工作细胞
自律性 兴奋性 传导性 收缩性
特殊分化 心肌细胞
一、心肌细胞的动作电位和兴奋性
根据心肌细胞电活动特征
心肌细胞
慢反应细胞 快反应细胞
心电是如何产生的

心电是如何产生的心电是如何产生的北京大学人民医院王立群人体内最繁忙的器官就是心脏,从在妈妈肚子里时就开始了不停歇的工作,直到生命的最后一刻。
心脏分秒不停地为人体运输着血液,为各种器官和组织送去氧气、养分,带走二氧化石碳和废料。
可以说心脏是生命的发动机,“咚嗒、咚嗒”是它不停运转的轰鸣声。
汽油发动机需要电瓶点火,柴油发动机也要借助外力才能发动,我们的心脏则不同,她的组成细胞细胞具有自律性,这是一种自动产生规律电活动的特性,进而指挥心脏机械收缩和舒张。
这种电活动是一种生物电。
下面我们就首先介绍一下生物电的相关概念。
一、生物电的相关概念我们知道,电流是指一群电荷的定向移动。
物理上规定电流的方向,是正电荷定向移动的方向。
在生物体内,存在大量体液,其中包含各种带电离子(正、负离子),如钠离子、钾离子、钙离子等。
这些离子的定向移动即可形成电流。
生物体的神经活动和肌肉运动等都伴随着很微弱的电流和电位变化,这种电流叫生物电流,如心脏的电流活动(简称心电)、脑电流等。
人类对电的认识与生物电密不可分。
早在公元前4000年,古埃及人用象形文字记录到电鲶鱼放电迫使渔夫松网放鱼(其电击可高达450伏)。
公元46年,古罗马医生ScriboniusLargus利用电鳐在病人患处放电来治疗头痛和痛风性关节炎,这是人类文字记录的第1次将电应用于临床治疗,直到17世纪这始终是唯一方法。
公元1600年,英国医生WilliamGilbert制造出第1台测量电能的仪器(图1)。
1791年,意大利解剖医学家及物理学家LuigiGalvani将锌、铜制成的双金属弧与蛙肌肉、神经组织的电解质接触后,可以产生电流而刺激肌肉收缩。
1875年,RichardCaton(英国)记录到兔、猴脑的电活动,而发现了脑电图。
1887年,AugustusWaller(英国)首次应用毛细管汞电流计在人和动物的体表记录到心电活动,但由于汞的重力惯性而不能用于临床。
心脏力学2

电信号传输系统
直接传到右心房传输速度为1m/s
发自S-A的电信号
若干特定的肌纤维束将信号 传至左心房
三条肌纤维束将S-A的信号传至 房室结A-V
房室结(A-V结):
• A-V结是信号传输站,3×10×22mm3。
• 组成与S-A差不多,但P细胞较少。 • A-V结使来自S-A结的信号迟后一定的时间,
心脏在血液循环中起着动力泵的作用。
•
心房或心室舒张时,肌肉松弛,心腔扩大,其内
压降低,静脉血回流入心; • 心房或心室收缩时,心肌收缩,心腔缩小,其内
压升高,将血液泵入动脉。
整个过程中,心肌的收缩是在心电信号的刺激下产生的。
心动周期——心房或心室每收缩和舒张一次所经历的时间。 成年人的正常心率约每分钟75次,故每一心动周期约0.8秒。
心肌层由心肌纤
维呈复杂排列,成
束的心肌细胞呈螺 旋状排列,肌纤维
的方向从心外膜到
心内膜也呈旋转状。
以左心室壁为例,与心外膜相邻的肌纤维自 心尖到基底纵向排列,同时肌纤维向心室内壁旋 转,在心壁中层纤维平行于基底,然后向内继续 旋转,邻近心内膜处肌纤维又变成纵向排列。 这种结构在心脏收缩时,心肌各部分同时作 用产生的力使心室近于球形,有利于心脏射血。
心室兴奋-收缩-压力 > 主动脉压力时,主动 脉瓣打开,心室向主动脉射血 心室压力 < 主动脉压力时,主动脉瓣关闭。
上图绘出了左心房、左心室、右心房、右心室以及主动 脉和肺动脉中压力的变化关系,并且图中表示出了四个瓣 膜的开闭状态
心房、心室舒缩
心房和心室之间, 心室和主动脉之间 压力差
瓣膜启闭和血液 流动的直接动力
压力-容积环所包围的面积—— 表示一个心动周期内左心室所作的输出功。
环核苷酸对心肌细胞bFGF与TGFβ2基因表达的调控初探

等 组 成 .E 床实 践 中绎 过 反 复 验 证 、 断 完 善 并采 用 新 I临 f 不 抟 枢加 I 成 。 临 主 要 用 }治 疗高 脂 血 症 l 脉 粥 样 硬 化 厦动
胜壤病
} 找有 技抗 ^ 的蓟 物
是备受 黄 的课题 代 医学 .班
匈A S的 主要 病 理 腹 I 璺是 噬 l 裎 搁 半滑 肌 细 胞 增 和 迁 胞
结 果 表 明 : 埘 照 组 比较 c l j AMf组 细 胞 代 酣 活 跃 程 度 增 加 . 以 7 h驯 尤 2 l) 】0 ) c MP纰 胞 代 谢 受 抑 制 . , j .( 九 8 h明 显 【 “ P 』 ( , 埘 州 组 比较 . AMP 主 要 分 。 2 i C
用机 理 , 心 脉 神 [服 嬗抗 A 为 1 S的 临 床应 用 提 供 一 定 的 理论 依
据
脉 神 【 服 渣 n i h r o a 1 u , 1 XiMe c, r [ i i XMS l组 力 为旃 S q d ot
I c u搀 ^ 实 骑 提 示 c AMP使 细 胞 内 R A 及 蛋 白 质 台 成 增 加 。 N
B,  ̄ AMP I]l]l 、(Mp组 I ^ 一 氧 化 氨 ( )的 rm(c 3 n[一I c r i ) ; i 加 N(】
供体 硝 普钠 】[ c/ . I[ I 借此 升高心肌 细胞内 c L  ̄ GMP维度 . 并
精 跃 、H l F mRN 厦 其 蛋 [ 和 T 表 述 明 显 增 加 :GMP 】 A L 『 GF c
腿 生 长代谢 活 性 ( ¨ 法 】 F - M “2 h CF T t郎 的 tR u NA 表 述 ( 位 杂 交 技 l j 其蛋 白 表 达水 平 ( 症 细 胞 化学 技 术 ) 原 术 及 免 。
心肌细胞

心肌细胞又称心肌纤维,有横纹,受植物性神经支配,属于有横纹的不随意肌,具有兴奋收缩的能力。
呈短圆柱形,有分支,其细胞核位于细胞中央,一般只有一个。
各心肌纤维分支的末端可相互连接构成肌纤维网。
广义的心肌细胞包括组成窦房结、房内束、房室交界部、房室束(即希斯束)和浦肯野纤维等的特殊分化了的心肌细胞,以及一般的心房肌和心室肌工作细胞。
根据它们的组织学特点、电生理特性以及功能上的区别,粗略地分为两大类型:两类心肌细胞分别实现一定的职能,互相配合,完成心脏的整体活动。
一类是普通的心肌细胞,包括心房肌和心室肌,含有丰富的肌原纤维,执行收缩功能,故又称为工作细胞。
工作细胞不能自动地产生节律性兴奋,即不具有自动节律性;但它具有兴奋性,可以在外来刺激作用下产生兴奋;也具有传导兴奋的能力,但是,与相特殊传导组织作比较,传导性较低。
另一类是一些特殊分化了的心肌细胞,组成心脏的特殊传导系统;其中主要包括P细胞和哺肯野细胞,它们除了具有兴奋性和传导性之外,还具有自动产生节律性兴奋的能力,故称为自律细胞,它们含肌原纤维甚小或完全缺乏,故收缩功能已基本丧失。
还有一种细胞位于特殊传导系统的结区,既不具有收缩功能,也没有自律性。
只保留了很低的传导性,是传导系统中的非自律细胞,特殊传导系统是心脏内发生兴奋和传播兴奋的组织,起着控制心脏节律性活动的作用。
1.心肌细胞为短柱状,一般只有一个细胞核,而骨骼肌纤维是多核细胞。
心肌细胞之间有闰盘结构。
该处细胞膜凹凸相嵌,并特殊分化形成桥粒,彼此紧密连接,但心肌细胞之间并无原生质的连续。
心肌组织过去曾被误认为是合胞体,电子显微镜的研究发现心肌细胞间有明显的隔膜,从而得到纠正。
心肌的闰盘有利于细胞间的兴奋传递。
这一方面由于该处结构对电流的阻抗较低,兴奋波易于通过;另方面又因该处呈间隙连接,内有15~20埃的嗜水小管,可允许钙离子等离子通透转运。
因此,正常的心房肌或心室肌细胞虽然彼此分开,但几乎同时兴奋而作同步收缩,大大提高了心肌收缩的效能,功能上体现了合胞体的特性,故常有“功能合胞体”之称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乳鼠心肌细胞原代培养综述
【摘要】
:目的
乳鼠原代心肌细胞培养在心血管病防治研究领域应用广泛,但
是心肌细胞成活率、
搏动率,
纯化率过低仍是本技术有待解决的关键之处。
本文
探讨原代心肌细胞培养的条件和方法以及一些注意事项做一下总结。
【关键词】乳鼠
心肌细胞原代培养
1.新生大鼠鼠龄的选择
乳鼠心肌细胞随年龄的增长,其增殖分化能力亦有变化,如在新生3d内,具有部分增殖能力,而成年大鼠心肌细胞为终末分化细胞,不具备增殖能力,因此,我们在选择鼠龄时,尽量选择出生时间短的乳鼠,这样的心肌细胞成活率及贴壁率较高,所以选择新生1~3d均可,最好为半日龄的大鼠更为理想。
2.消化酶的选择使用分离组织常用的消化液有胰蛋白、胶原酶和透明质酸,如依地酸二钠(EDTA),其作用是利于组织块分散为单个细胞,利于细胞的贴壁生长。
消化液的浓度、消化能力、消化的时间、温度对组织离散效果影响较大,甚至会损伤细胞,导致培养细胞状态不佳,失去贴壁生长能力,增加心肌细胞死亡率。
其中胰蛋白酶的消化力较强,常用浓度为0·05~0·50%,在37℃、PH8·0条件下作用最强,易造成心肌细胞损坏,因此,有学者认为“单纯应用胰蛋白酶消化对细胞的存活率有极大的负面影响”[1],而TDTA作为一种化学螯合剂,价格低、毒性小,对细胞有一定的离散作用。
所以,选用胰蛋白酶与EDTA联合应用,可降低细胞损害,具有更好的消化分离效果。
另外,胶原酶作用较温和,通过水解细胞间胶原蛋白来实现离散组织的目的,对细胞的损伤较小,也是理想的细胞分离液,针对心肌细胞间含有不同胶原酶类型,可联合使用Ⅰ型胶原酶和
Ⅱ型胶原酶。
且要知道的是在新生大鼠心肌组织,以胶原I为主,故我们选用胶原酶I,文献报道胶原酶的工作浓度一般在0。
61 g·L-1,我们使用的为0。
8 g·L-1。
胶原酶最好现用现配。
3.污染防治
虽然污染本身是不可能完全避免的,但可以降低其发生率、减轻其产生的严重后果。
因此,我们在细胞培养过程中,要坚持无菌操作的原则,如做好实验室、超净台、实验器械及实验用液的消毒灭菌工作,个人要身着消毒衣帽,佩戴口罩及无菌手套,
操作时,酒精灯火焰烧灼消毒器械,避免培养用液长时间暴露在空气环境,禁止吸管接触培养液瓶口等。
防止微生物污染常用的方法是在培养液中加入抗生素,由于抗生素的种类不同,其抗生范围也不尽相同,但多数针对细菌感染为主,常用青霉素和链霉素联合应用。
需要指出的是,抗生素的抗生范围有限,且污染发生具有隐匿性,出现后往往后果严重,所以抗生素仍不能替代无菌操作,而且过度的强调抗生素的作用,会使实验者淡化甚至忽视无菌操作,滥用也会导致产生耐药菌,因此,只有无菌操作才是防止细胞污染的最好手段
除了以上说的无菌操作还应特别注意以下几点:(1)获取心脏时避免剪破消化道,比较稳妥的办法是在剑突上一肋处入剪,这样做不涉及腹腔,也就减少了污染机会。
(2)如条件允许,应避免乳鼠心肌细胞与其他细胞在同一孵箱内共同培养,以防止发生交叉污染。
(3)对于培养心肌细胞的观察、照相每次时间不可过长,否则既会导致培养液pH改变,又能增加污染机率。
4.心肌细胞纯化
在心肌细胞培养中,成纤维细胞具有分裂增殖能力,
且生长迅速,
比心肌细胞更早贴壁,如不加以控制,常可生长为优势细胞。
细胞纯化方法有很多因此,目前,常用化学试剂抑制法和差速贴壁分离法来抑制其生长,而化学试剂势必对培养细胞生长环境有一定影响,因此,依据心肌细胞与成纤维细胞贴壁时间不同的原理做差速分离,
成了广泛采用的纯化方法,其优点是对目的细胞影响小,经比较,结果显示差速贴壁在60min、90min时最为理想
方法简便,纯化率较高,可达到95%以上。
经差速贴壁后仍有少量成纤维细胞混杂于心肌细胞之中,若处理不当,很容易生长成优势细胞。
因此再加上化学试剂抑制,加入分裂抑制剂(如丝裂霉素c)
,有时在培养早期如入溴脱氧脲苷,或加入不利非心肌细胞生长的成分(如谷氨酰胺)。
如溴脱氧尿苷(bromodeoxyuridine, BrdU)可干扰细胞的有丝分裂,故常
规使用BrdU抑制成纤维细胞的生长,但是,如果使用胎牛血清培养细胞,由于胎牛血清所含的促细胞有丝分裂的因子较多,BrdU很难完全抑制成纤维细胞的生长。
改用小牛血清则可克服这种现象的出现,获得高达90%以上的心肌细胞
]。
离心淘洗:通过各种转子速度和淘洗介质流速的选择对心肌细胞进行纯化,如转速度3 200 r/min,泵速设定20-80 mL/min,在80 mL/min时回收心肌细胞。
结果表明:差速贴壁易于实施,对细胞损伤小,但非心肌细胞不能彻底除去,离心淘洗能够得到较为理想的纯化目的,但代价高,梯度离心既便于实施也能较为彻底地除去非心肌细胞。
5.细胞接种密度
分离得到的心肌细胞在接种前,应精细计算细胞数量。
若接种数过大,可致过量心肌细胞无法贴壁生长而漂浮,过快耗尽培养液营养成分,影响正常贴壁细胞的生长及观察;若接种数过少,细胞间隙过大,难以进行细胞间信号通讯,不利于心肌细胞生长、产生一致性搏动。
同时,不同实验目的对接种细胞数有不同的要求,如用于基因及蛋白表达检测时,细胞接种数可在5~6 105/m,l用于心肌细胞形态观察时,细胞接种数可在1~2 105/ml[3]。
6.换液时间进行心肌细胞形态学观测时。
接种密度较低,贴壁的心肌细胞数量减少。
为避免成活心肌细胞随换液而被丢弃,应在接种48 h后换液。
这样不仅使贴壁的心肌细胞数量明显增加。
而且BrdU作用时间较长。
对成纤维细胞的抑制作用更确实。
此外,去血清后可用ITS和0。
1 g·L-1BSA对心肌细胞进行营养支持,对心肌细胞贴壁率与凋亡率均不产生明显影响。
之后换不加BRDU的培养液,每两天换一次。
7.培养液PH值控制注意
适宜的pH范围在7。
2—7。
4之间,配制及使养液时应注意:(1) pH值会在过滤后上升0。
1 0。
3。
(2)培养液中加入血清后pH值会有降低,降低程度与血清品质和含量有关。
(3)应及时换液。
(4)配制好的培养液不宜长时间贮存在4℃。
这是因为培养液中的CO2会溢出,使培养液pH上升。
每次配好的培养液尽量在2 wk内用完,否则应部分置于-20℃保存,使用前应补充谷氨酰胺和NaHCO3,再次过滤后方可使用。
8.培养心肌细胞存活的形态标志
倒置显微镜下观察刚分离的心肌细胞呈球形; 4h后开始贴壁生长; 19~24h时完全贴壁,细胞呈球形和梭形,以梭形为主,偶见单个细胞搏动。
心脏中有多种细胞,但能够产生自发搏动的只有心肌细胞。
48h后心肌细胞伸出伪足,且部分细胞间形成交联,这是心肌细胞存活的形态标志。
细胞核大且胞浆丰富,立体感明显,折光性强。
单个的细胞搏动频率较低,细胞交联后搏动的频率明显增加。
9.应用与讨论心肌细胞培养已成为心血管研究的基本方法和手段之一,在医学领域有着广阔的应用前景体外培养心肌细胞,可建立多种心肌细胞病理模型,
优点是: 1.可观测药物对心肌组织中细胞的直接作用。
2.通过染色等方法可直接观察到各种药物对活细胞影响的动态过程。
3.方法简便,可提高效率。
缺点是: 1.失去了整体调节、内环境及正常细胞比例和相互影响。
2.影响因素多,实验操作要求严格。
