试论微生物蛋白酶
微生物金属蛋白酶

微生物金属蛋白酶(Microbial Metalloproteases)是一类由微生物(包括细菌、真菌、古菌等)产生的含金属离子作为辅因子的蛋白酶。
这类酶在催化反应中,金属离子(如锌、铁、铜等)在活性中心发挥关键作用,参与底物的识别、结合以及催化水解过程。
微生物金属蛋白酶在自然界中广泛存在,它们在生物降解、营养吸收、免疫反应、信号传导等多种生物过程中发挥重要作用,同时也与多种人类疾病的发生和发展密切相关。
微生物金属蛋白酶的种类繁多,包括但不限于金属内肽酶(Metalloendopeptidases)、金属羧肽酶(Metalloexopeptidases)、金属丝氨酸蛋白酶
(Metallo-serine proteases)等。
它们能够降解多种生物大分子,如蛋白质、多肽、脂质等,有些还能降解环境中的有机污染物。
在工业应用上,微生物金属蛋白酶由于其独特高效的催化性能,被广泛应用于生物医药、洗涤剂、皮革处理、纺织品处理、饲料添加剂、环境保护等诸多领域。
同时,某些微生物金属蛋白酶也可能作为病原体的毒力因子,如肺炎克雷伯菌的金属蛋白酶可以协助细菌侵袭宿主细胞,因此也成为抗菌药物研发的靶点之一。
微生物学类实验指导书(下)蛋白酶产生菌活力测定及果酒酵母分离纯化

实验一产酶微生物的分离、纯化与选育酶是生物体内进行生物化学反应的催化剂,在生物体中已发现的酶有2500多种。
由于酶促反应的特异性强,反应条件温和,安全无毒,环境污染少,在洗涤剂、皮革、纺织、造纸、诊断、制药等领域具有广泛的应用价值。
目前,能由工业生产的50多种酶制剂包括蛋白酶、淀粉酶、脂肪酶、果胶酶、纤维素酶、葡萄糖氧化酶,葡萄糖异构酶等,这些酶大部分是由霉菌、细菌、链霉菌和酵母菌产生的.通过本实验项目,使学生学会从自然界中分离产酶微生物的方法,菌种的纯化技术及其高产菌的选育技术。
2。
蛋白酶产生菌的分离与纯化2。
1 实验目的学习从自然界中分离蛋白酶产生菌并纯化.2。
2 实验原理许多细菌和霉菌产生蛋白酶,细菌中的芽孢杆菌是常见的蛋白酶产生菌.本实验将土壤样品(或其他样品)悬液加热处理,杀死非芽孢细菌及其他微生物后进行划线分离得到芽孢杆菌,将其接种到酪蛋白平板进行培养,根据酪蛋白平板的水解圈作初筛.也可直接将细菌或霉菌接种到酪蛋白平板进行培养,分离筛选其他蛋白酶产生菌。
2.3 实验仪器与材料土壤样品或其他富含蛋白质的样品、牛肉膏蛋白胨培养基平板、酪蛋白平板、无菌水(带玻璃珠)、芽孢染色液;显微镜、恒温水浴锅、酒精灯、接种针、游标卡尺、无菌移液管、无菌试管、量筒等。
2。
4 实验方法与步骤2。
4.1 分离1)采集土壤样品,用无菌水制备1:10土壤悬液;2)取1:10土壤悬液5ml,注入已灭过菌的试管中,将此试管放入75—80 ℃水浴中热处理10 min,以杀死非芽孢细菌;3)取加热处理过的土壤悬液100-200 μL,涂布接种到牛肉膏蛋白胨培养基平板,将平板倒置,于30-32 ℃培养24-48 h;4)对长出的单菌落进行编号,选择表面干燥、粗糙、不透明的菌落,挑取少许菌苔涂片,做芽孢染色,判断是否为芽孢杆菌。
2。
4。
2 筛选1)从判定为芽孢杆菌的菌落处,分别挑取少许菌苔,先接种含酪蛋白的斜面培养基,再点接于含酪蛋白的平板,30-32 ℃培养24—48 h,测定平板上菌苔直径和水解圈直径.2)水解圈直径与菌落直径比值大的那个菌株对应的斜面培养物,可作为进行诱变选育或酶发酵、酶活力测定菌株。
一株海洋微生物产蛋白酶抗肿瘤活性的初步探讨

su id t de .EM T6c l r ut rd i r sn eo r ta ea ifrn o c n rt n ( . ~ 2 0 0 mg I)g a in s el weec l e n p ee c fp oe s tdfee tc n e ta i s u o O 2 0 /. r de t
t e t o e r in a d tm e T h e ts ewe h t p o e s 72 ha nt t m o c iiy i o e d gr e we n he c nc ntato n i . e t s h d ta r ta e1 da i u ) r a , 02 0 gL的 D MT 作 经 .~2 0m / 0 2 蛋国酶作用笨 时间, 同 MT 对体外培养靶细胞进 行 采用 T
细胞增殖抑制率检测, 并与阳性对照组( 紫杉醇组) 和正常细胞对照组( 人胚肺细胞组≥ }较 MT : T@测结果显蒂
Ab ta t s r c :T h_a ’ um or c iiy of ta n e nt i t a tvt s r i pr e s D2 r ota e fom dge tve t a tof i s i r c Pe ne e sai u tnss ri r i b hie i Gr e ub wa s
微生物产蛋白酶的作用

微生物产蛋白酶的作用蛋白酶是一类能够水解蛋白质的酶。
它们在许多生物过程中起着关键作用,包括消化、免疫、代谢调节和细胞信号传导等。
微生物是一类能够产生大量蛋白酶的生物体,它们具有多样的蛋白酶类型和功能。
本文将重点探讨微生物产蛋白酶的作用。
微生物产蛋白酶在消化过程中发挥着重要作用。
大多数微生物生活在环境中,需要通过分泌蛋白酶来将周围的蛋白质降解为小分子,以供其自身生长和繁殖所需。
这些蛋白酶能够水解食物中的蛋白质,将其分解为氨基酸等小分子,以便微生物吸收和利用。
此外,微生物产蛋白酶还能够分解寄生在宿主体内的蛋白质,从而帮助微生物获取营养。
微生物产蛋白酶在免疫系统中发挥着重要作用。
免疫系统能够识别和清除入侵的病原体,其中一个重要的机制就是通过蛋白酶的活性来消灭这些病原体。
微生物产生的蛋白酶能够分解病原体表面的蛋白质,破坏其结构和功能,从而使其失去活性并被免疫系统清除。
此外,微生物产蛋白酶还能够与免疫系统的其他成分相互作用,调节免疫反应的强度和方向。
微生物产蛋白酶在代谢调节中也起着重要作用。
微生物在特定环境中会产生不同类型的蛋白酶,以适应外界环境的变化。
例如,一些微生物能够在低温环境下产生低温蛋白酶,以增加其在低温条件下的代谢能力。
另外,微生物产蛋白酶还参与细胞内许多代谢途径的调节,包括葡萄糖代谢、脂肪酸代谢和氨基酸代谢等。
这些蛋白酶能够调控代谢途径的速率和方向,使微生物更加适应不同的代谢需求。
微生物产蛋白酶在细胞信号传导中也发挥着重要作用。
细胞信号传导是细胞内外信息的传递和转导过程,它涉及到许多蛋白质分子的互相作用和修饰。
微生物产生的蛋白酶能够参与细胞信号传导途径中的蛋白质降解和活性调节,从而影响细胞信号的传递效果。
这些蛋白酶能够剪切、降解和修饰其他蛋白质分子,改变其结构和功能,进而影响细胞内信号的传递和细胞行为。
微生物产蛋白酶在消化、免疫、代谢调节和细胞信号传导等生物过程中起着重要作用。
它们能够水解蛋白质,为微生物提供营养和能量,同时也能与其他生物分子相互作用,调节生物过程的进行。
微生物金属蛋白酶的研究进展

大 多 数 金 属 蛋 白 酶 是 含 z 的 蛋 白 , 是 很 ’ z
多 与新 陈代谢 密切相关 的蛋 白的整合组 分 。对许 多 含 zI 蛋 白的 x 射 线 晶体 学 分 析 已经确 定 了催 化 r . 性 z 和 结构性 z 的特 征” : 所 有 已知 晶体 结 在 构的 z 2 中 , n 酶 催化 性 zI 与三个 氨蓉 酸残 基 和 一 r 个 活性水 分子配 对 , 而结 构 性 z 则 与 四个 母s 残 基 配对 。 Hs Gu A p或 C s残 基 的 组 合组 成 一 i, l. s y 个 三齿形 的活性 位点 , 加 上一 个 活性 水 分 子 再
金属蛋 白酶 种类 多 、 分布 广 。基 质 金属 蛋 白酶
家族广 泛存 在于机 体 中 。蝮 蛇科和蝰 蛇科 毒 蛇蛇毒
中的出血毒 紊也 是 金 属 蛋 白酶 , 目前 已发 现 l0多 l 种 蛇 毒金属 蛋 白酶 , 们 大 多数 都 是 含锌 金 属 蛋 白 它
酶 。对 它们 的研究将 为抬 疗蛇 伤药 物的筛 选 提供 理论依 据 。 同时 . 属 蛋 白酶 在 微 生物 类 群 中也 】 金
摘要
金属 蛋 白酶 分布广泛 , 性质 特异 。对意 艾。本 文
着重综 述 了金 属蛋 白酶 的特 点和 分布 , 生 物金属 蛋 白酶 的结 构 、 源、 质 厦其 应 用 等方 面的研 微 来 性
蛋白酶酶活测定方法

蛋白酶酶活测定方法一、实验原理:一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及脂类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸(TCA)溶液的肽的数量与酶的数量和反应时间成正比。
在280nm波长下测定溶液吸光度的增加,计算酶的活力。
一分钟内1mg牛血清蛋白(BSA)相当的非蛋白性Lowry试液显色物质的增量值定义为一个蛋白酶活性单位(IU)。
二、试剂配制:A溶液:含2%KCl,1%TrltonX-100的50mM磷酸盐缓冲溶液(pH 6.0)试样TG酶溶液:直接取发酵样12000rpm离心5min,取上清测定。
底物溶液:精确称取底物二甲基酪蛋白0.250g,加入50mM PB缓冲溶液(pH 6.0)10mL,常温搅拌30min使其溶解后备用。
三、操作步骤:1. 试样1)将底物溶液放入37℃恒温水浴中预热备用2)试管中加入试样TG酶溶液0.2mL后放入恒温水浴中,10min后加入已预热的底物溶液1mL,立即振荡混合,于37℃反应60min3)反应结束后,加入12% TCA溶液1mL,再于37℃反应30min,使反应终止4)20℃,3000rpm,20min离心后取上清备用。
2.空白1)试管中加入已预热底物溶液1mL,再加入12% TCA溶液1mL,振荡混合后,于37℃反应60min2)加入试样TG酶溶液0.2mL,振荡混合后,于37℃反应30min3)20℃,3000rpm,20min离心后取上清备用。
四、Lowry法显色反应试管中分别加入试样清液和空白清液各0.2mL,加入A溶液1mL,振荡混合后室温下放置10min,然后加入试剂B 0.1mL,振荡混合后,于37℃反,空白的吸应30min。
微生物实验设计-产蛋白酶菌株的筛选

微生物实验设计-产蛋白酶菌株的筛选产蛋白酶菌株的筛选级分离一、实验原理自能够产生胞外蛋白酶的菌株在牛奶平板上生长后,其菌落周围可形成明显的蛋白水解圈,水解圈与菌落直径的比值,常被作为判断该菌株蛋白酶产生能力的初筛依据。
将腐烂的大豆浸泡液中的细菌接种在含有酪素的培养基上进行培养。
由于产蛋白酶菌株能在干酪素的培养基上形成无色透明圈,因此能将产蛋白菌株分离出来,分离出来的菌株经再次培养,就可获得纯种产蛋白酶的菌株。
二、实验器材1.菌种:从大豆浸泡液中获得2.培养基:(1)PDA斜面培养基:马铃薯200g,蔗糖20g,琼脂20g,水1000ml.马铃薯去皮,切成块,煮沸半小时后用纱布过滤,再加糖及琼脂,溶化后补水至1000ml,121℃灭菌30min备用。
(2)干酪素琼脂培养基:干酪素4.0g,用20ml 0.1mol/L NaOH溶液溶解后再加20g琼脂,加蒸馏水煮沸加水至1000ml 121℃灭菌30min备用。
3.试剂:无菌水。
4.仪器:天平,电磁炉,烧杯,无菌试管,无菌培养皿,高压灭菌锅,锥形瓶,接种环,涂布棒,酒精灯,恒温培养箱。
三、实验步骤1.将腐烂的大豆放入无菌水中浸泡,制成细菌悬浮液。
2.用涂布棒蘸取菌液接种于PAD培养基中,26℃培养48h。
3.倒置于酪素琼脂培养基平板上,37℃培养24h。
4.挑取培养好的菌落接种于平板上,28℃培养48h。
5.观察各菌落周围形成的透明圈的情况。
6.选取透明圈较大的三个菌落分别接种在干酪素琼脂培养基上,28℃培养48h。
7.观察受否为单菌落,若为单菌落且有透明圈,则为纯种产蛋白酶菌株。
若有杂菌,则需要重复步骤6,直到培养出纯菌为止。
参考文献[1]代玉梅.蛋白酶高产菌株的筛选鉴定及酶学性质研究[D].青岛:青岛大学,2008.[2]黄志强,林白雪,谢联辉.产碱性蛋白酶海洋细菌的筛选与鉴定[J].福建农林大学学报:自然科学版,2006,35(4):416-420.。
蛋白酶活性的测定

实验四蛋白酶活力的测定一、实验目的1、了解蛋白酶活力测定的原理;2、掌握蛋白酶活力测定的方法。
二、实验原理蛋白酶在一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及酯类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
在280nm波长下测定溶液吸光度的增加,就可计算酶的活力。
三、实验试剂①微生物蛋白酶萃取液(0.01g/ml):称取1.0g酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;② 0.02mol/L磷酸盐缓冲液(pH7.5);③ 1%酪蛋白溶液:取1.0g酪蛋白,加100ml 0.2mol/L磷酸盐缓冲液(PH7.5),加热并搅拌使它完全分散,然后置于冰箱中保存;④ 5%三氯醋酸(TCA)溶液。
四、实验步骤1、将5%TCA溶液和1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1、A0、B1和B0。
在A1和A0试管中各吸入0.20ml酶液,在B1和B0试管中各吸入0.40ml酶液,分别用0.2mol/L 磷酸盐缓冲液定容至2.00ml。
在A0和B0试管中各吸入6.00ml5%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温。
3、在各试管中吸入2.00ml 1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1和B1试管中吸入6.00ml5%三氯醋酸溶液。
4、将试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0和B0滤液为空白,测定A1和B1滤液的吸光度。
16种微生物蛋白酶的生物信息学分析

16种微生物蛋白酶的生物信息学分析作者:富玉竹李欣李晔王斯德金丽华于然来源:《江苏农业科学》2020年第04期摘要:蛋白酶(protease)是以降解蛋白质为主的糖苷酶,具有丰富的多样性,在生物有机体中发挥着重要而又广泛的作用,具有广泛的研究和应用价值。
本研究采用ProtParam、ProtScale、SignalP 4.1 server和NPSA serve等生物信息学软件,对天蓝色链霉菌、普通拟杆菌、金黄色葡萄球菌、枯草杆菌等16种微生物蛋白酶的理化性质、蛋白结构、系统发生树和功能域等进行了分析。
结果表明:通过分析16种微生物蛋白酶的稳定性发现,金黄色葡萄球菌、唾液链球菌、短小芽孢杆菌、绿脓杆菌为不稳定蛋白;二级结构由α螺旋、β转角、无规则卷曲和延伸链等结构元件组成;除了节杆菌属、无乳链霉菌、普通拟杆菌、肠杆菌属具有信号肽,其余蛋白酶氨基酸序列不具有信号肽的特点。
可以推测出蛋白酶为非分泌性蛋白;只有绿脓杆菌和猪链球菌有跨膜结构,剩下其余几种微生物均没有跨膜结构。
具有2个蛋白功能域,分别为Peptidase S8 familyi、Fn3_5like domain。
关键词:微生物;蛋白酶;序列分析;生物信息学;理化性质;蛋白结构;信号肽中图分类号: S188+.3文献标志码: A文章编号:1002-1302(2020)04-0065-08基金项目:北京市自然科学基金(编号:2182019);北京市教育委员会项目(编号:1-PXM2018-014306-000057/7);国家自然科学基金青年科学基金(编号:51708005);北京电子科技职业学院重点课题(编号:2019-KXZ);北京市优秀人才资助(拔尖自然科学)(编号:2020Z002-002-KWT)。
作者简介:富玉竹(2000—),女,北京人,研究方向为酶与基因重组,E-mail:1002967685@;共同第一作者:李欣(1998—),女,北京人,研究方向为生物技术,E-mail:1217436404@。
微生物实验设计-产蛋白酶菌株的筛选

产蛋白酶菌株的筛选级分离一、实验原理自能够产生胞外蛋白酶的菌株在牛奶平板上生长后,其菌落周围可形成明显的蛋白水解圈,水解圈与菌落直径的比值,常被作为判断该菌株蛋白酶产生能力的初筛依据。
将腐烂的大豆浸泡液中的细菌接种在含有酪素的培养基上进行培养。
由于产蛋白酶菌株能在干酪素的培养基上形成无色透明圈,因此能将产蛋白菌株分离出来,分离出来的菌株经再次培养,就可获得纯种产蛋白酶的菌株。
二、实验器材1.菌种:从大豆浸泡液中获得2.培养基:(1)PDA斜面培养基:马铃薯200g,蔗糖20g,琼脂20g,水1000ml.马铃薯去皮,切成块,煮沸半小时后用纱布过滤,再加糖及琼脂,溶化后补水至1000ml,121℃灭菌30min备用。
(2)干酪素琼脂培养基:干酪素4.0g,用20ml 0.1mol/L NaOH溶液溶解后再加20g琼脂,加蒸馏水煮沸加水至1000ml 121℃灭菌30min备用。
3.试剂:无菌水。
4.仪器:天平,电磁炉,烧杯,无菌试管,无菌培养皿,高压灭菌锅,锥形瓶,接种环,涂布棒,酒精灯,恒温培养箱。
三、实验步骤1.将腐烂的大豆放入无菌水中浸泡,制成细菌悬浮液。
2.用涂布棒蘸取菌液接种于PAD培养基中,26℃培养48h。
3.倒置于酪素琼脂培养基平板上,37℃培养24h。
4.挑取培养好的菌落接种于平板上,28℃培养48h。
5.观察各菌落周围形成的透明圈的情况。
6.选取透明圈较大的三个菌落分别接种在干酪素琼脂培养基上,28℃培养48h。
7.观察受否为单菌落,若为单菌落且有透明圈,则为纯种产蛋白酶菌株。
若有杂菌,则需要重复步骤6,直到培养出纯菌为止。
参考文献[1]代玉梅.蛋白酶高产菌株的筛选鉴定及酶学性质研究[D].青岛:青岛大学,2008.[2]黄志强,林白雪,谢联辉.产碱性蛋白酶海洋细菌的筛选与鉴定[J].福建农林大学学报:自然科学版,2006,35(4):416-420.。
微生物产弹性蛋白酶制取方法的探讨

弹性 蛋 白质为 特征 的水解酶 ,此 酶属于 丝 氨 酸蛋 白 K2 O4 ( HP 上海 恒信 化学 试 剂有 限公 司 ) AE- IDE 酶 ,可 由动物 胰脏提 取 或 由微 生 物发酵 制得 。 从胰 S p a e 2 ,S p a e 7 ( h r ca e h d xA-5 e h d xG一5 P ama i 公司 ) 。
. 脏提 取 的弹性 蛋 白酶价格 较高 ,因此 ,采 用微 生物 1 3 仪 器
ea t s - r d c n tan o c lu u tlswa n c l td i t e me t to d um d c li a e otr l sa e p o u i g sr i fBa il ss b ii si o u a e n o f r n a n me i i n a u tv td ona r a y
me o s fN ) O f cin t n aine c a g ho tga h n A — eh d xA一5a dg l la o t d ( H4, ,r t a o , no xh e rma rp yo h o S a o i n c o DE E S p ae 2 e ft t n n ri i
Ap o c nPr p r tv pr a ho e a a i eM e ho f a t s r o u e b t do El sa eP d c d yM ir o g nim co r a s
F NG hn —n , a jn, H a A S a gl g HUJ -u Z U N i i n ( ol eo ie gn e ig Hu e nv ri eh oo y Wu a 3 0 8, hn ) C l g Bo n ier , b i i st o T cn lg , h n4 0 6 C ia e f n U e yf Ab tat s c :Obet eT v sg t te rprt em to f l ts rd cdb co raim. to sA r jci oi et ae h e aa v eh do a ae o u e ymirog ns Me d v n i p i es p h
微生物源碱性蛋白酶研究进展

目前 , 碱性 蛋 白酶 主 要 产生 菌种 有 芽 孢 杆 菌 属
1 微 生 物碱 性 蛋 白酶 研 究 现 状
1 1 碱性 蛋 白酶 主要产 生 菌种 .
2 0 U m , 1 0/l 0 相对原始菌株 20 79酶活提高了 10 7 %。 冯清 平等 也从土 样 中筛选 到一株 产 碱性 蛋 白酶 的嗜 碱性地衣芽孢杆菌 5 一 对其原生质体进行复合 3 A, 诱变处理 , 从中选育 出了耐高温、 耐碱的碱性蛋 白酶 高产株。在生物技术领域 中, 碱性 蛋 白酶可作 为工 类) 去除 , 因为蛋白酶作用条件温和, D A的完整 对 N
生产 菌 20 79进行 诱 变 育 种 , 得 变 异 株 C , 产 获 伽 酶
现状、 高产菌株 的选育新途径 、 因结构与功能 , 基 并 对碱性 蛋 白酶 在今后 的发展 进 行 了展 望 。
量提高 了 4 %。郑铁 曾等对如何 提高 c 碱性蛋 0 ,
白酶活力 进 行 了研 究 , 过 优 化 设 计 , 活力 达 到 通 酶
植 物 源蛋 白酶 相 比具 有 下游 技 术 处 理 相 对 简 单 、 价
பைடு நூலகம்
目前我 国在 洗涤 行业 中添加 碱性 蛋 白酶 已有初
格低廉 、 来源广、 菌体易于培养 、 产量高 、 高产菌株选 育简单 、 速 、 有 动植 物 蛋 白酶 所 具 有 的全 部 特 快 具
性, 且相 对 中性 蛋 白酶 具有 更 强 的水 解 能 力 和 耐 碱 能力 , 有较 大 耐 热性且 有一定 的酯 酶 活 力 , 于实 现 易 工业 化生 产 。 因此 , 性 蛋 白酶研 究 成 为 蛋 白酶 研 碱 究 的热点 J 。本 文综 述 了碱性 蛋 白酶 国 内外 研究
微生物实验设计-产蛋白酶菌株的筛选

微生物实验设计-产蛋白酶菌株的筛选背景蛋白酶是一种具有很广泛的应用价值的酶类。
由于其在消化道营养吸收、生物反应器中的转化作用等方面均有重要的作用,因此蛋白酶的产生与筛选已成为当今生物技术领域中的研究热点之一。
尤其是在食品加工、污水处理、纤维素生物降解等领域,蛋白酶都有着非常广泛的应用前景。
因此,本实验拟通过对产蛋白酶的菌株进行筛选,找到高产蛋白酶的优良菌株。
材料与方法菌株的采集菌株采集方法:在集中饮水供应点,选择自然生长的水上植物为采样点,如睡莲、菖蒲、兰草等,具体点位由实验组决定。
采用无菌削皮刀在水上植物上擦拭,将擦拭物用无菌三角板置于室温营养物培养基上慢慢离心直至血清澄清。
取尽可能大的好的菌落转入入液氮甘油管中,经深冷保存。
后选取筛选菌落接种于琼脂板上。
菌株的鉴定先用生化方法进行初步鉴定,包括观察菌落形态、氧化酶试验和嗜酸性染色,确定分离菌株的生物学特性。
然后利用API系统和Biolog系统对鉴定的菌株进行进一步的鉴定,最终确定其菌种身份。
菌株的扩增将选出的菌株接种到含有碳源和氮源的液体培养基中进行预培养。
在预培养的基础上,将菌株接种到不同浓度的含有特定碳源和氮源的液体培养基中进行再培养,测定培养基中蛋白酶活性及菌株生长情况。
选择生长良好、活性高的优良菌株进行扩大培养。
菌株蛋白酶活性的检测制备含有特定底物的琼脂板进行蛋白酶活性的检测,通过观察菌落周围的荧光带,判断菌株产生的蛋白酶活性。
结果与分析通过菌株采集、鉴定、扩增和蛋白酶活性的检测,找到了多个高产蛋白酶的优良菌株。
本实验通过对菌株的筛选,找到了高产蛋白酶的优良菌株,为蛋白酶的产生与研究提供了重要的参考。
蛋白酶的生产和应用
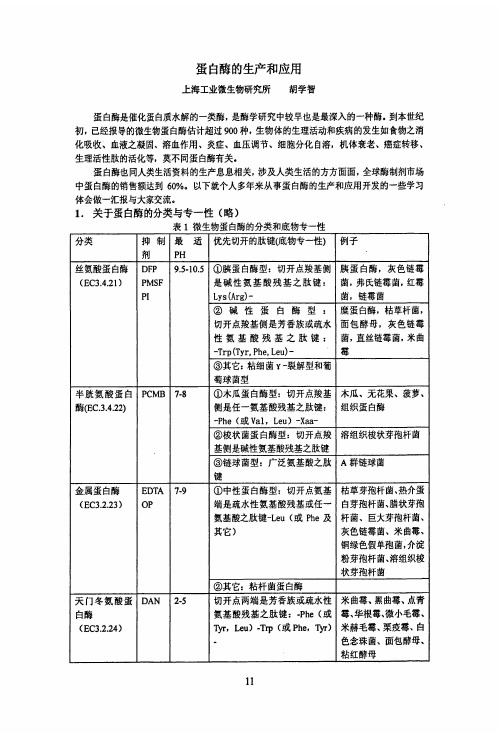
注:PFP.二异丙基磷酰氟 甲基磺酰氟 Ph 马铃薯蛋白酶抑制剂 EDTA:乙二胺四乙酸
PCMB:对氯汞苯甲酸 PMSF."苯 DAN:重氮乙酰正.DL.亮氨酸甲酯 OP:郯二氮杂菲)(菲绕啉)
2.关于微生物蛋白酶的生产
蛋白酶是用途最广泛的酶制剂之一,主要用于洗涤剂,制革、毛皮、蛋白水解物、酿酒、 酱油,以及纺织、医药品、化妆品等的生产上。全球蛋白酶的销售额占酶制剂市场的60%, 我国2005 年全国(外资合资企业不计)微生物酶制剂产量约48 万吨,总销售额约20 亿 人 民币,其中蛋白酶约10 万吨,销售额近9 亿人民币。
食品、饲料加工
蛋白质水解、脱苦、调味液
食品饲料加工
动植物蛋白水解、面包、发酵食品
面包制造
。·
动植物蛋白水解、调味液
弱碱性蛋白酶、调味液
水解蛋白质
Actinase(科研医药)
灰色链霉菌
试剂、食品加工、医药
13
Pantiase NP-2(Yokult)
酸性蛋白酶: SumizymeAP(新日本) Sumizyme RP(新日本) Molsin(Seishin 制药) Neulase F(天野)
奶酪制造
3.蛋白酶的利用 蛋白酶的用途非常广泛(表3),最大的用户是洗涤剂,其次用于饲料、食品工业、酿
酒酿造,以及制革工业和医药。
用途
说明
表3 蛋白酶的用途
干酪制造
凝固酪蛋白,缩短成熟时间 酱油酿造
预处理大豆,提高蛋白质利用率 天然调
味液制造
水解蛋白质,增强风昧,制HVP、HAP
酒精,酿酒
水解蛋白质,促进酵母发酵
啤酒澄清 酿醋
分解啤酒单宁蛋白沉淀,延长保质期 缩短酿醋周期,增加食醋得率
一种利用真菌微生物发酵生产蛋白酶k的生产工艺

一种利用真菌微生物发酵生产蛋白酶k的生
产工艺
蛋白酶K是一种广泛应用于医药、食品、化妆品等领域的重要酶类,其生产工艺也越来越受到关注。
近年来,利用真菌微生物发酵生产蛋白酶K的工艺备受青睐,下面就来介绍一下其具体生产工艺。
首先,选用高效产酶菌株。
真菌微生物发酵生产蛋白酶K的关键是选用高效产酶菌株。
目前做得较好的产酶菌株包括曲霉、木霉、产曲霉等。
其次,确定合适的发酵条件。
合理的发酵条件有利于提高蛋白酶K 的生产效率和纯度。
通常采用液态发酵,发酵条件包括温度、pH值、转速、空气流量等,最优发酵条件需根据具体情况确定。
再次,加入适量的培养基。
培养基是微生物发酵生产过程中的营养基础,合适的培养基配方可以提高蛋白酶K的产量和纯度。
培养基的成分包括碳源、氮源、矿物质和微量元素等,其中以大豆粉、麦芽粉和葡萄糖等为碳源,以酵母粉和蛋白质为氮源,再添加一些有机和无机盐类为矿物质和微量元素,能够获得较好的生产效果。
最后,进行后处理。
真菌微生物发酵生产蛋白酶K后,需要进行后处理以提高其纯度。
后处理主要包括离心、超滤、扩散等操作步骤,其目的是去除蛋白酶K中的杂质和不纯物质,同时保留其酶活性,以便应用到不同领域。
总之,利用真菌微生物发酵生产蛋白酶K的生产工艺在实践中已经被证明是一种成功的方法,具有重要的应用价值。
在生产过程中需要遵循合理的选菌、合理的发酵条件、合适的培养基配方和有效的后处理方法,才能取得最佳的生产效果,同时也必须注意工艺安全和环保等问题。
相信随着技术的不断进步和研发的深入,真菌微生物发酵生产蛋白酶K的工艺会更加完善,为各个领域的发展带来更多的机遇。
微生物源碱性蛋白酶研究进展

目前 , 碱性蛋 白酶主要产生菌种有芽孢杆 菌属 细菌 【” II u 和
链霉菌( 如灰色链霉菌 、 氏链霉菌 等) 费 以及酵母l。我国用于 1 2 1
工业化生产 的蛋 白酶菌种 主要有 : 地衣芽孢杆菌 2 0 、 79 地衣芽 孢杆菌 C 以及短小芽孢杆菌 2 9和 29等 。 , 8 0
每年总销售量 的 6 %左 右用 途 。由于微 生物蛋 白酶均 为胞 外
酶 , 动、 与 植物源蛋 白酶相 比具有 下游技术处理相对 简单 、 价 格低 廉 、 来源广 、 菌体易于培养 、 产量高 、 高产菌株选育 简单 、
维普资讯
第 3 卷 第3 4 期
20 0 7 年 5 月
酿
酒
Vo . 4 № . 1 . 3 3 Ma , 2 0 y 07
NG LQ OR MAKI IU
文 章 编 号 :0 2 8 (0 7 0 — 0 0 0 10 — 10 2 0 )3 05 — 3 1
微生物源碱性 蛋 白酶研究进展
包 巨南 , 兰立新 , 肖怀秋
( 湖南化工职业技术学院, 株洲 4 2 0 ) 10 4
摘 要 : 过 查 阅 国 内外 大量 文 献 资料 、 析 , 微 生物 碱 性 蛋 白酶 国 内 外 应 用 研 究现 状 、 产 菌株 的 选 育 方 通 分 从 高
发现该 酶在 6  ̄ 0E处理 了 3 0 n酶仍 保持 10 5 mi 0 %活 力。R i a a
N o ai a b a m n等人嗍对耐有机溶剂的碱性蛋 白 or l aRj A dR h a Z h a 酶进行 了酶学性质研究 , 利用硫酸铵盐析及层析方法纯化酶 , 酶活力提高 了近 14 , 2 倍 分子量约为 5 , 0D 。 1 0 a 当前 , 0 极端碱 性蛋 白酶和高活力碱性 蛋白酶工程菌构建成 为国外碱性蛋 白
微生物发酵生产蛋白酶

妥善保存,才能保证其产酶特性不异、不死亡、
不被杂菌污染。
❖ 2)菌种活化:产酶菌种在使用钱必须接种于斜
面培养基上,在一定条件下,进行培养,以恢复
细胞的生命活动能力。
❖ 3)扩大培养:活化了的菌种,一般还要经一级 至数级的扩大培养。
❖ 4)分离纯化:发酵结束后得到的酶可能含有一些杂
微生物发酵生产 蛋白酶
一、蛋白酶
❖ 定义:催化蛋白质中肽键水解的酶。根据酶 的活性中心起催化作用的基团属性,可分为: 丝氨酸/苏氨酸蛋白酶(编号:EC 3.4.21.-/EC 3.4.25.-)、巯基蛋白酶(编号:EC 3.4.22.-).、金 属蛋白酶(编号:EC 3.4.24.-)和天冬氨酸蛋白酶 (编号 :EC 3.4.23.-)等。
❖ 1、从菌种保存机构和有关研究部门获得 ❖ 2、通过筛选获得
五、培养基的配制
❖ 枯草杆菌ASL.398中性蛋白酶发酵培养基:
❖ 玉米粉8%,豆饼粉4%,麸皮3.2%,米 糠1%,磷酸氢二钠0.4%,磷酸二氢钠 0.03%.
六、发酵工艺流程
保藏菌种 菌种活化 种子扩大培养
发酵 分离纯化
酶
七、剖析:
❖ 蛋白酶广泛存在于动物内脏、植物茎叶、果 实和微生物中。微生物蛋白酶,主要由霉菌、 细菌,其次由酵母、放线菌生产。
二、酶发酵的方式
❖ 1、固体培养发酵 ❖ 2、液体深层发酵 ❖ 3、固定化细胞或固定化原生质体发酵
三、各种发酵方式发酵模式:
❖1、固定培养发酵:
❖ 以麸皮、米糠等为培养基的主要原料,加入 其它必需的营养成分而制成的固体或半固体 的麦曲,经灭菌、冷却后,接入产酶菌株, 在一定条件下,发酵产酶。
蛋白酶综述——精选推荐

蛋白质酶的研究和应用近况yangyaxuan西南大学动物科学系食品科学与工程2班摘要: 蛋白质酶来源很丰富,应用十分广泛,是重要的工业酶。
本文论述了早期蛋白酶的研究范围,如蛋白酶的主要作用,还有作用机制,蛋白酶的来源,以及蛋白酶的提取。
还有蛋白酶的商业化研究以及在商业方面的应用。
在食品加工中的应用,包括植物蛋白酶、动物蛋白酶以及在医药方面临床诊断中的应用和蛋白酶的研究近况和对蛋白酶的应用展望。
关键词:蛋白酶作用机制植物蛋白酶动物蛋白酶研究近况应用展望蛋白酶分子较小,来源丰富,功能比较简单,因此对蛋白酶的研究比较深入。
蛋白酶的种类有很多,广泛存在于动物内脏、植物茎叶、果实和微生物中。
微生物来源的蛋白酶是商品化酶的主体。
由于从动植物中获得蛋白酶资源有限,因此,蛋白酶的主要来源是从微生物中获得,这样就节省了成本。
早期对蛋白酶的研究包括对它的化学结构、高级结构以及它的动力学、作用机制等的研究。
蛋白酶的作用主要包括:(1)消除错误折叠、修饰及定位的蛋白(2)为合成新的蛋白质提供氨基酸;(3)通过限制性切割促使酶原成熟;(4)降低关键酶和调节蛋白含量以此控制新陈代谢平衡;(5)切除已定位蛋白的定位信号[4]。
蛋白酶是重要的工业酶,碱性蛋白酶是PH在9-11的蛋白酶,在工业上生产上应用的蛋白酶主要为内肽酶,主要用于洗涤业;如今已经商品化的酶制剂有木瓜蛋白酶、菠萝蛋白酶等;蛋白酶的应用范围很广泛,除了商业化应用外还有在临床医学、食品加工中也有相关应用。
一、蛋白酶的来源蛋白酶的研究是从发现胃中消化食物的胃蛋白酶和胰脏中分泌的胰蛋白酶、糜蛋白酶开始的。
目前开发的蛋白酶也就是动物蛋白酶、植物蛋白酶、微生物蛋白酶三类蛋白酶。
动物蛋白酶和植物蛋白酶主要来源于动物机体组织和植物组织中[3]。
蛋白酶的种类很多,碱性蛋白酶占蛋白酶总量的的70%左右,微生物来源的碱性蛋白酶具有培养简便、产量丰富的特点,其中枯草杆菌碱性蛋白酶的研究最广。
蛋白酶活性的测定

实验四蛋白酶活力得测定一、实验目得1、了解蛋白酶活力测定得原理;2、掌握蛋白酶活力测定得方法。
二、实验原理蛋白酶在一定条件下不仅能够水解蛋白质中得肽键,也能够水解酰胺键与酯键,因此可用蛋白质或人工合成得酰胺及酯类化合物作为底物来测定蛋白酶得活力、本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键得活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小得肽与氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大得蛋白质与肽就沉淀下来,相对分子质量较小得肽与氨基酸仍留在溶液中,溶解于三氯醋酸溶液中得肽得数量正比于酶得数量与反应时间。
在280nm波长下测定溶液吸光度得增加,就可计算酶得活力。
三、实验试剂①微生物蛋白酶萃取液(0、01g/ml):称取1。
0g酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;② 0。
02mol/L磷酸盐缓冲液(pH7.5);③ 1%酪蛋白溶液:取1、0g酪蛋白,加100ml 0。
2mol/L磷酸盐缓冲液(PH7。
5),加热并搅拌使它完全分散,然后置于冰箱中保存;④ 5%三氯醋酸(TCA)溶液。
四、实验步骤1、将5%TCA溶液与1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1、A0、B1与B0、在A1与A 0试管中各吸入0、20ml酶液,在B1与B0试管中各吸入0.40ml酶液,分别用0.2mol/L磷酸盐缓冲液定容至2、00ml。
在A0与B0试管中各吸入6.00ml5%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温、3、在各试管中吸入2。
00ml1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1与B1试管中吸入6。
00ml5%三氯醋酸溶液。
4、将试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0与B0滤液为空白,测定A1与B1滤液得吸光度。
蛋白酶的作用

蛋白酶的作用蛋白酶在动物的肝脏,植物的茎叶和果实,以及微生物中是很广泛存在的,蛋白酶的作用是很多的,现在蛋白酶在毛皮、皮革、丝绸、食品、医药、酿造方面已经有了很广泛的应用了,能够创造出很大生产力,蛋白酶的种类也有很多,常见的有胰蛋白酶和胃蛋白酶。
蛋白酶是有很多的用途的,它的药用功能也是很强大的,胃蛋白酶对于治疗消化不良有很大的作用,酸性的蛋白酶能够很好的治疗支气管炎,下面我们就来看看蛋白酶的作用,特别是胰蛋白酶。
★胰蛋白酶的作用胰蛋白酶的作用是使细胞间的蛋白质水解从而使细胞离散。
不同的组织或者细胞对胰酶的作用反应不一样。
胰酶分散细胞的活性还与其浓度、温度和作用时间有关,在 pH 为 8.0 、温度为 37℃时,胰酶溶液的作用能力最强。
使用胰酶时,应把握好浓度、温度和时间,以免消化过度造成细胞损伤。
因 Ca2+ 、 Mg2+ 和血清、蛋白质可降低胰酶的活性,所以配制胰酶溶液时应选用不含 Ca2+ 、 Mg2+ 的 BSS ,如: D-Hanks 液。
终止消化时,可用含有血清培养液或者胰酶抑制剂终止胰酶对细胞的作用。
1. 称取胰蛋白酶:按胰蛋白酶液浓度为 0.25 %,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调 PH 到 7.2 左右)或 PBS ( D-hanks )液中。
搅拌混匀,置于 4℃内过夜。
2. 用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器( 0.22 微米微孔滤膜)抽滤除菌。
然后分装成小瓶于-20℃保存以备使用。
胰蛋白酶能够催化蛋白质的特定肽键水解,这个催化过程是不需要能量的,不会使酶失去活力,也不会改变形状和使自身水解。
底物与酶的活性中心的结合是可逆的,这种结合使得蛋白质特定肽键因弯曲变形而被活化,更易于受到水分子的攻击,分别形成氨基和羧基而断裂,得到小分子多肽或氨基酸。
不同的蛋白酶可以作用在不同氨基酸相连组成的肽键,因此胰蛋白酶并不能作用在所有的肽键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
试论微生物蛋白酶中文摘要:目前低温蛋白酶的研究己经引起世界各国学者们的关注。
随着对低温蛋白酶研究的深入,将会有更多行业应用低温蛋白酶。
蛋白酶已广泛应用在皮革、毛皮、丝绸、医药、食品、酿造等方面。
皮革工业的脱毛和软化已大量利用蛋白酶,既节省时间,又改善劳动卫生条件。
关键词:低温蛋白酶、测定、提取、纯化、应用前景目录一、中文摘要、关键词 (2)二、目录 (3)三、论文正文 (4)(1)第一章蛋白酶的提取方法 (4)(2)第二章蛋白酶的纯化方法 (5)(3)第三章低温中温高温蛋白酶以及其作用 (6)(4)第四章蛋白酶的检测方法 (8)(5)第五章低温蛋白酶的应用前景,存在的问题 (9)四、参考文献 (10)蛋白酶是水解蛋白质肽键的一类酶的总称。
按其水解多肽的方式,可以将其分为内肽酶和外肽酶两类。
内肽酶将蛋白质分子内部切断,形成分子量较小的月示和胨。
外肽酶从蛋白质分子的游离氨基或羧基的末端逐个将肽键水解,而游离出氨基酸,前者为氨基肽酶后者为羧基肽酶。
按其活性中心和最适pH值,又可将蛋白酶分为丝氨酸蛋白酶、巯基蛋白酶、金属蛋白酶和天冬氨酸蛋白酶。
按其反应的最适pH值,分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶。
工业生产上应用的蛋白酶,主要是内肽酶。
蛋白酶广泛存在于动物内脏、植物茎叶、果实和微生物中。
微生物蛋白酶,主要由霉菌、细菌,其次由酵母、放线菌生产。
催化蛋白质水解的酶类。
种类很多,重要的有胃蛋白酶、胰蛋白酶、组织蛋白酶、木瓜蛋白酶和枯草杆菌蛋白酶等。
蛋白酶对所作用的反应底物有严格的选择性,一种蛋白酶仅能作用于蛋白质分子中一定的肽键,如胰蛋白酶催化水解碱性氨基酸所形成的肽键。
蛋白酶分布广,主要存在于人和动物消化道中,在植物和微生物中含量丰富。
由于动植物资源有限,工业上生产蛋白酶制剂主要利用枯草杆菌、栖土曲霉等微生物发酵制备。
第一章蛋白酶的提取方法目前国内对蛋白酶的分离技术主要是应用有机溶剂提取法、盐析法、或底物亲和法进行粗分离后, 得到混合的胃酶(包括胃蛋白酶A、B、C、D ), 但应用到生产中的只有有机溶剂提取法和盐析法。
国外则对此研究较早, 主要集中在20世纪六七十年代, 经盐析得到了商业结晶胃蛋白酶。
1.1 有机溶剂沉淀法有机溶剂法可用于胃蛋白酶的初步提取浓缩, 通常使用的有机溶剂有乙醇和丙酮。
此种方法是利用生化物质在不同浓度的有机溶剂中溶解度的差异而实现分离的[1.2 盐析法蛋白质在水溶液中的溶解度是由蛋白质周围亲水基团与水形成水化膜的程度, 以及蛋白质分子带有电荷的情况决定的。
当用中性盐加入蛋白质溶液, 中性盐对水分子的亲和力大于蛋白质,于是蛋白质分子周围的水化膜层减弱乃至消失。
同时, 中性盐加入蛋白质溶液后, 由于离子强度发生改变, 蛋白质表面电荷被大量中和, 更加导致蛋白溶解度降低, 使蛋白质分子之间聚集而沉淀[ 41.3 底物亲和法底物亲合法是利用酶(胃蛋白酶) 与其底物(酪蛋白) 的亲和性, 从胃黏膜中提取得到胃蛋白酶。
使底物和酶在pH25的乳酸缓冲液中充分结合, 然后调pH 至40 (底物的等电点) 沉淀底物和酶的结合物, 随后让沉淀物再溶解于乳酸缓冲液中, 添加低浓度的SDS将底物和酶分离,得到酶- SDS复合物, 再进一步分离纯化。
陈躬端( 2001) 成功的应用此法对蛇胃蛋白酶进行了实验室分离, 得率大约为30%。
与传统的分离方法比较, 此法具有简单高效的优点, 为后续的纯化工艺避免了昂贵的活化试剂和配基的使用, 同时具有较高的特异性第二章蛋白酶的纯化方法[1.1 凝胶过滤凝胶过滤主要是利用凝胶的多孔性, 当样品溶液通过凝胶柱时相对分子质量较大的物质由于直径大于凝胶网孔, 而只是沿着凝胶颗粒的孔隙随着溶剂首先流出层析柱[1.2 离子交换层析离子交换法一直以来都是酶生产所常用的方法。
它是一项利用溶液中各种带电粒子与离子交换剂之间结合力的差异进行物质分离的操作技术。
具有简便、高效、成本低, 且可自动化连续操作的优点1.3 双重层析配合法为了获得高活力的胃蛋白酶, 还常将两种层析方法配合使用。
张继平( 2004) 对暗纹东方鲀胃蛋白酶的纯化时, 采用CM - C ellu lose 柱纯化( 25cm ! 30cm ), 洗脱液为005mo l /L pH50 柠檬酸缓冲液, 0 10mo l /L NaC l直线梯度洗脱,流速为025mL /m in, 部分收集, 每管收集约4mL, 合并活力峰, 再经Sephadex G- 75 ( 25cm! 60cm ) 层析柱, 获得胃蛋白酶比活为713mo l/ ( m in∀ mg) [ 7] 。
基于以上对胃蛋白酶的分离纯化技术的比较分析可以看出, 长期以来分离提取技术一直没有取得较大的突破, 用有机溶剂、盐析等技术得到的天然胃蛋白酶产品, 纯度、生物活性愈将不能满足医药品和工业日益增长的需要。
随着分离科学技术的不断发展, 采用新型分离技术分离胃蛋白酶已势在必行。
因此, 笔者认为以下几种技术是胃蛋白酶分离纯化的方向。
1.3.1 有机溶剂与盐析共沉淀有机溶剂和盐析法都是分离纯化胃蛋白酶的传统方法, 有其各自的特点。
如果将有机溶剂和盐析配合使用, 不仅可以降低盐的用量, 而且可以不同程度的消除各自分离纯化所带来的问题,得到的胃蛋白酶纯度和活性也会有所增加。
此法在实验室的研究中已见报道, 但在工业生产中,有机溶剂与盐的用量还有待进一步优化。
1.3.2 膜分离技术分离膜是一种特殊的、具有选择性透过功能的薄层物质, 能利用分子大小实现分离, 从而起到浓缩和分离纯化的作用[ 12] 。
由于其可在维持原生物体系环境的条件下实现分离, 并可高效地浓缩、富集产物, 有效地去除杂质, 加之操作简单, 结构紧凑、能耗低, 过程简化, 无一次污染, 也将成为胃蛋白酶分离纯化工艺的研究方向。
1.3.3 等电点沉淀与底物亲和法胃蛋白酶具有极低的等电点(如猪胃蛋白pH10), 但胃蛋白酶的分离纯化技术中等电点沉淀法未见报道, 如果此方法可实现, 那将大大缩短分离纯化的时间。
底物亲和法是分离纯化胃蛋白酶的新亮点, 但其工艺条件还不成熟, 尤其是在分离底物和酶的复合物时, SDS 的添加量有待研究。
第三章低温中温高温蛋白酶以及其作用低温蛋白酶主要存在于低温微生物中,而低温微生物广泛分布于极地、冰川、永久冻土和深海等寒冷环境,其冷适应能力是多种机理共同作用的结果,包括酶的低温催化活性、低温下膜流动性的保持、冷休克蛋白、抗冻蛋白以及抗冻保护剂等。
低温微生物主要应用于催化低温发酵、表达热不稳定蛋白质、生产抗冻保护剂和冬季治理污水等领域。
早期对低温适应机理的研究多集中在嗜冷酶的分离和特点研究,但仅通过酶学研究低温微生物的机理有局限性,细胞膜在低温下流动性的保持以及低温下的新陈代谢也是低温适应性机理中非常重要的部分。
胞内物 ,包括胁迫蛋白、抗冻蛋白、小分子化合物等的研究,也证明了微生物的耐冷性更趋向于全细胞的适应,而不是单纯某类分子的特性改变。
嗜冷酶在低温下具有较高的催化效率 kcat/K,从结构方面讲,嗜冷酶的低温下活性主要得益于其分子组成特点引起的空间高柔韧性结构(flexibility) ,或者说是由其热不稳定性引起酶分子的高柔韧性结构使酶具有较高的底物结合能力从而降低Km,但高柔韧性结构同样也引起酶的耐热性降低。
嗜冷、嗜温和嗜热微生物中的谷氨酰脂脱氢酶(glutamate dehydrogenase)、β-内酰胺酶(β-lactamases)和α-淀粉酶(α-amylase)等酶的氨基酸组成表明,嗜冷酶具有较少的脯氨酸和精氨酸 ,较低的脯氨酸与赖氨酸比,较少的二硫键。
嗜冷、嗜温和嗜热3种DNA连接酶的三维模型分析显示,其表面疏水残基含量依次降低(22%、18%、17%),亲水残基含量依次升高(69%、75%、77%) ,中性氨基酸含量依次降低(21%、18%、14%);同时,低温连接酶活性位点的表面可接触中性残基含量(20%)也高于其他两种连接酶(18%、9%) ,表明嗜冷酶氨基酸残基组成对酶的活性、柔韧性和耐热性具有综合影响。
另外,其他研究表明减少盐桥、离子键、芳香环相互作用 ,减弱结构域的相互作用、增加表面环状结构(surface loops)也可以提高酶的柔韧性并降低其耐热性。
利用定点突变等手段改造中温、嗜热酶,使其具有类似于低温的特性证明了氨基酸组成对酶的低温活性具有重要影响,也为生产广适应温度蛋白酶奠定了基础。
Tindbaek等人通过定点改造 ,切除了中温枯草杆菌蛋白酶(savinase, EC 3.4. 21. 62)活性中心中的 12个氨基酸残基(LSLGSPSPSATL),并插入人工合成的低温枯草杆菌蛋白酶S39的一段同源高柔韧性性区域(MSLGSSGESSLI),获得一种新的蛋白酶 H5。
该酶在低温下 H5具有更高的催化活性与分子柔韧性,而其热稳定性也高于低温枯草杆菌蛋白酶 S39,而其最适催化温度及 pH值与出发酶savinase相同。
氨基酸组成与结构对比并不能完全解释嗜冷酶的机制。
如从南极分离出一株Arthrobacter属低温菌,其β-半乳糖苷酶在18℃具有最大活性,在0℃仍有50%活性,与另一种40℃最大活性的β-半乳糖苷酶比较,除了脯氨酸残基比较少外,上述嗜冷酶的其他特点都未发现,进一步研究表明,该酶在低温下是一种四聚体结构,在25℃的时候分解为无活性的单体,说明该酶的低耐热性与其四级结构有关。
目前对低温微生物的应用正处于起步阶段 ,并多为嗜冷酶的利用 ,但其他方面的研究也在逐步进展中 ,如膳食不饱和脂肪酸、作为防冻保护剂的抗冻蛋白、食品发酵中的低温酵母等。
在环境治理领域 ,利用低温微生物可以在冬季等低温环境下保持较高代谢活性的优势 ,一些环境治理的新方法也得以实现 ,如固定化培养耐冷隐球酵母(Cryptococcus sp.)和红酵母(Rhodotorula sp.)降解工业苯酚等。
另外 ,古细菌作为一种新兴的生物资源 ,广泛分布于高寒地带 ,而开发和利用古细菌资源包括其表达的酶、蛋白质、脂类等物质已经成为近年研究的热点。
第四章蛋白酶的检测方法蛋白酶在一定的温度和pH条件下,水解底物酪素产生含有酚基的氨基酸(如酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生成钼蓝与钨蓝,用分光光度计测定,计算其酶活力。
1.试剂和溶液1 mol/L及0.1mol/L盐酸(HCl)溶液、100mg/ml L-酪氨酸标准液、0.4mol/L 碳酸钠(Na2CO3)溶液、福林 (Folin) 试剂、乳酸缓冲液、1.0%酪素溶液、0.4mol/L 三氯乙酸(CCl3—COOH)溶液2.仪器和设备2.1 恒温水浴锅。
