猪Caspase_3基因的克隆及序列分析
caspase-3

(一)caspase家族Caspases是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,它们的一个重要共同点是特异地断开天冬氨酸残基后的肽键。
Caspase一词是从Cysteine aspartic acid specific protease 的字头缩写衍生而来,就反映了这个特征,而这种高度的特异性,在蛋白酶中是很少见的。
由于这种特异性,使caspase能够高度选择性地切割某些蛋白质,这种切割只发生在少数(通常只有1个)位点上,主要是在结构域间的位点上,切割的结果或是活化某种蛋白,或使某种蛋白失活,但从不完全降解一种蛋白质。
Caspase的研究源于线虫(C. elegans)细胞程序化死亡的研究。
线虫在发育过程中,有131个细胞将进入程序化死亡;研究发现有11个基因与PCD 有关,其中ced3和ced4基因是决定细胞凋亡所必需的,ced9基因抑制PCD。
线虫细胞程序化死亡的研究促进了其他动物特别是哺乳类动物中细胞凋亡的研究。
人们发现哺乳类细胞中存在着Ced3的同源物ICE(interleukin-1b converting enzyme),它催化白介素-1b的活化,即从其前体上将IL-1b 切割下来。
在大鼠成纤维细胞中过量表达ICE和Ced3都会引起细胞凋亡,表明了ICE和Ced3在结构和功能上的相似性;然而敲除ICE基因的小鼠其表现型正常,并未发现细胞凋亡发生明显改变。
进一步的研究发现,另一个ICE成员,后来被称为apopain,CPP32或Yama的半胱氨酸蛋白酶,催化poly(ADP-ribose)Polymerase(PARP),即聚(ADP-核糖)聚合酶的裂解,结果导致细胞的凋亡,因而认为apopain执行着与线虫中的ced3相同的功能。
Apopain被称为是“死亡酶”,而PARP被认为是“死亡底物”。
Apopain/CPP32/Yama是在1995年由两个实验室分别同时报导,时间上只有两周之差。
五指山小型猪生长激素及其受体基因的克隆与序列分析

摘要 : 动物 生长发 育调 控是一 个 高度 复杂 而精 细 的生理 过程 , 多种 因素如 神经 、体 液 、遗传 、营 受 养及 环境等 的影响 。其 中 ,动 物神 经 内分 泌生 长轴各 因子 ( 激素 、受 体 、结 合蛋 白等 )及 其基 因对 动
物的 生长发 育起着 关键 的作用 。正 常情 况 下 ,下丘脑 接受 体 内外 的 信息 ,生 长激 素 释放 激 素 (r wt go h h r n ee s gh r n ,GHRH)和 生长抑 素 (o tsai omo erlai omo e n s maott n,S ) S ,调 节垂 体生 长 激素 ( rwt go h
普 通猪 生长激 素受 体基 因 比对 发现 ,1 _ 1 3号位置 的 G T 突变 引起 天冬 氨酸 替换 谷氨 酸 ;1 2 号 位 置 4 — 25 的 G— T突 变 导 致 丝 氨 酸 替 换 丙 氨 酸 ; 6 号 位 置 C G突 变 导致 缬 氨 酸 替 换 亮 氨 酸 ; 3 号 位 置 1 66 — 1 9 7 ( 变导致 丙氨 酸被 甘氨酸所 代替 ;1 0 、 一( 突 8 1号位 置 G— A 突变 导致 缬 氨酸 被异亮 氨 酸代 替 ;1 4 2 8号
维普资讯
Sup
广 西 Ju n l fGu n x . 五c a 物 i手 in e o r a 0 农 业 Ag生 nlBo 斗 ce e agi . IS 堂 . ‘
, ,
20 0 6年 9月
Se .. 06 pt 20
h r n ,OH)的分 泌 , o mo e GH 通过 与 生长 激素 结合蛋 白 ( rwt o mo ebn igpo e GHB )结 go hh r n idn r ti n, P
caspase资料
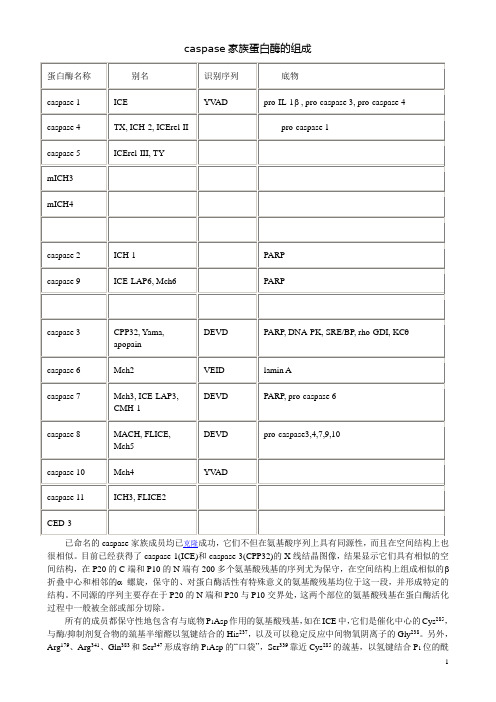
caspase家族蛋白酶的组成已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。
目前已经获得了caspase-1(ICE)和caspase-3(CPP32)的X线结晶图像,结果显示它们具有相似的空间结构,在P20的C端和P10的N端有200多个氨基酸残基的序列尤为保守,在空间结构上组成相似的β折叠中心和相邻的α螺旋,保守的、对蛋白酶活性有特殊意义的氨基酸残基均位于这一段,并形成特定的结构。
不同源的序列主要存在于P20的N端和P20与P10交界处,这两个部位的氨基酸残基在蛋白酶活化过程中一般被全部或部分切除。
所有的成员都保守性地包含有与底物P1Asp作用的氨基酸残基,如在ICE中,它们是催化中心的Cys285,与酶/抑制剂复合物的巯基半缩醛以氢键结合的His237,以及可以稳定反应中间物氧阴离子的Gly238。
另外,Arg179、Arg341、Gln383和Ser347形成容纳P1Asp的“口袋”,Ser339靠近Cys285的巯基,以氢键结合P1位的酰胺。
与P2~P4作用的氨基酸残基则变异比较大,这可能是各个成员识别不同底物的特异性之所在。
在活性Cys周围的氨基酸序列也很保守,一般都有Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,在caspase-8、caspase-10中为QACQG,在caspase-9中是QACGG,这三个成员都有一个氨基酸残基的变异,但这种变异不影响蛋白酶的剪切活性和特异性。
未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列。
酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10)2的形式组成的。
这种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域。
APOBEC3概述

1.1.1APOBEC3概述1.1.1.1APOBEC3基因的发现及在不同物种间的分布HIV-1 Vif蛋白能调节病毒的感染和复制,它对于病原感染宿主有重要作用。
HIV-1 ΔVif感染非允许细胞之后产生的病毒粒子没有感染力,感染允许细胞产生的HIV-1有感染能力,Madani, N将允许细胞和非允许细胞进行融合后,发现HIV-1Δvif感染这种异核体产生的病毒粒子也没有感染性,证明非允许细胞有一项抗病毒功能。
之后Ann M. Sheehy从非允许细胞里面筛选出了CEM51(后来的APOBEC3G),他发现这种蛋白有抗病毒功能,这种功能能被HIV-1的Vif所克服[66]。
Vif是通过与cullin5,elonginB,elonginC形成一种复合体将APOBEC3G(A3G)泛素化进而被蛋白酶体降解,宿主细胞核结合因子(CBF-β)能与Vif结合稳定上述复合体结构进而调节Vif对抗A3G的作用[77,78]。
在这之后A3F,A3B,A3DE和A3H也逐渐被发现具有限制HIV-1复制活性。
A3蛋白表达高度受到IFNs诱导特别是在髓系分离细胞,并且A3蛋白具有广谱抗病毒活性,例如A3G对HIV-1、HBV、SIV、HTLV-1、Foamy virus、EIAV、MLV都有一定限制作用。
因此,对于A3蛋白的深入研究有助于我们更好了解病毒和机体的相互作用,为以后研制抗病毒药物打下基础。
研究证实A3蛋白除了能够限制外源性逆转录病毒,还对内源性逆转录病毒有一定的限制作用。
过去几年以来,人们认为宿主寄生因子能够利用多种不同机制与宿主A3蛋白共存。
这些结果表明,A3基因在宿主体内进化动力来源于外源性和内源性逆转录病毒在不同宿主之间传播的威胁。
A3基因的进化造成了不同哺乳动物A3数量和类型不同。
A3基因串联排列在脊椎动物保守的侧翼基因CBX6和CBX7之间,不同哺乳动物A3基因数不同。
例如:鼠只有一个A3基因,猪有2个,牛和羊有3个,猫有4个,马有6个,人和大星星有7个。
Caspase_3与细胞凋亡的研究_cropped

分子生物医学C aspase23 与细胞凋亡的研究张晓田(综述) ,宋天保(审校)( 西安交通大学医学院组织学与胚胎学教研室,陕西西安710061)关键词: 半胱天冬酶23 ; 细胞凋亡; Bcl22 中图分类号: Q255文献标识码: A文章编号:100622084 (2002) 1120621203His 的咪唑基团在C ys 侧链的极化激活中有重要作用。
精氨酸残基(Arg341 和Arg179) 位于大、小亚基之间的界面上,它们形成S1 亚位点,与P1 位点的天冬氨酸结合。
casp se23 的三维结构揭示大、小亚基共同参与构成其特异性的结合腔( b in d ing cleft ,S42S1) ,其中S4 亚位点是最主要的特异性决定簇, 只由小亚基构成4 ,5 。
2 c a sp a se23 与细胞凋亡2. 1 caspase23 处于细胞凋亡的下游经典的细胞凋亡途径有两条,分别为细胞外途径( 或称细胞表面死亡受体途径) 和细胞内途径(或称线粒体引发途径) 。
在细胞外途径中,死亡信号的传导依赖于死亡配体与受体的结合(如TNFα和TNFR , Fas L 和Fas 的结合) , 接着,死亡受体的死亡结构域( d eath d o2 main ,DD) 与信号传导分子(如FADD 等) 结合,而FADD 又可与caspase28 酶原的DE D 相连接, 形成死亡诱导信号复合物( d eath indu cing sig naling complex ,DISC) ,随之caspase28 被激活, 它通过裂解BID 使线粒体释放细胞色素C , 或直接作用于caspase23 及其他下游的caspase 。
在细胞内途径中, 细胞内的死亡信号,如DNA 损伤、毒素和ATP 耗竭等均可诱发线粒体释放细胞色素C。
细胞色素C、Apaf21 、d ATP 和caspase29 酶原结合形成凋亡复合体(apoptosom e) ,caspase29 被释放并激活,接着下游的caspase23 、7 等被激活降解底物使细胞凋亡2 ,6 。
Caspase-3基因过表达抑制LN-18人神经胶质瘤细胞移植瘤生长

Caspase-3基因过表达抑制LN-18人神经胶质瘤细胞移植瘤生长葛风;蒋云召;王泳【摘要】目的观察靶向caspase-3基因过表达对LN-18人神经胶质瘤细胞移植瘤生长的影响并探讨其机制.方法化学合成caspase-3基因序列,通过同源重组,获得caspase-3基因过表达慢病毒.设置转染组、对照组和空白组,其中转染组细胞转染caspase-3基因过表达慢病毒,对照组细胞转染含阴性序列基因重组慢病毒,空白组细胞不加病毒上清液,慢病毒转染LN-18人神经胶质瘤细胞72 h后测定病毒转染效率,蛋白质印迹法评估caspase-3蛋白表达.制备裸鼠神经胶质瘤荷瘤模型,细胞接种后每3天测量肿瘤体积,21 d后处死动物,剥离肿瘤组织,比较各组瘤块大小,TUNEL法观察各组肿瘤组织内细胞凋亡情况.结果 caspase-3基因过表达慢病毒能有效感染LN-18人神经胶质瘤细胞,体外细胞转染率达到83.7%,转染72 h后,转染组caspase-3蛋白表达显著增加;转染组LN-18人神经胶质瘤细胞移植裸鼠皮下,肿瘤生长速度明显小于对照组和空白组,至移植后21 d,转染组、对照组和空白组移植瘤体积分别为(0.52±0.17)cm3、(2.61±0.22)cm3和(2.38±0.19)cm3,F=104.241,P=0.02189;移植后21 d,与对照组和空白组相比,转染组移植瘤细胞凋亡显著增加(P<0.001).结论 caspase-3基因过表达慢病毒转染LN-18人神经胶质瘤细胞可明显促进caspase-3蛋白合成,抑制LN-18神经胶质瘤细胞体内移植后生长,显著增加肿瘤细胞凋亡,可作为神经胶质瘤治疗新手段.【期刊名称】《实用医学杂志》【年(卷),期】2019(035)009【总页数】4页(P1379-1382)【关键词】caspase-3;慢病毒;神经胶质瘤;细胞凋亡;肿瘤抑制【作者】葛风;蒋云召;王泳【作者单位】无锡市第三人民医院神经外科,江苏无锡 214000;无锡市第三人民医院神经外科,江苏无锡 214000;无锡市第三人民医院神经外科,江苏无锡 214000【正文语种】中文神经胶质瘤是目前临床上最常见脑肿瘤,约占所有颅内原发肿瘤的一半,每年新增约14 万病例,65 岁以上人群发病率明显增高[1]。
Caspase-3及Cleaved-Caspase-3在氟中毒大鼠肝脏中表达

Caspase-3及Cleaved-Caspase-3在氟中毒大鼠肝脏中表达李永宁;肖晶晶;赵建勇【摘要】目的探讨氟中毒大鼠肝脏组织中Caspase-3及Cleaved-Caspase-3的表达情况.方法选用36只健康SD大鼠分为对照组、低氟组、高氟组(饮用含氟量分别为<1 mg/L、5mg/L及50 mg/L的自来水),每组12只(雌雄各半).饲养6个月后,股动脉放血处死,氟离子电极法检测大鼠尿氟含量;自动血生化分析仪检测大鼠肝功能;免疫组织化学法和蛋白印记(Western blot)法检测Caspase3及Cleaved-Caspase-3蛋白表达水平.结果低氟组、高氟组大鼠尿氟[(1.85±0.13)、(2.23±o.10) mg/L均高于对照组[(1.63±o.11) mg/L] (P<0.05);低、高氟组大鼠血清谷丙转氨酶及谷草转氨酶活性[(48.66±5.55)、(68.17±8.39)U/L及(142.57±16.21)、(165.89±28.26) U/L]均高于对照组[(38.49±2.98)、(117.98±9.88) U/L](P<0.05);高过剂量氟组Caspase-3及Cleaved-Caspase-3蛋白表达[(98.08±13.08)、(106.33±9.14)]明显高于对照组[(53.92±6.36)、(59.78±7.54)l(P<0.05).结论氟可促进Caspase-3及Cleaved-Caspase3蛋白的表达,其可能参与慢性氟中毒所致肝脏损伤发病过程.【期刊名称】《贵州医药》【年(卷),期】2016(040)003【总页数】3页(P239-240,封3)【关键词】氟中毒;Caspase-3;Cleaved-Caspase-3;细胞凋【作者】李永宁;肖晶晶;赵建勇【作者单位】贵州医科大学,贵州贵阳550004;贵州医科大学,贵州贵阳550004;贵州医科大学,贵州贵阳550004【正文语种】中文【中图分类】R392.11氟不仅可以导致骨质疏松、骨硬化、骨软化等一系列的骨相损害,还能造成中枢神经、心血管、消化、内分泌等多系统的非骨相损害[1]。
Caspase-3和Bcl-2在原发性支气管肺癌中的表达及意义

原发 性 支气管 肺癌 和 癌旁组 织 中 C sae 3及 B l2的表 达 , 结合 临床资 料 探讨 二者 表 达异 常与 原发 性 支气 管肺 aps一 c一 并 癌 发生 、 展 的关 系。结果 : 原发性 支 气管 肺癌 中, c一 发 在 B l2蛋 白高度 表达 (52 , C sae 3表达 略低(57 。在 4 .%1而 ap s一 3. %1 癌旁 组 织 中 , aps 一 C sae 3高度 表 达( 阳性率 为 1 0 , B l2无 表达 ( 0 %)而 c一 阳性 率 为 0 。结 论 : 发性 支 气 管肺 癌 中 B l2 ) 原 c一 蛋 白表达 上调 、 ap s一 C sae 3表达下 降 同原 发性 支气 管肺 癌 的发生 、 展及 分化 有 关 。 发
・
基础研究 ・
20 年 l 08 O月第 5卷第 3 期 O
a p s 口B ' 2在原发性支气管肺癌 中的 s a e 3和 (- - 布 C 3 l I
表达及 意义
线 铁 军
( 阳市 第一 人 民医 院呼 吸内科 , 沈 辽宁 沈 阳 1 0 4 ) 10 1
[ 摘要】 目的: 探讨 C sae3和 B l a s一 p c 2在原发性支气管肺癌中的表达及意义。方法: 一 本文应用免疫组织化学方法检测
基于caspase-3

doi:10.3971/j.issn.1000-8578.2023.22.1114基于caspase-3/Bcl-2/Bax 信号通路探究SMAC 基因对肺腺癌细胞紫杉醇敏感度及 细胞活性的影响陈康,陈颖,牛宗新,康莉,祖里培亚·艾拜都拉Effect of SMAC Gene on Sensitivity of Lung Adenocarcinoma Cells to Paclitaxel and Cell Viability Based on caspase-3/Bcl-2/Bax Signaling PathwayCHEN Kang, CHEN Ying, NIU Zongxin, KANG Li, ZULIPEYA . AibaidulaDepartment of Thoracic Surgery, Xinjiang Uygur Autonomous Region People’s Hospital, Urumchi 830000, ChinaCorrespondingAuthor:CHENYing,E-mail:*****************Abstract: Objective To investigate the effect of the SMAC gene on paclitaxel sensitivity and cellular activity in lung adenocarcinoma cells based on the caspase-3/Bcl-2/Bax signaling pathway. Methods A paclitaxel-resistant cell line A549/Taxol was established for lung adenocarcinoma, and the cells were divided into four following groups: pcDNA-NC (transfected with pcDNA-NC blank vector), pcDNA-SMAC (transfected with pcDNA-SMAC vector), siRNA-NC (transfected with siRNA-NC empty virus vector), and siRNA-SMAC groups (transfected with siRNA-SMAC lentiviral vector). The SMAC mRNA expression in cells was detected by qRT-PCR; cell sensitivity was detected by MTT; cell proliferation ability was detected by cloning assay; cell invasion ability was detected by Transwell; apoptosis ability was detected by flow cytometry assay; and caspase-3, Bcl-2 and Bax protein expression in cells were detected by Western blot analysis. Results The SMAC mRNA expression was significantly lower in A549 cells compared with BEAS-2B cells (P <0.05). The SMAC mRNA expression was significantly higher in the pcDNA-SMAC group than that in the pcDNA-NC group cells (P <0.05). The SMAC mRNA expression was significantly lower in the cells of the siRNA-SMAC group (P <0.05) than that in the siRNA-NC group. The SMAC mRNA expression was significantly lower in the cells of the siRNA-SMAC group (P <0.05) than in the siRNA-NC group. Compared with the pcDNA-NC group, the cell IC 50, cell clone number, cell invasion ability, and Bcl-2 protein and Bcl-2/Bax ratio were significantly lower in the pcDNA-SMAC group, the cell resistance index reversal was 2.51-fold, and the apoptosis ability and caspase-3, as well as Bax protein expression, were significantly higher (P <0.05). Compared with the siRNA-NC group, cell IC 50, cell clone number, cell invasion ability, and Bcl-2 protein and Bcl-2/Bax ratio were significantly higher in the siRNA-SMAC group, and apoptosis ability and caspase-3 and Bax protein expression were significantly lower (P <0.05). Conclusion High expression of SMAC increases paclitaxel sensitivity, inhibits cell growth and invasion, promotes apoptosis in lung adenocarcinoma cells, and has a regulatory effect on the caspase-3/Bcl-2/Bax signaling pathway.Key words: caspase-3/Bcl-2/Bax signaling pathway; SMAC gene; Lung adenocarcinoma cells; Paclitaxel resistance sensitivity; Proliferation; Invasion; ApoptosisFunding: Natural Science Foundation of Xinjiang Uygur Autonomous Region (No. 2017D01C136)Competing interests: The authors declare that they have no competing interests.收稿日期:2022-09-26;修回日期:2022-10-14基金项目:新疆维吾尔族自治区自然科学基金(2017 D01C136)作者单位:830000 乌鲁木齐,新疆维吾尔自治区人民医院胸外科 通信作者:陈颖(1978-),女,硕士,主任医师,主要从事肺癌化疗方面的工作,E-mail: *****************作者简介:陈康(1980-),男,硕士,主任医师,主要从事肺癌基础研究,ORCID: 0009-0002-5937-5360·基础研究·摘 要:目的 基于caspase-3/Bcl2/Bax 信号通路探究SMAC 基因对肺腺癌细胞紫杉醇敏感度及细胞活性的影响。
Caspase-3在视网膜母细胞瘤中的表达及相关性研究

胞 瘤 中 , 4例 是分 化 型 , 细胞 排列 成 菊 花 团 , 有 瘤 有
长 方形 、 正方 形 、 形或 锥 形 细胞 组成 , 梯 中央 围绕 一
空腔 。2 0例是 未 分 化 型 , 细 胞 核 大 部 分 深 染 , 瘤 形 态 大小 不 一 , 呈 圆 形 、 圆 形 、 形 。 异 型 性 明 可 椭 梭 显 , 质较 少 , 裂 相 多 见 。有 的 瘤 细 胞 呈 套 环 状 胞 分
A s atObe t e T td es nf a c f h x rsino ap s 一 adcr lt nb tente b t c : jci os yt i icn eo eepes f sae 3, n or ai e e m i r v u h gi t o C e o w h n rt o ls m ( B) ei bat a R .Meh d T e c teepes n o ap s 3 i R i t paii/ eoiaei n o to s od t th xrsi f sae一 n B wt s etv n p rx s e o C h r d d m—
BN a , I i —mig H N Q n I G H n J Xa N o n , A ig
( eat etfO hh looy teH si l H i nj n r i e H ri 5 0 1 HI A ) D p r n p tam l , h o t e ogi gP o n , ab 1 0 0 ,C N m o g pa o f l a vc n
例 ; 木斯 医 学 院 眼科 2例 ; 丹 江 医 学 院 眼科 2 佳 牡 例 ;4 22医 院眼科 1例 ; 医 大 附 属 二 院 眼科 1例 ; 哈 沈 阳第 四眼科 院 2例 , 计 2 共 4例 。其 中 : l 男 3例 , 女 1 。年龄 范 围在 :0个 月 ~ 1例 l 7岁 , 均 2 8岁 。 平 .
Caspase3_测定

Caspase3 测定caspase-3的检测方法:(1)免疫细胞化学检测caspase-3蛋白的表达,用悬浮的细胞;(2)western blot 理想结果:caspase-3有32KD的条带外,还出现了20KD和10KD大小的条带,表明caspase- 3被活化;(3)RT-PCR检测mRNA的表达,用凝胶成像分析系统处理,可以半定量。
Caspases可以在哺乳动物细胞内启动凋亡,caspase3比色蛋白酶试剂盒通过简单、方便的测定caspases活性的方法这种方法通过识别序列DEVD,这种方法基于用分光光度计测定从标记底物DEVD-pNA分开的发色团(pNA) 此时游离的pNA的发射光谱可用分光光度计或酶标仪或微量滴定板在400或405nm 检测,通过样本和背景的吸光度比较来测定caspase3活性的增加,进而推知Caspases的活性。
原理:在Caspase的底物多肽(如Caspase-3的底物为DEVD)上标记pNA (p-nitroanilide, 对硝基苯胺).当活化的Caspase剪切标记的底物多肽后, pNA被释放出来,此时游离的pNA的发射光谱可用分光光度计或酶标仪在400或405nm 检测,进而推知Caspases的活性.一.实验前准备:消毒的EP管、枪头、三蒸水、冰、水浴箱、实验组及对照组心肌组织、超速低温离心机、酶标仪、721分光光度计二.活性测定操作步骤(一)每组试剂组成Samples(lysis buffer)2×Reaction buffer DEVD-PNA 总Sample well (标本组)30ul 65ul 5ul 100ul Sample control(背景组)30ul(lysis buffer)70ul 0 100ulSample well(样本组)Sample control(背景组)3小时组N3 30ul样本30ul样本65ul Reaction buffer 70ul Reaction buffer5ul DEVD-PNAC3 30ul样本+65ul Reaction buffer5ul IETD-PNA 30ul样本+70ul Reaction buffer R3 30ul样+65ul Reaction buffer5ul LEHD-PNA 30ul样本+70ul Reaction buffer6小时组N6 30ul对照样本30ul样本65ul Reaction buffer 70ul Reaction buffer5ul DEVD-PNAC6 30ul样本+65ul Reaction buffer5ul IETD-PNA 30ul样本+70ul Reaction buffer R6 30ul样本+65ul Reaction buffer5ul LEHD-PNA 30ul样本+70ul Reaction buffer 共需2×Reaction buffer810 ul,配制2×830ul以防不够,用前加入8.3ul DTT活性表示为=样本OD1-背景OD1(实验组)/样本OD2-背景OD2(对照组)(二).操作步骤——酶标仪 1.取标记好的EP管(已消毒)2.取已冻好的冰块加点水,置插EP管的座于冰水中3. 放转子,打开高速离心机电源,时间、速度都在零位置先开机将至4摄氏度注意要配平套管A、B、C、D注意:1.速度、时间均为0时,才能开电源2.设置温度降温10min(夏天时间可以稍微长一些)3.开电源前先把转子放入4.定时-启动-慢慢调速10000转(显示为1000转)未配平-停机-重新配平-再开机5.停机灯亮,开盖(复位:速度、时间均为0)1.从低温冰箱中取出用锡铂纸包着的组织(已称重标记好的),取2-3块(30mg/块),放在EP管中,一直浸在冰水中2.锡铂纸剥去,组织直接置于EP管中,加裂解buffer(溶后4摄氏度保存)约700ul 冰上EP管中,用小弯剪将心脏组织剪碎,越碎越好组织、裂解buffer比例:1:10冰上操作3.开匀浆机取几块冰块于小烧杯中,接自来水成冰水液将EP管置于盛有冰水的小烧杯中,固定于匀浆机上先做对照组将转头插于组织液面下,打开电源,逐渐调大速度至max,上下搅动,直至浑浊,基本无小的组织块为止调小速度至零,关电源,取出转头,EP管放回冰水底座用蒸馏水冲洗转头,液冲至废烧杯中依次以同样方法将样本组进行匀浆注意:放空转,慢慢加速,别转别上下移动轴4.匀浆后置于离心机内先设时间10min “起动”;缓慢增大离心速度至1000×10r/min;缓慢减小离心速度,降至30×10r/min时,“停机”灯亮,即可取出注配平:套管A、B、C、D配平5.取Reaction buffer 6ml,用前加入60ul DTT(稀释100倍)吸取上清至小EP管依次加Reaction buffer、上清、底物至ELISA板,加底物时,每加一次换一个枪头(因为要混匀)注:底物每取完一次都要盖盖,避光;加完底物后,混匀。
猪Caspase-3基因的克隆及序列分析

和 8 . 、6 7 , 且 猪 、 、 的 C sae3上 的催 化 和剪 切 位 点 都 极 为保 守 。 7 8 8 . 而 人 鼠 aps一
关 键 词 : aps一 ; 隆 ; 列 分析 C sae3 克 序 中 图分 类 号 : 8 3 1 ¥ 1 . 文献标识码 : A 文 章 编 号 :0 2 8 6 ( 0 6 O 一O 8 一O 1 0— 1 12 0 ) 5 5 4 5
a tves t sc r s c i ie or e pon ng c t yssan l a g n Ca pa e 3a ong t i di a al i d ce va e o s s 一 m he p g,h um an a nd mous e e c s r a i e w r on e v tve v r uc e ym h. Ke r y wo ds:Ca p s 一 s a e 3;con ng;s qu nc n y s l i e e e a alsi
Cl ni nd s q nc na y i f Ca pa e 3 g ne o g o ng a e ue e a l ss o s s 一 e f pi
LIJ n, I B n Z NG n, U O n —o g u L U i g, E La L Tig r n
( i lS in e a d Te h o o y Co lg ,Gu n x i e s y,N a n n 5 0 0 ,Ch n ) An ma ce c n c n l g l e e a g iUn v r i t n i g 3 0 5 ia
Ab t a t s r c :Ca pa e i n o e s sw hih i e a e o a pt i s s s aki d ofpr t a e c sr l t d t po oss,a ndCas s - st e uli a e e e ut n pa e 3 i h tm t x c ei
caspase-3

caspase-3Caspase家族Caspase属于半胱氨酸蛋白酶,相当于线虫中的ced-3,这些蛋白酶是引起细胞凋亡的关键酶,一旦被信号途径激活,能将细胞内的蛋白质降解,使细胞不可逆的走向死亡。
它们均有以下特点:①酶活性依赖于半胱氨酸残基的亲核性;②总是在天冬氨酸之后切断底物,所以命名为caspase(cysteine aspartate-specific protease),方便起见本文称之为凋亡酶;③都是由两大、两小亚基组成的异四聚体,大、小亚基由同一基因编码,前体被切割后产生两个活性亚基。
最早发现人类中与线虫ced-3同源的基因[1]是ICE,即:白介素-1 β转换酶(Interleukin-1 β-converting enzyme)基因,因该酶能将白介素前体切割为活性分子,故名。
通过cDNA杂交和查找基因组数据库,在人类细胞中已发现11个ICE同源物[2],分为2个亚族(subgroup):ICE亚族和CED-3家族(图15-6),前者参与炎症反应,后者参与细胞凋亡,又分为两类:一类为执行者(executioner 或effector),如caspase-3、6、7,它们可直接降解胞内的结构蛋白和功能蛋白,引起凋亡,但不能通过自催化(autocatalytic)或自剪接的方式激活;另一类为启动者(initiator),如caspase-8、9,受到信号后,能通过自剪接而激活,然后引起caspase级联反应,如caspase-8可依次激活caspase-3、6、7。
细胞中还具有caspase的抑制因子,称为IAPs(inhibitors of apoptosis proteins),属于一个庞大的蛋白家族。
它们能通过BIR结构域(baculovirus IAP repeats domain)[3]与caspase结合,抑制其活性,如XIAP。
非活性状态的pro-Caspase-3和活性状态的cleaved-caspase-3存在于细胞质中,当pro-caspase-3被剪切后剩下p17和p12 2个亚基,而产生活性。
caspase家族及在细胞凋亡中的作用

caspase家族及在细胞凋亡中的作用caspase家族及在细胞凋亡中的作用admin注:本文仅是基础知识,目前这方面进展十分快,需要更新更多的知识。
如caspase家族目前发现至少14种。
这里仅介绍几种常见的成员。
目的是让大家了解到caspase家族的概况,以及在细胞凋亡中的作用。
一caspase家族蛋白酶的组成未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列。
酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10) 2的形式组成的。
这种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域。
这种剪切可以是酶原及中间活性酶自我催化,也可以是其它ICE家族蛋白酶的作用,还有其它酶类如颗粒酶B 参与。
表5. caspase家族蛋白酶的识别序列及作用底物蛋白酶名称别名识别序列底物caspase 1ICE YVAD pro-IL-1 , pro-caspase 3,pro-caspase 4caspase 4TX, ICH-2,ICErel-IIpro-caspase 1caspase 5ICErel-III, TYmICH3mICH4caspase 2ICH-1PARPcaspase 9ICE-LAP6, Mch6PARPcaspase 3CPP32, Yama,apopain DEVD PARP, DNA-PK, SRE/BP, rho-GDI, KCθcaspase 6Mch2VEID lamin Acaspase 7Mch3, ICE-LAP3,CMH-1DEVD PARP, pro-caspase 6caspase 8MACH, FLICE, Mch5DEVD pro-caspase3,4,7,9,10caspase 10Mch4YVADcaspase 11ICH3, FLICE2CED-3已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。
caspase信号通路
Caspase家族蛋白酶的识别序列及作用底物
Caspase家族蛋白酶的结构特征 Caspase家族蛋白酶的同源性 Caspase蛋白酶在细胞凋亡中的活化顺序 Caspase蛋白酶在死亡受体介导的细胞凋亡 中起着中心的作用 Caspase蛋白酶家族
1. 起始者 (initiators), 起始Caspase在 外来蛋白信号的 作用下被切割激 活,激活的起始 Caspase对执行 者Caspase进行 切割并使之激活 2. 执行者 (executioners) 被激活的执行者 Caspase通过对 caspase靶蛋白 的水解,导致程 序性细胞死亡
Caspase-3:
1994年Fernandez-Alnemri等在BenBank表达序列标记(expression sequence tag, EST)数据库中找到一段ICE/CED-3活性中心同源的序列,用它合成探针后,为32kD的半胱氨酸蛋白酶而称之为CPP32(cysteine protease protein, 32kD) 。随后,其它学者独立地将这一蛋白基因克隆出来,并分别命名为prICE、 apopain(凋亡素)和Yama(印度传说中的死亡之神)。1996年这种蛋白酶被命名 为caspase-3。现在一般认为caspase-3是细胞凋亡过程中最主要的终末剪切酶 ,也是CTL细胞杀伤机制的重要组成部分。
Caspase-2:
细胞发生凋亡时,48kDa的caspase-2先被一种caspase-3样蛋白酶在Asp316 剪切成p33和p14,然后再缓慢地在Asp152和Asp330处剪切为p18和p12组成的 活性蛋白酶,后一过程要在2~3h后才能完成。caspase-2可能参与CTL细胞的杀 伤作用,但它并不能被颗粒酶B直接活化,必须被一种caspase-3样蛋白酶活化。
caspase家族蛋白酶的结构与功能

caspase家族蛋白酶的结构与功能按照结构同源性的大小,可以将caspase蛋白酶分为三个组,分别以caspase-1、caspase-2和caspase-3为代表。
其中最重要的是caspase-1、caspase-3 和caspase-8。
(一)caspase-1(ICE)1. ICE的结构与生物学作用ICE即IL-1b 转化酶(IL-1b converting enzyme),是单核细胞合成的一种蛋白酶,可以将34kD的IL-1b 前体(pro-IL-1b )剪切为17kD的成熟IL-1b ,这种剪切对于IL-1b 活性的发挥是必须的。
不表达ICE的细胞系转化IL-1b 基因后可以产生pro-IL-1b ,但不能分泌有活性的成熟IL-1b ;ICE特异性抑制剂可以阻断金黄色葡萄球菌刺激引起的IL-1b 的分泌。
ICE 属于半胱氨酸蛋白酶,活性中心有高活性的巯基,对氧化剂很敏感,但对丝氨酸蛋白酶、金属蛋白酶或天冬氨酸蛋白酶的抑制剂不敏感。
(1)ICE活化时的剪切过程:ICE基因定位于11q13-23,编码的ICE前体(pro-ICE)全长404aa,约45kD,蛋白酶活性中心是位于283~287位置的Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,其中Cys285是发挥酶切活性的关键残基。
在活化过程中pro-ICE在4个位点Asp103~Ser104、Asp119~Asn120、Asp297~Ser298和Asp316~Ala317进行自我催化剪切形成两个片段P20和P10,P20和P10首先形成异源二聚体,然后两个P20/P10异源二聚体再通过P10小亚基多聚化形成同源二聚体,所以ICE的活性形式是(P20/P10)2。
pro-ICE活化过程中的剪切并不是在四个酶切位点同时进行的,最先被剪切的是第三个位点(Asp297~Ser298),形成P35和P12两个片段,P35的酶切活性比pro-ICE要高,它既可以进一步在第三个酶切位点剪切其它pro-ICE,还可以剪切其它三个酶切位点,形成P20和P10两个片段,再由P20和P10形成四聚体。
Caspase-3在缺血性脑损伤中的作用

Caspase-3在缺血性脑损伤中的作用摘要】脑血管疾病是当今人类三大死亡原因之一,目前仍然缺乏有效的治疗手段,因此需要进一步探讨发病过程中的分子机制,为预防及治疗提供新的理论依据。
近来许多研究发现由半胱氨酸蛋白酶家族介导的细胞凋亡在缺血性脑损伤中起到了重要的作用,而半胱氨酸蛋白酶-3(caspase-3)被认为是细胞凋亡执行阶段的关键蛋白酶,且通过干预caspase-3 表达可减轻脑缺血的损伤程度[1]。
【关键词】缺血性脑损伤凋亡半胱氨酸蛋白酶-3前言:缺血性脑损伤是缺血性脑血管疾病中必经的病理过程,在此过程中细胞凋亡占有重要的比重。
在机体凋亡与抗凋亡过程,Caspase-3属于关键步骤;故在此对细胞凋亡、Caspase-3在缺血性脑损伤中的作用做简要综述。
1、细胞凋亡凋亡是一个基因调控的程序性细胞死亡过程,形态学特征是细胞核和细胞质发生浓缩,染色质发生断裂,不伴有炎症反应。
在这个过程中大量的基因被激活,蛋白质表达增加。
其在体内稳态平衡、神经发育、机体防疫、老化及许多疾病的发生过程中发挥重要作用,如帕金森病、老年性痴呆等神经退行性疾病与神经细胞过度凋亡有关。
依据细胞凋亡机制可将凋亡分为caspase依赖的、非caspase依赖的凋亡,其中以前者为主。
caspase依赖的途径主要有线粒体/细胞色素C通路、死亡受体通路和内质网通路[2]。
1)线粒体/细胞色素C通路:由理化因素导致的DNA损伤、生长因子缺乏、氧化应激、毒物药物等刺激信号激活。
细胞色素C作为一种促凋亡因子从线粒体膜释放入胞浆后,与胞浆中的凋亡激活因子-1(Apaf-1)的C末端及ATP结合,促使caspase-9蛋白酶家族呈“瀑布式”层层激活(caspase-9→caspase-3、6、7),引起细胞形态学上的改变使细胞最终发生凋亡[3];2)死亡受体(Fas-associated death domain,FADD)通路:由配体如TNF、Fas或TRAIL同其受体结合引起,配体受体结合后激活caspase-8,进一步激活caspase-3、caspase-6、capase-7;3)内质网通路:主要由Ca2+介导,胞内钙超载,影响内质网对钙的摄取和释放,造成内质网的应激,内质网应激诱导caspase-12表达,激活的caspase-12可进一步激活caspase-3而引发细胞凋亡。
211132692_非洲猪瘟病毒p54蛋白原核表达及多克隆抗体的制备

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报非洲猪瘟病毒p54蛋白原核表达及多克隆抗体的制备摘 要:本研究以ASFV Pig/HLJ/18分离株基因组DNA 为模板扩增tE183L 基因片段,构建重组原核表达质粒pET-21a-tE183L 。
将其转化BL21(DE3)感受态细胞后经IPTG 诱导表达可溶性p54蛋白,并将采用镍亲和层析柱和分子筛纯化的p54与弗氏佐剂等比混合后免疫新西兰大白兔,采集血清经Protein G 亲和层析纯化得到兔抗p54多克隆抗体。
研究结果表明,构建的原核表达质粒pET-21a-tE183L 可成功表达p54蛋白且纯度较高。
Western blot 、间接免疫荧光和免疫沉淀试验结果显示,纯化的抗p54多克隆抗体能特异性识别HEK293T 细胞中瞬时表达的Flag-ASFV p54蛋白和ASFV 感染肺泡巨噬细胞(PAMs )后表达的ASFV p54蛋白。
本研究成功表达和纯化p54可溶性蛋白;制备的多克隆抗体有良好的特异性,这为深入探讨ASFV p54蛋白的生物学功能奠定了基础。
关键词:非洲猪瘟病毒;p54蛋白;多克隆抗体中图分类号: S852.651 文献标志码:A 文章编号:1674-6422(2023)01-0166-08Prokaryotic Expression of African Swine Fever Virus p54 Protein and Preparationof Rabbit Anti-p54 Polyclonal AntibodiesZHAO Gaihong 1, ZHANG Taoqing 1, XIANG Zhida 1,2, ZHANG Yuanfeng 1,LI Jiangnan 1, WENG Changjiang 1(1. Division of Fundamental Immunology, State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, CAAS,Harbin 150069, China; 2. College of Animal Science, Yangtze University, Jingzhou 434025, China)收稿日期:2021-03-02基金项目:国家自然科学基金(31941002)作者简介:赵改红,女,硕士研究生,预防兽医学专业通信作者:翁长江,E-mail:**********************2023,31(1):166-173赵改红1,张涛清1,向志达1,2,张元峰1,李江南1,翁长江1(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 基础免疫创新团队,哈尔滨150069;2.长江大学 动物科学学院,荆州434025)Abstract: To prepare rabbit polyclonal antibodies (PAbs) against p54 protein of African swine fever virus (ASFV), its tE183L gene was amplified by PCR to construct the recombinant expression plasmid pET-21a-tE183L. The plasmid was then transformed into E.coli BL21(DE3) cells for protein expression with induction of IPTG. The soluble p54 was purifi ed by Ni-affi nity column and molecular sieve. The New Zealand white rabbits were immunized 4 times with the purifi ed p54 emulsifi ed with Freund's adjuvant. Rabbit serum samples were collected for purifi cation of anti-p54 PAbs with Protein G affi nity chromatography column. The presence of fl ag-tagged p54 was demonstrated in infected HEK293T cells and porcine alveolar macrophages (PAMs) as visualized in Western blot, indirect immunofluorescence assay (IFA) and immunoprecipitation (IP) using the purified anti-p54 PAbs. The prokaryotic expression and· 167 ·赵改红等:非洲猪瘟病毒p54蛋白原核表达及多克隆抗体的制备第31卷第1期非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)感染家猪和野猪引起的一种急性、烈性传染病。
Caspase3旁分泌对细胞增殖及组织再生的影响

Caspase3旁分泌对细胞增殖及组织再生的影响蛋白激酶Caspase3是动物细胞凋亡过程中的关键环节,促进细胞增殖和组织再生。
最新研究表明Caspase3旁分泌信号可特异性激活其肿瘤发生的潜能,因而搞清Caspase3旁分泌信号的机制具有重要的临床意义Caspase3本文简要回顾了Caspase3的生物性、旁分泌功能、以及与肿瘤的关系,为肿瘤治疗新途径提供思路。
标签:caspase3;凋亡;旁分泌;肿瘤蛋白激酶Caspase3是细胞凋亡的执行者。
Caspase3能通过活化或抑制细胞内激酶、磷酸酶和蛋白分子来调节细胞的信号转导。
最新研究表明,caspase3的活化能影响周边非凋亡细胞的信号传导和基因表达,促进细胞增殖和组织再生。
这种非细胞自主控制的组织再生对维持机体生理平衡至关重要。
本文将重点阐述Caspase3的旁分泌功能。
1 Caspase3的生物性1994年Fernandez-Alnemri等利用RI-PCR技术在BenBank表达序列标记(expression sequence tag,EST)数据库中找到一段ICE/CED-3活性中心同源的序列,用它合成探针后,筛选人Jurkat T 淋巴细胞cDNA 文库,从中克隆到一种新基因,因其编码分子量为32kD 的半胱氨酸蛋白酶而称之为CPP32(cysteine protease protein,32kD)。
1996 年这种蛋白酶被统一命名为caspase-3。
现在一般认为caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分。
Caspase3是一种相对分子量32KD,含277个氨基酸的蛋白酶,是IL-1β转化酶家族中最受重视的一名成员。
Caspase3基因位于染色体4q32上,有32α和32β两种编码产物。
Caspase3在凋亡过程中主要负责切割靶向蛋白质。
Caspase3作为家族中最重要的蛋白酶,其过量表达标志着凋亡进入了不可逆环节。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
收稿日期:20060726基金项目:广西大学科学技术研究基金重点资助项目(2003ZD 01);广西科技攻关项目(桂科攻0480001)作者简介:李军(1971),男,广东梅州人,助理研究员,博士研究生,研究方向为动物传染病防治与分子病毒学。
*为通讯作者。
猪Caspase -3基因的克隆及序列分析李 军, 刘 兵, 曾 兰, 罗廷荣*(广西大学动物科学技术学院, 南宁 530005)摘要:天冬氨酸特异性半胱氨酸蛋白酶(Caspase)是与细胞凋亡有关的一类蛋白酶,其中Caspase-3是细胞凋亡的最终执行者。
为了进一步研究Caspase-3的生物学功能,从P K-15细胞中提取总RN A ,用RT -PCR 方法扩增出猪Caspase-3基因,序列分析表明克隆的Caspase-3基因与GenBank 上登录的猪Caspase-3基因核苷酸与推导的氨基酸序列同源性分别为98.9%和98.6%,与人和鼠的Ca spase -3基因核苷酸、氨基酸序列同源性分别为88.6%、83.5%和87.8%、86.7%,而且猪、人、鼠的Caspase-3上的催化和剪切位点都极为保守。
关键词:Caspase-3;克隆;序列分析中图分类号:S 813.1 文献标识码:A 文章编号:1002—8161(2006)05-0584-05Cloning and sequence analysis of Caspase -3gene of pigLI Jun ,LIU Bing ,ZENG Lan ,LU O Ting -r ong*(A nimal Science and T echnology College ,Guang x i Univers ity ,N anning 530005,China )Abstract :Caspase is a kind of pr ot eases which is r elated to apopto sis ,and Caspase -3is the ultimate ex ecute in apoptosis.In or der to st udy t he bio log ical functio n o f Caspase-3,t he Caspase-3gene of pig wa s amplified by RT -PCR w it h the ex tr actio n o f RN A fr om P K -15cells.Aft er clo ning and sequencing ,the results show ed that t he nu-cleo tide a nd the deduced amino acid sequences of clo ned Caspase -3sha red 98.9%and 98.6%homo log y w ith thoseof Caspase -3published in GenBank .A s co mpar ed with that of human a nd mouse ,the Caspase -3gene homo lo gy of the nucleotide and the deduced amino acid sequences w er e 88.6%,83.5%and 87.8%,86.7%,respect ively.T he activ e sites cor responding catalysis and cleav ag e o n Caspase-3amo ng the pig ,human and mo use w ere conser vative ver y much .Key words :Caspase -3;cloning ;sequence a nalysis 天冬氨酸特异性半胱氨酸蛋白酶(aspartate-specific cy steinyl pro teinase,Caspase)家族是执行细胞凋亡的一类重要蛋白酶。
Caspase 通常以单一的蛋白酶原前体形式存在,被激活后引起一系列酶级联效应,特异性地在特定的氨基酸序列中将肽链从天冬氨酸(Asp )之后切断,还可引起染色体DNA 的降解及细胞的解体[1,2]。
在细胞凋亡信号传导的Caspase 级联反应中,Caspase-3是凋亡信号传导途径下游的一个关键效应因子,它可以被Fas /FasL 途径活化,也可经颗粒酶B 途径活化。
研究表明,Caspase-3可以导致所有类型的细胞发生染色质浓缩和形成DNA 片段化[3,4]。
此外,Caspase -3可以抑制白细胞介素18的生物学活性[5],因此Caspase-3在细胞凋亡和炎症反应中起到关键的作用。
猪的许多病毒病都涉及到细胞凋亡[6~9],有的病毒既能促进细胞凋亡又能抑制细胞凋亡;有的只能诱导细胞凋亡;而有的只能抑制细胞凋亡。
但是Caspase-3在其中的分子作用机制尚未完全清楚,本研究通过克隆猪的Caspase-3基因,以便进一步研究在病毒感染过程中Caspase -3对细胞凋亡的影响。
1 材料与方法1.1 主要试剂 RNA 抽提试剂Tr izol Reag ent 、T aq DNA 聚合酶,购自上海生工生物工程技术服务有限公司。
M-M uLV反转录酶、Rnasin、DNA回收试剂盒购自Prom eg a公司。
PM D18-T载体、限制性内切酶购自Takara公司。
DM EM购自GIBICO公司。
其他化学试剂为进口或国产分析纯产品。
PK-15猪肾细胞系和大肠杆菌感受态细胞E coli DH5 为本实验室保存。
1.2引物根据Genbank上Caspase-3(AB029345)的基因序列,设计1对引物,扩增大小为834bp,由上海生工生物工程技术服务有限公司合成。
Csapase-3-1:5, AT GGAGAACA ATAAAACCT3,Csapase-3-2:5, CTAGT GAT A AAA GT AGAGT TC3。
1.3 模板的制备 取PK-15细胞进行总RNA的抽提,方法按T rizol说明书操作。
1.4 RT-PCR 取16 l总RN A置于反应管内,加1 l(25Pmol/ l)的反向引物混匀,于PCR仪内70℃5min,90℃5m in后迅速放入冰浴5min。
依次加入5×RT Buffer,dNT P,Rnasin,M-M uLV反转录酶,至总量25 l,42℃反转录1h。
PCR反应在50 l反应体系中进行,扩增的条件为95℃5m in预变性;95℃1min,50℃1m in,72℃1m in,共进行35个循环;72℃10min。
1.5 基因克隆及序列分析 PCR产物经1%琼脂糖凝胶电泳,用DNA回收试剂盒将扩增的目的片段纯化后连接到PM D18-载体,4℃过夜,然后转化E co li DH5 ,涂布于Amp/X-gal LB平板上,37℃培养过夜,经PCR和双酶切鉴定。
阳性克隆送上海生工生物工程技术服务有限公司测序。
用DNAstar 分析软件对测得的核苷酸序列和推导的氨基酸序列与其它种类的Caspase-3进行同源性比较和分析。
2 结果2.1 Caspase-3基因的RT-PCR扩增 从PK-15细胞中抽提总RNA,经RT-PCR扩增后得到一条834bp的片段,扩增产物大小与预期结果相符(图1)。
2.2 Caspase-3基因的克隆与鉴定 RT-PCR扩增的Caspase-3产物与PM D-18T载体连接后转化E coli DH5 ,小量抽提重组质粒,重组质粒经PCR 扩增产生一个834bp的片段。
而经HincII和SacI 双酶切后增加了2个酶切位点的长度,所以产生了2660bp和866bp的2个片段,证明是阳性重组质粒(图2)。
2.3 测序结果及序列分析 测序结果表明,扩增出的834bp的猪Caspase-3基因是一个完整开放阅读框(ORF),编码277个氨基酸,其中亲水性氨基酸占30.3%,疏水性氨基酸占29.2%,碱性氨基酸占13%,酸性氨基酸占13.4%。
推断的蛋白分子量约为32KDa(图3)。
它与GenBank上登录的猪Cas-pase-3基因的核苷酸序列与推导的氨基酸序列同源性为98.9%和98.6%。
与人、鼠Caspase-3基因的核苷酸序列与推导的氨基酸序列同源性分别为88. 6%、83.5%和87.8%、86.7%。
克隆的猪Caspase-3基因推断的氨基酸序列上含有His121和Gln161-Ala162-Cy s163-Arg164-Gly165(QACRG)五肽这两个参与将底物切割的催化位点以及加工酶原前体成为成熟的酶亚基的两个剪切位点Asp28和Asp175(图4)。
AT G GAG AAC AAT AAA ACC T CA GT G GAT T CA AAA TCC AT T AAA ACT TT G GAG AC A M E N N K T S V D S K S I K T L E T AAG ATC T TA CAT GGA AGC AAA T CA GT G GAC TC T GGA AT A T CC T TG GAT GT C AGT K I L H G S K S V D S G I S L D V S T AC AAA AT G GAT T AT CCT GAA AT G GGT T TA TGT ATA AT A ATT AAT AAT AAG AAC Y K M D Y P E M G L C I I I N N K N T T T GAT AAA AAT AC C GGA ATG GCA TGT CGA TC T GGT ACA GAT GT G GAT GCT GCAF D K N TG M A C R S G T D V D A AAAT CT C AGG GAG AC C TT C ACA AAC TT G AAA T AT GAA GT C AGG AAT AAA AAT GAT N L R E T F T N L K Y E V R N K N D CTT ACA C GT GAA GAA AT T TT G GAG TT A AT G CAC AGT GT T T CT AAA GAA GAC CAT L T R E E I L E L M H S V S K E D H AGT AAA AGG AGC AGT TT T ATT TGC GT G C TT CTA AGC C AT GGT GAA GAA GGA AAA S K R S S F I C V L L S H G E E G K AT T TT T GGA AC A AAT GGA C CT GT T GAT C TG AAA AA A T T A ACA AGT T TC T T C AGAI F G T N G P V D L K K L T S F F RGGG GAC T GT TGT AGA ACT CT A AC T GGC AAA CC C AA A CT C T TC AT A ATT CAG GCCG D C C R T L T G K P K L F I I Q ATGC CGA GGC AC A GAA T T G GAC T GT GGG AT T GAG ACG GAC AGT GGG ACT GAA GATC R G T E LD C G IE T D S G T E DGAC ATG GCG TGT CAG AAA ATA CCA GT T GAG GC A GAC TT C TT G T AT GC A T AT TC TD M A C Q K I P VE A DF L Y A Y SACA GCG CCT GGT T AC T AT T CC T GG CGA AAT TCA AAG GAC GGA TC C TGG T T C ATC T A P G Y Y S W R N S K D G S W F IC AG TC A C TT TGT GCA GCG CT G AAA CAG T AC GCT CA C AAG C CT GAG CT T AT G CACQ S L C A A L K Q Y A H K P E L M H AT T CT T ACT CGG GTT AAC CGA AAG GT A GCA GT A GAA TT C GAG TC C TT T T CT ACTI L T R V N R K V A V E F E S F S TGAC T CT ACT TT T CAT GCA AAG AAA CAG AT T CCA T GT AT T GTG TC C AT G CTC AC AD S T F H A K K Q I P C I V S M L TAAA GAA CT C TAC T TT T AT CAC T AGK E L Y F Y H*图3 Caspase-3核苷酸序列及其推导的氨基酸序列3 讨 论Caspase家族蛋白酶可以经一系列的级联反应,通过不同的信号途径参与多种类型的细胞凋亡[10],其中Caspase-3切割底物直接介导凋亡是细胞凋亡的一个重要途径[11,12]。
