聚合反应工程基础第二章
聚合物反应工程基础知识总结
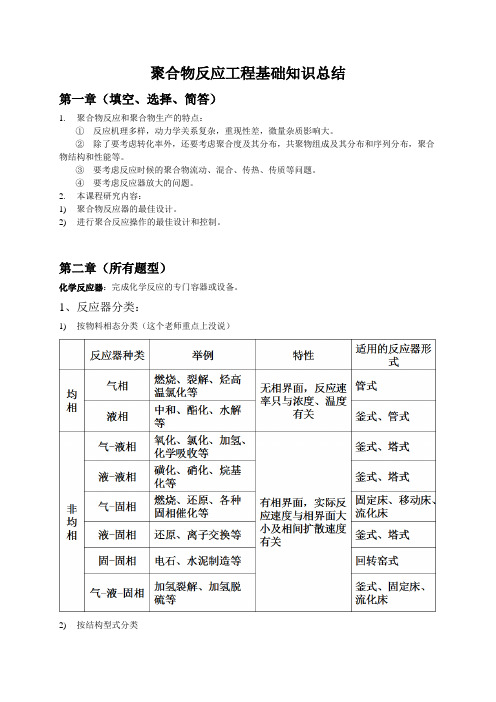
聚合物反应工程基础知识总结第一章(填空、选择、简答)1.聚合物反应和聚合物生产的特点:①反应机理多样,动力学关系复杂,重现性差,微量杂质影响大。
②除了要考虑转化率外,还要考虑聚合度及其分布,共聚物组成及其分布和序列分布,聚合物结构和性能等。
③要考虑反应时候的聚合物流动、混合、传热、传质等问题。
④要考虑反应器放大的问题。
2.本课程研究内容:1)聚合物反应器的最佳设计。
2)进行聚合反应操作的最佳设计和控制。
第二章(所有题型)化学反应器:完成化学反应的专门容器或设备。
1、反应器分类:1)按物料相态分类(这个老师重点上没说)2)按结构型式分类类型优点缺点举例釜式反应器优点:结构简单,加工方便,传质、传热效率高,适应性强,操作弹性大,连续操作时温度、浓度易控制,产品质量均一,适于多品种、小批量生产。
要求达到高转化率时,反应器容积大顺丁橡胶,丁苯橡胶,聚氯乙烯管式反应器结构简单、加工方便,耐高压,传热面大,热交换效率高,容易实现自动控制对慢速反应管子要求长且压降大高压聚乙烯的生产,石脑油的裂解,轻油裂解生产乙烯塔式反应器挡板型: 适于快速和中速反应过程,结构复杂固体填充式: 结构简单,耐腐蚀,适于快速和瞬间反应过程不同塔不同,书上没说,具体见老师ppt吧o(╯□╰)o苯乙烯的本体聚合,已内酰胺的缩聚流化床反应器传热好,温度均匀,易控制催化剂的磨损大,床内返混大,高转化率难丙烯氨氧化制丙烯腈,萘氧化制苯酐,聚烯烃的生产3)按操作方式分类间歇反应器:在反应之前将原料一次性加入反应器中,直到反应达到规定的转化率,即得反应物,通常带有搅拌器的釜式反应器。
优点是:操作弹性大,主要用于小批量生产。
连续操作反应器:反应物连续加入反应器产物连续引出反应器,属于稳态过程,可以采用釜式、管式和塔式反应器。
优点是:适宜于大规模的工业生产,生产能力较强,产品质量稳定易于实现自动化操作。
半连续操作反应器:预先将部分反应物在反应前一次加入反应器,其余的反应物在反应过程中连续或断连续加入,或者在反应过程中将某种产物连续地从反应器中取出,属于非稳态过程。
聚合反应工程基础(全套课件567P)

1.1.1 高分子化合物的分类和命名
2. 结构系统命名法:由(International Union of Pure and Applied
Chemistry, IUPAC)提出
I 26
1.1.2 高分子化合物的基本特点
H--NH(CH2)6NH--CO(CH2)4CO--OH
重复结构单元
结构单元
结构单元
n
例2:尼龙66 的重复单元与结构单元
----( CH2--CH=CH--CH 2 -)--(-CH --CH-)---2 y x
n
例3:丁苯橡胶 的重复结构单元与结构单元
I 24
1.1.2 高分子化合物的基本特点
实际上,分子量的大小并无明确的界限,一般
-- -- - --< 1,000 < - - - - - - < 10,000 < - - - - - < 1,000,000 < - - - - 低分子物 低/齐聚物 (Oligomer) 高聚物 (Polymer)
PS
PVC PTFE PAA PET
polystyrene
Polyvinyl chloride Polytetrafluoroethylene polyacrylic acid polyester
聚甲基丙烯酯 甲酯
聚醋酸乙烯 聚乙烯醇 聚丁二烯 聚丙烯腈
PMMA
PVAc PVA PB PAN
polymethylmet hacrylate
主要参考书目
1. 陈甘棠著,《聚合反应工程基础》,中国石化出版社,1991 2. 史子瑾主编,《聚合反应工程基础》,化学工业出版社, 1991 3. C.McGreavy(Ed),“Polymer Reactor Engineering”,Blackie
第一章 绪论 第二章 聚合物反应工程(2-1,2-2)

第一章 绪论
聚合反应工程研究的内容为: 1、进行聚合反应器的最佳设计 ; 2、进行聚合反应操作的最佳设计和控制;
第一章 绪论
本课程分为八章,由理论到实际,完成对聚合反 应工程内容讲授。 下面是各章节的目录
聚合物反应工程
第一章 第二章 第一节 第二节 第三节 第四节 第五节 第六节 第七节
聚合物反应工程
第三章 第六节 第七节 第八节 第九节 第十节
聚合反应工程分析 均相自由基共聚 缩聚反应 非均相聚合反应 流动与混合对聚合物分布的影响 聚合过程的凋节与控制
聚合物反应工程
第四章 化工流变学基础
第一节 第二节 第三节 第四节 第五节
非牛顿流体 非牛顿流体的流变特性 非牛顿流体在圆管中层流流动的分析 非牛顿流体在圆管中湍流流动的分析 非牛顿流体流变性的测量
第一节 化学反应和反应器分类
平推流和理想混合流是为了分析方便而人为的加以 理想化的二种极端的流动型态,平推流反应器中不 存在返混,而理想混合流反应器中返混最大,工业 上所使用的实际反应器由于种种原因而产生死角, 沟流,傍路、短路及不均匀的速度分布使之偏离理 想流动,这种偏离谓之非理想流动。相应的反应器 即为非理想流动反应器,在其中存在部分的返混。 在工程设计上,常常把比较接近某种理想流动型态 的过程当作理想流动来处理。
第一节 化学反应和反应器分类
通常可用幂函数的形式表示:
式中rA为反应速率常数。a1 a2为实验测定 的常数.反应的总级数为a1+ a2 对于基元 反应a1 a2分 别与计算方程式中的a、b 相 等。若反应是由若干个基元反应组成的反 应级数需用实验测定。
第二章 聚合反应工程基础(2-3、2-4)

稳定性是指对系统外加一个干扰,使过 程失去平衡,当外干扰消失后,若过程 有能力回复到原来的状态,则过程具有 稳定性,否则是不稳定。稳定性是系统 的一种动态特征。 自衡能力
第四节 理想混合反应器的热稳定性
如聚合过程中的爆聚,特别对于那些放 热量大,初始反应物浓度高,反应速度 快的反应过程,更应充分注意热稳定性 问题。
聚合反应工程
第三节 理想反应器设计
(2)连串反应
第三节 理想反应器设计
第三节 理想反应器设计
将A与B迅速混合
有三种加料方式 A慢慢加入B中 B 慢慢加入A中 将A与B迅速混合 S逐渐增多 R逐渐增多 R S
第三节 理想反应器设计
第三节 理想反应器设计
第三节 理想反应器设计
结论 (1)对于单一反应,因不存在产物分布 问题,所以在反应器选择时主要考虑容 积效率大小。 (2)对于复杂反应,在反应器的选择时 提高目的产物的收率。 (3)温度对复杂反应的产物分布也有重 大的影响。
第四节 理想混合关系, 所以反应过程的热变化对化学反应有决 定性的影响,反应器的设计必须考虑温 盘的控制。 另一方面,反应器操作时,总会遇到温 度的失控,偏离设定的操作条件,此时 反应器能否正常操作与反应器的热稳定 性有很大的关系。
第四节 理想混合反应器的热稳定性
这是热稳定性的又一条件。
第四节 理想混合反应器的热稳定性
第四节 理想混合反应器的热稳定性
第四节 理想混合反应器的热稳定性
第四节 理想混合反应器的热稳定性
第四节结束
第四节 理想混合反应器的热稳定性
• 当体系处于稳态时,放热度率与 除热速率应相等。
第四节 理想混合反应器的热稳定性
聚合反应工程基础(全套课件567P)

I
1
传递过程 化学工程 (三传一反) 单元操作 化学反应工程
高分子化学 高分子物理 高分子科学与工程 聚合反应工程 聚合物加工工程
聚合反应工程
I
2
•Black box (experiential) model •Mechanism-based model
基本问题:
均相自由基均聚 均相自由基共聚 非均相自由基聚合 连续聚合 缩合聚合 Modeling? 聚合反应速度 Computable! 聚合物分子量及其分布 Designable! 共聚物组成及其分布 Operable! 聚合物粒径及粒径分布 Controllable!
均聚物:“聚(Poly)”+单体名,如:
乙烯 聚乙烯 (Polyethylene,PE) 甲酯聚甲基丙烯酸甲酯(Polymethyl methacrylate, PMMA)
甲基丙烯酸
也有以假想单体为基础命名,如聚 乙烯醇(polyvinyl alcohol)
[CH2
CH] n OH
乙烯醇为假想的单体,聚乙烯醇实际上是聚醋酸乙烯(polyvinyl acetate)的水解产物。 I
甘油+ 邻苯二甲酸酐
合成橡胶:
丁二烯(Butadiene)+ 苯乙烯(Styrene) 丁二烯(Butadiene)+ 丙烯腈(Acrylonitrile) 乙烯(ethylene)+丙烯(propylene)
I
乙丙橡胶(EPR)
15
1.1.1 高分子化合物的分类和命名
2) 以高分子链的结构特征命名
4. N.A.Dotson et al., “Polymerization Process Modeling”, VCH,
聚合物反应工程基础第二章

Company Logo
Company Logo
4. 复合反应
复合反应:是几个反应同时进行的,常
见的复合反应有平行反应,连锁反应,平行- 连锁反应等。
k1 A k2
R
A
k1
R
k2
S
S
Company Logo
⑴ 平行反应
k1 A k2 R S
rA =
dCA = k1CA + k2CA = ( k1+k2 )CA dt
Company Logo
例1 某厂以己二酸与己二醇等摩尔缩聚反应生产醇酸 树脂。用间歇反应器,反应温度70℃,催化剂为H2SO4。 已知:cA0=4 kmol· -3;反应动力学方程为: m
m3· kmol-1· -1 min 若每天处理2400kg己二酸,每批操作辅助生产时
间为1h,反应器装填系数为0.75,求:
第二章 化学反应工程基础
Company Logo
3. 等温恒容单一反应动力学方程
⑴ 一级不可逆反应
A
1 dnA rA= V dt
恒容
S
dCA 一级 KCA dt
对于等温系统,k为常数,初始条件: t=0,CA=CA0
1 lnCA0 1 1 t= = ln 1-x K CA K A
Company Logo
tr=tt-t‘
④ 求cAf:
⑤ 若计算的cAf小于任务要求的cAf则满足要求
rA = -
1 V
nA 0
dn A dt
= dx A dt
dx A dt
1 V
dn A0 (1-x A ) dt
= V 0 (1+ε A x A )
CA0 = 1+ε A x A
聚合反应工程讲课课件1.2

高聚物流体流动曲线图上的三个区域
1、第一牛顿区 低切变速率,曲线的斜率n=1, 符合牛顿流动定律。该区的黏度通常 称为零切黏度μ 。 2、假塑性区(非牛顿区) 流动曲线的斜率n<1,该区的黏度为表观黏度μ a,随着切变 速率的增加, μ a值变小。通常聚合物流体加工成型时所经 受的切变速率正在这一范围内。 3、第二牛顿区 在高切变速率区,流动曲线的斜率 n=1,符合牛顿流动定 律。该区的黏度称为无穷切剪切黏度或极限剪切黏度 μ∞。 从聚合物流动曲线,可求得 μ 、μ ∞和 μ a。
lg 0 lg A d lg C
A, d 均为常数,将lg 0 对 lg C 作图,得图2-18。
浓度对非牛顿流体特性的影响
lg 0 lg A d lg C
Cc为临界浓度,低于Cc 的溶液为牛顿型,高于 Cc的溶液为非牛顿型。 其斜率随剪切速率的增 加而下降。
4 3 2 1
4
T
不同敏感性。 柔性链的黏度随剪切速率增加明显下降。 原因:链柔顺,易取向。如聚氯醚。 刚性链则不敏感。 原因:链刚性,分子间力大,不易受剪 切力而取向。
Thank you !
非牛顿流体流动曲线比较
E:屈服-假塑性流体
D:宾汉塑性流体 F:屈服-胀塑性流体
y
B:假塑性流体
A:牛顿流体
C:胀塑性流体
剪切速率
图2-2(b)各种不同流体的流动曲线
非牛顿流体分类与特征
非依时性非牛顿流体
1.假塑性流体和胀塑性流体 2.宾汉塑性流体
依时性非牛顿流体
1.触变性流体 2.震凝性流体
高聚物流体的流变性和黏弹性
低分子液体流动所产生的形变是完全不 可逆的,而高聚物在流动过程中所发生 的形变中: 只有一部分(黏性流动)是不可逆的。 因为高聚物的流动并不是高分子链之间 的简单的相对滑移的结果,而是各个链 段分段运动的总结果。在外力作用下, 高分子链顺外力场有所伸展,这就是说, 在高聚物进行黏性流动的同时,必然会 伴随一定量的高弹形变,这部分高弹形 Model of a monomer 变显然是可逆的,外力消失后,高分子 链又要蜷曲起来,因而整个形变要恢复 一部分。
第一章 聚合反应工程基础1-2

返混:反应器内不同年龄的流体微元间的混合。
平推流反应器
• 反应器内每一微元体积中的流体均以同样 的速度向前移动;
• 稳态操作时,反应器各个截面上物料浓度 不随时间而变化;
• 物料浓度沿流动方向而改变,反应速率随 空间位置改变。
理想混合流反应器
• 强烈搅拌作用,刚进入反应器的物料微元 与器内原有的物料微元瞬时充分混合,各 点浓度相等,出口流体组成与器内相同。
• 微元停留时间分布 • 管径小、流速大的管式反应器作为平推流
反应器处理;带有强烈搅拌的釜式反应器 作为理想混合流反应器。
2.2 均相反应动力学 2.2.1 相关术语
20世纪30年代,丹克莱尔(Damhohler)论述了扩散、流体流 动和传热对反应器产率的影响——奠定了基础 梯尔(Thiele)和史尔多维奇对扩散反应问题作了开拓性的工作
40年代,霍根(Hougen)、华生(Waston)著作《化学过程原理》 法兰克-卡明聂斯基著作《化学动力学中的扩散与传热》问世 1957年,荷兰阿姆斯特丹第一次欧洲反应工程会议——确立 了化学反应工程的名称
1.3 聚合物合成材料的发展
1910年,美国正式工业化生产酚醛树脂,随后相继合成出丁 苯橡胶、丁腈橡胶、氯丁橡胶、尼龙-66、聚酯纤维、高压聚乙 烯和聚氯乙烯,产量和品种在世界大战中得到快速发展。 1920年,H. Staudinger提出了“高分子化合物的概念,建立 了大分子链的学术观点并系统研究了加聚反应。
应机理; • 不同操作方式对聚合过程的影响; • 粘度对聚合反应的影响;
……
3)化工流变学基础 • 非牛顿流体的分类、流变特性;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5)多级串联全混流反应器
(1)代数法
等温一级不可逆反应
rAi
C A1
A S
1
V1 C A0 C A1 C A0 C A1 v0 rA1 C A1
dC Ai kC Ai dt
C A0 1 1
C A2
C A0 C A1 1 2 1 1 1 2
对第i级反应器中的A组分进行物料衡算
v0C Ai 1 v0C Ai rAi Vi
Vi C Ai 1 C Ai C A0 xAi x Ai 1 i v0 rAi rAi
其中
C Ai 1 C A0 1 xAi 1
C Ai C A0 1 x Ai
dt
nA0
dxA dt
t C A0
0
C A dC dxA A CA0 r rA A
动力学方程式积分
2)间歇反应器
图解积分
图2-10恒容情况下间歇反应器的图解计算。
2)间歇反应器
(1)反应器容积
操作周期=反应时间+辅助时间
tT tR ta
有效容积=每小时处理物料的体积×操作周期
dt
反应达平衡equilibrium时,k1=k2,dC A 0
k1C Ae k2CRe k2 C A0 C Ae C Ae k2C A 0 k1 k2
C A0 C Ae k1 k2 t ln C A C Ae
2)等温恒容单一反应
一级可逆反应
A R
k2 k1
rA
dCA k1CA k2CR dt
若t=0,CR0=0,则CR=CA0-CA带入上式:
dC A k1C A k2 C A0 C A dt k1 k2 C A k2C A0 rA
k1C A0 k1 k2 t ln k1 k2 C A k2C A0
2)反应器的分类
按物料的相态分: (1)均相---均相反应无相界面,反应速率只与T或浓度有 关; (2)非均相---非均相反应有相界面,实际反应速率与相 界面大小及相见扩散速率有关。
按反应器的结构型式分: 釜式、管式、塔式、固定床、流化床、回转筒式、喷嘴式 等
3)反应器操作方式
间歇,半间歇,连续式
物料衡算 热量衡算 动量衡算 (压力差小,可忽略) 动力学方程
1)基本原理
物料衡算——质量守恒定律 流入量= 流出量 +反应消失量 +累积量
间歇式反应器:流入量=0,流出量=0; 稳态操作连续流动反应器:累积量=0; 非稳,连续,半连续:都不为零。
热量衡算——能量守恒定律 Q物料流入+Q反应过程的热效应 = Q物料流出 +Q反应系统与外界交换+Q累积
3)复合反应
平行反应
k1
A
k2
R S
dC rR R k1CA dt
k1 k2 t
dC rA A k1C A k2C A k1 k2 C A dt
ln CA k1 k2 t C A0
rS
dCS k2C A dt
C A C A0e
2)等温恒容单一反应
一级不可逆反应
A→S
dC A rA kC A dt
恒温系统,k为常数;初始条件,t=0,CA=CA0,对上式积 分:
1 C A0 1 1 t ln ln k C A k 1 xA
2)等温恒容单一反应
二级不可逆反应
A+B→S
dC A rA kC ACB dt
V2 C A1 C A 2 C A0 x A 2 x A1 2 v0 rA2 rA2
1 2
图2-19 不同大小二个理想混合反应器的组合。
5)多级串联全混流反应器
(3)优化多级全混釜的体积
②优化使反应器总体积最小必须有SKLMN最大
“最大矩形法”求最佳中间转化率XA:
C A C A0 1 xA C A0 xA C A0 C A
V 1 v0 C A0 C A C A0 C A C A0 x A v0 v0 rA rA rA
4)全混流反应器
图2-14 理想混合反应器的图rM
rA rB rL rM a b l m
1)反应速率
化学反应的速率方程式,通常可用幂函数的形式
1 dnA a a rA kC A1 CB2 V dt
阿伦尼乌斯关系式
k A0e
E RT
A0为常数,称为频率因子;E为活化能,J/mol; R为气体常数,R=8.31 J/(mol· K)
理想混合流反应器:
加入反应器的物料微元在强烈搅拌作用下与器内原有的物料微元瞬 时达到充分混合,器内各点浓度相等且不随t变化,出口流体的组成 与器内相同;存在强烈的返混。 返混=无穷大 停留时间分布
2.均相反应动力学 1)动力学方程的建立
2)等温恒容单一反应
3)复合反应
1)动力学方程的建立
实验数据的获得:物料浓度的测定,C~t
2)等温恒容单一反应
二级可逆反应
A+B S+P
rA dC A k1C ACB k2CS CR dt
若t=0,CR0= CS0=0,CA0= CB0,上式积分得:
x Ae 2 x Ae 1 x A K kt ln mC A0 x Ae x A
作图 ln
CA ~t C A0
可得斜率为k1+k2的直线
CR CR 0 k1 CS CS 0 k 2
+
做CR~CS图,直线斜率为k1/k2
k1 k k t CR C A0 1 e 1 2 k1 k2
解得k1,k2
k2 k k t CS C A0 1 e 1 2 k1 k2
4)全混流反应器(理想混合反应器)
5)多级串联全混流反应器
6)反应器型式和操作方法的评比和选择
1)基本原理
几个概念: 反应时间 停留时间 停留时间分布 平均停留时间 返混 平推流 全混流
1)基本原理
反应器的三个基本要求:容积、传热、混 合 反应器设计的目的:满足反应器的要求 反应器设计需要联立:
间歇:Q物料流入=0,Q物料流出=0; 稳态操作连续流动反应器: Q累积=0。
2)间歇反应器
(1)反应时间 对于微元时间dt内的物料衡算式: dnA 0 物料A的反应消失量 +累积量 =0 即 rAV dt
rAV dnA dt
xA
d nA0 1 xA
1 dni 恒容 dCi ri V dt dt
对于反应: aA bB lL mM 其各组分的反应速率分别为:
rA dC 1 dnA A V dt dt
rL
1 dnL dCL V dt dt
1 dnM dCM V dt dt
dC 1 dnB rB B V dt dt
积分法
推测动力学方程,得到C~t的直线,实验数据拟合。 试差过程。
微分法
dC A kf C A (1)假定反应机理 dt rA
(2)将实验所得的C~t数据绘图,在所得曲线相应C位置求 曲线的斜率dCA/dt,该斜率就代表该组成下的反应速率 (3)将所得各点dCA/dt对f(CA)作图,若所得直线通过原点, 说明假定的机理与实验数据相符,是,求出待定系数k,α, β。否则需重新进行。 (4)lg(dCA/dt)~lg CA
各级反应器体积相等
图2-16 多级串联理想混合反应器的图解计算。
5)多级串联全混流反应器
各级反应器体积不等
各级反应器温度不等
5)多级串联全混流反应器
表2-12 不同型式反应器体积比
5)多级串联全混流反应器
(3)优化多级全混釜的体积
①两只不等容全混流反应器
1
V1 C A0 C A1 C A0 xA1 v0 rA1 rA1
第二章
1.引言
化学反应工程基础
2.均相反应动力学
3.理想反应器的设计
4.理想混合反应器的热稳定性
5.连续流动反应器的停留时间分布
6.流动模型 7.停留时间分布与化学反应
1. 引言 1)反应速率
2)反应器分类
3)反应器操作方式 4)两种连续流动形态的理想反应器
1)反应速率
定义:以反应体积为基准时(均相反应),单位时间,单 位反应体积中所生成(或消失)的某组分的摩尔数
C A f dC V A CA 0 v0 rA
V 1 FA0 C A0 C A0
CA f
CA0
dC A rA
(2)反应器体积 V=v0τ
图2-12 平推流反应器的图解计算。
4)全混流反应器
稳态下: 反应物A流入速度=反应物A流出速度+消失速度
v0C A0 v0C A rA V
A和B的消失量是相等的,故:
C A 0 x A C B 0 xB
令: M CB 0
C A0 ( M 1)
rA
d C A 0 x AC A 0 dt
C A0
2 kC A0 1 x A M x A
dx A dt
CB 0C A M xA 1 1 kt ln ln C A0 M 1 M 1 x A C A0 CB 0 C A0CB
