化学式及离子符号书写练习
化学式及离子符号的书写训练

化学式及离子符号的书写训练
氢氧根:硝酸根碳酸根:硫酸根:铵根:
氢氧根离子:硝酸根离子:碳酸根离子:硫酸根离子:铵根离子:氢离子:银离子:钠离子:氟离子:钾离子:钙离子:镁离子:钡离子:锌离子:铁离子:亚铁离子:铜离子:
氢气:氧气:氮气:臭氧:
二氧化碳:一氧化碳:五氧化二磷:四氧化三铁:二氧化氮:一氧化氮:二氧化硫:三氧化硫:
硫酸:碳酸:硝酸:盐酸:
氯化钠:氯化钾:氯化铁:氯化亚铁:
氯化铜:氯化银:氢氧化钠:氢氧化钾:
氢氧化铁:氢氧化铜:氢氧化镁:氢氧化锌:
碳酸钠:碳酸镁:碳酸钾:碳酸钡:
硫酸钠:硫酸镁:硫酸钾:硫酸铜:
硫酸亚铁:硫酸铁:硫酸钡:硝酸钠:
硝酸钾:硝酸银:硝酸铁:硝酸钡:
氯化铵:硫酸铵:硝酸铵:碳酸铵:。
化学式书写与化学方程式配平专项练习

+2 Mg__________________________ +2MgO______________________________元素符号、原子团及化学式的书写及练习一、写出各元素的元素符号或名称及部分常见原子团离子的符号。
1、写出下列各种符号所表示的意义:“Cu” 表示①__________________ ②_________________________ “H 2O” 表示①②③④“5H” 表示①“2CO 2”表示①2、写出下列各种符号或指出符号中的“2”的意义: 三个铁原子 五个五氧化二磷分子液态氮铝离子 氯离子 二个铵根离子2Mg___________________________ Mg 2+______________________________SO 2___________________________2O,O 2-, 2.O 2-,O 2, 2. O 2 ,四、熟练书写化学式:(写出下列各种物质的化学式)1、单质: 氢气 氯气 氮气 氦气 氖气 氩气铜 锰 镁 金刚石 固态磷硫磺 臭氧气体 2 、化合物:氧化物: 一氧化碳 水 二氧化硫氧化镁氧化铁 氧化亚铁氧化铜氧化铝氧化锌 氧化亚铜 硫化物:(硫元素显示-2价)硫化镁 硫化锌硫化铁硫化亚铁硫化钠 氯化物(又称盐酸盐)氯元素显示-1价 氯化镁 氯化锌氯化铁 氯化亚铁氯化钠 氯化铜氯化铵 氯化氢(盐酸)氢氧化物(含OH )氢氧化镁 氢氧化锌 氢氧化铁氢氧化铝氢氧化钠 氢氧化铜 氢氧化钾 氢氧化钡硝酸盐(含硝酸根NO 3)硝酸镁 硝酸锌硝酸铁 硝酸钾硝酸钠硝酸铜 硝酸铵硝酸银硝酸钙硝酸铝硝酸钡硝酸亚铁硫酸盐(含SO4)硫酸镁硫酸锌硫酸铜硫酸铁硫酸钠硫酸钾硫酸铵硫酸钡碳酸盐(含CO3)碳酸镁碳酸锌碳酸钙碳酸钡碳酸钠碳酸钾碳酸氢钠碳酸氢铵磷酸盐(含PO4)磷酸镁磷酸锌磷酸铜磷酸铁磷酸钠磷酸钾磷酸铵磷酸钡酸类(H+与某些阴离子结合而成的化合物)盐酸(氯化氢)氢硫酸(硫化氢)氢氟酸(氟化氢)硫酸硝酸碳酸亚硫酸磷酸酸式盐(含HCO3或HSO4或HPO4)碳酸氢钠碳酸氢钙碳酸氢钡碳酸氢铵硫酸氢钠硫酸氢钙硫酸氢钡硫酸氢铵磷酸氢钠磷酸氢二钙磷酸氢钡磷酸氢铵配平化学方程式的专项练习一、最小公倍数法:(找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。
(整理)高中离子方程式经典练习题

(整理)高中离子方程式经典练习题离子反应问题及离子方程式的书写离子方程式的书写步骤:1、写:书写完全正确的化学方程式;2、拆:将能拆的化学式(完全电离的酸、碱、盐及融化态的金属氧化物)拆为离子符号;3、删:将未参加离子反应的离子从两边删掉(等个数),整理(系数应为最简整数比);4、查:⑴质量守恒、⑵电荷守恒、⑶注明“↑”“↓” ;⑷ 、为氧化还原反应时、氧化剂与还原剂得失电子数应相等。
? 书写相关知识1、完全电离的酸是指:HCl 、H 2SO 4、HNO 3、HI 、HBr 、HClO 4等强酸;中强酸(H 2SO 3、H 3PO 4),弱酸(H 2CO 3、H 2S 、HF 、HclO 、CH 3COOH 、H 2SiO 3)则不能拆。
2、完全电离的碱是指:NaOH 、KOH 、Ca(OH)2、Ba(OH)2等强碱、中强碱的溶液;而 NH 3?H 2O 及Cu(OH)2、Fe(OH)3等难溶性弱碱则不能拆。
3、完全电离的盐是指:所有易溶、可溶及微溶性的盐的溶液。
附:盐的溶解性规律:钾盐、钠盐、铵盐、硝酸盐,二元酸的酸式盐、磷酸的二氢盐均易溶。
碳酸盐、磷酸盐、硅酸盐的正盐中只有钾盐、钠盐、铵盐溶;氯化物中只有AgCl 不溶;硫酸盐中只有PbSO 4 、BaSO 4不溶,但CaSO 4、Ag 2SO 4为微溶。
4、特殊情况处理:微溶物:作反应物时,为溶液时拆,作产物时不拆。
浓硫酸作反应物时,不能拆,而浓盐酸、浓硝酸则必须拆。
酸式酸根离子只有HSO 4-必须拆,而HS -、HCO 3-、HSO 3-、HPO 42-、H 2PO 4-则不能拆。
5、凡单质、氧化物、气体、难溶固体、弱酸、弱碱、水等难电离的及非电解质均不能拆。
练习题一选择题1、下列电离方程式错误的是()A NaHCO 3 ====Na + +H ++CO 32―B NaHSO 4 ====Na + +H ++SO 42―C MgCl 2 ====Mg 2++2Cl ―D B a (O H )2 =====Ba 2++2OH ―2、离子方程式CO 32-+ 2H += H 2O + CO 2↑中的CO 32-代表的物质可以是() A 、CaCO 3 B 、NaHCO 3 C 、Na 2CO 3 D 、BaCO 33、下列化学方程式中,不能用离子方程式 Ba 2++SO 42―====BaSO 4 ↓A .Ba(NO 3)2+H 2SO 4==BaSO 4↓+2HNO 3B .BaCl 2+Na 2SO 4==BaSO 4↓+2NaClC .BaCO 3+H 2SO 4==BaSO 4↓+H 2O+CO 2↑D .BaCl 2+H 2SO 4==BaSO 4↓+2HCl4.下列各组离子反应可用H ++OH -H 2O 表示的是()A .氢氧化钡和硫酸B .氢氧化铁和盐酸C.硝酸和氢氧化钠D.硫酸氢钠和氢氧化钠5、下列离子方程式,书写正确的是()A、盐酸与碳酸钡反应 CO32-+2H+==CO2↑+H2OB、硫酸铜溶液中滴加氢氧化钡溶液Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓C、硝酸银溶液中加入铜粉Ag++Cu==Cu2++Ag↓D、铁与稀盐酸反应2Fe+6H+==2Fe3++3H2↑6、下列离子方程式书写正确的是()A、氧化铜与盐酸反应O2― +2H+ ====H2OB、碳酸氢钠溶于盐酸:HCO3-+ H+ = H2O + CO2↑C、硫酸氢钠溶液与NaOH溶液混合:HSO4- + OH- = H2O + SO42-D、石灰石溶于硝酸:CO32-+ 2H+ = H2O + CO2↑7.下列反应的离子方程式中,正确的是()A.向硝酸银溶液中加盐酸Ag++C1-===AgCl↓B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑C.盐酸跟氢氧化镁反应:H++OH-===H2OD.碳酸镁跟硫酸反应:MgCO3+2H+===Mg2++H2O+CO2↑8.下列离子方程式中,正确的是A.碳酸氢钙溶液与盐酸反应Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑B稀盐酸和碳酸钙反应 CO32- + 2H+ = CO2↑ + H2OC碳酸钠溶液与醋酸反应 CO32-+ 2H+ = CO2↑ + H2OD石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O9.下列反应的离子方程式中,正确的是()A、氢氧化钡溶液和稀硫酸Ba2++OH-+H++SO42-=BaSO4↓+2H2OB、氯化铁溶液中加铁粉 2Fe3+ + Fe = 3Fe2+C、过量CO2通入NaOH溶液中CO2 + 2OH-= CO32-+ H2OD、少量CO2通入NaOH溶液中CO2 + OH-= HCO3-+ H2O10.下列离子方程式中,正确的是A、氨气通入醋酸CH3COOH + NH3 = CH3COO-+NH4+B.碳酸氢镁溶液中加过量石灰水Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ C、澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2OD、稀硫酸滴在铜片上:Cu+2H+==Cu2++H2↑11.下列各组中的离子,能在溶液量共存的是()A 、K+、H+、SO42-、OH-B、Na+、Ca2+、CO32-、NO3-C 、Na+、H+、CO32- Cl-D 、Na+、Cu2+、Cl、SO42-12、在无色透明强酸性溶液中,能大量共存的离子组是()A、K+、Cu2+、NO3-、SO42-B、K+、Na+、Cl-、CO32-C、Zn2+、NH4+、NO3-、Cl-D、K+、Na+、MnO4-、SO42-13、在PH=1无色透明溶液中能大量共存的离子组是()A.Al3+、Ag+、NO3-、Cl-B.Mg2+、NH4+、NO3-、Cl-C.Ba2+、K+、S2-、Cl-D.Cu2+、Na+、NO3-、SO42-14、在强酸性或强碱性溶液中都能大量共存的一组离子是()A.Ba2+,Fe3+,Br-,NO3-B.Na+,Ca2+,HCO3-,NO3-C.Al3+,NH4+,SO42-,Na+D.Na+,K+,NO3-,SO42-15、下列各组中的离子,能在溶液量共存的是()A.Mg2+、H+、C1-、OH-B.Na+、Ba2+、CO-23、NO-3C、Na+、H+、Cl-、CO-23 D.K+、Cu2+、NO-3、SO-24、16、在强酸性无色透明溶液中,下列各组离子能大量共存的是()A、Fe3+、K+、Cl-、MnO4-B、Ag+、Na+、NO3-、Cl-C、Zn2+、Al3+、SO42-、Cl-D、Ba2+、NH4+、Cl-、HCO3-17、巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是A.Al3+、CH3C00—、Cl—B.Mg2+、Ba2+、Br—C.Mg2+、Cl—、I—D.Na+、NH4+、Cl—18、某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。
化学用语(元素符号、化学式、化学方程式)专题练习

“化学用语”(元素符号、化学式、化学方程式)专题练习一.说出下列符号的含义:1.H:2、2H:23、H2:4、2H2:25.H+:6、2H+:27、3Mg2+:二.说出下列符号中数字“2”的含义:1、2S:22、SO2:3、S2-:4、2S2-:5、MgO:6、SO42-:三.用数学或符号表示:1、3个铝原子:2、5个水分子:23、a个氦分子:4、b个铁离子:5、3个硫酸根离子:6、m个碳酸根离子:37、2个亚铁离子:8、氯酸钾中氯的化合价:4四.写出下列物质的化学式:1、氯化钾:2、氯酸钾:3、硫酸铜:4、硫酸锌:5、硫化锌:6、氢氧化钙:7、氯化钠:8、氧化钙:9、碳酸钠:10、硝酸铵:11、硫酸亚铁:12、氢氧化钠:五.用序号回答下列问题:1、写出下列粒子的名.称.、符号..:A:____B:_____C:_____D:____E:______2、以上粒子中,表示原子的是;表示阳离子的有__种,阴离子有__种;电子排布相同的是;五、配平下列化学方程式(反应条件忽略):1、Al + Fe3O4—- Fe + Al2O32、Al + MnO2—Mn + Al2O33、 CO + Fe3O4 —- Fe + CO 24、 C+ Fe3O4 —— Fe + CO 25、 H 2 + WO 3 —— W + H 2O6、 Fe + H 2O —— H 2 + Fe3O47、 FeS 2 + O 2 —— Fe2O3+ SO 28、 MnO 2+ HCl —— MnCl2 + Cl 2 + H 2O9、 Cl 2 + Ca (OH )2 —— CaCl2 + Ca (ClO )2 + H 2O六.(1) 3Cu+8HNO3==3Cu (NO 3)2+2X ↑+4H 2O ,求X 的化学式为 。
(2) R+3O 2==2CO 2+3H 2O 求R 的化学式为 。
化学用语过关练习修

化学符号书写过关练习※2个氢原子__;2个硫原子__;4个铁原子__;5个氧原子__;2个氮原子__2.化学式:单质:①稀有气体、金属和固态非金属氦气____氩气_____氖气____铁____汞____铜____碳_____硫______磷______②非金属气体氧气____氢气____氮气____氯气____化合物:①常见的氧化物的化学式:水_____二氧化硫____四氧化三铁_____五氧化二磷____二氧化碳_____一氧化碳_____二氧化氮___过氧化氢_____二氧化锰______氧化镁_____氧化汞_____氧化铁_____②金属和非金属组成化合物的化学式:氯化钠___氯化钾___硫化钾___氯化锌___硫化锌___③其他:高锰酸钾_____氯酸钾_______锰酸钾______※2个氢分子__4个水分子__5个二氧化碳分子__2个氮分子__3.离子符号:常见的离子:①阳离子:钾离子,钙离子,钠离子,镁离子铝离子,锌离子,铁离子,氢离子铜离子,银离子,亚铁离子②阴离子:氧离子,氯离子,氟离子,硫离子,③原子团:硝酸根离子___氢氧根离子___氯酸根离子___高锰酸根离子___碳酸根离子___硫酸根离子___锰酸根离子___铵根离子___※2个钠离子__3个镁离子__4个硫酸根离子___3个硝酸根离子___5个氢氧根离子___ 3个氯酸根离子___ 4个高锰酸根离子___3个碳酸根离子___ 4个硫酸根离子___ 4个锰酸根离子___4个铵根离子___4.化合价①请标出下列元素的常见化合价,括号中写出对应元素的化合价形成的离子符号H ( )Cl ( )Na ( )K ( )Ag ( )O ( )Ca ( )Mg ( ) Ba ( )Zn ( )Al ( )Si P Fe ( )Fe ( )Cu ( )Hg C C S S S②写出下列酸根离子硝酸根氢氧根氯酸根高锰酸根碳酸根硫酸根锰酸根磷酸根铵根5.结构示意图①请画出下列元素的原子结构示意图:氢氦碳氮氧氟氖钠镁铝硫氯氩②请画出下列离子结构示意图钠离子镁离子铝离子氧离子硫离子氯离子6.符号和数字的含义①说明下列符号的含义:O: 、2O: 2O2: O2: ①;②③;④O2-O-2②说明下列符号中数字的含义:2H: 2H 2: H 2: C 60 O 2- Mg 2+2S 2-____ 2H ++2 +2Mg MgO 7.下列化学式如有错误请改在横线上: 氧化钙Ca 2O 2 ______,氯化铁 FeCl 2 ______,氯化锌 ZnCl ______,硫化铝Al 3 S 2 ______,氢氧化铜CuOH __________,氯化钠ClNa ______,8.写出下列物质的化学式(并标出金属元素或非金属元素及原子团的化合价)。
九年级上离子符号化学式练习题
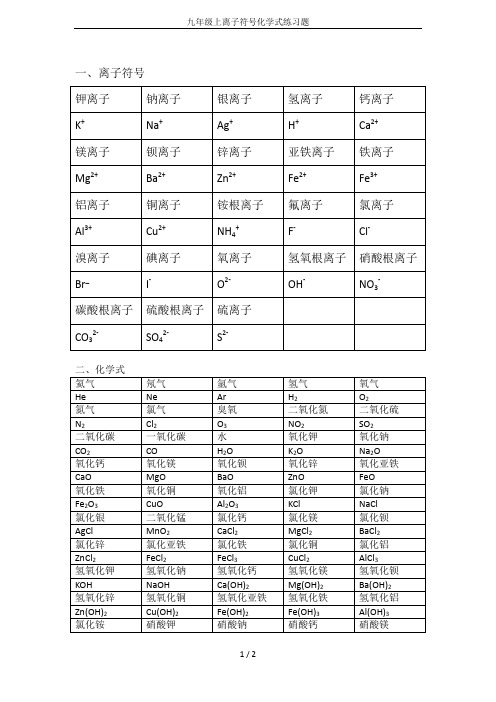
CaSO4
MgSO4
硫酸钡
硫酸锌
硫酸铜
氯化铵
硝酸
BaSO4
ZnSO4
CuSO4
NH4Cl
HNO3
盐酸
硫酸
四氯化碳
二硫化碳
二氧化氯
HCl
H2SO4
CCl4
CS2
ClO2
硝酸铵
硫酸铵
NH4NO3
(NH4)2SO4
CO32-
SO42-
S2-
二、化学式
氦气
氖气
氩气
氢气
氧气
He
Ne
Ar
H2
O2
氮气
氯气
臭氧
二氧化氮
二氧化硫
N2
Cl2
O3
NO2
SO2
二氧化碳
一氧化碳
水
氧化钾
氧化钠
CO2
CO
H2O
K2O
Na2O
氧化钙
氧化镁
氧化钡
氧化锌
氧化亚铁
CaO
MgO
BaO
ZnO
FeO
氧化铁
氧化铜
氧化铝
氯化钾
氯化钠
Fe2O3
CuO
Al2O3
一、离子符号
钾离子
钠离子
银离子Байду номын сангаас
氢离子
钙离子
K+
Na+
Ag+
H+
Ca2+
镁离子
钡离子
锌离子
亚铁离子
铁离子
Mg2+
Ba2+
Zn2+
Fe2+
Fe3+
九年级上册化学期末专练:元素符号、化合价、离子符号、化学式默写和计算

九年级上册化学期末复习专练元素符号、化合价、离子符号、化学式背写与计算➢背写部分一. 写出元素符号1.元素周期表前20个元素氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙2.常见元素:锰铁银碘钡汞铅溴铜锌金二. 背出常见元素、原子团的化合价:(用符号填写)常见元素化合价:常见原子团化合价:(一定要靠记忆来背写)练习:1. 标出下列物质中N元素的化合价,请标在N元素的正上方①N.2; ②N.O: ③N.O2: ④N.2O5; ⑤HN.O3⑥N.H4N.O32. NaSO4中S的化合价是KMnO4中Mn的化合价为三、写出下列离子的符号氢离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子钙离子铁离子铜离子亚铁离子氢氧根离子硫酸根离子硝酸根离子碳酸根离子铵根离子碳酸氢根离子四、写出下列物质的化学式1、单质三原子:臭氧双原子:氧气氯气氢气碘溴单原子:稀有气体:氦气氩气氖气金属:铜银水银锌铁其他:磷金刚石硫碳石墨2、化合物氧化物:氧化铝水干冰氧化铜三氧化硫过氧化氢二氧化硫氧化钾氧化钙一氧化碳二氧化锰四氧化三铁五氧化二磷氯化物:氯化钠氯化铜氯化银氯化氢氯化镁氯化铁硫化物:硫化氢硫化钠硫化锌其他:氯酸钾 硫酸钾 碳酸钙 锰酸钾 高锰酸钾 硫酸 氢氧化钙 氢氧化钾 氢氧化铝 碳酸钠 碳酸铵 综合练习 1、看符号写含义O 5N 3H 2 C Al mC 2、按要求写出下列符号:①氧元素 ②两个氧原子 ③氧气 ④两个氧气分子 ⑤氧离子 ⑥两个氧离子 3、写出下列符号中数字2的意义。
2H Ca 2+ 2SO 3 Cl 2 2H 2O 、2MgO C +2u SO 42-➢ 计算部分一、根据化学式计算相对分子质量或相对分子质量之和1、A12(SO 4)3的相对分子质量=2、下列各相对分子质量的计算中,正确的是( ) A 、2MgO 的相对分子质量之和=2×24+16=64 B 、NO 2的相对分子质量=14×16×2=448C、2N的相对分子质量和=2(14+2)=32D、3O2的相对分子质量和=3×(16×2)=96二、根据化学式计算化合物中各元素的质量比(最简整数比)化合物中各元素的质量比等于各元素的相对原子质量的和之比1:计算硫酸铵【(NH4)2SO4】中各元素的原子个数比及各元素的质量比解:(NH4)2SO4中N、H、S、O原子个数比为:(NH4)2SO4中各元素的质量比:2、在H2SO4中氢、硫、氧三种元素的质量比的计算式正确的是( )A、(1×2):32:(16×4)B、1:32:16C、2:1:4D、(16×4):32:(1×2)三、计算化合物中某元素的质量分数例题:计算碳酸氢铵【NH4HCO3】中氮元素的质量分数。
化学式的书写专题训练

化学式的书写专题训练化学式的书写专题训练1金属单质:钾钙钠镁铝锌铁铜汞银2、稀有气体:氨气氛气氮气3、固态非金属单质:硫磷4、气态(液态)非金属单质:氢气氧气氮气5、氧化物:水双氧水二氧化碳一氧化碳二氧化硫二氧化氮二氧化硅五氧化二磷氧化钾氧化钙___________ 氧化钠_________ 氧化镁____________ 氧化铝________氧化锌___________ 氧化铁_______ 氧化亚铁___________ 四氧化三铁_______ 氧化铜________ 氧化亚铜________ 氧化汞___________ 二氧化镭__________ 6、酸(H ):盐酸硫酸硝酸碳酸磷酸7、碱(_OH)?氢氧化钾氢氧化钠氢氧化钙氢氧化镁氢氧化铁氢氧化锌氢氧化锁氢氧化铜氢氧化铝8、盐1)盐酸盐(_C1):氯化钾__________ 氯化钠__________ 氯化银__________ 氯化钙________ 氯化钞!氯化镁氯化锌氯化铝氯化亚铁氯化铁氯化铜氯化钱2)硫酸盐(_SOJ :硫酸钾硫酸钠硫酸钙硫酸顿硫酸镁硫酸锌硫酸铝硫酸铁硫酸亚铁硫酸铜硫酸讓写出下列物质的化学式(1)单质的化学式:铜,铁,汞,铝,硫,t ,磷氨气,氛气,氮气,氢气,氧气,氯气,氮气,碘,(2)化合物的化学式:①氧化物:氧化钠镁,9氧化钾,氧化钙氧化氧化铜,水,氧化铁,氧化亚铁氧化铝9②酸:硫酸,硝酸,盐酸,碳酸,磷酸9③氢氧化物:氢氧化钠,镁,氢氧化钾,氢氧化钙9氢氧化氢氧化铝,亚铁,氢氧化铜,氢氧化领,氢氧化铁氢氧化④氯化物:氯化钠,氯化钾,氯化锲,氯化钙,氯化铜9氯化铝,氯化钱,氯化亚铁,氯化银,⑤硝酸钠,硝酸钾, 硝酸铜9硝酸银9硝酸亚铁,硝酸铝, 硝酸汞9硝酸铁9⑥硫酸钾,硫酸铜,硫酸顿硫酸铝9硫酸锌,硫酸镁, 硫酸亚铁9硫酸铁9⑦氯化彼,硝酸彼, 硫酸钱9碳酸彼9⑧碳酸钾, 碳酸钙, 碳酸铝9碳酸锁f 镭酸钾高徭酸钾氯酸钾元素符号、化学式练习一.常见单质的书写1、氨气氛气氨气2、氢气氧气氮气氯气氟气漠碘3、金刚石铜磷石墨二.常见化合物的书写(一)1、水一氧化碳二氧化碳二氧化硫三氧化硫一氧化氮二氧化氮五氧化二磷过氧化氧2、氧化铜氧化钙氧化铁氧化铝氧化镁氧化钠四氧化三铁3、氯化氢硫化氢*氨气甲烷4、氯化钠氯化镁氯化钞!氯化钙氯化铜氯化铁氯化亚铁四.常见化合物的书写(二)1、硫酸盐酸硝酸碳酸2、氢氧化钠氢氧化钾氢氧化钞!氢氧化铜氢氧化铁氢氧化铝氢氧化钙氢氧化镁3、碳酸钙碳酸钠碳酸顿碳酸氢钠硫酸钠硫酸铜硫酸亚铁硫酸顿硝酸镀__________ 硝酸钾___________ 硝酸顿__________ 硝酸铜___________五、常见离子符号1、氯离子镁离子氧离子钠离子钙离子锁离子铝离子铁离子硫酸根硝酸根碳酸根氢氧根2、Fe2+HCO厂Cu2+NHZSO?-PO43-3、3个硫酸根2个锌离子六、符号的意义1、玄严表示________________________________“2C1”表示 _____________________________ ;“2Cb”表示 ___________________________ :2、“Fe”表示 _______________________________ 、3、“良0”表示 ______________________________4、下列符号的“2”各表示什么意义①H2②2H③2Hi?■④H.O⑤2CO⑥202⑦汨⑧MgO化学式练习题[日期:2012-01-04]來源:芳星园中学作者:饶利[字体:大中小]专题四:化学式的写法基础知识巩固:1、化学式的写法(1)单质化学式的书写直接用元素符号表示化学式的有_____________ 、 __________ :一般在元素符号的右下角标''2〃的有 _________(2)化合物化学式的书写i先读—写,后读—写。
离子符号默写及根据化合价写化学式

钡离子Ba2+锌离子Zn2+铜离子Cu2+钙离子Ca2+
镁离子Mg2+
铝离子Al3+铁离子Fe3+亚铁离子Fe2+
铵ቤተ መጻሕፍቲ ባይዱNH4+
氯离子Cl-氟离子F-
氧离子O2-硫离子S2-
氢氧根OH-硝酸根NO3-碳酸氢根HCO3-
高锰酸根MnO4-
碳酸根CO32-硫酸根SO42-锰酸根MnO42-
磷酸根PO43-
铜Cu氖气Ne
氯化镁MgCl2硫化钠Na2S硫酸钠Na2SO4
氧化锌ZnO氢氧化铝Al(OH)3硝酸钙Ca(NO3)2
氧化铜CuO氧化亚铜Cu2O碳酸钡BaCO3
氯化铵NH4Cl高锰酸钾KMnO4锰酸钾K2MnO4
硫酸钾K2SO4碳酸钠Na2CO3
氢离子铝离子钾离子银离子
钡离子锌离子铜离子铁离子
亚铁离子镁离子氯离子钠离子
硫离子钙离子氧离子氟离子
铵根氢氧根硝酸根
碳酸根碳酸氢根
硫酸根磷酸根高锰酸根锰酸根
铜氖气氯化镁硫化钠
硫酸钠氧化锌
氢氧化铝硝酸钙氧化铜
氧化亚铜碳酸钡
氯化铵高锰酸钾锰酸钾
硫酸钾碳酸钠
答案:
氢离子H+铝离子Al3+钾离子K+银离子Ag+钡离子Ba2+锌离Zn2+铜离子Cu2+铁离子Fe3+亚铁离子Fe2+镁离子Mg2+氯离子Cl-钠离子Na+硫离子S2-钙离子Ca2+氧离子O2-氟离子F-铵根NH4+氢氧根OH-硝酸根NO3-碳酸根CO32-碳酸氢根HCO3-
离子方程式练习题

离子方程式演习题离子方程式的书写步调:1.写:书写完整准确的化学方程式;2.拆:将能拆的化学式(完整电离的酸.碱.盐及熔化态的金属氧化物)拆为离子符号;3.删:将未介入离子反响的离子从双方删掉落(等个数),整顿(系数应为最简整数比);4.查:⑴质量守恒.⑵电荷守恒.⑶注明“↑”“↓” ;⑷ .为氧化还原反响时.氧化剂与还原剂得掉电子数应相等.书写相干常识1.完整电离的酸是指:HCl.H2SO4.HNO3.HI.HBr.HClO4等强酸; 中强酸(H2SO3.H3PO4),弱酸(H2CO3.H2S.HF.HclO.CH3COOH.H2SiO3)则不克不及拆.2. 完整电离的碱是指:NaOH.KOH.Ca(OH)2.Ba(OH)2等强碱.中强碱的溶液;而NH3•H2O及Cu(OH)2.Fe(OH)3等难溶性弱碱则不克不及拆.3.完整电离的盐是指:所有易溶.可溶及微溶性的盐的溶液.附:盐的消融性纪律:钾盐.钠盐.铵盐.硝酸盐,二元酸的酸式盐 .磷酸的二氢盐均易溶.碳酸盐.磷酸盐.硅酸盐的正盐中只有钾盐.钠盐.铵盐溶;氯化物中只有AgCl 不溶;硫酸盐中只有PbSO4.BaSO4不溶,但CaSO4.Ag2SO4为微溶.4.特别情形处理:微溶物:作反响物时,为溶液时拆,作产品时不拆.浓硫酸作反响物时,不克不及拆,而浓盐酸.浓硝酸则必须拆. 酸式酸根离子只有HSO4-必须拆,而HS-.HCO3-.HSO3-.HPO42-.H2PO4-则不克不及拆.5.凡单质.氧化物.气体.难溶固体.弱酸.弱碱.水等难电离的及非电解质均不克不及拆.离子方程式演习题1.鄙人列化学方程式中,不克不及用离子方程式Ba2++SO42-=BaSO4↓来暗示的是A.BaCl2+Na2SO4=BaSO4↓+2NaCl B.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑C.BaCl2+H2SO4=BaSO4↓+2HCl D.Ba(NO3)2+H2SO4=BaSO4↓+2HNO32.下列各组中的离子,能在溶液中大量共存的是:A.Cu2+.Ba2+.Cl-.SO42-B.Na+.Fe3+.SO42-.OH-C.H+.Na+.CO32-.NO3-D.K+.Na+.Cl-.OH-3. 溶液.胶体和浊液这三种疏散系的基本差别是()C.是否能经由过程滤纸D.是否均一.透明.稳固4.某无色溶液中参加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则该溶液中有的离子是()A.必定消融有SO42- B.必定消融CO32-C.必定溶有Ag+ D.可能SO42-,也可能有Ag+5.列离子方程式准确的是( )A.铁和硝酸银溶液反响 Fe+Ag+=3Ag+Fe3+B.氢氧化镁与硫酸溶液反响 OH-+H+=H2OC.碳酸钙与盐酸溶液反响: CaCO3+2H+=Ca2++H2O+CO2↑D.铁与稀硫酸反响 2Fe+6H+=2Fe3++3H2↑6. 下列物资不是电解质的是()7.下列物资属于电解质的是A 铜B 二氧化碳C H2SO4D 蔗糖8.能用H++ OH-=H2O 暗示的是A Ba(OH)2溶液和稀硫酸的反响B NaOH溶液和硫酸的反响C Cu(OH)2和稀HNO3的反响D NaOH溶液Na2SO4溶液的反响9.下列各组物资中,没有任何化学反响产生的是A.CH3COOH溶液+NaOH溶液 B.Na2SO4溶液+Cu(OH)2溶液C.Na2CO3溶液+Ca(OH)2澄清液 D.Na投入NaCl溶液中10.向必定体积的Ba(OH)2溶液中逐滴参加稀硫酸,溶液的导电性(以电流I暗示)和滴入的稀硫的体积(用V暗示)间的关系准确的是11.下列各组物资水溶液,可以用来直接制取NaOH的是A. Ca(OH)2和Na2CO3B. Ca(OH)2和NaClC. Ba(OH)2和NaNO3D. KOH和Na2SO412.下列各组离子,可以在溶液中大量共存的是(A)Ag+.Ca2+.Br-.S2-(B)H+.SO32-.SO42-.Ba2+(C)Na+.Cl-.SO42-.SO32- (D)H+.Na+.Cu2+.S2-13.下列离子在溶液中能大量共存的是A.NH4+.SO42-.NO3-.H+ B.I-.NO3-.H +.K+C.NH4+.Cl-.OH-.NO3- D.Na +.H+.SO32-.SO42-14.某100mL混杂酸中,HNO3物资的量浓度为0.4mol/L,H2SO4物资的量浓度为0.2mol/L.向个中参加 2.56克Cu粉,待充分反响后,溶液中Cu2+物资的量浓度为A 0.15mol/LB 0.3mol/LC 0.225mol/LD 无法盘算15.下列各组离子在溶液中不克不及大量共存,但参加过量NaOH溶液或过量稀盐酸后均能得到澄清溶液的是A.Fe3+.Cl -.Na+.SO42-B.Al3+.Na+.HCO3-.NO3-C.Ag+.Na+.SO42-.NO3-D.AlO2-.CO32-.K+.Na+16.下列离子方程式书写错误的是 A.足量的氢氧化钠溶液参加到碳酸氢钙溶液中Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O B.明矾溶液与足量的氢氧化Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O C.石灰乳与碳酸氢铵浓溶液混杂加热Ca(OH)2+NH4++HCO3-CaCO3+NH3↑+2H2O D.Fe2O3溶于过量的氢碘酸中Fe2O3+6H++6I-=2Fe2++3I2+3H2OA H2SO4=2H+ +SO42-B Na2CO3=Na+2 +CO32-C NaOH=Na+ +OH-D KClO3=K+ +ClO3-19.下列各组中的离子,能在溶液中大量共存的是:A.Cu2+.Ba2+.Cl-.SO42-B.Na+.Fe3+.SO42-.OH-C.H+.Na+.CO32-.NO3-D.K+.Na+.Cl-.OH-20. 溶液.胶体和浊液这三种疏散系的基本差别是()C.是否能经由过程滤纸D.是否均一.透明.稳固21.某无色溶液中参加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则该溶液中有的离子是()A.必定消融有SO42- B.必定消融CO32-C.必定溶有Ag+ D.可能SO42-,也可能有Ag+22.列离子方程式准确的是( )A.铁和硝酸银溶液反响 Fe+Ag+=3Ag+Fe3+B.氢氧化镁与硫酸溶液反响 OH-+H+=H2OC.碳酸钙与盐酸溶液反响: CaCO3+2H+=Ca2++H2O+CO2↑D.铁与稀硫酸反响 2Fe+6H+=2Fe3++3H2↑23. 下列物资不是电解质的是()24.能用H++ OH-=H2O 暗示的是A Ba(OH)2溶液和稀硫酸的反响B NaOH溶液和硫酸的反响C Cu(OH)2和稀HNO3的反响D NaOH溶液Na2SO4溶液的反响25.下列离子方程式书写准确的是A.向明矾溶液中滴加Ba(H)2溶液至Al3+正好完整沉淀:Al3++2SO42—+3OH—+2Ba2+=2BaSO4↓+Al(OH)3↓B.向明矾溶液中滴加Ba(H)2溶液至SO42—正好完整沉淀:Al3++SO42—+Ba2++4OH= BaSO4↓+AlO2—+2H2OC.向FeI2溶液中通入Cl2至I—正好完整被氧化2I—+Cl2=I2+2Cl—D.向FeI2溶液中通入Cl2至Fe2+正好完整被氧化2Fe2++Cl2=2Fe3++2Cl—26.向某溶液中参加铝粉,反响生成氢气,则原溶液中确定不消失的离子组是 A.NH4+.Cl -.Na+.Ba2+B.SO4+.Cl-.CO32-.Na+C.Al3+.Mg2+.SO42-.Cl-D.Cl-.NO3-.Mg2+.Na+27.下列离子方程式书写不准确的是A.氯气和水反响:Cl2+H2O=2H++Cl-+ClO-B.二氧化锰和盐酸制氯气:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2OC.氢氧化钠溶液接收氯气:Cl2+2OH-=Cl-+ClO-+H2OD.漂白粉和盐酸:Ca2(ClO)2+2HCl=Ca2++2Cl-+2HClO28.下列离子方程式书写不准确的是 A.小苏打溶于醋酸溶液:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑B.碳酸氢钙与盐酸反响:Ca(HCO3)2+H+=Ca2++H2O+CO2↑C.硫酸氢钠与氯化钡溶液的反响:Ba2++SO42-=BaSO4↓D.向碳酸钠溶液中滴加少量稀盐酸:CO32-+2H+=HCO3-29.下列物资间产生反响的离子方程式,书写错误的是 A.锌与稀硫酸Zn+2H+=Zn2++H2B.大理石与稀硝酸CaCO3+2H+=Ca2++CO2+H2OC.钠跟水反响:Na+2H2O=Na++2OH-+H+↑D.氢氧化钾溶液与氯化镁溶液混杂2OH-+Mg2+=Mg(OH)230.写出下列反响的离子方程式盐酸与硝酸银溶液反响 __________________________试验室用大理石与盐酸反响制取CO2 ___________________________碳酸钠溶液跟澄清石灰水反响 ___________________________澄清石灰水中通入CO2 ____________________________________________。
离子符号默写及根据化合价写化学式(九年级上册)

亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子铜氖气氯化镁硫化钠硫酸钠氧化锌氢氧化铝硝酸钙氧化铜氧化亚铜碳酸钡氯化铵高锰酸钾锰酸钾硫酸钾碳酸钠氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子铜氖气氯化镁硫化钠硫酸钠氧化锌氢氧化铝硝酸钙氧化铜氧化亚铜碳酸钡氯化铵高锰酸钾锰酸钾硫酸钾碳酸钠氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子铜氖气氯化镁硫化钠硫酸钠氧化锌氢氧化铝硝酸钙氧化铜氧化亚铜碳酸钡氯化铵高锰酸钾锰酸钾硫酸钾碳酸钠氢离子铝离子钾离子银离子钡离子锌离子铜离子铁离子亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子铜氖气氯化镁硫化钠硫酸钠氧化锌氢氧化铝硝酸钙氧化铜氧化亚铜碳酸钡氯化铵高锰酸钾锰酸钾硫酸钾碳酸钠亚铁离子镁离子氯离子钠离子硫离子钙离子氧离子氟离子铵根离子氢氧根离子硝酸根离子碳酸根离子碳酸氢根离子硫酸根离子磷酸根离子高锰酸根离子锰酸根离子铜氖气氯化镁硫化钠硫酸钠氧化锌氢氧化铝硝酸钙氧化铜氧化亚铜碳酸钡氯化铵高锰酸钾锰酸钾硫酸钾碳酸钠答案:氢离子H+铝离子Al3+钾离子K+银离子Ag+ 钡离子Ba2+锌离Zn2+铜离子Cu2+铁离子Fe3+亚铁离子Fe2+ 镁离子Mg2+氯离子Cl-钠离子Na+ 硫离子S2-钙离子Ca2+氧离子O2-氟离子F-铵根离子NH4+氢氧根离子OH-硝酸根离子NO3-碳酸根离子CO32-碳酸氢根离子HCO3-硫酸根离子SO42-磷酸根离子PO43-高锰酸根离子MnO4-锰酸根离子MnO42-铜Cu 氖气Ne 氯化镁MgCl2 硫化钠Na2S 硫酸钠Na2SO4 氧化锌ZnO氢氧化铝Al(OH)3 硝酸钙Ca(NO3)2 氧化铜CuO 氧化亚铜Cu2O 碳酸钡BaCO3氯化铵NH4Cl 高锰酸钾KMnO4 锰酸钾K2MnO4 硫酸钾K2SO4 碳酸钠Na2CO3。
化学式的书写专题训练

化学式的书写专题训练1金属单质:钾钙钠镁铝锌铁铜汞银2、稀有气体:氨气氛气氮气3、固态非金属单质:硫磷4、气态(液态)非金属单质:氢气氧气氮气5、氧化物:水双氧水二氧化碳一氧化碳二氧化硫二氧化氮二氧化硅五氧化二磷氧化钾氧化钙___________ 氧化钠 _________ 氧化镁____________ 氧化铝________氧化锌___________ 氧化铁 _______ 氧化亚铁___________ 四氧化三铁_______ 氧化铜________ 氧化亚铜________ 氧化汞___________ 二氧化镭__________ 6、酸(H ):盐酸硫酸硝酸碳酸磷酸7、碱(_OH)••氢氧化钾氢氧化钠氢氧化钙氢氧化镁氢氧化铁氢氧化锌氢氧化锁氢氧化铜氢氧化铝8、盐1)盐酸盐(_C1):氯化钾__________ 氯化钠__________ 氯化银 __________ 氯化钙 ________ 氯化钞!氯化镁氯化锌氯化铝氯化亚铁氯化铁氯化铜氯化钱2)硫酸盐(_SOJ :硫酸钾硫酸钠硫酸钙硫酸顿硫酸镁硫酸锌硫酸铝硫酸铁硫酸亚铁硫酸铜硫酸讓写出下列物质的化学式(1)单质的化学式:铜,铁,汞,铝,硫,t ,磷氨气,氛气,氮气,氢气,氧气,氯气,氮气,碘,(2)化合物的化学式:①氧化物:氧化钠镁,9氧化钾,氧化钙氧化氧化铜,水,氧化铁,氧化亚铁氧化铝9②酸:硫酸,硝酸,盐酸,碳酸,磷酸9③氢氧化物:氢氧化钠,镁,氢氧化钾,氢氧化钙9氢氧化氢氧化铝,亚铁,氢氧化铜,氢氧化领,氢氧化铁氢氧化④氯化物:氯化钠,氯化钾,氯化锲,氯化钙,氯化铜9氯化铝,氯化钱,氯化亚铁,氯化银,⑤硝酸钠,硝酸钾, 硝酸铜9硝酸银9硝酸亚铁,硝酸铝, 硝酸汞9硝酸铁9⑥硫酸钾,硫酸铜,硫酸顿硫酸铝9硫酸锌,硫酸镁, 硫酸亚铁9硫酸铁9⑦氯化彼,硝酸彼, 硫酸钱9碳酸彼9⑧碳酸钾, 碳酸钙, 碳酸铝9碳酸锁f 镭酸钾高徭酸钾氯酸钾元素符号、化学式练习一.常见单质的书写1、氨气氛气氨气2、氢气氧气氮气氯气氟气漠碘3、金刚石铜磷石墨二.常见化合物的书写(一)1、水一氧化碳二氧化碳二氧化硫三氧化硫一氧化氮二氧化氮五氧化二磷过氧化氧2、氧化铜氧化钙氧化铁氧化铝氧化镁氧化钠四氧化三铁3、氯化氢硫化氢*氨气甲烷4、氯化钠氯化镁氯化钞!氯化钙氯化铜氯化铁氯化亚铁四.常见化合物的书写(二)1、硫酸盐酸硝酸碳酸2、氢氧化钠氢氧化钾氢氧化钞!氢氧化铜氢氧化铁氢氧化铝氢氧化钙氢氧化镁3、碳酸钙碳酸钠碳酸顿碳酸氢钠硫酸钠硫酸铜硫酸亚铁硫酸顿硝酸镀__________ 硝酸钾___________ 硝酸顿__________ 硝酸铜___________五、常见离子符号1、氯离子镁离子氧离子钠离子钙离子锁离子铝离子铁离子硫酸根硝酸根碳酸根氢氧根2、Fe2+HCO厂Cu2+NHZSO?-PO43-3、3个硫酸根2个锌离子六、符号的意义1、玄严表示________________________________“2C1”表示 _____________________________ ;“2Cb”表示 ___________________________ :2、“Fe”表示 _______________________________ 、3、“良0”表示 ______________________________4、下列符号的“2”各表示什么意义①H2②2H③2Hi•■④H.O⑤2CO⑥202⑦汨⑧MgO化学式练习题[日期:2012-01-04]來源:芳星园中学作者:饶利[字体:大中小]专题四:化学式的写法基础知识巩固:1、化学式的写法(1)单质化学式的书写直接用元素符号表示化学式的有_____________ 、 __________ :一般在元素符号的右下角标''2〃的有 _________(2)化合物化学式的书写i先读—写,后读—写。
离子反应练习题

专题训练--离子反应、离子方程式※ 1. 离子方程式概念,离子方程式的书写及判断依据一、离子方程式书写原则:即“分离原则”确定准哪些写成离子式,哪些写成化学式。
1、强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
2、微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。
微溶物作为生成物,一般写化学式(标↓号),如石灰水和石灰乳石灰水写成离子式而石灰乳则写化学式。
3、氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3 (标↑号)。
4、固体之间反应不能写离子方程式,5、可溶性多元弱酸酸式盐的酸式根一律保留酸式根的形式,6、正确把握与“量”有关的反应原则二、离子方程式的正误判断⑴、反应要符合事实。
⑵、要做到质量和电荷守恒。
⑶、看化学式拆分是否正确。
⑷、看是否系数化简时错误⑸、看是否漏写离子⑹、没有参加反应的离子没有删除练习:一写出下列反应的化学方程式和离子方程式1.稀硫酸溶液与氢氧化钡溶液反应。
2.铜与浓硝酸反应。
3.二氧化锰与浓盐酸反应。
4.过氧化钠与水反应5.(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:6.向氯化铝溶液中逐滴加入氢氧化钠溶液至过量:7.向氢氧化钠溶液中逐滴加入氯化铝溶液至过量:8.向碳酸钠溶液加逐滴加入稀盐酸:9.向稀盐酸中逐滴加入碳酸钠溶液:10.FeBr2溶液中加入少量Cl2的反应方程式:FeBr2溶液中加入足量Cl2的反应方程式:11.在氢氧化钡溶液加入过量的碳酸氢钠溶液:在氢氧化钡溶液中加入少量碳酸氢钠溶液:12.碳酸氢钡溶液加入足量的氢氧化钠溶液二离子方程式的正误判断1、下列反应的离子方程式正确的是A.硫酸亚铁酸性溶液中加入过氧化氢: 4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2OB.氯化铝溶液通入过量氨水: Al3+ + 4OH- = AlO2- + 2H2OC.碳酸钙溶于醋酸: CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + H2O + CO2D.次氯酸钙溶液中通入过量二氧化碳: Ca2+ + 2ClO- + H2O + CO2 = CaCO3 + 2HClO2、下列反应的离子方程式正确的是:A.碳酸氢钙溶液跟稀硝酸反应: HCO3- + H+ = H2O + CO2B.饱和石灰水跟稀硝酸反应: Ca(OH)2 + 2H+ = Ca2+ + 2H2OC.向稀氨水中加入稀盐酸: NH3.H2O + H+ = NH4+ + H2OD.氨气通入醋酸溶液中: CH3COOH + NH3= CH3COONH43、下列离子方程式书写正确的是A.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClOB.向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7Ba2++2OH-+2H++SO42-=BaSO4↓+2H2OC.向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca2++2 HCO3-+2OH-=CaCO3↓+CO32-+2H2OD.112mL(S.T.P)Cl2通入10mL1mol/L的FeBr2溶液中2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br24、下列离子方程式中正确的是:A.在氯化铁溶液中加入过量氨水:Fe3+ + 3NH3•H2O == Fe(OH)3↓+ 3NH4+B.氢氧化亚铁溶于稀硝酸中:Fe(OH)2=+ 2H+ == Fe2+ + 2H2OC.稀硫酸加入硫化亚铁中:S2- + 2H+ == H2S↑D.向碳酸氢钠溶液中加入少量的氢氧化钡溶液:CO32- + OH- + Ba2+ == BaCO3↓+H2O5、下列反应的离子方程式错误的是:A.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3•H2O == AlO2- + 4NH4+ + 2H2OB.用氨水吸收过量的二氧化硫 NH3•H2O + SO2 == NH4+ + HSO3-C.碳酸钠溶液中加入过量的苯酚 C6H5-OH + CO32- == C6H5O- + HCO3-D.次氯酸钙溶液中通入过量的二氧化碳 ClO- + CO2 + H2O == HCO3- + HclO6、下列离子方程式正确的是A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OB.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2OC.将氯化铁饱和溶液加入到沸水中:Fe3++3H2O Fe(OH)3(胶体)+3H+D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O※ 2.离子共存解此类题应该注意以下几个方面的问题:1、看组内离子间是否可直接发生化学反应(包括形成①难溶物 ②弱电解质③易挥发性物质 等)如果能发生化学反应,则不能大量共存。
化学式及离子符号书写练习
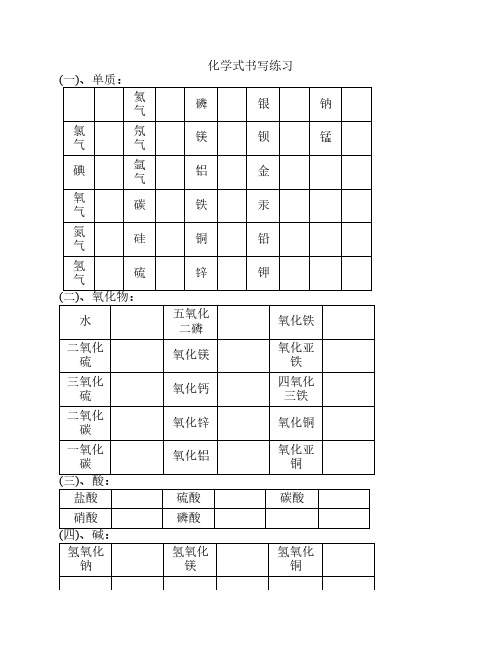
碳酸
氢氧化 铜
氢氧化 钾
氢氧化 钙
氢氧化 钡
(五)、盐: 硝酸钾 硝酸钠 硝酸钡 硝酸钙 硝酸镁 硝酸铝 硝酸锌 硝酸铁 硝酸亚 铁 硝酸铜 硝酸银 硝酸铵 碳酸钾
碳酸钠
碳酸钡
碳酸钙
碳酸镁
碳酸铝
氢氧化 铝
氢氧化 铁
氢氧化 亚铁
氯化钾 氯化钠 氯化钡 氯化钙 氯化镁 氯化铝 氯化锌 氯化铁
氯化亚铁
5、人体含量最多的金属元素__________
6、地壳中含量最多的非金属元素与含量最高的金属元素组成的化合
物___
7、KClO3中氯元素的化合价是_______ 3ClO2表示
8、O3中氧元素的化合价是______2Hg表示
9、Fe2+中“2”表示__________
Ca2+和S2-中“2”表示__________
硝酸根离子 m个碳酸根离子 高锰酸根离子 氢氧根离子
13、空气中含量最多的元素_____ 空气中含量最多的气体
二、按要求填空
1、FeSO4的名称__________
NaNO2的名称
2、构成氯化钠的微粒是________氯酸钾中的阴离子
3、右图表示的微粒是______ 画出氧原子的结构示意图
4、相对分子质量最小的氧化物________
10、过氧化氢中氧元素的化合价是__________
6、两个氦原子_________氖气
氩原子
7、氧化钾的化学式__________
8、硫酸铁的化学式________常温下一种液态金属的化学式
9、 硅元素______铅元素
铂元素
金元素
10、3个亚铁离子_______ 铁离子
3个碳酸分子
元素符号、化合价、离子符号、化学式练习题

初三化学(上)(元素符号.化合价.离子符号.化学式温习)姓名一.写出下列元素的符号氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯______ 氩钾钙罕有元素:锰铁银碘钡汞铅溴铜锌金二.背出罕有元素.原子团的化合价:(用符号填写)_________________________;________________________________________________;________________________________________________;_________________________________________________;________________________罕有原子团化合价:_______________________________________________(必定要背出!)演习:标出下列物资中N元素的化合价,请标在N元素的正上方上:①N2; ②N O;③NO2;④N2O5;⑤ H NO3;⑥NH4NO32.NaHSO4中S的化合价是 , KMnO4中Mn的化合价为 .三.写出下列离子的符号氢离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子钙离子铁离子亚铁离子铜离子氢氧根离子硫酸根离子硝酸根离子碳酸根离子碳酸氢根离子铵根离子四.写出下列物资的化学式☆1.单质三原子:臭氧_________双原子:氧气氯气氢气碘溴__________单原子:罕见气体: 氦气氩气氖气_______金属: 铜银水银锌_________铁_________其他:磷金刚石硫碳_________ 石墨___________☆2.化合物氧化物:氧化铝水干冰氧化铜三氧化硫过氧化氢二氧化硫氧化钾氧化钙一氧化碳二氧化锰四氧化三铁五氧化二磷氯化物:氯化钠氯化铜氯化银氯化氢氯化镁氯化铁硫酸钾硫化物:硫化氢硫化钠_________ 硫化锌_________其他:氯酸钾碳酸钙锰酸钾高锰酸钾硫酸氢氧化钙氢氧化钾氢氧化铝碳酸钠碳酸铵☆分解演习:1.看符号写寄义:O_________________5N__________________C__________________ mC_______________ Al____________________2.按请求写出下列符号:①氧元素②两个氧原子③氧气④两个氧气分子⑤氧离子⑥两个氧离子3.写出下列符号中数字2的意义.Cl2 2HCa2+2SO32H2O . MgO+2Cu SO42-☆一.依据化学式盘算相对分子质量或相对分子质量之和1.Al2(SO4)3的相对分子质量=_______________________________________2.下列各相对分子质量的盘算中,准确的是 ( )A.2MgO的相对分子质量之和=2×24+16=64B.NO2的相对分子质量=14×16×2=448C.2N2的相对分子质量和=2(14+2)=32D.3O2的相对分子质量和=3×(16×2)=96☆二.依据化学式盘算化合物中各元素的质量比(最简整数比)化合物中各元素的质量比等于各元素的相对原子质量的和之比1:盘算硫酸铵【(NH4)2SO4】中各元素的原子个数等到各元素的质量比解:(NH4)2SO4中N.H.S.O原子个数比为:(NH4)2SO4中各元素的质量比__________________________________2.在H2SO4中氢.硫.氧三种元素的质量比的盘算式准确的是( )A. (1×2):32:(16×4)B.1:32:16C.2:1:4D.(16×4):32:(1×2)☆三.盘算化合物中某元素的质量分数例题:盘算碳酸氢铵【NH4HCO3】中氮元素的质量分数:N解: NH4HCO3中氮元素的质量分数 N%=的子分子质量×100%= 14×100%=17.7%NH4HCO3 791:盘算尿素【CO(NH2)2】中氮元素的质量分数.☆四.化合物与元素之间的质量换算元素的质量=化合物资量×化合物中元素的质量分数1.盘算200Kg尿素【CO(NH2)2】中含氮元素若干Kg?有关化学式的根本盘算类型:以NH4NO3 为例请盘算(写出具体步调)(1)NH4NO3的相对分子质量M= ;(2)先盘算 N.H.O原子个数比为(3)NH4NO3各元素的质量比m N:m H:m O= ;(4)NH4NO3中N元素的质量分数为N%= ;(5)40克NH4NO3含N元素的质量为m N= .3.填补:若干克NH4NO3中含N元素的质量为70克?5.某临盆碳酸氢铵(NH4HCO3)的化肥厂,为谋取好处,打出“本厂临盆的优质碳酸氢铵,属国际开创,含氮量全球最高,达到20.1%”的告白.试经由过程盘算解释该告白的荒诞之处.。
化学符号与化学式练习题

化学符号与化学式练习题1.按要求写出下列粒子或物质的化学符号(1) 1个氮分子(2) 2个氢原子 (3)3个钠离子(4) 4个水分子 (5) 3个亚铁离子 (6)n个硫酸根离子____(7)m个氢氧根离子____ (8)+2价的镁元素⑼2个硫离子_______⑽2个铜离子,⑾4个铁原子,⑿3个二氧化硫分子。
2.写出下列物质的化学式或名称⑴液氧_____ ⑵硝酸铵_____ ⑶氧化铜_____ ⑷氢氧化镁⑸过氧化氢⑹FeCl2_____ ⑺CaCO3_____ ⑻Ca(OH)2_____ ⑼NH4Cl_____ ⑽N23.写出下列物质的化学式:氧化铜氯化钾硫酸铝硝酸铜碳酸钠硫酸钡氯化铝二氧化锰氯酸钾高锰酸钾4.写出下列物质的化学式:(1)氮气 (2)氦气(3)红磷(4)铁丝(5)氧化镁 (6)二氧化硫(7 )氧化铝 (8)水蒸气(8) 氧化铁(9) 二氧化锰(10) 硝酸银(11)碳酸钾 (12) 氯化铝(13) 硫酸铵(14) 液氮上述物质中,属于单质的是 (写序号,下同):;属于化合物的有:;属于氧化物的有:。
6.现有下列元素:钠、钙、铝、氢、氯、氧、硫等元素,请回答系列问题:(1)上表元素中,在地壳内含量最多的金属元素符号是;在人体内含量最多的元素符号是;水中含有的+1价的元素符号是;(2)氯化钙的化学式为Na2SO3中S元素的化合价为;(3)下图表示气体分子示意模型,其中属于化合物的是(填字母序号),属于混合物的是(填字母序号)。
选用上表中元素,表示A图中的分子,其化学式可能为(写出两种即可)。
A B C7.已知四种元素A、B、C、D,其中A 离子核外电子排布与氩原子相同;B原子比D原子多两个电子层,B原子的最外层电子数与其电子层数相同; C原子核外电子数比B原子多3个;D+离子的核外没有电子。
这四种元素的元素名称和符号为:A:________________B:______________C:________________D:____________8.判断下列化学符号中数字“2”表示的意义,将其序号填在相应的横线上:A. Ca2+B. NO2C. 2NOD. MgOE. 2PO43—①表示分子个数的是③表示元素化合价的是9.在下列H、O、H2、O2、H2O粒子中,保持水的化学性质的粒子是:最小的粒子是:;电解水的反应中,生成新物质的粒子是:;当水加热变成水蒸气时,粒子没有变化。
元素符号、化学式练习

北京路中学符号书写及意义一、常见元素名称或元素符号1、氢元素氧元素钠元素碳元素氯元素锰元素锌元素钙元素2、Si N Ne AlFe Cu F Mg3、3个氢原子2个氧原子2个碳原子二、常见离子符号1、氯离子镁离子氧离子钠离子钙离子钡离子铝离子铁离子硫酸根离子硝酸根离子碳酸根离子氢氧根离子2、Fe2+CO32-Cu2+NH4+SO42-PO43-3、3个硫酸根离子2个锌离子三、符号的意义1、“Cl”表示、。
“2Cl”表示;“2Cl2”表示。
2、“Fe”表示、、。
3、“H2O”表示、、、。
4、下列符号的“2”各表示什么意义○1H2○22H○32H2、。
○4H2O○52CO○62O2、。
○7Mg2++2○8MgO○92OH-化学式专题训练1、写出下列单质的化学式:(1)氧气____ (2)氢气____ (3)氖气____ (4)铁_____ (5)硫_____ (6)氯气_____ (7)铜______ (8)铝______ (9)氦气_____ (10)红磷____ (11)银______ (12)碳_______2、写出下列“某化某”的化学式(在化合物中正三价的铁一般读作铁,正二价的铁读作亚铁。
)(1)氧化锌__________(2)氧化钠__________(3)氧化铝__________ (4)氧化汞__________ (5)氧化镁__________ (6)氧化钾__________(7)氧化铜_________(8)氧化亚铁________ (9)氧化铁______ (10)四氧化三铁___________ (11)二氧化碳_______(12)二氧化锰_____ (13)五氧化二磷_______ (14)二氧化硫_____(15)氯化氢_________(16)氯化铝__________(17)氯化钙_________(18)氯化镁_________ (19)氯化铜________(20)氯化锌_________(21)氯化银__________(22)氯化铁_________ (23)氯化钠_________(24)氟化钙________(25)硫化锌_________(26)硫化铜__________ (27)硫化氢_______(28)硫化钠_________(29)氮化镁_________(30)硫化亚铁_________3、已知酸根前加氢元素的名称读作“某酸”如H2SO4读作硫酸;请根据以上提示写出下列物质的化学式:(1)硝酸________ (2)碳酸________ (3)磷酸_________ (4)氯酸__________4、已知含有酸根的化合物(酸除外)的名称读作“某酸某”如Na2SO4读作硫酸钠;请根据以上提示写出下列物质的化学式:(1)硫酸锌_________(2)硫酸镁__________(3)硫酸铁___________(4)硫酸钾__________(5)硫酸钠___________(6)硫酸亚铁_________(7)硫酸铜________(8)硫酸钙__________ (9)碳酸铜_________(10)碳酸钙__________(11)碳酸钠_________(12)碳酸钾_________(13)碳酸钡___________(14)碳酸镁__________(15)硝酸铝_________(16)硝酸钠________(17)硝酸钾_________(18)硝酸亚铁__________(19)硝酸铁___________(20)硝酸铜_________(21)磷酸铝_________(22)磷酸镁_________(23)磷酸钠_________ (24)高锰酸钾_______ (25)氯酸钾____________5、已知含有氢氧根的化合物的名称读作“氢氧化某”如NaOH读作氢氧化钠;请根据以上提示写出下列物质的化学式:(1)氢氧化钾______ (2)氢氧化钙_______ (3)氢氧化镁________ (4)氢氧化锌______(5)氢氧化铜_____ (6)氢氧化亚铁______ (7)氢氧化铁_______ (8)氢氧化铝______6、已知含有NH4的化合物的名称读作“某化铵”或“某酸铵”如NH4NO3读作硝酸铵;NH4Cl读作氯化铵;请根据以上提示写出下列物质的化学式:(1)硫酸铵_______ (2)碳酸铵_______(3)磷酸铵___________ (4)硫化铵__________化学式练习(一)(书写)氟气氦气磷银钠氯气氖气镁钡锰碘氩气铝金氧气碳铁汞氮气硅铜铅氢气硫锌钾水五氧化二磷氧化铁二氧化硫氧化镁氧化亚铁三氧化硫氧化钙四氧化三铁二氧化碳氧化锌氧化铜一氧化碳氧化铝氧化亚铜盐酸硫酸碳酸硝酸磷酸氢氧化钠氢氧化镁氢氧化铜氢氧化钾氢氧化铝氨水氢氧化钙氢氧化铁氢氧化钡氢氧化亚铁硝酸钾氯化钾硫酸钾硝酸钠氯化钠硫酸钠硝酸钡氯化钡硫酸钡硝酸钙氯化钙硫酸钙硝酸镁氯化镁硫酸镁硝酸铝氯化铝硫酸铝硝酸锌氯化锌硫酸锌硝酸铁氯化铁硫酸铁硝酸亚铁氯化亚铁硫酸亚铁硝酸铜氯化铜硫酸铜硝酸银氯化银硫酸银硝酸铵氯化铵硫酸铵碳酸钾碳酸锌碱式碳酸铜碳酸钠碳酸铁高锰酸钾碳酸钡碳酸亚铁锰酸钾碳酸钙碳酸铜亚硫酸钠碳酸镁碳酸银亚硝酸钠碳酸铝碳酸铵碳酸氢钙硫酸氢钠磷酸氢二铵磷酸二氢钾甲烷甲醇乙醇乙酸尿素一、单质:氟气F2氦气He 磷P 银Ag 钠Na 氯气Cl2氖气Ne 镁Mg 钡Ba 锰Mn 碘I2氩气Ar 铝Al 金Au氧气O2碳 C 铁Fe 汞Hg氮气N2硅Si 铜Cu 铅Pb氢气H2硫S 锌Zn 钾K二、氧化物:水H2O 五氧化二磷P2O5氧化铁Fe2O3二氧化硫SO2氧化镁MgO 氧化亚铁FeO三氧化硫SO3氧化钙CaO 四氧化三铁Fe3O4二氧化碳CO2氧化锌ZnO 氧化铜CuO一氧化碳CO 氧化铝Al2O3氧化亚铜Cu2O 三、酸:盐酸HCl 硫酸H2SO4碳酸H2CO3硝酸HNO3磷酸H3PO4氢氧化钠NaOH 氢氧化镁Mg(OH)2氢氧化铜Cu(OH)2氢氧化钾KOH 氢氧化铝Al(OH)3氨水NH3·H2O 氢氧化钙Ca(OH)2 氢氧化铁Fe(OH)3氢氧化钡Ba(OH)2 氢氧化亚铁Fe(OH)2五、盐:硝酸钾KNO3氯化钾KCl 硫酸钾K2SO4硝酸钠NaNO3氯化钠NaCl 硫酸钠Na2SO4 硝酸钡Ba(NO3)2氯化钡BaCl2硫酸钡Ba SO4硝酸钙Ca(NO3)2氯化钙CaCl2硫酸钙Ca SO4硝酸镁Mg(NO3)2氯化镁MgCl2硫酸镁Mg SO4硝酸铝Al(NO3)3氯化铝AlCl3硫酸铝Al2(SO4)3硝酸锌Zn(NO3)2氯化锌ZnCl2硫酸锌Zn SO4硝酸铁Fe(NO3)3氯化铁FeCl3硫酸铁Fe2(SO4)3硝酸亚铁Fe(NO3)2氯化亚铁FeCl2硫酸亚铁Fe SO4硝酸铜Cu(NO3)2氯化铜CuCl2硫酸铜Cu SO4硝酸银AgNO3氯化银AgCl 硫酸银Ag2SO4硝酸铵NH4NO3氯化铵NH4Cl 硫酸铵(NH4)2SO4碳酸钾K2CO3碳酸锌ZnCO3 碱式碳酸铜Cu2(OH)2CO3碳酸钠Na2CO3碳酸铁Fe2(CO3)3高锰酸钾KMnO4碳酸钡Ba CO3碳酸亚铁Fe CO3锰酸钾K2MnO4碳酸钙Ca CO3碳酸铜Cu CO3亚硫酸钠Na2SO3碳酸镁Mg CO3碳酸银Ag2CO3亚硝酸钠NaNO2碳酸铝Al2(CO3)3碳酸铵(NH4)2CO3碳酸氢钙Ca(HCO3)2硫酸氢钠NaHSO4磷酸氢二铵(NH4)2HPO4磷酸二氢钾KH2PO4六、有机物甲烷CH4甲醇CH3OH 乙醇C2H5OH 乙酸CH3COOH 尿素CO(NH2)2。
元素符号、原子团及化学式的书写及练习

+2 Mg__________________________ +2 MgO______________________________ 元素符号、原子团及化学式的书写及练习一、写出各元素的元素符号或名称及部分常见原子团离子的符号。
常见原子团离子符号:1、写出下列各种符号所表示的意义:“Cu” 表示①__________________ ②_________________________“H 2O” 表示① ②③ ④“5H” 表示 ①“2CO 2”表示 ①2、写出下列各种符号或指出符号中的“2”的意义:三个铁原子 五个五氧化二磷分子 液态氮铝离子 氯离子 二个铵根离子2Mg___________________________ Mg 2+______________________________SO2___________________________1、单质: 氢气 氯气 氮气 氦气 氖气 氩气 铜锰 镁 金刚石 固态磷 硫磺 臭氧气体2 、化合物:氧化物: 一氧化碳 水 二氧化硫 氧化镁 氧化铁氧化亚铁 氧化铜 氧化铝 氧化锌 氧化亚铜硫化物:(硫元素显示-2价)硫化镁 硫化锌 硫化铁 硫化亚铁 硫化钠氯化物(又称盐酸盐)氯元素显示-1价氯化镁 氯化锌 氯化铁 氯化亚铁氯化钠 氯化铜 氯化铵 氯化氢(盐酸)氢氧化物(含OH )氢氧化镁 氢氧化锌 氢氧化铁 氢氧化铝氢氧化钠 氢氧化铜 氢氧化钾 氢氧化钡硝酸盐(含硝酸根N O 3)硝酸镁 硝酸锌 硝酸铁 硝酸钾硝酸钠硝酸铜硝酸铵硝酸银硝酸钙硝酸铝硝酸钡硝酸亚铁硫酸盐(含SO4)硫酸镁硫酸锌硫酸铜硫酸铁硫酸钠硫酸钾硫酸铵硫酸钡碳酸盐(含CO3)碳酸镁碳酸锌碳酸钙碳酸钡碳酸钠碳酸钾碳酸氢钠碳酸氢铵磷酸盐(含PO4)磷酸镁磷酸锌磷酸铜磷酸铁磷酸钠磷酸钾磷酸铵磷酸钡酸类(H+与某些阴离子结合而成的化合物)盐酸(氯化氢)氢硫酸(硫化氢)氢氟酸(氟化氢)硫酸硝酸碳酸亚硫酸磷酸酸式盐(含HCO3或HSO4或HPO4)碳酸氢钠碳酸氢钙碳酸氢钡碳酸氢铵硫酸氢钠硫酸氢钙硫酸氢钡硫酸氢铵磷酸氢钠磷酸氢二钙磷酸氢钡磷酸氢铵五、其它练习1、写出下列物质化学式中,加点元素的化合价?(已知氧的化合价-2,氢+1)HF.H2S.P.2O5 H2CO3 HnROn+2H2Cu2、A原子和B原子在形成化合物时,每个A原子得到2个电子,形成A离子,每个B原子失去3个电子,成为B离子。
九年级化学鲁教版上册微专题2离子符号与化学式的书写

(2)非金属氧化物 一氧化碳 CCOO
二氧化氮 NNOO22 三氧化硫 SSOO33 二氧化硅 SiO22 过氧化氢 HH22O22
二氧化碳 CO22 二氧化硫 SO22 五氧化二磷 PP22O55 水 H22OO
(3)填写下表中酸、碱、盐的化学式
OH-
H+
H2O
NH+4
NH33•·H2HO2O
这些规律可以帮助我们掌握学习化学的方法。请你仔细阅读下表中的内
容,并回答有关的问题。
常见的几种离子 元素和原子团的化合价
H+ Na+ Ca2+ OH- Cl- SO24- CO23- +H1 N+a1 C+a2 O-H1 C-l1 S-O2 4 C-O2 3
你从上表中得出的规律是:离子的电量与化合价的数字相等;离子的电
BBaaSSOO44 CCaaSSOO44
Cl- HCl NH44CCll KCl NNaaCCll BaCl22 CaCl22
Mg2+
Mg(OH)22
Al3+
Al(OH)33
Mn2+
Mn(OH)22
Zn2+
Zn(OH)22
Fe3+
Fe(OH)33
Fe2+
Fe(OH)22
Cu2+
Cu(OH)22
Ag+
B.FeO
C.Fe2O3
D.Fe3O4
6.(黄冈中考)关于下列符号或图示的说法正确的是
①2N ②2Fe2+ ③
④
⑤
A.①表示 2 个氮分子
B.②表示 2 个铁离子
C.③和④构成物质的化学式为 Al2O3 D.由⑤可知锡的相对原子质量为 118.7 g
(C )
7.在下列化合物中,若 X 代表某种元素,在化合物中它只有一种化合价 ,
化学式书写练习
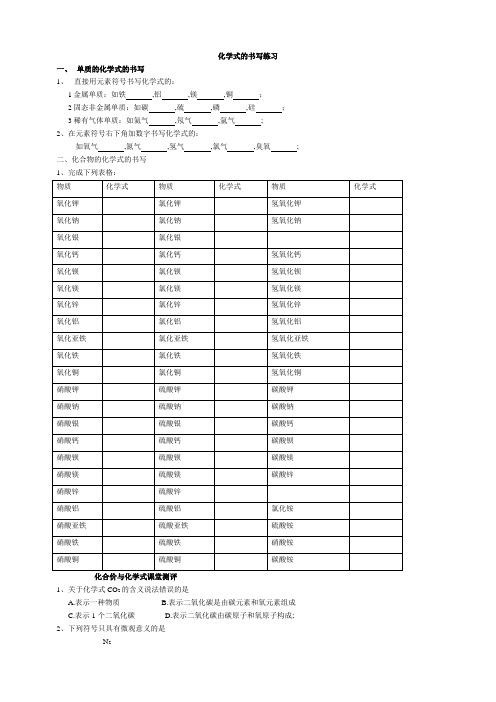
化学式的书写练习一、单质的化学式的书写1、直接用元素符号书写化学式的:1金属单质:如铁,铝,镁,铜;2固态非金属单质:如碳,硫,磷,硅;3稀有气体单质:如氦气,氖气,氩气;2、在元素符号右下角加数字书写化学式的:如氧气,氮气,氢气,氯气,臭氧;二、化合物的化学式的书写1、完成下列表格:化合价与化学式课堂测评1、关于化学式CO2的含义说法错误的是A.表示一种物质B.表示二氧化碳是由碳元素和氧元素组成C.表示1个二氧化碳D.表示二氧化碳由碳原子和氧原子构成;2、下列符号只具有微观意义的是N23、在下列化合物中,具有+5价元素的是A..P2O54.在化合物KMnO4和K2MnO4中不同的是A.钾元素的化合价B.氧元素的化合价C.所含元素的种类D.锰元素的化合价5.某金属元素R没有可变化合价,它的氧化物的化学式为RO,则它氯化物的化学式为6、下列化学式错误的是OH3 NO327.下列化学式书写正确的是A. MgO2B. K2Cl OH3 D. Fe2O38、下列物质的名称与化学式相符合的是A.氯化钾KClO3B.高锰酸钾K2MnO4C.氢氧化亚铁FeOH2D.硫化钠NaS9.A和B两种原子的电子层数都是3层,已知A原子的最外层电子数是1,B原子的最外层电子数为6,则A和B形成的化合物的化学式是A、ABB、A2BC、.AB2D、.A2B310、自第十一届奥运会以来,历届奥运会开幕式都要举行颇为隆重的“火炬接力”,火炬的可燃物是丁烷C4H10,它燃烧时,火苗高且亮,在白天,200m以外也能清晰可见,下列关于丁烷的叙述正确的是①丁烷由碳、氢两种元素组成②丁烷由丁烷分子构成③丁烷由碳、氢两个元素构成④丁烷由4个碳原子和10个氢原子组成⑤丁烷分子由4个碳原子和10个氢原子构成;A.①②③④⑤B.①②⑤C.②③④⑤D.①②④⑤11.用数字和化学符号表示3个硫酸根离子3个二氧化硫分子:4个亚铁离子4个铁原子12、写出下列符号的意义O ; 2O O2;2 O22个氧离子3个碳酸根离子13、写出下列符号总数字的意义2N:“2”4N2:“4”“2”3H2O:“3”“2”14、下列化学式如有错误请改正在横线上:氧化钙Ca2O2 __________, 氯化铁FeCl2 __________, 氯化锌ZnCl __________,硫化铝Al3 S2 __________,氢氧化铜CuOH __________, 氯化钠ClNa __________,15、写出下列物质的化学式氯化亚铁:硫酸:氢氧化铝:碳酸钠:硝酸镁:氧化亚铜:氯化银:碳酸:硫酸铁:磷酸钙:硫酸铵:氢气:氦气:三氧化硫:铝:16、写出下列化学式的名称MgOH2:AlCl3 :H2S:H2SO4:NH3: H2O2:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学式书写练习
碳酸钠碳酸铁高锰酸钾
碳酸钡碳酸亚铁锰酸钾
碳酸钙碳酸铜亚硫酸钠
碳酸镁碳酸银亚硝酸钠
碳酸铝碳酸铵
常见离子符号
氢离子铵根离子钾离子钠离子钡离子
钙离子镁离子铝离子锌离子亚铁离子
铁离子铜离子银离子氯离子硝酸根离子
硫酸根离子氢氧根离子碳酸根离子
一、用化学用语填空
1、2个氧原子____2个氧离子 2个氧分子 2个硫酸分子
2、锌离子____ 镁离子氢离子银离子铜离子
氟离子钾离子钡离子钙离子硫离子
3、+2价的镁元素__________
4、2个氮分子__________
5、保持硫酸铜化学性质的粒子是_____构成氧化汞的微粒是
6、两个氦原子_________氖气氩原子
7、氧化钾的化学式__________
8、硫酸铁的化学式________常温下一种液态金属的化学式
9、硅元素______铅元素铂元素金元素
10、3个亚铁离子_______ 铁离子 3个碳酸分子
11、氧化铁中铁元素的化合价___硝酸铵中+5价的氮元素
12、铵根离子________4个氨分子_____铝离子 2个硫酸根离子____
硝酸根离子 m个碳酸根离子高锰酸根离子氢氧根离子
13、空气中含量最多的元素_____ 空气中含量最多的气体
二、按要求填空
1、FeSO4的名称__________ NaNO2的名称
2、构成氯化钠的微粒是________氯酸钾中的阴离子
3、右图表示的微粒是______ 画出氧原子的结构示意图
4、相对分子质量最小的氧化物________
5、人体含量最多的金属元素__________
6、地壳中含量最多的非金属元素与含量最高的金属元素组成的化合物___
7、KClO3中氯元素的化合价是_______ 3ClO2表示
8、O3中氧元素的化合价是______2Hg表示
9、Fe2+中“2”表示__________ Ca2+和S2-中“2”表示__________
10、过氧化氢中氧元素的化合价是__________。
