九年级化学氧气的工业制法原理(1)
工业制取氧气的方法

工业制取氧气的方法
工业制取氧气的方法主要有分馏法、吸附法和膜法。
首先,分馏法是利用空气分馏的方法来制取氧气。
空气分馏是指将空气冷却至液态,然后根据各种气体的沸点差异进行分离。
在这个过程中,空气中的氮气和氧气会被分离出来,从而得到纯净的氧气。
这种方法可以大规模生产氧气,但是设备成本较高,能耗也比较大。
其次,吸附法是利用分子筛或活性炭等吸附剂对空气进行吸附,从而分离出氧气。
在这个过程中,空气中的氮气、氩气等惰性气体被吸附下来,而氧气则被释放出来。
这种方法操作简单,设备成本低,但是吸附剂的选择和再生过程会影响氧气的纯度和产量。
最后,膜法是利用气体分离膜对空气进行分离,从而得到氧气。
气体分离膜是一种特殊的多孔膜,能够根据气体分子的大小和亲和力来选择性地分离气体。
在这个过程中,空气中的氮气等气体会被截留下来,而氧气则通过膜被分离出来。
这种方法操作简单,能耗低,但是膜的选择和维护会影响氧气的纯度和产量。
总的来说,工业制取氧气的方法有分馏法、吸附法和膜法三种。
每种方法都有其特点和适用范围,可以根据实际情况选择合适的方法来制取氧气。
随着科技的发展,工业制氧技术也在不断进步,未来有望出现更加高效、节能的氧气制取方法。
初三化学制取氧气
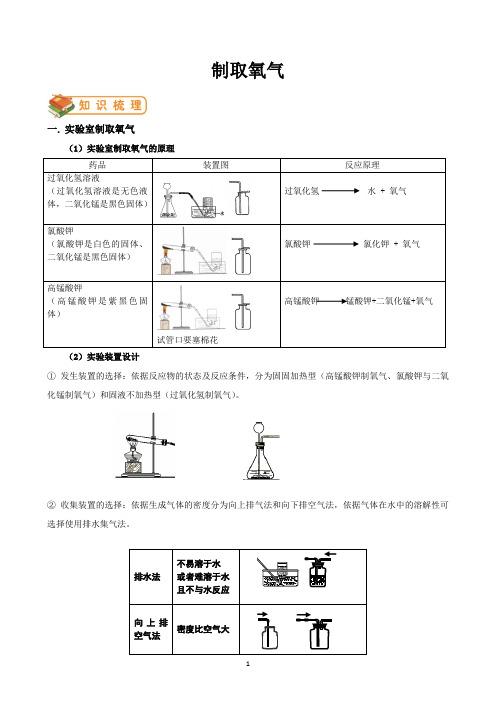
二氧化锰Mn O2二氧化锰加热Mn O2△加热△制取氧气一. 实验室制取氧气(1)实验室制取氧气的原理药品装置图反应原理过氧化氢溶液(过氧化氢溶液是无色液体,二氧化锰是黑色固体)过氧化氢水 + 氧气氯酸钾(氯酸钾是白色的固体、二氧化锰是黑色固体)氯酸钾氯化钾 + 氧气高锰酸钾(高锰酸钾是紫黑色固体)试管口要塞棉花高锰酸钾锰酸钾+二氧化锰+氧气(2)实验装置设计①发生装置的选择:依据反应物的状态及反应条件,分为固固加热型(高锰酸钾制氧气、氯酸钾与二氧化锰制氧气)和固液不加热型(过氧化氢制氧气)。
②收集装置的选择:依据生成气体的密度分为向上排气法和向下排空气法,依据气体在水中的溶解性可选择使用排水集气法。
排水法不易溶于水或者难溶于水且不与水反应向上排空气法密度比空气大(3)检验方法:将带火星的木条伸入集气瓶内,如果木条复燃,说明该瓶内的气体是氧气。
(4)验满方法:①用排水法收集时,集气瓶口处有较大气泡冒出,证明已满。
②用向上排空气法收集时,将带火星的木条放在集气瓶口,木条复燃,证明已满。
二. 实验室用高锰酸钾制取氧气的操作步骤和注意事项(1)反应原理:高锰酸钾→锰酸钾+二氧化锰+氧气(2)装置选择:用高锰酸钾制取氧气反应物是固体,所以发生装置应选用固固加热型的。
(3)操作步骤:查—装—定—点—收—移—熄a.检查装置的气密性;b.将高锰酸钾装入干燥的试管,并在试管口处放一团棉花,用带导管的单孔橡皮塞塞紧试管。
c.将试管固定在铁架台上;d.点燃酒精灯,均匀加热后,固定在药品的底部加热;e.用排水法收集氧气;(当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有较大气泡冒出时,证明已满。
)f.收集氧气结束后,将导管撤离水槽;(如果先熄灭酒精灯,试管内温度降低,压强减小,水槽里的水就会被吸入热的试管内,使试管炸裂。
)g.熄灭酒精灯。
(4) 注意事项①试管口略向下倾斜:防止冷凝水倒流引起试管破裂②药品平铺在试管的底部:均匀受热③铁夹夹在离管口约1/3处④导管应稍露出橡皮塞:便于气体排出⑤试管口应放一团棉花:防止高锰酸钾粉末进入导管⑥排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气)⑦实验结束时,先移导管再熄灭酒精灯:防止水倒吸引起试管破裂⑧用排空气法收集气体时,导管伸到集气瓶底部三. 氧气的工业制法1.分离液态空气法①原理:利用液态空气中液氮(沸点-196ºC)和液氧(沸点-183ºC)的沸点不同。
氧气制取原理

氧气制取原理
氧气制取原理:
氧气的制取通常有多种方法,下面介绍两种常用的制取原理。
1. 热分解法(也称为高温电解法):
热分解法是一种通过高温电解水来制取氧气的方法。
首先,将纯水注入至电解池中,并加热至高温。
然后,在电解池中加入一个适应电流的电极,电流通过电解池内的水产生化学反应。
随着电流的通过,水开始发生电解反应,将水分子分解为氧气和氢气。
氧气会在电解池的正极(阳极)产生,而氢气会在电解池的负极(阴极)产生。
最后,通过收集氧气,即可得到纯净的氧气。
2. 分子筛吸附法:
分子筛吸附法是一种通过分子筛材料对气体进行吸附和分离的方法。
分子筛是一种具有特殊孔隙结构的固体材料,可以选择性地吸附分子尺寸较小的气体分子。
在氧气制取过程中,通过将空气经过分子筛材料,由于分子筛具有尺寸适当的孔隙,能够吸附住空气中的氮气和水分,而不吸附氧气。
这样,当氮气和水分被吸附后,可通过减压或升温的方式将其甩掉,从而得到纯净的氧气。
通过以上两种制取方法,可以高效地制取到足够纯净的氧气供应给各种需要的领域,如医疗、工业等。
九年级化学实验室制取氧气

黄冈中学初三化学实验室制取氧气一、内容概述:本节课我们学习了课题3:制取氧气,在这一课题,我们通过实验研究了实验室制氧气的反应原理、反应条件、所需仪器、反应装置、收集装置、操作步骤,除此之外,还学习了催化剂的定义和作用。
最后,还学习了分解反应这一基本反应类型.(一)、氧气的实验室制法1、反应原理:①加热氯酸钾制取氧气:氯酸钾氯化钾+氧气。
②加热高锰酸钾制取氧气:高锰酸钾锰酸钾+二氧化锰+氧气③分解过氧化氢制取氧气:过氧化氢水+氧气.2、实验装置:(以加热高锰酸钾制氧气为例,如图所示)3、操作步骤:①检查装置的气密性.②把药品装入试管内,使用高锰酸钾作反应物时在试管口放一团棉花。
③把试管固定在铁架台上,将集气瓶装满水并倒立在盛水的水槽中。
④点燃酒精灯,加热药品。
⑤收集气体。
⑥把导气管从水槽中移出水面.⑦熄灭酒精灯。
4、收集方法:①排水集气法(因为氧气不易溶于水)。
操作要点:把盛满水的集气瓶(无泡)倒立在水中,排水充气,取出放置。
②向上排空气法(因为氧气的密度略大于空气)。
操作要点:使导气管尽量伸入集气瓶底便于排尽空气。
5、检验:将带火星的木条伸入集气瓶内,若木条复燃,证明瓶内气体是氧气。
氧气可以使带火星的木条复燃6、验满:若用向上排空气法收集氧气,验满时,取一根带火星的木条,放在集气瓶口,若木条复燃,则证明氧气已集满。
7、放置:因为氧气的密度大于空气的密度,故应正放在桌面上。
8、注意事项:①在用氯酸钾或高锰酸钾制取氧气时,试管口应略向下倾斜,原因是防止加热时药品中的湿存水倒流炸裂试管。
②铁夹应夹在距试管口1/3处,原因是利于加热。
③导管伸入试管内要刚露出橡皮塞,原因是利于排出产生的气体.④用排水法收集氧气时,不宜立即收集,待有连续均匀的气泡产生时再收集,原因是开始的气泡是试管内的空气,若立即收集则氧气不纯.⑤排气法收集气体时,导管要伸入接近集气瓶底部,原因是利于充分排出瓶内空气。
⑥实验结束时,先将导管移出水面,再熄灭酒精灯,原因是防止水槽中的水倒吸炸裂试管.⑦如果用高锰酸钾制氧气时,试管口应塞一小团棉花,原因是防止高锰酸钾粉末进入导管。
工业制氧气的原理化学

工业制氧气的原理化学
工业制氧气的原理化学主要涉及两个过程:空气分离和制氧。
1. 空气分离:空气主要由氮气(约78%)、氧气(约21%)、水蒸气和稀有气体组成。
工业生产中,采用常见的空气分离技术是通过冷却压缩空气,然后通过膜技术或吸附剂技术(如分子筛或活性炭)分离氧气和氮气。
2. 制氧:制氧通常使用两种主要的工艺:常压吸附法和膜分离法。
- 常压吸附法:这种方法使用吸附剂,例如分子筛,可以选择性地吸附氮气,而不吸附氧气。
空气首先被压缩,并通过吸附床,其中用于吸附氮气。
氧气则从吸附床中通过洗涤剂冲洗,从而分离出来。
然后,吸附床通过排空或升压进入再生,以将吸附的氮气释放掉。
- 膜分离法:膜分离法使用特殊的膜材料,如聚合物膜或陶瓷膜,可以选择性地通过氧气,而阻止氮气的通过。
将压缩的空气通过膜,氧气可以通过膜的孔洞或固溶体扩散到另一侧,而氮气被阻拦。
通过这种方式,可以有效地分离氧气和氮气。
上述两种工艺可以根据实际需要进行调整和组合,以满足产量和纯度的要求。
九年级化学知识点梳理 课题3制取氧气

九年级化学新课知识点梳理预习(人教版)第二单元我们周围的空气第7课课题3 制取氧气知识梳理如何获得氧气?氧气的制取:氧气的工业制法、氧气的实验室制法一、氧气的工业制法(阅读课本P40资料卡片)——均属于物理变化(1)分离液态空气法①原理:利用液态空气中液氮(沸点-196℃)和液氧(沸点-183℃)的沸点不同②过程(2)膜分离技术法二、氧气的实验室制法在实验室里,常采用加热高锰酸钾、分解过氧化氢或加热氯酸钾的方法制取氧气。
1.加热高锰酸钾制取氧气实验2-5(阅读实验步骤)实验编号现象(1)集气瓶中有大量气泡(2)木条复燃实验药品:高锰酸钾(暗紫色的固体)加热实验原理:高锰酸钾锰酸钾+二氧化锰+氧气2.分解过氧化氢制取氧气(阅读书本P 38探究)(1)分解过氧化氢制氧气中二氧化锰(黑色粉末)的作用(2)催化剂①概念:在化学反应中,能改变其他物质的化学反应的速率,而本身的质量和化学性质, 在反应前后都没有变化的物质叫催化剂(又叫触媒)。
②特点:“一变二不变”“一变”:改变其他物质的化学反应速率。
(注意:改变:可以是加快、也可以是减慢)“二不变”:本身的质量和化学性质都没有改变。
③催化剂在化学反应中所起的作用叫催化作用在上述反应中, 二氧化锰起了加速过氧化氢分解的作用所以这个反应中的二氧化锰是催化剂,是反应条件。
反应原理:过氧化氢 水+氧气3.加热氯酸钾制取氧气实验药品:氯酸钾(白色固体)、二氧化锰(黑色粉末)实验原理:氯酸钾 氯化钾 + 氧气 三、分解反应——属于基本反应类型定义:由一种物质生成两种或两种以上其他物质的反应。
特点:“一变多”二氧化锰加热 二氧化锰四、氧气的实验室制取装置(发生装置、收集装置)1.制取氧气的发生装置固固加热型:反应物都是固体、反应需要加热固液不加热型:反应物是固体和液体的混合物、反应不需要加热注意:使用长颈漏斗时,长颈漏斗的末端必须插入液体中:防止生成的气体从长颈漏斗口逸出,所以必须液封。
氧气制法

氧气的制法一、氧气的工业制法原理:工业上大规模生产氧气广泛采用液态空气分馏法。
首先使空气通过过滤器除去尘埃等固体杂质,进入压缩机压缩,再经过分子筛净化器除去水蒸气和二氧化碳等杂质气体。
在这里分子筛可使氮气、氧气等较小分子通过,起到筛选分子的作用。
然后进行冷却、降压,当温度降至—170℃左右时,空气开始部分液化进入精馏塔,根据空气中各气体的不同沸点进行分馏。
液态氧的沸点比液态氮的沸点高,两者相比液氮更易气化。
经多步分馏可以得到99%以上的纯氧,同时得到氮气和提取稀有气体的原料。
这种方法工艺复杂。
如果需用纯度不高的氧气,可用分子筛吸附法分离空气,制得氧气。
特定的分子筛对氮的吸附能力比氧大,当空气通过分子筛床后,流出的气体含氧量较高,经多次吸附可得含氧70~80%的气体。
这种方法是常温操作,循环周期短,易于实现自动化。
另外,如需高纯度氧气,可采用电解水法生产,此法成本高,只适于小型生产。
从空气中分离出的氧气,一般是加压贮存在天蓝色的钢瓶中,以供工业、医疗或其它方面使用。
二、氧气的实验室制法1. 将某些含氧化合物加热分解是实验室制取氧气的主要方法。
常用的含氧化合物为氯酸钾或高锰酸钾。
用高锰酸钾制氧气的方法简便、安全,但是原料的价格较高,利用率低,高锰酸钾分解时化合态的氧元素没有全部转化成游离态的氧元素(即氧气):2KMnO4 K2MnO4+MnO2+O2↑2.用氯酸钾分解制氧气,如果单独加热氯酸钾,到356℃才熔化,400℃才开始缓慢分解放出氧气。
为了加快氯酸钾的分解速度和降低分解温度,常常需要加入二氧化锰作催化剂:3.当实验室用氯酸钾制氧气而没有二氧化锰时,可用少量的高锰酸钾代替。
在反应中高锰酸钾分解产物二氧化锰(见化学方程式①)可以在氯酸钾的分解反应中(见化学方程式②)起催化剂作用。
实验室制取氧气的装置如图。
由于氧气不易溶于水,可用排水法收集;由于氧气的密度大于空气,可用向上排气法收集。
验满的方法是:将带火星的木条接近集气瓶口,若木条复燃,证明集气瓶里已充满氧气。
九年级化学 第二单元 课题3制取氧气

实验室制取氨气时发生装置应选择(
C 收集装置应选择( )装置。
)A 装置,
B A
E D C
归纳氧气的实验室制法
过氧化氢 二氧化锰 水 + 氧气
氯酸钾
二氧化锰 加热
氯化钾+氧气
高锰酸钾 加热 锰酸钾+二氧化锰+氧气
一变 多
分解反应
氧气的工业制法
• 工业上生产大量氧气是用分离液态空气的 方法
• 在低温条件下加压,使空气转变为液态空 气,然后蒸发。由于液态氮的沸点比液态 氧的沸点低,因此氮气首先从液态空气中 蒸发出来,剩下的主要就是液态氧。
【思考】
我们知道氧气是一
种化学性质比较活泼的
气体,它可以跟很多物 质发生反应。那么,在
O2
实验中我们用到的这些
氧气是如何得到的呢?
氧气的制取方法可分为: 工业制法 实验室制法
一、实验室制法
加热高锰酸钾(KMnO4) 原理 加热氯酸钾(KClO3)和二氧
化锰(MnO2)的混合物 分解过氧化氢溶液(H2O2)
分离液态空气法
降温
空气 加压
液态空气
液态氮气(-196℃) 液态氧气(-183℃)
利用沸点不同 液态氮气先蒸发了,剩下
蒸发
的主要是液态氧气,再把 它贮存起来
三、工业制法(分离液态空气法)
依据:液氮和液氧的沸点不同(液 氮较低先蒸发,剩下的是液氧)
(物理变化)
③催化剂并不具有通用性,如二氧化锰在过氧化氢
分解制取氧气时,能够起催化作用,是催化剂,但 对于其他反应就不一定了。
④同一化学反应可有多种催化剂。如双氧水分解制取 氧气时,既可用二氧化锰做催化剂,也可用硫酸铜 溶液做催化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧气的工业制法
•工业制氧:
实验室中常用过氧化氢或高锰酸钾分解制取氧气的方法,具有反应快、操作简便、便于收集等特点,但成本高,无法大量生产,只能用于实验室中。
工业生产则需考虑原料是否易得、价格是否便宜、成本是否低廉、能否大量生产以及对环境的影响等。
空气中约含21%的氧气,这是制取氧气的廉价、易得的原料。
工业制氧•工业制氧的方法:
1、空气冷冻分离法
空气中的主要成分是氧气和氮气。
利用氧气和氮气的沸点不同,从空气中制备氧气称空气分离法。
首先把空气预冷、净化(去除空气中的少量水分、二氧化碳、乙炔、碳氢化合物等气体和灰尘等杂质)、然后进行压缩、冷却,使之成为液态空气。
然后,利用氧和氮的沸点的不同,在精馏塔中把液态空气多次蒸发和冷凝,将氧气和氮气分离开来,得到纯氧(可以达到99.6%的纯度)和纯氮(可以达到
99.9%的纯度)。
如果增加一些附加装置,还可以提取出氩、氖、氦、氪、氙等在空气中含量极少的稀有惰性气体。
由空气分离装置产出的氧气,经过压缩机的压缩,最后将压缩氧气装入高压钢瓶贮存,或通过管道直接输送到工厂、车间使用。
使用这种方法生产氧气,虽然需要大型的成套设备和严格的安全操作技术,但是产量高,每小时可以产出数干、万立方米的氧气,而且所耗用的原料仅仅是不用买、不用运、不用仓库储存的空气,所以从1903年研制出第一台深冷空分制氧机以来,这种制氧方法一直得到最广泛的应用。
2、分子筛制氧法(吸附法)
利用氮分子大于氧分子的特性,使用特制的分子筛把空气中的氧离分出来。
首先,用压缩机迫使干燥的空气通过分子筛进入抽成真空的吸附器中,空气中的氮分子即被分子筛所吸附,氧气进入吸附器内,当吸附器内氧气达到一定量(压力达到一定程度)时,即可打开出氧阀门放出氧气。
经过一段时间,分子筛吸附的氮逐渐增多,吸附能力减弱,产出的氧气纯度下降,需要用真空泵抽出吸附在分子筛上面的氮,然后重复上述过程。
这种制取氧的方法亦称吸附法.利用吸附法制氧的小型制氧机已经开发出来,便于家庭使用。
