第二章 紫外吸收光谱分析
2紫外吸收光谱分析
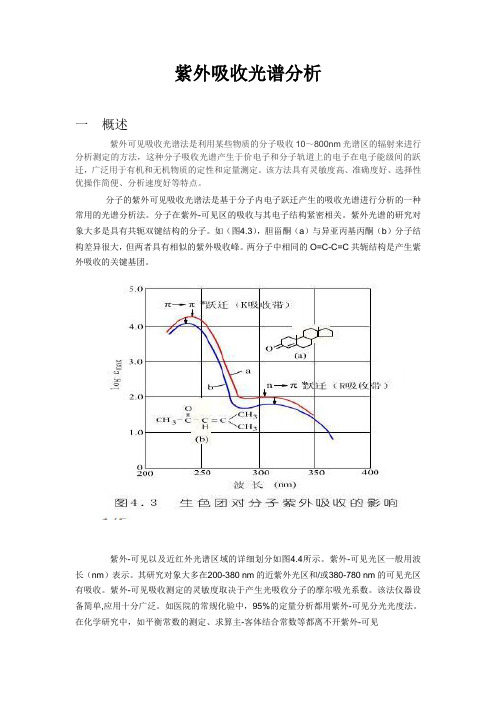
紫外吸收光谱分析一概述紫外可见吸收光谱法是利用某些物质的分子吸收10~800nm光谱区的辐射来进行分析测定的方法,这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于有机和无机物质的定性和定量测定。
该方法具有灵敏度高、准确度好、选择性优操作简便、分析速度好等特点。
分子的紫外可见吸收光谱法是基于分子内电子跃迁产生的吸收光谱进行分析的一种常用的光谱分析法。
分子在紫外-可见区的吸收与其电子结构紧密相关。
紫外光谱的研究对象大多是具有共轭双键结构的分子。
如(图4.3),胆甾酮(a)与异亚丙基丙酮(b)分子结构差异很大,但两者具有相似的紫外吸收峰。
两分子中相同的O=C-C=C共轭结构是产生紫外吸收的关键基团。
紫外-可见以及近红外光谱区域的详细划分如图4.4所示。
紫外-可见光区一般用波长(nm)表示。
其研究对象大多在200-380 nm的近紫外光区和/或380-780 nm的可见光区有吸收。
紫外-可见吸收测定的灵敏度取决于产生光吸收分子的摩尔吸光系数。
该法仪器设备简单,应用十分广泛。
如医院的常规化验中,95%的定量分析都用紫外-可见分光光度法。
在化学研究中,如平衡常数的测定、求算主-客体结合常数等都离不开紫外-可见二基本原理紫外可见吸收光谱的基本原理是利用在光的照射下待测样品内部的电子跃迁,电子跃迁类型有:(1)σ→σ* 跃迁指处于成键轨道上的σ电子吸收光子后被激发跃迁到σ*反键轨道(2)n→σ* 跃迁指分子中处于非键轨道上的n电子吸收能量后向σ*反键轨道的跃迁(3)π→π* 跃迁指不饱和键中的π电子吸收光波能量后跃迁到π*反键轨道。
(4)n→π* 跃迁指分子中处于非键轨道上的n电子吸收能量后向π*反键轨道的跃迁。
电子跃迁类型不同,实际跃迁需要的能量不同:σ→σ* ~150nmn→σ* ~200nmπ→π* ~200nmn→π* ~300nm吸收能量的次序为:σ→σ*>n→σ*≥π→π*>n→π*特殊的结构就会有特殊的电子跃迁,对应着不同的能量(波长),反反映在紫外可见吸收光谱图上就有一定位置一定强度的吸收峰,根据吸收峰的位置和强度就可以推知待测样品的结构信息三特点1、紫外可见吸收光谱所对应的电磁波长较短,能量大,它反映了分子中价电子能级跃迁情况。
第二章 可见紫外吸收光谱分析1

由于玻璃可吸收紫外光,所以玻璃棱镜只能用于
用于可见光域内。 石英棱镜可使用的波长范围较宽,可从185- 4000nm,即可用于紫外、可见和近红外三个光域。
光栅是利用光的衍射与干涉作用制成的。
它可用于紫外、可见及红外光域,而且
在整个波长区具有良好的、几乎均匀一 致的分辨能力。
它具有色散波长范围宽、分辨本领高、 成本低、便于保存和易于制备等优点。 缺点是各级光谱会重叠而产生干扰。
它是分光光度法定量分析的依据。
吸光系数
朗伯-比耳定律中,当c以克/升,液层厚 度b以厘米表示时,常数K以a表示,称 为吸光系数。 a的单位为升/克.厘米。 朗伯-比耳定律 :A=abc
摩尔吸光系数
朗伯-比耳定律中,浓度用摩尔/升,液 层厚度b用厘米为单位表示,则K用另一 符号ε来表示。 ε称为摩尔吸光系数(或克分子消光系数), 单位为升/摩尔.厘米。 它表示物质的浓度为1摩尔/升,液层厚 度为1厘米时溶液的吸光度。 朗伯-比耳定律 : A=εbc
72型 721型
751型 WFD-8型
760 40000
~
硅碳棒或 辉光灯
岩盐或萤 石棱镜
WFD-3型 WFD-7型
一、组成部件
光源
单色器
样品池
记录装置
检测器
(一)光源
对光源的基本要求是应在仪器操作所 需的光谱区域内能够发射连续辐射,有足 够的辐射强度和良好的稳定性,而且辐射 能量随波长的变化应尽可能小。 常用的光源有热辐射光源(如钨丝灯 和卤钨灯)和气体放电光源(如氢灯和氘 灯)两类。
1)非单色光的影响: 光吸收定律的重要前提是入射光
第二章 紫外吸收光谱

发色基团 化合物 吸收波长/nm 吸收波长 溶剂
C=C C三C 三 C=O COOH CONH2 COOR COCl N=N NO2 ONO SO ONO Ar
乙烯 乙炔 丙酮 乙酸 乙酰胺 乙酸乙酯 乙酰氯 偶氮甲烷 硝基甲烷 硝酸丁酯 亚砜 亚硝酸丁酯 苯甲酸
第一节 紫外吸收光谱的基本原理
一、紫外吸收光谱的产生
n2 A E
V3 V2 V1 V0
J2 J0 J1 J3
V3
λmax
n1
V2 V1 V0
J2 J0 J1 J3
J:转动量子数 V:振动量子数
二、分子轨道与电子跃迁的类型 1、分子轨道 、 + - σs* + + + σs - + + + -
己 乙 氯 甲 水
烷 腈 仿 醇
π* En π
Ep< En
π* En
Ep
n
Ep
Ep> En
C=C 在非极性溶剂中 在极性溶剂中
C=O 在非极性溶剂中 在极性溶剂中
图 溶剂极性对轨道能级的影响 二、分子结构改变的影响
CH=CH—CO—CH3 CH=CH—CO—CH3
CH3
CH3
π→π*跃迁吸收波长分别为 → 跃迁吸收波长分别为227和299nm 和
+H+ -H+
NH2
NH+3
OH
O-
四、取代基的影响
如果在某些发色基团的一端存在含孤对电子的助色基团时, 如果在某些发色基团的一端存在含孤对电子的助色基团时, 由于n→π共轭作用,使π→π*跃迁的吸收带产生红移。并能使吸 共轭作用, 跃迁的吸收带产生红移。 由于 共轭作用 收强度增加。 收强度增加。 例如,取代烃——C=C—X,当X分别是 2、NR2、OR、Cl时, 分别是SR 例如,取代烃 , 分别是 、 时 跃迁吸收波长分别增加45、 、 和 其π→π*跃迁吸收波长分别增加 、40、30和5nm。 。 苯环上氢原子为助色基团取代时,苯的E吸收带和 吸收带和B吸收带 苯环上氢原子为助色基团取代时,苯的 吸收带和 吸收带 产生红移,例如氯代苯和苯甲醚的E吸收带波长分别红移 吸收带波长分别红移6和 产生红移,例如氯代苯和苯甲醚的 吸收带波长分别红移 和 13nm。 。 烷基是弱的给电子基团, 烷基是弱的给电子基团,与π键的超共轭效应也会使吸收带 键的超共轭效应也会使吸收带 产生5nm红移。 红移。 产生 红移 与上述作用相反,当助色基团与羰基碳原子相连时, 与上述作用相反,当助色基团与羰基碳原子相连时,羰基 n→π*跃迁吸收波长将产生蓝移。例如乙醛的 跃迁吸收波长将产生蓝移。例如乙醛的n→π*跃迁吸收波长 为290nm,而乙酸乙酯分别蓝移到 ,而乙酸乙酯分别蓝移到220nm和208nm。这是由于未 和 。 成键电子与发色基团形成的n→π共轭作用提高了反键 轨道的能 共轭作用提高了反键π轨道的能 成键电子与发色基团形成的 共轭作用提高了反键 电子轨道的能级并没有变化, 级,而n电子轨道的能级并没有变化,因此增加了电子从 轨道到 电子轨道的能级并没有变化 因此增加了电子从n轨道到 π*轨道时需要的能量,从而导致 轨道时需要的能量,从而导致n→π*跃迁吸收带蓝移。 跃迁吸收带蓝移。
紫外吸收光谱分析

单色器是将光源发出的复合光分解为单色光的装置。在紫外吸收光谱分析中,常 用的单色器有棱镜单色器和光栅单色器。棱镜单色器分辨率较低,适用于宽波段 扫描;光栅单色器分辨率较高,适用于窄波段扫描和定量分析。
样品池设计与使用注意事项
样品池设计
样品池是承载样品的装置,其设计应考虑到样品的性质、浓度以及分析波长等因素。常 用的样品池有石英比色皿和玻璃比色皿,前者适用于紫外区域的分析,后者适用于可见 光区域的分析。此外,样品池的光程长也是需要考虑的因素,一般根据分析需求选择合
03 样品前处理与实验条件 优化
样品溶解与稀释方法
选择合适溶剂
根据样品的性质选择合适的溶剂 ,确保样品在溶剂中完全溶解, 避免产生浑浊或沉淀。
稀释倍数确定
根据样品的浓度和仪器的检测范 围,确定合适的稀释倍数,使样 品在检测时处于线性范围内。
pH值调整及缓冲液选择
pH值调整
根据样品的性质和实验需求,使用酸或碱调整样品的pH值,确保样品在合适 的pH值下进行实验。
多组分体系同时测定策略探讨
1 2 3
多波长测定法
利用不同组分在紫外光谱中的特征吸收峰,选择 多个波长进行同时测定,实现多组分体系的分析 。
差分光谱法
通过比较样品与参比溶液在特定波长下的吸光度 差异,消除背景干扰,提高多组分体系测定的准 确性。
化学计量学方法
结合化学计量学算法,对多组分体系的紫外吸收 光谱数据进行解析,实现各组分浓度的同时测定 。
应用举例
在药物分析中,利用紫外光谱法可以 快速识别原料药或制剂中的主成分, 以及可能的杂质或降解产物。
导数光谱法在Biblioteka 合物鉴定中应用原理导数光谱法通过对原始紫外光谱进行数学处理(求导),可 以突出光谱的细微特征,提高混合物中各组分的分辨率。
仪器分析-紫外可见光光谱分析

正己烷
258
n=4
1,3,5,7-辛四烯
环己烷
304
不共轭双键不发生红移。
C=O双键同C=C双键的共轭作用使n→*和→*跃迁的吸收峰都发生红移。
3)溶剂效应
01
02
03
04
05
极性溶剂使π-π*跃迁发生红移。
pH值
Note: 测UV-Vis应注明溶剂
pH增大,苯酚π-π*吸收带发生红移。
1
2
特点:灵敏度高,实际工作中常用。
1
常将M与某L(显色剂)生成具有电荷迁移的配合物,然后进行含量测定。
2
-* 跃迁 配体具有双键的金属络合物
3
2.3光的吸收定律
郎伯-比尔(Lambert-Beer )定律 入射光强度 吸光强度 反光强度 透光强度 + IS 散射光强度 均匀溶液,散射光小,可忽略
由于n—π共轭参与,使分子整体共轭效应增强。
取代基 苯环或烯烃(吸电子基)上的H被各种取代基取代,多发生红移。 空间异构
蓝移(紫移):使化合物的吸收波长向短波方向移动效应。 影响蓝移因素: 1)溶剂效应 极性溶剂使n-π*跃迁发生蓝移 2)pH值 pH值减小,苯胺的π-π*吸收带蓝移n—π共轭参与少,使分子整体π共轭效应减少。
分子转动-转动能级(rotation)
分子整体能级 E=Ee+Ev+Er
01
03
02
04
05
分子从基态能级跃迁到激发态能级
当有一频率v , 如果辐射能量hv恰好等于该分子较高能级与较低能级的能量差时,即有:
激发态
基态
ΔE电=1-20eV ΔE振=0.05-1eV ΔE转 在分子能级跃迁所产生的能量变化,电子跃迁能量变化最大,它对应电磁辐射能量主要在区紫外—可见区。
波谱分析第二章有机化合物紫外光谱解析

羰基吸收峰受取代基影响显著位移
醛酮均在270 —300nm有R吸收带,但略有差别。 酮: 270 —280nm, 醛: 280—300nm附近 酮比醛多一个烃基,由于超共轭效应π轨道能级降低, π*轨道能级升高, n→π* 跃迁需要较高的能量。
n→ * /nm n→π* /nm
到π*轨道,完成 n→π*跃迁。
→* 跃迁在120—130nm之间产生吸收 π→π* 跃迁在 —160 nm左右产生吸收
n→* 跃迁在 —180 nm左右产生吸收
孤立羰基化合物研究最多的是 n→π* 跃迁,谱带吸收在 270—300nm附近。低强度的宽谱带。 (=10~20)
R带位置的变化对溶剂很敏感
CH3Cl CH3OH CH3NH2
σ→σ* 164-154
150 173
n →σ* 174 183 213
σ*
E
n σ
波谱分析第二章有机化合物紫外光 谱解析
2.烯类化合物
单烯烃: σ→σ* 和π→π* 两种跃迁。
ΔΕπ→π*<ΔΕσ→σ* , 吸收带在200nm左右。
λmax/nm εmax CH2=CH2 π→π* 162 ~104 CH3CH=CHCH3 π→π* 178 ~104 环己烯 π→π* 176 ~104
λmax =114+5×10+11×(48.0-1.7×11)-16.5×2=453.3nm εmax =1.74 × 104× 11=19.1× 104
波谱分析第二章有机化合物紫外光 谱解析
3.羰基化合物
(1)饱和羰基化合物: →* 、 π→π* 、 n→* 、 n→π*四种跃迁; 常常在发生π→π* 跃迁的同时,n 电子亦被激发而跃迁
第二章--紫外光谱

这组数据对应于下面哪个化合物?
AC2 HC2 H B C 2 C H C H C H C H C H 2H
C
CH CH
D
CC HC HC HH
?4
乙酰乙酸乙酯存在酮式和烯醇式互变异 构体,今有两张紫外光谱图,一张在 204nm有弱吸收,另一张在245nm有强吸 收,请判断哪一张是烯醇式。
优点是仪器普及、操作 简单而且灵敏度高
Chapter 2 紫外光谱
§2-1紫外吸收光谱的基本知识 §2-2常见有机物的紫外吸收光谱 §2-3溶剂对吸收光谱的影响 §2-4紫外光谱的解析与应用
§2-1紫外吸收光谱的基本知识
紫外吸收光谱是由于分子中价电子的跃 迁而产生的。 一、紫外吸收光谱的波长范围 二、紫外光谱图的组成 三、电子跃迁的类型 四、常用术语
σ*
σ*
E
л*
n л
σ
σ
C3C H2C HH=2C C2C H H2C H C3H H CH3OC3H
N(C 2CH 3 H )3
§2-2常见有机物的紫外吸收光谱
一、饱和烃及其取代衍生物 二、不饱和烃 三、羰基化合物 四、芳香烃的紫外光谱
一、饱和烃及其取代衍生物
★饱和烃的最大吸收峰一般小于190nm,处于真空紫外 区。如甲烷125nm,乙烷135nm。
甲苯的U图
?
图2-7 a 苯的紫外光谱图 b取代苯与苯紫外光谱的比较
分析:
H C
H H
苯环与甲基的超共轭效应
3、助色团取代苯的紫外光谱
★助色团含有孤电子对,它能与苯环 π 电子 共轭。使 B 带、E 带均移向长波方向。且吸 收强度都增加,精细结构消失。例如苯胺
紫外吸收光谱基本原理

07:18:51
光的互补:蓝 黄
07:18:51
2.物质对光的选择性吸收及吸收曲线
M + h 基态 → M* 激发态 M + 热
M + 荧光或磷光
E1
(△E)
E2
• E = E2 - E1 = h
• 量子化 ;选择性吸收 • 吸收曲线与最大吸收 波长 max • 用不同波长的单色光 照射,测吸光度;
也提供分子结构的信息。通常将在最大吸收波长处测得的摩
尔吸光系数ε max也作为定性的依据。不同物质的λ max有时
可能相同,但ε max不一定相同;
(6)吸收谱带强度与该物质分子吸收的光子数成正比,定 量分析的依据。
07:18:51
二、有机物吸收光谱与电子跃迁
ultraviolet spectrometry of organic compounds
07:18:51
苯环上助色基团对吸收带的影响
07:18:51
苯环上发色基团对吸收带的影响
07:18:51
2. 立体结构和互变结构的影响
H C C H
顺反异构: 顺式:λmax=280nm;
εm;εmax=29000
H C C H
O H 3C C OH H 3C C H C H2 C
极性
非极性
n → p*跃迁:兰移; ;e
max(正己烷) max(氯仿)
p → p*跃迁:红移; ;e
max(甲醇) max(水)
pp np
230 329
07:18:51
238 315
237 309
243 305
溶剂的影响
苯 酰 丙 酮 1 1:乙醚 2:水
第二章紫外吸收光谱

CH3
H+
C OH
CH3
CH3 C OH2+ H2C H
CH3 C CH2 + H2O
A
CH3 C OH CH3
H+ H
CH3 C OH2+ CH3
CH3 C
CH3 B
+ H2O
计算:A max = 214nm + (3×5)nm = 229nm
B max = 214nm + (4×5)nm = 239nm
只能被真空紫外分光光度计检 测到,在紫外区透明,可作为溶 剂使用;
E K
s*
p*
R
n
p
s
n→σ*跃迁
所需能量较大; 吸收波长为150~250nm,大部分在远紫外区, 近紫外区仍不易观察到; 含非键电子的饱和烃衍生物(含N、O、S和卤素 等杂原子)均呈现n→σ* 跃迁。
化合物 H2O
CH3OH CH3CL
s s*
p p*
n s*
n p*
800nm
紫外光谱适用于在200-400nm 区域有吸 收的不饱和分子体系, 特别是具有共轭结构 的化合物。
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的 能量才能发生跃迁; 饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ<200 nm;
例:甲烷的λmax为125nm , 乙烷 λmax为135nm。
化合物B更接近实验值242nm,产物应为B。
例2. 某化合物分子式为C7H10O,经红外光谱测定含有 酮羰基、甲基及碳碳双键,但不能肯定是六元环酮还
是开链脂肪酮。其紫外吸收max(EtOH)=257nm(>104), 试推测其结构。
有机波谱解析-第二章 紫外光谱

C
Hale Waihona Puke n<pOC
C
p*
n > p p*
n
n C
p* p
p*
n
p n 非极性
p
O 非极性
C C
p
极性
极性
n → p*跃迁:兰移; ; pp np
(4)尽量和文献中所用的溶剂一致。
(5)溶剂挥发性小、不易燃、无毒性、价格便宜。
5. 电子跃迁的类型
紫外吸收光谱是由价电子的能级跃迁而产生的,有机化 合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ电子、 π电子、n电子。 s* n p* H C O
s
p E 分子轨道理论:成键轨道—反键轨道。
各种电子能级的能量及电子跃迁类型如右图
3. 紫 外 光 谱 图
横坐标:波长或频率 纵坐标:吸光度(A) 或 透过率(T)
紫外光谱(图)的特点: 吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
H H c H
取代基 红移距离 -SR 45(nm)
c H
max=162nm 助色基团取代 p
-NR2 40(nm) -OR 30(nm)
p*(K带)发生红移。
-Cl 5(nm) CH3 5(nm)
(2)共轭烯烃中的
p → p*
紫外-可见和红外吸收光谱分析

第二章紫外-可见吸收光谱【教学内容】1. 紫外-可见吸收光谱概述2. 紫外-可见光谱的仪器原理3.紫外-可见吸收光谱的原理4.常用术语5 有机化合物紫外-可见光谱的吸收峰6 吸收谱带的四种类型7 常见有机化合物生色团的紫外吸收峰8 紫外-可见光谱的影响因素9.紫外-可见光谱的定性和定量应用【掌握内容】1.掌握紫外-可见光谱的基本概念12.掌握有机化合物中电子跃迁的基本类型。
3.掌握紫外-可见光谱的定性分析方法4.掌握紫外-可见光谱的定量分析方法【熟悉内容】熟悉紫外-可见光谱仪的基本原理【了解内容】了解无机化合物的紫外-可见吸收光谱【教学重点和难点】教学重点:紫外-可见吸收光谱的基本概念、定性和定量分析方法【教学目标】掌握紫外-可见光谱的基本概念,紫外-可见光谱的定性和定量分析方法。
【教学手段】课堂讲授,辅以多媒体幻灯图片【教学过程】1 紫外-可见吸收光谱概述紫外—可见分光光度法是利用某些物质分子能够吸收200 ~ 800 nm光谱区的辐射来进行分析测定的方法。
这种分子吸收光谱源于价电子或分子轨道上电子的电子能级间跃迁,广泛用于无机和有机物质的定量测定,辅助定性分析(如配合IR)。
1.1 分子吸收光谱的产生在分子中,除了电子相对于原子核的运动外,还有核间相对位移引起的振动和转动。
这三种运动能量都是量子化的,并对应有一定能级。
下图为分子的能级示意图。
图1. 分子中电子能级、振动能级和转动能级示意图分子总能量:E分子= E电子+ E振动+ E转动当用频率为ν的电磁波照射分子,而该分子的较高能级与较低能级之差△E恰好等于该电磁波的能量hν时,即有:△ E = hν(h为普朗克常数)此时,在微观上出现分子由较低能级跃迁到较高的能级;在宏观上则透射光的强度变小。
用一连续-辐射的电磁波照射分子,将照射前后光强度的变化转变为电信号,并记录下来,然后以波长为横坐标,以电信号(吸光度A)为纵坐标,就可以得到一张光强度变化对波长的关系曲线图-紫外吸收光谱图,如下:A称为吸光度(absorbance),吸收度或光密度(OD,optical density),a称为吸收系数(absorotiviry),是化合物分子的特性,它与浓度(c)和光透过介质的厚度(b)无关。
紫外-可见吸收光谱分析2

氢谱、碳谱、红外,其结论都没有紫外的结果清晰。
例2.
(a) max = 215(基本值)+12(烷基取代)=227nm (b) max = 215(基本值)+212(烷基取代)+10(烷
基取代)+5(环外双键)= 254nm 莎草酮的实测值:251nm
27
5.UV在食品分析中的应用
钙 调 蛋 白
①CH3(CH2)5CH3 ②(CH3)2C=CH-CH2-CH=C(CH3)2 ③CH2=CH-CH=CH-CH3
6. 试用紫外光谱区分下列化合物。
(1) (2)
7.在紫外-可见光谱分析中最好选择什么极性的溶 剂作为溶剂?为什么?
38
类
黄
酮
儿茶酚
4,5,7-三羟黄烷酮
栎精
图6 一些特定类黄酮的吸收图谱
乌龙茶多糖
图7 乌龙茶多糖的紫外光谱
白果蛋白
Tyr
HO
O
OH
OH OH O
黄烷酮
HO 4' 3' 2' OH
5' 6' 1' OH O
2 1
3
4 OH
5
查尔酮
O
O
黄酮
2' '
1
6'
3' 4'
5'
脂肪
35
紫外-可见光谱思考题
效应 • 光谱具有加和效应(D+E)
24
4.应用举例
例1:香料-紫罗兰酮用于化妆品,-紫罗兰酮只 作皂用香精。
-紫罗兰酮 max=228nm -紫罗兰酮
max=298nm
▪ 紫外吸收光谱决定双键位置,既简单又有效, 如:
紫外吸收光谱分析

紫外吸收光谱分析摘要:分子内部的运动可分为价电子运动,分子内原子在平衡位置附近的振动和分子绕其重心的转动。
因此分子具有电子(价电子)能级、振动能级和转动能级。
分子的能量等于三者能量之和。
分子从外界吸收能量之后,就能引起分子能级的跃迁,即从基态能级跃迁到激发态能级。
分子吸收能量具有量子化的特征,即分子只吸收等于两个能级之差的能量。
由于三种能级跃迁所需能量不同,所以需要不同波长的电磁辐射使他们跃迁,即在不同的光学区出现吸收谱带。
由于电子能级跃迁而产生的吸收光谱主要处于紫外及可见光区域(200-780nm),这种分子光谱称为电子光谱或紫外可见光谱。
[1]关键词:电子能级跃迁红移蓝移溶剂效应一、形成原理在有机化合物分子中有形成单键的σ电子、有形成双键的л电子、有未成键的孤对n电子。
当分子吸收一定能量的辐射能时,这些电子就会跃迁到较高的能级,此时电子所占的轨道称为反键轨道,而这种电子跃迁同内部的结构有密切的关系。
在紫外吸收光谱中,电子的跃迁有σ→σ*、n→σ*、π→π*和n→π*四种类型,各种跃迁类型所需要的能量依下列次序减小:σ→σ*>n→σ*>π→π*>n→π*。
一般来说,未成键孤对电子较易激发,成键电子中π电子较相应的σ电子具有较高的能级,而反键电子却相反。
因此简单分子中n→π*跃迁、配位场跃迁需最小的能量,吸收带出现在长波段方向,n→σ*、π→π*及电荷迁移跃迁的吸收带出现在较短波段,而σ→σ*跃迁则出现在远紫外区。
二、紫外吸收光谱与分子结构的关系当饱和单键碳氢化合物中的氢被氧、氮、卤素、硫等杂原子取代时,由于这类原子中有n电子,n电子较σ键电子易于激发,使电子跃迁所需的能量减低,吸收峰向长波方向移动,这种现象称为深色移动或红移,此时产生n→σ*跃迁。
例如甲烷一般跃迁的范围在125~135nm(远紫外区),碘甲烷(CH3I)的吸收峰则处在150~210(σ→σ*跃迁)及259nm(n→σ*)。
第二章紫外吸收光谱法

第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)ζ→ζ*(2)π→π*(3)n→ζ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λ值最大的是max(1)(2)(3)(4)二、解答及解析题1.吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2.紫外吸收光谱有哪些基本特征?3.为什么紫外吸收光谱是带状光谱?4.紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5.分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6.影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8.溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9.什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11.为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12.芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。
紫外吸收光谱分析.

H3CO
例1
246 +3 +25 274 nm (276nm ) CI 例2 基本值: 246 邻位环残基 +3 邻位—OH取代 + 7 间位CI取代 +0 OH 256nm (257nm) 例3 基本值: 246 H CO 邻位环残基 +3 间位—OCH3取代 +7 对位—OCH3取代 +25 281nm(278nm)
图2.23 紫外—可见吸收曲线
2.3.2 紫外吸收光谱的基本原理
1 电子跃迁类型
(1)σ→σ* 跃迁 指处于成键轨道上的σ电子吸收 光子后被激发跃迁到σ*反键轨道
(2)n→σ* 跃迁 指分子中处于非键轨道上的n电 子吸收能量后向σ*反键轨道的跃迁 (3)π→π* 跃迁 指不饱和键中的π电子吸收光波 能量后跃迁到π*反键轨道。
(4) 吸收带分类
i R—带
它是由n→π* 跃迁产生的吸收带,该带的特点是吸 收强度很弱,εmax<100,吸收波长一般在 270nm以上。 ii K—带 K—带(取自德文: konjuierte 共轭谱带)。它是 由共轭体系的π→π* 跃迁产生的。它的特点是:跃 迁所需要的能量较R吸收带大,摩尔吸收系数εmax >104。K吸收带是共轭分子的特征吸收带,因此用 于判断化合物的共轭结构。紫外-可见吸收光谱中应 用最多的吸收带。
图2.28 溶剂对π→π*,n→π*的影响
4 溶剂pH值对光谱的影响
pH的改变可能引起共轭体系的延长或缩短,从而 引起吸收峰位置的改变,对一些不饱和酸、烯醇、 酚、及苯胺类化合物的紫外光谱影响很大。如果化 合物溶液从中性变为碱性时,吸收峰发生红移,表 明该化合物为酸性物质;如果化合物溶液从中性变 为酸性时,吸收峰发生蓝移,表明化合物可能为芳 胺。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定量基础:朗伯-比尔定律 研究对象:多为具有共轭双键结构的分子。 光谱区域:其研究对象大多在200 -380nm 的近紫外光区和380
-780nm 的可见光区有吸收 测定的灵敏度:由吸光分子的摩尔吸光系数κ表征。
特点:仪器设备简单,应用十分广泛。
如医院的常规化验中,大量定量分析都用紫外-可见分光光度 法。在化学研究中,如平衡常数的测定、求算主-客体结合常数 等都离不开紫外-可见吸收光谱。
饱和烃的C-C键和C-H键属于这种跃迁。 如,甲烷的λmax=135nm。 由于它们在200-800nm 无吸收带,所以在紫外-可 见吸收光谱分析中常用作溶 剂(如己烷、环己烷等)。
(2)n→σ*跃迁:
其能量比σ→σ*稍低,在近紫外端200nm附近。 含杂原子(O,N,S,Cl等)的饱和烃,如C-OH中,除了 σ→σ*外还有n→σ*跃迁。 κmax小。
22
各跃迁对应的光谱区:
远紫外光 5 4 σ σ* n π* n π* π π* 近紫外光 可见光
lgκ
3 2 n 1 σ*
10
100
200
300
400 λ/nm
500
600
700
800
图2.4最常见电子跃迁所处的波长范围及强度
2016/6/20
23
(1)σ→σ*跃迁:
需要的能量较高,相当于真空(远)紫外光。
光学分析法分类:
光谱分析法:测量试样光谱的波长和强度,利用物 质组分的吸收或发射光谱与物质结构及含量的内在 联系,实现对物质的定性和定量分析。
方法与分类:
分子光谱 吸收光谱 发射光谱 紫外-可见、红外 分子荧光、磷光 原子光谱 原子吸收 原子发射
定性:红外、原子发射、紫外 定量:紫外-可见、原子吸收/发射、红外、荧光、 磷光
2016/6/20
25
(4)n→π*跃迁:
含杂原子的双键化合物C=O、C=N等,杂原子上有n电子, 同时又有π*轨道,形成n→π*跃迁。
吸收光波长在近紫外区,亦称R吸收带。属于禁阻跃迁, 吸收较弱, κmax≤102 L· mol-1· cm-1,如丙酮的吸收峰 在280nm, κmax=10-30 L· mol-1· cm-1
第二章
紫外吸收光谱分析
2016/6/20
1
目录
§2-1 §2-2 §2-3 §2-4 §2-5
概述 分子吸收光谱 紫外吸收光谱原理 紫外分光光度计 紫外吸收光谱的应用
2016/6/20
2
光谱示意
复合光
表观现象示意
完全吸收
完全透过
吸收黄色光
物质的颜色和对光的选择性吸收
2016/6/20 3
κ称为摩尔吸收系数:单位为L· mol-l· cm-1,它表示物
质的量浓度为l mol· L-1,液层厚度为l cm时溶液的吸 光度。
A bc
κ =Mα
注:同一吸收物质在不同波长下的 κ值是不同的。在最 大吸收波长处的摩尔吸光系数,常以 κmax 表示。
κmax表明了该吸收物质最大限度的吸光能力,也反
2016/6/20
20
一、有机化合物的紫外-可见吸收光谱
紫外-可见吸收光谱是由分子中的价电子跃迁产生。因 此有机化合物的紫外-可见吸收光谱决定于分子中价电子的 分布和结合情况。
1.有机物分子中与光谱有关的价电子:
形成单键的σ电子,
形成双键的π电子 未成键的孤对电子称为n电子。
2016/6/20
2016/6/20
26
(5)电荷转移跃迁 分子同时具有电子给予体和电子接受体,吸收能量使电 子从给予体轨道向接受体轨道跃迁。实为一个内氧化过程。 谱带宽,吸收强。
二、无机化合物的紫外-可见吸收光谱
无机化合物的紫外-可见吸收光谱主要由电荷转移跃 迁和配位场跃迁产生。
1.电荷转移跃迁 电子由配位体的轨道跃迁到中心离子相关的轨道上。 过渡金属离子与含生色团的试剂所生成的络合物、水合 无机离子及含d10电子结构的过渡元素形成的卤化物和硫化 物,均可产生电荷转移跃迁。 κmax > 104 L· mol-1· cm-1,定量。
红外光谱:吸收0.025ev-1ev的光辐射产生的吸收光谱。对应于红
外线(0.78-50μm)。分子内发生振动能级的跃迁,同时伴有转动能 级跃迁,又称振动转动光谱。
紫外-可见光谱:吸收1ev-20ev的光辐射产生的吸收光谱。对应
于紫外线和可见光(200-780nm)。分子内发生电子能级的跃迁,同时 伴有振动和转动能级跃迁,又称电子光谱。
表2.2 吸收带的划分
跃迁类型 s n s* s* 吸收带 远紫外区 端吸收 E1 p p* K(E2) B n p* R 特征 远紫外区测定 紫外区短波长端至远紫外区的强吸收 芳香环的双键吸收 共轭多烯、-C=C-C=O-等的吸收 芳香环、芳香杂环化合物的芳香 环吸收。有的具有精细结构 含CO,NO2等n电子基团的吸收 >200 >10,000 >100 <100 emax
h 为Plank常数,h=6.626×10-34Js。
2016/6/20
8
光学分析法
利用物质发射、吸收电磁辐射的性质以及物质与电 磁辐射的相互作用实现对物质(组分)成分分析和结构 分析的一类仪器分析方法。
此类分析方法是仪器分析中较早且重要的一类。
电磁辐射区域划分
图2.1 光学区电磁辐射区域
2016/6/20 9
2016/6/20
24
(3)π→π*跃迁:
双键、三键上价电子跃迁到π*上形成,吸收峰大多在紫 外区,在200nm左右,κmax≈104属于强吸收。如乙烯的 λmax=165nm ,κmax=104 L· mol-1· cm-1。 共轭烯炔中的π→π*跃迁的吸收峰成为K带,比非共轭 烯炔的π→π*的波长更长。
价电子运动 分子内原子在平衡位置附近的振动
分子绕其重心的转动
分子能级: 分子和原子一样,也有它的特征分子能级。
电子能级 振动能级
1-20 ev 0.025-1ev
转动能级
0.003-0.025ev
2016/6/20
15
分子结构与吸收光谱
分子吸收光谱是带状 光谱:
分子对电磁辐射的 吸收是分子总能量 变化之和。
分子光谱
分子吸收光谱:
当光辐射通过吸收介质时,辐射能因被介质选 择性吸收而使其透过后的强度有不同程度的减弱,所 损失的能量转变为介质的内能,这种吸收的结果就产 生了分子吸收光谱。 利用这种吸收与物质的性质以及物质的量的关系 可以实现物质的定性及定量分析。
2016/6/20
14
分子内部的运动:
2016/6/20 28
2.配位场跃迁 含3d、4d、4f、5f轨道的过渡元素,在络合物中,由于 配体的配位场影响, d轨道和f轨道分裂,如果轨道未充满,吸 光后会出现d-d 跃迁和f-f跃迁。 κmax < 100 L· mol-1· cm-1,研究。
三、常用术语
生色团——分子中能吸收紫外或可见光的基团。具有不饱和键和含有孤 对电子的基团。 π→π*,n→π*。 如: 生色团的共轭效应:两个彼此相邻的生色团形成共轭体系, 原生色团的吸收带消失,同时出现新的吸收带,位置移向长波长 处,吸收增强。 助色团——本身不产生吸收峰,但与生色团相连时,使生色团的吸收峰 向长波方向移动(红移),且加强。 如:-OH , -OR , -NH2 , -SH , -X 等。 红移和蓝移——取代基、溶剂的变化导致λmax变化。
吸收曲线:
测量某物质对不同波长 单色光的吸收程度,以波长 ()为横坐标,吸光度(A)为 纵坐标,绘制吸光度随波长 的变化可得一曲线,此曲线 即为吸收曲线(吸收光谱)。 ①进行定性分析 用 途 ②进行定量分析 ③选择吸收波长 ④判断干扰情况
2016/6/20
λmax=525nm
KMnO4溶液的光吸收曲线
21
2.电子跃迁:
当这些价电子吸收一定能量ΔE后,将跃迁到较高的能级(激 发态),此时电子所占的轨道称为反键轨道,而这种特定的跃迁是
同分子内部结构有着密切关系的,一般可将这些跃迁分成如下四
类:
σ→σ*
跃 迁 能 量
n→σ* π → π* n→ π*
图2.3 电子能级及电子跃迁示意图
2016/6/20
10
2016/6/20
非光谱分析法:不涉及光谱 电磁辐射与物质(组分)间的相互作用,引起电 磁辐射在传播方向或物理性质上的变化,如,折射、 反射、色散、干涉、衍射、偏振等,利用这些变化与 物质结构及含量的内在联系,实现对物质的定性和定 量分析。 例如: 测有机物的折射率——定性分析
X-射线衍射——测定晶体结构
4
定性分析与定量分析的基础
根据物质对光的 最大吸收波长, 可进行定性分析。 一定的实验条件 下,物质对光的 吸收与物质的浓 度成正比。根据 物质对光的吸收 多少可进行物质 的定量分析。
λmax=525nm
KMnO4吸收光谱
2016/6/20
5
光吸收的基本定律
——朗伯-比尔定律 当一束强度为I0的平行单色光垂直照射到长度为b、 浓度为c的液层,通过溶液后光的强度减弱为It ,则:
2016/6/20
11
电磁辐射与物质的相互作用
原理:物质与光的作用可看成是对光子能量的授受,
即 hν=Ei-E0,该原理广泛应用于光谱解析。
本质:物质吸收(或发射)光能后发生跃迁。
